
PODSTAWY CHEMII
Inżynieria Biomedyczna
Wykład III

Plan
• Bufory
• Hydroliza
• Reakcje strącania
• Reakcje zobojętniania

Równowagi w roztworach elektrolitów (II)
Efekt wspólnego jonu
•
Jeżeli w roztworze znajdują się dwa
elektrolity o wspólnym jonie, to następuje
cofnięcie dysocjacji słabego elektrolitu:
Stężenie jonów H
3
O
+
jest praktycznie równe
stężeniu mocnego elektrolitu, a ponieważ
występuje we wzorze na stałą równowagi
dysocjacji elektrolitu słabego, wpływa na jego
stopień dysocjacji.
s
3
3
s
m
3
3
m
R
O
H
O
H
HR
R
O
H
O
H
HR

Efekt wspólnego jonu (2)
Jeśli w roztworze znajduje się równocześnie mocny
kwas (HCl) o stężeniu c
m
=0,1 M oraz słaby kwas
(CH
3
COOH) o stężeniu c
s
=0,1 M, to:
UWAGA! W rzeczywistości stężenie jonów wodorowych
jest sumą c
m
i stężenia jonów octanowych
COO
CH
O
H
O
H
COOH
CH
Cl
O
H
O
H
HCl
3
3
2
3
3
2
COOH
CH
COO
CH
O
H
COOH
CH
3
3
3
3
c
c
c
K
COOH
CH
COO
CH
m
3
3
c
c
c
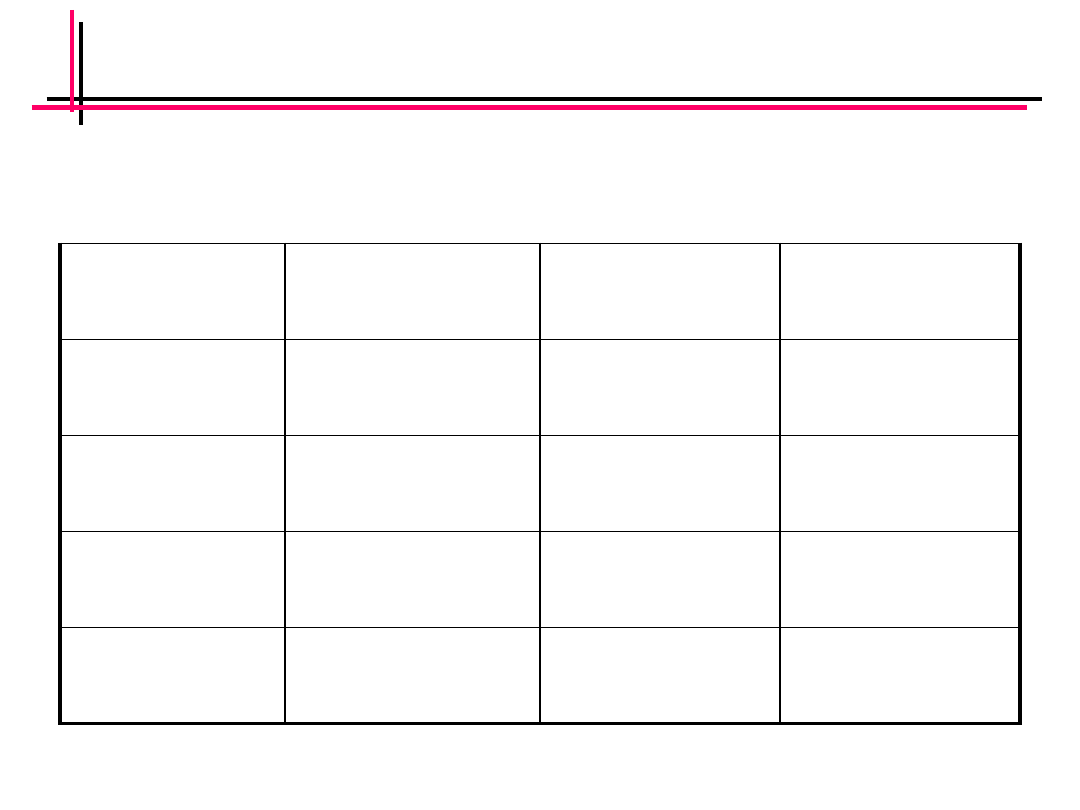
Efekt wspólnego jonu (3)
• Stopień dysocjacji kwasu octowego w
roztworze z kwasem solnym i bez niego:
c
m
c
s
α, stopień
dysocjacji
α dla czystego
0,1
0,1
0,00002
0,0133
0,01
0,1
0,00018
0,0133
0,001
0,1
0,00156
0,0133
0,0001
0,1
0,00376
0,0133

Roztwory buforowe
Roztwory buforowe
mają zdolność
utrzymywania pH roztworu na stałym poziomie
(w przybliżeniu).
Składają się one z jednej lub kilku substancji, w
których istniejąca równowaga dysocjacji
niweluje dodatek silnego kwasu lub zasady.
Przykłady:
- mieszanina słabego kwasu i jego soli z mocną
zasadą (np.
CH
3
COOH i CH
3
COONa
);
- mieszanina słabej zasady i jej soli z mocnym
kwasem (np.
NH
3aq
i NH
4
Cl
);
- niektóre sole (np.
CH
3
COONH
4
);
- mieszanina dwóch soli (np.
KH
2
PO
4
i K
2
HPO
4
).

Mechanizm działania roztworu buforowego
KWAS
COOH
CH
sól
COO
CH
c
c
;
c
c
3
3
Na
COO
CH
COONa
CH
O
H
COO
CH
O
H
COOH
CH
3
3
3
3
2
3
COOH
CH
COO
CH
O
H
COOH
CH
3
3
3
3
c
c
c
K
Bufor octanowy składa się z
kwasu octowego
i jego
soli z
mocną zasadą
:
Kwas octowy jest elektrolitem słabym – jest zdysocjowany
częściowo, a sól – elektrolitem mocnym i zdysocjowanym
całkowicie. Zatem biorąc pod uwagę efekt wspólnego jonu
można napisać w przybliżeniu:
KWAS
sól
O
H
c
c
c
3

Mechanizm działania roztworu buforowego(2)
COOH
CH
sól
Kwas
O
H
3
3
K
c
c
c
Dodatek mocnego kwasu:
Wzrost ilości jonów H
3
O
+
, powoduje dalsze cofnięcie
dysocjacji kwasu octowego
Dodatek mocnej zasady:
Wzrost ilości jonów OH- , powoduje wzrost dysocjacji
kwasu octowego (równowaga dysocjacji wody!).
pH zmieni się nieznacznie, gdyż oba stężenia są „pod
logarytmem” ...
KWAS
sól
COOH
CH
c
c
log
pK
pH
3
Na
COO
CH
COONa
CH
O
H
COO
CH
O
H
COOH
CH
3
3
3
3
2
3
O
H
OH
O
H
3
2
2

Działanie roztworu buforowego (3)
74
.
4
0
pK
c
c
log
pK
pH
COOH
CH
KWAS
sól
COOH
CH
3
3
Bufor octanowy zawiera 1 m CH
3
COOH i 1 m CH
3
COONa,
jego pH wynosi zatem:
Jeżeli dodamy
0,1 mola mocnego kwasu
(HCl), to efekt
będzie taki, jakby stężenie soli zmalało, a kwasu
wzrosło:
Gdyby taką samą ilość kwasu dodać do czystej wody,
pH zmieniłoby się z 7 na 1 ...
66
.
4
08
.
0
74
.
4
1
.
0
c
1
.
0
c
log
pK
pH
KWAS
sól
COOH
CH
3
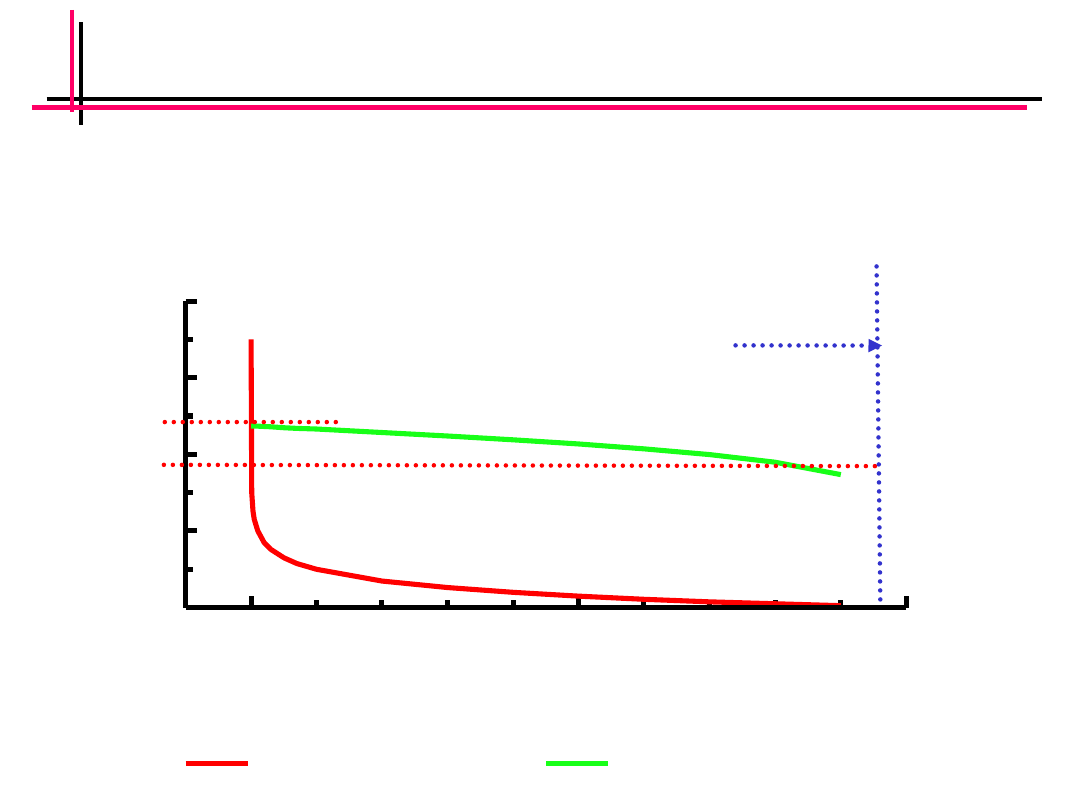
Działanie roztworu buforowego (4)
0.00
0.50
1.00
ilość mocnego kwasu [mol]
0
2
4
6
8
pH
bez buforu
z buforem
pojemność
roztworu
buforowego
1
Pojemność buforowa
:
liczba moli mocnego
jednozasadowego kwasu lub mocnej jednowodoro-
tlenkowej zasady, które dodane do 1 dm
3
roztworu
buforowego zmieniają jego pH o jednostkę

Hydroliza soli
• Hydroliza soli jest zjawiskiem związanym z reakcją jonów
powstałych z dysocjacji soli z wodą:
(sól jest elektrolitem mocnym i dysocjuje całkowicie,
woda jest elektrolitem słabym i dysocjuje częściowo
)
zasada sodowa
jest elektrolitem mocnym i jest
całkowicie zdysocjowana, kwas octowy - elektrolit
słaby - tylko częściowo, zatem roztwór będzie miał
odczyn
zasadowy ...
NaOH
COOH
CH
O
H
COONa
CH
H
OH
O
H
Na
COO
CH
COONa
CH
3
2
3
2
3
3
OH
Na
COOH
CH
Na
O
H
COO
CH
3
2
3
Hydroliza soli (2)
Stała równowagi reakcji hydrolizy:
O
H
COO
CH
O
H
COOH
CH
OH
h
O
H
'
h
3
3
3
3
2
c
c
c
c
c
K
c
K
jeśli stężenie wody uznać za stałe oraz pomnożyć licznik i mianownik
przez stężenie jonów hydroniowych, to:
Skoro można zdefiniować stałą hydrolizy, to można również
określić
stopień hydrolizy β
O
H
COO
CH
COOH
CH
OH
'
h
2
3
3
c
c
c
c
K
COOH
CH
W
3
K
K
OH
COOH
CH
O
H
COO
CH
3
2
3
Hydroliza soli (3)
kwas solny jest elektrolitem mocnym i jest całkowicie
zdysocjowany, zasada amonowa - elektrolit słaby - tylko
częściowo, zatem roztwór będzie miał odczyn
kwaśny ...
aq
NH
w
OH
NH
OH
NH
O
H
O
H
'
h
3
4
3
3
2
K
K
c
c
c
c
c
c
K
Cl
O
H
NH
Cl
O
H
NH
Cl
NH
Cl
NH
3
3
2
4
4
4

Hydroliza soli (4)
Czy można obliczyć
pH
lub
pOH
roztworu soli po jej hydrolizie ?
COOH
CH
h
COO
CH
OH
3
3
c
K
c
c
O
H
COO
CH
COOH
CH
OH
'
h
2
3
3
c
c
c
c
K
OH
s
COOH
CH
OH
COO
CH
c
c
c
c
c
3
3
β
1
c
β
K
s
2
h
s
OH
c
β
c
OH
COOH
CH
O
H
COO
CH
3
2
3

Hydroliza soli (5)
Jaki jest odczyn 0,1 M roztworu CH
3
COONa ?
Przyjmijmy wartość stałej dysocjacji K
kw
= 1·10
-5
;
wówczas wartość stałej hydrolizy wynosi 1·10
-9
Jeśli stopień hydrolizy β jest niewielki, możemy
skorzystać z uproszczonego wzoru:
wówczas c
OH
-
= 10
-4
·0,1=10
-5
; pOH wynosi 5,
czyli pH=9
4
9
s
h
10
1
.
0
10
c
K
β
9
5
14
COOH
CH
W
'
h
10
10
10
K
K
K
3
Hydroliza soli (6)
chlorek sodowy jest solą
mocnej zasady NaOH
i
mocnego
kwasu HCl
, które są całkowicie zdysocjowane. Sól nie ulega
hydrolizie, a odczyn jej roztworu jest
obojętny
...
kwas
zasada
hydroliza
odczyn
UWAGA !
dotyczy kwasów
i zasad dyso-
cjujących
jednostop-
niowo
mocny
mocna
brak
obojetny
mocny
słaba
zachodzi
kwaśny
słaby
mocna
zachodzi
zasadowy
słaba
słaby
zachodzi
zależy od K
d
kwasu
i zasady
Cl
O
H
Na
Cl
O
H
Na
Cl
Na
NaCl
2
2

Hydroliza soli (7)
Przypadki
trochę bardziej
skomplikowane
Jaki odczyn mają wodorosole, sole słabych kwasów i
mocnych zasad?
Zasadowy ???
Dysocjacja kwasu węglowego:
3
2
3
3
3
2
3
3
HCO
CO
O
H
2
2
3
3
3
CO
H
HCO
O
H
1
3
3
3
2
c
c
c
K
CO
O
H
HCO
a
c
c
K
HCO
O
H
CO
H
K
1
=4,3·10
-7
K
2
=5,6·10
-11
Dysocjacja wodorowęglanu sodowego NaHCO
3
:
3
3
HCO
Na
NaHCO

Hydroliza soli (8)
Przypadki skomplikowane
2
3
3
dysocjacja
2
3
hydroliza
3
2
CO
O
H
O
H
HCO
OH
CO
H
8
7
14
1
W
h
10
3
.
2
10
3
.
4
10
K
K
K
możliwe są dwie reakcje “konkurencyjne”
Ponieważ K
dys
<< K
h
(3 rzędy!), a obie stałe mają taki sam
mianownik, przeważa hydroliza i roztwór ma
odczyn
zasadowy
...
11
2
dys
10
6
.
5
K
K
Hydroliza soli (9)
Przypadki skomplikowane
Dysocjacja wodorosiarczanu (IV) sodowego NaHSO
3
:
Dysocjacja kwasu siarkowego (IV):
3
2
3
3
3
2
3
3
HSO
SO
O
H
2
2
3
3
3
SO
H
HSO
O
H
1
3
3
3
2
c
c
c
K
SO
O
H
HSO
c
c
c
K
HSO
O
H
SO
H
K
1
=1,7·10
-2
K
2
=6,2·10
-6
3
3
HSO
Na
NaHSO

Hydroliza soli (10)
Przypadki skomplikowane
2
3
3
dysocjacja
2
3
hydroliza
3
2
SO
O
H
O
H
HSO
OH
SO
H
13
2
14
1
W
h
10
9
.
5
10
7
.
1
10
K
K
K
możliwe są dwie reakcje “konkurencyjne”
Ponieważ K
dys
>> K
h
(7 rzędów!), a obie stałe mają taki sam
mianownik, przeważa dysocjacja i roztwór ma
odczyn
kwaśny ...
Jak z tego widać, nawet sól
mocnej zasady
i
słabego
kwasu
może mieć
odczyn kwaśny
...
6
2
dys
10
2
.
6
K
K
Reakcje strącania
• Definicja (1)
Reakcja strącania zachodzi gdy
występują kationy oraz aniony, które
łącząc się tworzą trudno
rozpuszczalny związek (
wytrąca się
osad
)
• Definicja (2)
Reakcja strącania zachodzi gdy
zostanie przekroczony iloczyn stężeń
jonów w roztworze nasyconym

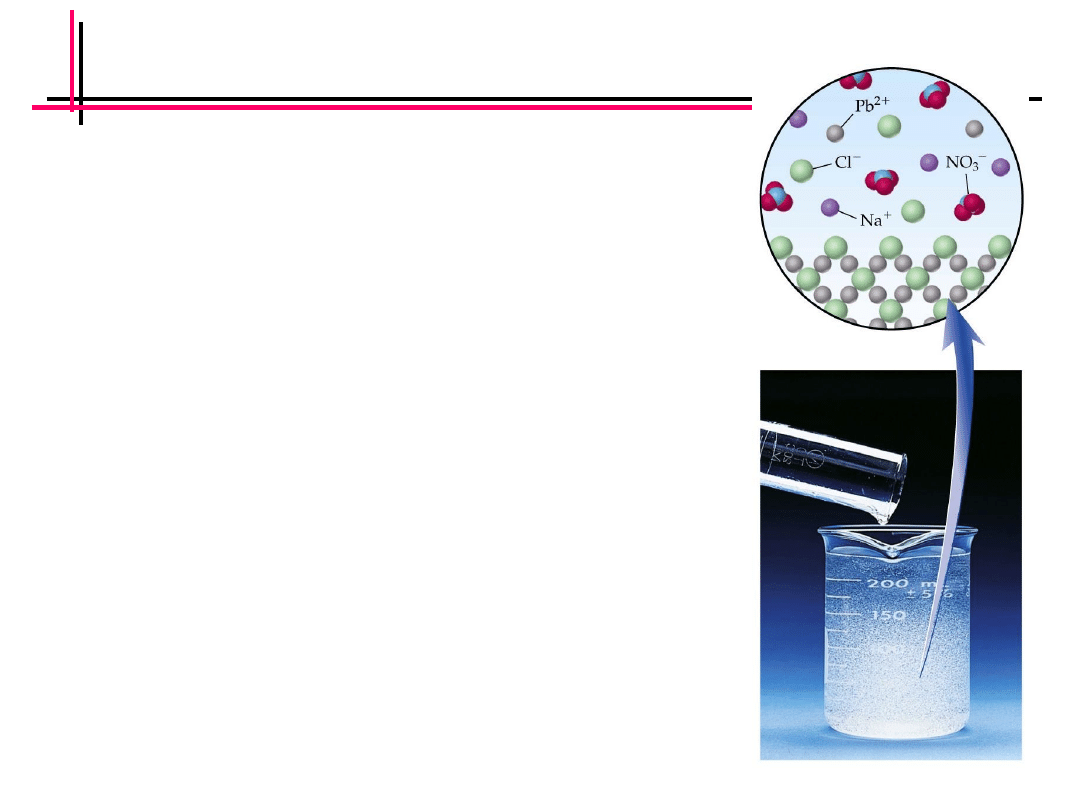
Przykład reakcji strącania osadu
•
W wyniku zmieszania wodnych roztworów AgNO
3
i KCl wytracił
się biały osad. Jaki to osad?
– Mieszanina zawiera jony: Ag
+
, NO
3
-
, K
+
, Cl
-
•
Jakie są możliwe kombinacje?
– Z listy jonów wynika że AgCl i KNO
3
Który ze związków (AgCl czy KNO
3
) tworzy
osad?

Zasady rozpuszczalności
Przewidywanie stałych produktów w reakcjach strącania osadów
wymaga znajomości rozpuszczalności substancji jonowych w wodzie
(
tablice rozpuszczalności
)
– Większość soli azotanu (V) (NO
3
-
) jest rozpuszczalna w
wodzie
– Większość soli Na
+
, K
+
, NH
4
+
jest rozpuszczalna w wodzie
– Większość chlorków (Cl
-
) jest rozpuszczalna w wodzie
oprócz AgCl, PbCl
2
i Hg
2
Cl
2
– Większość soli siarczanu (VI) (SO
4
2-
) jest rozpuszczalna
w wodzie oprócz BaSO
4
, PbSO
4
, CaSO
4,
SrSO
4
– Większość siarczków (S
2-
), węglanów (CO
3
2-
) oraz
fosforanów (PO
4
3-
) jest zasadniczo nierozpuszczalna w
wodzie
Wracamy do poprzedniego przykładu
-
3
s
-
-
3
NO
K
AgCl
Cl
K
NO
Ag
3(aq)
s
(aq)
3(aq)
KNO
AgCl
KCl
AgNO
gCl
A
Cl
Ag
-
Zapis cząsteczkowy
Zapis cząsteczkowo-jonowy
[AgCl]
]
[Cl
]
[Ag
K
Iloczyn rozpuszczalności - iloczyn stężeń jonów znajdujących się w nasyconym
roztworze elektrolitu, podniesionych do odpowiednich potęg,.
]
[Cl
]
[Ag
I
r
Roztwór nasycony
Przypadek ogólny
Iloczyn rozpuszczalności I
r
zależy od
temperatury
W zależności od tego, czy reakcja
rozpuszczania soli jest egzo- czy
endotermiczna rozpuszczalność albo maleje,
albo rośnie ze wzrostem temperatury
(zgodnie z regułą przekry Le Chateliera)
n
m
m
n
r
m
n
n
m
]
[B
]
[A
I
nB
mA
B
A
X-rozpuszczalność
(mol/dm
3
)
Substancja + rozpuszczalnik
roztwór (
H)
H>0 T
, X
H<0 T
, X
m
n
n
m
r
n
m
I
X

Od czego zależy rozpuszczalność ? (T=const)
Czynniki wpływające na rozpuszczalność:
• Hydroliza
jonów powstałych z dysocjacji trudno
rozpuszczalnej soli:
wzrost rozpuszczalności
X
• Obecność jonów pochodzących od innych elektrolitów
w roztworze
–
Efekt wspólnego jonu
: obniżenie rozpuszczalności
X
–
Wpływ siły jonowej
: wzrost rozpuszczalności
X
• pH roztworu: wzrost lub obniżenie rozpuszczalności:
Decyduje mechanizm hydrolizy (kationowa czy
anionowa) oraz wartość pH roztworu
Podsumowanie:
• Jeżeli układ znajduje się w stanie równowagi
dynamicznej to L=I
r
i roztwór jest nasycony
• Jeżeli roztwór jest nienasycony to L<I
r
• Jeżeli roztwór jest przesycony to L>I
r
i wtedy będzie
się wytrącał osad aż do momentu, gdy L osiągnie
wartość Ir
n
m
m
n
r
m
n
n
m
]
[B
]
[A
I
nB
mA
B
A
n
m
m
n
]
[B
]
[A
L
W roztworze nasyconym, w danej temperaturze
W roztworze, w danej temperaturze

Podsumowanie cd
• Im mniejsza wartość iloczynu rozpuszczalności,
tym związek jest trudniej rozpuszczalny, a tym
samym łatwiej wytrącić jego osad.
• Wykorzystując wartości iloczynów
rozpuszczalności związków, możemy przewidzieć
kolejność wytrącania się różnych (trudno
rozpuszczalnych) soli pod wpływem wspólnego
odczynnika wytrącającego.

Reakcje zasadowo-kwasowe
• Kwasy i zasady można identyfikować z punktu widzenia
praktycznego, lub z punktu widzenia zjawisk chemicznych
• Definicje Arrheniusa i/lub Bronsted-Lowre’go opisują naturę kwasu
i zasady
• Definicja Arrheniusa
– Kwas: w wyniku reakcji dysocjacji powstają jony H
+
– Zasada: w wyniku reakcji dysocjacji powstają jony
OH
-
Definicja Arrheniusa stosuje się do roztworów wodnych
….
co pozwala wytłumaczyć właściwości kwasów
mineralnych i organicznych
…. można łatwo wytłumaczyć właściwości
zasadowe
wodorotlenków metali
Reakcje zasadowo-kwasowe
• Definicja Brønsteda-Lowre’go
– Kwas: donor protonów
– Zasada: akceptor protonów
OH
NH
O
H
NH
4(aq)
(l)
2
3(aq)
zasada I
kwas II
kwas I
zasada II
kwas I i zasada I
kwas II i zasada II
Stanowią sprzężone pary
kwas-zasada
O
H
HSO
O
H
SO
H
3
3(aq)
(l)
2
3
2
kwas I
zasada II
zasada I
kwas II

Zasady
i kwasy
(Brønsted)
O
H
O
H
O
H
OH
2
2
3
Według Brønsteda, reakcja pomiędzy
kwasem
i
zasadą
jest zawsze reakcją prowadzącą do otrzymania
sprzężonej pary
zasada
-
kwas
zasada I
kwas II
kwas I
zasada II
Przykłady
kwas
zasada
O
H
2
3
NH
-
4
HSO
-
2
4
SO
O
H
2
OH
O
H
3
4
2
SO
H
4
NH
-
4
HSO
Reakcje zobojętnienia
O
H
Cl
O
H
HCl
NH
F
NH
HF
3
2
4
3
Zgodnie z teorią Arrheniusa
kwas + zasada
sól + woda
Proces ograniczony do reakcji w wodzie
Zgodnie z teorią Brønsteda-Lowre’go
HA + B
A
-
+ BH
+
Proton jest przeniesiony z kwasu (HA) do zasady (B)
Proces bardziej ogólny
O
H
NaCl
HCl
NaOH
2
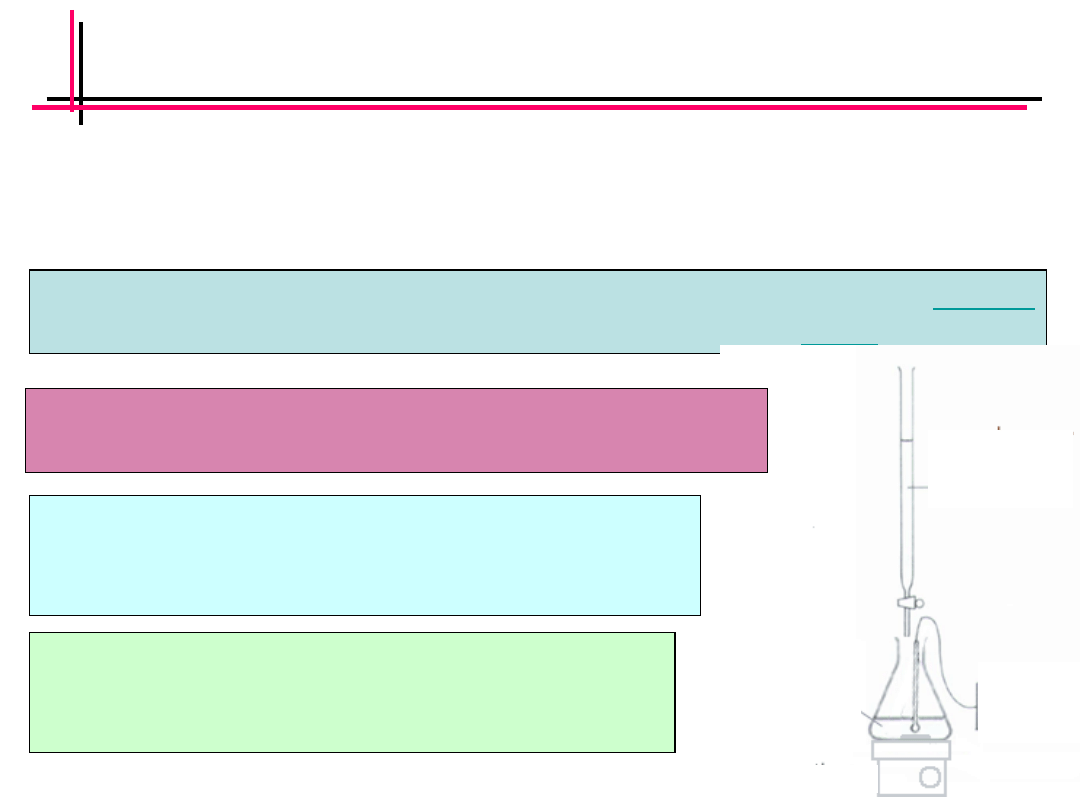
Titrant - roztwór mianowany (o znanym stężeniu) dodawany z
w postaci kropel do roztworu analizowanej substancji (
).
Alkacymetria-
praktyczne zastosowanie reakcji zobojętnienia
dział
analizy miareczkowej
, w której ustala się dokładne stężenie
kwasów (lub zasad) poprzez miareczkowanie roztworów z użyciem zasad
(lub kwasów). W trakcie miareczkowania alkacymetrycznego zachodzi
reakcja zobojętniania,
która prowadzi do zmian
pH
.
Moment osiągnięcia punktu
równoważnikowego umożliwia obserwację
punktu końcowego miareczkowania.
Punkt równoważnikowy – moment
miareczkowania, w którym oznaczany składnik
przereagował ilościowo z titrantem.
Titrant -
odczynnik
miareczkujący
mieszadło
Analit -
odczynnik
miareczkowany
pH –
metr
Biureta – sprzęt laboratoryjny z precyzyjną skalą
objętości i możliwością precyzyjnego dozowania.
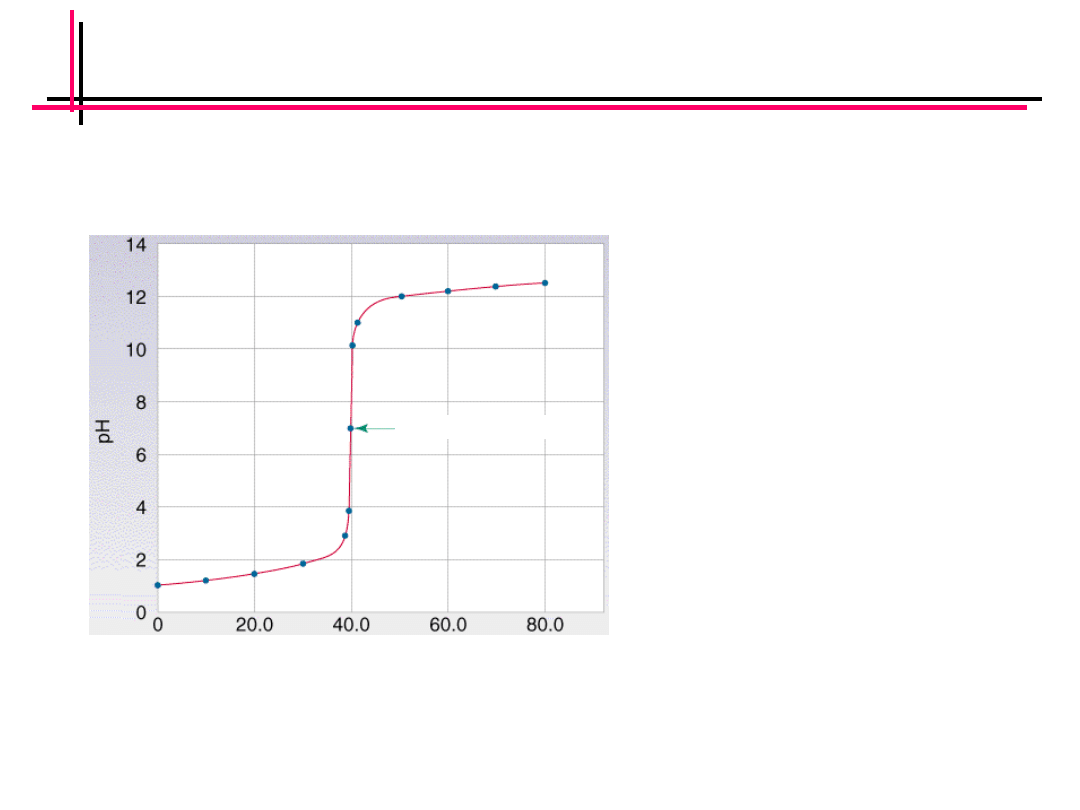
Krzywe miareczkowania
• Wykres zależności pH roztworu od objętości
dodanego titrantu
Titrant - 0.1M-owy NaOH
Analit- x M-owy HCl
Punkt równoważnikowy
V 0.1M NaOH (cm
3
)
Jakie jest stężenie
roztworu kwasu solnego?
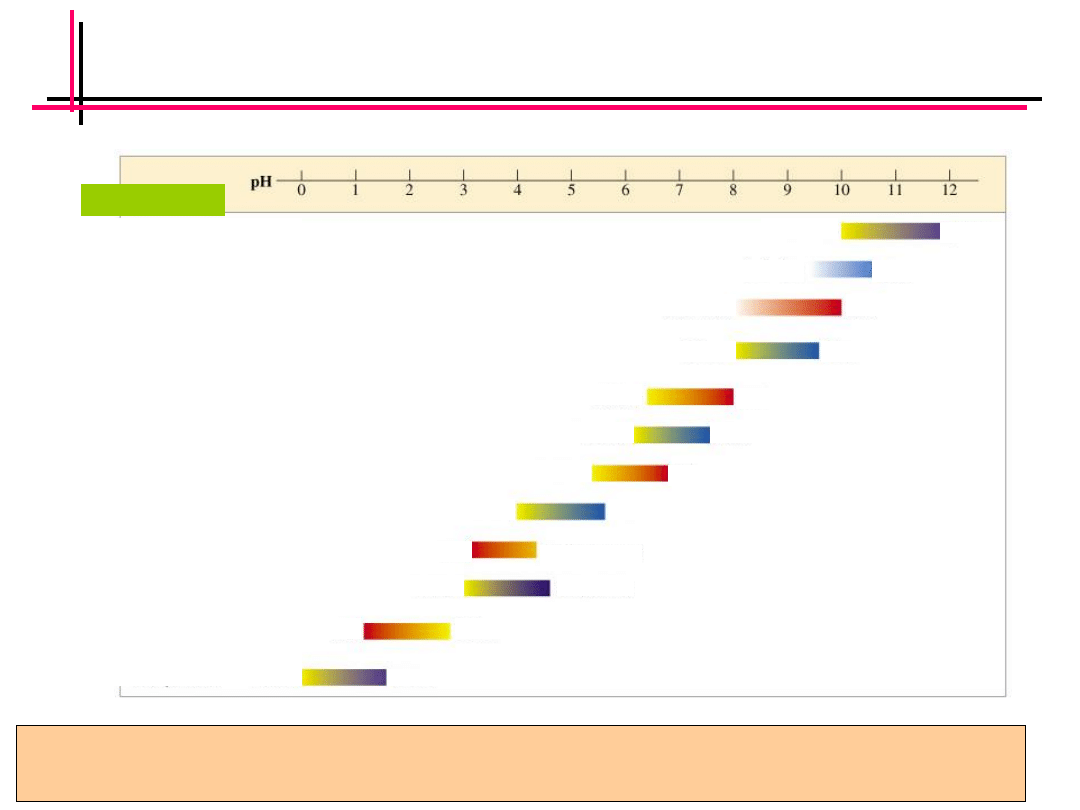
Wskaźniki
Alizaryna
Tymoloftaleina
Fenoloftaleina
Błękit tymolowy
Czerwień fenolowa
Błękit bromotymolowy
Czerwień chlorofenolowa
Zieleń bromokrezolowa
Oranż metylowy
Błękit bromofenolowy
Błękit tymolowy
Fiolet metylowy
WSKAŹNIK
6-7.6
Wskaźniki pH są to słabe kwasy lub słabe zasady organiczne, które reagując z
wodą tworzą układy sprzężone kwas-zasada.
Wyszukiwarka
Podobne podstrony:
IB wyk3 09 www
IB wyk13 11
IB wyk11 11
IB wyk6 7 11(1)
IB wyk3
IB 007 12 Oznaczanie gęstości objętościowej próbek mma 12697 6 v2013 11
ib 11 05
11 IB Wojny grecko perskie
więcej podobnych podstron