
2012-01-21
1
INŻYNIERIA BIOMEDYCZNA

Plan
Stan gazowy
Prawa gazowe
Gaz idealny a gaz rzeczywisty
Oddziaływania międzycząsteczkowe

Stan materii a stan skupienia
Stan materii – podział z punktu widzenia mikroskopowego
(struktury jakie tworzą atomy, cząsteczki, jony)
Stan skupienia - forma występowania materii (forma
makroskopowa):
Gazowy
Ciekły
Stały
STAN GAZOWY STAN CIEKŁY STAN STAŁY
uporządkowanie
temperatura
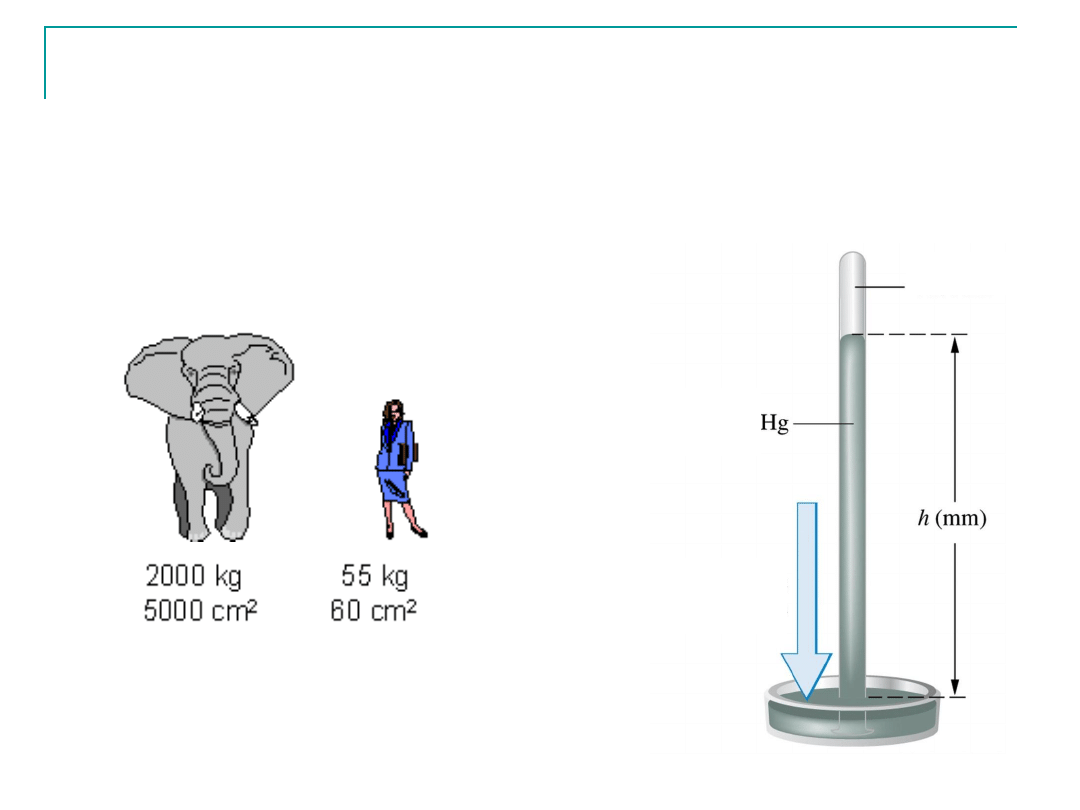
Opis stanu
Objętość V: miara przestrzeni jaka zajmuje „próbka” [m
3
]
Ciśnienie: siła działająca na jednostkę powierzchni
Jednostka w układzie SI [Pa]=[N
·m
-2
]
1atm=760 mmHg=1013.25 hPa
Temperatura T: [K]
Ilość substancji n: [mol]
próżnia
ciśnienie
atmosferyczne

Cechy stanu gazowego
Brak kształtu:
Gaz przyjmuje kształt układu, w którym się znajduje
Brak objętości:
Gaz przyjmuje objętość układu, w którym się znajduje
Średnia energia kinetyczna
„elementów” tworzących gaz jest
większa od
średniej energii oddziaływania
pomiędzy tymi
„elementami”
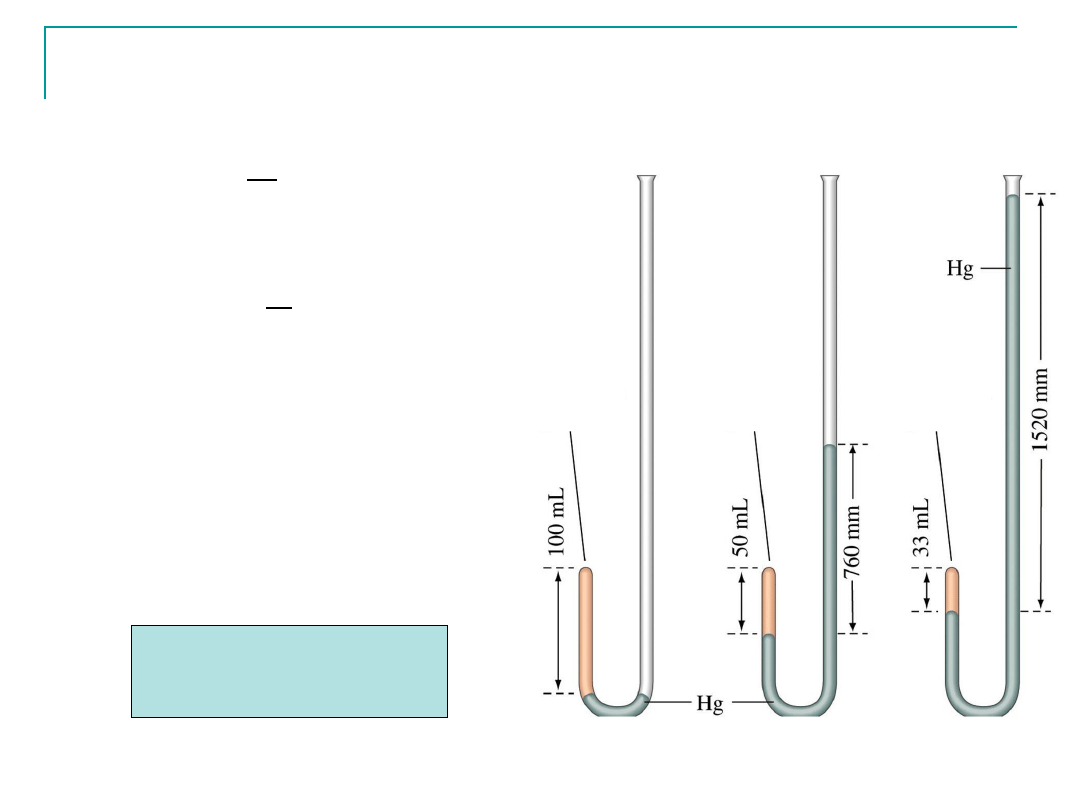
Prawa gazowe – prawo Boyle
p
1
V
p
1
V
a
a
Vp
2
2
1
1
p
V
p
V
a
2
2
1
1
p
V
p
V
Gdzie
V
-objętość,
p
-ciśnienie,
a
-stała
Zamknięty
gaz
Zamknięty
gaz
Zamknięty
gaz
T=const, n=const
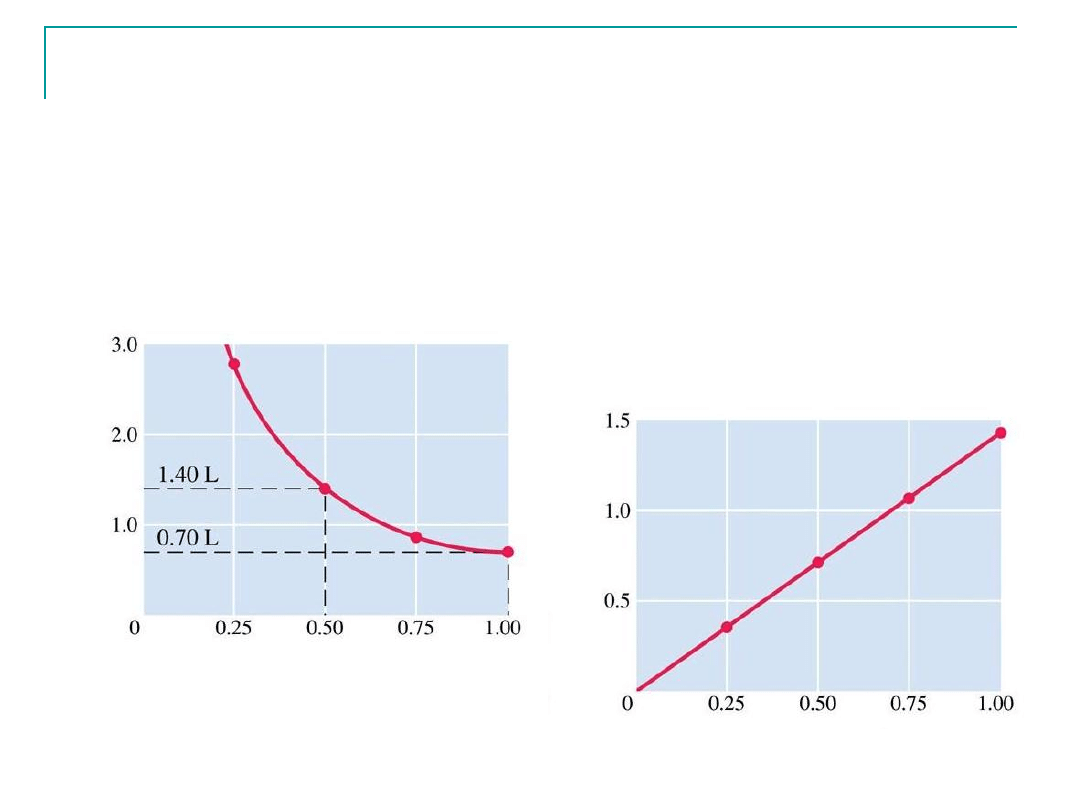
Prawo Boyle’a cd
pV=const jedynie w przybliżeniu opisuje relacje pomiędzy p i V
Gaz który spełnia prawo Boyle’a nazywa się gazem idealnym
Prawo to pozwala przewidzieć nową objętość gazu jeżeli
zmienimy ciśnienie (przy T=const) lub vice versa: p
1
V
1
=p
2
V
2
ciśnienie (atm)
ciśnienie (atm)
Ob
jęto
ść
(dm
3
)
1
/V
(
d
m
-3
)
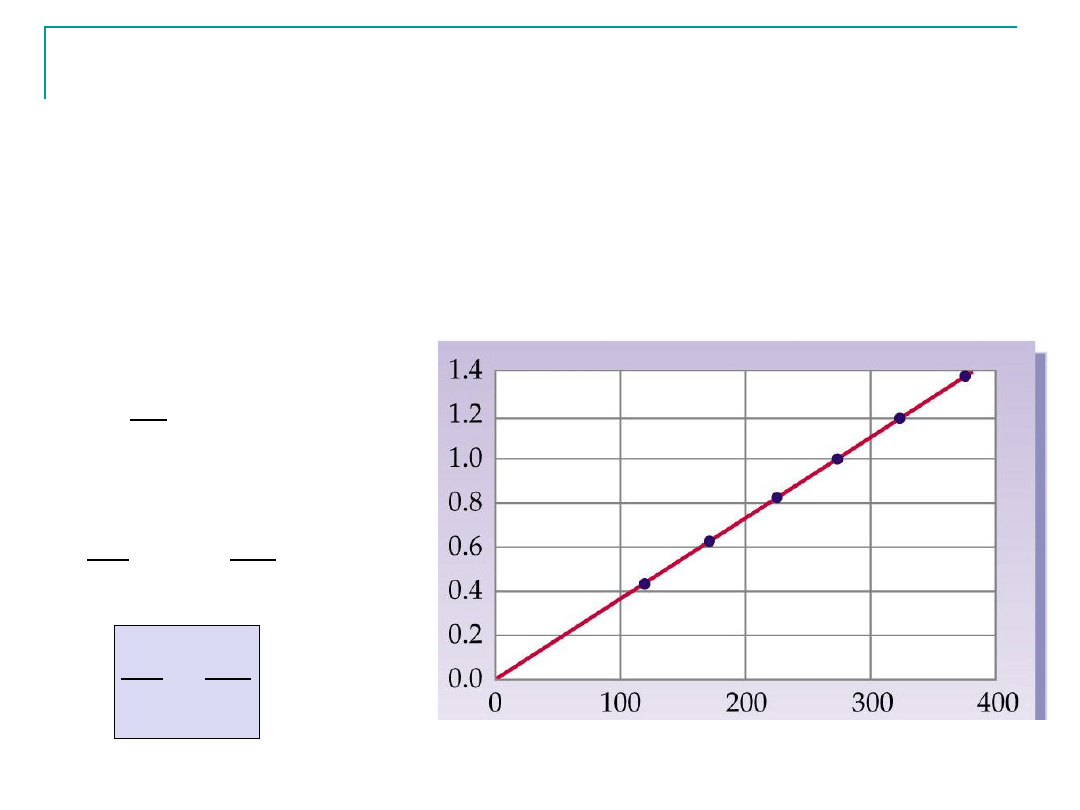
Prawo Charles’a
J.Charles stwierdził, ze objętość gazu pod stałym ciśnieniem
rośnie „liniowo” ze wzrostem temperatury dla określonej
ilości gazu
b
T
V
T
V
T
V
b
2
2
1
1
T
V
T
V
b
2
2
1
1
T
V
T
V
Gdzie V-objętość,
T-temperatura,
b-stała
Temperatura (K)
Objęt
ość (m
3
)
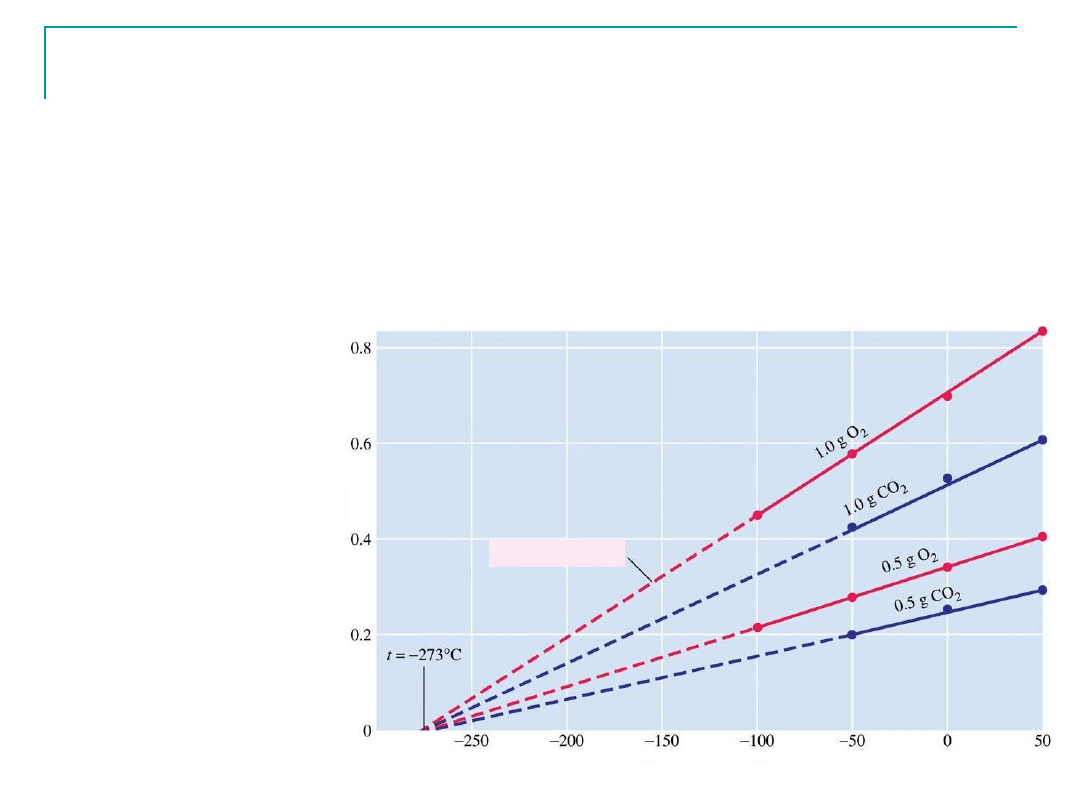
Prawo Charles’a cd
Punkt charakterystyczny wykresu: dla wszystkich gazów
objętość ekstrapolowana do zera jest w tym samym punkcie,
-273.2
o
C
W skali Kelwina, ten punkt definiowany jest jako 0 K (zero
absolutne)
Temperatura (
o
C)
Ob
jęto
ść
(dm
3
)
Ekstrapolacja
Kombinacja praw gazowych
Każde z praw gazowych opisuje wpływ zmiany jednej z
wielkości, jeżeli pozostałe dwa są stałe
Dla stałej masy gazu
p
T
V
p
T
d
V
d
T
Vp
2
2
2
1
1
1
T
p
V
d
T
p
V
2
2
2
1
1
1
T
p
V
T
p
V
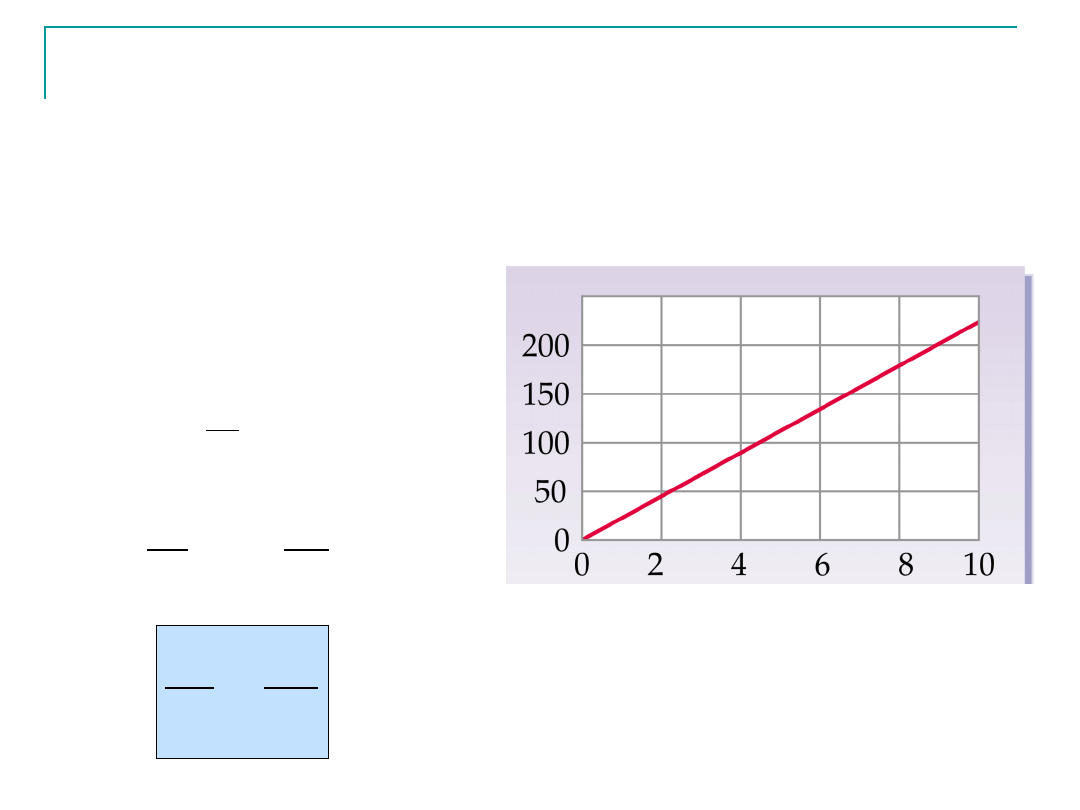
Prawo Avogadro
A. Avogadro stwierdził, że równe objętości gazów w tej
samej temperaturze i pod tym samym ciśnieniem zawierają
taka samą ilość „cząstek”
n
V
n
V
c
c
n
V
2
2
1
1
n
V
c
n
V
2
2
1
1
n
V
n
V
Ilość moli
Objęt
ość
Prawo gazu doskonałego
p
T
n
V
p
T
n
R
V
nRT
pV
R- stała gazowa,
R=8.314 J·(mol·K)
-1
2
2
2
2
1
1
1
1
T
n
V
p
T
n
V
p
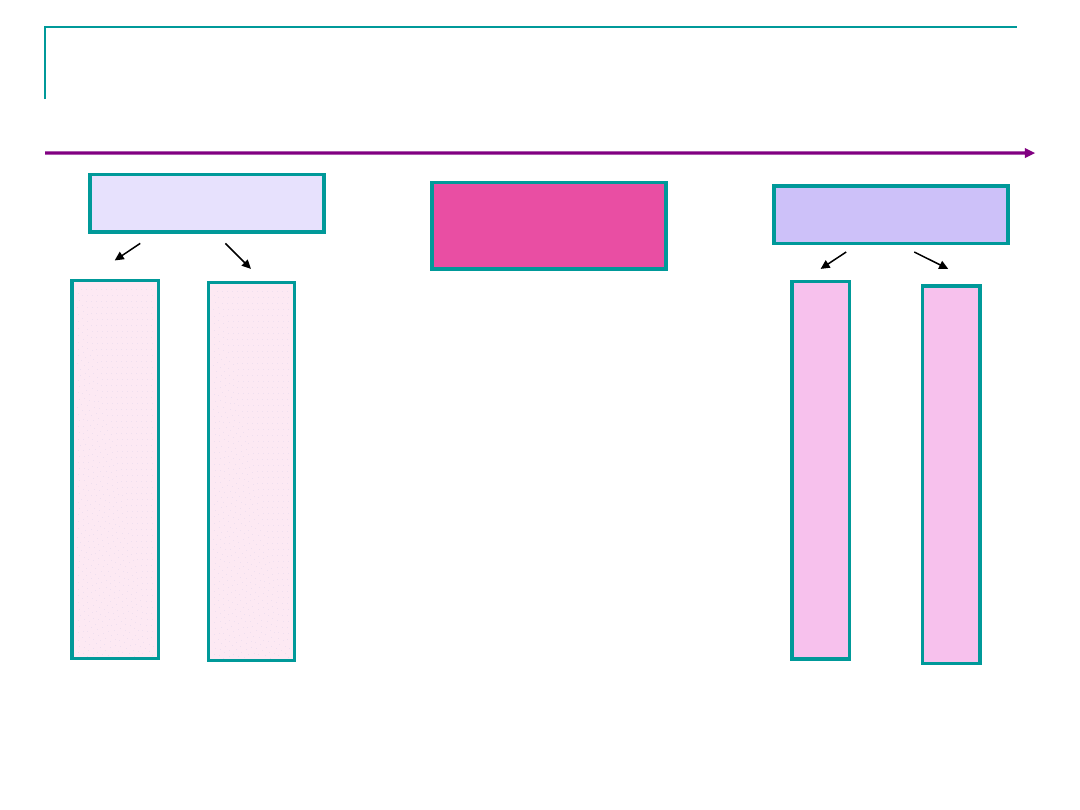
GAZOWY STAN SKUPIENIA
uporządkowanie
STANY MATERII W GRANICACH
GAZOWEGO STANU SKUPIENI
A
GAZ
WŁAŚCIWY
PLAZMA
WY
SOK
O
-
TE
M
PERA
TURO
W
A
NIS
KO
-
TE
MPERA
TURO
W
A
NIENASYC
ON
A
NA
SYC
ONA
PARA
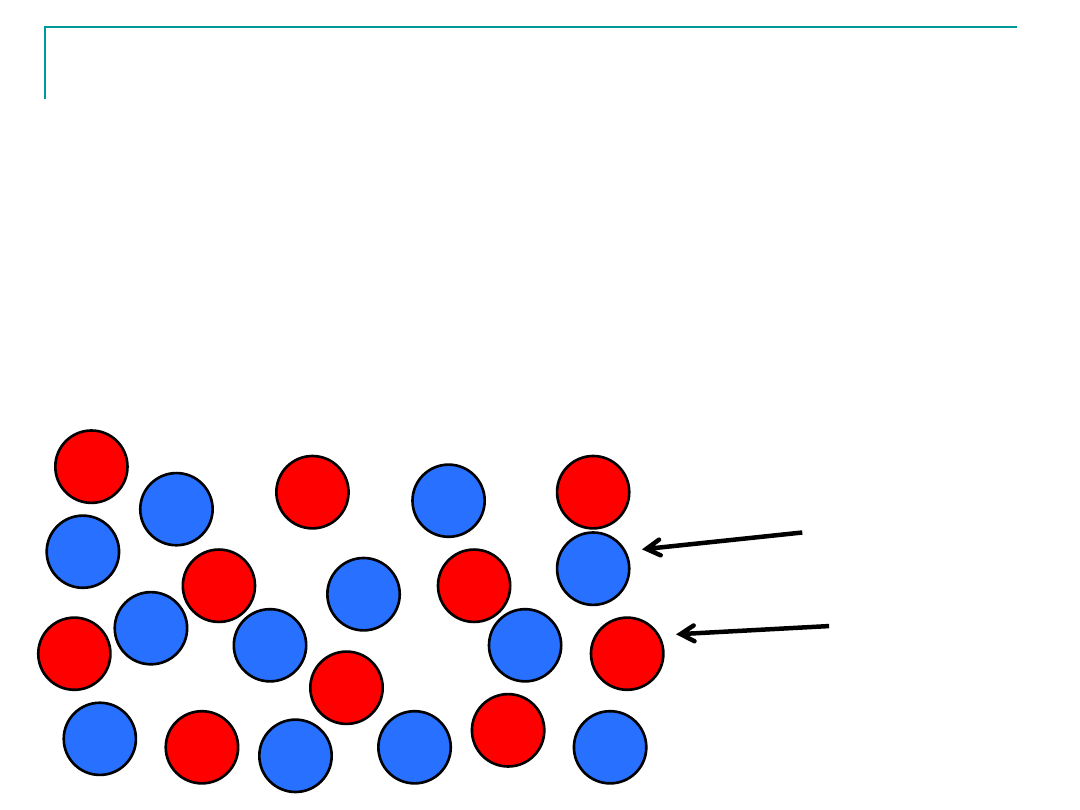
Plazma wysokotemperaturowa
W temperaturach powyżej 10
5
-10
6
K atomy ulegają
całkowitej jonizacji tworząc nieuporządkowany stan
materii złożony z jąder i elektronów-
PLAZMA
WYSOKOTEMPERATUROWA
elektron
jadro

Plazma wysokotemperaturowa
Występowanie swobodnych ładunków elektrycznych
o rozmiarach rzędu 10
-15
m
Silne oddziaływania elektrostatyczne i magnetyczne
pomiędzy składnikami
pV
nRT
Emisja wyłącznie ciągłego widma fal
elektromagnetycznych
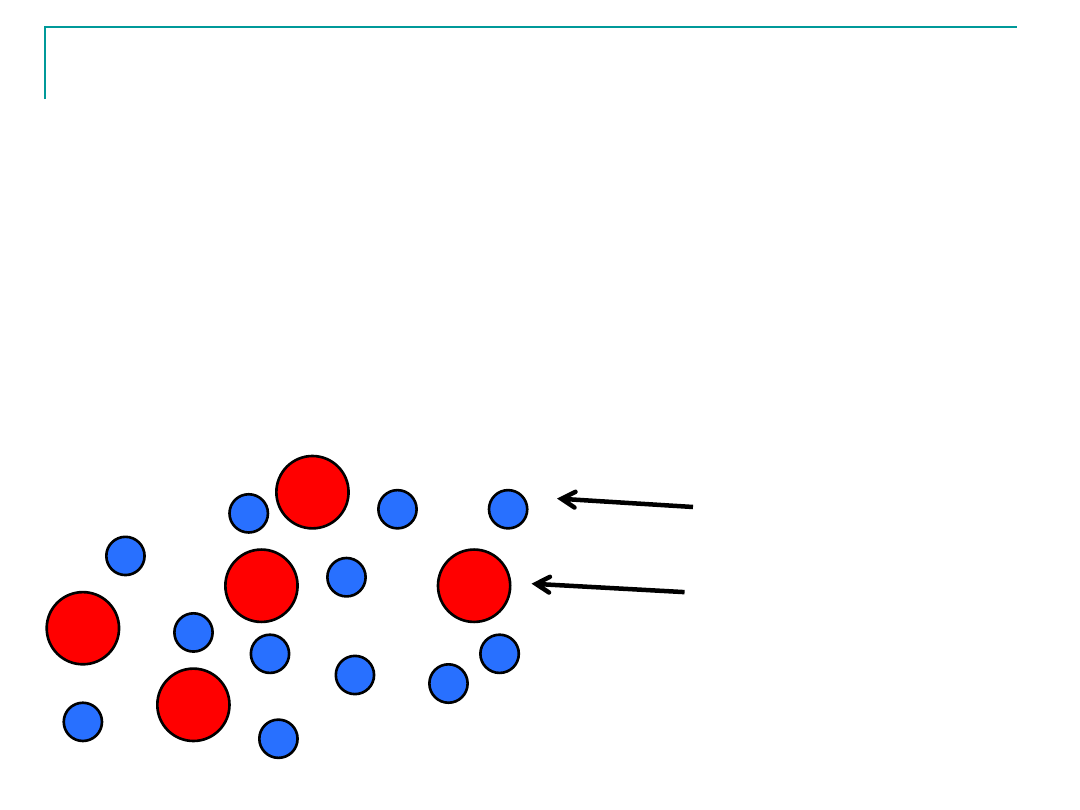
Plazma niskotemperaturowa
W temperaturach > 10
3
K atomy ulegają częściowej
jonizacji tworząc nieuporządkowany stan materii
złożony z jonów dodatnich i elektronów –
PLAZMA
NISKOTEMPERATUROWA
elektron
jon dodatni

Plazma niskotemperaturowa
Występowanie swobodnych ładunków elektrycznych
o rozmiarach rzędu 10
-10
m (jony dodatnie) i 10
-15
m
(elektrony)
Silne oddziaływania elektrostatyczne i magnetyczne
pomiędzy składnikami
pV
nRT
Emisja ciągłego i charakterystycznego widma fal
elektromagnetycznych
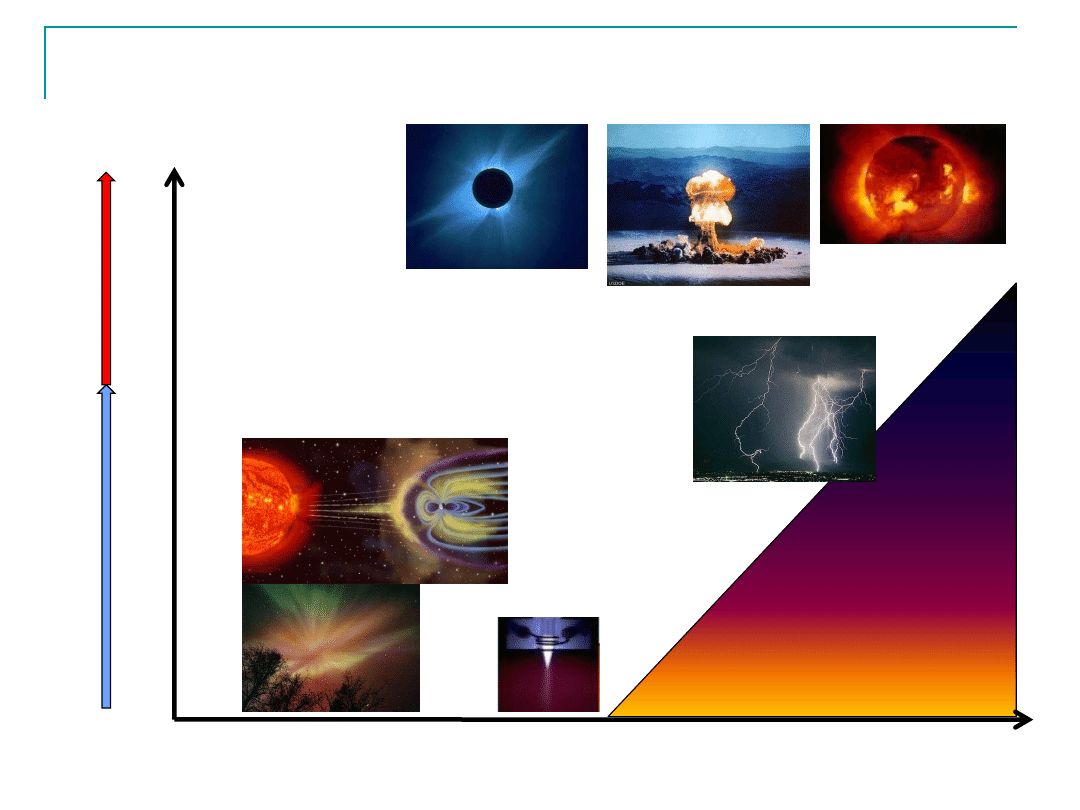
Plaz
m
a zi
m
na
niskote
m
per
at
urowa
Plaz
m
a gorąc
a
wy
sokotempera
turowa
PLAZMA
Koncentracja elektronów ( m
-3
)
10
3
10
9
10
15
10
21
10
27
10
33
ciała stałe
ciecze i gazy
Niska temperatura
Duża gęstość
T
empera
tura
[K]
10
6
10
5
10
4
10
3
Jądro słońca
Synteza jądrowa
Korona słońca
Wiatr słoneczny
Zorza
Gaz właściwy
W temperaturach od kilku do 1000-1500K atomy i cząsteczki
praktycznie
nie
ulegają jonizacji mogąc tworzyć
nieuporządkowany stan materii złożony z obojętnych
atomów lub cząsteczek
-
GAZ WŁAŚCIWY
warunkiem istnienia stanu gazowego jest
oddz
śr
kin
śr
E
E
Istnienie silnych oddziaływań w plazmie było wynikiem
obecności swobodnych ładunków elektrycznych (dlatego plazma
nie może istnieć w niskich temperaturach)
Słabe oddziaływania pomiędzy atomami i cząsteczkami
gazów właściwych (co umożliwia ich istnienie w
stosunkowo niskich temperaturach) są wynikiem
istnienia
sił międzycząsteczkowych
zwanych
siłami
Van der Waalsa
Siły międzycząsteczkowe
Gaz właściwy składa się z atomów, których moment
dipolowy
=0, lub cząsteczek dla których
0
-
+
atom
cząsteczka
cząsteczka
=0
=0
0
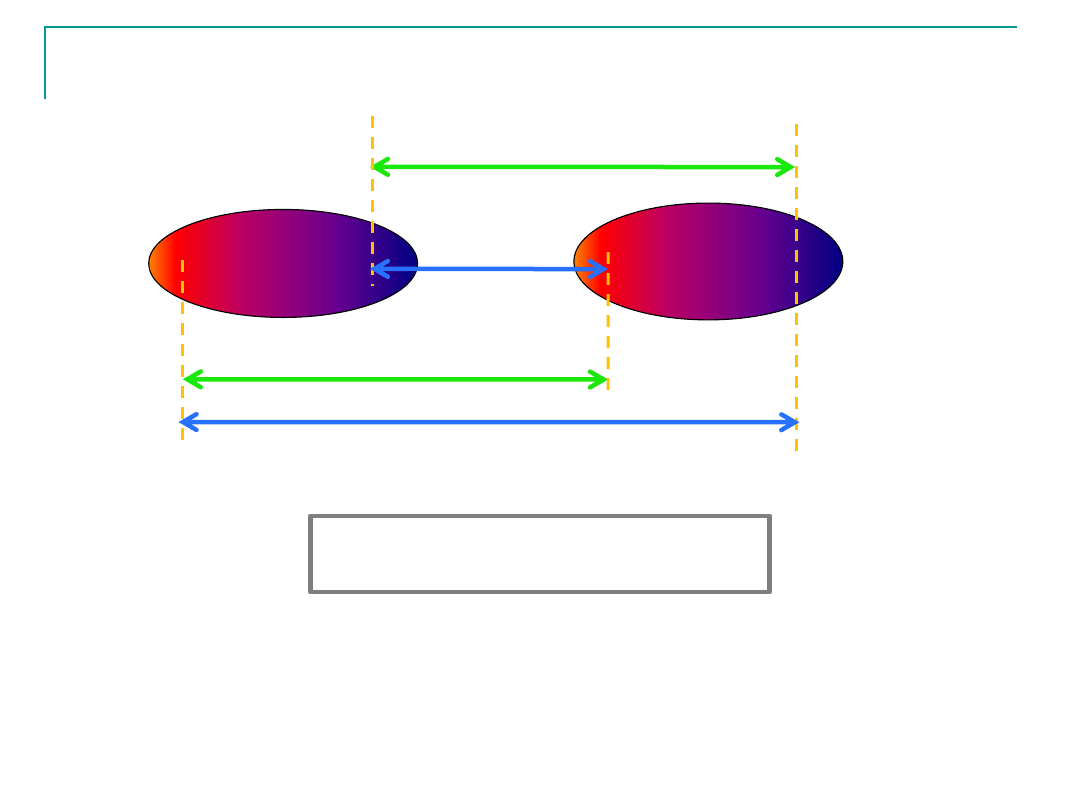
Oddziaływanie dipol-dipol
-
+
-
+
F
4
F
3
F
1
F
2
F
1
+F
2
>
F
3
+F
4
Oddziaływanie dipol- indukowany dipol
duża odległość
mała odległość
indukowane
dipole
trwałe dipole
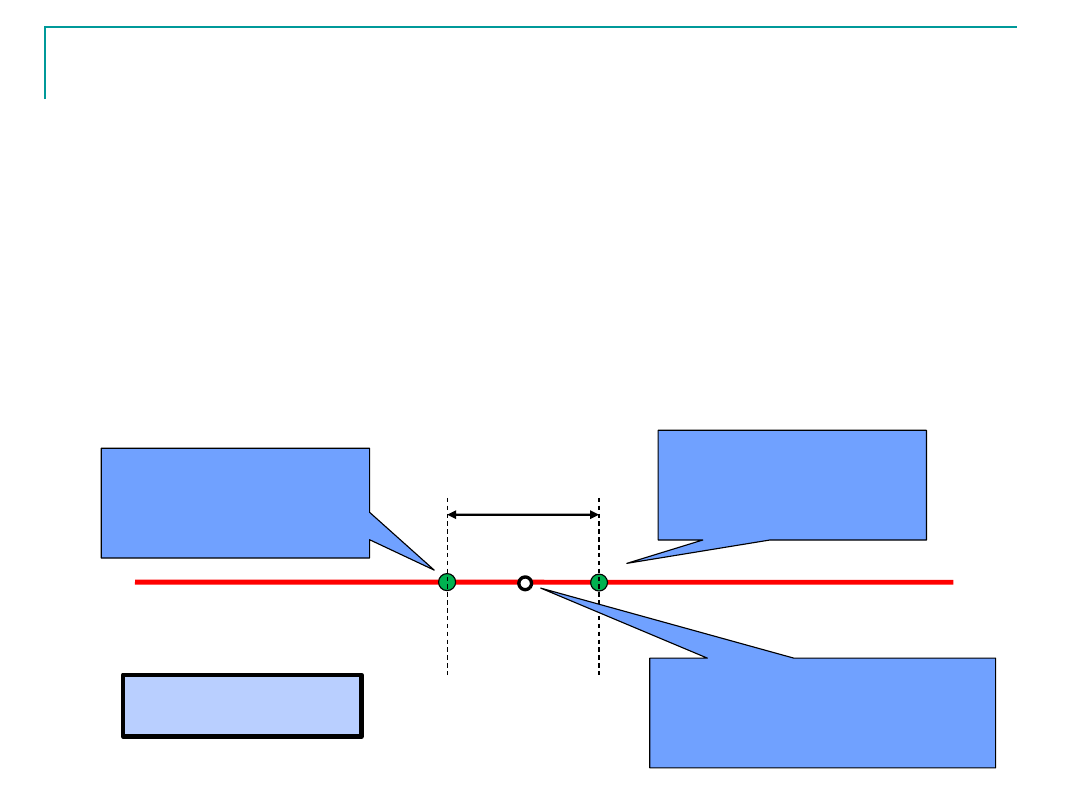
Siły międzycząsteczkowe: siły dyspersyjne Londona
W każdym atomie lub cząsteczce środki ładunku dodatniego
i ujemnego wykonują ruch drgający wokół położenia
równowagi, które jest wspólne w przypadku cząsteczek
(atomów) mających zerowy moment dipolowy (
=0)
Chwilowe
położenie q
(-)
Położenie równowagi
dla q
(+)
i q
(-)
Chwilowe
położenie q
(+)
l
chwil
=q·l
Siły międzycząsteczkowe: siły dyspersyjne Londona
Każda cząsteczka (nawet taka,
dla której
=0) jest drgającym
dipolem elektrycznym
Czyli
=0 oznacza tylko,
że średni w czasie moment
dipolowy wynosi zero
Jeżeli dwie cząsteczki
znajdują się blisko siebie…
przyciąganie
przyciąganie
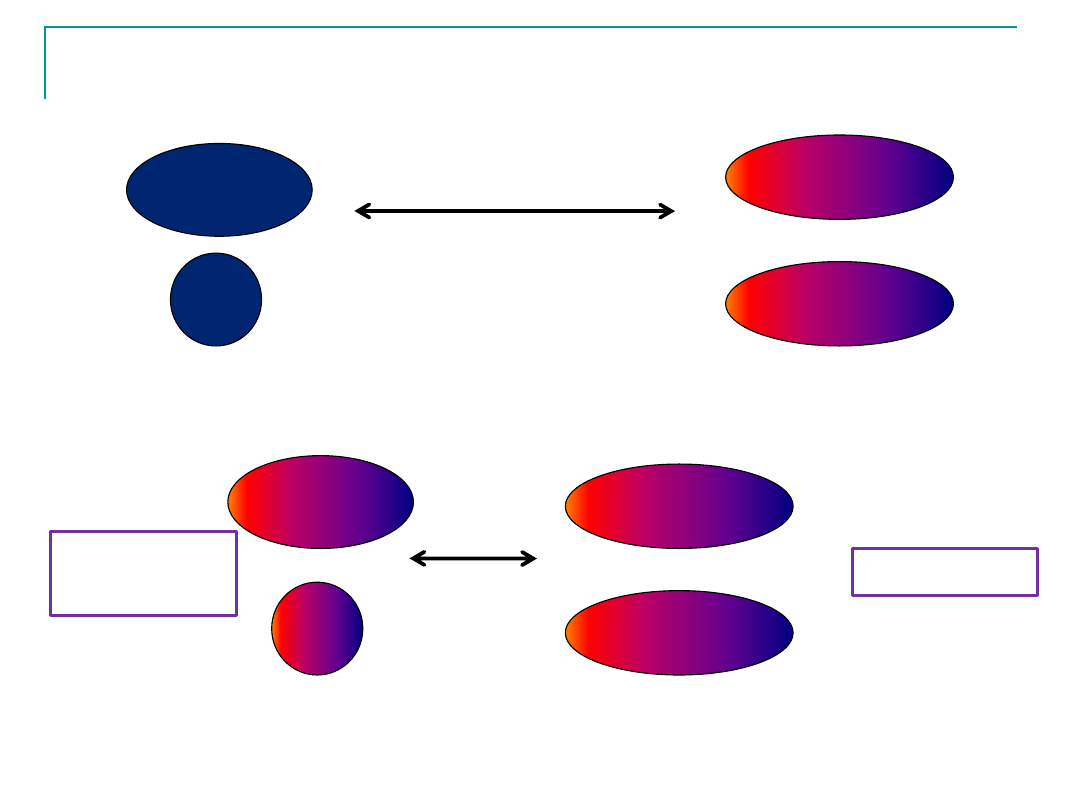
Siły międzycząsteczkowe
Siły Van der Waalsa
Oddziaływanie
dipol-dipol
Siły dyspersyjne
(Londona)
Oddziaływanie
dipol-
indukowany dipol

Teoria kinetyczna gazów
Model stanu gazowego
założenia
1. Cząsteczki są punktami materialnymi (mają masę, nie
posiadają wymiarów)
2. Gaz składa się z cząsteczek, które znajdują się w
ciągłym ruchu
3. Cząsteczki nie oddziaływają na siebie za wyjątkiem
momentu zderzeń (zderzenia sprężyste)

Teoria kinetyczna gazów cd
Jaki jest związek pomiędzy energią cząsteczek gazu a temperaturą
w której się znajduje?
Średnia energia kinetyczna ruchu postępowego cząsteczki gazu w temperaturze
wynosi:
gdzie jest stałą Boltzmanna k=1.38
·10
-23
J•K
-1
Średnia energia kinetyczna cząsteczki jest wprost
proporcjonalna do temperatury bezwzględnej
Średnia energia kinetyczna cząsteczki nie zależy od jej masy!
Na każdy stopień swobody ruchu cząstki przypada energia.
W przypadku ruchu postępowego cząstka ma trzy stopnie
swobody: związane z ruchem wzdłuż osi.
Dla gazów jednoatomowych jest to jedyny wkład do energii
kinetycznej
kT
2
3
E
śr
A
N
R
k
Teoria kinetyczna gazów cd
W przypadku cząsteczki dwuatomowej cząsteczka ma
również wkład do energii kinetycznej związany z jej ruchem
obrotowym wokół dwóch osi prostopadłych do osi łączących
atomy.
W przypadku cząsteczki składającej się z trzech lub więcej
atomów są trzy stopnie swobody związane z ruchem
obrotowym (obroty wokół trzech prostopadłych osi), w
związku z tym energia kinetyczna cząsteczki wynosi:
kT
2
5
E
śr
3kT
kT
2
6
E
śr
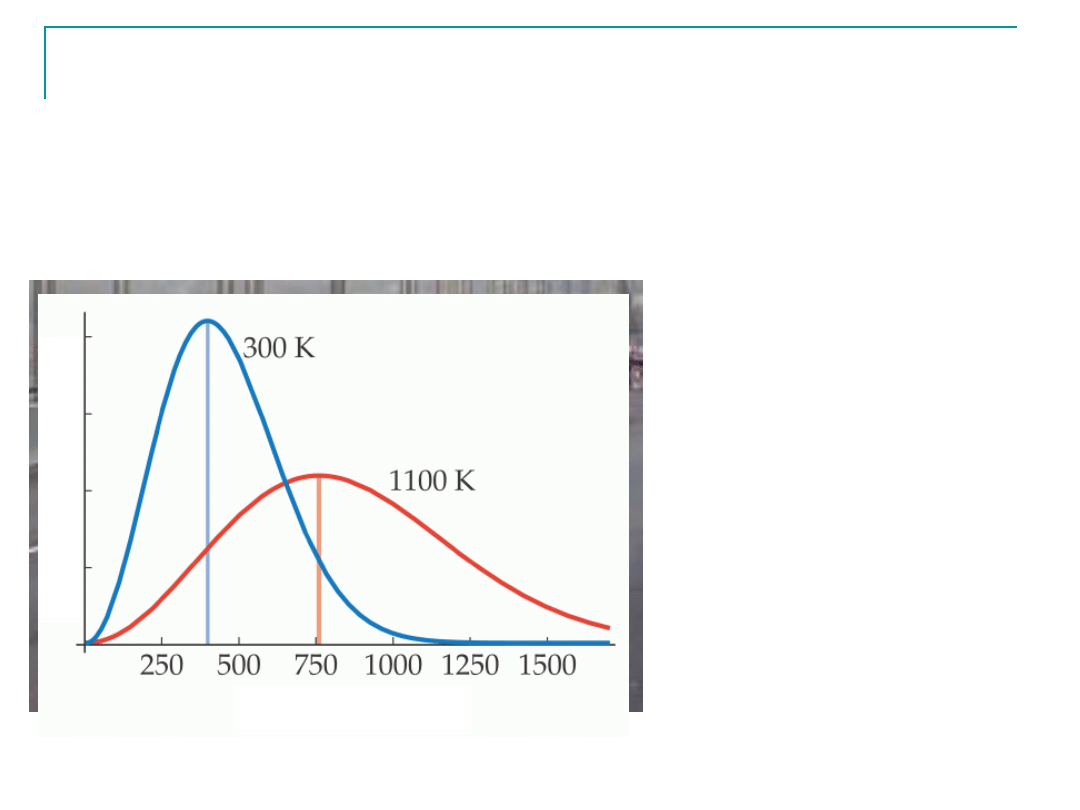
Rozkład prędkości Maxwella
Rozkład szybkości cząsteczek- ułamek cząsteczek poruszających się z
określoną szybkością
J.M.Maxwell zaproponował matematyczną funkcji rozkładu (koniec XIX)
•Jedynie niewielki ułamek
cząsteczek porusza się z
szybkościami znacznie
mniejszymi lub znacznie
większymi od szybkości
średniej
•Ze wzrostem temperatury
następuje „poszerzenie”
rozkładu i przesuniecie
wartości średniej ku
większym szybkościom
prędkość (m/s)
Li
cz
ba
cz
ąste
k
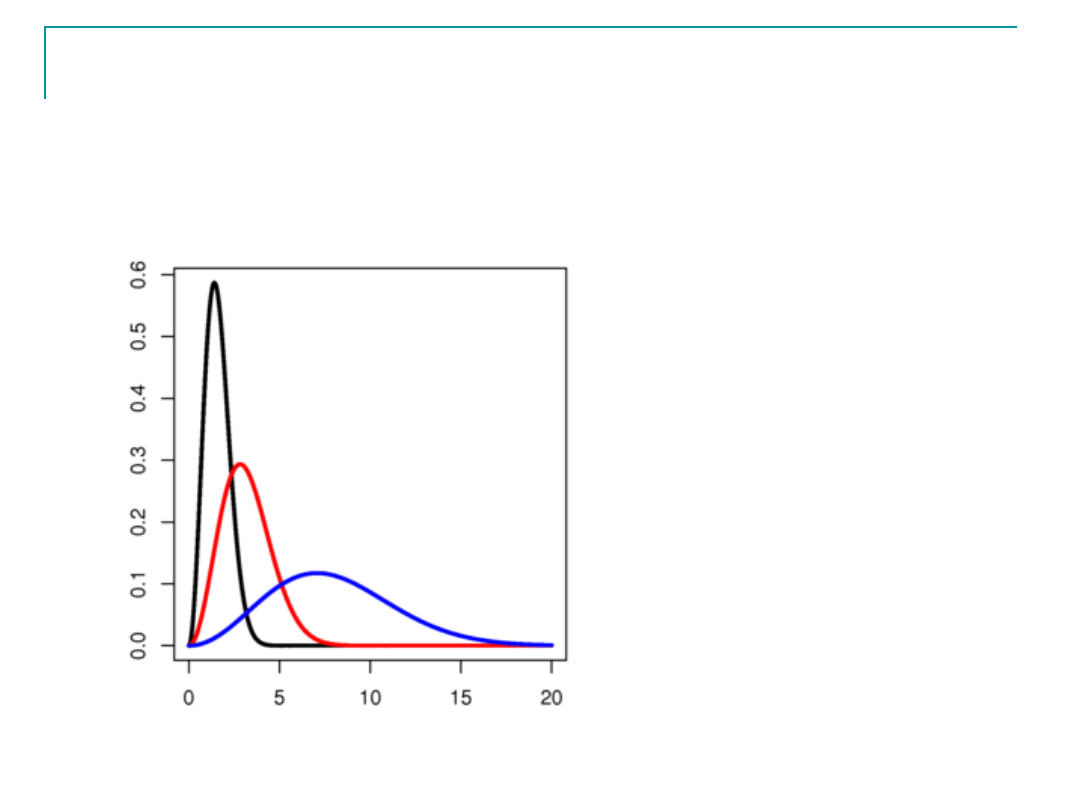
Rozkład szybkości Maxwella cd
Rozkład szybkości dla cząsteczek o różnych masach molowych
•Szybkość średnia ciężkich
cząsteczek jest w danej
temperaturze mniejsza niż
szybkość średnia
cząsteczek lekkich
•Cząsteczki cięższe
wykazują znacznie węższy
rozkład szybkości,
większość z nich porusza
się z szybkościami
zbliżonymi do średniej
duża masa
molowa
mała masa
molowa
średnia masa
molowa
prędkość (m/s)
Li
cz
ba
cz
ąstek
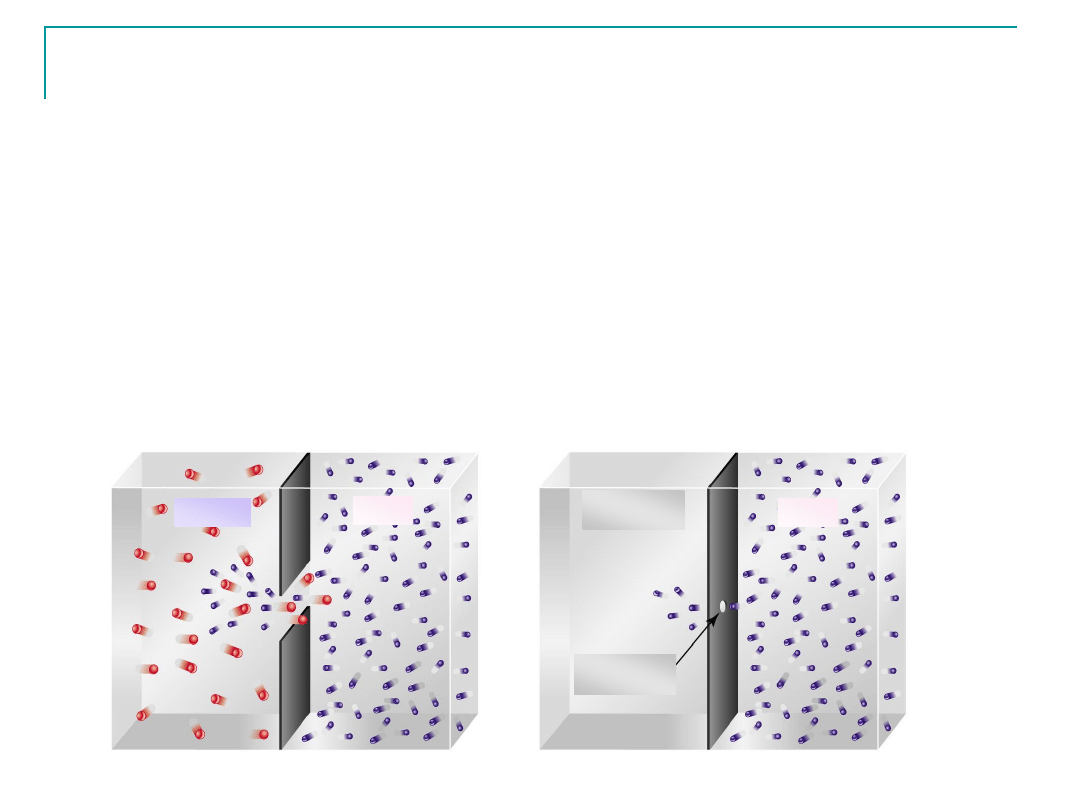
Dyfuzja i efuzja
Dyfuzja - samorzutny proces mieszania się cząsteczek dwóch substancji
Efuzja – proces wypływu gazu ze zbiornika przez mały otwór
Ze wzrostem temperatury następuje wzrost szybkości dyfuzji i efuzji
Szybkości procesów dyfuzji i efuzji są tym mniejsze im większe są masy
molowe gazów
Prawo efuzji Grahama: w danych warunkach temperatury i ciśnienia
szybkość efuzji gazu jest odwrotnie proporcjonalna do pierwiastka
kwadratowego z jego masy molowej
otwór
próżnia
Gaz 2
Gaz 1
Gaz

Gazy rzeczywiste
Jakie są przyczyny odstępstwa od prawa gazu
doskonałego?
Istnienie oddziaływań międzycząsteczkowych
Występowanie objętości cząsteczek
nRT
pV
•Przybliżenie jest tym lepsze im średnie odległości
cząsteczek gazu są większe od średnic cząsteczek
•Warunek ten spełniony jest dla niskich wartości ciśnień i
wysokich temperatur
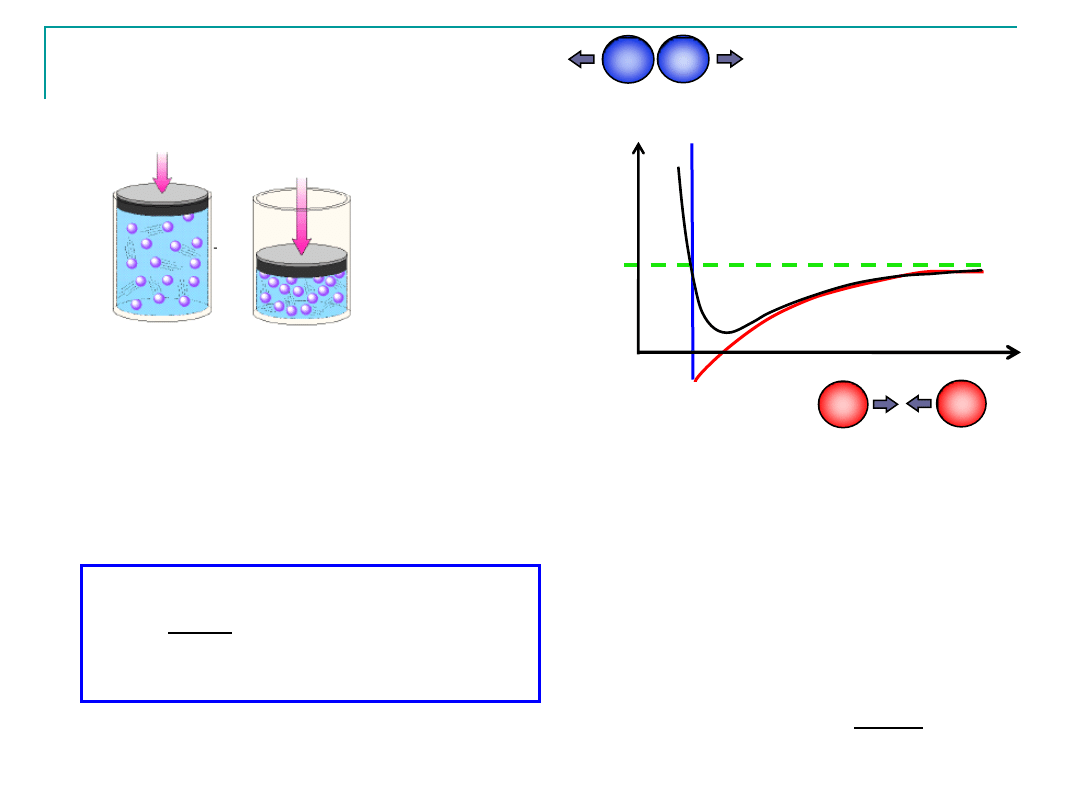
Gazy rzeczywiste
2
2
eff
V
a
n
p
p
b
n
V
V
eff
nRT
V
p
ideal
ideal
U(r)
Mała odległość
odpychanie
Duża odległość
Przyciąganie
r
Siły dalekiego zasięgu
Siły przyciągania-tendencja do
trzymania się razem
Efektem jest dodatkowa kompresja
gazu
Siły krótkiego zasięgu
nRT
b
n
V
V
a
n
p
2
2
0
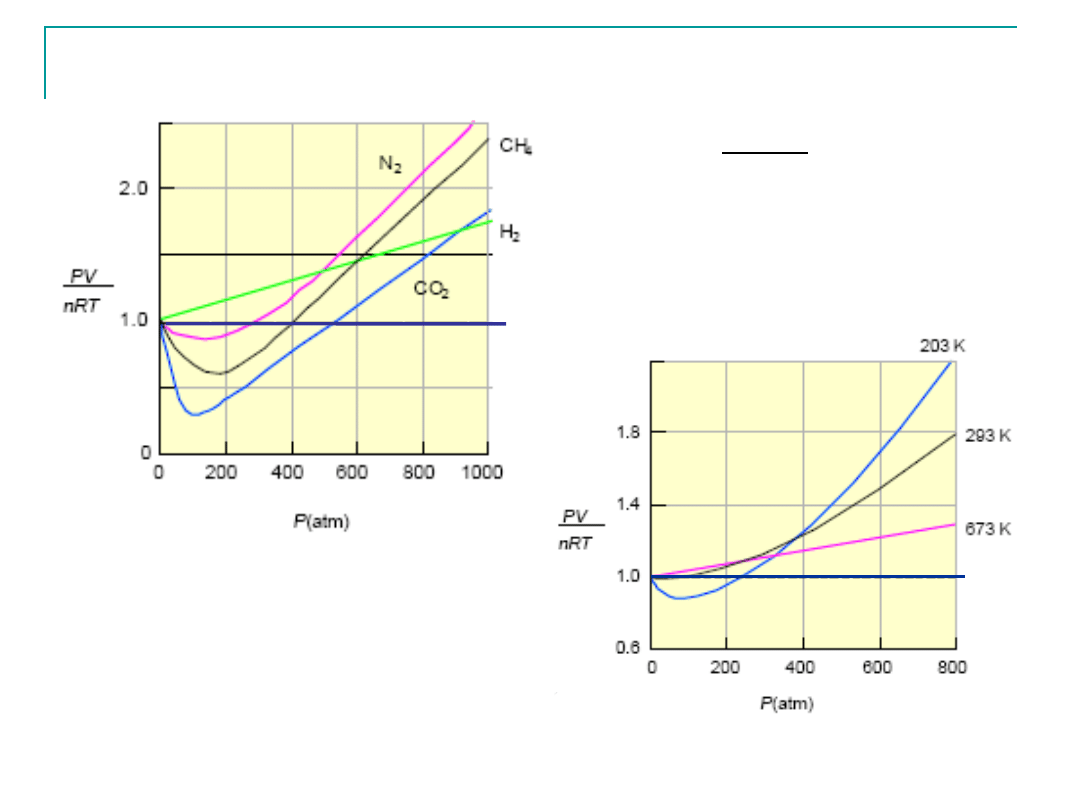
Gaz rzeczywisty
Gaz
idealny
Gaz
idealny
1
nRT
pV

Gaz rzeczywisty cd
azot N
2
................................ 22,401 dm
3
amoniak NH
3
....................... 22,089 dm
3
ditlenek siarki SO
2
............... 21,888 dm
3
siarkowodór H
2
S .................. 22,145 dm
3
W warunkach standardowych T=273K, p=1atm
1 mol gazu idealnego zajmuje objętość 22.43 dm
3
Obniżamy temperaturę gazu rzeczywistego
Średnia energia cząstek gazu maleje:
Energia oddziaływań międzycząsteczkowych prawie nie
ulega zmianie
Gdy sprężymy gaz w którym
możliwe jest tworzenie się agregatów cząsteczek o
rozmiarach nie przekraczających pewnej
wartości
krytycznej
Taki stan gazowy materii nazywamy
PARĄ
NIENASYCONĄ
Granicę pomiędzy gazem a parą nienasyconą określa T
K
zwana temperaturą krytyczną
kT
E
śr
2
3
oddz
śr
kin
śr
E
E
oddz
śr
kin
śr
E
E
oddz
śr
kin
śr
E
E
temperatura
T
k
PARA
NIENASYCONA
GAZ WŁAŚCIWY
oddz
śr
kin
śr
E
E
oddz
śr
kin
śr
E
E
Jak zachowuje się para nienasycona przy podwyższaniu ciśnienia
lub przy obniżaniu temperatury?
2012-01-21
40
Para nienasycona
para nasycona
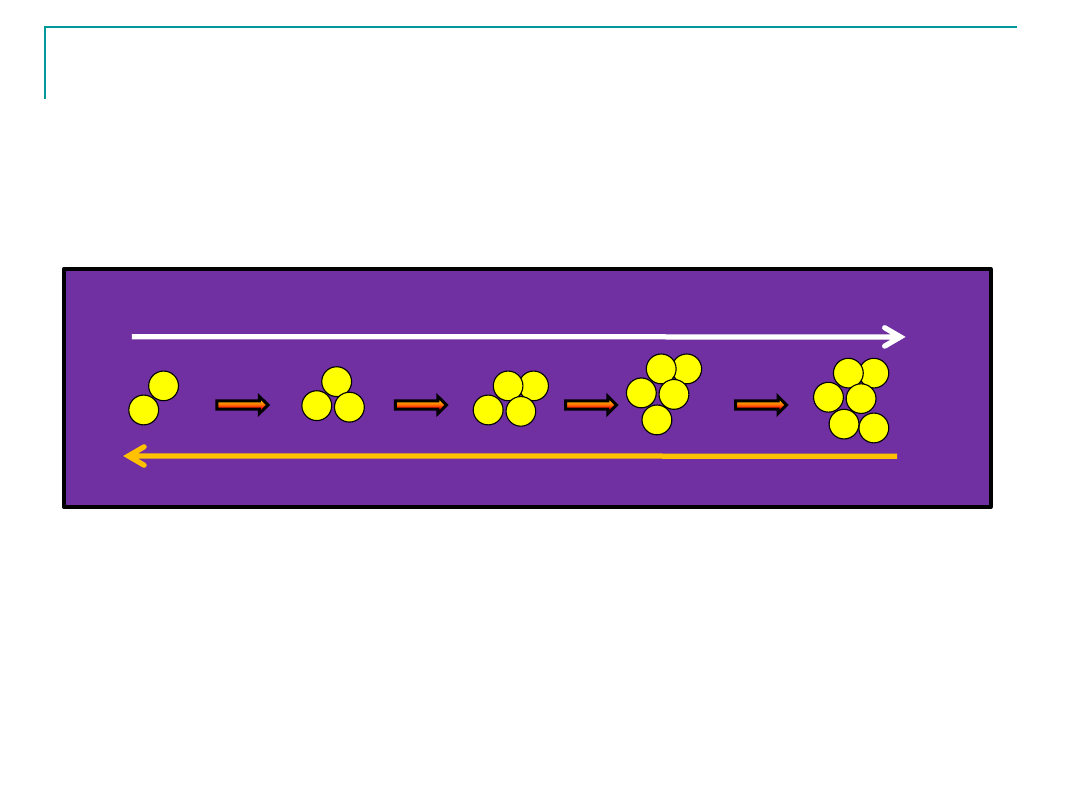
Przy obniżaniu temperatury lub podwyższaniu
ciśnienia pary nienasyconej wzrasta przeciętny
rozmiar agregatów cząsteczek
..agregaty takie tworzą się i rozpadają z szybkością
zależną od rodzaju cząsteczek, temperatury, ciśnienia
oraz
rozmiarów agregatów (czyli od liczby
cząsteczek w agregacie),
ciśnienie
temperatura
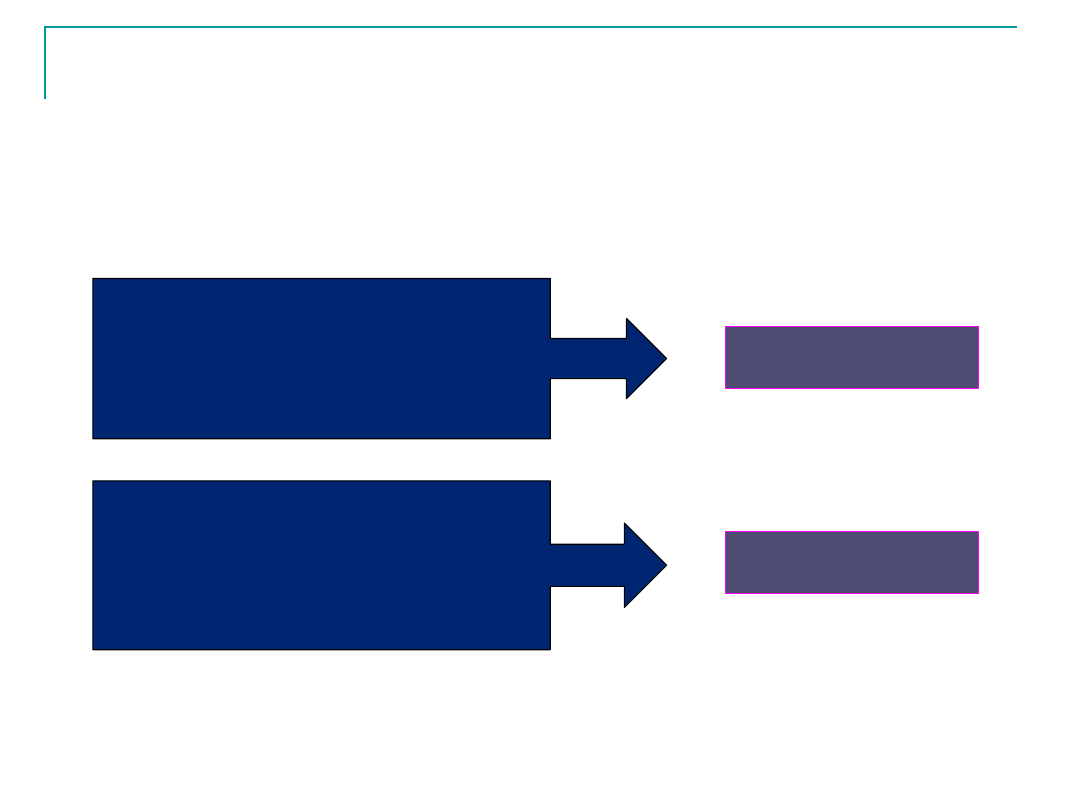
Dla każdej temperatury poniżej temperatury krytycznej T
K
istnieje
takie ciśnienie, przy którym rozmiary agregatów cząsteczek
osiągają wartość krytyczną, to znaczy taką począwszy od której,
szybkość wzrostu v
wzr
agregatu przewyższa szybkość jego
rozpadu v
rozp
Rozmiary agregatów są
MNIEJSZE
od rozmiarów
krytycznych
Rozmiary agregatów są
WIĘKSZE
od rozmiarów
krytycznych
V
rozp
>V
wzr
V
rozp
<V
wzr
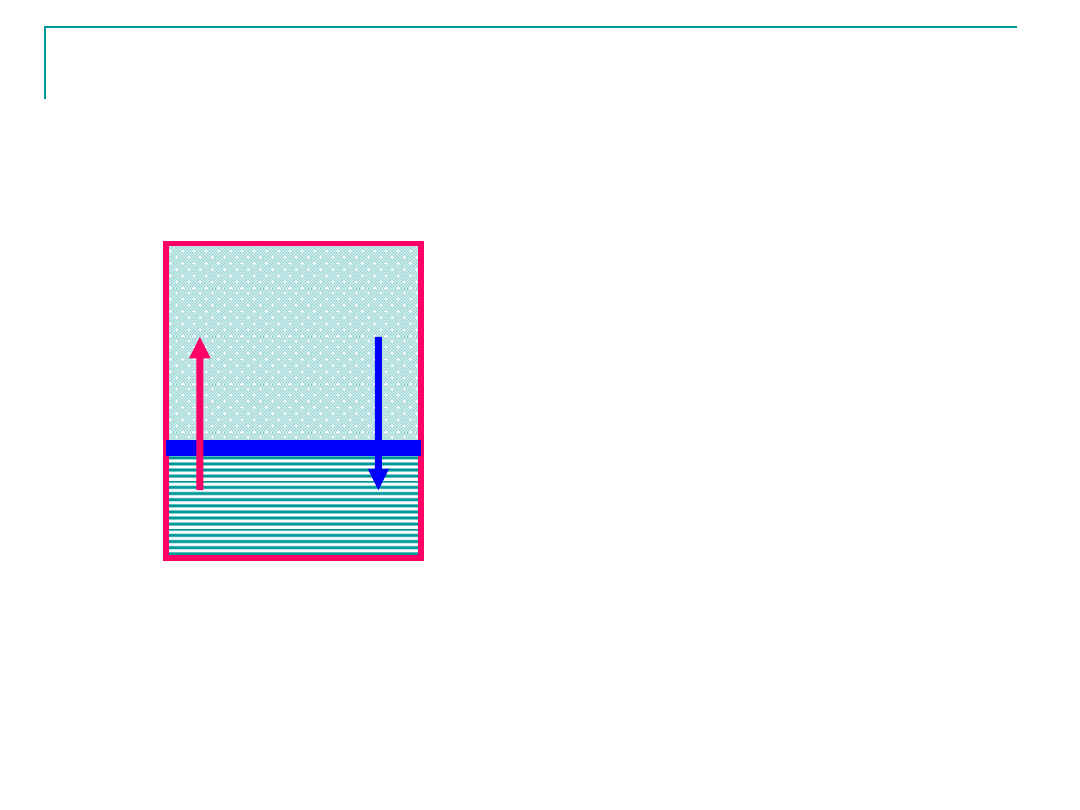
Równowaga ciecz-para
Para
Ciecz
v
par
v
kon
V
par
– szybkość parowania
V
kon
– szybkość kondensacji
W stanie równowagi, w
stałej temperaturze:
V
par
=V
kon
W takim stanie para nad cieczą osiąga maksymalne
ciśnienie p
R
(w stałej temperaturze), które jest
ciśnieniem pary nasyconej
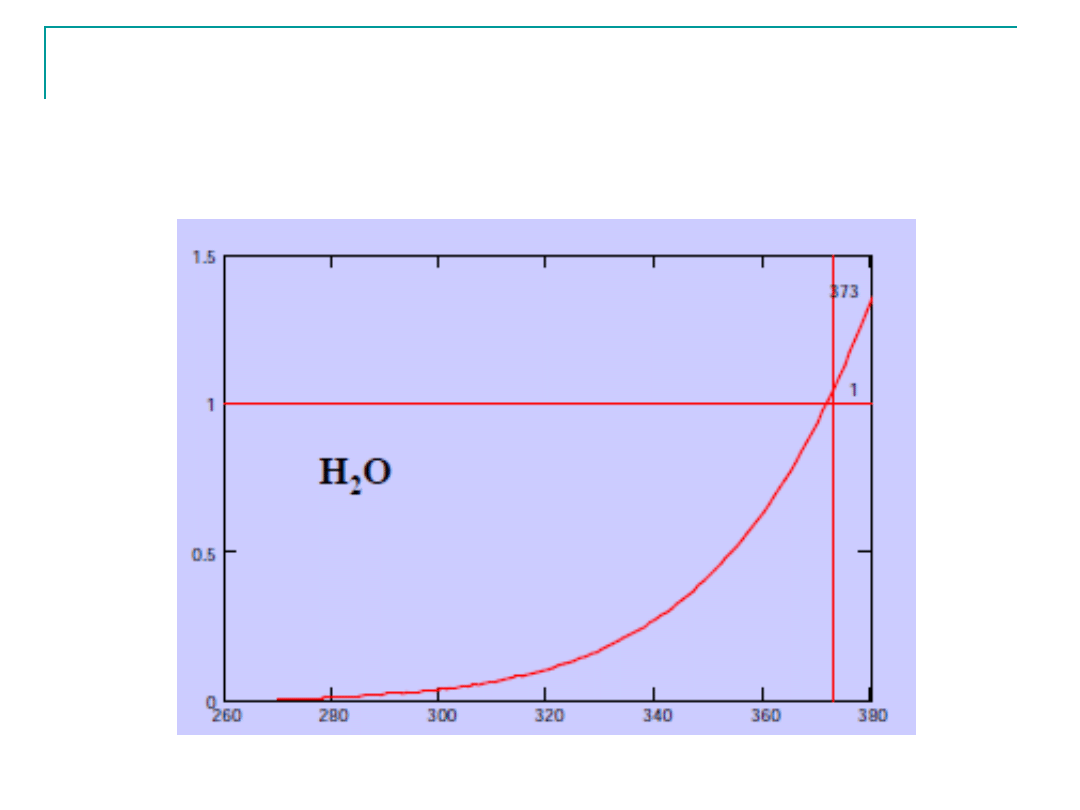
Para nasycona
Para nasycona (definicja) to para, która w danej
temperaturze osiągnęła maksymalne ciśnienie
Temperatura (K)
Ciśni
eni
e
(at
m
)
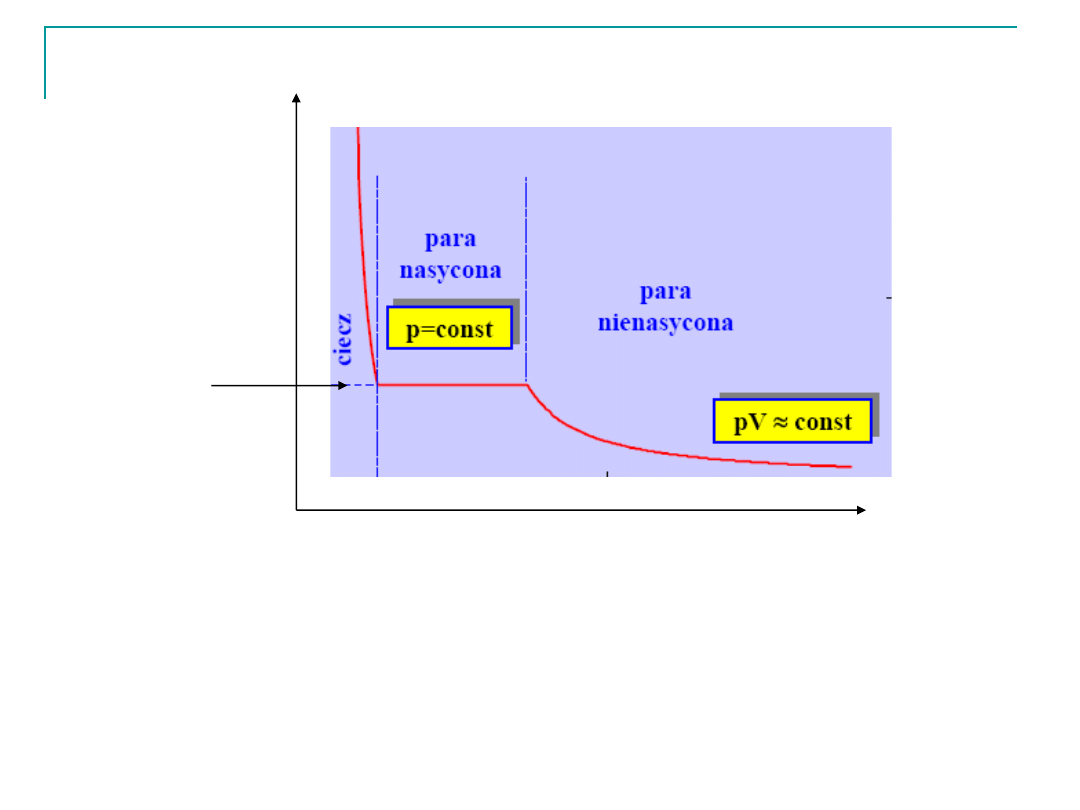
Rozważmy sytuację, w której para nienasycona o temperaturze
T<T
K
poddana jest sprężaniu
objętość
ci
śnie
nie
pk
Para nasycona to para w równowadze z cieczą, z której powstała.
Para ta ma największe możliwe dla danej temperatury ciśnienie i gęstość.
Ciśnienie pary nasyconej jest niezależne od objętości. Zmniejszanie
objętości w stałej temperaturze powoduje skraplanie pary, a stan równowagi
w dalszym ciągu istnieje. Zwiększanie objętości powoduje wyparowanie
cieczy bez obniżenia ciśnienia pary nasyconej.
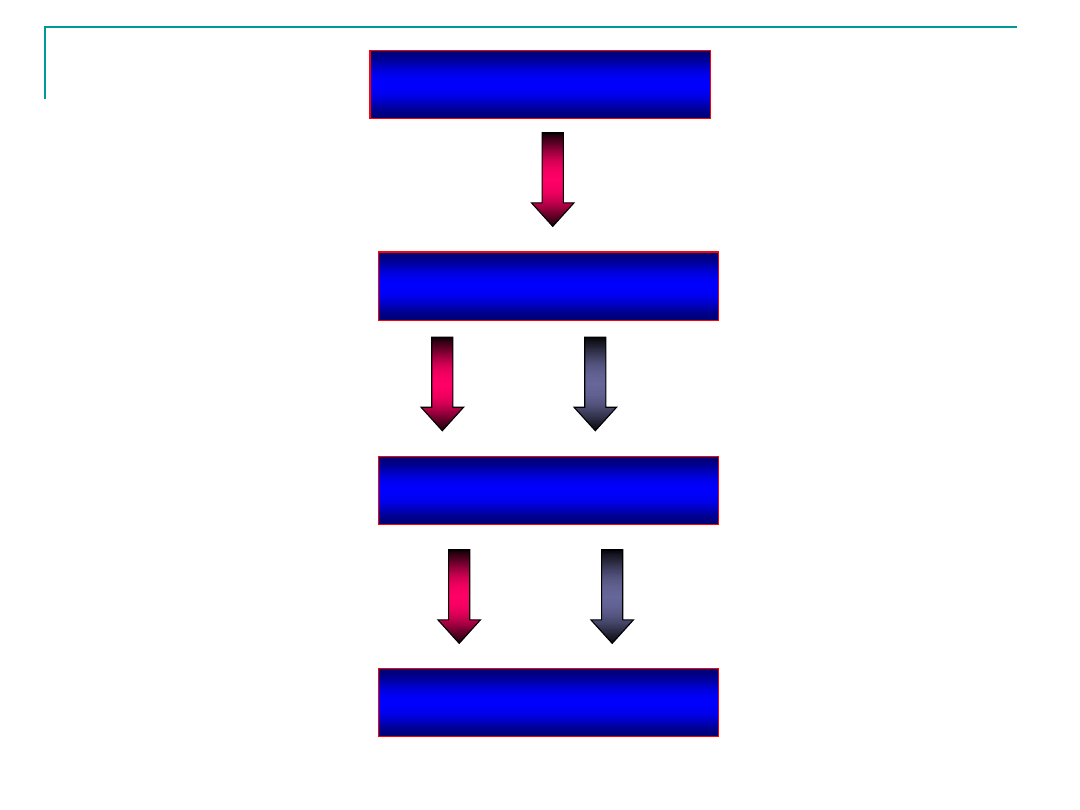
GAZ
Obniżenie temperatury
PARA NIENASYCONA
Obniżenie temperatury
Zmniejszenie objętości
PARA NASYCONA
Obniżenie temperatury
Zmniejszenie objętości
CIECZ

Fizyczne stany materii
Gaz
Przyjmuje kształt naczynia w którym się znajduje
Wypełnia naczynie w którym się znajduje
Łatwo ulega kompresji
Niska gęstość
Ciała stałe
Zachowuje własny kształt, niezależnie od kształtu naczynia w którym się
znajduje
Nie ulega kompresji
Wysoka gęstość
Ciecze
Własności pośrednie pomiędzy własnościami gazów i ciał stałych, bardziej
zbliżone do własności ciał stałych (gęstość wody i lodu są podobne)

Fizyczne stany materii cd
Gaz
Ciecz
Ciało stałe

Oddziaływania międzycząsteczkowe
Oddziaływanie wewnątrzcząsteczkowe
Oddziaływanie pomiędzy dwoma atomami „wewnątrz”
cząsteczki (udział elektronów pomiędzy dwoma atomami-
wiązanie kowalencyjne)
Oddziaływania międzycząsteczkowe-oddziaływania pomiędzy
cząsteczkami
Jakie siły są odpowiedzialne za agregacje indywidualnych
elementów tworzących ciecz lub ciało stałe?
Oddziaływania te mogą „wprowadzać” wiązania jonowe lub
kowalencyjne lub słabsze wzajemne oddziaływania zwane
oddziaływaniami międzycząsteczkowymi
Zmiany w stanie skupienia są spowodowane przez zmiany
w oddziaływaniach pomiędzy cząsteczkami a nie
wewnątrzcząsteczkowych
Wyszukiwarka
Podobne podstrony:
IB wyk13
IB wyk3 11
IB wyk11 11
IB wyk6 7 11(1)
IB wyk13
IB 007 12 Oznaczanie gęstości objętościowej próbek mma 12697 6 v2013 11
ib 11 05
11 IB Wojny grecko perskie
Zarz[1] finan przeds 11 analiza wskaz
11 Siłowniki
więcej podobnych podstron