Inżynieria Biomedyczna
Wykład XI

2012-01-08
2
Plan
Wiązania chemiczne
Teoria Lewisa
Teoria orbitali molekularnych
Homojądrowe cząsteczki dwuatomowe
Heterojądrowe cząsteczki dwuatomowe
Elektroujemność

2012-01-08
3
DEFINICJE
CZĄSTECZKA
-
układ co najmniej dwóch atomów
połączonych
wiązaniem
(wiązaniami)
chemicznymi
WIĄZANIE CHEMICZNE
-
oddziaływanie pomiędzy atomami
prowadzące do powstawania sił o
charakterze przyciągającym, które są
wynikiem zmian struktury elektronowej
układu atomów tworzących cząsteczkę

2012-01-08
4
DEFINICJE
REAKCJE CHEMICZNE
-procesy, w
wyniku których dochodzi do zrywania i/lub
tworzenia wiązań chemicznych
WIĄZANIE CHEMICZNE
powstaje,
jeżeli energia utworzonej cząsteczki jest
mniejsza od sumy energii oddzielnych
atomów

2012-01-08
5
Dlaczego tworzą się wiązania chemiczne?
Cząsteczka składa się przynajmniej z 2 atomów
Co oznacza, że mamy co najmniej 2 jadra atomowe oraz
2 elektrony
Oddziaływanie pomiędzy atomami:
JĄDRO-JĄDRO
ODPYCHANIE
JĄDRO-ELEKTRON
PRZYCIĄGANIE
ELEKTRO-ELEKTRON
ODPYCHANIE
Energia całego układu ulega obniżeniu (zmniejsza się
odpychanie) jeżeli elektrony będą się znajdować
pomiędzy jądrami
STANY ENERGETYCZNE elektronów w
cząsteczce, odpowiadają niższym energiom niż
w izolowanych atomach
2012-01-08
6
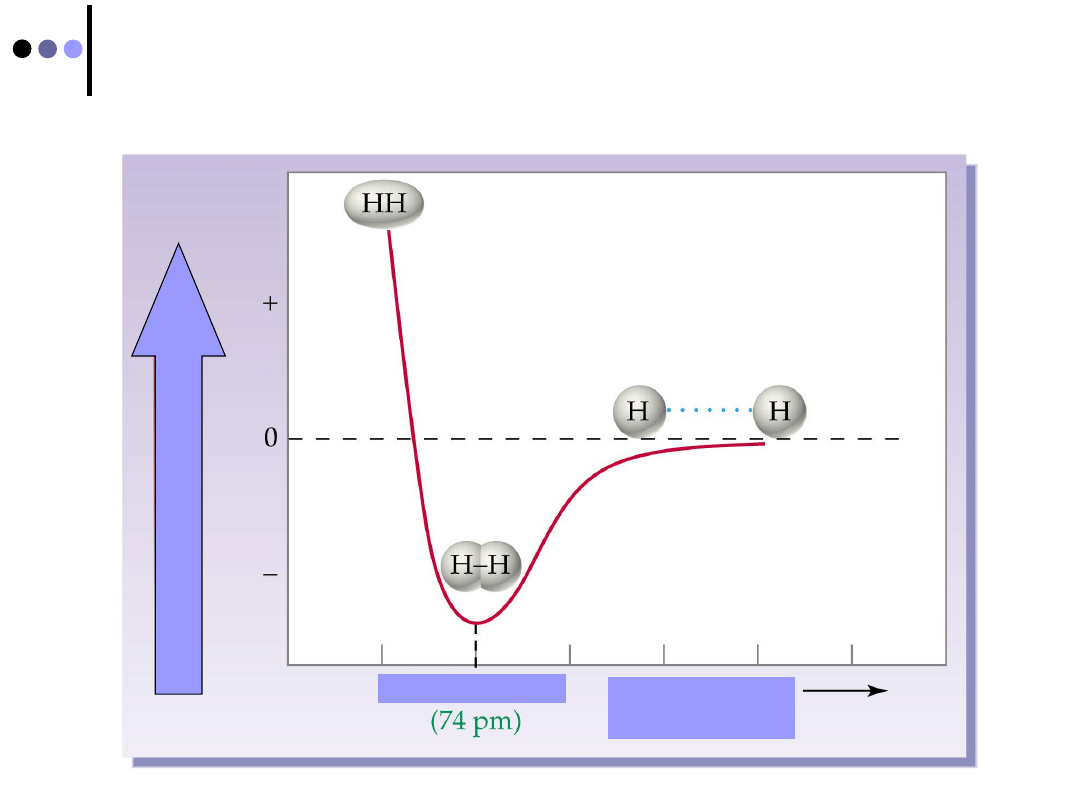
Energia wiązania a odległość pomiędzy
atomami
Długość wiązania
Odległość między
atomami
EN
ERGIA
POTEN
CJAL
NA
WIĄZANIE CHEMICZNE-koncepcja Lewisa
WIĄZANIE JONOWE:
ELEKTROSTATYCZNE PRZYCIĄGANIE
KATIONÓW i ANIONÓW
2012-01-08
7
A
B
ne
-
A
n+
B
n-
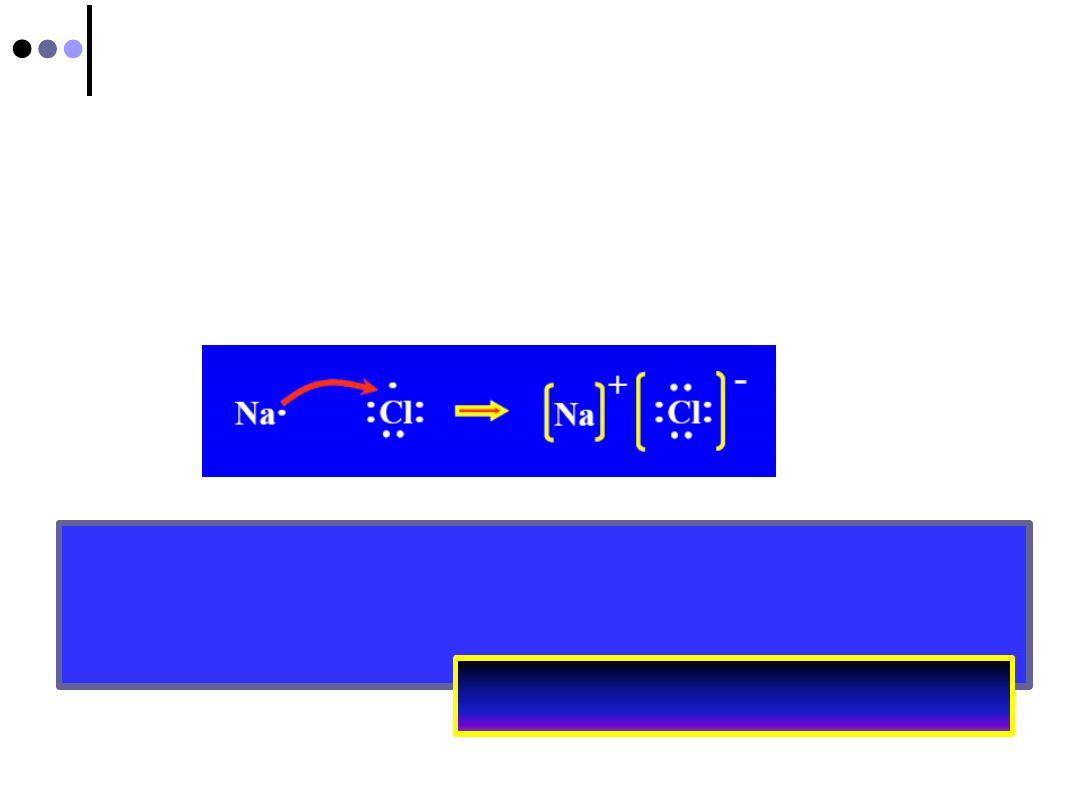
Wiązanie jonowe cd
Symbol Lewisa składa się z symbolu pierwiastka oraz
kropek (elektrony walencyjne)
Pojedyncza kropka -” samotny elektron”
Para kropek-dwa sparowane elektrony w orbitalu
2012-01-08
8
W wyniku przeniesienia elektronu powstałe jony
uzyskują szczególnie trwałą konfiguracji gazu
szlachetnego
REGUŁA OKTETU
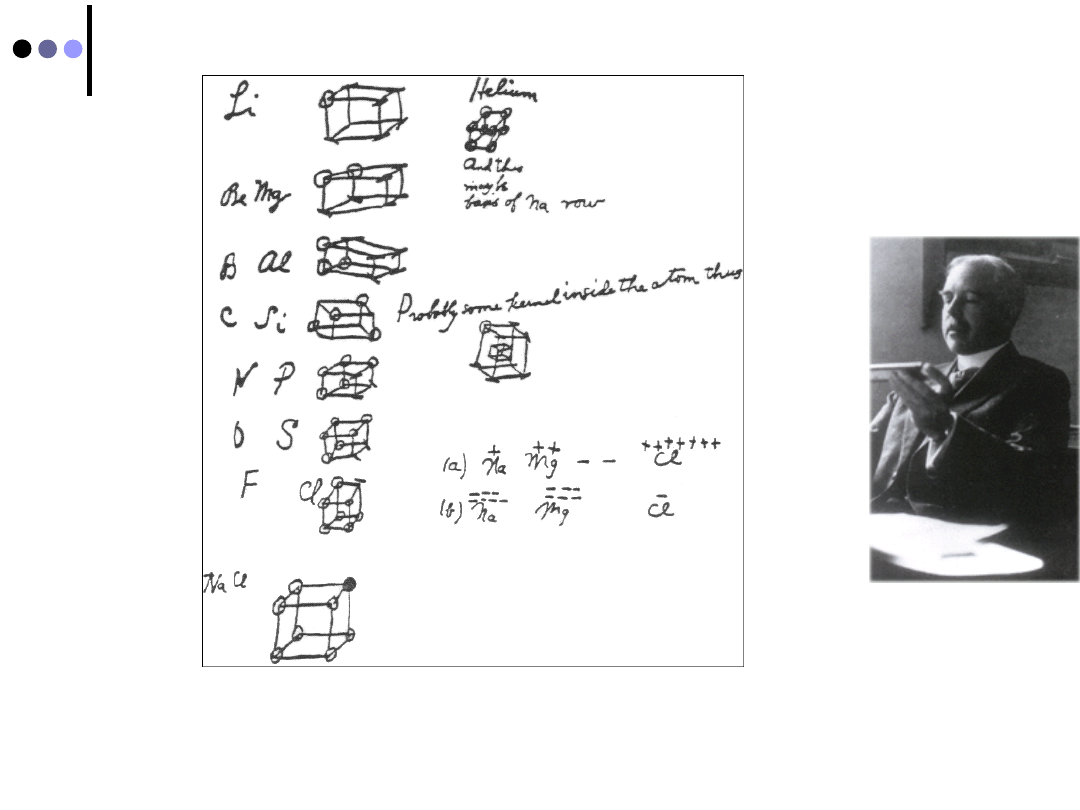
Teoria Lewisa wiązania kowalencyjnego
Każdy atom cząsteczki przyłącza elektrony, aż osiągnie
konfigurację oktetu, odpowiadającą najbliższemu w układzie
okresowym atomowi helowca (wyjątek wodór)

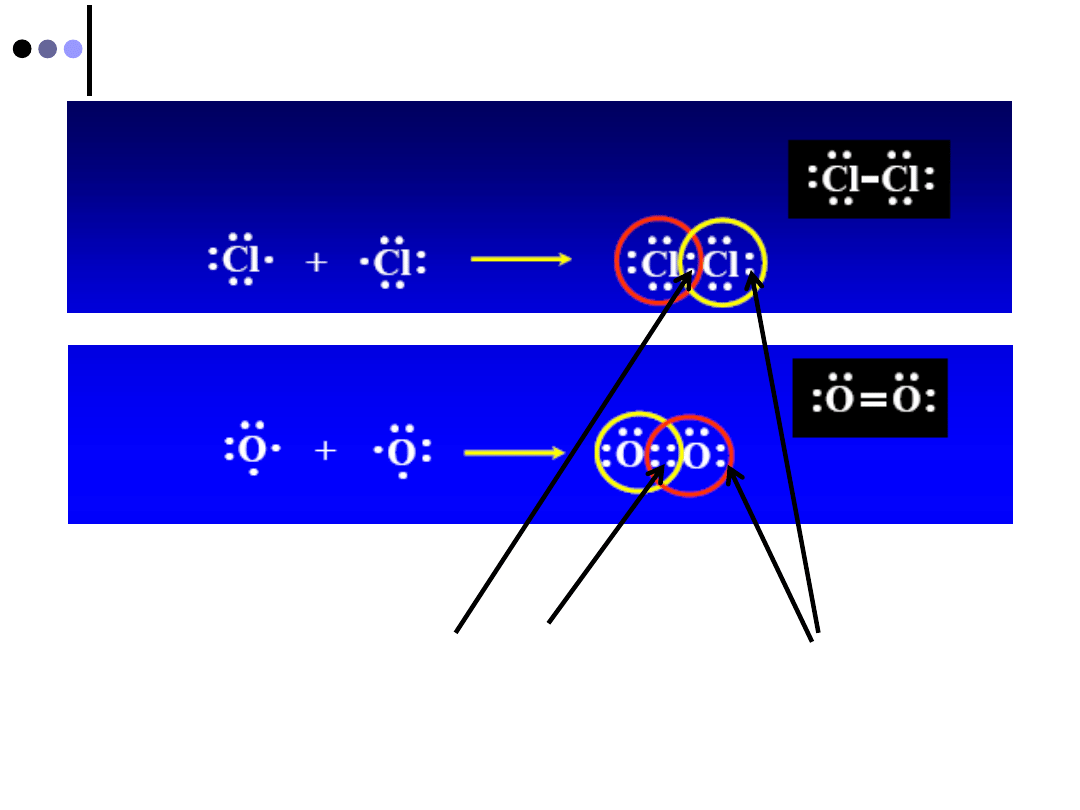
Teoria Lewisa wiązania kowalencyjnego
Sposób tworzenia struktury Lewisa:
Ustawiamy atomy tak, jak są ułożone w cząsteczce
Miedzy każde dwa atomy połączone wiązaniem
wprowadzamy parę elektronową (oznaczoną jako
:
)
Rozmieszczamy pozostałe elektrony tak, aby skompletować
oktety na wszystkich atomach albo przez wprowadzenie
wolnych par elektronowych, albo przez utworzenie wiązań
wieloktrotnych
Zastępujemy pary elektronowe wiązań poziomą kreska,
pozostawiając kropki (:) na oznaczanie wolnych par
elektronowych
Struktura Lewisa (z wyjątkiem prostych przypadków) nie
przedstawia rzeczywistej struktury geometrycznej
cząsteczki); stanowi ona topologiczną mapę układu wiązań.
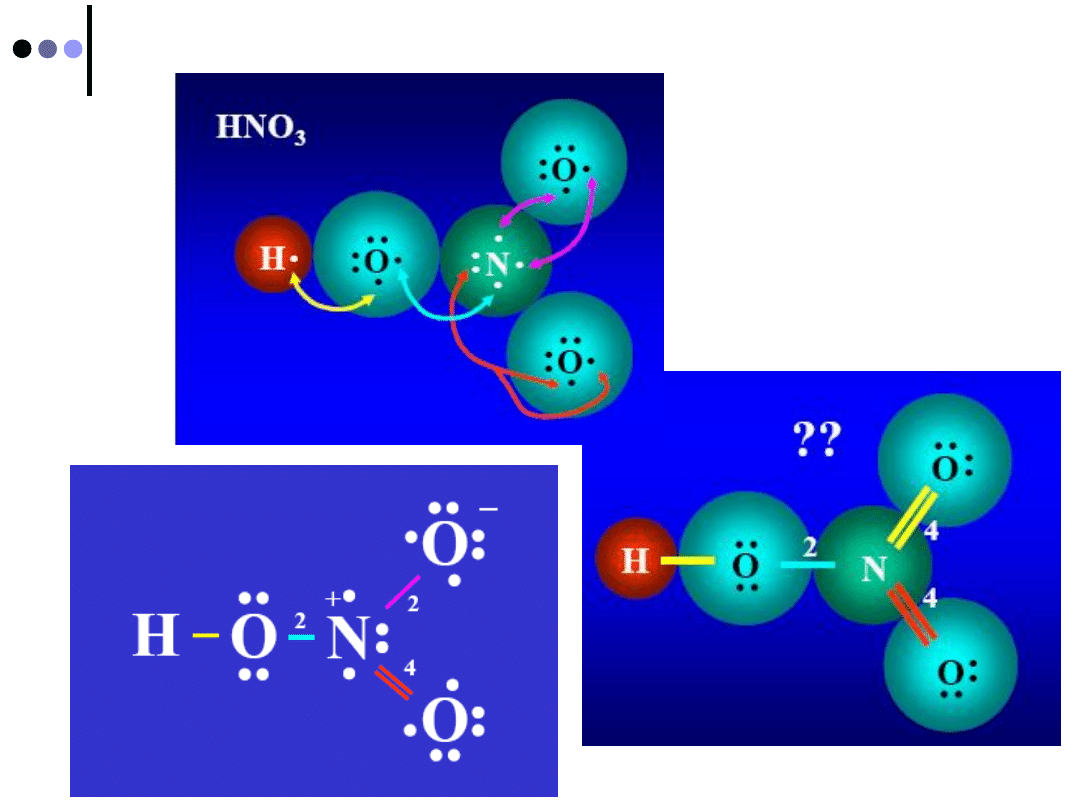
Struktury Lewisa: CH
3
F
Obliczamy ogólną liczbę elektronów
walencyjnych atomów wchodzących
w skład cząsteczki:
4
+
3
1
+
7 = 14 e
C
3 H
F
Pary elektronów umieszczamy
pomiędzy atomami tak, aby połączyć
wszystkie atomy wchodzące w skład
cząsteczki
Pozostałe elektrony umieszczamy
jako niewiążące pary elektronów
tak, aby każdy z atomów posiadał
„oktet elektronowy”
C
F
H
H
H
:
:
:
C
F
H
H
H
:
:
:
:
:
:
:
6/2 =3
Przykłady:
2012-01-08
12
Pary wiążące
Wolna para
elektronowa
Struktury jonowo-kowalencyjne
2012-01-08
13
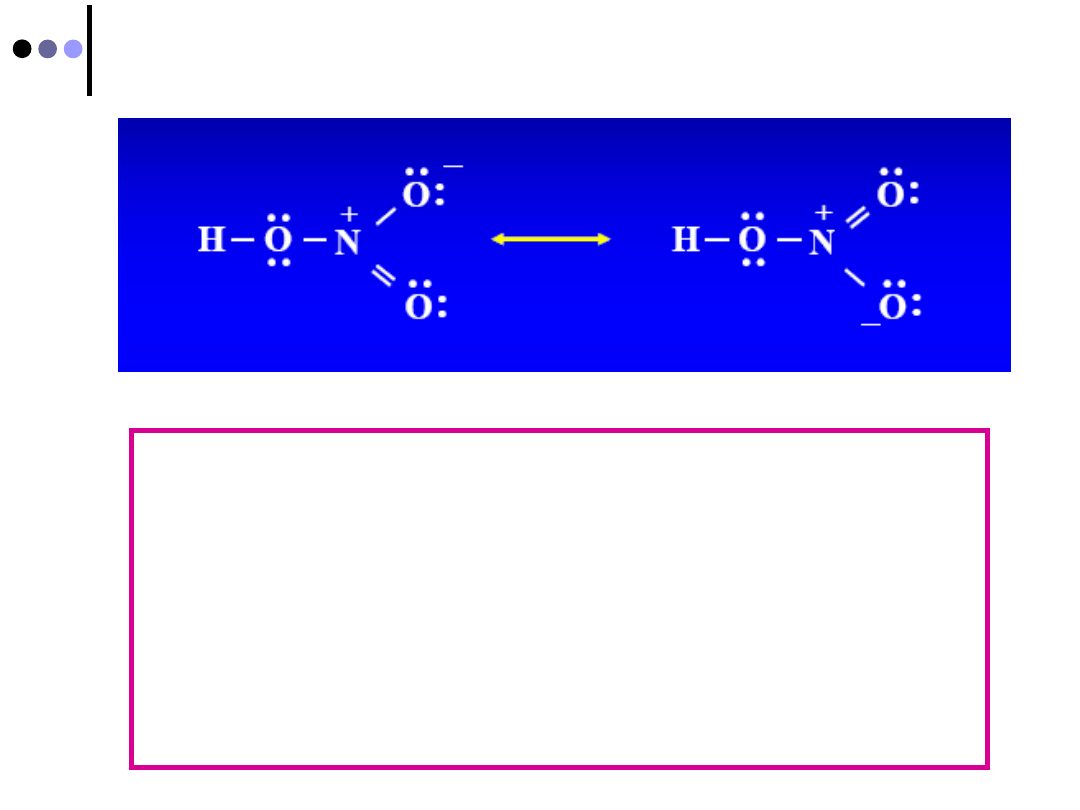
Struktury rezonansowe
Elektrony w strukturach rezonansowych
są ZDELOKALIZOWANE
Dodatkowa gęstość elektronowa,
związana z drugą parą elektronów w
wiązaniu podwójnym, obejmuje kilka
atomów
2012-01-08
14

2012-01-08
15
Współczesne teorie wiązań chemicznych
Metoda wiązań walencyjnych:
V
alency
B
ond
-VB
Metoda orbitali molekularnych:
M
olecular
O
rbitals
- MO
Założenia dla obu metod są podobne, różnica występuje w
sposobie dokonywania obliczeń:
Zachowanie elektronu (”z osobna”) w cząsteczce opisuje
spinorbital molekularny (przybliżenie jednoelektronowe)
Funkcja falowa całego układu jest iloczynem tych funkcji
Tak jak w przypadku atomów, dwa
SPINORBITALE składają się na jeden
ORBITAL MOLEKULARNY odpowiadający dwóm
elektronom, różniących się spinem, o bardzo
podobnym zachowaniu

2012-01-08
16
Metoda orbitali molekularnych - MO
W
tworzeniu orbitalu molekularnego
praktyczny udział
biorą tylko
orbitale atomowe należące do elektronów
walencyjnych
wchodzących w wiązanie atomów.
W
TEORII
ORBITALI
MOLEKULARNYCH
przyjmujemy, że „prawdziwy” orbital molekularny
Y
M
można przybliżyć:
LINIOWĄ KOMBINACJĄ ATOMOWYCH ORBITALI
ELEKTRONÓW WALENCYJNYCH
f
1
, f
2
, f
3
, ........
f
n
atomów tworzących cząsteczkę:
Y
m
= c
1
f
1
+ c
2
f
2
+ c
3
f
3
+ ...... + c
n
f
n
LCAO-L
inear
C
ombination of
A
tomic
O
rbitals

2012-01-08
17
Kiedy stosowanie metody LCAO ma sens?
Muszą być spełnione trzy warunki:
1.
E
A
E
B
, energie obu orbitali atomowych są
zbliżone (ale nie muszą być identyczne)
2.
Symetria obu orbitali atomowych względem
osi wiązania jest identyczna
3.
Zachodzi efektywne nakładanie się orbitali
(czyli obszarów o niezerowym
prawdopodobieństwie napotkania elektronu).

2012-01-08
18
Jak wyrazić w teorii LCAO przybliżoną postać
orbitalu molekularnego cząsteczki NO?
konfiguracje elektronowe atomów:
N:
1s
2
2s
2
p
3
O:
1s
2
2s
2
p
4
Y
NO
=
c
1
(2s)
N
+ c
2
(2p
x
)
N
+ c
3
(2p
y
)
N +
c
4
(2p
z
)
N
+
+ c
5
(2s)
O
+ + c
6
(2p
x
)
O
+ c
7
(2p
y
)
O
+ c
8
(2p
z
)
O
Orbitale atomowe
f
i
są funkcjami, których postać jest
znana, aby znaleźć postać orbitalu molekularnego
Y
MO
należy wyznaczyć wartości współczynników c
i
Liczba wynikowych kombinacji (orbitali molekularnych)
jest zawsze równa liczbie "wyjściowych" orbitali
atomowych
(takie są reguły tworzenia kombinacji)
Każdemu zestawowi współczynników odpowiada wartość
energii

2012-01-08
19
Zaczynamy od cząsteczki wodoru H
2
H
H
oś wiązania
dwa zbliżające się
atomy H
Struktura elektronowa atomów H:
1s
1
Przybliżone wyrażenie orbitalu molekularnego
Y
H2
dla
cząsteczki H
2
:
Y
H2
= c
1
(1s)
H-1
+ c
2
(1s)
H-2
Pamiętamy:
liczba współczynników c
i
= liczba zestawów współczynników c
i
Czyli otrzymujemy 2 rozwiązania:
Y
I
H2
= c
I
1
(1s)
H-1
+ c
I
2
(1s)
H-2
Y
II
H2
= c
II
1
(1s)
H-1
+ c
II
2
(1s)
H-2
2012-01-08
20
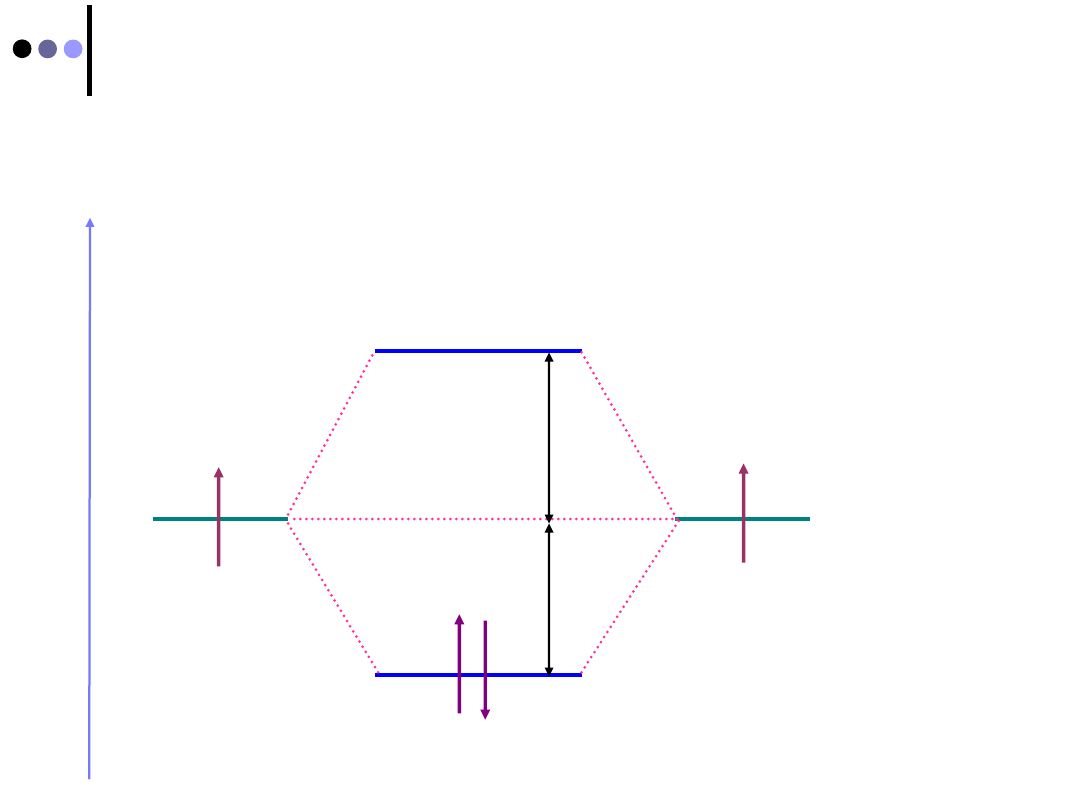
Cząsteczką wodoru H
2
(cd)
Każdemu z tych rozwiązań odpowiada inna wartość
energii dla elektronów w cząsteczce wodoru
Diagram orbitali dla H
2
:
E
1s
E
I
E
II
I
Ψ
II
Ψ
D
E
1
D
E
2
D
E
2
>
D
E
1
s
1
σ
*
s
1
σ
1s
Konfiguracja H
2
:
σ1s
2
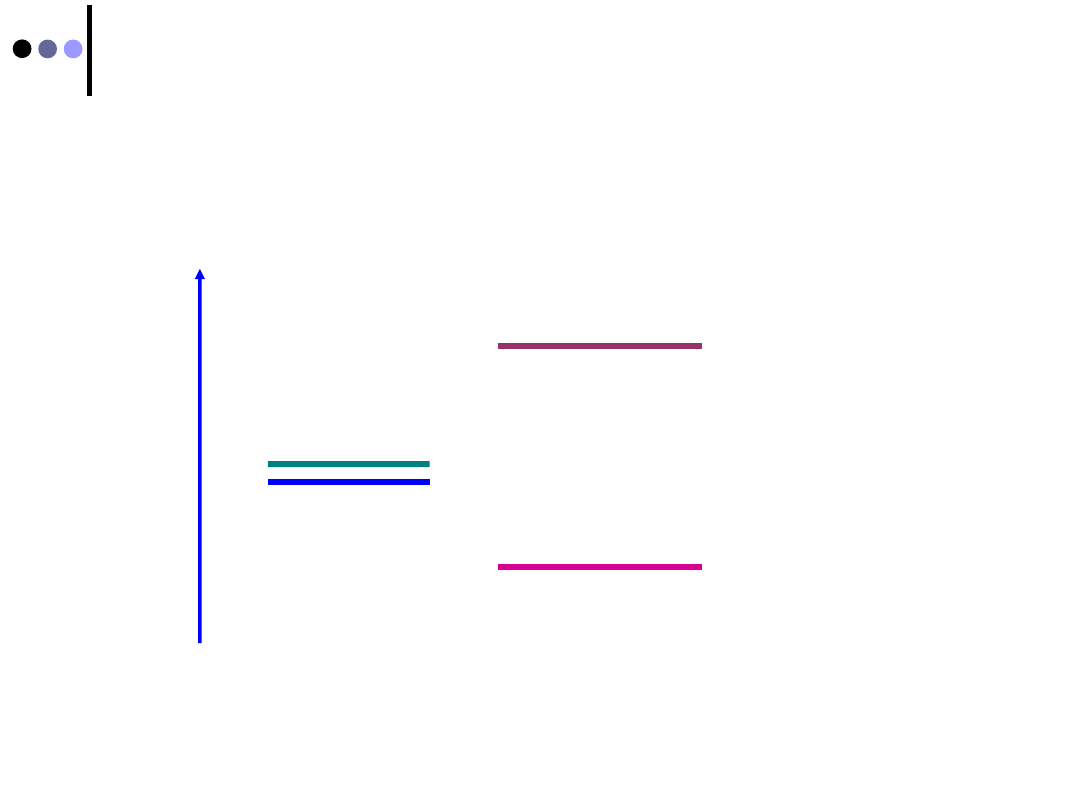
2012-01-08
21
Orbitale wiążące i antywiążące
Z dwóch orbitali atomowych powstają dwa orbitale
molekularne
Y
MO
i
Y
*
MO
o różnej energii
orbitale atomowe
orbitale molekularne
Y
*
MO
Y
MO
wiążący
antywiążący
EN
ERGIA

2012-01-08
22
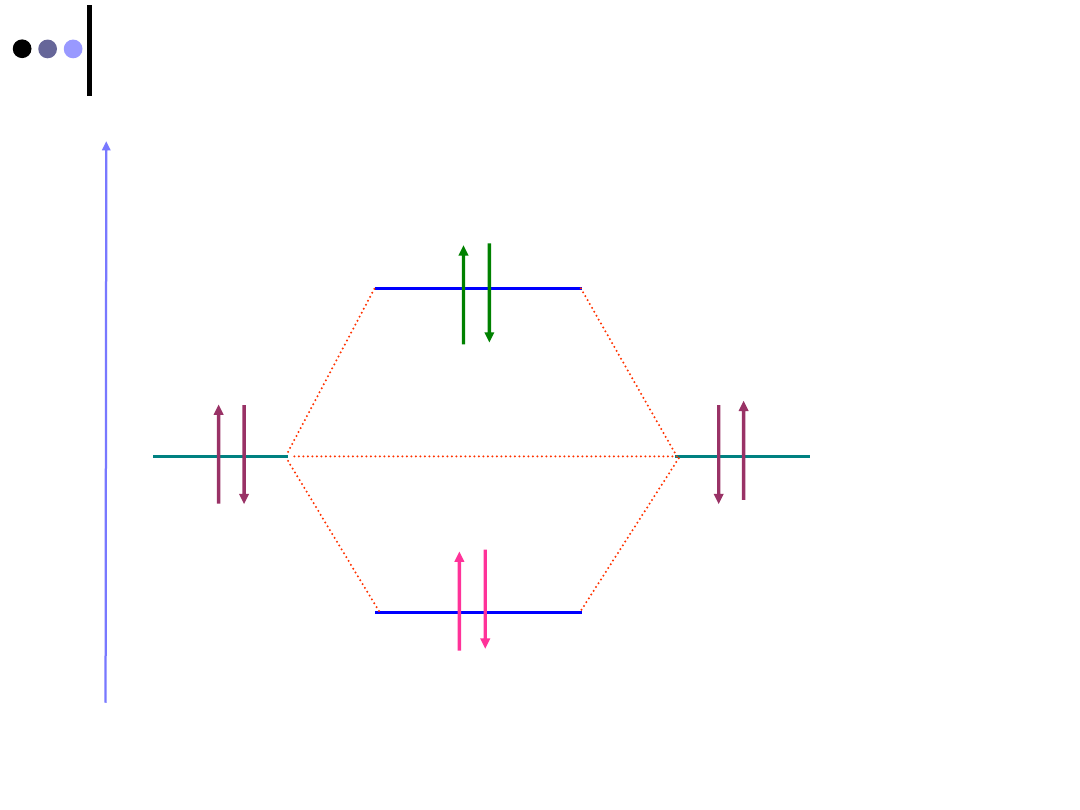
Orbitale molekularne typu
Dla orbitalu molekularnego typu
maksymalne
prawdopodobieństwo znalezienia elektronów
występuje w obszarze zawierającym oś wiązania
Orbitale atomowe
Orbitale molekularne
Oś
wiązania
1s
1s
1s
wiążący
1s
antywiążący
2012-01-08
23
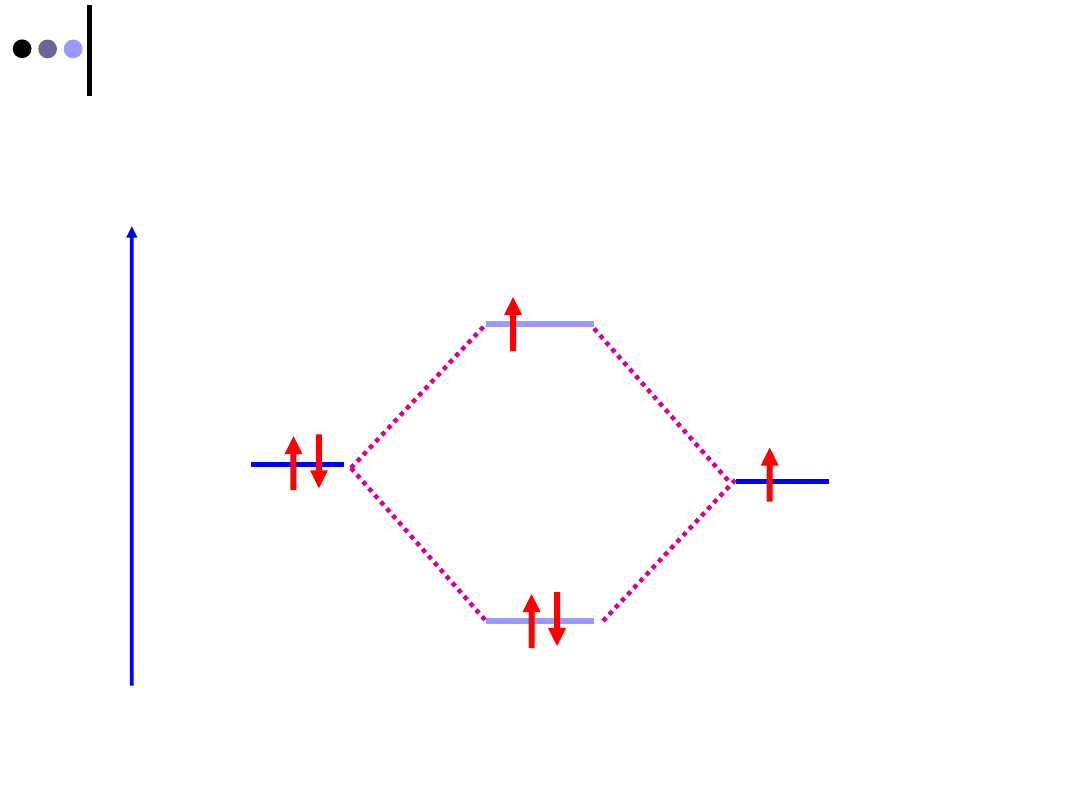
Czy istnieje cząsteczka He
2
?
1s
2
E
I
E
II
I
He2
Ψ
II
He2
Ψ
s
1
σ
*
s
1
σ
1s
2
E
Konfiguracja He
2
:
σ
1s
2
σ*
1s
2
- nie istnieje
Struktura elektronowa atomów He:
1s
2
Przybliżone wyrażenie orbitalu molekularnego
Y
H2
dla
cząsteczki H
2
:
Y
He2
= c
1
(1s)
He-1
+ c
2
(1s)
He-2
2012-01-08
24
a cząsteczka He
+
2
?
*
1s
σ
He: 1s
2
He
+:
1s
s
1
σ
Konfiguracja He
+
2
:
σ1s
2
σ*1s
1
- istnieje

2012-01-08
25
Cząsteczka tlenu O
2
Konfiguracja elektronowa
O: 1s
2
2s
2
p
4
przybliżona postać orbitalu molekularnego:
Y
O2
= c
1
(2s)
O-1
+ c
2
(2p
x
)
O-1
+ c
3
(2p
y
)
O-1 +
c
4
(2p
z
)
O-1
+
+
c
5
(2s)
O-2
+ c
6
(2p
x
)
O-2
+ c
7
(2p
y
)
O-2
+c
8
(2p
z
)
O-2
tak więc otrzymamy 8 zestawów współczynników c
i
,
8 orbitali molekularnych
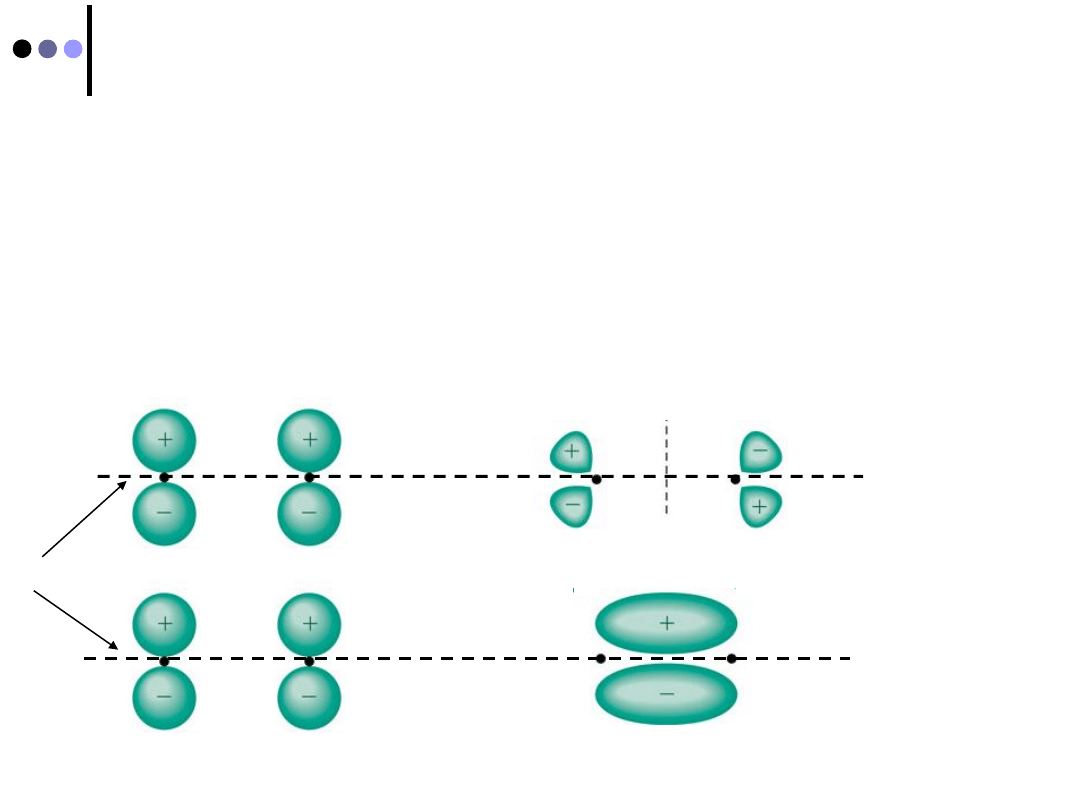
Oddziaływanie orbitali 2s i 2p
x
zachodzi w obszarze osi
wiązania w przeciwieństwie do oddziaływania
orbitali
2p
y
, 2p
z
,
2012-01-08
26
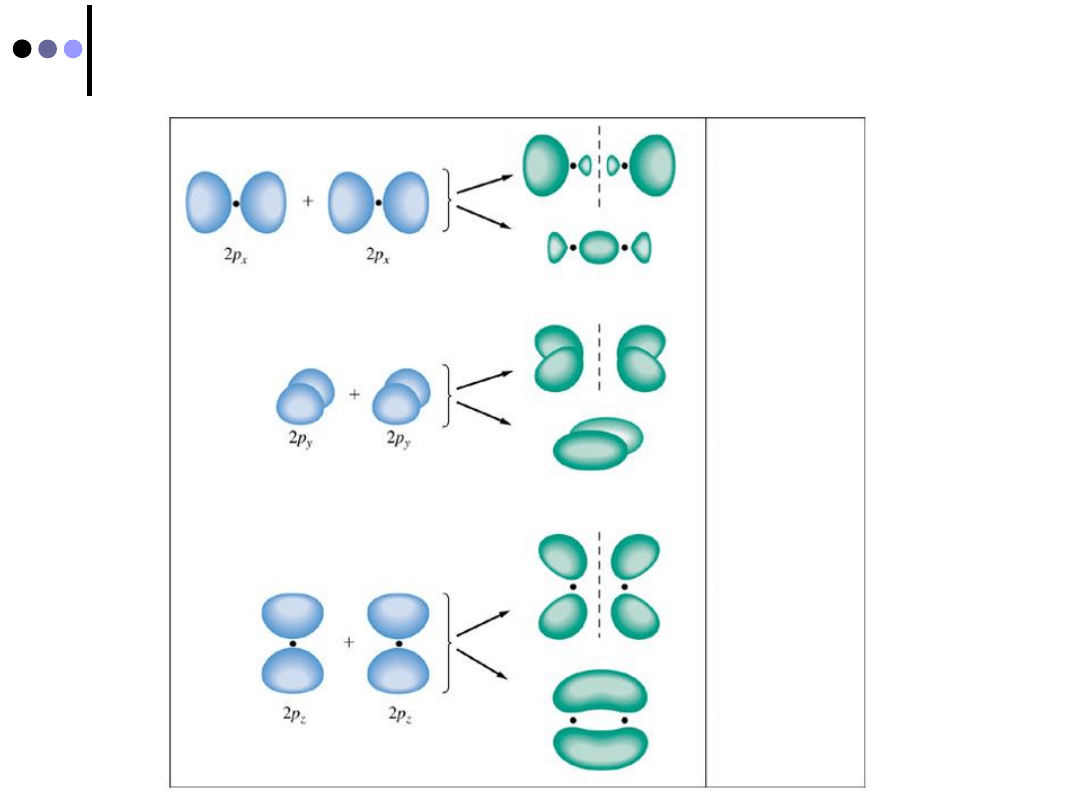
Orbitale typu
Jeżeli oddziaływanie orbitali atomowych zachodzi w
obszarze poza osią wiązania to powstają orbitale
molekularne typu
Dla orbitalu molekularnego
maksymalne
prawdopodobieństwo napotkania elektronów znajduje się
poza obszarem zawierającym oś wiązania
2p
z
2p
z
Orbitale atomowe
Orbitale molekularne
2p
wiążący
2p
antywiążący
Oś
wiązania
2012-01-08
27
Wracamy do cząsteczki O
2
2s
2s
x
y
z
x
y
z
σ
*
2s
σ
2px
π
2pz
π
*
2pz
σ
*
2px
π
2py
π
*
2py
σ
2s
O: 1s
2
2s
2
p
4
O: 1s
2
2s
2
p
4
O
2
σ
2s
2
σ
*
2s
2
σ
2p
2
π
2p
2
π
2p
2
π
*
2p
1
π
*
2p
1
2012-01-08
28
Klasyfikacja ortbitali molekularnych cd
*
2p
2p
*
2p
2p
*
2p
2p

2012-01-08
29
Rząd wiązania R.W.
R.W.=½(liczba elektronów na orbitalach molekularnych wiążących –
liczba elektronów na orbitalach molekularnych antywiążących)
Przykłady
dla H
2
R.W.= ½(2-0)=1
wiązanie pojedyncze
dla He
2
R.W.= ½(2-2)=0
brak wiązania
dla He
+
2
R.W.= ½(2-1)= ½
wiązanie 1-elektronowe
dla O
2
R.W.= ½(8-4)=2
wiązanie podwójne
dla N
2
R.W.= ½(8-2)=3
wiązanie potrójne
Rząd wiązania R.W. może przyjmować wartości niecałkowite, zawarte
pomiędzy 1 i 2 oraz 2 i 3.
Im wyższy rząd wiązania pomiędzy dwoma atomami, tym długość
wiązania krótsza a wiązanie jest silniejsze.
Długość wiązania = odległość pomiędzy jadrami atomowymi
Jeżeli R.W. > 0 to znaczy, że energia elektronów w
cząsteczce jest niższa niż energia elektronów w
atomach, z których cząsteczka powstała.
2012-01-08
30
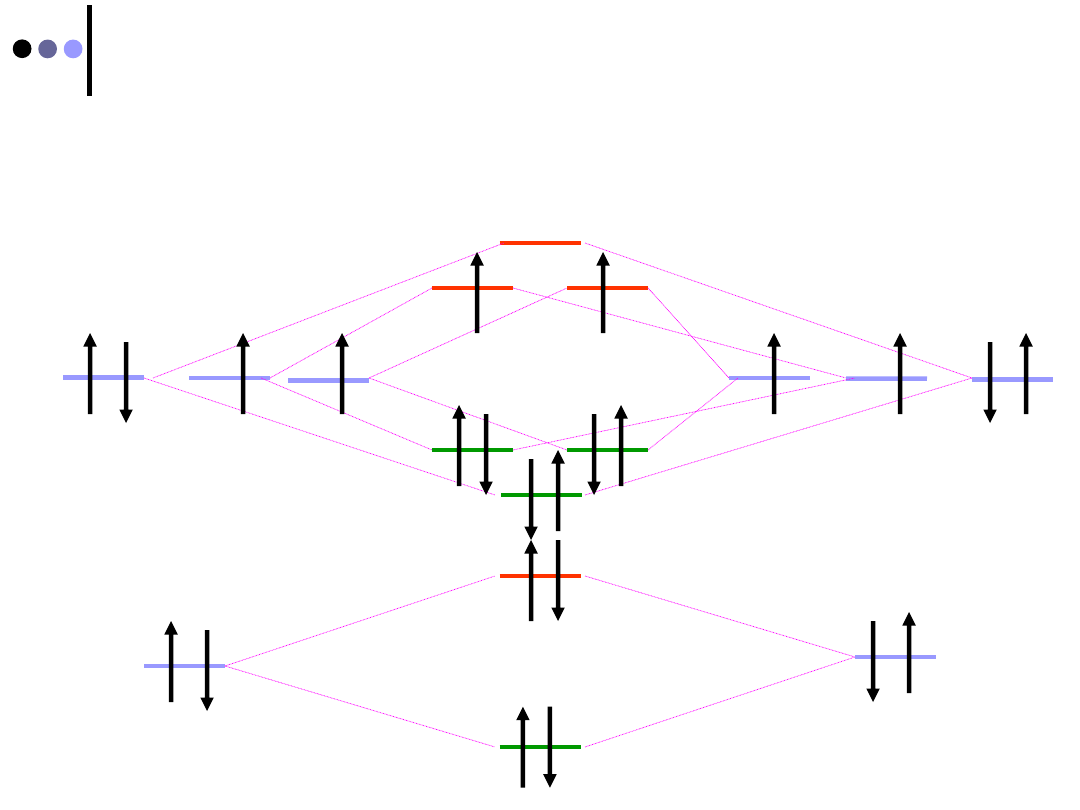
Wracamy do cząsteczki O
2
2s
2s
x
y
z
x
y
z
σ
*
2s
σ
2px
π
2pz
π
*
2pz
σ
*
2px
π
2py
π
*
2py
σ
2s
O: 1s
2
2s
2
p
4
O: 1s
2
2s
2
p
4
O
2
σ
2s
2
σ
*
2s
2
σ
2p
2
π
2p
2
π
2p
2
π
*
2p
1
π
*
2p
1
2012-01-08
31
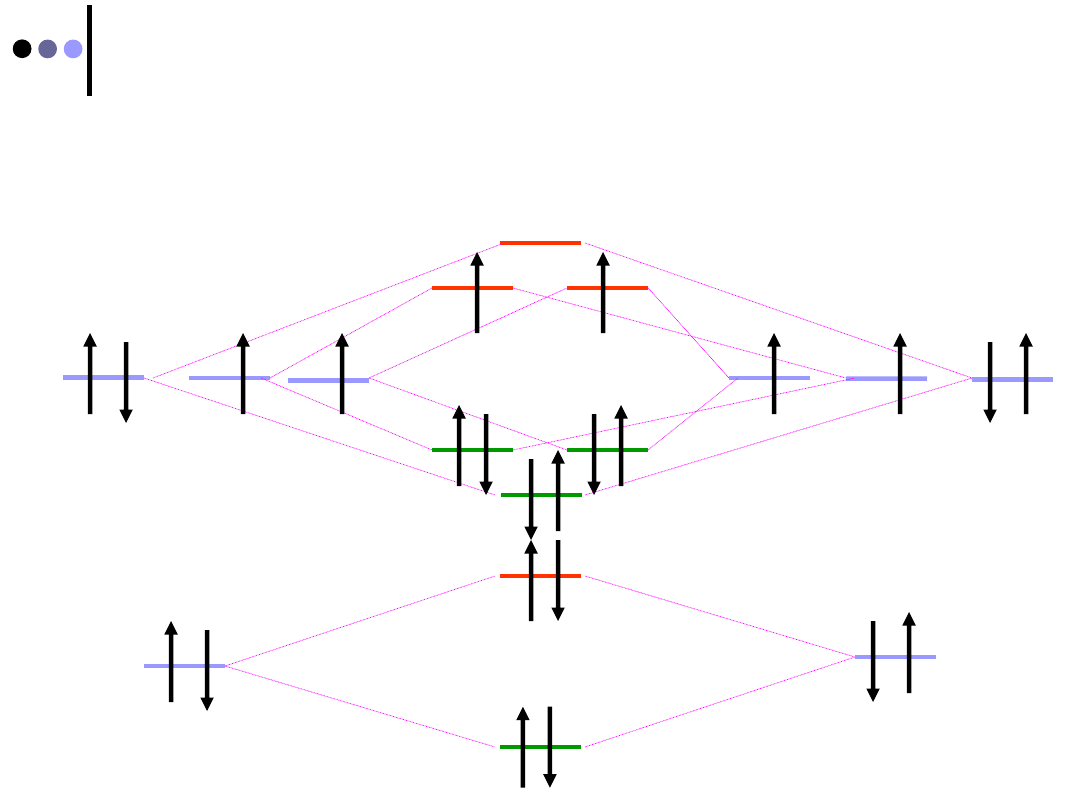
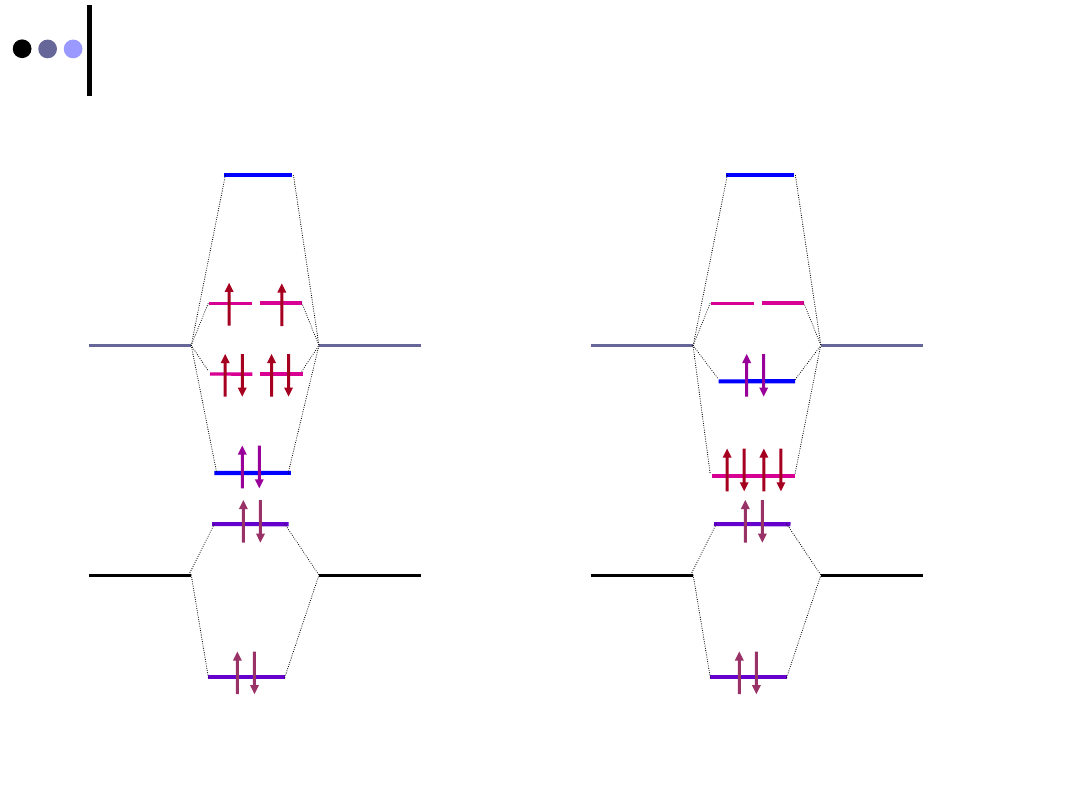
Dwuatomowe homojądrowe cząsteczki II-go okresu
2s
2s
2s
*
2s
2p
2p
2p
*
2
p
2p
*
2p
2s
2s
2s
*
2s
2p
2p
2p
*
2
p
2p
*
2p
Cząsteczki O
2
i F
2
Cząsteczki od B
2
do N
2
2012-01-08
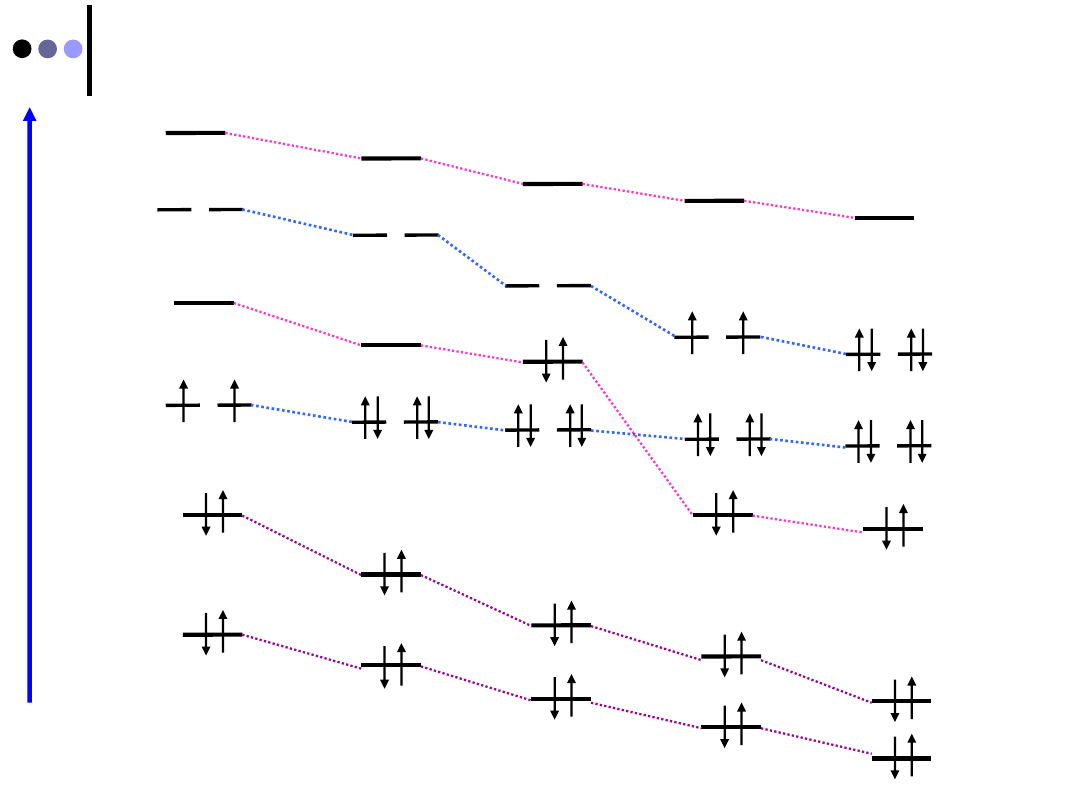
32
B
2
C
2
N
2
O
2
F
2
(2s)
*
(2s)
(2p)
(2p)
*
(2p)
*
(2p)
(2s)
*
(2s)
(2p)
(2p)
*
(2p)
*
(2p)

Para i diamagnetyki
2012-01-08
33

Dwuatomowe cząsteczki heterojądrowe
2012-01-08
34
Postać
diagramu
orbitali
dwuatomowych
cząsteczek heterojądrowych zależy od faktu
posiadania przez atomy tworzące te cząsteczki
orbitali tego samego typu.
CZĄSTECZKA CO:
C: He2s
2
2p
2
O: He2s
2
2p
4
CZĄSTECZKA HF:
H: 1s
2
F: He2s
2
2p
5
Diagram orbitalowy
podobny do opisanego
dla cząsteczek
homojądrowych
Diagram orbitalowy
różny od opisanego dla
cząsteczek
homojądrowych
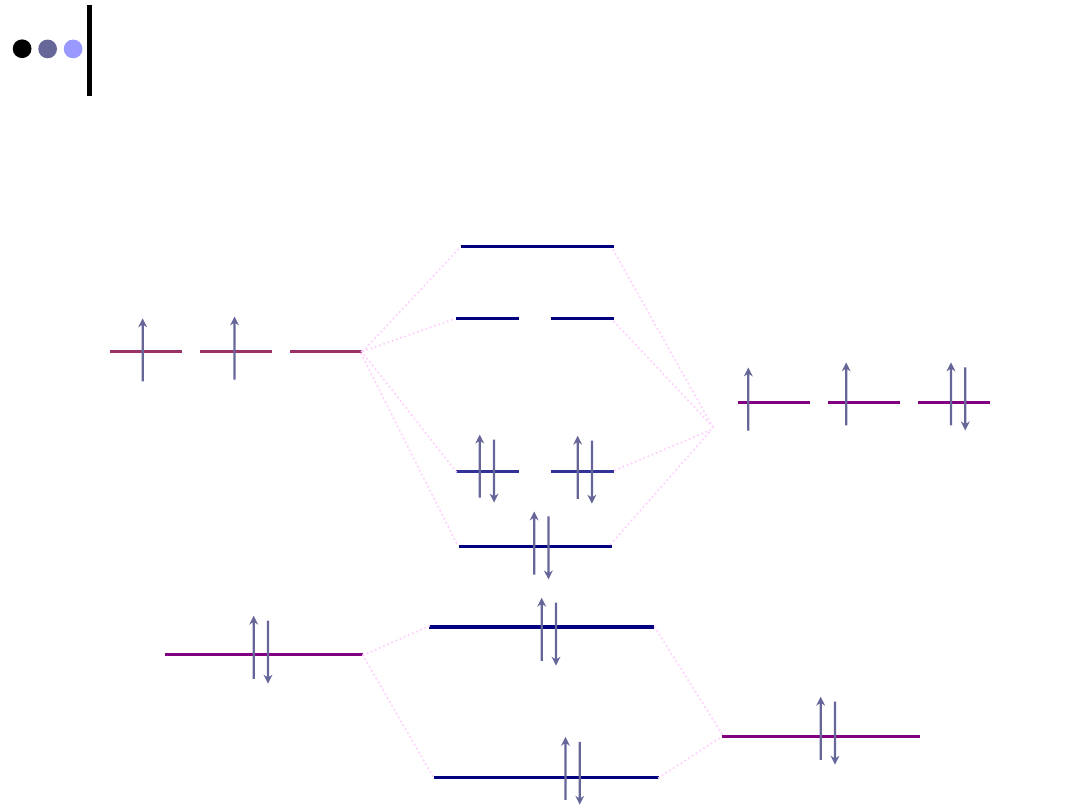
2012-01-08
35
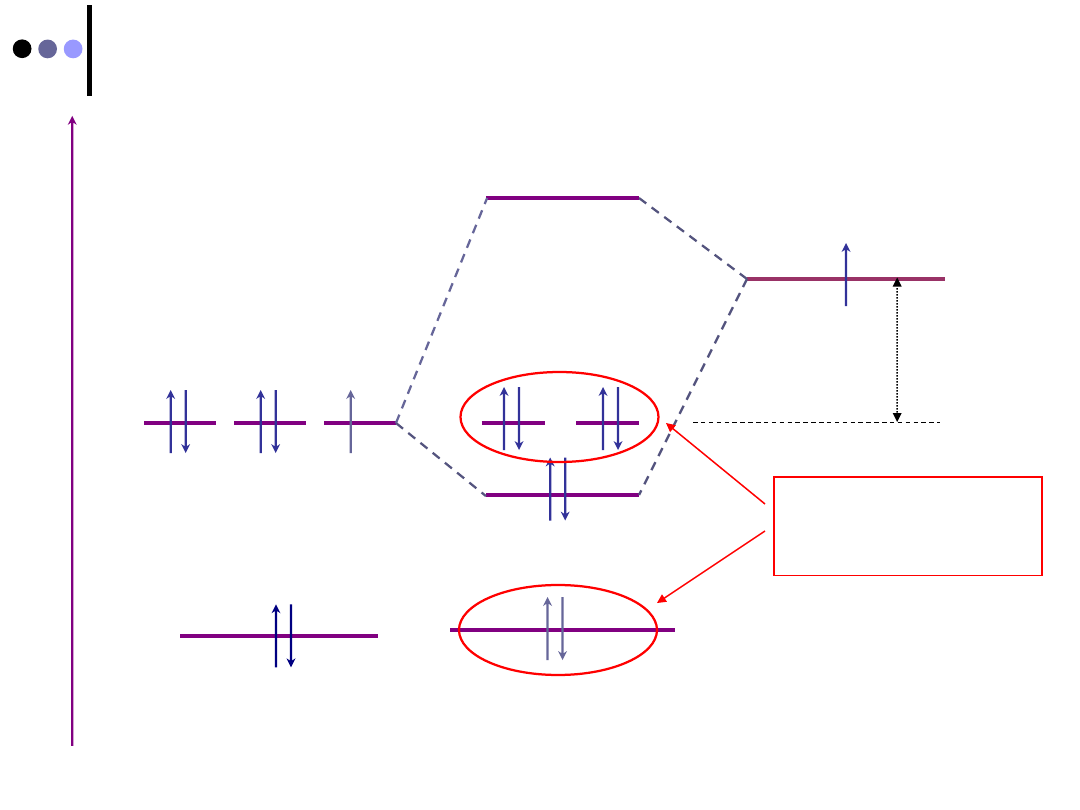
Dwuatomowe cząsteczki heterojądrowe (CO)
... kolejność energii orbitali we wszystkich atomach
wieloelektronowych jest taka sama, ale taki sam orbital (n,l)
w różnych atomach ma różne energie ...
C
O
C
O
2s
2p
2s
2p
*
s
2
s
2
2py
π
2pz
π
2px
σ
*
2px
σ
*
2py
π
*
2pz
π
C:
[He]
2s
2
p
2
O:
[He]
2s
2
p
4
2012-01-08
36
Cząsteczka HF
2s
2p
1s
*
2px
1s
σ
F
H
2px
1s
σ
F
s
2
F
2py
F
pz
2
HF
orbitale
niewiążące
F: [He]2s
2
2p
5
H: 1s
3.8 eV
E

2012-01-08
37
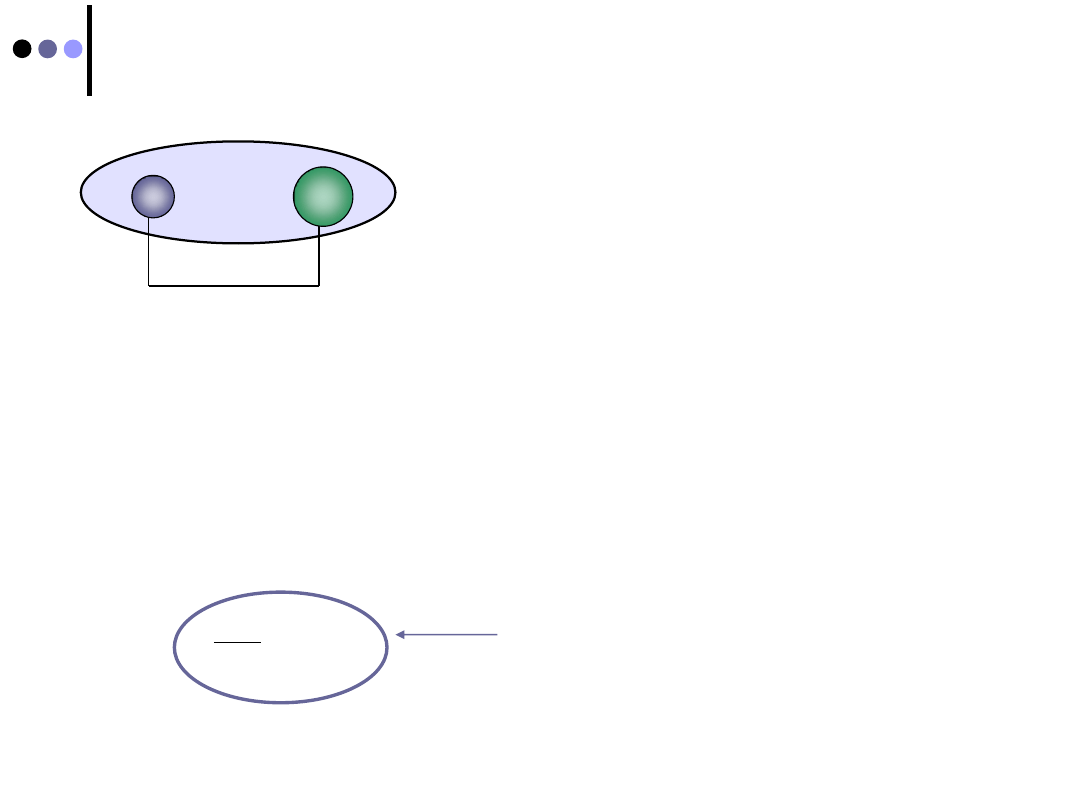
Przesunięcie ładunku wiązania
udział orbitalu atomowego 2p
x
fluoru w orbitalu molekularnym jest
większy niż udział orbitalu 1s wodoru
prawdopodobieństwo znalezienia elektronów w pobliżu jądra F jest
większe niż w pobliżu jądra H
ładunek (ujemny) wiązania jest przesunięty w stronę fluoru
ORBITAL MOLEKULARNY NIE JEST SYMETRYCZNY !
A
+δ
B
-δ
δ
- wielkość przemieszczonego ładunku (0,
e
);
δ = 0
ładunek jest symetryczny - wiązanie ma
charakter
kowalencyjny
;
δ = e
przeniesienie ładunku
(elektronu)
od A do B,
wiązanie jonowe
2012-01-08
38
Moment dipolowy
WIĄZANIE JONOWE
jeśli δ = e, to μ jest maksymalne dla stałej wartości l,
WIĄZANIE KOWALENCYJNE
δ = 0
μ = 0
Dla częściowego przesunięcia ładunku
... takie wiązanie nazywa się
wiązaniem atomowym
(kowalencyjnym)
spolaryzowanym ...
μ = δ·l
moment dipolowy jest tym
większy, im większy jest
przemieszczony ładunek oraz
im większa jest odległość
przesunięcia
100
l
e
μ
procentowy udział charakteru
jonowego w wiązaniu
+
-
l
δ
+
δ
-
2012-01-08
39
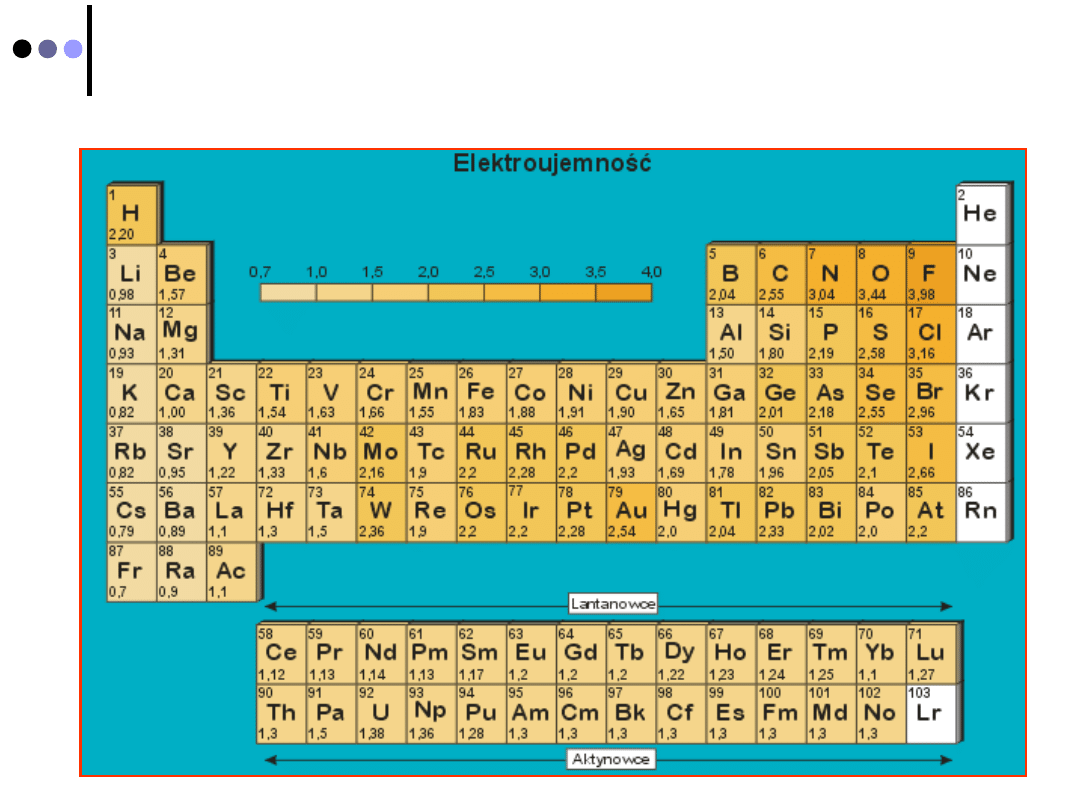
Elektroujemność
Elektroujemność
jest to miara tendencji do
przyciągania elektronów w wiązaniu (
Mullikan
1935)
E ~
I
+
P
e
I -
pierwsza
energia jonizacji
P
e
- powinowactwo elektronowe
Względna
skala elektroujemności
pozwala określić, który z
atomów tworzących wiązanie będzie silniej przyciągać
wspólne elektrony
Wszystkie skale opierają się na własnościach pierwiastków,
a przede wszystkim własnościach tworzonych przez nie
wiązań:
Najbardziej znane skale:
- Mullikana
- Paulinga
- Alfreda - Rochowa
- Görlicha ...
2012-01-08
40
Skala elektroujemności Paulinga
2012-01-08
41
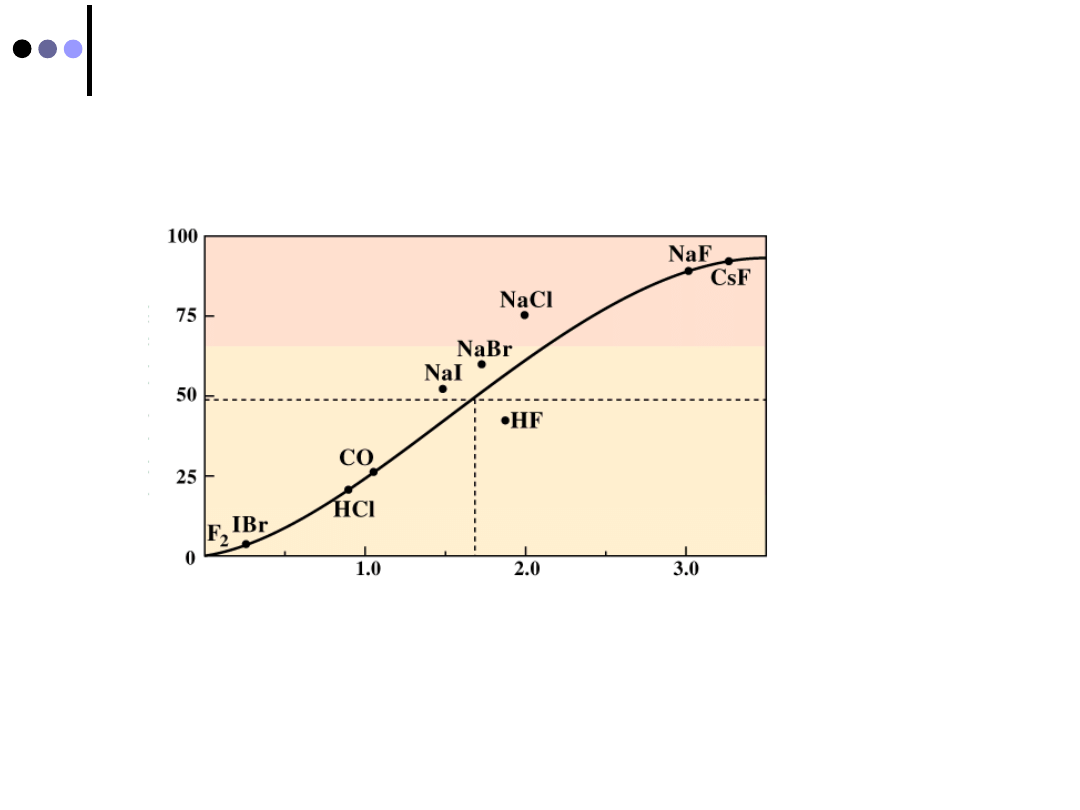
Charakter wiązania
Różnica elektroujemności pierwiastków
tworzących wiązanie określa jego charakter
Udział
wiązania
jonowego
w %
Wiązanie
kowalencyjne
Wiązanie
jonowe
Różnica
elektroujemności
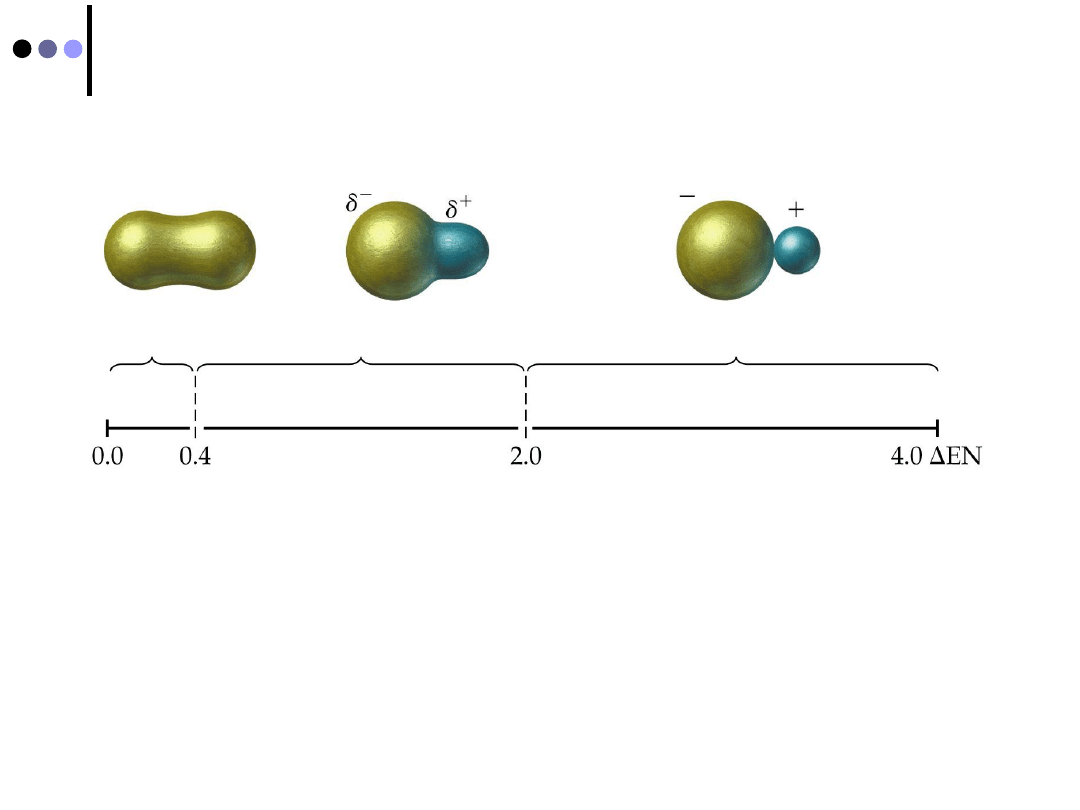
2012-01-08
42
Charakter wiązania
F
2
3,0 - 3,0 = 0
wiązanie kowalencyjne
CsF 4,0 - 0,7 = 3,3
wiązanie jonowe
HCl 3,2 -2,2 = 1,0
wiązanie atomowe spolaryzowane
H
2
O 3,5 -2,2 = 1,3
wiązanie atomowe spolaryzowane
Wyszukiwarka
Podobne podstrony:
IB wyk11
IB wyk13 11
IB wyk3 11
IB wyk6 7 11(1)
IB wyk11
IB 007 12 Oznaczanie gęstości objętościowej próbek mma 12697 6 v2013 11
ib 11 05
11 IB Wojny grecko perskie
Zarz[1] finan przeds 11 analiza wskaz
11 Siłowniki
więcej podobnych podstron