
UNIWERSYTET PRZYRODNICZY
Wydział Medycyny Weterynaryjnej
KATEDRA BIOCHEMII I FIZJOLOGII ZWIERZĄT
Zakład Biochemii
20-033 Lublin, ul. Akademicka 12
tel. 081 445 69 73
09-10-17 www.biochfiz.up.lublin.pl Wersja 1.17.10.09
- 1 z 11 -
Roztwory, bufory – teoria roztworów buforowych
rozpuszczalno
ść
, wpływ rozcie
ń
czania na pH buforu, wyznaczanie pojemno-
ś
ci buforowej, buforuj
ą
ce działanie roztworów soli
cz
ęść
teoretyczna
ROZTWORY ............................................................. 1
Roztwory ......................................................................... 1
SPOSOBY WYRA
ś
ANIA ST
Ęś
E
Ń
............................................. 2
St
ęż
enie molowe .................................................................. 2
St
ęż
enie procentowe .............................................................. 2
Przeliczanie st
ęż
e
ń
.............................................................. 3
Rozcie
ń
czanie roztworów .......................................................... 3
ROZPUSZCZALNO
ŚĆ
...................................................... 4
Rozpuszczalno
ść
.................................................................. 4
ROZTWORY BUFOROWE .................................................... 4
Bufory ........................................................................... 4
Mechanizm działania buforu ....................................................... 5
Rozcie
ń
czanie buforów ............................................................ 6
Pojemno
ść
buforowa ............................................................... 6
PRZYKŁADY OBLICZE
Ń
................................................... 8
Rozcie
ń
czanie roztworów .......................................................... 8
Sporz
ą
dzanie roztworów o okre
ś
lonym st
ęż
eniu ..................................... 8
Obliczanie pH roztworu buforowego ................................................ 9
Pojemno
ść
buforowa .............................................................. 10
ROZTWORY
Roztwory
Roztwór jest to jednorodna mieszanina substancji stanowi
ą
cych jedn
ą
faz
ę
. Roztwory mog
ą
wyst
ę
powa
ć
w ró
ż
nych fazach skupienia:
−
gazowym (mieszaniny gazów),
−
ciekłym (gaz, ciało stałe lub ciecz rozpuszczone w cieczy),
−
stałym (gaz okludowany w metalu, stopy metali).
Roztwory dzielimy na:
−
roztwory rzeczywiste (wła
ś
ciwe), gdzie
ś
rednica cz
ą
stek substancji
rozproszonej w rozpuszczalniku jest w przybli
ż
eniu równa
ś
rednicy
cz
ą
stek rozpuszczalnika, około 10
-9
m (10 Å
1
),
−
roztwory koloidalne, gdzie
ś
rednica cz
ą
stek substancji rozproszo-
nej w rozpuszczalniku jest na tyle wi
ę
ksza od
ś
rednicy cz
ą
stek
rozpuszczalnik,
ż
e powoduje to zjawisko rozproszenia
ś
wiatła
(efekt Tyndalla),
1
1
Å
(angstrem) = 10
-10
m

UNIWERSYTET PRZYRODNICZY
Wydział Medycyny Weterynaryjnej
KATEDRA BIOCHEMII I FIZJOLOGII ZWIERZĄT
Zakład Biochemii
20-033 Lublin, ul. Akademicka 12
tel. 081 445 69 73
09-10-17 www.biochfiz.up.lublin.pl Wersja 1.17.10.09
- 2 z 11 -
−
zawiesiny, gdzie
ś
rednica cz
ą
steczek substancji rozproszonej w
rozpuszczalniku przekracza 10
-7
m (1000 Å)
Wielko
ś
ci
ą
charakteryzuj
ą
c
ą
roztwór jest st
ęż
enie. Skład roztworu
mo
ż
e si
ę
zmienia
ć
w sposób ci
ą
gły w granicach okre
ś
lonych wzajemn
ą
roz-
puszczalno
ś
ci
ą
składników. Dany układ, w przypadku ograniczonej wzajem-
nej rozpuszczalno
ś
ci składników tworz
ą
cych roztwór, mo
ż
e stanowi
ć
w
okre
ś
lonych warunkach (ci
ś
nienia i temperatury):
−
roztwór nasycony, o st
ęż
eniu odpowiadaj
ą
cym rozpuszczalno
ś
ci dane-
go składnika, czyli roztwór zawieraj
ą
cy maksymaln
ą
ilo
ść
substan-
cji rozpuszczonej,
−
roztwór nienasycony, o st
ęż
eniu mniejszym ni
ż
rozpuszczalno
ść
da-
nego składnika,
−
roztwór przesycony, o st
ęż
eniu wi
ę
kszym ni
ż
rozpuszczalno
ść
danego
składnika.
SPOSOBY WYRA
ś
ANIA ST
Ęś
E
Ń
St
ęż
enie molowe
St
ęż
enia substancji w roztworze okre
ś
la si
ę
podaj
ą
c jej liczno
ść
rozpuszczon
ą
w okre
ś
lonej obj
ę
to
ś
ci (masie) roztworu lub rozpuszczalni-
ka. Zgodnie z Mi
ę
dzynarodowym Układem Jednostek SI, który okre
ś
la,
ż
e
liczno
ść
materii powinna by
ć
okre
ś
lona w molach, st
ęż
enia roztworów na-
le
ż
y wyra
ż
a
ć
molowo
ś
ci
ą
lub molalno
ś
ci
ą
. Układ SI nie obejmuje poj
ę
cia
gramorównowa
ż
nika i roztworu normalnego (jednostki u
ż
ywane tradycyj-
nie).
Roztworem molowym – jednostk
ą
st
ęż
enia dopuszczon
ą
w układzie SI -
nazywa si
ę
roztwór zawieraj
ą
cy jeden mol substancji w 1 dm
3
roztworu
(lub praktycznie ujmuj
ą
c 1 mol substancji w 1 L roztworu. Nale
ż
y jednak
wiedzie
ć
,
ż
e 1 kg wody = 1 L w temperaturze 3,88
o
C, a obj
ę
to
ść
tego li-
tra lub kilograma w tych warunkach wynosi 1,000028 dm
3
).
Podstawow
ą
jednostk
ą
st
ęż
enia w układzie SI jest mol/dm
3
Roztworem molalnym (z którym spotykamy si
ę
sporadycznie) nazywa si
ę
roztwór zawieraj
ą
cy 1 mol danej substancji rozpuszczony w 1 kg rozpusz-
czalnika.
St
ęż
enie procentowe
W laboratorium biochemicznym stosuje si
ę
tak
ż
e, i nale
ż
y przypusz-
cza
ć
,
ż
e b
ę
dzie to jeszcze praktykowane przez szereg lat, procentowe i
wagowe wyra
ż
anie st
ęż
e
ń
roztworów (mieszanin).
Procent (z łac. „pro centum” – od setki, - na sto) okre
ś
la liczb
ę
gramów substancji zawartych w 100 g roztworu. Je
ż
eli wi
ę
c przy podanym
st
ęż
eniu procentowym nie zaznaczone s
ą
inne symbole, procent oznacza
zawsze procent wagowy. Np. wodny roztwór 5 % jakiej
ś
substancji ozna-
cza,
ż
e w 100 g roztworu znajduje si
ę
5 g tej substancji i 95 g wody.

UNIWERSYTET PRZYRODNICZY
Wydział Medycyny Weterynaryjnej
KATEDRA BIOCHEMII I FIZJOLOGII ZWIERZĄT
Zakład Biochemii
20-033 Lublin, ul. Akademicka 12
tel. 081 445 69 73
09-10-17 www.biochfiz.up.lublin.pl Wersja 1.17.10.09
- 3 z 11 -
Przeliczanie st
ęż
e
ń
St
ęż
enie wyra
ż
one w % mo
ż
na przelicza
ć
na st
ęż
enie molowe (c
mol
)
substancji w tym roztworze wg nast
ę
puj
ą
cego wzoru:
⋅
⋅
=
3
100
1000
%
dm
mol
d
M
c
mol
mol
gdzie:
c
mol
–
st
ęż
enie składnika w mol/dm
3
% –
st
ęż
enie procentowe składnika,
M
mol
–
jego masa molowa,
d –
g
ę
sto
ść
roztworu w kg/dm
3
(dla roztworów bardzo rozcie
ń
czonych
mo
ż
na przyj
ąć
za równ
ą
1 kg/dm
3
).
Natomiast st
ęż
enie molowe danej substancji w roztworze przelicza
si
ę
na jej st
ęż
enie procentowe wg tego samego, lecz przekształconego
wzoru:
[ ]
%
1000
100
%
d
M
c
mol
mol
⋅
⋅
=
Rozcie
ń
czanie roztworów
Roztwory odczynników wyra
ż
ane w st
ęż
eniu procentowym przygotowuje
si
ę
przez odwa
ż
enie danej substancji i odmierzenie rozpuszczalnika
(którym najcz
ęś
ciej jest woda) cylindrem miarowym do sumarycznej masy
100 g. Je
ż
eli nie jest wymagana du
ż
a dokładno
ść
st
ęż
enia procentowego,
mo
ż
na przyrz
ą
dzi
ć
roztwory odczynników przez rozcie
ń
czenie roztworów
bardziej st
ęż
onych. Roztwory te mog
ą
by
ć
przygotowywane w dwojaki spo-
sób:
•
przez rozcie
ń
czenie wyj
ś
ciowego roztworu bardziej st
ęż
onego (n)
przy pomocy wody (0).
•
przez rozcie
ń
czenie wyj
ś
ciowego roztworu (n) roztworem tego samego
zwi
ą
zku o ni
ż
szym st
ęż
eniu (k).
Stosunki wagowe w jakich nale
ż
y zmiesza
ć
wyj
ś
ciowe roztwory wylicza
si
ę
wg nast
ę
puj
ą
cego schematu
:
n x – 0 (k)
x
0 (k) n - x

UNIWERSYTET PRZYRODNICZY
Wydział Medycyny Weterynaryjnej
KATEDRA BIOCHEMII I FIZJOLOGII ZWIERZĄT
Zakład Biochemii
20-033 Lublin, ul. Akademicka 12
tel. 081 445 69 73
09-10-17 www.biochfiz.up.lublin.pl Wersja 1.17.10.09
- 4 z 11 -
ROZPUSZCZALNO
ŚĆ
Rozpuszczalno
ść
Rozpuszczalno
ść
– jest to maksymalna ilo
ść
gramów substancji, która
tworzy roztwór nasycony w 100 g rozpuszczalnika w okre
ś
lonej temperatu-
rze i ci
ś
nieniu. Rozpuszczalno
ść
okre
ś
la si
ę
w tych samych jednostkach
jak st
ęż
enie, podaj
ą
c dodatkowo warunki, dla jakich została ona ustalo-
na (zwykle s
ą
to tzw. warunki normalne). Tak wi
ę
c, rozpuszczalno
ść
okre
ś
la mas
ę
danego składnika jak
ą
mo
ż
na rozpu
ś
ci
ć
w danym rozpuszczal-
niku w sprecyzowanych warunkach.
Rozpuszczalno
ść
substancji zale
ż
y od:
•
rodzaju substancji rozpuszczanej,
•
rodzaju rozpuszczalnika,
•
temperatury,
•
ci
ś
nienia,
•
wpływu wspólnego jonu (np. wpływ pH na rozpuszczalno
ść
substancji
amfoterycznych),
•
zdolno
ś
ci do kompleksowania.
Substancje o budowie polarnej lepiej rozpuszczaj
ą
si
ę
w rozpusz-
czalnikach polarnych, a substancje o budowie niepolarnej – w niepolar-
nych. Ze wzrostem temperatury, rozpuszczalno
ść
najcz
ęś
ciej ro
ś
nie dla
cieczy i ciał stałych, za
ś
maleje dla gazów.
Wzrost ci
ś
nienia zwi
ę
ksza rozpuszczalno
ść
gazów.
Ka
ż
d
ą
substancj
ę
mo
ż
na zaliczy
ć
do jednej z trzech grup:
•
substancja praktycznie nierozpuszczalna (rozpuszczalno
ść
poni
ż
ej
0,1 g),
•
substancja słabo rozpuszczalna (rozpuszczalno
ść
w granicach 0,1-1
g),
•
substancja dobrze rozpuszczalna (rozpuszczalno
ść
ponad 1 g).
Czynniki przy
ś
pieszaj
ą
ce proces rozpuszczania:
•
wstrz
ą
sanie,
•
ogrzewanie,
•
rozdrobnienie.
ROZTWORY BUFOROWE
Bufory
Bufory s
ą
to mieszaniny zwi
ą
zków, których zadaniem jest zapobiega-
nie gwałtownym zmianom pH roztworów, zarówno podczas ich rozcie
ń
czania,
jak i dodawania niewielkich ilo
ś
ci mocnego kwasu lub zasady. Mieszaniny
te składaj
ą
si
ę
najcz
ęś
ciej ze słabego kwasu i soli tego kwasu z mocn
ą
zasad
ą
lub te
ż
słabej zasady i soli tej zasady z mocnym kwasem. W przy-
padku buforu zło
ż
onego z wodorosoli, jedna z nich, o wi
ę
kszej zawarto-
ś
ci zdolnych do dysocjacji atomów wodoru, odgrywa rol
ę
kwasu.

UNIWERSYTET PRZYRODNICZY
Wydział Medycyny Weterynaryjnej
KATEDRA BIOCHEMII I FIZJOLOGII ZWIERZĄT
Zakład Biochemii
20-033 Lublin, ul. Akademicka 12
tel. 081 445 69 73
09-10-17 www.biochfiz.up.lublin.pl Wersja 1.17.10.09
- 5 z 11 -
Roztwory (układy) buforowe odgrywaj
ą
wa
ż
n
ą
rol
ę
w procesach bioche-
micznych wszystkich organizmów
ż
ywych, zapewniaj
ą
c
ś
ci
ś
le okre
ś
lon
ą
kwasowo
ść
ś
rodowiska, zmienn
ą
tylko w bardzo w
ą
skim zakresie (soki ko-
mórkowe, krew, limfa itp.). Ju
ż
małe przekroczenie pH w kierunku kwaso-
wo
ś
ci lub zasadowo
ś
ci powoduje chorob
ę
, a nawet
ś
mier
ć
organizmu. Wiele
produktów przemiany materii to kwasy, dlatego te
ż
nawet w warunkach fi-
zjologicznych istnieje tendencja do obni
ż
ania warto
ś
ci pH w ustroju.
Utrzymanie stałego pH płynów ustrojowych i komórek wymaga sprawnego
funkcjonowania mechanizmów regulacyjnych, do których zalicza si
ę
m.in.
system buforów krwi i tkanek. Zasadniczymi buforami krwi s
ą
: układ wo-
dorow
ę
glanowy, białczanowy i hemoglobinowy. W tkankach istotn
ą
rol
ę
od-
grywa równie
ż
bufor fosforanowy.
Stałe pH ma znaczenie dla utrzymania struktury II-, III- i IV rz
ę
-
dowej białek, a tym samym zapewnienie ich biologicznej aktywno
ś
ci,
przede wszystkim jako enzymów.
Roztwory buforowe s
ą
równie
ż
głównym składnikiem
ś
rodowiska, jakie
nale
ż
y stworzy
ć
przy badaniu ró
ż
nych procesów biochemicznych in vitro,
np. w procesach wysalania i frakcjonowania białek oraz w reakcjach en-
zymatycznych.
Mechanizm działania buforu
Mechanizm działania mieszanin buforowych mo
ż
na wyja
ś
ni
ć
na przykła-
dzie buforu octanowego. Kwas octowy znajduj
ą
cy si
ę
w tym buforze wyst
ę
-
puje praktycznie w postaci cz
ą
steczek niezdysocjowanych i spełnia funk-
cj
ę
donatora protonów. Natomiast octan sodowy ma posta
ć
jonów Na
+
i
CH
3
COO
-
, przy czym jony CH
3
COO
-
jako silna zasada s
ą
akceptorem proto-
nów. Donator protonów CH
3
COOH (kwas Broensteda) chroni roztwór przed
zmian
ą
pH podczas dodawania do układu zasady. Dodany nadmiar jonów OH
-
przechodzi w niezdysocjowan
ą
wod
ę
:
CH
3
COOH + OH
-
⇔
CH
3
COO
-
+ H
2
O
Akceptor protonów jon CH
3
COO
-
(zasada Bröensteda) chroni roztwór
przed zmian
ą
pH podczas dodawania do układu niewielkiej ilo
ś
ci kwasu
(jonów wodorowych, oksoniowych- H
3
O
+
):
CH
3
COO
-
+ H
3
O
+
⇔
CH
3
COOH + H
2
O
W reakcji powstaje słabo zdysocjowany kwas octowy i pH roztworu
praktycznie nie ulega zmianie. W ten sposób układ buforowany jest obu-
stronnie – w kierunku podwy
ż
szania jak i obni
ż
ania pH.
Je
ż
eli stała dysocjacji kwasu octowego (K
a
) okre
ś
lona jest wzorem:
K
a
= [H
+
] [CH
3
COO
-
] / [CH
3
COOH],
to po dodaniu drugiego składnika buforu – CH
3
COONa – prawie całkowicie
dysocjowanego:
[CH
3
COO
-
] = c
soli
, zaś [CH
3
COOH] = c
kwasu
i zale
ż
no
ść
na stał
ą
dysocjacji kwasu buforu przyjmuje posta
ć
:

UNIWERSYTET PRZYRODNICZY
Wydział Medycyny Weterynaryjnej
KATEDRA BIOCHEMII I FIZJOLOGII ZWIERZĄT
Zakład Biochemii
20-033 Lublin, ul. Akademicka 12
tel. 081 445 69 73
09-10-17 www.biochfiz.up.lublin.pl Wersja 1.17.10.09
- 6 z 11 -
K
a
= [H
+
] . c
soli
/ c
kw
Rozwi
ą
zuj
ą
c to równanie wzgl
ę
dem H
+
, otrzymuje si
ę
:
[H
+
] = K
a
. c
kw
/ c
soli
,
sk
ą
d pH buforu wytworzonego ze słabego kwasu i jego soli zostaje okre-
ś
lone worem:
Zale
ż
no
ść
ta nosi równie
ż
nazw
ę
równania Hendersona-Hasselbalcha.
Rozcie
ń
czanie buforów
Rozcie
ń
czenie lub zat
ęż
enie roztworu buforowego nie wpływa na zmia-
n
ę
stosunku st
ęż
e
ń
jego składników (c
kw
/ c
soli
), a tak
ż
e na pK
c
. Procesy
te nie wpływaj
ą
zatem na zmian
ę
pH buforu, natomiast s
ą
odpowiedzialne
za zmian
ę
pojemno
ś
ci buforowej.
Gdy stosunek st
ęż
enia kwasu do st
ęż
enia soli równy jest jedno
ś
ci,
wówczas pH buforu = pK
a
. Mieszanina buforowa o takim składzie ma dla
danego st
ęż
enia najwi
ę
ksz
ą
pojemno
ść
buforow
ą
, tzn. najwy
ż
sz
ą
zdolno
ść
wi
ą
zania zasad i kwasów, i przeciwdziałania zmianom pH.
Pojemno
ść
buforowa
Pojemno
ść
buforowa (
β
) jest to liczba moli mocnego kwasu lub mocnej
zasady, która musi by
ć
dodana do 1 dm
3
roztworu buforu, aby spowodowa
ć
zmian
ę
jego pH o jednostk
ę
:
β
=
∆
B /
∆
pH
gdzie:
∆
B
- dodana liczba moli silnego kwasu lub zasady,
∆
pH
– zmiana pH.
Pojemno
ść
buforowa ro
ś
nie wraz ze wzrostem st
ęż
enia buforu.
Dla roztworów buforowych otrzymanych przez zmieszanie słabej zasady
i soli tej zasady, wykładnik st
ęż
enia jonów wodorowych wylicza si
ę
ze
wzoru:
pH = 14 – (pK
b
- log c
zas
/ c
soli
).
gdzie
K
b
jest stał
ą
dysocjacji słabej zasady
Przykłady roztworów buforowych
W tabeli przedstawiono przykłady roztworów buforowych.
pH = pK
a
- log c
kw
/ c
soli
UNIWERSYTET PRZYRODNICZY
Wydział Medycyny Weterynaryjnej
KATEDRA BIOCHEMII I FIZJOLOGII ZWIERZĄT
Zakład Biochemii
20-033 Lublin, ul. Akademicka 12
tel. 081 445 69 73
09-10-17 www.biochfiz.up.lublin.pl Wersja 1.17.10.09
- 7 z 11 -
Tab. 1. Przykłady wzorcowych roztworów buforowych
Nazwa
Skład na 1 dm
3
wody
pH w 25
o
C
W
ę
glanowy
0,025 mola NaHCO
3
0,025 mola Na
2
CO
3
10,012
Fosforanowy
0,25 mola Na
2
HPO
4
0,25 mola KH
2
PO
4
6,865
Octanowy
0,1 mola CH
3
COOH
0,1 mola CH
3
COONa
4,644
Je
ż
eli w roztworze buforowym st
ęż
enia słabego kwasu i sprz
ęż
onej z
nim zasady nie s
ą
takie same, to st
ęż
enie jonów H
+
(H
3
O
+
) ró
ż
ni si
ę
od
warto
ś
ci stałej dysocjacji kwasu K
a
. Warto
ść
pH takiego roztworu mo
ż
na
obliczy
ć
z podanego wy
ż
ej równania Hendersona-Hasselbalcha i wielko
ś
ci
jego stałej dysocjacji.
Tab.2. Stałe dysocjacji kwasów i zasad
K
a
Mocny kwas
Słaba zasada
K
b
55,4
H
3
O
+
H
2
O
1,8 . 10
-16
1,0 . 10
-2
HSO
4
-
SO
4
2-
1,0 . 10
-12
1,8 . 10
-5
CH
3
COOH
CH
3
COO
-
5,5 . 10
-10
4,5 . 10
-7
H
2
CO
3
HCO
3
-
2,2 . 10
-8
1,0 . 10
-7
H
2
S
HS
-
1,0 . 10
-7
5,5 . 10
-10
HCN
NH
3
1,8 . 10
-5
4,0 . 10
-10
NH
4
+
CN
-
2,5 . 10
-5
1,3 . 10
-13
HS
-
S
2-
8,0 . 10
-2
1,8 . 10
-16
H
2
O
OH
-
55,4
K
a
Wzrost
Mocy kwa-
sów
Słaby kwas
Mocna zasada
Wzrost
mocy zasad
K
b
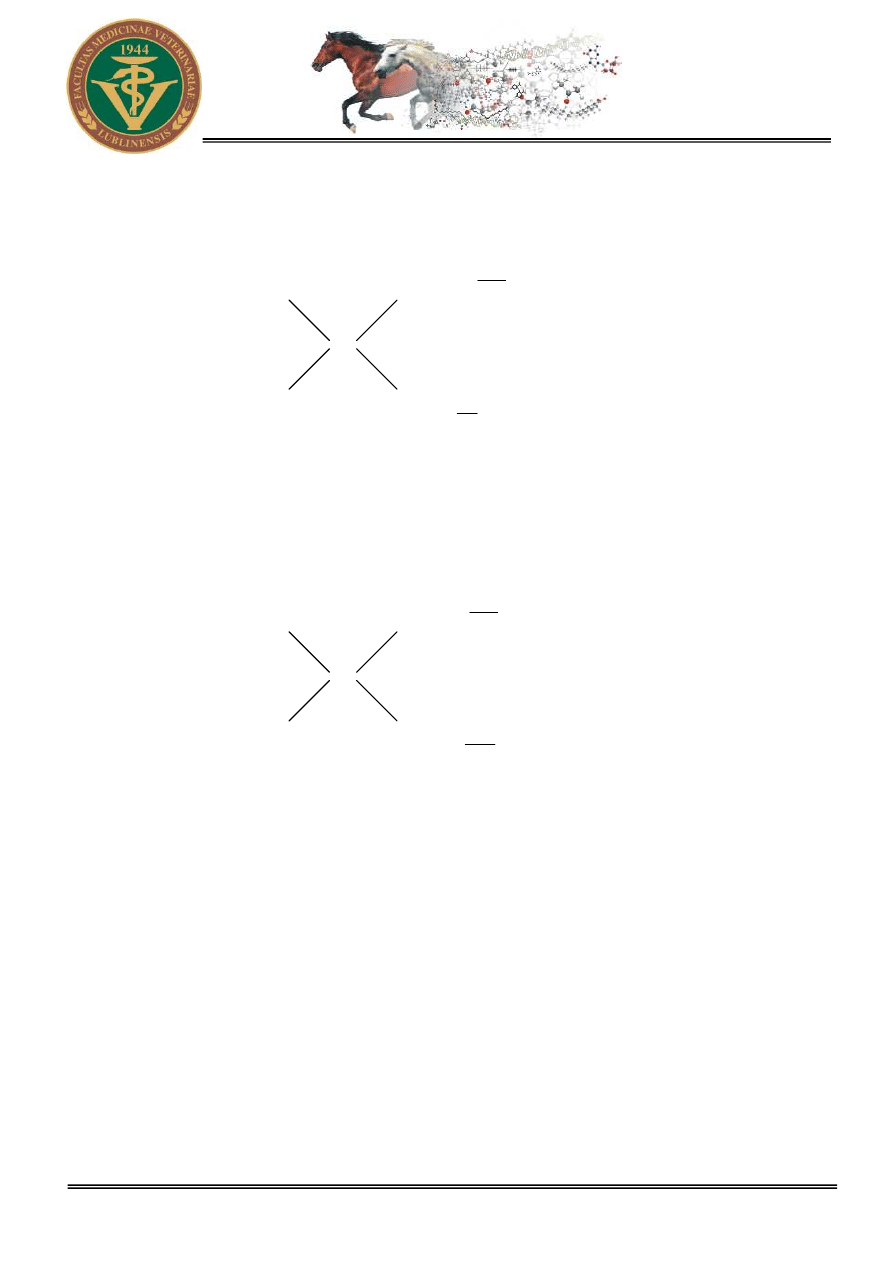
UNIWERSYTET PRZYRODNICZY
Wydział Medycyny Weterynaryjnej
KATEDRA BIOCHEMII I FIZJOLOGII ZWIERZĄT
Zakład Biochemii
20-033 Lublin, ul. Akademicka 12
tel. 081 445 69 73
09-10-17 www.biochfiz.up.lublin.pl Wersja 1.17.10.09
- 8 z 11 -
PRZYKŁADY OBLICZE
Ń
Rozcie
ń
czanie roztworów
Przykład 1: W jakim stosunku nale
ż
y zmiesza
ć
36 % kwas solny z wo-
d
ą
, aby otrzyma
ć
jego 10 % roztwór?
kwas 36 10 g =
18
,
1
10
cm
3
= 8,47 cm
3
10
woda 0 26 g =
1
26
cm
3
= 26,00 cm
3
Odpowied
ź
: Kwas solny 36 % nale
ż
y zmiesza
ć
z wod
ą
w stosunku wago-
wym 10 : 26 lub w stosunku obj
ę
to
ś
ciowym 8,47 : 26 (1,18 – g
ę
sto
ść
36 %
HCl, 1 – g
ę
sto
ść
wody).
Przykład 2: W jakim stosunku nale
ż
y zmiesza
ć
roztwory kwasu solnego
o st
ęż
eniu 36 % i 4 %, aby otrzyma
ć
kwas solny o st
ęż
eniu 10 %?
kwas > 36 6 g =
18
,
1
6
cm
3
= 5,08 cm
3
10
kwas < 4 26 g =
02
,
1
26
cm
3
= 25,49 cm
3
Odpowied
ź
: w celu otrzymania 10 % roztworu, kwas solny 36 % i jego
roztwór 4 % nale
ż
y zmiesza
ć
w stosunku wagowym 6 : 26 lub w stosunku
obj
ę
to
ś
ciowym 5,08 : 25,49.
Uwaga:
W przypadku zwi
ą
zków tworz
ą
cych hydraty (Na
2
SO
4
⋅
10 H
2
O, CuSO
4
⋅
5 H
2
O) nale
ż
y w wy-
liczeniach uwzgl
ę
dnia
ć
zawarto
ść
tylko czystego zwi
ą
zku, ale w odwa
ż
ce uwzgl
ę
dni
ć
tak
ż
e zawarto
ść
wody.
W przypadku rozcie
ń
czania roztworów o st
ęż
eniu molowym u
ż
ywa si
ę
podobnych
schematów krzy
ż
owych i operuje si
ę
jednostkami obj
ę
to
ś
ciowymi.
Sporz
ą
dzanie roztworów o okre
ś
lonym st
ęż
eniu
Przykład 1: Aby sporz
ą
dzi
ć
5% roztwór w
ę
glanu sodowego dysponuj
ą
c
Na
2
CO
3
⋅
10 H
2
O nale
ż
y najpierw wyliczy
ć
w jakiej masie uwodnionego w
ę
gla-
nu znajdzie si
ę
5g czystego zwi
ą
zku. Z wielko
ś
ci masy cz
ą
steczkowej
Na
2
CO
3
i Na
2
CO
3
⋅
10 H
2
O układamy proporcj
ę
: 106g czystego w
ę
glanu w 286 g
hydratu. To 5 g czystego zwi
ą
zku znajdzie si
ę
w x g hydratu.

UNIWERSYTET PRZYRODNICZY
Wydział Medycyny Weterynaryjnej
KATEDRA BIOCHEMII I FIZJOLOGII ZWIERZĄT
Zakład Biochemii
20-033 Lublin, ul. Akademicka 12
tel. 081 445 69 73
09-10-17 www.biochfiz.up.lublin.pl Wersja 1.17.10.09
- 9 z 11 -
106 ------- 286
5 ------- X
X = 5
⋅
286 : 106
X = 13,49 g
Odpowied
ź
: 5 g czystego w
ę
glanu znajdzie si
ę
w 13,49 g hydratu w
ę
-
glanu sodu. Do sporz
ą
dzenia 5% roztworu Na
2
CO
3
nale
ż
y odwa
ż
y
ć
13,49 g
Na
2
CO
3
⋅
10 H
2
O i rozpu
ś
ci
ć
t
ą
odwa
ż
k
ę
w 86,51 g wody. Przy dodawaniu wody
uwzgl
ę
dnia si
ę
zawarto
ść
wody zawartej w odwa
ż
ce hydratu.
Obliczanie pH roztworu buforowego
Przykład 1
Obliczy
ć
pH buforu powstałego ze zmieszania w probówce 0,6 cm
3
0,1
mol/dm
3
roztworu 0,01 mol/dm
3
CH
3
COOH z 1 cm
3
0,1 mol/dm
3
roztworem
CH
3
COONa i 8,4 cm
3
wody destylowanej.
Dane:
Szukane:
1
3
C
= 0, 01mol / dm
CH COOH
3
1
3
3
V
=0,6cm =0,0006dm
CH COOH
3
1
3
C
=0,1mol/dm
CH COONa
3
1
3
3
V
=1cm =0,001dm
CH COONa
3
(
)
3
3
3
V
= 0,6+8,4+1 cm =10cm =0,01dm
probówki
pH=?
Warto
ść
pH powstałego roztworu okre
ś
lona jest poprzez bufor octano-
wy. Bufor ten składa si
ę
ze sprz
ęż
onego układu słaby kwas CH
3
COOH i je-
go sól CH
3
COONa. Dysocjacj
ę
kwasu octowego mo
ż
na zapisa
ć
:
CH
3
COOH
⇔
CH
3
COO
-
+ H
+
W naszym przypadku st
ęż
enie jonów CH
3
COO
-
jest równe st
ęż
eniu CH
3
COONa
w roztworze. Równanie Hendersona-Hasselbalcha dla buforu octanowego
mo
ż
na wi
ę
c zapisa
ć
:
[
]
[
]
CH COONa
3
pH = pK +log
CH COOH
3
pK kwasu octowego wynosi 4,65.
St
ęż
enie CH
3
COOH w roztworze obliczmy w nast
ę
puj
ą
co:
Obliczamy dodan
ą
do probówki ilo
ść
moli CH
3
COOH:
1
1
n
=C
×V
CH COOH
3
CH COOH
CH COOH
3
3
UNIWERSYTET PRZYRODNICZY
Wydział Medycyny Weterynaryjnej
KATEDRA BIOCHEMII I FIZJOLOGII ZWIERZĄT
Zakład Biochemii
20-033 Lublin, ul. Akademicka 12
tel. 081 445 69 73
09-10-17 www.biochfiz.up.lublin.pl Wersja 1.17.10.09
- 10 z 11 -
Obliczamy st
ęż
enie roztworu CH
3
COOH w probówce po dodaniu wszystkich
składników roztworu:
n
CH COOH
2
3
C
=
CH COOH
3
V
probówki
St
ą
d st
ęż
enie CH
3
COOH w probówce mo
ż
na zapisa
ć
wzorem:
1
1
C
×V
CH COOH
CH COOH
2
3
3
C
=
CH COOH
3
V
probówki
Po podstawieniu otrzymujemy:
3
3
0,01mol/dm ×0,0006dm
2
-4
3
C
=
=6×10
mol/dm
CH COOH
3
3
0,01dm
Analogicznie przeprowadzamy obliczenia dla CH
3
COONa, otrzymuj
ą
c:
1
1
C
×V
CH COONa
CH COONa
2
3
3
C
=
CH COONa
3
V
probówki
Po podstawieniu:
3
3
0,1mol/dm ×0,001dm
2
-2
3
C
=
=1×10
mol/dm
CH COONa
3
3
0,01dm
Podstawiaj
ą
c do równania Hendersona-Hasselbalcha, otrzymujemy:
-2
3
1×10
mol/dm
pH=4,65+log
-4
3
6×10
mol/dm
é
ů
ę
ú
ë
ő
é
ů
ę
ú
ë
ő
-2
-4
pH =4,65+log 1×10
-log 6×10
é
ů
é
ů
ę
ú
ę
ú
ë
ő
ë
ő
pH =5,87
Odpowied
ź
: pH w probówce wynosi 5,87.
Pojemno
ść
buforowa
UNIWERSYTET PRZYRODNICZY
Wydział Medycyny Weterynaryjnej
KATEDRA BIOCHEMII I FIZJOLOGII ZWIERZĄT
Zakład Biochemii
20-033 Lublin, ul. Akademicka 12
tel. 081 445 69 73
09-10-17 www.biochfiz.up.lublin.pl Wersja 1.17.10.09
- 11 z 11 -
Przykład 1: Do probówki zawieraj
ą
cej 5 cm
3
buforu octanowego o pH =
5 dodano 3 krople czerwieni metylenowej i miareczkowano (dodawano po
kropli) roztworem 0,1 mol/dm
3
NaOH do uzyskania barwy cytrynowo
ż
ółtej
(pH = 6,3). Zu
ż
yto 1,2 cm
3
roztworu NaOH. Obliczy
ć
pojemno
ść
buforow
ą
u
ż
ytego buforu octanowego wobec zasady.
Obliczamy ilo
ść
0,1 mol/dm
3
NaOH jak
ą
nale
ż
y zu
ż
y
ć
na zoboj
ę
tnienie
(1 dm
3
) 1000 cm
3
roztworu buforu octanowego, układamy proporcj
ę
:
5 cm
3
-------- 1,2 cm
3
1000 cm
3
-------- x
3
240
5
2
,
1
1000
cm
x
=
⋅
=
Obliczamy liczb
ę
moli NaOH w 240 cm
3
roztworu 0,1 mol/dm
3
. Układamy
proporcj
ę
:
1000 cm
3
-------- 0,1 mol/dm
3
240 cm
3
-------- x
mol
x
024
,
0
1000
1
,
0
240
=
⋅
=
Korzystaj
ą
c z definicji pojemno
ś
ci buforowej obliczamy:
pH
x
∆
=
β
018
,
0
0
,
5
3
,
6
024
,
0
=
−
=
β
Odpowied
ź
: Pojemno
ść
buforowa wobec zasady u
ż
ytego buforu octanowe-
go wynosi 0,018
Uwaga W analogiczny sposób oblicza si
ę
pojemno
ść
buforow
ą
badanego roztworu wobec
zasady.
Wyszukiwarka
Podobne podstrony:
chemia bufory
bufory, Ogrodnictwo UP Lbn, chemia
bufory2724, UG, SEM1, Chemia
BUFORY2, Weterynaria, Chemia
bufory, Szkoła, penek, Przedmioty, Chemia, Teoria
Bufory sprawko, podstawy chemii nieorganicznej, Chemia nieorganiczna laboratorium, MOJE
obliczenia - bufory, Inżynieria środowiska, inż, Semestr II, Chemia ogólna
Bufory, Studia, I rok, Chemia ogólna i nieorganiczna
bufory, Study =], CHEMIA, laborki chemia nieorganiczna
bufory, chemia
bufory ZMiN, Chemia nieorganiczna
Chemia Bionie wyk1
chemia powt
więcej podobnych podstron