ĆWICZENIE 7
STĘŻENIE JONÓW WODOROWYCH
I WSKAŹNIKI pH. ROZTWORY BUFOROWE.
ODCZYNNIKI
0.1 M, 0.5 M HCl,
0.5 M KOH,
roztwór fioletu metylowego,
roztwór oranżu metylowego,
roztwór czerwieni metylowej,
roztwór błękitu bromotymolowego,
roztwór tymoloftaleiny,
roztwór karminu indygo,
alkoholowy roztwór fenoloftaleiny,
roztwór zieleni malachitowej
roztwór czerwieni fenolowej
roztwór czerwieni bromofenolowej
papierki wskaźnikowe
roztwory o pH 1 - 14
0.2 M, 0.5 M, 1 M NH4Cl
0.2 M, 1 M CH3COOH
0.2 M CH3COONa
1 M NaCl
1 M CH3COONH4
APARATURA
11 płytek testowych,
kolbki miarowe 50 cm3,
cylinder 100 cm3,
zlewki 50cm3,
probówki,
I. CEL ĆWICZENIA:
Określenie stężenia jonów wodorowych w roztworze
Zapoznanie z pojęciem pH. Opanowanie kolorymetrycznej metody wyznaczania stężenia jonów wodorowych przy użyciu wskaźników alkacymetrycznych
Obliczanie stężenia jonów H+ i OH-
Zapoznanie się z własnościami mieszanin buforowych oraz techniką analizy miareczkowej.
II. WSTĘP TEORETYCZNY:
Przy rozważaniu równowag w układzie kwas - zasada istotne znaczenie ma znajomość stężenia jonów wodorowych. Niekiedy ta wartość jest mała i bardziej wygodne jest posługiwanie się w obliczeniach wykładnikiem jonów wodorowych.
![]()
Pomiar pH wykonuje się na ogół dwiema metodami: potencjometryczną i kolorymetryczną. Ta ostatnia polega na obserwacji zmiany barwy wskaźników pH. Wskaźniki pH są to bardzo słabe kwasy lub zasady organiczne, których jony są inaczej zabarwione niż cząsteczki niezdysocjowane, przy czym stopień dysocjacji, a więc i barwa wskaźników zależy od pH roztworu.
Bufory są to roztwory, których pH prawie nie zmienia się przy znacznych rozcieńczeniach, oraz w których dodatek niewielkich ilości mocnego kwasu lub mocnej zasady powoduje wielokrotnie mniejsze zmiany stężenia jonów H+ niż taki sam dodatek kwasu lub zasady do roztworu niezawierającego buforu.
Roztwory buforowe:
Bufor octanowy: CH3COOH, CH3COONa, pH = 3.5-6
Bufor amonowy: NH4OH, NH4Cl, pH = 8-11
Bufor fosforanowy: NaH2PO4, Na2HPO4, pH = 5.5-8
Bufor octanowy:
![]()
Bufor amonowy:
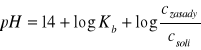
lub
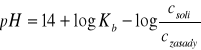
Bufor fosforanowy:
NaH2PO4 = Na+ + H2PO4-
Na2HPO4 = 2Na+ + HPO42-
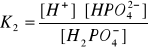
![]()
c1=[H2PO4-]
c2=[HPO42-]
Zdolność przeciwstawiania się zmianom pH nazywamy pojemnością buforową. Jej miarą jest najmniejsza liczba moli jonów H+ mocnego kwasu albo jonów OH- mocnej zasady, które dodane do 1 dm3 roztworu buforowego zmienią wartość pH o jednostkę.
Bufor octanowy |
Bufor fosforanowy |
Bufor amoniakalny |
||||||
0.2 M kwas octowy ml |
0.2 M octan sodu ml |
pH roztworu |
0.067 M KH2PO4 ml |
0.067 Na2HPO4 ml |
pH roztworu |
0.2 M NH3 ml |
0.2 M NH4Cl ml |
pH roztworu |
9.5 |
0.5 |
3.48 |
9.5 |
0.5 |
5.93 |
9.5 |
0.5 |
10.52 |
9.0 |
1.0 |
3.80 |
9.0 |
1.0 |
6.25 |
9.0 |
1.0 |
10.20 |
8.0 |
2.0 |
4.16 |
8.0 |
2.0 |
6.61 |
8.0 |
2.0 |
9.84 |
7.0 |
3.0 |
4.39 |
7.0 |
3.0 |
6.84 |
7.0 |
3.0 |
9.61 |
6.0 |
4.0 |
4.58 |
6.0 |
4.0 |
7.03 |
6.0 |
4.0 |
9.42 |
5.0 |
5.0 |
4.75 |
5.0 |
5.0 |
7.21 |
5.0 |
5.0 |
9.25 |
4.0 |
6.0 |
4.94 |
4.0 |
6.0 |
7.39 |
4.0 |
6.0 |
9.06 |
3.0 |
7.0 |
5.13 |
3.0 |
7.0 |
7.58 |
3.0 |
7.0 |
8.87 |
2.0 |
8.0 |
5.36 |
2.0 |
8.0 |
7.81 |
2.0 |
8.0 |
8.64 |
1.0 |
9.0 |
5.71 |
1.0 |
9.0 |
8.16 |
1.0 |
9.0 |
8.29 |
0.5 |
9.5 |
6.04 |
0.5 |
9.5 |
8.49 |
0.5 |
9.5 |
7.96 |
Najczęściej stosowane układy buforujące, obejmujące cały zakres wartości pH, są następujące:
pH = 0 1 M HCl
pH = 2 0,01 M HCl
pH = 4,7 1 M CH3COOH + 1 M CH3COONa
pH = 7.2 1 M KH2PO4 + 1 M Na2HPO4
pH = 9,2 1 M NH4Cl + 1 M NH3
pH = 12 0,01 M NaOH
pH = 14 1 M NaOH
WSKAŹNIKI pH
W celu stwierdzenia, czy roztwór jest kwaśny, obojętny czy zasadowy, można stosować wskaźniki. Najprostszym wskaźnikiem, który możemy zrobić w warunkach domowych jest wywar z czerwonej kapusty. Wskaźniki tym charakteryzują się, że zmieniają swoje zabarwienie przy określonym pH. Na przykład fioletowe zabarwienie wywaru z czerwonej kapusty zmienia się na różowe w obecności kwasu.
Wskaźnikiem (indykatorem) pH są substancje ulegające przemianom lub modyfikacjom strukturalnym przy zmianie stężenia jonów H+ (H3O+) a w konsekwencji tego wykazują zmiany pH w pewnych określonych granicach. Im te granice leżą bliżej siebie, tym lepszy jest wskaźnik
Tablica 1
Charakterystyka wybranych wskaźników
Wskaźnik |
Zakres zmian barwy |
Barwa wskaźnika pH
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
|
|||
Błękit tymolowy |
1,2 - 2,8 |
|
|
|
|
Oranż metylowy |
3,0 - 4,4 |
|
|
Błękit bromofenylowy |
3,0 - 4,6 |
|
|
Czerwień metylowa |
4,4 - 6,2 |
|
|
Lakmus |
5,0 - 8,0 |
|
|
Błękit bromotymolowy |
6,0 - 7,6 |
|
|
Błękit tymolowy |
8,0 - 9,6 |
|
|
|
Fenoloftaleina |
8,4 - 10,0 |
|
|
Wskaźniki są ogólnie słabymi kwasami lub słabymi zasadami organicznymi. Zmiana barwy wskaźnika ze zmianą pH roztworu nie jest ostra, lecz następuje w zakresie jednej lub dwóch jednostek pH (patrz tabela 1). Wynika to z istnienia równowagi chemicznej między dwiema różnie zabarwionymi postaciami wskaźnika. Na przykład wskaźnik będący słabym kwasem o ogólnym wzorze HIn w zależności od środowiska będzie miał postać kwasową lub zasadową.
HIn <=> H+ + In-
postać kwasowa postać zasadowa
Takim wskaźnikiem jest lakmus. Postać kwasowa HIn lakmusu ma zabarwienie czerwone, a postać zasadowa opisana wzorem In- ma zabarwienie niebieskie. Działanie wskaźnika jest następujące;
w roztworach kwaśnych, w których stężenie [H+] jest duże, równowaga przesuwa się w lewo, wskaźnik przybiera postać kwasową (zabarwienie wskaźnika jest czerwone)
w roztworach zasadowych, o małym stężeniu [H+], równowaga jest przesunięta w prawo, a wskaźnik przechodzi niemal całkowicie w postać zasadową (zabarwienie wskaźnika jest niebieskie).
Obecnie są dostępne uniwersalne papierki wskaźnikowe, nasycone mieszaniną wskaźników i wykazujące szereg zmian barwy. Za pomocą tych papierków można ocenić pH roztworu z dokładnością ok. 1 jednostki w zakresie pH od 1 do 13.
III. WYKONANIE ĆWICZENIA
A) BARWY WSKAŹNIKÓW W ROZTWORACH O RÓŻNYCH WARTOŚCIACH pH
Posługując się 0.1 M roztworem HCl i 0.1 M roztworem NaOH przygotować roztwory wzorcowe o pH od 1 do 13. Umieścić je w czystych przygotowanych butelkach i podpisać. Jako roztwór o pH = 1 będzie służyć 0.1 M kwas solny. Roztwór o pH = 2 sporządzić, odmierzając pipetą 5 cm3 0.1 M HCl do kolby miarowej na 50 cm3 i dopełniając wodą destylowaną do kreski. Roztwór starannie wymieszać. Roztwór o pH = 3 przygotowujemy odmierzając 5 cm3 roztworu o pH = 2 do kolbki miarowej (50 cm3) i dopełniamy wodą do kreski. W Przypadku roztworów o pH = 4 - 11 należy stosować gotowe roztwory buforowe. Roztwory o dużych wartościach pH sporządzić z 0.1 M NaOH, którego pH wynosi 13. Rozcieńczając dziesięciokrotnie 0.1 M NaOH otrzymuje się roztwór o pH = 12. Przygotować płytki testowe. Do każdej z nich odmierzyć 1 cm3 odpowiedniego roztworu wzorcowego, dodawać po 1 kropli roztworu wskaźnika i obserwować zabarwienie. Zmiany barw zanotować w sprawozdaniu
OZNACZANIE STĘŻENIA JONÓW WODOROWYCH
W ROZTWORZE.
Odmierzyć pipetą po 1 cm3 roztworu badanego do probówek. Kolejno dodawać do nich po dwie krople wskaźników. Posługując się skalą pH sporządzoną w poprzednim ćwiczeniu określić pH próbki. Obliczyć stężenie jonów wodorowych w badanym roztworze.
BADANIE STAŁOŚCI pH W MIESZANINIE BUFOROWEJ
Sporządzić roztwór buforowy o pH równym 8.4 w następujący sposób:
do 50 cm3 0.5 M roztworu chlorku amonu dodać 10 kropli roztworu fenoloftaleiny, po czym dolewać kroplami rozcieńczonego roztworu amoniaku, aż roztwór zabarwi się wyraźnie na różowo (nie intensywnie na czerwono).
Sporządzić w cylindrze roztwór o takim samym stężeniu jonów wodorowych, jak w roztworze buforowym (pH=8.4), dodając kroplami do 50 cm3 wody destylowanej, zawierającej 10 kropel roztworu fenoloftaleiny, rozcieńczonego roztworu amoniaku, aż do uzyskania takiego samego koloru jak w roztworze buforowym. Dla porównania barw naczynia należy umieścić na białym tle.
Każdy z przygotowanych roztworów podzielić na dwie części, korzystając
z cylindrów miarowych. Do jednej części roztworu buforowego i jednej niezbuforowanego dodać takie ilości 0.5 M roztworu wodorotlenku potasu, aby oba roztwory przybrały barwę czerwoną. Zapisać objętości dodanego KOH
do obu probówek. Dla drugiej połowy roztworów powtórzyć eksperyment dodając 0.5 M roztwór kwasu solnego, aż do zaniku różowej barwy roztworu. Zapisać objętości dodanego HCl do obu probówek. Porównać objętości kwasu
i zasady, potrzebne dla zmiany barwy wskaźnika w roztworze buforowym
i niezbuforowanym.
BUFORUJĄCE DZIAŁANIE NIEKTÓRYCH SOLI
Do trzech ponumerowanych probówek odmierzyć pipetą po ok 2 cm3
0.1 molowego roztworu kwasu solnego, dodać po 1 kropli fioletu metylowego
i obserwować barwę roztworów. Do każdej probówki dodać po
1 cm3 jednego z następujących 1 molowych roztworów: CH3COONa, NaCl, CH3COONH4 i obserwować zmiany barwy.
Postępując jak poprzednio, należy pobrać do trzech probówek po 2 cm3
0.1 molowego roztworu wodorotlenku sodowego, dodać do każdej probówki po jednej krople fioletu metylowego i po 2 cm3 jednego z następujących
1 molowych roztworów: NH4Cl, NaCl, CH3COONH4.
Objaśnić zaobserwowane zmiany barw wskaźników pod wpływem dodanych soli i podać równania jonowe dla każdej z zachodzących reakcji.
EFEKT WSPÓLNEGO JONU
Do probówki odmierzyć pipetą 5 cm3 1 molowego roztworu kwasu octowego, dodać dwie krople oranżu metylowego i nieco 1 molowego roztworu octanu sodu. Zachodzące zmiany zinterpretować na podstawie odpowiedniego równania reakcji.
IV. OPRACOWANIE WYNIKÓW
Wyniki opracować zgodnie ze wzorem sprawozdania i wytycznymi prowadzącego.
Literatura
L. Pajdowski, Chemia ogólna
J. Minczewski, Z. Marczenko, Chemia analityczna
A. Śliwa, Obliczenia chemiczne
10
Wyszukiwarka
Podobne podstrony:
ZADANIA Z CHEMII U PLUTY, UG, SEM1, Chemia
aniony, UG, SEM1, Chemia
egzamin chemia, UG, SEM1, Chemia
phmetria, UG, SEM1, Chemia
Zer+-wka z chemii, UG, SEM1, Chemia
chemia pltka, UG, SEM1, Chemia
Sprawozdanie - Cymbella2, UG, SEM1, Zarodniki, sprawozdania różne
Sprawozdanie - Tolypothrix, UG, SEM1, Zarodniki, sprawozdania różne
Sprawozdanie -furcellaria fastigata, UG, SEM1, Zarodniki, sprawozdania różne
SPRAWOZDANIE nr 1 na zarodniki, UG, SEM1, Zarodniki, sprawozdania różne
Laboratorium chemia 4, Przyroda UG, Laboratorium - chemia
Laboratorium chemia 1 ver2, Przyroda UG, Laboratorium - chemia
dicranum scoparium - sprawozdanie, UG, SEM1, Zarodniki, sprawozdania różne
Laboratorium chemia 3, Przyroda UG, Laboratorium - chemia
Bufory, Studia, I rok, Chemia ogólna i nieorganiczna
Laboratorium chemia 1 ver1, Przyroda UG, Laboratorium - chemia
chemia!!!, SiMR sem1, chemia, Chemia koleszki
nieorganiczna zerowka!!, UG, Sem.2, Chemia nieorganiczna, Egzamin
Laboratorium chemia 2, Przyroda UG, Laboratorium - chemia
więcej podobnych podstron