
100
Charakterystyka komórek macierzystych
Rosnące zainteresowanie komórkami macierzystymi (KM) wynika
z ich unikalnej zdolności do samoodnawiania, namnażania się oraz
różnicowania w komórki tworzące różne tkanki i narządy. KM, dzieląc
się, dają początek komórkom siostrzanym, z których stale odnawia-
na jest pula komórek macierzystych. Część z komórek siostrzanych
różnicuje się jednocześnie w komórki somatyczne swoiste tkankowo.
Proces ten zapewnia utrzymanie odpowiedniej ilości komórek soma-
tycznych, które się starzeją i ulegają apoptozie. KM budzą zrozumia-
łe nadzieje na zastosowanie ich w regeneracji uszkodzonych narzą-
dów i tkanek. Zgodnie z powyższym podjęto próby wykorzystywania
komórek naskórka w leczeniu oparzeń i owrzodzeń. Uważa się, że
zabiegi przeszczepiania narządów i tkanek zostaną w przyszłości
zastąpione „przeszczepami” namnożonych in vitro komórek macie-
rzystych (1-9). Koncepcja ta stworzyła podwaliny pod dynamicznie
rozwijającą się medycynę regeneracyjną.
Występuje wiele rodzajów komórek macierzystych, które różnią się
zdolnościami do proliferacji i różnicowania. Im mniej „dojrzała” ko-
mórka macierzysta, tym większe ma możliwości różnicowania i na-
mnażania. Zapłodniona komórka jajowa zwana jest zygotą i jest ko-
mórką macierzystą totipotencjalną (ryc. 1). Charakteryzuje ją zdolność
tworzenia zarówno embrionu, jak i łożyska. Kolejny etap różnicowania
zarodka to blastocysta, w której pojawiają się komórki macierzyste
pluripotencjalne węzła zarodkowego. Komórki pluripotencjalne mogą
dać początek komórkom wszystkich trzech listków zarodka (mezo-
dermy, ektodermy i endodermy), ale tracą zdolność różnicowania
się w komórki łożyska. Wykazują one ekspresję markerów embrio-
nalnych, takich jak Oct4, Nanog i Rex-1. Komórki pluripotencjalne
w węźle zarodkowym tworzą hipoblast i epiblast. W dalszym rozwoju
hipoblast zanika, a z epiblastu powstają w wyniku gastrulacji wszyst-
kie trzy listki zarodkowe. Komórki pluripotencjalne epiblastu tworzą
komórki macierzyste różnych tkanek i narządów, a następnie część
z nich prawdopodobnie ulega zdeponowaniu w rozwijających się na-
rządach, gdzie mogą przetrwać aż do wieku dorosłego. Jest wysoce
prawdopodobne, że ostatnio zidentyfi kowane w dorosłych tkankach
tzw. małe embrionalne komórki macierzyste (very small embryonic-
like stem cells, VSEL) są takimi pozostałościami rozwojowymi komó-
rek pluripotencjalnych epiblastu. Podobnie pochodzące z epiblastu
prekursory komórek prapłciowych (primordial germ cells, PGC) za-
siedlają nie tylko grzebienie płciowe, gdzie różnicują się w plemniki
i oocyty, ale mogą również przetrwać w innych dorosłych tkankach.
Ostatnio wykazano obecność komórek o właściwościach PGC w ni-
szy naskórkowej (10, 11). Komórki zbliżone do PGC opisano również
w nadnerczach.
Pluripotencjalne komórki macierzyste dają początek multipoten-
cjalnym komórkom macierzystym, ekto-, mezo- i endodermalnym.
Te różnicują się w ukierunkowane tkankowo unipotencjalne komórki
macierzyste zasiedlające nisze tkankowe. Wyróżnia się ukierunko-
wane tkankowo komórki dla układu hematopoetycznego, nabłonka
jelitowego, tkanki nerwowej, wątroby oraz inne. Dla przykładu linia
hematopoetyczna różni się od pozostałych linii komórek macierzy-
stych zestawem antygenów powierzchniowych. Sortując np. komórki
szpiku kostnego wg antygenów powierzchniowych, komórki CXCR4+
CD45+lin- stanowią linię komórek macierzystych hematopoetycz-
nych, a komórki linii CXCR4+CD45-lin- są niehematopoetycznymi ko-
mórkami macierzystymi. Pomocne jest również wykazanie ekspresji
antygenów CD34 i AC133, które występują na KM układu krwiotwór-
czego oraz innych tkanek. Warto nadmienić, że komórki macierzyste
naskórka wywodzą się bezpośrednio z multipotencjalnych komórek
ektodermalnych (1, 3, 12).
Komórki macierzyste naskórka i ich znaczenie w procesach odnowy
Epidermal stem cells and their role in regeneration
Marzena Staniszewska, Sylwia Słuczanowska-Głąbowska
Zakład Fizjologii, Katedra Fizjopatologii PAM w Szczecinie
S
TRESZCZENIE
Rozwój nowoczesnych technologii badawczych prowadzi do coraz lepszego poznania biologii komórek macierzystych (komórki macierzyste, KM) i budzi
nadzieje w świecie medycznym na ich potencjalne coraz szersze wykorzystanie w terapii. Komórki macierzyste uczestniczą bowiem w procesach naprawy
i regeneracji uszkodzonych narządów i tkanek. Im mniej dojrzała jest KM, tym szersze są możliwości jej wykorzystania. Tak więc, komórki pluripotencjalne
charakteryzuje największa zdolność do różnicowania w więcej niż jedną linię komórkową. Jednym z najbogatszych źródeł KM stosunkowo łatwych do
pozyskania jest naskórek. Izolowanie i możliwości klinicznego wykorzystania KM naskórka otwierają nowe perspektywy w leczeniu chorób skóry, takich jak
ciężkie poparzenia, czy przewlekłe owrzodzenia. W pracy podsumowano główne cechy KM naskórka, uwzględniając zarówno ich dojrzałość, zróżnicowanie,
jak i możliwości izolowania. Omówiono również udział i znaczenie różnych typów KM w procesach naprawy i regeneracji skóry w przewlekłych owrzodze-
niach i oparzeniach.
Słowa kluczowe: komórki macierzyste, CXCR4, SDF-1, naskórek, oparzenia, owrzodzenia
A
BSTRACT
In the last years it is observed a tremendous increase in understanding the biology of stem cells (stem cells, SC) as well as interest to employ these cells
in the clinic. Evidence accumulates that SC participate in regeneration of injured organs and tissues. Epidermis is the richest source of SC which could
be relatively easy isolated. These cells provide new perspectives for treatment of several skin disorders such as for example extensive burns and trophic
ulcers. In this review we will summarize main features of epidermal SC such as their heterogenity, differentiation potential and markers that allow for their
isolation. We also discussed potential application of these cells for skin regeneration and repair of burns and trophic ulcers.
Key words: stem cells, CXCR4, SDF-1, epithelium, burns, trophic ulcers
P
RACE
POGLĄDOWE
/
R
EVIEWS
ARTICLES
Dermatologia Kliniczna 2008, 10 (2): 100-104
Copyright © 2008 Cornetis
www.cornetis.com.pl
ISSN 1730-7201
A
DRES
DO
KORESPONDENCJI
:
Dr n. med. Marzena Staniszewska
d
r n. med. Sylwia Słuczanowska-Głąbowska
Z
akład Fizjologii, Katedra Fizjopatologii PAM
u
l. Powstańców Wielkopolskich 72, 70-111 Szczecin, tel.: +48 091 466 16 11
e-mail: stanma@sci.pam.szczecin.pl, sylwia@sci.pam.szczecin.pl
101
Rola osi SDF-1-CXCR4 w migracji komórek macierzystych
Migracja komórek macierzystych, będąca kluczowym procesem
rozwoju tkanek, jest regulowana przez liczne nakładające się często
mechanizmy regulacji z udziałem czynników wzrostowych, cytokin
i chemokin. Chemokiny po połączeniu z transbłonowym białkiem G,
pełniącym funkcję receptora, regulują ruch i adhezję KM. Zwykle jed-
na chemokina może przyłączać się do wielu receptorów i odwrotnie
– jeden receptor może przyłączać różne chemokiny. Przez wiele lat
uważano, że istnieje jeden wyjątek od tej reguły – taki, iż SDF-1 (stro-
mal derived factor-1, SDF-1) przyłącza się tylko do receptora CXCR4
(13). Ostatnio opisano jednak inny alternatywny receptor CXCR7,
który również może łączyć się z SDF-1 (14).
Wspomniany transbłonowy receptor powiązany z białkiem G, CXCR4
został opisany zarówno w wielu typach tkankowo swoistych KM, np.
tkanki nerwowej, mięśni szkieletowych, serca, wątroby, śródbłonka,
kanalików nerkowych, komórek barwnikowych siatkówki, jak i w em-
brionalnych pluripotencjalnych komórkach macierzystych (pluripo-
tencjalne komórki macierzyste, PKM). Komórki te nie tylko wykazują
ekspresję CXCR4, ale także podążają za gradientem SDF-1. Tak więc,
CXCR4 stanowi marker KM, zaś SDF-1 wydaje się jednym z najbar-
dziej istotnych chemoatraktantów dla komórek macierzystych posia-
dających ekspresję CXCR4 (13, 15, 16).
Ekspresja receptora CXCR4 jest regulowana na wielu pozio-
mach. Jednym z najważniejszych jest niedotlenienie tkanek (hipok-
sja). Zwiększa ono bowiem jego ekspresję (transkrypcję) w komórce
przez aktywację czynnika transkrypcyjnego, jakim jest HIF-1
α
(hy-
poxia – inucible factor 1-alfa). HIF-1
α
współdziała w tym procesie
z NF-
κβ (nuclear factor κβ). Receptor CXCR4 może być również
przedmiotem proteolizy zależnej od np. katepsyny G lub elastazy.
Opisano, że CXCR4 po połączeniu z SDF-1 podlega dimeryzacji, zaś
aktywny kompleks SDF-1–receptor – internalizacji. Funkcjonalność
receptora CXCR4 zależy także od wbudowania go w błonach komór-
kowych do dominant lipidowych (lipid rafts). Receptor CXCR4 może
być również przedmiotem negatywnej regulacji odbywającej się za
pośrednictwem białek regulacyjnych RGS (regulators of G-protein
signaling, RGS). Specyfi czne tkankowo białka RGS mają istotny
wpływ na aktywność receptora w poszczególnych tkankach (13).
Jak wspominano powyżej, SDF-1 odgrywa kluczową rolę w re-
gulowaniu migracji CXCR4+ komórek macierzystych. SDF-1 ulega
ekspresji w komórkach podścieliska i śródbłonka szpiku kostnego,
mięśnia serca, mięśni szkieletowych, wątroby, mózgu i nerek. Jego
wydzielanie zwiększa się podczas uszkodzenia tkanek. Czynnik ten
odgrywa więc ważną rolę w „przyciąganiu” CXCR4+ KM potrzeb-
nych do regeneracji tkanek, czy narządów. Wykazano, że ekspresja
SDF-1 jest regulowana pozytywnie w komórkach endotelium przez
czynnik transkrypcyjny, jakim jest HIF-1
α. Ekspresja SDF-1 może
być zmniejszona pod wpływem leków steroidowych oraz przez takie
czynniki, jak G-CSF (granulocytes colony stimulating factor) i TGF-
β1
(transforming growth factor
β1) (11).
Komórki macierzyste pod względem rozwojowym można także
podzielić na embrionalne i nieembrionalne. Zarodkowe albo embrio-
nalne komórki macierzyste izolowane są zarówno z węzła blastocy-
sty lub z epiblastu zwierząt doświadczalnych, jak i człowieka (17, 18).
Mają one zdolność do różnicowania się we wszystkie rodzaje KM.
Embrionalne komórki macierzyste, jako ustalone linie komórkowe, są
praktycznie nieśmiertelne, co związane jest m.in. z wysoką aktywno-
ścią telomerazy. Różne czynniki środowiska decydują o ich różnico-
waniu w somatyczne KM, np. to, w jakim środowisku (warunkach ho-
dowli) się one znajdują. Migracja ich jest regulowana m.in. przez oś
CXCR4-SDF-1. W warunkach laboratoryjnych, w hodowlach komór-
ki embrionalne mogą być utrzymywane przez nieograniczony czas
w przeciwieństwie do komórek macierzystych ukierunkowanych,
które w hodowli dość szybko się różnicują. Komórki te mogą być
również stosunkowo łatwo modyfi kowane i ukierunkowywane oraz
pozyskiwane do celów regeneracyjnych metodą klonowania tera-
peutycznego. Metoda ta jest jednak jeszcze niedostatecznie pozna-
na i wymaga udoskonalenia, a uzyskanie dużej liczby komórek ukie-
runkowanych tkankowo z komórek embrionalnych nie jest jeszcze
dzisiaj możliwe technicznie. Poza tym występuje jeszcze ważny
aspekt etyczny pobierania i wykorzystania tych komórek, który budzi
wiele kontrowersji (1, 3, 6, 17, 18).
Obecność komórek o cechach embrionalnych
w dorosłych tkankach
Wykazano, że w tkankach znajdują się tkankowo ukierunkowane
komórki macierzyste. KM ukierunkowane tkankowo izolowane z do-
rosłych tkanek mają ograniczone zdolności do różnicowania się oraz
ograniczony czas życia, a w hodowli mogą przejść ograniczoną licz-
bę podziałów. Nie zawsze łatwo je uzyskać w odpowiedniej ilości od
zdrowych dawców zgodnych tkankowo. Ze względu na niewielkie
możliwości do podziałów trzeba je pobierać i izolować w dużej ilości.
Mają również naturalną zdolność do różnicowania w kierunku tkanki,
z której zostały pozyskane. Obecnie z powodzeniem są stosowane
np. KM krwiotworzenia w leczeniu chorób układu krwiotwórczego,
czy też KM naskórka w leczeniu oparzeń skóry (1-3, 6, 17, 19).
Wcześniejsze badania sugerowały, że komórki macierzyste swo-
iste tkankowo wykazują tzw. plastyczność, tzn. że mogą zmieniać
ukierunkowanie tkankowe/narządowe i różnicować się w inne ko-
mórki ukierunkowane tkankowo w zależności od czynników środo-
wiska je otaczającego. Postulowano np., że KM układu krwiotwór-
czego mogłyby dawać początek KM mięśnia sercowego, wątroby,
czy trzustki. Obecnie odchodzi się od takiej koncepcji. Uważa się,
bowiem, że nisze tkankowe zasiedlane są nie tylko przez populacje
komórek ukierunkowanych tkankowo, ale również mogą zawierać
bardzo wczesne komórki pluripotencjalne, które mogą się różnico-
wać w określone tkanki.
Zgodnie z powyższym badania zespołu Kucia i Ratajczaka (15, 16)
potwierdziły obecność w szpiku kostnym i innych tkankach do-
rosłych osobników populacji pluripotencjalnych, bardzo małych,
o typie embrionalnym KM (VSEL). Wykazują one podobieństwo tak
pod względem morfologicznym, jak i immunocytochemicznym do
wczesnych embrionalnych komórek macierzystych. Izolowane np.
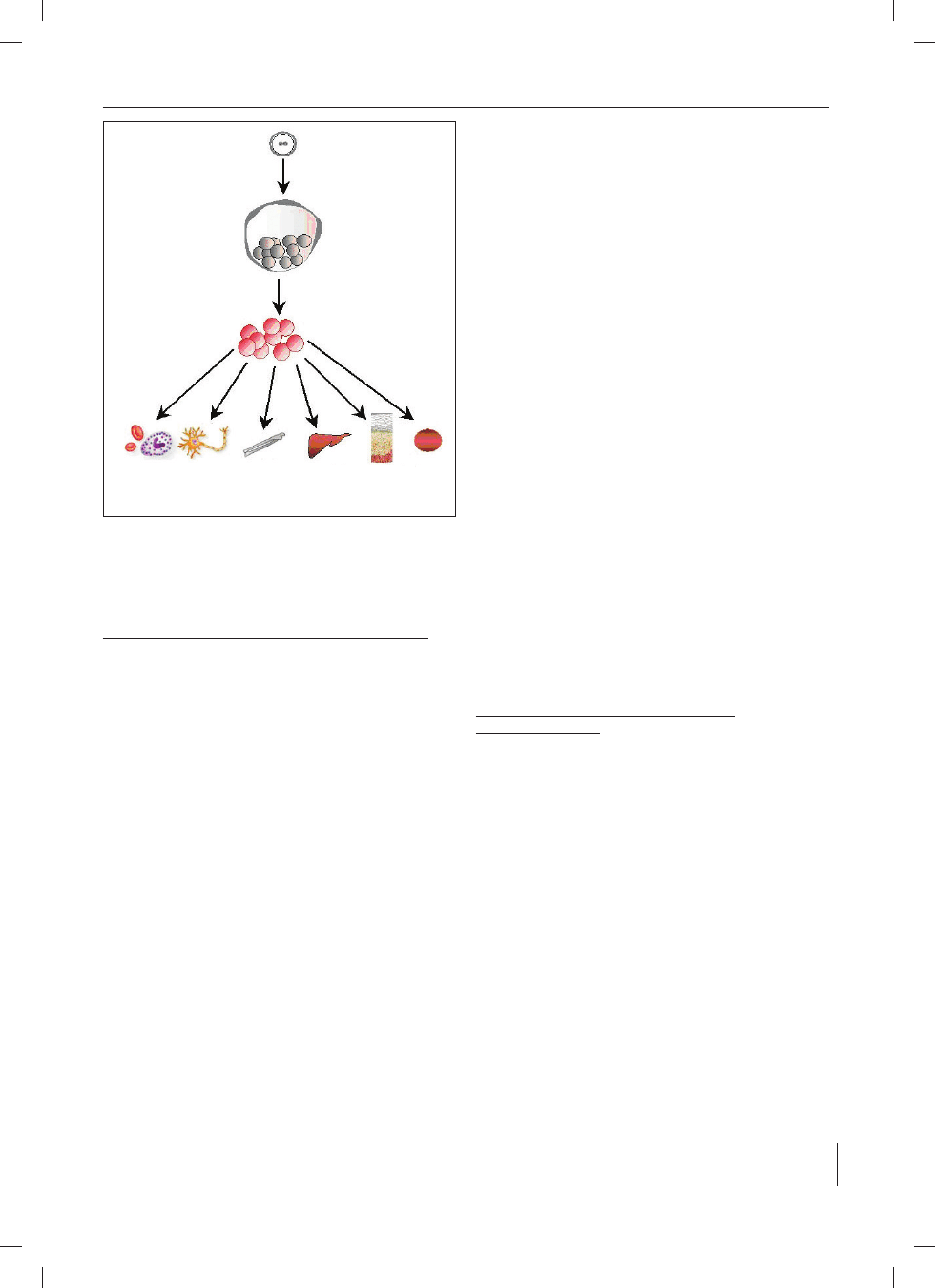
Ryc. 1. Stadia rozwojowe komórek macierzystych. Zygota, komórki pluripoten-
cjalne, komórki multipotencjalne
Fig. 1. Developmental stages of stem cells. Zygote, pluripotential cells, multipo-
tential cells
Krew
Blood
Nerwy
Nerves
Tkanka łączna,
kości, chrząstki
Connective tissue,
bone, cartilage
Wątroba
Liver
Naskórek
Epidermis
Inne
Other
Komórki multipotencjalne
Multipotential stem cells
Komórki pluripotencjalne
Pluripotential stem cells
Zygota
Zygote
Marzena Staniszewska, Sylwia Słuczanowska-Głąbowska
Komórki macierzyste naskórka i ich znaczenie w procesach odnowy
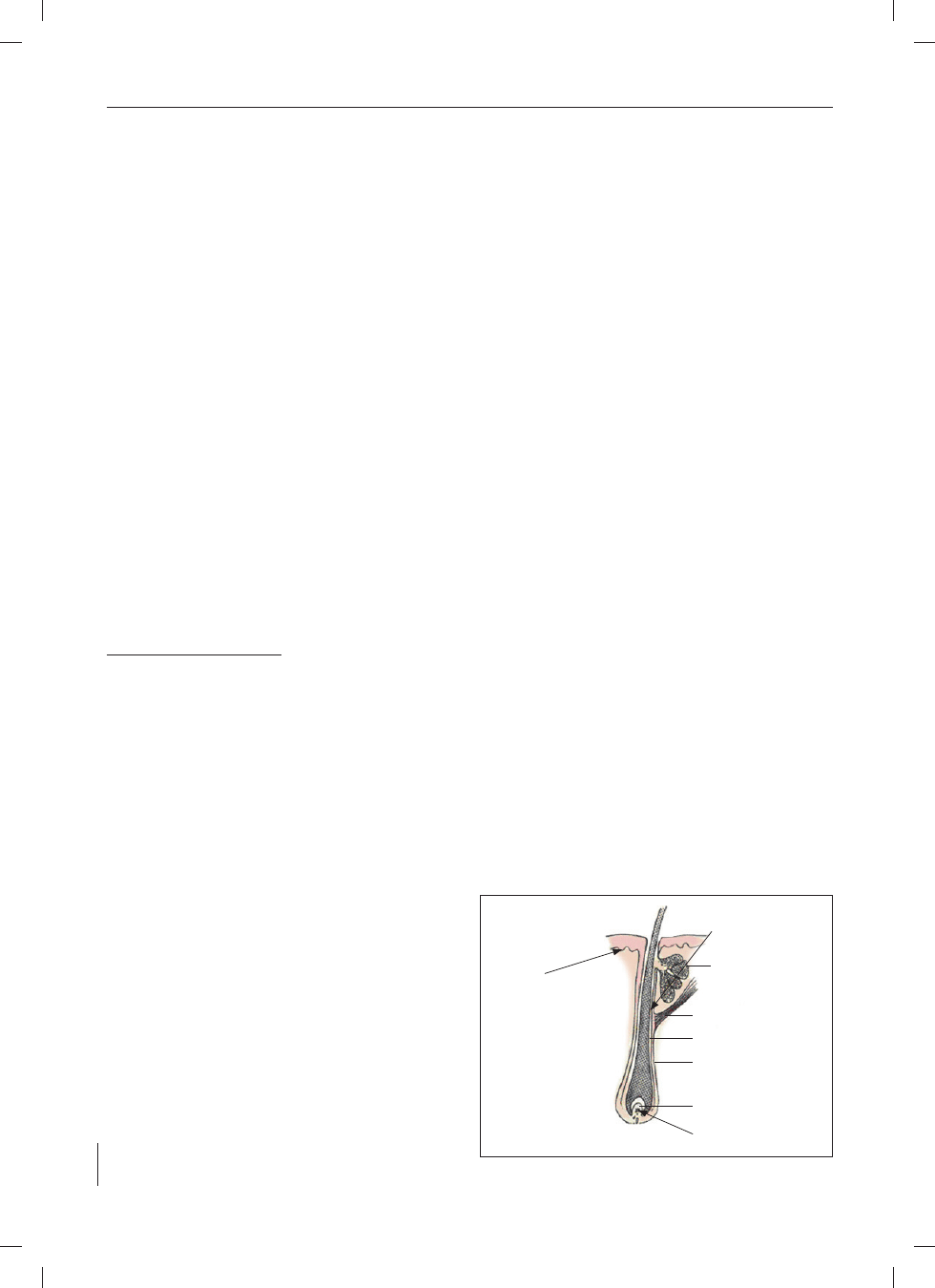
102
ze szpiku kostnego jako homogenna, rzadka linia Sca-1+lin-CD45-
wykazują ekspresję markerów komórek macierzystych pluripoten-
cjalnych, takich jak: SSEA-1, Oct-4, Nanog i Rex-1. Komórki te są
także wzbogacone w mRNA charakterystyczne dla naskórka, takie
jak: Trp63, Krt2-5, BNC (15, 16, 20). Komórki VSEL były prawdopo-
dobnie identyfi kowane przez innych badaczy jako komórki linii za-
rodkowej Oct4+ oraz nieepitelialne niemelanocytowe komórki Oct4+
Nanog+ w obrębie naskórka (10, 11, 21).
Bezpośrednie badania w mikroskopie elektronowym wykazują, że
są to komórki małe, wielkości ok. 5
μ
m
, z dużym jądrem wypełnio-
nym euchromatyną, otoczonym wąskim rąbkiem cytoplazmy. In vitro
wykazują zdolność do różnicowania się we wszystkie trzy listki za-
rodkowe. Na powierzchni ich występuje receptor CXCR4+ odpowia-
dający na gradient stężeń SDF-1. Komórki te izolowane są ze szpiku
jako CXCR4+lin-CD45-, zaś ze szpiku, krwi obwodowej i pępowino-
wej jako CD34+CD133+CXCR4+lin-CD45-. Ich liczba jest większa
u osobników młodych i zmniejsza się z wiekiem. VSEL są depono-
wane w szpiku kostnym oraz różnych narządach/tkankach w czasie
ontogenezy i podlegają mobilizacji w czasie uszkodzenia narządów
i tkanek w celu regeneracji uszkodzeń (12, 15, 16, 20).
Jak wspomniano powyżej, Dyce i wsp. (10) wykazali, że wśród
komórek macierzystych izolowanych ze skóry występuje również
populacja mająca możliwości różnicowania się w oocytopodobne
komórki posiadające ekspresję Oct4 oraz innych markerów charak-
terystycznych dla oocytów. Ich obecność w skórze można tłumaczyć
wspomnianym powyżej zasiedlaniem w życiu płodowym nisz poza-
gonadalnych przez migrujące komórki epiblastu – w tym wypadku
PGC. Alternatywne pozyskiwanie oocytopodobnych komórek ze
skóry może potencjalnie stwarzać nowe możliwości wykorzystania
ich w terapii tkankowej i stanowi nowy model do badań in vitro nad
komórkami linii germinalnej (10, 11). Dalszych badań wymaga zbada-
nie związku tych komórek z populacją komórek VSEL.
Komórki macierzyste naskórka
Naturalną właściwością naskórka jest jego rogowacenie i złusz-
czanie. Jest to tkanka stale się odnawiająca. Proces ten jest zależny
od subpopulacji ukierunkowanych tkankowo komórek macierzystych
występujących w warstwie podstawnej naskórka. W prawidłowym na-
skórku KM stanowią 1-10% komórek warstwy podstawnej (6, 22-27).
Uważa się, że skóra jest najbogatszym w KM narządem ustroju.
Komórki macierzyste naskórka ulegają podziałom asymetrycznym.
Prowadzi to, z jednej strony, do samoodnawiania puli KM naskórka,
a z drugiej – do tworzenia komórek siostrzanych: namnażających się
przejściowo (transient amplifyng cells, TAC), które przechodzą skoń-
czoną liczbę podziałów i ostatecznie się różnicują. In vitro proces ten
przebiega bardzo szybko. Odróżnienie tych dwóch typów komórek
jest trudne. Wydaje się, że pomocna może być tutaj identyfi kacja
receptora CD71 obecnego na TAC i jego brak na ukierunkowanych
tkankowo KM naskórka. Z kolei identyfi kacja antygenu CD90 jest
użyteczna do określania populacji keratynocytów wzbogaconych
w komórki macierzyste.
Komórki macierzyste naskórka stanowią niejednorodną popula-
cję ze względu na miejsce występowania. Identyfi kuje się je w prze-
działach międzymieszkowych, w górnym rejonie mieszka włosowego
(bulge) i w macierzy germinalnej mieszka włosowego (22) (ryc. 2).
Komórki międzymieszkowe ściśle przylegają do błony podstawnej
naskórka. Wykazują właściwości komórek macierzystych somatycz-
nych. Wolny cykl komórkowy zabezpiecza je przed gromadzeniem
mutacji, zaś długi czas życia i zdolność do namnażania gwarantuje
utrzymanie i naprawę tkanki, w której rezydują. Końcowe różnicowa-
nie ich w keratynocyty związane jest z utratą kontaktu z błoną pod-
stawną i odnową naskórka (26-28).
Subpopulacja komórek występujących w górnym rejonie mieszka
włosowego (bulge) jest wskazywana jako ta, która może dać począ-
tek zarówno keratynocytom skóry, jak i mieszka włosowego. Stanowi
ona największą rezerwę komórek macierzystych zdolnych do odtwa-
rzania wielu struktur skóry, m.in. mieszków włosowych, gruczołów
łojowych (6, 29, 30). Na uwagę zasługuje doniesienie Yu i wsp. (21),
którzy wykazali, że w obrębie mieszka włosowego występuje również
populacja komórek innych niż naskórkowe KM, czy melanocytowe
KM, które wykazują ekspresję markerów Oct4 i Nanog. Jest praw-
dopodobne, że jest to frakcja komórek odpowiadająca komórkom
VSEL identyfi kowanym w szpiku kostnym. Tak więc, gromadzi się
coraz więcej danych, że naskórek zawiera heterogenną populację
komórek macierzystych o różnym stopniu zróżnicowania.
Komórki rejonu bulge wykazują duży potencjał proliferacyjny,
choć w naskórku pozostają w stanie uśpienia (quiescent) ze względu
na wydłużony cykl komórkowy. Hodowane in vitro zachowują swoją
zdolność do namnażania się. Uważa się, że rejon bulge funkcjonuje
jako nisza, w której KM są zlokalizowane i utrzymywane. Pula KM
mieszkowych daje początek komórkom siostrzanym, które – migru-
jąc do góry mieszka włosowego – służą jako progenitorowe komórki
naskórka w rekonstrukcji ran – lub w dół mieszka włosowego – prze-
mieniając się w komórki macierzy włosa. Zidentyfi kowany marker
KM międzymieszkowych naskórka CD34 pozwala na odróżnienie
ich od komórek bulge, które nie posiadają tego markera (22, 25,
29, 31, 32).
Komórki bulge mają większy potencjał do odnowy, charaktery-
zuje je dłuższy cykl komórkowy i największy potencjał klonogenny,
w przeciwieństwie do międzymieszkowych KM, dla których nie moż-
na zidentyfi kować niszy (25). Populacja KM bulge różnicuje się w ke-
ratynocyty, melanocyty, komórki mięśni gładkich i komórki nerwowe
w zależności od użytego medium indukcyjnego, specyfi cznego dla
danej tkanki. Komórki te wykazują ekspresję markerów embrional-
nych Oct4 i Nanog (21).
W hodowli in vitro komórki warstwy podstawnej naskórka dają po-
czątek klonom komórkowym opisanym w literaturze jako tzw. holo-
klony, meroklony i paraklony. Holoklony tworzone są przez właściwe
komórki macierzyste naskórka, zaś paraklony – komórki przejściowo
namnażające się. Meroklony z kolei tworzy pośredni typ komórek
stanowiący rezerwuar TAC. Różnicowanie komórek klonogennych
przebiega od holoklonów przez meroklony do paraklonów (22).
Komórki macierzyste naskórka charakteryzują się wysoką ekspre-
sją
β1 i
α
6 integryn, czynnika traskrypcyjnego p63 i delta-1, a także
dużą ekspresją
β-kateniny cytoplazmatycznej w stosunku do związa-
nej z kadherynami błon komórkowych oraz podwyższoną ekspresją
cytokeratyny 15 i 19 (22, 25, 29). Yu i wsp. (21) w badaniach immuno-
histochemicznych wykazali obecność cytokeratyny 15 w rejonie bulge
mieszka włosowego oraz ekspresję markerów Oct4 i Nanog w tej
lokalizacji. Świadczy to o tym, że komórki Oct4+, Nanog+ obecne
są w bulge. Wspomniane powyżej komórki pozyskiwane z mieszka
włosowego mogą stanowić ważne źródło autologicznych KM dla
procesów naprawczych tkanek.
Ryc. 2. Lokalizacja komórek macierzystych (komórki macierzyste, KM) w skórze
Fig. 2. Localization of stem cells (stem cell, SC) in skin
Brodawka włosa
Dermal papila
Zewnętrzny płaszcz korzenia włosa
External root sheat
Wewnętrzny płaszcz korzenia włosa
Internal root sheath
Mięsień włosowy
Pili muscle
Gruczoł łojowy
Sebaceus gland
Rejon bulge
Region bulge
KM przedziału międzykomórkowego
SC of intercellular compartment
Macierz terminalna włosa
Hair follicle matrix
Marzena Staniszewska, Sylwia Słuczanowska-Głąbowska
Epidermal stem cells and their role in regeneration
Dermatologia Kliniczna 2008, 10 (2)

103
Stwierdzono, że integryna
β1 i
α
6 występują we wszystkich ko-
mórkach warstwy rozrodczej naskórka. Opuszczanie warstwy pod-
stawnej i stopniowa migracja w kierunku powierzchownych warstw
wiąże się ze spadkiem ekspresji
β1-integryny. Frakcja wykazująca
największą ekspresję tej integryny jest wzbogacona w KM, które też
najszybciej przylegają do podłoża pokrytego kolagenem IV lub lami-
niną. Podobnie czynnik transkrypcyjny p63 ulega ekspresji w jądrach
komórek dzielących się lub zachowujących zdolność proliferacyjną.
W trakcie różnicowania drastycznie spada poziom ekspresji tego
białka. Tak więc, integryna
β1, czynnik p63 oraz inne markery ww.
mogą być przydatne w identyfi kacji KM naskórka. Melanocyty obfi -
cie występujące w koloniach nie posiadają ekspresji białka p63, zaś
z hodowli mogą być usuwane przez marker c-kit. Do identyfi kacji
KM naskórka można też używać barwnika metabolicznego rodami-
ny 123, który jest słabo przez nie gromadzony. Sortowanie według
Rh123 – i
β1-integryny + komórek naskórka daje frakcję wzbogaconą
w KM, w hodowli tworzącą holoklony (22, 25, 29, 32).
Proliferacja KM naskórka zależy od czynników wzrostowych pro-
dukowanych przez fi broblasty skóry. Należą do nich czynnik wzro-
stowy fi broblastów FGF-4 (fi broblast growth factor), keratynocytów
KGF (keratinocytes growth factor), naskórkowy EGF (epidermal
growth factor), wątrobowy HGF (hepatocyte growth factor); także cy-
tokiny IL-6 i onkostatyna M (22, 25, 29, 32).
Wykorzystanie komórek macierzystych naskórka
Komórki macierzyste naskórka otwierają nowe perspektywy w le-
czeniu różnych zaburzeń występujących w skórze, takich jak ciężkie
oparzenia, przewlekłe owrzodzenia trofi czne, rak skóry, łysienie, czy
trądzik (4-6, 25, 28).
Mieszkowe i międzymieszkowe przedziały naskórka utrzymywane
są przez niezależne populacje KM. Po uszkodzeniu naskórka komór-
ki te werbowane są do jego naprawy. Na przykład, w powierzchow-
nych oparzeniach, w których dochodzi do uszkodzenia naskórka
i pozbawienia go międzymieszkowych KM, przy obecności miesz-
ków włosowych, nie jest wymagane używanie przeszczepów, ponie-
waż naskórek odtwarzany jest przez komórki macierzyste występu-
jące w bulge. Uważa się, że komórki mieszkowe tylko tymczasowo
uczestniczą w pokrywaniu rany i są zastępowane przez komórki
potomne naskórka. Okazuje się jednak, że mogą one pozostawać
w naskórku znacznie dłużej (33). Po głębokich oparzeniach przebie-
gających z uszkodzeniem mieszka, naskórek może być odtworzony
tylko przez komórki migrujące z brzegów nieuszkodzonych płatów
skórnych (34).
Procesy naprawcze w obrębie owrzodzeń także zależą od komó-
rek naskórkowych sąsiadujących z miejscem uszkodzenia. U osób
zdrowych keratynocyty skórne nie poruszają się, ale zmieniają po-
zycję w pionie będąc popychane przez odnawiające się komórki
warstwy podstawnej i różnicują się w korneocyty. W uszkodzonej
skórze wykazują migrację boczną i przy gojeniu ran pokrywają ich
powierzchnię.
Limat i wsp. (4) pobierali i hodowali autologiczne keratynocyty
z okolicy zewnętrznych warstw mieszka włosowego. Namnożone ke-
ratynocyty były nakładane na rozległe owrzodzenia kończyn dolnych.
Im większa powierzchnia owrzodzenia była pokryta, tym szybciej na-
stępowała reepitalizacja i tym była większa. Po 8 tygodniach reepi-
talizacja u pacjentów była znaczna, a u 1/3 pacjentów – całkowita.
Pacjenci zgłaszali mniejszą bolesność, nie obserwowano żadnych
skutków ubocznych tego leczenia.
Drukała i wsp. (5) stosowali w badaniach autologiczne przeszcze-
py keratynocytów i obserwowali obraz ich migracji w pierwotnej kul-
turze na polistyrenie, zaś we wtórnej na podłożu kolagenu IV i fi bry-
ny. Komórki wykazywały odległą migrację na podłożu kolagenowym
i fi brynowym, choć zdecydowanie szybszą w zawiesinie fi bryny niż
kolagenu. Transplantacje już po 5 dniach dawały powstawanie wysp
z namnażających się keratynocytów. Towarzyszyło temu ograni-
czenie bólu i wydzielania w obrębie rany. Zastosowanie drobnych
przeszczepów może zatem przyspieszać proces naskórkowania,
podobnie jak wykorzystanie zawiesiny keratynocytów. Nie obserwuje
się tego efektu w przypadku przeszczepów w postaci jednorodnej
warstwy komórek naskórka, gdzie zjawisko migracji dotyczy tylko
brzegów kultury. Dodatkowo in vivo proces leczenia wymaga wzro-
stu fi broblastów i tworzenia kolagenu, co może być stymulowane
przez obecność fi bryny.
Postuluje się również udział w procesach regeneracji komórek
macierzystych uwalnianych ze szpiku kostnego oraz innych niszy
tkankowych (2, 19, 35). Ich mobilizacja zależy od czynników wy-
dzielanych przez uszkodzone tkanki. Jak już wcześniej wspomnia-
no, wśród dużej grupy tych związków kluczową rolę odgrywa oś
CXCR4–SDF -1. Dzięki temu KM mogą uczestniczyć w regeneracji
uszkodzonych narządów.
Przy zachowanej homeostazie skóry keratynocyty pochodzenia
szpikowego nie są jednak wykrywane w naskórku. Jak wykazali Fan
i wsp. (36) w uszkodzonej skórze naskórek zawierał tylko nieliczne
szpikowe keratynocyty. Może to sugerować, że komórki szpikowe
nie są odpowiedzialne za odnawianie keratynocytów w naskórku
w warunkach normalnej odnowy. W warunkach uszkodzenia naskór-
ka stwierdzono jednak zasiedlenie nowo tworzonego naskórka przez
komórki szpikowe. Sugeruje to, że komórki szpikowe uczestniczą we
wczesnym leczeniu rany przez wszczepienie jako TAC, które następnie
różnicują się w keratynocyty. Borue i wsp. (37) wykazali, że po napro-
mieniowaniu śmiertelną dawką myszy, odtworzeniu szpiku na drodze
przeszczepu, a następnie uszkodzeniu naskórka, w leczeniu powstałej
w ten sposób rany uczestniczyły komórki pochodzenia szpikowego,
a ekspresja antygenu proliferacyjnego Ki67 korelowała ze zwiększo-
ną liczbą komórek dawcy w ranie. Ekspresja cytokeratyny 5 komórek
dawcy była niewielka, co sugeruje, że komórki szpikowe wszczepiały
się nie jako naskórkowe KM, ale raczej asystowały w początkowej fazie
leczenia jako TAC, różnicujące się następnie w keratynocyty (35, 37).
Niewykluczone, że komórki szpikowe przedstawione w powyższej
pracy są migrującymi VSEL; wymaga to dalszych badań.
Według Inokuma i wsp. (38) największym chemoatraktantem dla
migracji komórek macierzystych naskórka pochodzenia szpikowe-
go do skóry jest CTACK (cutaneous T-cell attracting chemokine,
CTACK). Jest on obecny konstytucyjnie w naskórku, a jego ekspresja
zwiększa się w ranach. Komórki szpikowe CD34+ wykazują ekspre-
sję jego liganda CCL27.
Ostatnie badania wykazały, że komórki szpikowe mogą być wszcze-
piane do naskórka nie jako komórki macierzyste, ale jako TCA, co pot-
wierdza wcześniejsze spostrzeżenia. Tak więc, komórki szpikowe
mogą budować prowizoryczną warstwę naskórka, która później
zastępowana jest przez keratynocyty migrujące z nieuszkodzonej
skóry. Być może po uszkodzeniu migracja odbywa się dzięki pro-
zapalnym cytokinom. Zasiedlanie uwarunkowane jest przez CTACK
wydzielaną przez keratynocyty. W ranach przewlekłych migracja ko-
mórek macierzystych naskórka pochodzenia szpikowego może być
upośledzona przez blokowanie osi CTACK/CCL27. Hamowanie osi
przez PSGL-1 (P-selectin glycoprotein ligand-1, PSGL-1) wydzielaną
przez neutrofi le obecne licznie w ognisku zapalnym może opóźniać
leczenia przewlekłych ran (39), co potwierdza wcześniejsze doniesie-
nia o istnieniu tej osi dla chemotaksji.
Z drugiej strony wykazano, że bezpośrednia transplantacja ko-
mórek szpikowych na uszkodzoną skórę powoduje różnicowanie ich
w niehematopoetyczne struktury skóry (40). Według badań Krause
i wsp. (7) wzbogacona populacja macierzystych komórek hemato-
poetycznych pochodzenia szpikowego może być włączona do tkan-
ki i w niej funkcjonować. Rzadkie komórki przebywające w szpiku
mogą tworzyć długo utrzymywaną populację komórek macierzystych
o ogromnych zdolnościach różnicowania, również w komórki skóry.
Interesujący wydaje się ewentualny związek omawianych komórek
z komórkami VSEL.
Badiavas i wsp. (8) wykazali, że u ludzi z niegojącymi się ranami
bezpośrednie zaaplikowanie na powierzchnię komórek szpikowych
może prowadzić do zamknięcia rany i odtworzenia tkanki. Wynik ba-
dania sugeruje wszczepienie podawanych komórek, co potwierdzo-
no przez badanie bioptatów.
Marzena Staniszewska, Sylwia Słuczanowska-Głąbowska
Komórki macierzyste naskórka i ich znaczenie w procesach odnowy
104
W badaniach Kataoka i wsp. (9) transplantowali komórki szpiko-
we myszy na osobniki z defektem skóry. Po 3 tygodniach uzyskali
odbudowę skóry wraz z przydatkami. Komórki dawcy zlokalizowa-
no w naskórku, mieszku włosowym, gruczołach łojowych i w skórze
właściwej. Lokalizacja i morfologia tych komórek, badanie immu-
nohistochemiczne i barwienia potwierdziły różnicowanie komórek
szpikowych w keratynocyty, komórki gruczołów łojowych i komórki
mieszka włosowego.
Odkąd poznano, że oś SDF-1-CXCR4 jest istotnym regulatorem
przemieszczania KM, stała się ona docelowym elementem terapeu-
tycznych poszukiwań. Dowiedziono, że ekspresja CXCR4 może być
zahamowana na poziomie transkrypcji przez HIF-1
α
po podaniu che-
taminy, na poziomie translacji przez siRNA i na poziomie receptora
białkowego, jakim jest CXCR4 przez T140 lub AMD 3100. Blokada
tworzenia dominant lipidowych przez np. statyny hamuje odpowiedź
komórek na gradient SDF-1. Interesujące jest, że promotory genów
kodujących receptor CXCR4 zawierają miejsca wiązania dla HIF-1
α
.
Warunki takie, jak przewlekłe zapalenie lub uszkodzenie tkanki, stwa-
rzają środowisko, które na drodze chemotaktycznej przyciąga KM
dla regeneracji (16).
Potencjalne zastosowanie kliniczne KM naskórka ze względu na
stosunkowo łatwe możliwości ich pozyskiwania stwarza nowe nadzie-
je w leczeniu nie tylko chorób i uszkodzeń skóry, ale także – biorąc pod
uwagę, że naskórek zawiera również inne bardzo wczesne komórki
macierzyste posiadające markery KM pluripotencjalnych (np. Oct-4)
– wskazuje na to, że mogą one stanowić potencjalne źródło KM także
w regeneracji innych narządów. Najbliższe lata pokażą, czy komórki te
znajdą szersze zastosowanie w medycynie regeneracyjnej.
Piśmiennictwo
1. Ratajczak M.Z., Kucia M.: Komórki macierzyste – wyzwanie XXI wieku? Post. Biol.
Komórki, 2005, 32, 11-26.
2. Dłubek D., Witkiewicz W., Lange A.: Szpikowe komórki macierzyste – identyfi kacja
i zastosowanie kliniczne. Post. Biol. Komórki, 2005, 32, 125-131.
3. Ratajczak M.Z., Goździk J.: Komórki macierzyste – klucz do długowieczności. Medy-
cyna po Dyplomie, 2004, 13, 16-25.
4. Limat A., French L.E., Blal L., Saurat J.H., Hunziker T., Salomon D.: Organotypic cul-
tures of autologus hair follicle keratinocytes for the treatment of recurrent leg ulcers.
J. Am. Acad. Dermatol., 2003, 48, 207-214.
5. Drukała J., Bandura L., Cieślik K., Korohoda W.: Locomotion of human skin keratino-
cytes on polystyrena, fi brin, and collagen substrata and its modifi cation by cell-to-cell
contacts. Cell Transplant., 2001, 10, 765-771.
6. Cha J., Falanga V.: Stem cells in cutaneous wound healing. Clin. Dermatol., 2007, 25,
73-78.
7. Krause D.S., Theise N.D., Collector M.I., Henegariu O., Hwang S., Gardner R., Neut-
zel S., Sharkis S.J.: Multi-organ, multi-lineage engrafment by a single bone mar-
row-derived stem cells. Cell, 2001, 105, 367-377.
8. Badiavas E.V., Falanga V.: Treatment of chronic wounds with bone marrow-derived
cells. Arch. Dermatol., 2003, 139, 510-516.
9. Kataoka K., Medina R.J., Kageyama T., Miyazaki M., Yoshino T., Makino T., Huh N.H.:
Participation of adult mouse bone marrow cells in reconstitution of skin. Am. J. Pathol.,
2003, 163, 1227-1231.
10. Dyce PW., Wen L., Li J.: In vitro germline potential of stem cells derived from fetal
porcine skin. Nat. Cell Biol., 2006, 8, 384-390.
11. Scholer H.R., Wu G.: Oocytes originating from skin? Nat. Cell Biol., 2006, 8, 313-314.
12. Kucia M., Machaliński B., Ratajczak M.Z.: The developmental deposition of epiblast/
germ cell-line derived cells in various organs as a hypothetical explantation of stem
cell plasticity? Acta Neurobiol. Exp., 2006, 66, 331-341.
13. Ratajczak M.Z., Zuba-Surma E., Kucia M., Rece R., Wojakowski W., Ratajczak J.: The
pleotropic effect of the SDF-1-CXCR4 axis in organogenesis, regeneration and tumo-
rigenesis. Leukemia, 2006, 20, 1915-1924.
14. Valentin G., Haas P., Gilmour D.: The chemokine SDF-1a coordinates tissue migration
through the spatially restricted activation of CXCR7 and CXCR4b. Curr. Biol., 2007, 17,
1026-1031.
15. Kucia M., Zuba-Surma E., Wysoczyński M., Dobrowolska H., Reca R., Ratajczak J.,
Ratajczak M.Z.: Physiological and pathological consequences of identifi cation of very
small embryonic like (VSEL) stem cells in adult bone marrow. J. Physiol. Pharmacol.,
2006, 57, 5-18.
16. Kucia M., Ratajczak M.Z.: Stem cells as a two edged sword – from regeneration to
tumor formation. J. Physiol. Pharmacol., 2006, 57, 5-16.
17. Snarski E., Jędrzejczak W.W.: Zarodkowe komórki macierzyste i możliwości ich wyko-
rzystania w medycynie. Post. Biol. Komórki, 2005, 32, 41-53.
18. Thomson J.A., Itskovitz-Eldor J., Shapiro S.S., Waknitz M.A., Swiergiel J.J., Marshall
V.S., Jones J.M.: Embryonic stem cell lines derived from human blastocysts. Science,
1998, 282, 1145-1147.
19. Kucia M., Majka M., Ratajczak M.Z.: Plastyczność nieembrionalnych komórek macie-
rzystych:fakt czy artefakt? Post. Biol. Komórki, 2003, 30, 3-15.
20. Kucia M., Reca R., Campbell F.R., Zuba-Surma E., Majka M., Ratajczak J., Ratajczak M.Z.:
A population of very small embryonic-like (VSEL) CXCR4(+)SSEA-1(+)Oct-4(+) stem cells
identifi ed in adult bone marrow. Leukemia, 2006, 20, 857-869.
21. Yu H., Fang D., Kumar S.M., Li L., Nguyen T.K., Acs G., Herlyn M., Xu X.: Isolation of no-
vel population of multipotent adult stem cells from human hair follicles. Am. J. Pathol.,
2006, 168, 1879-1888.
22. Drukała J., Majka M., Ratajczak M.: Postępy w metodach izolacji i namnażania komó-
rek macierzystych naskórka ludzkiego. Post. Biol. Komórki, 2003, 30, 37-48.
23. Tani H., Morris R.J., Kaur P.: Enrichment for murine keratinocyte stem cells based on
cell surface phenotype. Proc. Natl. Acad. Sci. USA, 2000, 97, 10960-10965.
24. Nakamura Y., Muguruma Y., Yahata T., Miyatake H., Sakai D., Mochida J., Hotta T., Ando
K.: Expression of CD90 on keratinocyte stem/progenitor cells. Br. J. Dermatol., 2006,
154, 1062-1070.
25. Barthel R., Aberdam D.: Epidermal stem cells. J. Eur. Acad. Dermatol. Venereol., 2005,
19, 405-413.
26. Lehrer M.S., Sun T.T., Lavker R.M.: Strategies of epithelial repair: modulation of stem
cell and transit amplifying cell proliferation. J. Cell. Sci., 1998, 111, 2867-2875.
27. Lavker RM., Sun T.T.: Epidermal stem cells: properties, markers and location. Proc.
Natl. Acad. Sci. USA, 2000, 97, 13473-13475.
28. Roh C., Lyle S.: Cutaneous stem cells and wound healing. Pediatr. Res., 2006, 59,
100R-103R.
29. Taylor G., Lehrer M.S., Jensen P.J., Sun T.T., Lavker R.M.: Involvement of follicular stem
cells in forming not only the follicle but also the epidermis. Cell, 2000, 102, 451-461.
30. Oshima H., Rochat A., Kedzia C., Kobayashi K., Barrandon Y.: Morphogenesis and rene-
val of hair follicles from adult multipotent stem cells. Cell, 2001, 104, 233-245.
31. Linheng Li., Ting X.: Stem cell niche: structure and function. Annu. Rev. Cell Dev. Biol.,
2005, 21, 605-631.
32. Tumbar T., Guasch G., Greco V., Blanpain C., Lowry W.E., Rendl M., Fuchs E.: Defi ning
the epithelial stem cell niche in skin. Science, 2004, 303, 359-363.
33. Levy V., Lindon C., Zheng Y., Harfe B.D., Morgan B.A.: Epidermal stem cells arise from
the hair follicle after wouding. FASEB J., 2007, 21, 1358-1366.
34. Alonso L., Fuchs E.: Stem cells of the skin epithelium. Proc. Natl. Acad. Sci. USA, 2003,
100, 11830-11835.
35. Kucia M., Goździk J., Ratajczak M.Z.: Szpik kostny jako źródło krążących CXCR4+
ukierunkowanych tkankowo komórek macierzystych. Post. Biol. Komórki, 2005, 32,
59-78.
36. Fan Q., Yee C.L., Ohyama M., Tock C., Zhang G., Darling T.N., Vogel J.C.: Bone mar-
row-derived keratinocytes are not detected in normal skin and only rarely detected in
wounded skin in two different murine models. Exp. Hematol., 2006, 34, 672-679.
37. Borue X., Lee S., Grove J., Herzog E.L., Harris R., Difl o T., Glusac E., Hyman K., Theise
N.D., Krause D.S.: Bone marrow-derived cells contribute to epithelial engraftment du-
ring wound healing. Am. J. Pathol., 2004, 165, 1767-1772.
38. Inokuma D., Abe R., Fujita Y., Sasaki M., Shibaki A., Nakamura H., McMillan JR., Shi-
mizu T., Shimizu H.: CTACK/CCL27 accelerates skin regeneration via accumulation of
bone marrow-derived keratinocytes. Stem Cells, 2006, 24, 2810-2816.
39. Simka M.: Delayed healing of chronic leg ulcers can result from impaired traffi cking of
bone marrow-derived precursors of keratinocytes to the skin. Med. Hypotheses, 2007,
69, 637-641.
40. Badiavas E.V., Abedi M., Butmarc J., Falanga V., Quesenberry P.: Participation of
bone marrow derived cells in cutaneous wound healing. J. Cell. Physiol., 2003, 196,
369-377.
Marzena Staniszewska, Sylwia Słuczanowska-Głąbowska
Epidermal stem cells and their role in regeneration
Dermatologia Kliniczna 2008, 10 (2)
Wyszukiwarka
Podobne podstrony:
PROGRAM BUDOWY DK 2008 2012
Puszki odgałęźne DK (2008)
Zobowiązania, ART 516 KC, I CSK 100/08 - wyrok z dnia 17 października 2008 r
Patomorfologia - gielda- 2008 inne roczniki, 4 rok, patomorfologia, gielda na 100%, Giełda, egzamin,
100 101 1007 pol ed01 2008
SCHEMAT GEDA PRIMOLIFT 150, 100 000 070B rok 2008
99 100 407 pol ed02 2008
100 101 206 pol ed01 2008
20 Phys Rev Lett 100 016602 2008
100 101 407c pol ed01 2008
100 308blsw pol ed02 2008
BWE08100 PWFY 100 200VM AU BU Parts Sep 2008
100 207 pol ed02 2008
Ubytki,niepr,poch poł(16 01 2008)
2008 XIIbid 26568 ppt
Tamponada serca, Karpacz, 2008
Bliźniuk G , interoperacyjność przegląd, marzec 2008
więcej podobnych podstron