
Medycyna Wet. 2007, 63 (3)
261
Artyku³ przegl¹dowy
Review
Naturalne ród³o wielu leków stanowi¹ krew oraz
tkanki cz³owieka. Pozyskiwanie farmaceutyków z or-
ganizmu cz³owieka niesie jednak ze sob¹ ryzyko zaka-
¿enia patogenami. W 1985 r. odkryto zwi¹zek pomiê-
dzy stosowanym w leczeniu kar³owatoci hormonem
wzrostu, oczyszczanym z przysadki mózgowej cz³owie-
ka a wystêpowaniem choroby Creutzfeldta-Jacoba.
Mimo ¿e dawcy s¹ obecnie szczegó³owo badani, a pre-
paraty poddaje siê rutynowo procedurom inaktywuj¹-
cym wirusy, zagro¿enie ze strony niektórych patogenów
nadal wystêpuje. Powa¿nym ograniczeniem pozyskiwa-
nia farmaceutyków bezporednio od dawców jest wy-
stêpowanie terapeutycznych bia³ek w bardzo ma³ych
ilociach, co utrudnia izolacjê i podnosi koszty produk-
cji. Wysoka cena wyklucza lub bardzo ogranicza mo¿li-
woæ stosowania ich jako leków.
Dwa odkrycia z po³owy lat 70. pozwoli³y na uzyski-
wanie biofarmaceutyków wytwarzanych przez organizm
cz³owieka. Technologia komórek hybrydoma umo¿li-
wia produkcjê przeciwcia³ monoklonalnych, a in¿ynie-
ria genetyczna produkcjê okrelonych bia³ek. Techniki
in¿ynierii genetycznej stosowane do celów biotechno-
logicznych umo¿liwiaj¹ izolacjê, charakterystykê oraz
modyfikacjê okrelonych genów. Do ich rozwoju przy-
czyni³o siê odkrycie restryktaz i ligaz enzymów nie-
zbêdnych do klonowania DNA. Enzymy restrykcyjne
hydrolizuj¹ DNA ka¿dego organizmu na powtarzalny
uk³ad fragmentów. Ligazy mog¹ natomiast trwale ³¹czyæ
fragmenty DNA z samoreplikuj¹cymi cz¹steczkami
DNA wektorami. Uzyskany w ten sposób rekombino-
wany DNA mo¿e byæ wprowadzany do komórek gos-
podarza najczêciej komórek bakterii, ale równie czês-
to stosuje siê komórki dro¿d¿y, owadów czy ssaków.
Techniki in¿ynierii genetycznej umo¿liwi³y równie¿ wpro-
wadzanie precyzyjnych zmian w sekwencji aminokwa-
sowej bia³ka w celu modyfikacji jego w³aciwoci.
Era biofarmaceutyków rozpoczê³a siê od pojawienia
siê na rynku w 1982 r. pierwszego produktu nowoczes-
nej biotechnologii rekombinowanej insuliny. W 2004 r.
w Stanach Zjednoczonych i Unii Europejskiej zarejes-
trowano ju¿ 160 biofarmaceutyków, a ponad 500 prze-
chodzi³o próby kliniczne. Wartoæ rynkowa produko-
wanych biofarmaceutyków osi¹gnê³a 34 mld dolarów,
a z ich terapeutrycznych w³aciwoci skorzysta³o 250 mln
pacjentów. Ronie równie¿ udzia³ biofarmaceutyków
w ogólnej puli produkowanych lekarstw. W latach 90.
w Stanach Zjednoczonych zarejestrowano 370 nowych
leków, wród których 49 (13%) stanowi³y biofarma-
Produkcja biofarmaceutyków
z wykorzystaniem transgenicznych zwierz¹t
DANIEL LIPIÑSKI*, JOANNA ZEYLAND**
/
***, RYSZARD S£OMSKI*
/
**
*Instytut Genetyki Cz³owieka PAN, ul. Strzeszyñska 32, 60-479 Poznañ
**Katedra Biochemii i Biotechnologii Wydzia³u Rolniczego AR, ul. Wo³yñska 35, 60-637 Poznañ
***Stypendystka w ramach Dzia³ania 2.6 Zintegrowanego Programu Operacyjnego Rozwoju Regionalnego
finansowanego z Europejskiego Funduszu Spo³ecznego Unii Europejskiej i z bud¿etu pañstwa
Lipiñski D., Zeyland J., S³omski R.
Biopharmaceutical production in transgenic animals
Summary
Two discoveries reported in the mid 1970s in hybridoma technology and genetic engineering techniques
have enabled overcoming the difficulties related to the generation of pharmaceuticals from their natural
resources, such as blood or human tissues, and in 1982 led to the introduction of the first product of the
modern biotechnology, a recombinant insulin, opening the biopharmaceutical era. Among the registered
biopharmaceuticals in the 1980s and the early 1990s the majority of the products were identical to the natural
forms of the proteins and their amino acid sequences. Currently, the rapid growth of the contribution of the
second generation biopharmaceuticals with genetically introduced modifications is observed. All of the
biopharmaceuticals registered on the market until 2005 were generated with the application of E. coli bacte-
ria, yeast, or animal cell lines (CHO, BHK). With the possible registration on the market of the recombinant
antithrombin, in 2006 the first therapeutic protein produced in milk of the transgenic goats will appear as
a new alternative, cheaper and more effective system enabling the production of complex proteins. The
biopharmaceuticals can be generated in blood, milk, urine, semen, egg white of the transgenic animals, and
the silk glands of silkworms. At present, several dozens of the protein products which are produced in milk of
almost all species of farm animals and in the egg white of the hens are subjected to studies at the clinical phase.
Keywords: biopharmaceuticals, transgenic animals
Medycyna Wet. 2007, 63 (3)
262
ceutyki. W latach 1995-2000 Europejska Agencja Oce-
ny Medycznej (EMEA; http://www.emea.eu.int) zare-
jestrowa³a 127 nowych leków, z których 44 (34%) sta-
nowi³y biofarmaceutyki (oko³o 25% produkowanych
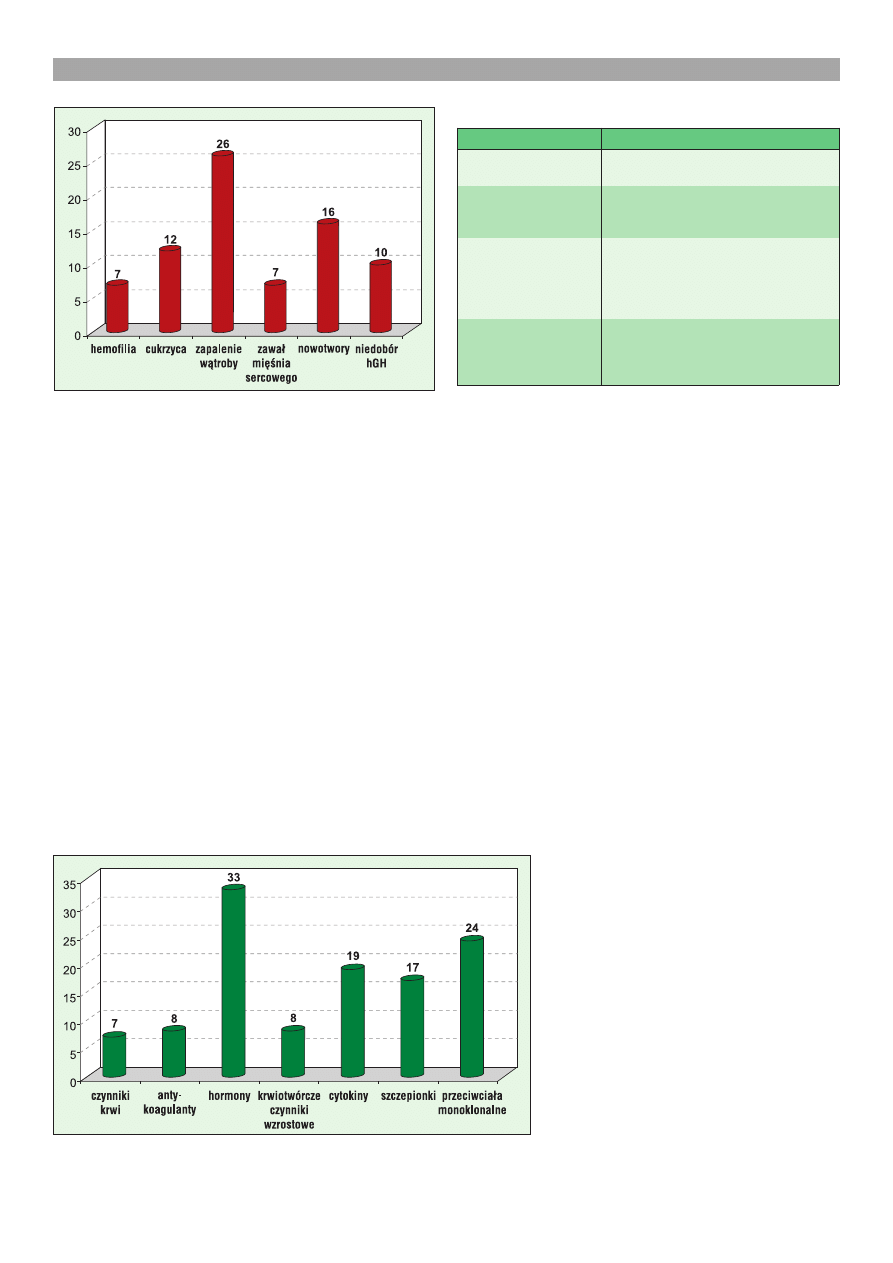
leków). Ponad po³owa dopuszczonych do rynku pro-
duktów przeznaczona jest do walki z hemofili¹, cukrzy-
c¹, zapaleniem w¹troby, zawa³em miênia sercowego,
nowotworami czy chorobami zwi¹zanymi z niedobo-
rem hormonu wzrostu (ryc. 1). Obejmuj¹ one przeciw-
cia³a monoklonalne, szczepionki, cytokiny, czynniki
krwi, antykoagulanty, hormony oraz krwiotwórcze czyn-
niki wzrostowe (ryc. 2).
Systematycznie ronie liczba biofarmaceutyków znaj-
duj¹cych siê w ró¿nych fazach badañ klinicznych. We-
d³ug organizacji Badania Farmaceutyczne i Producenci
Ameryki (PhRMA; http://www.phrma.org) w 1988 r.
w fazie badañ klinicznych by³o 81 produktów, w 1993 r.
143, w 1996 r. 369, a w 2000 r. liczba badañ klinicz-
nych przekroczy³a 500. Niemal po³owa ze znajduj¹cych
siê w fazie badañ klinicznych biofarmaceutyków nale-
¿y do grupy leków, które mog³yby znaleæ zastosowa-
nie w terapii nowotworów. Liczna grupa leków mo¿e
znaleæ zastosowanie w terapii chorób zakanych, au-
toimmunologicznych, neurologicznych oraz zwi¹zanych
z zaka¿eniem wirusem HIV.
W latach 80. oraz wczesnych latach 90. wiêkszoæ
zarejestrowanych biofarmaceutyków stanowi³y mysie
przeciwcia³a monoklonalne oraz bia³ka terapeutyczne
o identycznej w porównaniu z naturaln¹ form¹ bia³ka
sekwencji aminokwasowej. W latach 90. pojawi³o siê
kilka produktów drugiej generacji o w³aciwociach
zmodyfikowanych metodami in¿ynierii genetycznej. Ta
tendencja uleg³a w latach 2000-2004 znacznemu przy-
spieszeniu. W tym czasie 29 z 65 (44%) zarejestrowa-
nych produktów by³o w pewnym zakresie poddanych
zabiegom in¿ynierii genetycznej. Tego typu modyfika-
cje mog¹ polegaæ na zmianie sekwencji aminokwaso-
wej, kowalencyjnym przy³¹czaniu grup chemicznych czy
zmianie w obrêbie oligosacharydowej struktury ³añcu-
chów bocznych bia³ek podlegaj¹cych procesowi gliko-
zylacji. Wprowadzane zmiany umo¿liwiaj¹ tworzenie
chimerycznych lub humanizowanych przeciwcia³ mo-
noklonalnych o obni¿onej immunogenno-
ci, tworzenie bia³ek o szerokim profilu far-
makokinetycznym, bia³ek hybrydowych
³¹cz¹cych w sobie cechy tworz¹cych je po-
jedynczych polipeptydów czy bia³ek o wy-
d³u¿onym okresie pó³trwania (tab. 1).
Wszystkie biofarmaceutyki dopuszczo-
ne do sprzeda¿y do 2005 r. produkowane
s¹ z wykorzystaniem bakterii E. coli,
dro¿d¿y lub linii komórek zwierzêcych,
z których najczêciej stosuje siê komórki
jajnika chomika chiñskiego (CHO) oraz ko-
mórki nerki m³odych chomików (BHK). Na
pocz¹tku 2006 r. oczekuje siê dopuszcze-
nia do sprzeda¿y pierwszego produktu
uzyskanego z wykorzystaniem zwierz¹t
transgenicznych antytrombiny cz³owieka
wytwarzanej w mleku transgenicznych kóz
(http://www.transgenics.com). Oczekuje
siê, ¿e taki sposób produkcji biofarmaceu-
Ryc. 2. G³ówne kategorie biofarmaceutyków dostêpnych na rynkach Unii
Europejskiej i Stanów Zjednoczonych. Produkowane biofarmaceutyki nale-
¿¹ do siedmiu grup bia³ek
Ryc. 1. G³ówne kategorie biofarmaceutyków dostêpnych na
rynkach Unii Europejskiej i Stanów Zjednoczonych. Ponad
po³owa produkowanych biofarmaceutyków skierowana jest
do walki z szecioma g³ównymi chorobami cz³owieka
Tab. 1. G³ówne kierunki modyfikacji biofarmaceutyków
a
h
c
e
C
e
i
n
a
w
o
s
o
t
s
a
Z
e
i
n
a
w
u
s
u
b
u
l
e
i
n
e
¿i
n
b
O
i
c
o
n
n
e
g
o
n
u
m
m
i
a
³
a
i
c
w
i
c
e
z
r
p
e
n
a
w
o
zi
n
a
m
u
h
b
u
l
e
n
z
c
y
r
e
m
i
h
C
w
ó
t
k
u
d
o
r
p
e
i
n
e
z
r
o
w
T
m
e
li
f
o
r
p
m
y
n
o
i
n
e
i
m
z
e
z
m
y
n
z
c
y
t
e
n
i
k
o
k
a
m
r
a
f
y
n
il
u
s
n
i
.
p
n
,i
k
e
l
e
c
¹
j
a
³
a
iz
d
o
n
l
o
w
i
o
k
b
y
z
S
a
l
d
e
n
z
c
e
i
p
z
e
b
j
e
iz
d
r
a
b
e
c
¹
j
a
i
w
il
¿
o
m
u
u
k
e
l
e
i
n
a
w
o
k
w
a
d
e
n
l
a
u
d
i
w
y
d
n
i
o
g
e
r
o
h
c
a
i
n
a
w
rt
³
ó
p
u
s
e
r
k
o
a
n
a
i
m
Z
e
n
j
y
c
n
e
l
a
w
o
k
z
e
z
r
p
w
ó
n
o
r
e
fr
e
t
n
i
a
j
c
a
k
if
y
d
o
M
o
g
e
w
o
n
e
l
y
t
e
il
o
p
u
l
o
k
il
g
e
i
n
e
z
c
¹
³
y
z
r
p
,
a
i
n
a
w
rt
³
ó
p
s
e
r
k
o
e
c
¹
j
a
¿
u
³
d
y
w
e
i
n
t
o
r
k
-
6
u
k
e
l
a
i
n
a
w
a
d
o
p
æ
o
t
s
ê
z
c
e
j
u
k
u
d
e
r
o
c
ii
p
a
r
e
t
y
tz
s
o
k
a
z
c
i
n
a
r
g
o
i
k
e
³
a
i
b
e
i
n
e
z
r
o
w
T
h
c
y
w
o
d
y
r
b
y
h
e
i
n
l
a
r
u
t
a
n
)j
e
c
ê
i
w
b
u
l(
h
c
ó
w
d
e
i
n
e
z
c
¹
³
o
P
n
e
d
e
j
h
c
y
r
ó
t
k
z
,
w
ó
d
y
t
p
e
p
il
o
p
h
c
y
c
¹
j
u
p
ê
t
s
y
w
b
u
l
ê
k
z
c
e
t
s
¹
z
c
¹
w
o
l
e
c
o
d
e
¿
¹
i
w
i
e
j
a
n
z
o
p
z
o
r
¹
w
o
r
o
t
k
e
f
e
ê
j
c
k
n
u
f
i
n
³
e
p
i
g
u
r
d
a
,
ê
k
r
ó
m
o
k
Medycyna Wet. 2007, 63 (3)
263
tyków bêdzie du¿o wydajniejszy i tañszy w porówna-
niu z obecnie stosowanymi systemami.
Wybór systemu biologicznego jest w du¿ym stopniu
uzale¿niony od rodzaju modyfikacji, którym podlega
okrelone bia³ko. Wiele bia³ek, aby mog³o byæ w pe³ni
funkcjonalnych i stabilnych in vivo musi ulec np. gliko-
zylacji. Wydaje siê, ¿e jedynie zastosowanie hodowli
komórek in vitro oraz zwierz¹t jako bioreaktorów, które
potrafi¹ dok³adnie przeprowadziæ skomplikowane mo-
dyfikacje potranslacyjne, umo¿liwia uzyskanie bia³ka
w formie normalnie wystêpuj¹cej w organizmie cz³o-
wieka. Pomimo wielu zalet zastosowanie hodowli ko-
mórkowych ograniczone jest wzglêdnie wysokimi kosz-
tami oraz trudnociami zwi¹zanymi z utrzymaniem
w hodowli du¿ej liczby komórek. Pozbawione takich
ograniczeñ zwierzêta transgeniczne wydaj¹ siê idealny-
mi bioreaktorami. Biofarmaceutyki mo¿na wytwarzaæ
u transgenicznych zwierz¹t w krwi, mleku, moczu, na-
sieniu, bia³ku jaj oraz z zastosowaniem jedwabników.
Krew jest ³atwo dostêpnym i stosunkowo tanim ród-
³em bia³ek, jednak¿e wiêkszoæ bia³ek wydzielanych
przez komórki do krwi wykorzystywanych w celach te-
rapeutycznych jest nietrwa³a i szybko usuwana z krwio-
biegu. Czas pó³trwania hormonu wzrostu cz³owieka
wynosi oko³o 15 minut. Z tego wzglêdu u transgenicz-
nych zwierz¹t stê¿enie hormonu rzadko przekracza kil-
ka µg/ml nawet przy wysokim poziomie ekspresji genu
znajduj¹cego siê pod kontrol¹ silnego promotora genu
metalotioneiny. W zwi¹zku z tym iloæ zgromadzonych
we krwi bia³ek jest czêsto niewystarczaj¹ca, aby mog³a
staæ siê wa¿nym ród³em biofarmaceutyków. Ponadto
w wiêkszoci przypadków obecne w krwi zwierz¹t trans-
genicznych bia³ka cz³owieka, ze wzglêdu na bliskie
ewolucyjnie pokrewieñstwo s¹ aktywne, a co za tym
idzie, maj¹ wp³yw na ich fizjologiê. Obecnoæ hormo-
nu wzrostu cz³owieka w krwi transgenicznych myszy,
wiñ i owiec mo¿e prowadziæ do gigantyzmu, cukrzycy
i wielu innych objawów chorobowych. Krew mo¿e byæ
jednak wartociowym ród³em niektórych bia³ek
(3, 6).
Doskona³ym ród³em rekombinowanych bia³ek jest
bia³ko jaj (5). Kura domowa znosi rocznie do 300 jaj,
z których ka¿de zawiera 6,5 g bia³ka. Silny promotor
genu owoalbuminy, zdolny wydajnie kierowaæ eks-
presj¹ transgenu w jajowodach transgenicznych kur od-
powiada za produkcjê oko³o 2 g bia³ka. Zalet¹ systemu
w porównaniu z innymi grupami zwierz¹t hodowlanych
s¹ mo¿liwoci reprodukcyjne (kilkaset sztuk potomstwa
rocznie), krótki odstêp miêdzypokoleniowy (oko³o 7-8
miesiêcy) oraz niskie koszty hodowli drobiu. Jednak ze
wzglêdu na problemy techniczne zwi¹zane z przygoto-
waniem transgenicznych ptaków system ten przez wie-
le lat nie spe³nia³ pok³adanych w nim oczekiwañ. Obec-
nie sta³ siê drugim po mleku ród³em biofarmaceuty-
ków znajduj¹cych siê w zaawansowanej fazie badañ.
Wykorzystaniem tego systemu do produkcji biofarma-
ceutyków zainteresowanych jest obecnie kilka firm ame-
rykañskich, a kilka produktów firmy Avigenics (http://
www.avigenics.com) erytropoetyna, G-CFS, humani-
zowane przeciwcia³a poliklonalne, interferon produ-
kowanych w jajach transgenicznych kur znajduje siê ju¿
w fazie badañ przedklinicznych (tab. 2).
Obecnie najlepszym ród³em biofarmaceutyków po-
zostaje mleko. Wykorzystanie mleka do uzyskiwania
biofarmaceutyków rozwa¿ano od chwili urodzenia siê
pierwszego transgenicznego ssaka. Po raz pierwszy uda-
³o siê to zastosowaæ u transgenicznych myszy, które z po-
wodzeniem wydziela³y w mleku b-laktoglobulinê owcy
(7). G³ównymi bia³kami mleka s¹ a
S1
-, a
S2
-, b- i k-kaze-
ina, wystêpuj¹ce u wiêkszoci gatunków w ró¿nym stê-
¿eniu, b-laktoglobulina obecna szczególnie w mleku
prze¿uwaczy, a-laktoalbumina syntetyzowana u wiêk-
szoci gatunków oraz kwane bia³ko serwatki (WAP
whey acidic protein) wystêpuj¹ce szczególnie w mleku
gryzoni. Ekspresja genów koduj¹cych bia³ka mleka
wystêpuje tylko w gruczo³ach mlekowych zwierz¹t
w okresie laktacji. Zastosowanie regionów regulatoro-
wych tych genów pozwala ograniczyæ ekspresjê trans-
genu do komórek gruczo³u mlekowego. W zwi¹zku
z tym obecnoæ obcych bia³ek w mleku nie powinna
wp³ywaæ na organizm zwierzêcia.
Transgeniczne zwie-
rzêta produkuj¹ce
w mleku biofarmaceu-
tyki uzyskano u prawie
wszystkich gatunków
zwierz¹t gospodarskich
(tab. 3). Wybór gatunku
zale¿y od wielkoci za-
potrzebowania na okre-
lone bia³ko (tab. 4).
ród³em bia³ek tera-
peutycznych, na które
zapotrzebowanie nie
przekracza 1 kg rocznie mog¹ byæ transgeniczne króli-
ki, które w okresie laktacji dostarczaj¹ potomstwu po-
nad 200 ml mleka dziennie o stê¿eniu bia³ka trzy razy
wy¿szym w porównaniu z mlekiem krowy. W ci¹gu roku
samica królika mo¿e mieæ do 8 laktacji trwaj¹cych 4-5
tygodni. W praktyce podczas jednego okresu laktacji od
samicy królika mo¿na uzyskaæ 1 litr mleka, dlatego te
zwierzêta mog¹ byæ ród³em wzglêdnie du¿ej iloci bio-
farmaceutyków. Wiêksze iloci biofarmaceutyków mo¿-
na uzyskiwaæ, wykorzystuj¹c zwierzêta gospodarskie,
takie jak: winia, owca i koza produkuj¹ce 300-900 lit-
rów mleka rocznie albo krowê, której wydajnoæ mo¿e
Tab. 3. Wybór gatunku zwierz¹t
w zale¿noci od wielkoci zapo-
trzebowania na okrelony pro-
dukt
a
t
ê
z
r
e
i
w
Z
e
i
n
a
w
o
b
e
z
rt
o
p
a
Z
z
s
y
M
g
1
o
d
k
il
ó
r
K
g
k
1
a
i
n
i
w
,
a
z
o
k
,
a
c
w
O
g
k
0
0
0
1
-
1
a
w
o
r
K
g
k
0
0
0
1
j
e
¿
y
w
o
p
t
k
u
d
o
r
P
e
i
n
a
w
o
s
o
t
s
a
Z
a
i
n
e
¿
o
r
d
w
p
a
t
E
a
j
c
a
zi
n
a
g
r
O
a
n
y
t
e
o
p
o
rt
y
r
E
a
i
m
e
n
A
a
i
n
a
d
a
B
e
n
z
c
i
n
il
k
d
e
z
r
p
.
c
n
I
,
s
c
i
n
e
g
i
v
A
)
A
S
U
(
F
S
C
-
G
a
i
n
e
p
o
k
u
e
L
a
i
n
a
d
a
B
e
n
z
c
i
n
il
k
d
e
z
r
p
.
c
n
I
,
s
c
i
n
e
g
i
v
A
)
A
S
U
(
e
n
a
w
o
zi
n
a
m
u
H
a
³
a
i
c
w
i
c
e
z
r
p
e
n
l
a
n
o
l
k
il
o
p
e
n
¿
ó
R
a
i
n
a
w
o
s
o
t
s
a
z
a
i
n
a
d
a
B
e
n
z
c
i
n
il
k
d
e
z
r
p
.
c
n
I
,
s
c
i
n
e
g
i
v
A
)
A
S
U
(
n
o
r
e
fr
e
t
n
I
e
i
n
a
³
a
iz
D
e
w
o
s
u
ri
w
w
i
c
e
z
r
p
e
i
n
a
d
a
B
e
n
z
c
i
n
il
k
d
e
z
r
p
.
c
n
I
,
s
c
i
n
e
g
i
v
A
)
A
S
U
(
Tab. 2. Biofarmaceutyki uzyskiwane w jajach transgenicz-
nych kur

Medycyna Wet. 2007, 63 (3)
264
Tab. 4. Biofarmaceutyki uzyskiwane w mleku transgenicznych zwierz¹t
t
k
u
d
o
r
P
e
i
n
a
w
o
s
o
t
s
a
Z
a
i
n
e
¿
o
r
d
w
p
a
t
E
a
j
c
a
zi
n
a
g
r
O
1
.
1
G
5
,
w
ó
w
a
t
s
e
i
n
e
l
a
p
a
z
e
n
l
a
d
i
o
t
a
m
u
e
R
k
e
r
e
n
e
i
n
e
l
a
p
a
z
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
s
c
it
u
e
p
a
r
e
h
t
o
i
B
C
T
G
-
n
o
i
x
e
l
A
a
a
n
y
s
p
y
rt
y
t
n
A
1
-
,
c
u
³
p
a
m
d
e
z
o
r
a
n
z
c
iz
d
e
iz
D
a
z
o
d
y
c
s
i
w
o
k
u
m
t
k
u
d
o
r
p
y
n
z
c
i
n
e
g
s
n
a
r
T
y
n
o
c
ó
r
k
s
b
u
l
y
n
w
y
t
k
a
e
i
n
C
R
A
,
L
P
P
-r
e
y
a
B
a
a
n
i
e
t
o
r
p
o
t
e
f-
,
e
n
a
i
s
z
o
r
e
i
n
e
i
n
d
r
a
w
t
s
,
a
i
n
e
t
s
a
i
M
w
ó
w
a
t
s
e
i
n
e
l
a
p
a
z
e
n
l
a
d
i
o
t
a
m
u
e
r
II
a
z
a
F
C
T
G
-
k
c
a
m
ir
r
e
M
F
G
E
-
X
B
A
e
w
o
r
o
w
t
o
w
o
n
y
b
o
r
o
h
C
II
a
z
a
F
n
e
g
m
A
-
x
i
n
e
g
b
A
8
L
I-
X
B
A
w
ó
w
a
t
s
e
i
n
e
l
a
p
a
z
e
n
l
a
d
i
o
t
a
m
u
e
R
t
k
u
d
o
r
p
y
n
z
c
i
n
e
g
s
n
a
r
T
y
n
o
c
ó
r
k
s
b
u
l
y
n
w
y
t
k
a
e
i
n
C
T
G
-
x
i
n
e
g
b
A
7
3
1
D
C
a
t
s
i
n
o
g
A
e
w
o
r
o
w
t
o
w
o
n
y
z
u
G
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
C
T
G
-
c
i
n
il
C
o
y
a
M
i
w
r
k
y
c
i
w
o
r
u
s
a
n
i
m
u
b
l
A
a
i
n
e
z
r
a
p
o
,
a
i
n
e
¿
a
r
b
o
,i
w
r
k
e
i
n
e
i
n
i
C
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
C
T
G
-
s
u
i
n
e
s
e
r
F
)
®
n
y
r
T
A
(
II
I
a
n
i
b
m
o
rt
y
t
n
A
a
c
i
p
e
z
r
k
a
z
,
y
r
o
t
a
Z
¿
a
d
e
z
r
p
s
a
n
a
d
o
g
z
,I
II
a
z
a
F
C
T
G
C
o
k
³
a
i
B
i
w
r
k
e
i
c
ê
i
n
p
e
z
r
K
t
k
u
d
o
r
p
y
n
z
c
i
n
e
g
s
n
a
r
T
y
n
o
c
ó
r
k
s
b
u
l
y
n
w
y
t
k
a
e
i
n
L
P
P
,
C
R
A
a
z
a
r
e
t
s
e
o
n
il
o
h
c
o
l
y
r
y
t
u
B
u
m
zi
n
a
g
r
o
a
n
o
r
h
c
O
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
a
i
x
e
N
R
T
F
C
a
z
o
d
y
c
s
i
w
o
k
u
M
t
k
u
d
o
r
p
y
n
z
c
i
n
e
g
s
n
a
r
T
y
n
o
c
ó
r
k
s
b
u
l
y
n
w
y
t
k
a
e
i
n
C
T
G
g
I
4
A
L
T
C
w
ó
w
a
t
s
e
i
n
e
l
a
p
a
z
e
n
l
a
d
i
o
t
a
m
u
e
R
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
C
T
G
-
b
b
i
u
q
S
-
s
r
e
y
M
-l
o
t
s
ir
B
X
I
k
i
n
n
y
z
C
a
il
if
o
m
e
h
,i
w
r
k
e
i
c
ê
i
n
p
e
z
r
K
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
g
n
i
m
r
a
h
P
-
C
R
A
,
L
P
P
,
C
T
G
II
I
V
k
i
n
n
y
z
C
A
a
il
if
o
m
e
H
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
g
n
i
m
r
a
h
P
-
C
R
A
7
E
2
D
w
ó
w
a
t
s
e
i
n
e
l
a
p
a
z
e
n
l
a
d
i
o
t
a
m
u
e
R
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
C
T
G
-t
t
o
b
b
A
o
g
e
w
o
n
i
m
a
t
u
l
g
u
s
a
w
k
a
z
a
l
y
s
k
o
b
r
a
k
e
D
I
u
p
y
t
a
c
y
z
r
k
u
C
t
k
u
d
o
r
p
y
n
z
c
i
n
e
g
s
n
a
r
T
y
n
o
c
ó
r
k
s
b
u
l
y
n
w
y
t
k
a
e
i
n
n
y
S
o
i
B
-
C
T
G
a
k
e
i
w
o
³z
c
u
t
s
o
r
z
w
n
o
m
r
o
H
a
r
e
n
r
u
T
³
ó
p
s
e
z
,
æ
o
³
s
o
r
o
k
s
i
N
y
t
k
u
d
o
r
p
e
n
w
y
t
k
a
e
i
n
i
e
n
w
y
t
k
A
C
T
G
e
n
l
a
n
o
l
k
il
o
p
a
³
a
i
c
w
i
c
e
z
r
p
e
n
a
w
o
zi
n
a
m
u
H
a
i
n
a
w
o
s
o
t
s
a
z
e
n
¿
ó
R
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
h
c
e
t
a
m
e
H
1
0
9
N
u
h
c
u
³
p
k
a
R
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
C
T
G
-
n
e
G
o
n
u
m
m
I
1
C
r
o
ti
b
i
h
n
I
y
w
o
h
c
u
r
o
i
n
y
z
c
a
n
k
ê
z
r
b
o
y
n
o
z
d
o
r
W
II
I
a
z
a
F
g
n
i
m
r
a
h
P
a
n
il
u
s
n
I
a
c
y
z
r
k
u
C
t
k
u
d
o
r
p
y
n
z
c
i
n
e
g
s
n
a
r
T
y
n
o
c
ó
r
k
s
b
u
l
y
n
w
y
t
k
a
e
i
n
C
T
G
a
n
i
n
o
t
y
c
l
a
K
a
z
o
r
o
p
o
e
t
s
O
t
k
u
d
o
r
p
y
n
z
c
i
n
e
g
s
n
a
r
T
y
n
o
c
ó
r
k
s
b
u
l
y
n
w
y
t
k
a
e
i
n
L
P
P
n
e
g
a
l
o
K
w
ó
w
a
t
s
e
i
n
e
l
a
p
a
z
e
n
l
a
d
i
o
t
a
m
u
e
R
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
g
n
i
m
r
a
h
P
a
n
y
r
e
f
o
t
k
a
L
d
a
³
k
u
e
c
¹
j
u
l
u
g
e
r
e
i
n
a
³
a
iz
D
e
n
l
a
p
a
z
w
i
c
e
z
r
p
e
i
n
a
³
a
iz
d
,
y
w
o
i
c
o
n
r
o
p
d
o
I
a
z
a
F
,
y
n
z
c
e
i
p
z
e
b
a
z
y
n
a
¿
a
w
U
g
n
i
m
r
a
h
P
m
y
z
o
zi
L
,
e
n
j
y
r
e
t
k
a
b
w
i
c
e
z
r
p
e
i
n
a
³
a
iz
D
y
w
o
i
c
o
n
r
o
p
d
o
d
a
³
k
u
e
c
¹
j
u
l
u
g
e
r
e
i
n
a
³
a
iz
d
t
k
u
d
o
r
p
y
n
z
c
i
n
e
g
s
n
a
r
T
y
n
o
c
ó
r
k
s
b
u
l
y
n
w
y
t
k
a
e
i
n
s
i
v
a
D
-
C
U
e
w
o
i
n
h
c
z
r
e
i
w
o
p
o
k
³
a
i
B
m
u
i
d
o
m
s
a
l
P
)
1
P
S
M
(
a
n
z
c
y
r
a
l
a
m
w
i
c
e
z
r
p
a
k
n
o
i
p
e
z
c
z
S
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
C
T
G
l
e
e
t
s
o
i
B
(
a
n
b
a
w
d
e
j
æ
i
n
a
z
c
ê
j
a
P
M
T
)
w
ó
³
a
ir
e
t
a
m
h
c
y
w
o
n
e
i
n
e
z
r
o
w
T
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
a
i
x
e
N
2
4
5
O
R
P
S
D
I
A
/
V
I
H
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
C
T
G
-
s
c
i
n
e
g
o
r
P
a
n
y
t
k
a
l
o
r
P
o
g
e
w
o
i
c
o
n
r
o
p
d
o
u
d
a
³
k
u
e
i
n
e
i
n
c
o
m
z
W
t
k
u
d
o
r
p
y
n
z
c
i
n
e
g
s
n
a
r
T
y
n
o
c
ó
r
k
s
b
u
l
y
n
w
y
t
k
a
e
i
n
C
T
G
e
n
a
w
o
zi
n
a
m
u
h
a
³
a
i
c
w
i
c
e
z
r
P
a
i
n
a
w
o
s
o
t
s
a
z
e
n
¿
ó
R
II
I
i
II
,I
a
z
a
F
x
e
r
a
d
e
M
®
e
d
a
c
i
m
e
R
,
a
n
h
o
r
C
a
b
o
r
o
h
C
w
ó
w
a
t
s
e
i
n
e
l
a
p
a
z
e
n
l
a
d
i
o
t
a
m
u
e
r
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
C
T
G
-r
o
c
o
t
n
e
C
w
ó
s
u
ri
w
o
rt
e
r
a
k
³
a
i
B
k
e
n
o
i
p
e
z
c
z
s
e
i
n
e
z
r
o
w
T
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
n
i
e
t
o
r
p
o
i
B
u
n
e
g
o
n
i
m
z
a
l
p
r
o
t
a
w
y
t
k
a
y
w
o
k
n
a
k
T
,i
w
r
k
w
ó
p
e
z
r
k
s
e
i
n
a
z
c
z
s
u
p
z
o
R
a
c
r
e
s
³
a
w
a
z
t
k
u
d
o
r
p
y
n
z
c
i
n
e
g
s
n
a
r
T
y
n
o
c
ó
r
k
s
b
u
l
y
n
w
y
t
k
a
e
i
n
e
m
y
z
n
e
G
)
®
n
e
r
g
e
t
n
A
j
e
i
n
e
z
c
w
(
®
ir
b
a
s
y
T
e
n
z
c
i
g
o
l
o
r
u
e
n
a
i
n
e
z
r
o
h
c
S
e
n
z
c
i
n
il
k
d
e
z
r
p
a
i
n
a
d
a
B
C
T
G
-
n
a
l
E
)
a
k
e
i
w
o
³z
c
a
³
a
i
c
w
i
c
e
z
r
p
(
®
e
s
u
o
m
o
n
e
X
a
i
n
a
w
o
s
o
t
s
a
z
e
n
¿
ó
R
e
n
¿
ó
R
x
i
n
e
g
b
A

Medycyna Wet. 2007, 63 (3)
265
siêgaæ nawet 10 000 litrów. Poniewa¿ ekspresja rekom-
binowanych bia³ek mo¿liwa jest na poziomie 1 g/L, nie-
wielka liczba transgenicznych zwierz¹t jest w stanie
zaspokoiæ potrzeby pacjentów na poszczególne leki.
Alternatyw¹ dla pozyskiwania biofarmaceutyków
w mleku zwierz¹t gospodarskich jest wykorzystanie mo-
czu lub p³ynu nasiennego. Z mleka bia³ka terapeutycz-
ne mo¿na uzyskaæ tylko od samic w okresie laktacji,
podczas gdy w przypadku moczu bia³ka mo¿na produ-
kowaæ u wszystkich osobników przez ca³y okres ¿ycia.
Pozyskiwanie bia³ek by³oby równie¿ ³atwiejsze technicz-
nie i znacznie obni¿y³o koszty. Zastosowanie specyficz-
nych dla komórek nab³onka pêcherza moczowego sek-
wencji regulatorowych genu uroplakiny oraz uromodu-
liny pozwoli³o uzyskaæ w moczu transgenicznych my-
szy wzglêdnie niewielkie iloci hormonu wzrostu (100-
-500 ng/ml) (2), erytropoetyny (6 ng/ml) (9) oraz a
1
-
-antytrypsyny cz³owieka (65 µg/ml) (10).
Od niedawna jako ród³o biofarmaceutyków brane
jest pod uwagê nasienie. System ten ma niew¹tpliwe
zalety: obfitoæ i ³atwoæ pozyskiwania u niektórych
gatunków zwierz¹t, np. wiñ. Od knura mo¿na uzyskaæ
2-3 razy w tygodniu, 200-300 ml ejakulatu, zawieraj¹-
cego 30 mg/ml bia³ka. W ci¹gu roku od transgenicznej
wini produkuj¹cej rekombinowane bia³ko w iloci
1 mg/ml mo¿na uzyskaæ 22,4 g produktu. Dotychczaso-
we badania, ograniczone do zwierz¹t laboratoryjnych
da³y bardzo obiecuj¹ce wyniki. W nasieniu transgenicz-
nych myszy uda³o siê uzyskaæ hormon wzrostu cz³o-
wieka w iloci oko³o 0,5 mg/ml (1). Jest to iloæ wielo-
krotnie wy¿sza ni¿ iloæ hormonu wzrostu produkowa-
nego w moczu transgenicznych myszy (100-500 ng/ml)
(2). Dyck i wsp. zastosowali sekwencjê regulatorow¹
genu P12 myszy, którego ekspresja jest ograniczona do
komórek gruczo³ów p³ciowych samców. Poniewa¿ nie
poznano jeszcze wszystkich bia³ek wystêpuj¹cych
w nasieniu, istnieje mo¿liwoæ odkrycia innych specy-
ficznych dla nasienia sekwencji regulatorowych, za po-
moc¹ których uda³oby siê uzyskaæ jeszcze wiêksz¹ iloæ
biofarmaceutyków.
Biofarmaceutyki mog¹ byæ równie¿ produkowane
przez jedwabniki, naturalnego producenta jedwabiu dla
przemys³u w³ókienniczego. Jedwabnik morwowy (Bom-
byx mori) wytwarza du¿e iloci bia³ek kokonu, zbudo-
wanego z niewielu rodzajów bia³ek, potencjalnego ród-
³a rekombinowanych bia³ek, dziêki czemu ³atwo wyod-
rêbniæ egzogenne bia³ko. Dwa gruczo³y jedwabne sta-
nowi¹ce oko³o 25% masy cia³a produkuj¹ p³ynny jed-
wab sk³adaj¹cy siê z w³ókienek fibroinowych sklejo-
nych serycyn¹. Wyspecjalizowane komórki gruczo³u
jedwabnego 85% mocy produkcyjnych przeznaczaj¹ na
produkcjê jedwabiu. Ka¿da z oko³o 1000 komórek gru-
czo³u produkuje dziennie 80 µg bia³ka. Dla porówna-
nia: najbardziej wydajne pod wzglêdem produkcji re-
kombinowanych bia³ek komórki zwierzêce wytwarzaj¹
oko³o 50 pg bia³ka dziennie. Dodatkowo w krótkim cza-
sie mo¿na osi¹gn¹æ dowoln¹ liczebnoæ jedwabnika.
Wiele laboratoriów rozpoczê³o ju¿ prace nad wykorzys-
taniem jedwabnika morwowego do ekspresji obcych
genów (8).
Obecnie do biofarmaceutyków zalicza siê niemal
wy³¹cznie rekombinowane bia³ka terapeutyczne i prze-
ciwcia³a monoklonalne. Przynajmniej do koñca obec-
nej dekady nie powinno siê pod tym wzglêdem wiele
zmieniæ. O ile jednak w latach 80. oraz wczesnych la-
tach 90. zdecydowan¹ wiêkszoæ zarejestrowanych bio-
farmaceutyków stanowi³y produkty o identycznej w po-
równaniu z naturaln¹ form¹ bia³ka sekwencji aminokwa-
sowej, o tyle obecnie gwa³townie ronie udzia³ biofar-
maceutyków drugiej generacji o zmodyfikowanych
metodami in¿ynierii genetycznej w³aciwociach.
W 2004 r. w Stanach Zjednoczonych i Unii Europej-
skiej dostêpnych by³o 160 biofarmaceutyków o war-
toci rynkowej przekraczaj¹cej 34 mld dolarów. Anali-
tycy rynkowi przewiduj¹, ¿e w 2010 r. biofarmaceutyki
stanowiæ bêd¹ 50% rejestrowanych leków, a ich war-
toæ rynkowa siêgnie 52 mld dolarów. Najwiêkszy
wp³yw na rynek biofarmaceutyczny w nadchodz¹cych
latach bêdzie mia³o pojawienie siê w 2006 r. rekombi-
nowanej antytrombiny, pierwszego produktu uzyskiwa-
nego w mleku transgenicznych kóz du¿o wydajniej-
szego, tañszego i umo¿liwiaj¹cego produkcjê z³o¿onych
bia³ek, alternatywnego dla obecnie stosowanych, syste-
mu wykorzystuj¹cego do produkcji biofarmaceutyków
transgeniczne zwierzêta (4). Obecnie w fazie badañ kli-
nicznych znajduje siê ju¿ kilkadziesi¹t produktów bia³-
kowych produkowanych w mleku niemal wszystkich ga-
tunków zwierz¹t gospodarskich oraz w bia³ku kurzych
jaj. W nieco d³u¿szej perspektywie czasu nale¿y ocze-
kiwaæ pojawienia siê na rynku zupe³nie nowych kate-
gorii produktów zwi¹zanych z prowadzonymi obecnie
intensywnymi badaniami w dziedzinie terapii genowej,
technologii wykorzystuj¹cych antysensowe lub interfe-
ruj¹ce RNA czy terapii komórkowej.
Pimiennictwo
1.Dyck M. K., Gagne D., Ouellet M., Senechal J. F., Belanger E., Lacroix D.,
Sirard M. A., Pothier F.: Seminal vesicle production and secretion of growth
hormone into seminal fluid. Nat. Biotechnol. 1999, 17, 1087-1090.
2.Kerr D. E., Liang F., Bondioli K. R., Zhao H., Kreibich G., Wall R. J., Sun T. T.:
The bladder as a bioreactor: urothelium production and secretion of growth
hormone into urine. Nat. Biotechnol. 1998, 16, 75-79.
3.Massoud M., Bischoff R., Dalemans W., Pointu H., Attal J., Schultz H., Clesse D.,
Stinnakre M. G., Pavirani A., Houdebine L. M.: Expression of active recombi-
nant human alpha 1-antitrypsin in transgenic rabbits. J. Biotechnol. 1991, 18,
193-203.
4.Pavlou A. K., Reichert J. M.: Recombinant protein therapeutics success rates,
market trends and values to 2010. Nat. Biotechnol. 2004, 22, 1513-1519.
5.Rapp J. C., Harvey A. J., Speksnijder G. L., Hu W., Ivarie R.: Biologically active
human interferon alpha-2b produced in the egg white of transgenic hens. Trans-
genic Res. 2003, 12, 569-575.
6.Sharma A., Martin M. J., Okabe J. F., Truglio R. A., Dhanjal N. K., Logan J. S.,
Kumar R.: An isologous porcine promoter permits high level expression of
human hemoglobin in transgenic swine. Biotechnology 1994, 12, 55-59.
7.Simons J. P., McClenaghan M., Clark A. J.: Alteration of the quality of milk by
expression of sheep beta-lactoglobulin in transgenic mice. Nature 1987, 328,
530-532.
8.Tomita M., Munetsuna H., Sato T., Adachi T., Hino R., Hayashi M., Shimizu K.,
Nakamura N., Tamura T., Yoshizato K.: Transgenic silkworms produce recom-
binant human type III procollagen in cocoons. Nat. Biotechnol. 2003, 21, 52-56.
9.Zbikowska H. M., Soukhareva N., Behnam R., Chang R., Drews R., Lubon H.,
Hammond D., Soukharev S.: The use of the uromodulin promoter to target
production of recombinant proteins into urine of transgenic animals. Trans-
genic Res. 2002, 11, 425-435.
10.Zbikowska H. M., Soukhareva N., Behnam R., Lubon H., Hammond D.,
Soukharev S.: Uromodulin promoter directs high-level expression of biologically
active human alpha1-antitrypsin into mouse urine. Biochem. J. 2002, 365, 7-11.
Adres autora: dr Daniel Lipiñski, ul. Strzeszyñska 32, 60-479 Poznañ;
e-mail: lipin1@poczta.onet.pl
Wyszukiwarka
Podobne podstrony:
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
3 Zalety i ograniczenia wykorzystywania zwierzat
5 Wykorzystywanie zwierzat w badaniach majacych cel poznawczy,
BIOLOGIA mutacje, klonowanie, rośliny i zwierzęta transgeniczne
higiena produktow spozywczych pochodzenia zwierzecego wyklady
zwierzęta transgeniczne
bhp w zakładach przetwórstwa produktów ubocznych pochodzenia zwierzęcego, 1 bhp w zakladach
Produkty spożywcze pochodzenia zwierzęcego
Metody otrzymywania zwierząt transgenicznych, genetyka
zwierzęta transgeniczne, BIOLOGIA MOJE PRYWATNE
6 Wykorzystanie zwierzat w eksperymentach majacych cel praktyczny
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
3 Zalety i ograniczenia wykorzystywania zwierzat
Plemniki jako wektory do orzymywania zwierzat transgen
Zwierzęta transgeniczne
Gospodarcze zwierzęta transgeniczne
więcej podobnych podstron