Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
1
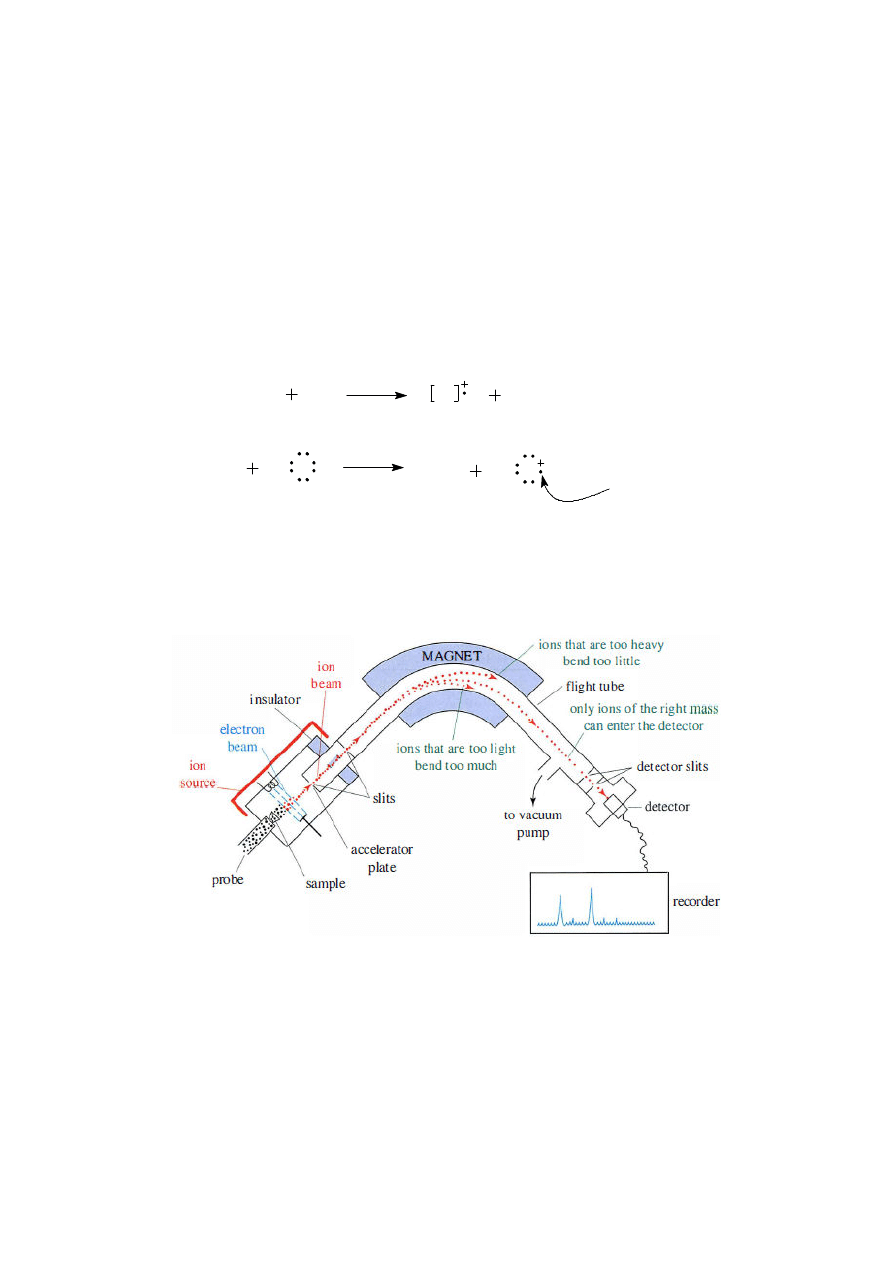
Spektrometria mas (MS)
Spektrometria mas (MS, ang. Mass Spectrometry) – technika analityczna stosowana w chemii
głównie do ustalania składu mieszanin oraz identyfikacji związków organicznych. Cząsteczki badanej
próbki wzbudzane są przez jonizację elektronową (EI – ang. Electron Impact). Powstające jony
przyśpieszane są w polu elektrycznym i po przejściu przez szczeliny zapewniające spójność wiązki
trafiają do analizatora. Metoda umożliwia wyznaczenie masy cząsteczkowej badanego związku.
Pomiar mas fragmentów powstałych w procesie rozpadu wzbudzonych cząsteczek nieznanego
związku dostarcza dodatkowych informacji o jego strukturze.
Jonizacja elektronowa (EI)
- zderzenie elektronu z cząsteczką organiczną powoduje wybicie elektronu z powłoki
walencyjnej cząsteczki, w wyniku czego tworzy się tzw. kationorodnik (cząstka posiadająca
ładunek dodatni i nieparzystą liczbę elektronów)
e
-
M
M
2 e
-
e
-
C
H
H
H
H
2 e
-
C
H
H
H
H
elektron
metan
kationorodnik
niesparowany
elektron
np.
Zasada działania spektrometru masowego
- w spektrometrii masowej, w odróżnieniu od metod spektroskopowych, nie wykorzystuje się
promieniowania elektromagnetycznego do wzbudzania próbki ani zjawisk jego absorbcji czy
też emisji
- duża powtarzalność wyników;
- możliwość sprzężenia spektrometru mas z chromatografem gazowym (GC-MS, ang. Gas
Chromatography-Mass Spectrometry) lub cieczowym (LC-MS, ang. Liquid Chromatography-
Mass Spectrometry) (wprowadzenie analitu do spektrometru poprzedzone rozdziałem
mieszaniny związków na poszczególne frakcje)
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
2
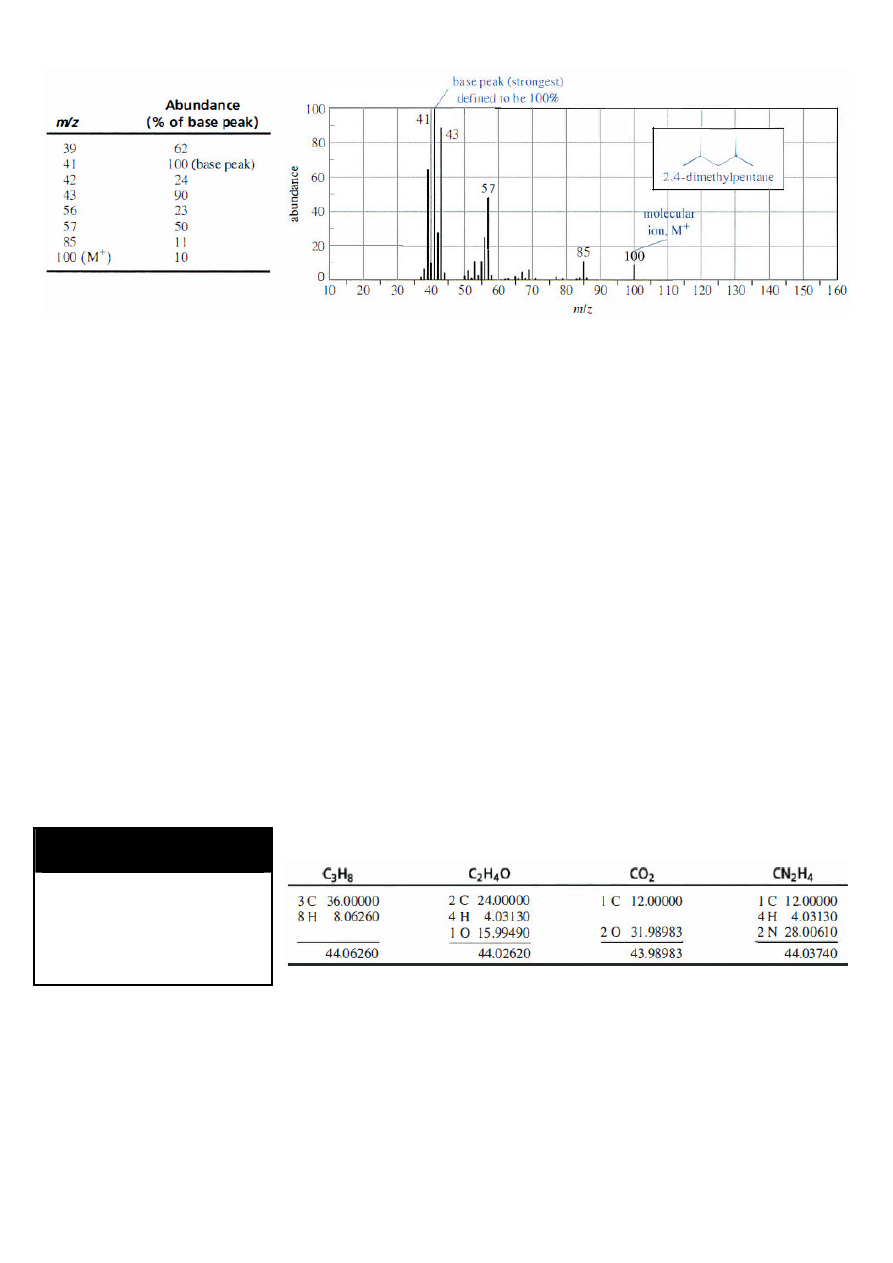
Widmo masowe 2,4-dimetylopentanu
- spektrometr dokonuje pomiaru stosunku masy jonu do jego ładunku [m/z];
- natężenie rejestrowanego sygnału jest wprost proporcjonalne do ilości padających jonów,
a co za tym idzie do prawdopodobieństwa ich powstawania;
- widmo MS – najczęściej wykres słupkowy przedstawiający poszczególne piki o
odpowiedniej wartości m/z oraz intensywności (abundancji) [%]; niekiedy dodatkowo
tabelka z wyszczególnionymi danymi.
pik główny (podstawowy) – pik o największej intensywności - jego intensywność arbitralnie
ustalona jako 100% (nie zawsze odpowiada masie jonu molekularnego!!)
pik macierzysty (pik jonu molekularnego; M
+
) – pik odpowiadający masie cząsteczkowej
(obserwowany w większości wid mas; jego obecność wskazuje, że wykrywalna ilość jonów
molekularnych dociera do detektora bez fragmentacji)
Wysokorozdzielcza spektrometria mas (HRMS, ang. High-Resolution Mass Spectrometry) –
pozwala na ustalenie wzoru sumarycznego badanego związku (dzięki zastosowaniu dodatkowego
ogniskowania promieni, możliwe jest rozróżnienie jonów z dokładnością do 0,0001 u)
Przykład:
- jon molekularny o m/z=44 może odpowiadać masom cząsteczkowym molekuł o wzorach
sumarycznych np. C
3
H
8
, C
2
H
4
O, CO
2
czy CN
2
H
4
. Każdy z tych wzorów odpowiada różnym
tzw. masom dokładnym (ang. exact mass), liczonym na podstawie mas atomowych
najbardziej powszechnych izotopów danego pierwiastka:
Dokładne masy najczęściej
spotykanych izotopów
Izotop
Masa at. [ajm]
12
C
12.000000
1
H
1.007825
16
O
15.994914
14
N
14.003050
- jeżeli pomiar HRMS wykaże obecność jonu molekularnego o masie dokładnej np. 44.029, to
można na tej podstawie wnioskować, że badany związek ma wzór sumaryczny C
2
H
4
O,
ponieważ jego masa dokładna jest najbliższa wartości zmierzonej.
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
3
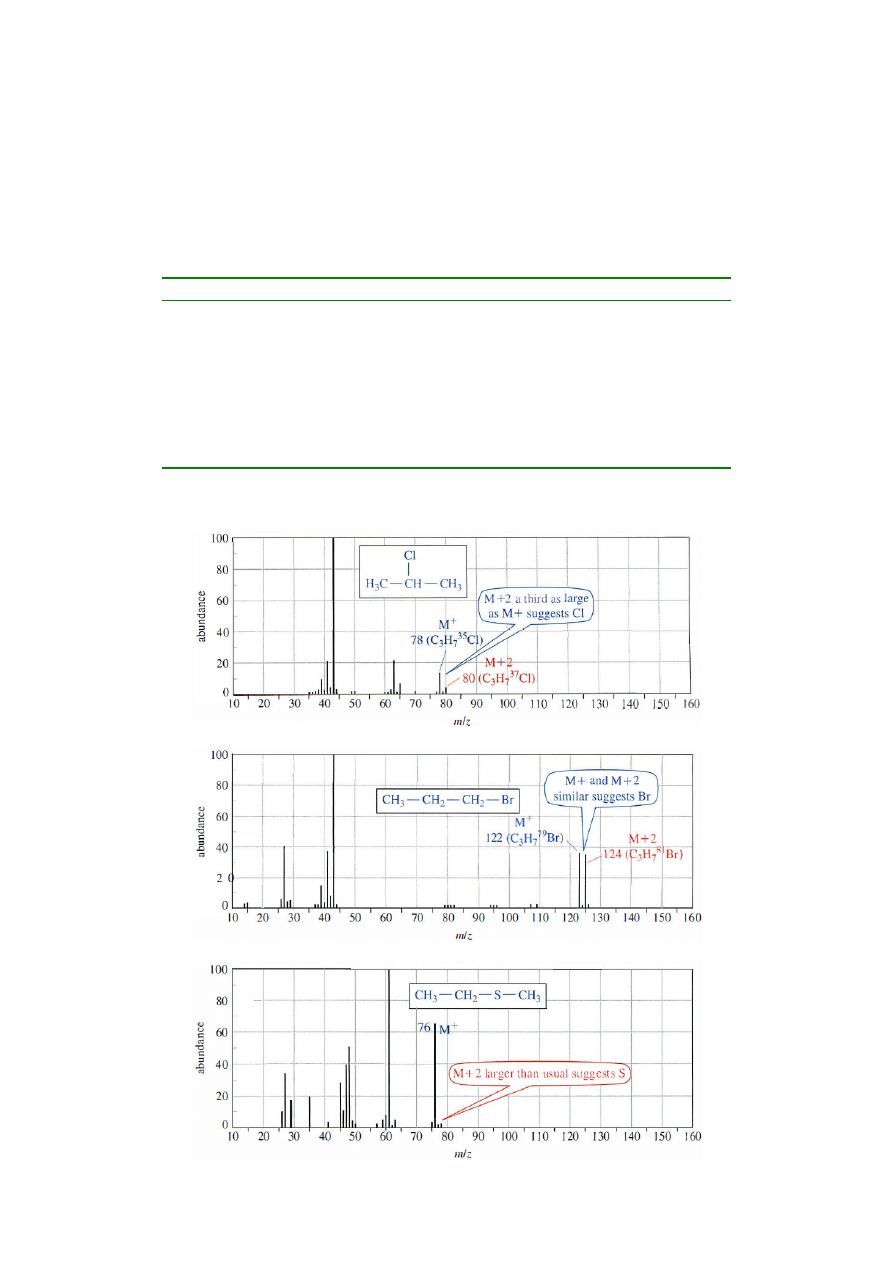
piki izotopowe – piki o m/z większej o jedną, dwie lub czasem kilka jednostek od wartości M
+
(M
+
+1,
M
+
+2,...);
- występują w widmie MS ze względu na niejednorodność izotopową pierwiastków
wchodzących w skład związku;
- w przypadku związków zbudowanych wyłącznie z atomów C, H, O i N, piki izotopowe mają
niewielką intensywność ze względu na naturalny, niewielki udział cięższych izotopów tych
pierwiastków;
- piki molekularne M
+
oraz piki izotopowe M
+
+1 i M
+
+2 pozwalają na rozpoznanie niektórych
pierwiastków zawartych w badanym związku (w szczególności atomów Br, Cl, I, N oraz S)
Skład izotopowy wybranych pierwiastków:
Pierwiastek
M
+
M
+
+1
M
+
+2
wodór
1
H 100%
węgiel
12
C 98.9%
13
C 1.1%
azot
14
N 99.6%
15
N 0.4%
tlen
16
O 99.8%
18
O 0.2%
siarka
32
S 95.0%
33
S 0.8%
34
S 4.2%
chlor
35
Cl 75.5%
37
Cl 24.5%
brom
79
Br 50.5%
81
Br 49.5%
jod
127
I 100%
Widma zawierające chlor, brom oraz siarkę:
- Cl (M
+
+2 w ⅓ tak intensywny jak M
+
)
- Br (M
+
+2 równie intensywny jak M
+
)
- S (M
+
+2 większy niż zwykle /4% intensywności M
+
/)
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
4
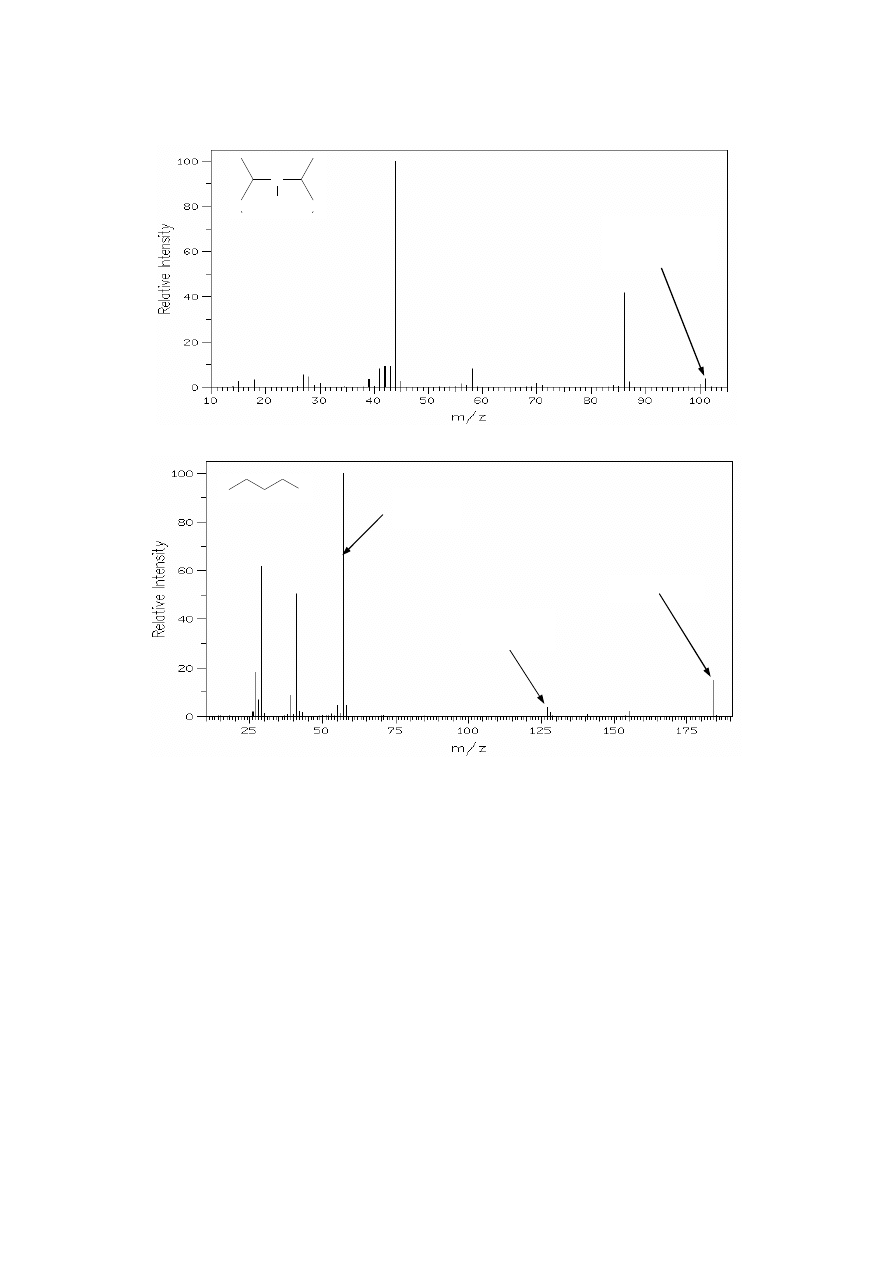
Widma zawierające azot i jod:
-
N (nieparzysta masa jonu molekularnego M
+
, jeśli w cząsteczce obecna jest nieparzysta
liczba atomów N; tzw. reguła azotowa, jest konsekwencją występowania azotu na
nieparzystym stopniu utlenienia w zw. organicznych, czyli wiązania się z nieparzystą liczbą
atomów węgla i/lub wodoru);
- I (pik pochodzący od jonu I
+
przy m/z=127 oraz ewentualnie pik M
+
-127 /utrata rodnika I
•
/)
Fragmentacja
- najbardziej powszechną metodą jonizacji związku chemicznego jest jonizacja elektronami w
komorze próżniowej (EI); efektywna jonizacja wymaga zastosowania strumienia elektronów o
stosunkowo wysokiej energii, która oprócz wzbudzenia cząsteczek, powoduje także ich rozpad
- fragmentację, która prowadzi do powstania tzw. jonów fragmentacyjnych;
- prawdopodobieństwo fragmentacji jest tym większe, im większa jest energia jonów źródła
jonizującego;
- proces fragmentacji daje charakterystyczną mieszaninę jonów;
- zaletą metody EI jest szybkie otrzymywanie powtarzalnych widm (daje to możliwość
identyfikacji substancji w oparciu o istniejące bazy danych);
- prawdopodobieństwo fragmentacji kationorodnika związane jest z jego trwałością i może
prowadzić do powstania mniejszych jonów i rodników; rodniki nie są widoczne w widmie mas,
ponieważ nie są obdarzone ładunkiem; dystrybucja powstających kationów jest bezpośrednio
związana z szeregiem trwałości karbokationów (rzędowość);
N
H
M
+
=101
nieparzysta
wartość m/z
I
M
+
=184
I
+
(m/z=127)
M
+
-127
(m/z=57)
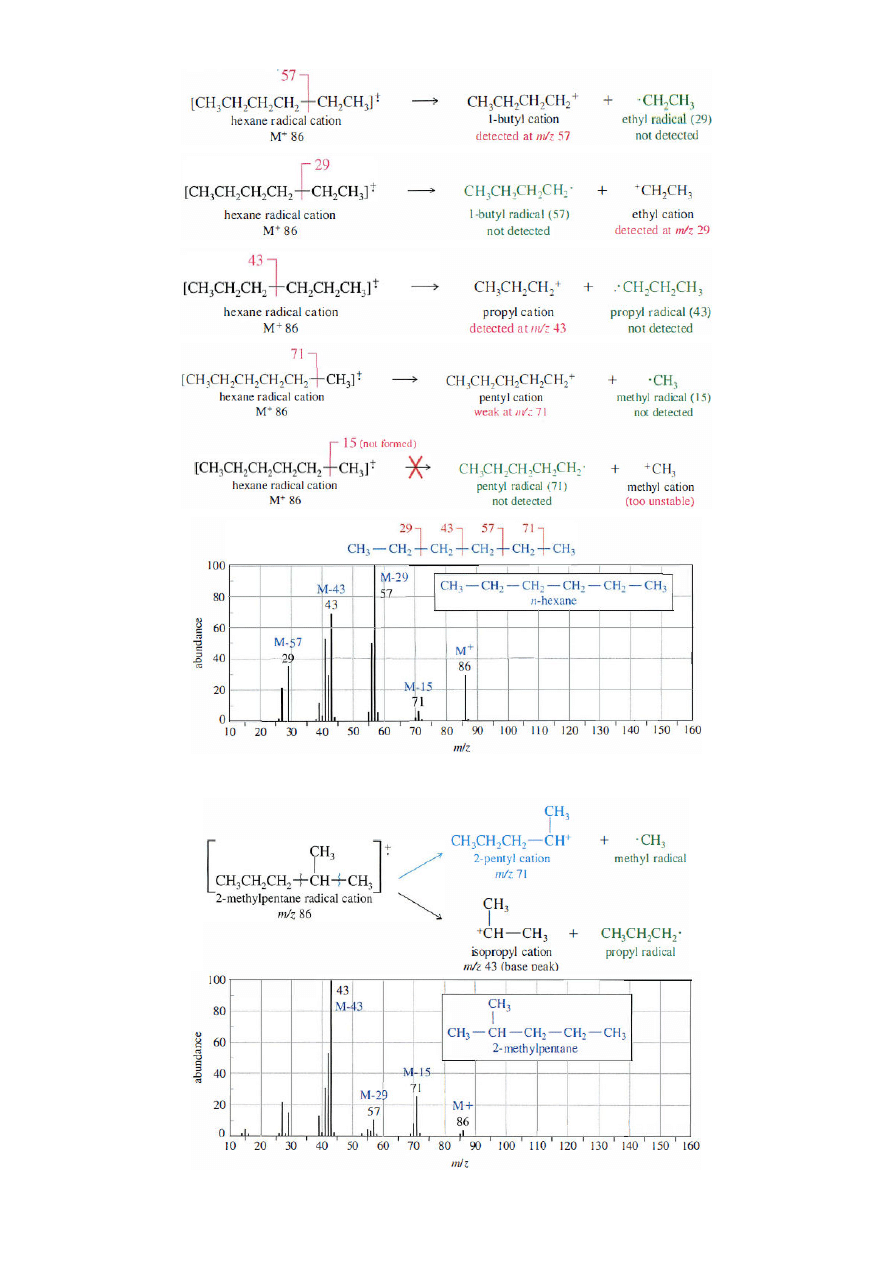
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
5
Drogi fragmentacji oraz widmo mas dla cząsteczki n-heksanu
Drogi fragmentacji oraz widmo mas dla cząsteczki 2-metylopentanu
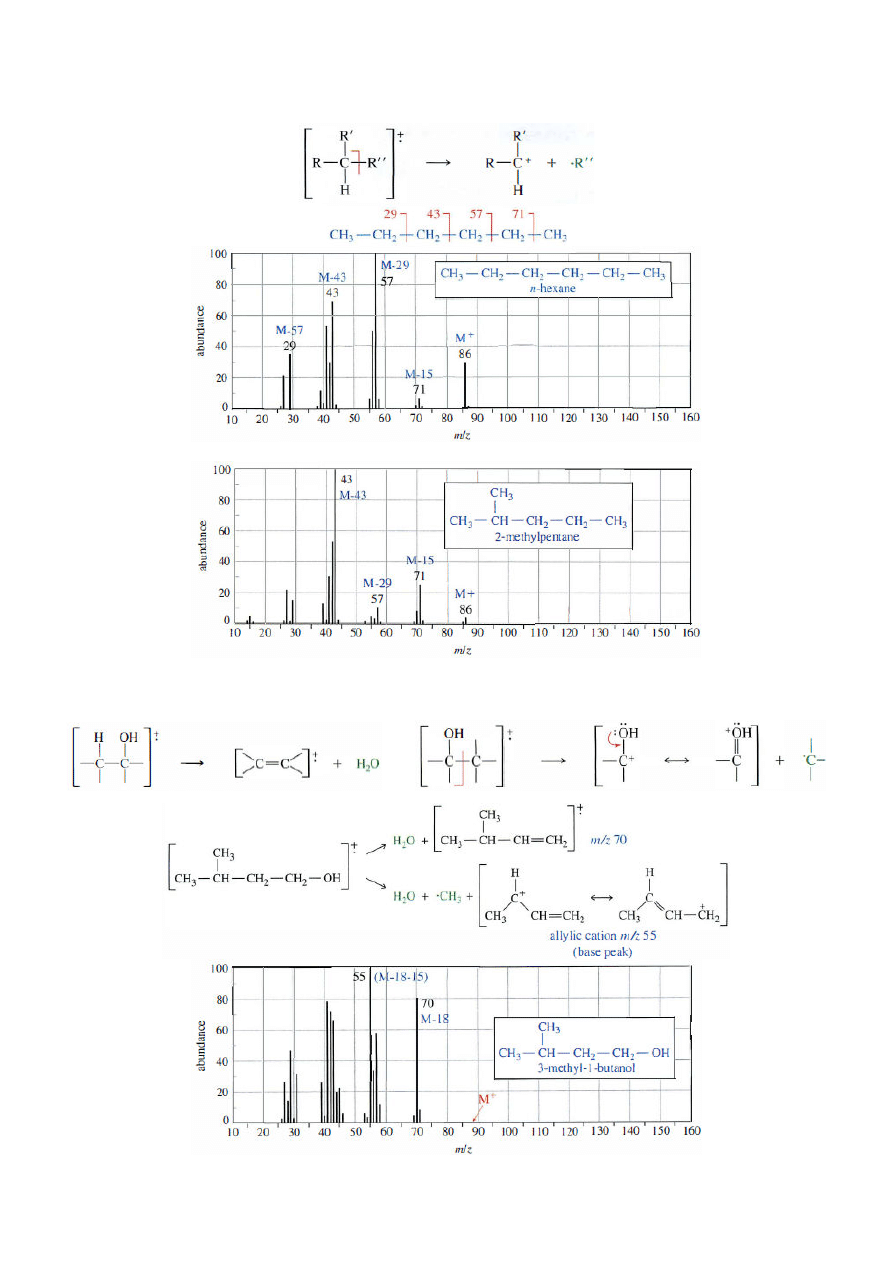
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
6
Fragmentacja związków organicznych
1. Alkany
- rozpad do najbardziej trwałych karbokationów
2. Alkohole
- utrata cząsteczki wody (M
+
-18) lub rozpad
α
z utworzeniem stabilizowanych kationów
lub
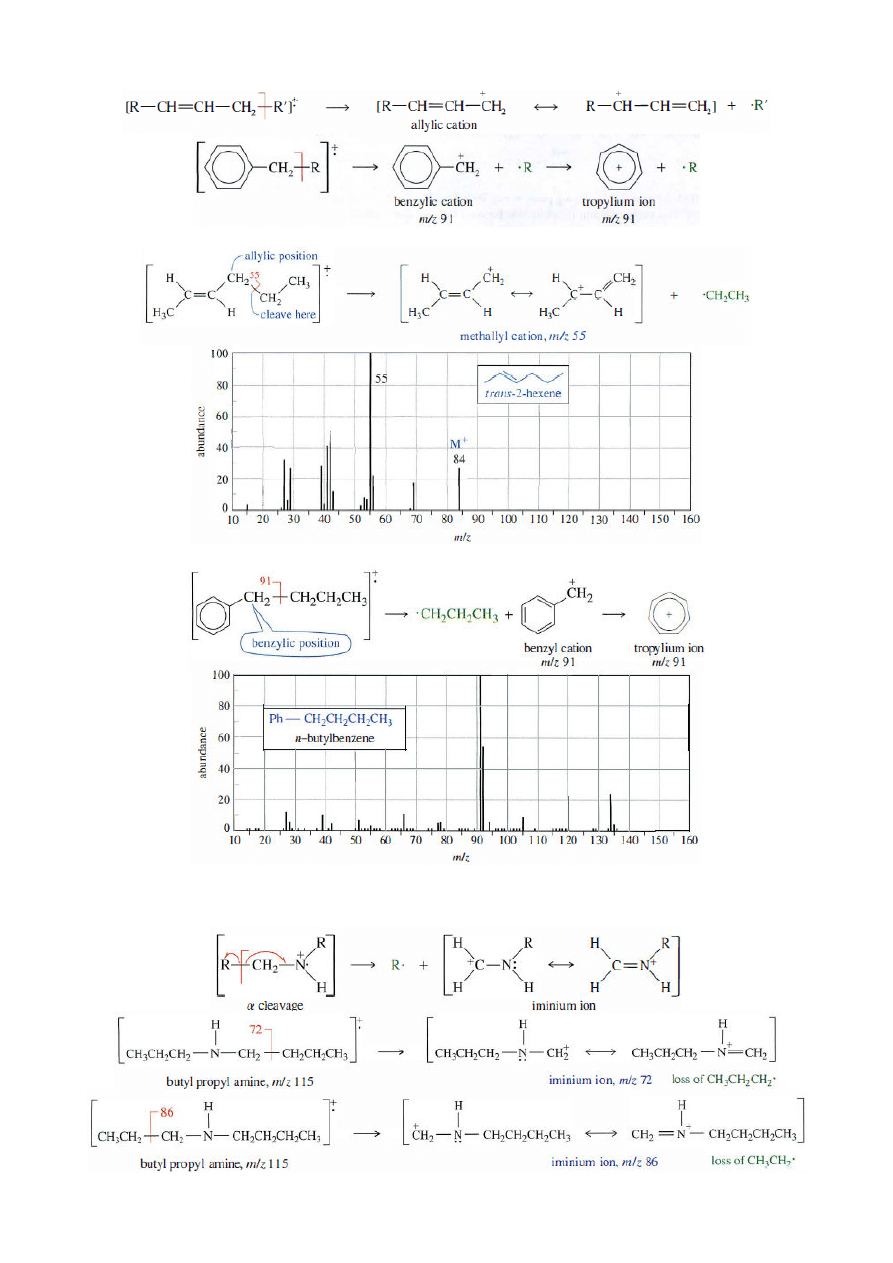
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
7
3. Alkeny i związki aromatyczne
- rozpad do kationów allilowych i benzylowych
4. Aminy
- rozpad
α
z utworzeniem stabilizowanych jonów iminiowych

Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
8
5. Etery
- utrata grupy alkilowej
lub
- rozpad
α
6. Ketony i aldehydy
- utrata grup alkilowych z utworzeniem jonów acyliowych
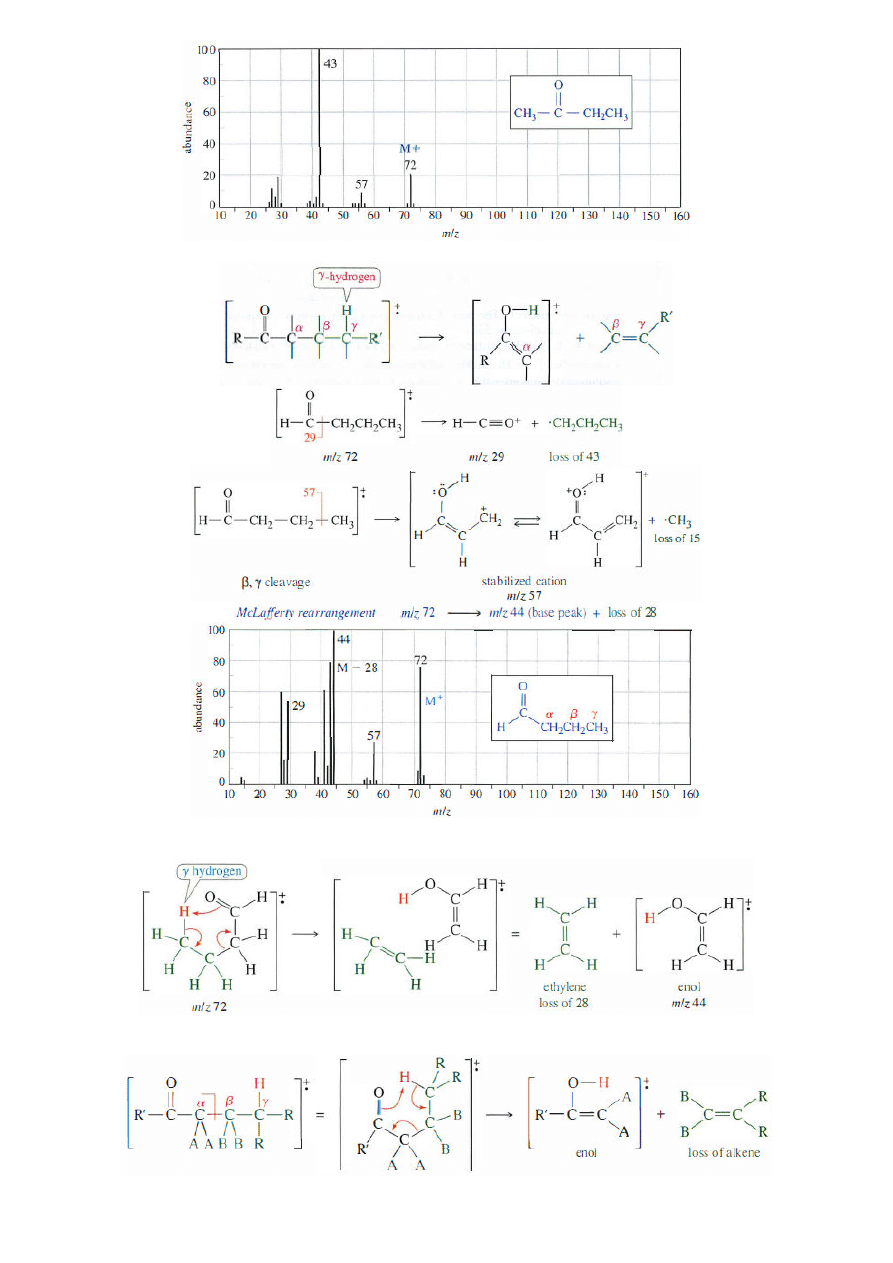
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
9
- przegrupowanie McLafferty'ego
- schemat przegrupowania McLafferty’ego butanalu
- ogólny schemat przegrupowania McLafferty’ego aldehydów i ketonów
Chemia Organiczna-konwersatorium; gr. D1; 2011/12Z (B. Kozik)
10
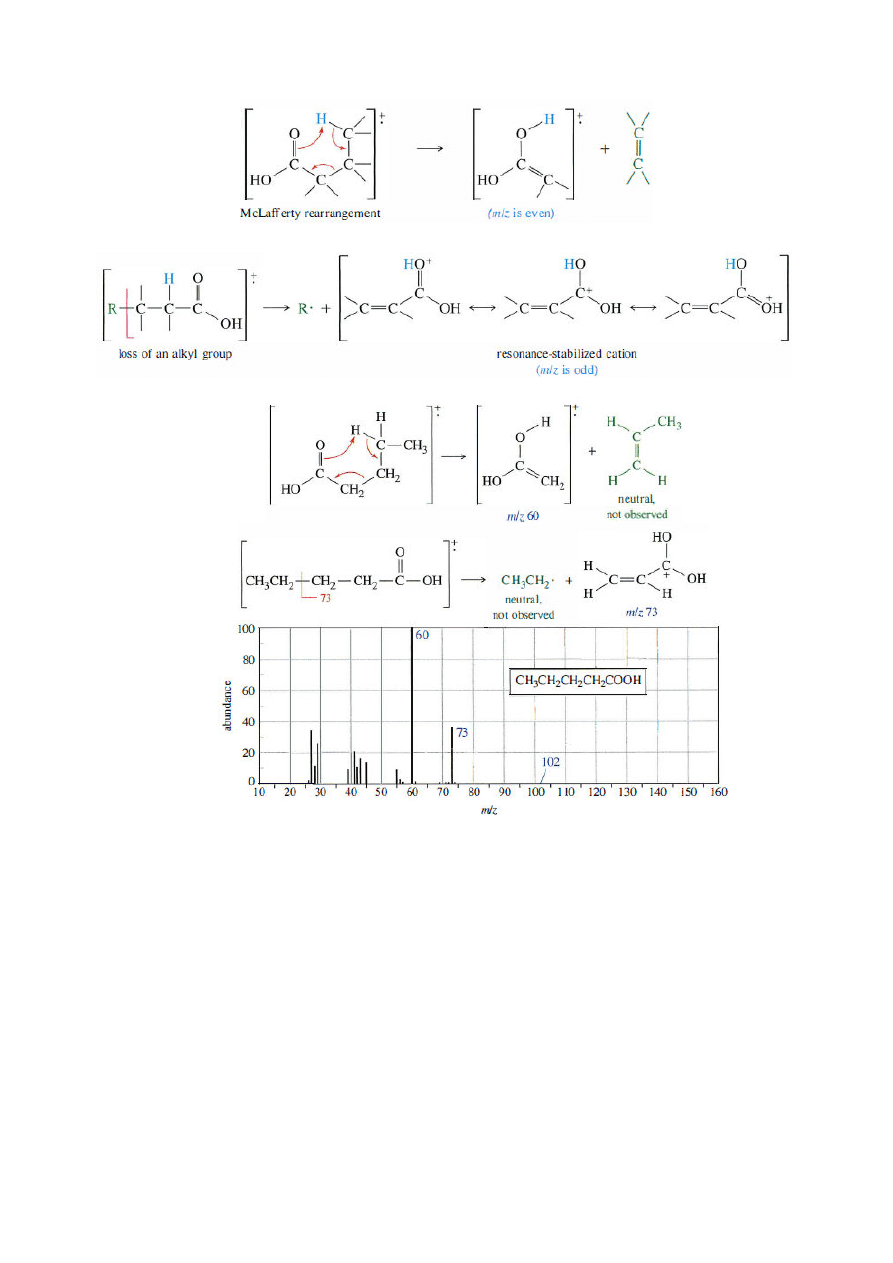
7. Kwasy karboksylowe
- przegrupowanie McLafferty’ego
- utrata grupy alkilowej z utworzeniem stabilizowanego rezonansowo kationu
Wyszukiwarka
Podobne podstrony:
IR materialy dodatkowe gr D1 II rok 2011 12Z
MS zadania gr D1 II rok 2011 12Z
IR zadania gr D1 II rok 2011 12Z
Egzamin 2011 - I termin + dodatkowe, lekarski2rok, lekarski II rok, fizjologia, Egzamin teoretyczny
MATERIAŁY BUDOWLANE-cementy, Studia, II rok, Materiały Budowlane 2
Cwiczenie Piknometr, Materiały na studia ZIP, II Rok, Fizyka, Labolatorium
fiza, Materiały na studia ZIP, II Rok, Fizyka, Labolatorium, Piknometr
Sprawozdanie Efekt Halla 2, Materiały na studia ZIP, II Rok, Fizyka, Labolatorium
wypracowanie- materiały, Gospodarka przestrzenna licencjat, II rok, Semestr IV, GIS
materialy bud- skały, Studia, II rok, Materiały Budowlane 2
Wyn.Hist.UE.gr.L31.II sem.2011, STUDIA-Administracja
Ergonomia 41-49, Materiały na studia ZIP, II Rok, Ergonomia
Chem nieorg egzamin II rok 2011 2012 grupy od 15 do 18 egzamin, Chemia
Nasiennictwo-materiały dla studentów, Studia, II rok, II rok, IV semestr, Nasiennictwo
SPrawozdanie Hall, Materiały na studia ZIP, II Rok, Fizyka, Labolatorium
przykady rozgrzewkowe do wykadlw 2013 LISTA 3, Materiały na studia ZIP, II Rok, Rachunek kosztów dla
Gr 1 IM II rok PiK zagadnienia
przykady rozgrzewkowe do wykadlw 2013 LISTA 1, Materiały na studia ZIP, II Rok, Rachunek kosztów dla
więcej podobnych podstron