
Strukturę przestrzenną białek złożonych maksymalnie z ok. 370 aminokwasów możemy uzyskać
dzięki badaniom NMR. W przypadku większych białek stosuje się metody krystalograficzne.
Odległości między obiektami i ich wielkości nie mogą być wyznaczane z rozdzielczością większą niż
długość fali promieniowania za pomocą której oświetlamy układ. Aby uzyskać dane z rozdzielczością
atomową potrzebne jest promieniowanie o odpowiednio krótkiej długości fali. Dlatego do określania
struktury makromolekuł stosujemy promieniowanie rentgenowskie.
Spis treści
1 Historia
2 Etapy uzyskiwania struktury białka
3 Czynniki wpływające na krystalizacje białek
3.1 Diagram fazowy
3.2 Jak w sposób kontrolowany przenieść białko do strefy przesycenia?
3.3 Odparowywanie wody
3.4 Optymalizacja środowiska krystalizacji
3.5 Inne czynniki, które wpływają na wzrost kryształów białkowych
4 Techniki uzyskiwania kryształów białek
5 Kryształy białkowe
6 Fale
6.1 Prawo Braggów
6.2 Transformata Fouriera
6.3 Splot funkcji
6.4 Ważne zależności
6.5 Dyfrakcja
7 W jaki sposób informacja o strukturze obiektu zakodowana jest w jego obrazie dyfrakcyjnym?
7.1 Dyfrakcja na układzie szczelin
7.1.1 Wnioski dla dwuwymiarowego układu szczelin przenoszą się na
trójwymiarowy
7.2 Dyfrakcja w sieci przestrzennej kryształu
7.2.1.1 Okrąg (sfera) Ewalda
7.2.1.2 Rozpraszanie na kryształach to rozpraszanie.
7.2.1.3 Fala ugięta przez ciągły rozkład elektronów
8 Sposoby rozwiązywania problemu fazowego:
8.1 Funkcja Pattersona
8.2 Metoda wielokrotnego podstawienia izomorficznego
8.3 Rozpraszanie anomalne
8.4 Metoda podstawienia molekularnego
8.5 Udokładnianie struktury

Historia
W 1840 roku F.L. Hunefeld opisał przypadkowo powstałe kryształy hemoglobiny dżdżownicy.
W 1912 roku Max von Laue przeprowadził pierwsze doświadczenie ugięcia promieniowania
rentgenowskiego na krysztale. *Rok później William Henry Bragg i jego syn William Lawrence
Bragg rozwiązali struktury kilku minerałów.
W 1934 roku Arthur Lindo Patterson wyprowadził nazwaną od jego nazwiska funkcję
Pattersona, która umożliwia rozwiązanie problemu fazowego dla struktur zawierających atom
ciężkiego pierwiastka.
Na początku lat 30. XX wieku pojawiły się pierwsze zdjęcia dyfrakcji: na włóknach białek w
laboratorium Williama Astbury'ego i na monokryształach w laboratorium Desmonda Bernala.
W 1951 roku Linus Pauling na podstawie obserwacji krystalograficznych i właściwości wiązań
chemicznych zapostulował struktury alfa-helisy i beta-kartki, jako główne motywy w białkach
(Nagroda Nobla 1954).
Pod koniec lat 50. XX wieku John Kendrew opublikował pierwszą w dziejach strukturę białka,
mioglobiny wieloryba. *W tym samym czasie Max Perutz opublikował strukturę hemoglobiny.
W 1953 roku Rosalind Franklin zarejestrowała zdjęcia rentgenowskie włókien DNA.
W 1965 roku uzyskano pierwszą strukturę lizozymu z białka jaja kurzego. W 1971 roku
utworzono Bank Struktur Białkowych (Protein Data Bank, PDB), w którym zdeponowano 7
struktur białek. W roku 1973 w PDB było zdeponowanych 9 struktur białkowych.
Powolny początkowo rozwój rentgenografii białek wynikał z braku silnych źródeł
promieniowania rentgenowskiego. W latach 70-tych nastąpił skok jakościowy związany z
zastosowaniem synchrotronów jako źródeł promieniowania rentgenowskiego, wprowadzeniem
programowalnych maszyn cyfrowych, oraz rozwojem inżynierii genetycznej i biotechnologii.
Etapy uzyskiwania struktury białka
Do etapów uzyskiwania białka odpowiedniego do badań krystalograficznych, a następnie określania
struktury krystalograficznej należą:
Oczyszczanie.
1.
Krystalizacja (uzyskanie dobrze rozpraszającego monokryształu).
2.
Wstępna analiza dyfrakcyjna (grupa przestrzenna, zdolność rozdzielcza, stabilność w wiązce).
3.
Zebranie pełnych danych dyfrakcyjnych
4.
Rozwiązanie problemu fazowego odpowiednią metodą:
5.
Podstawienia molekularnego
1.
Anomalnego rozpraszania
2.
Podstawienia izomorficznego pochodnych z ciężkimi atomami
3.
Utworzenie mapy gęstości elektronowej
6.
Interpretacja mapy, udokładnienie struktury
7.
Prezentacja graficzna uzyskanej struktury białka
8.
Czynniki wpływające na krystalizacje białek
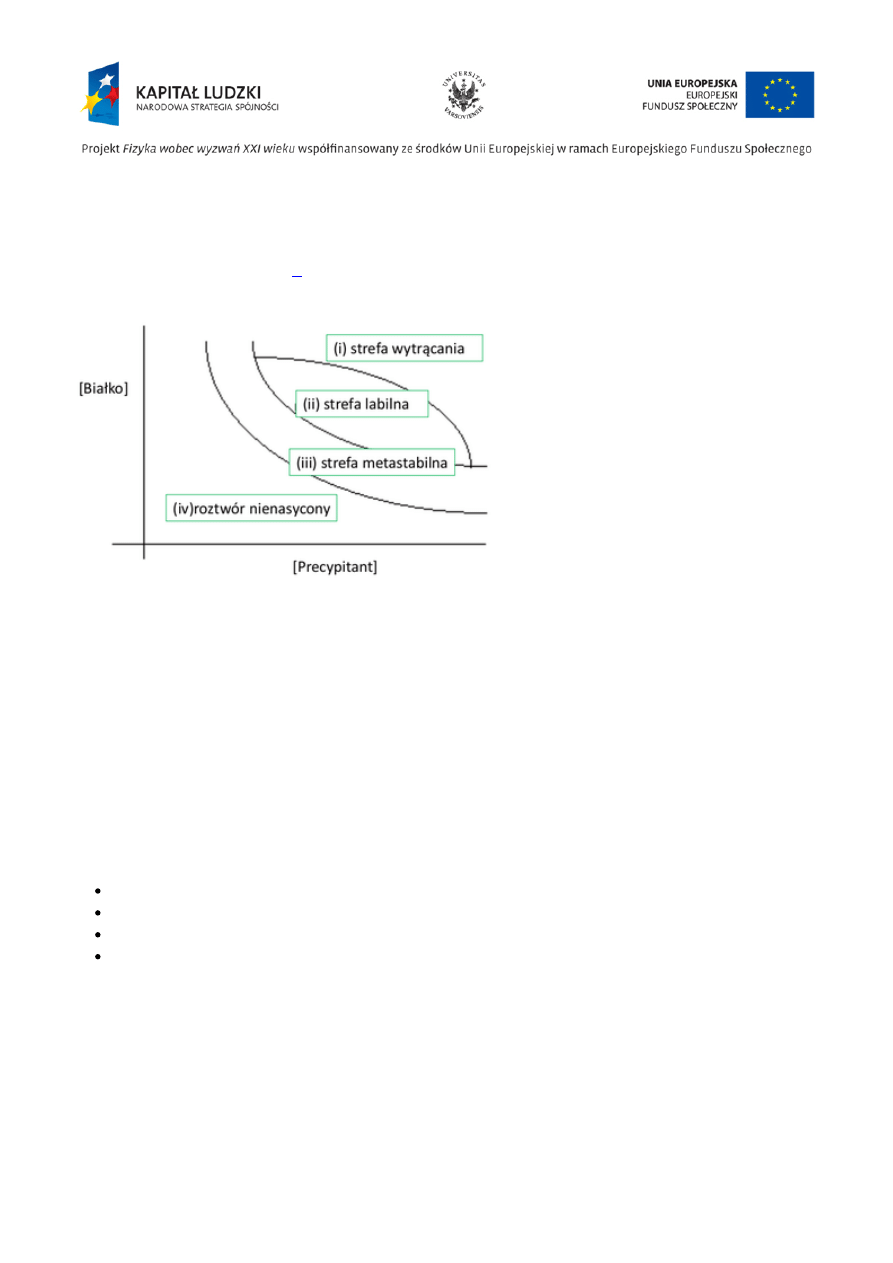
Diagram fazowy
Na rozpuszczalność białek wpływają „czynniki wytrącające” (precypitanty): np.: sole, glikol
polietylenowy. Diagram fazowy zależności stężenia białka od stężenia precypitanta jest
przedstawiony na Rys. Figure
Diagram fazowy dla hipotetycznego białka w funkcji
stężenia precypitanta.
(i)Dla wysokich stężeń białka i precypitanta białko wytrąca
się w postaci amorficznych agregatów.
(ii)Dla niższych stężeń mogą tworzyć się jądra krystalizacji,
a następnie rozpraszające kryształy.
(iii)Dla jeszcze niższych stężeń, w strefie metastabilnej, nie
tworzą się jądra krystalizacji, ale umieszczenie kryształu
białka w takim roztworze powoduje jego wzrost.
(iv)Dla najniższych stężeń białka są całkowicie
rozpuszczalne.
Jak w sposób kontrolowany przenieść białko do strefy przesycenia?
Dodać precypitant.
Suszyć kroplę cieczy zawierającej białko.
Wymieniać bufor (dializa).
Czekać i regularnie obserwować eksperyment pod mikroskopem.
Odparowywanie wody
Rozpuszczone białko umieszcza się w kropli (~5 ml) ponad lub obok rezerwuaru z buforem
zawierającym większe stężenie czynnika wytrącającego. Kropla i rezerwuar ulegają równoważeniu
wymieniając wodę. Osiągany zostaje stan przesycenia, tworzone są zarodzie krystalizacji i następuje
wzrost kryształów.
Skład roztworu do krystalizacji (sól, bufor, precypitant) wpływa na rozpuszczalność białek.

Ze zmiana pH niektóre aminokwasy (np. Asp, Glu, Lys, His, Arg, Try) zmieniają stan
naładowania (z obojętnego na naładowany lub odwrotnie).
Zawartość soli wpływa na ładunek powierzchniowy białka i oddziaływania z cząsteczkami
wody. Wsalanie ( dodanie soli zwiększa rozpuszczalność białek) lub wysalanie (dodawanie soli
zmniejsza rozpuszczalność białek)
Rozpuszczalniki polarne np. Glikol polietylenowy (PEG) wiąże cząsteczki wody.
Optymalizacja środowiska krystalizacji
Zakres krystalizacji białek to przedział 2 – 50 mg/ml .
Przeprowadzenie testu PCT (Pre-crystallization test, Hampton Research) — pozwala na
ustalenie granic stężenie białka zdolnego do krystalizacji pomiędzy precypitatem a przejrzysta
kroplą.
Temperatura i jej fluktuacje: białka zwykle krystalizują w zakresie temperatur 4 – 45°C, ale
zdarzają się wyjątki np. glukagon (60°C). Najczęściej dwie równoległe hodowle w
temperaturach 4°C i 20°C.
Pożądana czystość (homogeniczność białka — chemiczna, izomeryczna, konformacyjna,
oligomeryczna) testowana z wykorzystaniem m.in. elektroforezy natywnej (obserwuje się
korelację pomiędzy heterogenicznością oligomeryczną białka a jego zdolnością do
krystalizacji).
Inne czynniki, które wpływają na wzrost kryształów białkowych
Dodatki — jony metali, ligandy,
organizm, z którego wyizolowano białko,
grawitacja, konwekcja, sedymentacja,
drgania, dźwięki,
objętość próbki,
ciśnienie,
proteoliza,
lepkość roztworu,
zanieczyszczenia,
pole elektryczne i magnetyczne itp…
Należy szukać wielu możliwych warunków krystalizacji (w niektórych uzyskuje się małe kryształy, o
kształcie igły, słabo rozpraszające promieniowanie rentgenowskie).
Jeśli nie uzyskamy w pierwszym podejściu kryształów odpowiednich do badań dyfrakcyjnych to
należy zanotować obserwowane typy wytrąceń. Mogą to być wytrącenia amorficzne, nieamorficzne
lub mikrokryształy. Doświadczony „badacz” może na podstawie typu wytrącenia zaplanować dalsze
etapy postępowania w celu uzyskania kryształu.
Techniki uzyskiwania kryształów białek
Metoda wiszącej kropli.
1.
Najbardziej rozpowszechniona technika.
Białko z roztworem zawierającym precypitant jest mieszane w stosunku 1:1.

Kropla umieszczana jest na silikonowanej płytce, którą zawiesza się nad zbiornikiem z
roztworem.
Woda paruje z kropli do wyrównania stężeń precypitanta pomiędzy zbiornikiem a kroplą
zawierającą białko.
Zwiększanie stężenia białka i precypitanta powoduje wzrost kryształów.
Metoda siedzącej kropli.
2.
Technika podobna do „wiszącej kropli”.
Kropla umieszczana jest na silikonowanej płytce, którą umieszcza się na podstawce w
zbiorniku z roztworem.
Dializa.
3.
Roztwór białka jest oddzielony od roztworu zewnętrznego za pomocą półprzepuszczalnej
membrany.
Wyrównywanie stężeń precypitanta pomiędzy rozdzielonymi membraną częściami
naczynia powoduje wzrost kryształów.
Batch crystallization.
4.
Krystalizator jest wypełniany roztworem nienasyconym.
Przesycenie jest osiągane przez stopniowe ochładzanie roztworu.
Kryształy o określonym rozkładzie rozmiarów uzyskuje się dzięki określonemu
przebiegowi procesu zmiany temperatury w funkcji czasu.
Mikroposiew.
5.
Pobranie kryształu z kropli.
Mycie kryształu.
Posiew w zrównoważonej kropli będącej w fazie metastabilnej.
Metoda stosowana dla białek, które krystalizują łatwo, ale mają tendencję do tworzenia
małych kryształów.
Makroposiew.
6.
Technika podobna do mikroposiewu.
Różnica — kryształ nie nadający się do badań dyfrakcyjnych jest kruszony.
Następnie pobierane są jego fragmenty i umieszczane w kropli będącej w fazie
metastabilnej.
Kryształy białkowe
Kryształ to obiekt posiadający symetrię translacyjną.
Symetrie tworów skończonych to tzw. symetrie punktowe zachowujące przynajmniej jeden punkt w
przestrzeni (figura przekształca się na siebie). Należą do nich:
Obroty o kąt
, najczęściej równa się 2, 3, 4, lub 6.
Inwersje względem punktu 0 — przekształcenie, w którym punkt P
1
przechodzi w punkt P
2
,
takie, że OP
1
=-OP
2
.
Obroty inwersyjne — złożenie obrotu i inwersji względem punktu leżącego na osi obrotu.
Odbicie zwierciadlane — złożenie obrotu dwukrotnego i inwersji.
Symetrie tworów nieskończonych (figura przekształca się na sąsiednią)
translacje,

obroty względem osi śrubowej (złożenie obrotu względem osi symetrii i translacji równoległej
do tej osi),
płaszczyzny ślizgowe (złożenie odbicia względem płaszczyzny symetrii i równoległej do niej
translacji.
Białka zbudowane są wyłącznie z aminokwasów typu L ↠
W wyniku operacji symetrii nie mogą utworzyć innego enancjomeru.
Możliwe są tylko osie obrotu i osie śrubowe.
Opis struktury kryształu wymaga podania:
Jednostki asymetrii — najmniejsza część kryształu, z której po zastosowaniu operacji
symetrii (obroty, translacje, osie śrubowe) uzyskujemy komórkę elementarną, Jednostka
asymetrii może zawierać jedną cząsteczkę aktywną biologicznie, część cząsteczki aktywnej
biologicznie lub kilka cząsteczek aktywnych biologicznie.
Przykład z PDB — struktura hemogloginy (aktywna biologicznie cząsteczka składa się z
czterech łańcuchów:
Struktura o ID 2hhb zawiera jedną cząsteczkę aktywnej biologicznie w jednostce
1.
asymetrii.
Struktura o ID 1hho zawiera pół cząsteczki aktywnej biologicznie w jednostce asymetrii.
2.
Struktura o ID 1hv4 zawiera dwie cząsteczki aktywnej biologicznie w jednostce
3.
asymetrii.
Komórki elementarnej — czyli najmniejszą powtarzającą się jednostkę w krysztale.
Sieci Bravais’go — sieć, zgodnie z którą ustawione są elementy składowe w krysztale. Na
podstawie symetrii sieci Bravais’go kryształy można podzielić na 7 układów
krystalograficznych:
układ trójskośny; P,
1.
układ jednoskośny; P, C,
2.
układ prostokątny (rombowy); P, C, F, I,
3.
układ tetragonalny; P, I,
4.
układ trygonalny; P,
5.
układ heksagonalny; P
6.
układ regularny; P, F, I,
7.
Gdzie oznaczenia P,C,F i I oznaczają położenia atomów: P oznacza atomy tylko w rogach
komórki, I — dodatkowy atom w środku komórki, F — dodatkowy atom na każdej ścianie
komórki, C — dodatkowy atom na wybranej ściance.
Fale
Równanie falowe jest najbardziej ogólną formą analitycznej reprezentacji ruchu falowego:
.
Rozwiązanie równania falowego:
.
Rozwiązanie ogólne równania falowego:
.
Zasada superpozycji: każde zaburzenie wywołane przez kilka fal emitowanych przez różne źródła
można wyznaczyć dodając te fale i traktując je niezależnie od siebie.
Natężenie fali I jest wielkością rzeczywistą — mierzalną:
.
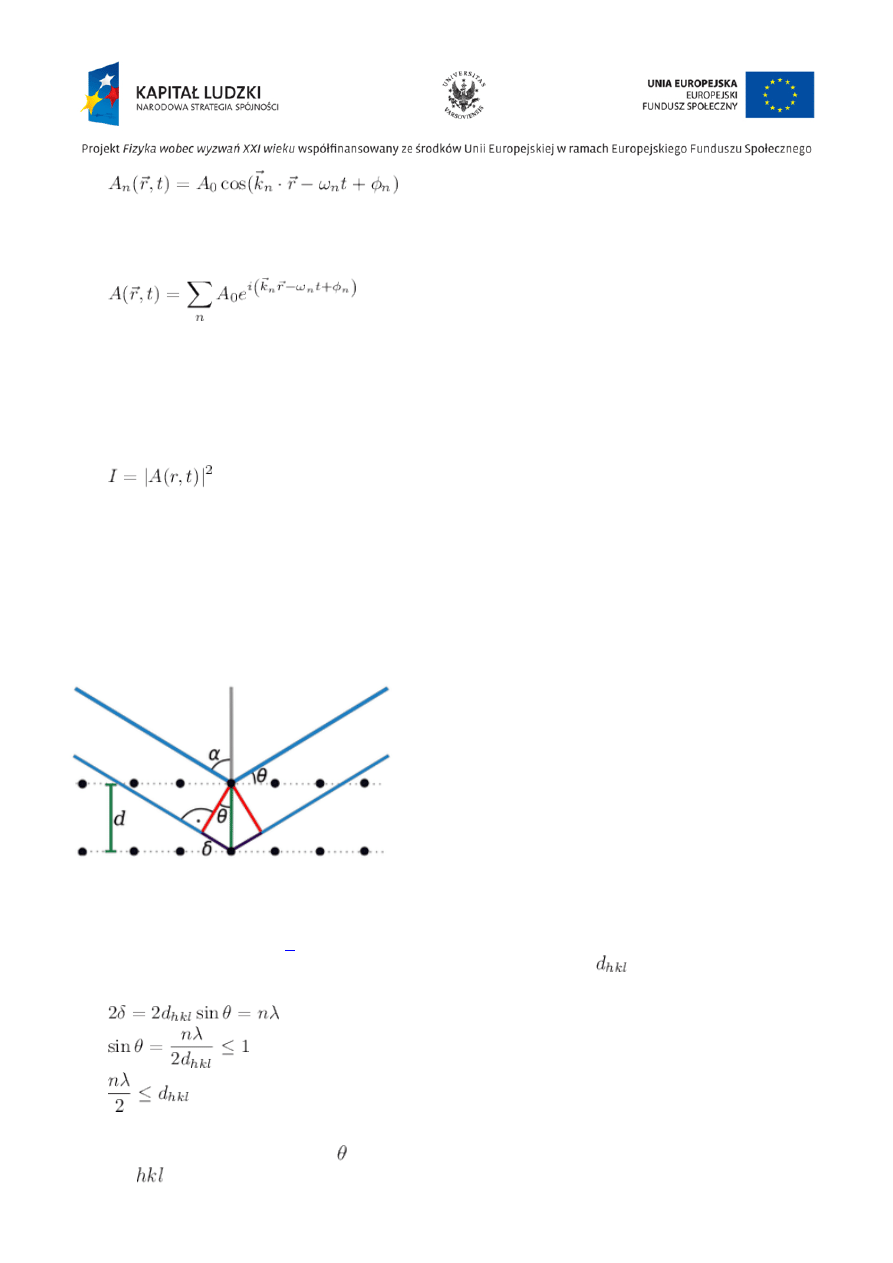
Prawo Braggów
Wzbudzone promieniowaniem protony i elektrony stają się źródłem promieniowania o częstości i
długości fali promieniowania wzbudzającego. Mówimy wtedy o rozpraszaniu, którego szczególnym
przypadkiem jest dyfrakcja czyli zjawisko rozpraszania w ściśle określonych kierunkach. Protony
rozpraszają (1837)
2
razy słabiej niż elektrony.
Ilustracja prawa Braggów
) (geometryczny warunek dyfrakcji promieni rentgenowskich na
płaszczyznach krystalicznych o odległościach międzypłaszczyznowych
):
,
,
,
gdzie: n — rząd odbicia lub ugięcia, — kąt odbicia wiązki promieni rentgenowskich od płaszczyzny
sieciowej
.

Transformata Fouriera
Jeśli
, to
jest transformatą Fouriera funkcji
.
można obliczyć
następująco:
.
Obie funkcje zawierają te same informacje, ale dotyczą różnych przestrzeni: rzeczywistej
i
odwrotnej
.
Splot funkcji
Ważne zależności
Dyfrakcja
Fale ulegające dyfrakcji na obiekcie zawierają informację o jego strukturze.
Rejestracja i analiza obrazu dyfrakcyjnego kryształu powinna doprowadzić do odtworzenia struktury
kryształu.
Strukturę opisujemy za pomocą funkcji
— funkcja amplitudy obiektu, gdzie dla każdego punktu
w krysztale możemy ustalić .
Opis dyfrakcji zawiera informację o falach rozproszonych → zawiera funkcję charakterystyczna dla
ruchu falowego.
Fala rozproszona przez element obiektu
.
Obraz dyfrakcyjny
Obraz dyfrakcyjny dowolnego obiektu jest transformatą Fouriera jego funkcji amplitudy. Znając
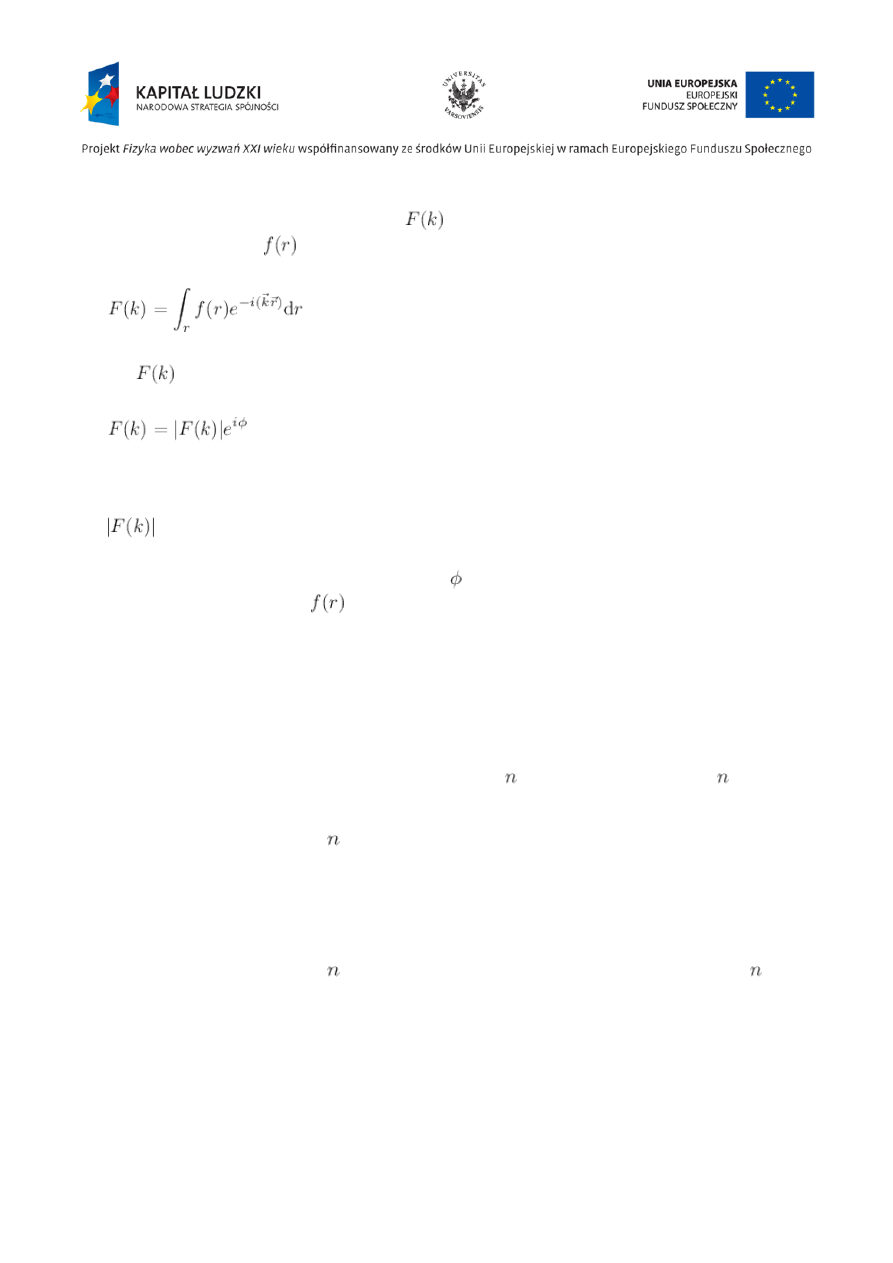
strukturę obiektu możemy obliczyć jego obraz dyfrakcyjny.
Zarejestrowawszy obraz dyfrakcyjny obiektu
możemy, dokonując odwrotnej transformacji
Fouriera, obliczyć funkcję
, czyli strukturę interesującego obiektu:
.
Problem:
— funkcja obrazu dyfrakcyjnego — jest funkcją zespoloną:
Rejestrujemy tylko natężenie promieni ugiętych, czyli
.
Tracimy natomiast informację o czynniku fazowym . Jest to tzw. problem fazowy. Jego rozwiązanie
jest niezbędne w celu obliczenia
i uzyskania struktury obiektu.
W jaki sposób informacja o strukturze obiektu zakodowana
jest w jego obrazie dyfrakcyjnym?
Dyfrakcja na układzie szczelin
Rozważmy dwa typy siatek dyfrakcyjnych, jedna złożona z wąskich szczelin, druga z szerokich
szczelin
Siatka dyfrakcyjna złożona z wąskich szczelin.
1.
Wraz ze wzrostem liczby szczelin główne maksima obrazu dyfrakcyjnego są coraz
1.
ostrzejsze.
Wysokość wszystkich maksimów jest taka sama.
2.
Położenie maksimów dyfrakcyjnych jest stałe (odległość zależy od długości fali padającej
3.
i odległości pomiędzy szczelinami).
Siatka dyfrakcyjna złożona z szerokich szczelin — splot jednej szerokiej szczeliny i szczelin
2.
wąskich.
Obrazem dyfrakcyjnym jest szereg maksimów o różnej wysokości równooddalonych.
1.
Wysokość tych maksimów nie zależy od liczby szczelin, mieści się w ramach obwiedni,
2.
która jest obrazem dyfrakcyjnym jednej szerokiej szczeliny.
Wnioski dla dwuwymiarowego układu szczelin przenoszą się na trójwymiarowy
Sieć przestrzenna kryształu może być reprezentowana przez trójwymiarową siatkę
dyfrakcyjną.

Pozycje i sposoby rozmieszczenia w przestrzeni maksimów obrazu dyfrakcyjnego sieci
przestrzennej kryształu zależą od odległości między węzłami sieci przestrzennej tego
kryształu oraz od długości fali padającego nań promieniowania rentgenowskiego.
Natomiast dokonując pomiaru wysokości maksimów dyfrakcyjnych można odtworzyć
kształt obwiedni obrazu dyfrakcyjnego motywu struktury. Dokonując jej transformacji
oznaczymy strukturę motywu badanego kryształu.
Intensywność obrazu dyfrakcyjnego kryształu zawiera informacje o strukturze jego motywu
— strukturze tworzących go molekuł.
Obraz dyfrakcyjny N szerokich szczelin:
Tf(N szczelin szerokich) = Tf(1 szczelina szeroka) * Tf(N szczelin wąskich)
Stąd:
Tf(struktury kryształu) = Tf(motywu) * Tf(sieci przestrzennej kryształu)
Dyfrakcja w sieci przestrzennej kryształu
Dla nieskończonej sieci przestrzennej:
.
Równanie jest iloczynem funkcji z których każda jest reprezentowana przez serię równoległych do
siebie płaszczyzn.
Ze względu na właściwości delty Diraca funkcja jest różna od zera tylko w punktach przecięcia się
wszystkich prostopadłych do siebie płaszczyzn.
Równanie opisuje zbiór węzłów sieci opisanej przez wektor ∆k czyli sieć odwrotną w przestrzeni
Fouriera.
Sieć rzeczywista i odwrotna przekształcają się w siebie pod wpływem transformaty Fouriera. Obie są
równoważnymi opisami budowy sieciowej kryształu.
Sieć odwrotną opisujemy wektorami bazy
. Równanie jest spełnione, gdy są spełnione
równania Laue’go.
,
,
,
.

Wprowadzamy wektor, który wyznacza węzły sieci odwrotnej i odpowiada wartości
dającej
maksimum dyfrakcyjne
Zachodzi:
,
,
.
jest prostopadły do serii płaszczyzn
w rzeczywistej sieci przestrzennej kryształu.
,
— rzeczywista odległość między płaszczyznami w rzeczywistej sieci
przestrzennej kryształu.
Maksimum dyfrakcyjne występuje, gdy różnica dróg promieni odbitych jest równa całkowitej
wielokrotności długości fali padającej.
Płaszczyzny
Okrąg (sfera) Ewalda
Dla punktu P spełnione są równania Laue’go i Bragga.
jest wektorem
sieci odwrotnej.
Jeśli węzeł sieci odwrotnej znajdzie się na okregu Ewalda to zajdzie dyfrakcja — zarejestrujemy
promień dyfrakcyjny (np. na błonie fotograficznej).
W stanie statycznym na okręgu Ewalda dla danych warunków są trzy węzły sieci odwrotnej.
Liczba obserwowanych promieni ugiętych zwiększa się gdy obracamy kryształ. Rozszerzenie okręgu
Ewalda do 3D — sfera Ewalda.
Plamki dyfrakcyjne na np. błonie światłoczułej są rzutem węzłów sieci odwrotnej, które odpowiadają
maksimom dyfrakcyjnym i znalazły się na sferze odbicia podczas pomiaru. Plamki możemy
wywskaźnikować przypisując im wskaźniki
Położenia maksimów dyfrakcyjnych są zdeterminowane przez grupę przestrzenną (stałe sieciowe
).
Natężenia maksimów są zdeterminowane rozłożeniami atomów w jednostce asymetrycznej.
Rozpraszanie na kryształach to rozpraszanie.
Efektywnym źródłem promieniowania są elektrony.
Obowiązuje zasada superpozycji: całkowita amplituda fali rozproszonej jest równa sumie
amplitud fal pochodzących od każdego elektronu.

Gęstość elektronowa ρ(r) może opisywać rozkład elektronów w komórce elementarnej
kryształu – umożliwia lokalizację atomów i opis struktury.
Fala ugięta przez ciągły rozkład elektronów
Dla atomu:
Dla komórki elementarnej (KE) kryształu i stałej wartości (funkcja rozpraszania elektronu):
,
,
,
,
czynnik struktury (wielkość zespolona):
,
.
Znając rozkład gęstości (
możemy wyznaczyć
, ale nie odwrotnie, tymczasem zależy nam
na wyznaczeniu rozkładu gęstości przy znanym rozkładzie
.
.
Ze względu na rozkład dyskretny
:
.
Sposoby rozwiązywania problemu fazowego:
Metody bezpośrednie
1.
Oparte na zależnościach pomiędzy pewnymi refleksami.
a.
Wymagana wysoka rozdzielczość i niewielkie układy.
b.

Popularna w przypadku badań niewielkich struktur.
c.
Funkcja Pattersona.
2.
Metoda podstawienia izomorficznego — wprowadzenie ciężkiego atomu do kryształu i
3.
obserwacja, które refleksy są z nim związane:
wielokrotnego (Multiple Isomorfous Replacement, MIR),
a.
jednokrotnego, połączona z anomalnym rozpraszaniem (Multiple wavelength Anomalous
b.
Dispersion, MAD).
Metoda podstawienia molekularnego (Molecular Replacement, MR):
4.
znalezienie podobnej struktury i oparcie na niej pierwszych prób uzyskania rozwiązań,
a.
popularność wzrasta wraz z ilością rozwiązanych struktur.
b.
Funkcja Pattersona
Atomy — obiekty punktowe — funkcja gęstości przyjmuje wartość , gdy w położeniach i
znajduje się atom, lub zero, w przeciwnym wypadku. Funkcja Pattersona jest równa wartości
niezerowej, gdy wektor względnego położenia u jest równy odległości międzyatomowej. Obrazem
funkcji
jest zbiór pików pojawiających się w miejscach odpowiadających odległościom między
atomami.
Można wykazać, że:
Przykład: komórka elementarna jednowymiarowego kryształu złożona z trzech atomów w pozycjach
— na widmie Pattersona piki w siedmiu pozycjach:
. Jeśli
na widmie Pattersona pięć pików
.
Odległość pomiędzy drugim i trzecim atomem jest równa odległości między pierwszym i drugim: 0,1.
Oba te piki w tym samym miejscu, wysokości ich się zsumują, a rozdzielenie nie będzie możliwe.
Trudność w interpretacji mapy Pattersona wynikająca z ograniczeń pomiarowych widma
dyfrakcyjnego. Pojedynczy pik jest złożony z piku centralnego i zbioru harmonicznych otaczających
go. Zdarza się, że pierwsze harmoniczne (maksima poboczne) nakładają się na sąsiadujące piki.
Maksima poboczne zniekształcają informację o położeniach atomów i utrudniają poprawne
rozpoznanie pików Pattersona.
Informacje zawarte w mapie Pattersona są niejednoznaczne (trudności interpretacyjne)
Metoda wielokrotnego podstawienia izomorficznego
Polega na wprowadzaniu do kryształu bez wywoływania zmian w jego budowie sieciowej związków
zawierających ciężkie atomy (Pt, Pb, Ag, Au, Hg) i uzyskaniu pochodnych izomorficznych, różniących
się od kryształu niemodyfikowanego natężeniem niektórych promieni dyfrakcyjnych —co stwarza
możliwość oznaczenia położeń atomów ciężkich w kryształach pochodnych izomorficznych a

następnie znalezienia faz dla kryształu niezmodyfikowanego.
Rozpraszanie anomalne
Elektrony wewnętrznych powłok elektronowych nie mogą być traktowane jako swobodne oscylatory
o częstości rezonansowej i współczynniku tłumienia . Czynnik rozpraszania dla elektronu:
— dyspersja,
— absorpcja.
W 1925 roku Hermann Francis Mark wykazał, że rozpraszanie promieniowania rentgenowskiego w
pobliżu progu absorpcji zależy od długości fali.
Dane dyfrakcyjne zabrane dla różnych częstości fali symulują izomorficzne podstawienia.
Metoda podstawienia molekularnego
Zastosowanie w rozwiązywaniu struktur białek blisko spokrewnionych z białkami o znanej strukturze
i skatalogowanymi parametrami atomów. Znana cząsteczka jest modelem który służy do
rozwiązywania struktury podobnej cząsteczki za pomocą funkcji translacyjnej i rotacyjnej.
.
Zakładamy, że struktury są identyczne (pierwsze przybliżenie — ta sama gęstość elektronowa) i
poszukujemy operatorów rotacji i translacji przeprowadzających jedną w drugą.
Poszukujemy minimum funkcji
w dwóch etapach (translacja i rotacja).
Funkcja rotacji:
Porównanie uzyskanej mapy Pattersona z mapą Pattersona wybranej struktury.
Mapa Pattersona jest związana z orientacją molekuły, ale nie położeniem w komórce
elementarnej.
Funkcja translacji:
Mapa Pattersona jest bezużyteczna.
Przesuwamy cząsteczkę w komórce elementarnej, liczymy teoretyczna wartość
i
porównujemy z obserwowana eksperymentalnie
.
Udokładnianie struktury
Udokładnianie struktury ma na celu zyskanie najlepszej zgodności pomiędzy modelem molekuły
otrzymanym po rozwiązaniu problemu faz ze strukturą rzeczywistą w krysztale.
Dla białek różnice w niewielkim stopniu dotyczą łańcucha głównego, w znacznym reszt bocznych
aminokwasów.
Znając strukturę próbną ogląda się ją w programie graficznym i pozostawia tylko „dobre”
atomy, mające sens fizyczny.
Program SHELXL stosuje metodę najmniejszych kwadratów do polepszenia rozwiązania.
Zmieniane są współrzędne atomów, tak aby obliczone z nich czynniki struktury |Fhkl|2
możliwie mało różniły się od obserwowanych.
Po znalezieniu optymalnych współrzędnych atomów ze względu na dopasowanie do zbioru
refleksów obliczana jest ponownie mapa gęstości elektronowej i porównywana z mapą
otrzymaną na podstawie czynników struktury powstałych przez dodanie obliczonych faz do
obserwowanego widma.
W mapie różnicowej znajdujemy brakujące atomy i powtarzamy obliczenia aż do uzyskania
zgodności obu map elektronowych (wynikającej z położenia atomów i obliczonej z czynników
F).
Na koniec krytycznie przyglądamy się jakości mapy i odpowiadamy na pytania:
Czy sekwencja zgadza się z gęstością elektronową i sekwencją pierwszorzędową?
Czy widać wszystkie ciężkie atomy ?
Czy kontakty w krysztale nie wprowadzają zaburzeń?
Testem poprawności struktury są wykresy Ramachandrana podające zakres w jakim
powinny mieścić się katy torsyjne wiązania peptydowego (kąt (fi)
i kąt (ksi)
) w zależności od drugorzędowej struktury białka.
Zbieranie danych dyfrakcyjnych
Dyfraktometr (urządzenie rejestrujące kierunki (kąty odbłysku) oraz natężenia ugiętych na
krysztale wiązek promieniowania) składa się z:
Źródła promieniowania.
Monochromatora.
Miejsca na próbkę.
Detektora (licznik scyntylacyjny).
Komputera sterującego dyfraktometrem i rejestrującego wyniki pomiarów.
Najczęściej stosowane metody
W metodzie Lauego na nieruchomy monokryształ pada wiązka równoległych promieni
1.
rentgenowskich o różnych częstościach. Zwykle stosuje się promieniowanie emitowane przez
anodę wolframową, a średnica wiązki padającej wynosi 0,5-1,2 mm. Preparatem w tej metodzie
jest na ogół monokryształ lub wycięta z niego płytka, o grubości 0,05-0,4 mm. Obraz
dyfrakcyjny rejestruje się na płaskiej błonie fotograficznej ustawionej za kryształem,
prostopadle do kierunku promieni pierwotnych.
W metodzie obracanego kryształu wiązka równoległa monochromatycznego promieniowania
2.
rentgenowskiego pada na niewielki monokryształ. Średnica lub szerokość wiązki wynosi od
0,5-1 mm. Badanemu kryształowi nadaje się najczęściej kształt walca o średnicy 0,1-0,3 mm i
długości kilku milimetrów lub kulki o średnicy kilku dziesiątych milimetra. Przy takim kształcie
preparatu, drogi jakie przebywają w krysztale wiązki ugięte promieniowania, należące do

jednej warstwicy, są jednakowe. Ułatwia to określenie i porównanie ze sobą natężeń refleksów.
Rentgenogramy wykonane tą metodą nazywa się dyfraktogramami warstwicowymi.
Metoda kołysanego kryształu jest odmianą metody obracanego kryształu. W metodzie
3.
kołysanego kryształu nie wykonuje on obrotu o pełne 360o, lecz jest obracany tam i z
powrotem, w zakresie niewielkich kątów. Refleksów w warstwicach jest znacznie mniej niż w
metodzie obracanego kryształu co pozwala uniknąć nakładania się ich na siebie. Ułatwia to
wskaźnikowanie.
.Metoda Weissenberga — cylindrycznie zwinięta błona fotograficzna, umieszczona
4.
współosiowo z osią obrotu kryształu, przesuwa się — tam i z powrotem — równolegle do tej
osi.
Źródła promieniowania
Promieniowanie rentgenowskie (promieniowanie w zakresie od 10 pm do 10 nm powstające w
wyniku zderzeń elektronów z atomami) uzyskiwane jest poprzez wyhamowywanie rozpędzonych
elektronów na materiale o dużej (powyżej 20) liczbie atomowej (promieniowanie hamowania) i
wybijanie elektronów z atomów anody przez rozpędzone elektrony (promieniowania
charakterystyczne anody) Źródłem promieniowania jest lampa rentgenowska. Położenie pasm w
widmie charakterystycznym zależy od różnicy poziomów energetycznych, danego pierwiastka
wykorzystanego przy konstrukcji lampy. Im wyższa liczba atomowa pierwiastka tym większe różnice
energii między wewnętrznymi poziomami energetycznymi = emitowane promieniowanie o coraz
krótszej fali.
Promień świetlny odbija się od powierzchni ściany kryształu, a promień rentgenowski, dzięki
przenikalności w głąb, odbija się od wielkiej — w założeniu nieskończonej — liczby równoległych
płaszczyzn sieciowych należących do tej samej rodziny
. Stąd wzmocnienie promieni odbitych
od równoległych płaszczyzn następuje dla różnicy dróg będącej całkowitą wielokrotnością długości
fali
(fale zgodne w fazie).
Promieniowanie synchrotronowe — efektywniejsze źródła promieniowania X — poruszające się po
okręgu elektrony w synchrotronach. Duże natężenie promieniowania znacznie skraca czas
uzyskiwania obrazów dyfrakcyjnych. Energia promieniowania emitowanego
, gdzie: —
energia elektronów, — promień krzywizny toru elektronów. Energie osiągane przez elektrony : 2-6
GeV.
Widmo promieniowania synchrotronowego ma charakter ciągły, ale można z niego wyciąć wiązkę
monochromatyczną, którą wykorzystuje się w metodach dyfrakcyjnych. Natężenie promieniowania
synchrotronowego jest 106-107 razy większe niż natężenie promieniowania pochodzącego z lamp
rentgenowskich.
Wyszukiwarka
Podobne podstrony:
MetodyOpt Biofiz 2013 w3 polaryzacja
Metody biologii molekularnej sprawozdania
Biofizyka molekularna 1
Biofizyka molekularna 4
Metody obrazowe i molekularne w ZBN
Biofizyka molekularna 2
Metody biologii molekularnej w diagnostyce medycznej(1)
MetodyOpt Biofiz 2013 w9 magnetyzm
Zagadnienia na egzamin z Biofizyki Molekularnej i Medycznej
Metody biologii molekularnej koło
Biofizyka molekularna 3
50 Metody biologii molekularnej wykorzystywane w taksonomii molekularnej
7 [ Biofizyczne metody monitorowania ciąży ]
więcej podobnych podstron