
Ćwiczenie
T: Wykrywanie i oznaczanie liczby bakterii z grupy coli
1. Wykrywanie i oznaczanie liczby bakterii z grupy coli
a) Najbardziej prawdopodobna liczba bakterii z grupy coli w 1 ml
b) Metoda filtrów membranowych. Wskaźnik bakterii z grupy coli.
Bakterie z grupy coli występują w jelicie człowieka oraz wielu gatunków zwierząt. Obecność
i stopień zanieczyszczenia fekalnego jest ważnym wskaźnikiem w ocenie jakości wody.
Ponieważ zdolność niektórych bakterii z grupy coli do przeżycia w wodzie jest ograniczona
ich obecność i liczba może służyć do oceny świeżego zanieczyszczenia kałowego wody.
Bakterie grupy coli:
G(-)
Oksydazoujemne
Tlenowe i względnie beztlenowe
Zdolność do wzrostu w obecności soli żółci
Zdolność do rozkładu i fermentacji laktozy
Zdolność do rozkładu mannitolu do aldehydu i gazu w czasie 48h inkubacji w temp
37°C
Bakterie grupy coli termotolerancyjne to bakterie z grupy coli wykazujące właściwości
biochemiczne jw. ale podczas inkubacji w 44°C.
Domniemane Escherichia coli to bakterie grupy coli termotolerancyjne, wytwarzające indol z
tryptofanu.
Domniemane E.coli uznaje się za E. coli gdy:
mają zdolność do redukcji czerwieni metylowej i
dekarboksylacji kw. L – glutaminowego
brak zdolności do wytwarzania acetylometylo karbinolu
brak zdolności do wykorzystania cytrynianu jako jedynego źródła węgla
brak wzrostu w obecności cyjanku potasu
Bakterie z grupy coli:
a) E. coli
b) Citrobacter sp.
c) Enterobacter sp.
d) Klebsiella sp.
I.
NPL bakterii z grupy coli w 1 ml próby
Do badania używamy pożywki z siarczanem laurylowym, laktozą i rurką Durhama
Siarczan laurylowy – hamuje rozwój G(+)
1. Wykonujemy rozcieńczenia badanej próby w postępie dziesiętnym
2. Na podłoże posiewamy próbę wody w systemie trójkowym tzn.

posiewa się po 10 ml wyjściowej próby wody do 3 kolbek (w każdej 10
ml podwójnie stężonego podłoża)
posiewa się po 1 ml wyjściowej próby do 3 probówek (w każdej 10 ml
standardowego podłoża)
posiewa się po 1 ml rozcieńczenia 10
-1
do 3 probówek (w każdej 10 ml
standardowego podłoża)
posiewa się po 1 ml rozcieńczenia 10
-2
do 3 probówek (w każdej 10 ml
standardowego podłoża)
posiewa się po 1 ml rozcieńczenia 10
-3
do 3 probówek (w każdej 10
ml standardowego podłoża)
3. Inkubacja prób w 37 °C przez 24-48h.
Jako próbę dodatnią uznaje się probówkę z widocznym zmętnieniem oraz
gazem w rurce Durhama.
4. Próby „+” posiewa się na odpowiednio przyporządkowane podłoża
potwierdzające (na 1 probówkę z próbą „+” przypada jedno podłoże
potwierdzające).
Podłoże potwierdzające:
Laktoza, rurka Durhama
Żółć – czynnik wybiórczy
Zieleń brylantowa – hamuje rozwój G(+)
5. Każdemu rozcieńczeniu przyporządkowujemy liczbę prób dodatnich z
podłoży potwierdzających. Wyznaczamy liczbę składającą się z 3 cyfr
według następujących zasad:
1) Pierwsza cyfra odpowiada największemu rozcieńczeniu dającemu wyniki dodatnie w 3
probówkach oraz dwa kolejne większe rozcieńczenia (czyli próbki o mniejszej
koncentracji)
Przykład 1
2) Jeżeli wykonano niewystarczającą liczbę rozcieńczeń ponad największe rozcieńczenie
dające wynik „+” w 3 probówkach, należy wybrać 3 największe rozcieńczenia serii (tj.
takie, które zawierają najniższą koncentrację próbki).
Przykład 2
3) Jeżeli nie ma rozcieńczenia z maksymalną liczbą prób dodatnich pod uwagę bierzemy
3 największe rozcieńczenia z wyjątkiem sytuacji opisanych poniżej w pkt. 4.
Przykład 3
4) W przypadku, gdzie 2 z 3 rozcieńczeń wybranych na podstawie pkt 1), 2) i 3) nie daje
wyników dodatnich należy wybrać najniższe rozcieńczenie (największe stężenie) nie
dające wyniku „+” (czyli 0) i dwa poprzednie rozcieńczenia (czyli próbki o wyższej
koncentracji).
Przykład 4
Przykład 5
Dopuszczalna jest sytuacja w przykładzie 6, gdzie jedyna próba dodatnia znajduje się na 1
pozycji.
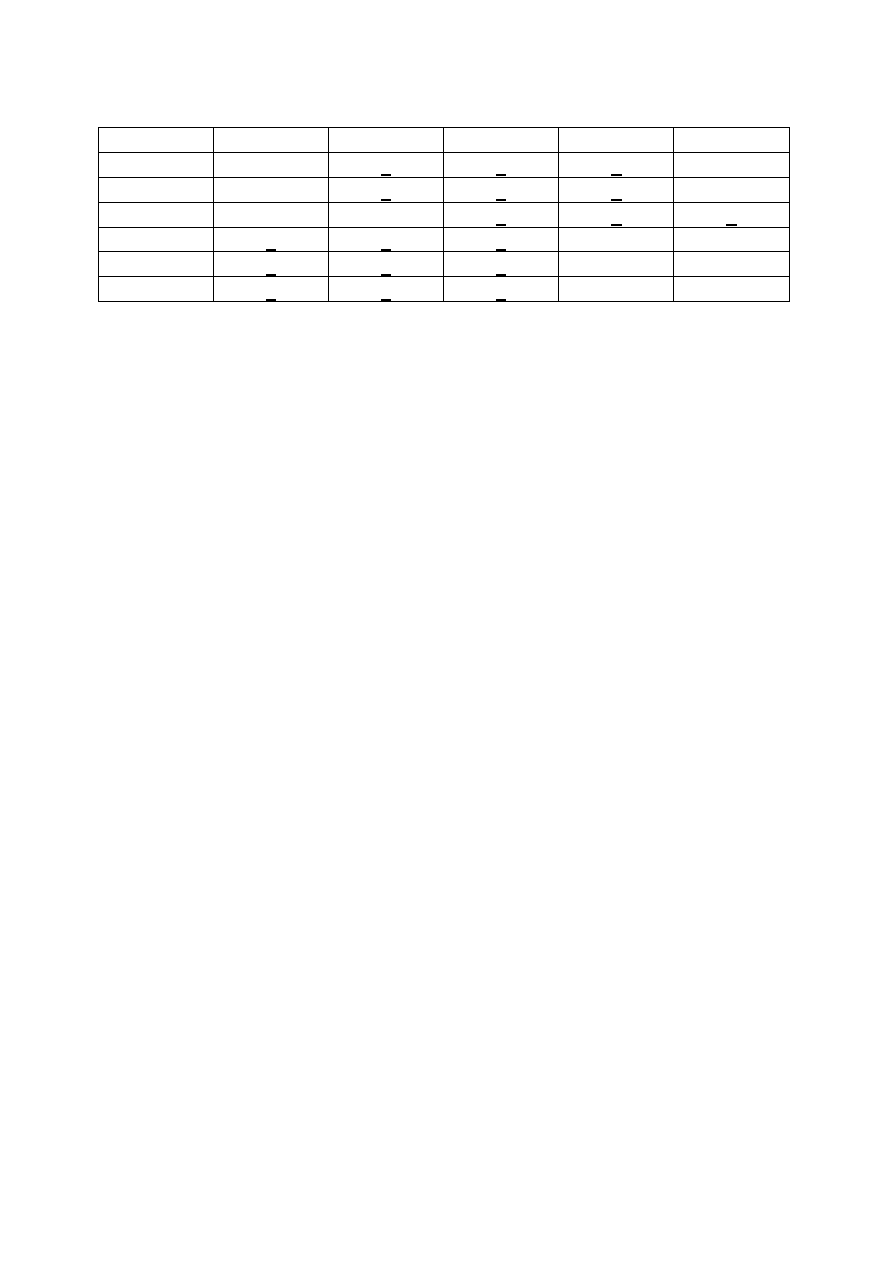
10 ml
1 ml
10
-1
ml
10
-2
ml
10
-3
ml
Przykład 1
3
3
2
1
0
Przykład 2
3
3
3
0
Przykład 3
2
2
1
1
0
Przykład 4
3
3
0
0
0
Przykład 5
2
2
0
1
0
Przykład 6
1
0
0
0
0
6. Porównujemy naszą liczbę z tablicami i odczytujemy wynik.
7. Wynik odczytany z tablic mnożymy przez odwrotność rozcieńczenia
odpowiadającego pierwszej z cyfr wyznaczonej liczby oprócz sytuacji,
gdzie 1 cyfra odpowiada posiewowi 10 ml próby na 10 ml podwójnie
stężonego podłoża. Wówczas odczytany z tablic wynik najpierw dzielimy
przez 10.
Końcowy wynik to NPL bakterii z grupy coli w 1 ml.
II.
Metoda filtrów membranowych dla bakterii z grupy coli
Wykonuje się identycznie jak w przypadku metody filtrów membranowych dla ogólnej liczby
bakterii ale nie stosujemy szeregu optymalnego (tzn. bierzemy pod uwagę nawet 1 bakterię i
powyżej 96).
Drugą różnicą jest typ stosowanego podłoża. W tym wypadku stosujemy podłoże o
następującym składzie:
Laktoza
Błękit bromotymolowy – wskaźnik
Tergitol – zahamowanie wzrostu G(+)
TTC (chlorek trifenylo tetrazolu) – zahamowanie wzrostu G(+)
1. Określoną objętość wody sączymy przez filtr, który umieszcza się na powierzchni
podłoża opisanego wyżej. [0,1 ml; 1 ml; 10 ml]
2. Inkubacja 24 h w temp 37°C
3. Liczymy kolonie. Pod uwagę bierzemy kolonie o barwie żółtej lub czerwonej lub
pomarańczowej, które tworzą żółtą strefę (żółte halo) na podłożu pod filtrem.
Bakterie z grupy coli termotolerancyjne to kolonie o barwie j.w, które obserwujemy po
inkubacji w temp. 44°C.
4. Aby potwierdzić wynik badań posiewa się próby dodatnie na wodę peptonową z
laktozą i rurką Durhama. Inkubacja 48 godzin w temp 37°C. Pojawienie się gazu
potwierdza obecność bakterii z grupy coli.
Aby potwierdzić obecność bakterii z grupy coli termotolerancyjnych i domniemanych E. coli
kolonie o cechach j.w przesiewa się na wodę peptonową z laktozą, tryptofanem i rurką
Durhama. Inkubuje się 24 h w temp 44 °C i dodaje do próby odczynnik Kovacsa. Obecność
gazu w rurce potwierdza występowanie bakterii grupy coli termotolerancyjnych.

Pojawienie się czerwonego pierścienia w próbie potwierdza obecność domniemanych E. coli.
Obliczamy wskaźnik grupy coli
WSKAŹNIK = liczba kolonii (dodatnich, potwierdzonych) x 100
objętość przefiltrowanej wody
Wskaźnik = liczba bakterii grupy coli w 100 ml próby
Wyszukiwarka
Podobne podstrony:
oznaczanie bakterii grupy coli, materiały farmacja, Materiały 4 rok, epidemiologia, Higiena i epidem
bakterie wykłady, 1. E.coli, (salmonella), Mikrobiologia 3
BAKTERIE Z GRUPY PSEUDOMONAS I INNE PAŁECZKI GRAMUJEMNE., BAKTERIE Z GRUPY PSEUDOMONAS I INNE PAŁECZ
Ćwiczenia 4 Wyznaczanie parametrów i liczby stanowiskprzeładunkowych
Instrukcja do ćwiczeń laboratoryjnych Określanie wielkości kinematycznych chodu człowieka
BAKTERIE Z GRUPY PSEUDOMONAS I INNE PAŁECZKI GRAMUJEMNE, pwr, W7 wydział inżynierii środowiska, Pwr
Metody wykrywania mechanizmów oporności bakterii na antybiotyki nowa (1)
ćwiczenie nr 3, OKREŚLANIE STRUKTURY SPOŻYCIA ENERGII
Ćwiczenie nr 2 Określenie współczynnika lepkości cieczy doc
Bakterie z grupy Pseudomonas i inne pałeczki gram ujemne
Dezaktywacja bakterii Escherichia coli z ozonem
6 17 03 2014 Ćwiczenie 4b USTALANIE LICZBY OBSERWACJI
NO 04 A004 3 2010 Metody okreslania liczby urządzeń
OKREŚLENIA ĆWICZEŃ, metodyka ruchu
Ćwiczenie Amylolityczne i Lipolityczne bakterie
5b. Wstępna lista właściwości grupy, Ćwiczenia - dr K
więcej podobnych podstron