
1
Literatura:
Minczewski J., Marczenko Z.: Chemia analityczna. T.1. Podstawy teoretyczne i analiza jakościowa.
Wyd. 10. PWN, Warszawa 2009
Kocjan R.: Chemia analityczna. Analiza jakościowa. Analiza klasyczna; tom 1, Wyd.1 PZWL,
Warszawa, 2000.
Skrypt do ćwiczeń z chemii ogólnej, nieorganicznej i analitycznej, Białystok 2010, pod redakcją E.
Skrzydlewskiej.
Szmal Z., Lipiec T.: Chemia analityczna z elementami analizy instrumentalnej. Wyd. VII poprawione i
unowocześnione PZWL, Warszawa, 1997.
Celem ćwiczenia jest poznanie warunków strącania kationów grupy III oraz opanowanie umiejętności
przeprowadzenia analizy systematycznej mieszaniny kationów tej grupy.
Zakres materiału obowiązującego na ćwiczenie:
Znajomość warunków strącania osadów kationów grupy III z odczynnikiem grupowym. Umiejętność
zapisywania równań reakcji chemicznych charakterystycznych dla kationów grupy III i reakcji rozpuszczania
trudno rozpuszczalnych osadów powstałych w wyniku w/w reakcji w dobrze rozpuszczalne sole. Znajomość
poszczególnych etapów rozdzielenia mieszaniny kationów grupy III wraz ze znajomością równań reakcji
chemicznych i efektów zachodzących reakcji. Znajomość obliczeń chemicznych – pH mocnych elektrolitów.
Zagadnienia z wykładów poprzedzających ćwiczenie.
I. Część wprowadzająca
Kationy III grupy: Ni
2+
, Co
2+
, Fe
2+
, Fe
3+
, Mn
2+
, Zn
2+
, Al
3+
, Cr
3+
Odczynnik grupowy - (NH
4
)
2
S lub AKT w środowisku zasadowym
Pod wpływem działania odczynnika grupowego w obecności amoniaku i chlorku amonu przy pH 8–9
wytrącane są siarczki lub wodorotlenki kationów III grupy:
CoS
, NiS
, FeS
, Fe
2
S
3
osady czarne
ZnS
, Al(OH)
3
osady białe
MnS
osad cielisty
Cr(OH)
3
osad zielonkawy
Siarczki i wodorotlenki kationów III grupy są nierozpuszczalne w wodzie, natomiast łatwo
rozpuszczają się w rozcieńczonych kwasach mineralnych (w odróżnieniu od siarczków kationów I i II grupy).
W związku z tym, siarczki te nie mogą się wytrącić w warunkach, w których zachodzi wytrącanie siarczków
grupy II, a więc w środowisku kwaśnym. Fakt ten tłumaczy się tym, że H
2
S jako bardzo słaby kwas daje w
roztworze wodnym bardzo mało jonów S
2–
i dlatego iloczyn rozpuszczalności większości siarczków III grupy
nie może być przekroczony. Stosując zamiast H
2
S jego rozpuszczalne sole, np. (NH
4
)
2
S, które są silnie
zdysocjowane, otrzymujemy całkowite wytrącenie siarczków III grupy. Zamiast (NH
4
)
2
S stosuje się również
roztwór AKT w środowisku zasadowym. Powstający w wyniku hydrolizy AKT siarkowodór w środowisku
zasadowym ulega dysocjacji z powstaniem jonów siarczkowych, które hydrolizują wg reakcji: S
2–
+ 2H
2
O
H
2
S
+ 2OH
–
Ćwiczenie 5
Analiza jakościowa kationów III grupy analitycznej
oraz mieszaniny kationów III grupy

2
Stężenie powstających jonów OH
–
jest wystarczające do przekroczenia iloczynu rozpuszczalności
Al(OH)
3
i Cr(OH)
3
i dlatego następuje wytrącanie osadów tych wodorotlenków. Wodorotlenki te, podobnie
jak siarczki, rozpuszczają się w kwasach. Al
2
S
3
i Cr
2
S
3
mogą powstawać tylko w warunkach bezwodnych,
w wysokiej temperaturze Pozostałe siarczki mają iloczyn rozpuszczalności mniejszy od odpowiednich
wodorotlenków i dlatego wytrącają się dobrze. Najmniej rozpuszczalny jest siarczek cynkowy, który wytrąca
się nawet w środowisku słabo kwaśnym (roztwór zakwaszony CH
3
COOH). W tych warunkach pozostałe
kationy nie wytrącają się.
Dodatek salmiaku (NH
4
Cl) podczas wytrącania siarczków i wodorotlenków kationów grupy III
zapobiega powstawaniu osadów koloidowych. Jednocześnie zmniejsza on stężenie jonów OH
–
powstających
w wyniku dodanego amoniaku, co powinno zapobiec wytrącaniu się Mg(OH)
2
, a ułatwia wytrącanie się
Al(OH)
3
i Cr(OH)
3
,
które ze względu na swój charakter amfoteryczny w obecności nadmiaru jonów OH
–
mogłyby ulec rozpuszczeniu.

3
II. Część doświadczalna
NIKIEL (Niccolum) Ni
srebrzystobiały metal, kowalny, ciągliwy, twardszy od żelaza, nie utlenia się na suchym lub wilgotnym powietrzu w pokojowej temperaturze, ma właściwości
magnetyczne
Reakcje metalicznego niklu
Odczynnik
Efekt działania odczynnika
Równanie reakcji
kwas solny
roztwarza nikiel powoli
Ni + 2HCl
NiCl
2
+ H
2
kwas siarkowy (VI)
roztwarza nikiel powoli
Ni + H
2
SO
4
NiSO
4
+ H
2
kwas azotowy (V)
(rozcieńczony)
roztwarza nikiel łatwo
3Ni + 8HNO
3
3Ni(NO
3
)
2
+ 2NO
+ 4H
2
O
kwas azotowy (V)
(stężony)
brak reakcji (pasywacja)
Związki niklu
stopień utlenienia: +2 (rzadko +3 i +4); liczba koordynacyjna w związkach kompleksowych: 4 i 6
w roztworach występuje prosty jon niklu – Ni
2+
, który jest zabarwiony na zielono
Rozpuszczalność związków niklu:
dobrze rozpuszczalne: azotan (V) – Ni(NO
3
)
2
, siarczan (VI) – NiSO
4
, chlorek – NiCl
2
, octan – Ni(CH
3
COO)
2
bromek – NiBr
2
, jodek – NiI
2
,
tiocyjanian (rodanek) – Ni(SCN)
2
, tiosiarczan – NiS
2
O
3
trudno rozpuszczalne: węglan – NiCO
3
, wodorotlenek – Ni(OH)
2
, tlenek – NiO, ortofosforan (V) – Ni
3
(PO
4
)
2,
siarczek – NiS
Przykłady kompleksów:
[Ni(NH
3
)
6
]
2+
(bezbarwny)
kation heksaaminaniklu (II)
Właściwości redoks:
jon Ni
2+
jest słabym reduktorem; utlenienie niklu (II) do wyższych stopni w środowisku zasadowym (w postaci Ni(OH)
2
)
nie przebiega na powietrzu [w
odróżnieniu od Mn(OH)
2
, Fe(OH)
2
i Co(OH)
2
], a jedynie pod wpływem silnych utleniaczy; związki niklu (III) są nietrwałe, a niklu (IV) bardzo
nietrwałe, dlatego stopień utlenienia niklu (Ni
2+
) nie zmienia się podczas wszystkich reakcji wykorzystywanych podczas analizy III grupy kationów
Właściwości kwasowo-zasadowe:
nierozpuszczalny jasnozielony Ni(OH)
2
strąca się pod wpływem roztworu NaOH z roztworów rozpuszczalnych soli niklu (II); nie ulega on rozpuszczeniu
w nadmiarze tego odczynnika, co świadczy o jego zdecydowanie zasadowym charakterze, dodatek rozcieńczonego NaOH (lub NH
3
aq.) do stężonych
roztworów soli niklu (II) powoduje strącanie zielonego osadu soli zasadowych.
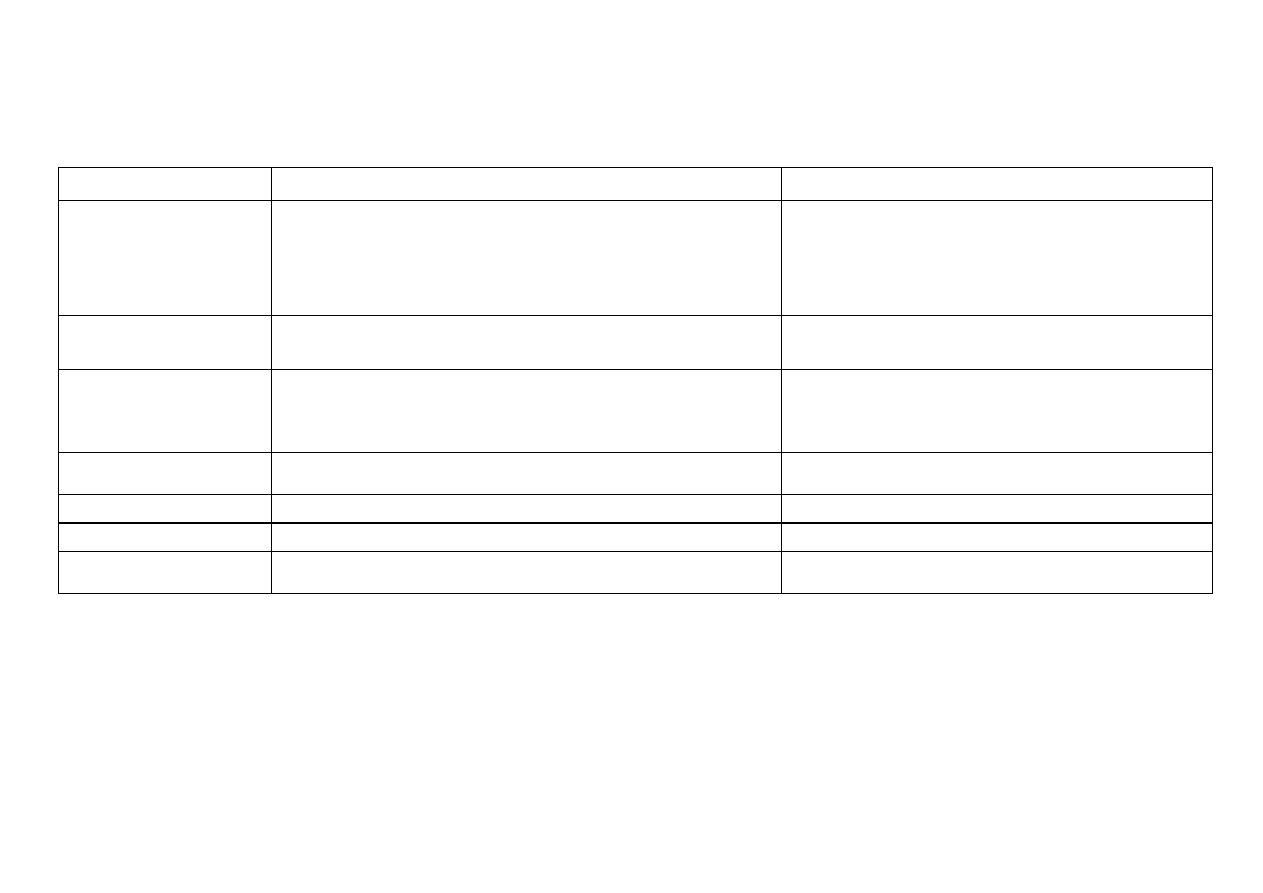
4
Reakcje charakterystyczne jonu Ni
2+
[ 0,1M Ni(NO
3
)
2
]
Odczynnik
Równania reakcji
Efekt reakcji
AKT*
(odczynnik grupowy)
+NH
3
aq. + NH
4
Cl
2M
HNO
3
stęż.
Ni
2+
+ S
2–
NiS
3NiS
+ 8H
+
+ 2
3
NO
3Ni
2+
+ 2NO
+ 4H
2
O + 3S
czarny osad siarczku niklu (II); wobec nadmiaru siarczku amonu i
amoniaku przechodzi w stan koloidowy, co utrudnia jego oddzielenie,
zapobiega temu dodatek NH
4
Cl; nie rozpuszcza się w rozcieńczonych
kwasach, rozpuszcza się w wodzie królewskiej, kwasie azotowym
(V), wodzie chlorowej
NaOH lub KOH
2M
Ni
2+
+ 2OH
–
Ni(OH)
2
zielony osad wodorotlenku niklu (II) nierozpuszczalny w nadmiarze
odczynnika, rozpuszczalny w rozcieńczonych kwasach, amoniaku i
solach amonowych; Ni(OH)
2
nie utlenia się na powietrzu
NH
3
aq.
2M
Ni
2+
+
NO
3
+ NH
3
· H
2
O
Ni(OH)NO
3
+
NH
4
Ni(OH)NO
3
+ 6NH
3
[Ni(NH
3
)
6
]
2+
+ OH
–
+ NO
3
zielononiebieski osad obojętnych hydroksosoli rozpuszcza się w
nadmiarze
amoniaku
z
utworzeniem
szafirowofioletowego
kompleksowego jonu heksaaminaniklu (II); z roztworu tej soli NaOH
wytrąca Ni(OH)
2
, w odróżnieniu od soli heksaaminakobaltu (II)
Na
2
CO
3
lub
K
2
CO
3
1M
Ni
2+
+ CO
3
2
NiCO
3
jasnozielony osad węglanu niklu (II) rozpuszczalny w kwasach,
roztworach amoniaku i węglanu amonu
K
4
[Fe(CN)
6
] 1%
2Ni
2+
+ [Fe(CN)
6
]
4–
Ni
2
[Fe(CN)
6
]
żółtozielony osad heksacyjanożelazianu (II) niklu (II)
K
3
[Fe(CN)
6
] 1%
3Ni
2+
+ 2[Fe(CN)
6
]
3–
Ni
3
[Fe(CN)
6
]
2
żółtozielony osad heksacyjanożelazianu (III) niklu (II)
Na
2
HPO
4
0,5M
3Ni
2+
+ 2HPO
4
2
Ni
3
(PO
4
)
2
+ 2H
+
jasnozielony osad fosforanu (V) niklu (II) rozpuszczalny w kwasach
mineralnych i w kwasie octowym
*
odczynnik używa się tylko pod wyciągiem

5
KOBALT (Cobaltum) Co
twardy, szary metal, niezbyt kowalny, ma własności magnetyczne, nie ulega działaniu powietrza, sproszkowany szybko się utlenia
Reakcje metalicznego kobaltu
Odczynnik
Efekt działania odczynnika
Równanie reakcji
kwas solny
(ciepły, rozcieńczony)
roztwarza kobalt powoli
Co + 2HCl
CoCl
2
+ H
2
kwas siarkowy (VI)
(ciepły, rozcieńczony)
roztwarza kobalt powoli
Co + H
2
SO
4
CoSO
4
+ H
2
kwas azotowy (V)
(rozcieńczony)
roztwarza kobalt bardzo szybko
3Co + 8HNO
3
3Co(NO
3
)
2
+ 2NO
+ 4H
2
O
kwas azotowy (V)
(stężony)
roztwarza kobalt bardzo powoli
(może zachodzić pasywacja)
Związki kobaltu
stopień utlenienia: +2 i +3; liczba koordynacyjna w związkach kompleksowych: Co
2+
– 4 i 6; Co
3+
– 6
w roztworach występuje prosty jon kobaltu – Co
2+
, który jest zabarwiony na różowo (uwodniony) lub na niebiesko (bezwodny)
Rozpuszczalność związków kobaltu:
dobrze rozpuszczalne: octan – Co(CH
3
COO)
2
, bromek – CoBr
2
, chlorek – CoCl
2
, fluorek – CoF
2
, jodek – CoI
2
, azotan (V) – Co(NO
3
)
2
,
siarczan (VI) – CoSO
4
, (tiocyjanian) – Co(SCN)
2
, tiosiarczan – CoS
2
O
3
umiarkowanie rozpuszczalne: jodan( V) - Co(IO
3
)
2
trudno rozpuszczalne: węglan - CoCO
3
, chromian (VI) – CoCrO
4
, cyjanek – Co(CN)
2
, heksacyjanożelazian (II) – Co
2
[Fe(CN)
6
],
heksacyjanożelazian (III) – Co
3
[Fe(CN)
6
]
2
, wodorotlenek – Co(OH)
2
, szczawian – CoC
2
O
4
, ortofosforan (V) – Co
3
(PO
4
)
2
,
siarczek – CoS
Przykłady kompleksów:
[Co(NH
3
)
6
]
2+
(żółtobrązowy)
kation heksaaminakobaltu (II)
[Co(NH
3
)
6
]
3+
(żółtobrązowy)
kation heksaaminakobaltu (III)
Właściwości redoks:
jon Co
2+
jest słabym reduktorem; jego utlenienie do wyższych stopni utlenienia zachodzi w środowisku zasadowym o wiele łatwiej od niklu (II), zwłaszcza w
obecności ligandów tworzących mocne kompleksy z jonem Co
3+
(NH
3
, CN
–
); proste sole kobaltu (III) są nietrwałe i są bardzo silnymi utleniaczami.
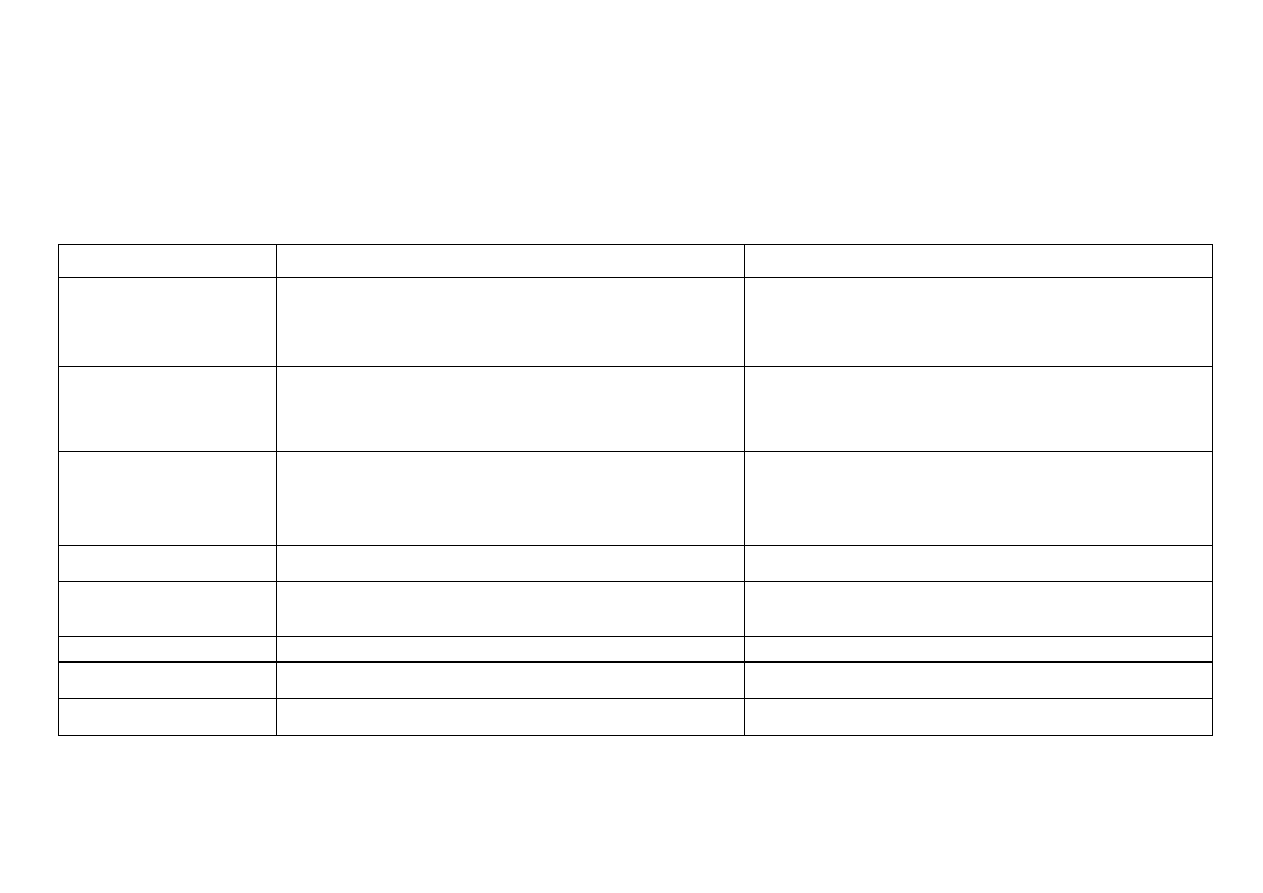
6
Właściwości kwasowo-zasadowe:
nierozpuszczalny różowy Co(OH)
2
strąca się pod wpływem roztworu NaOH z roztworów rozpuszczalnych soli kobaltu (II); podobnie jak Ni(OH)
2
nie
rozpuszcza się w nadmiarze NaOH, co świadczy o zdecydowanie zasadowym jego charakterze; dodatek rozcieńczonego roztworu NaOH (lub NH
3
aq.) do
stężonych roztworów soli kobaltu (II) powoduje strącanie niebieskiego osadu soli zasadowych.
Reakcje charakterystyczne jonu Co
2+
[0,25M Co(NO
3
)
2
]
Odczynnik
Równania reakcji
Efekt reakcji
AKT
*
(odczynnik grupowy)
+ NH
3
aq. + NH
4
Cl 2M
st. HNO
3
Co
2+
+ S
2–
CoS
3CoS
+ 8H
+
+ 2
3
NO
3Co
2+
+ 2NO
+
3S
+ 4H
2
O
czarny osad siarczku kobaltu (II) nie rozpuszcza się w nadmiarze
odczynnika, w kwasie octowym, w rozcieńczonym HCl; rozpuszcza się w
gorącym HNO
3
, wodzie królewskiej, wodzie chlorowej (z wydzieleniem
siarki); nie ma zdolności przechodzenia w stan koloidowy (odróżnienie od
NiS)
NaOH 2M
O
2
(z powietrza)
Co
2+
+ OH
–
+ 2NO
3
Co(OH)NO
3
+ NO
3
Co(OH)NO
3
+ OH
–
Co(OH)
2
+ NO
3
4Co(OH)
2
+ O
2
+ 2H
2
O
4Co(OH)
3
niebieski osad hydroksosoli, który po ogrzaniu przechodzi w różowy osad
wodorotlenku kobaltu (II);
na powietrzu Co(OH)
2
natychmiast utlenia się do brunatnego
wodorotlenku kobaltu (III)
NH
3
aq. 4M
Co
2+
+ 2
NO
3
+ NH
3
· H
2
O
Co(OH)NO
3
+ NH
4
+
+ NO
3
-
Co(OH)NO
3
+ 7(NH
3
· H
2
O)
[Co(NH
3
)
6
](OH)
2
+ NH
4
NO
3
+ 6H
2
O
niebieski osad hydroksosoli kobaltu (II) rozpuszcza się w nadmiarze
amoniaku barwiąc roztwór początkowo na kolor różowy od jonu
kompleksowego heksaaminakobaltu (II)
[
Co(NH
3
)
6
]
2+
, który jest nietrwały i
utlenia się do jonu heksaaminakobaltu (III), dającego brązowożółte
zabarwienie roztworu
Na
2
CO
3
lub (NH
4
)
2
CO
3
1M
2Co
2+
+ 2Cl
–
+ CO
3
2
+ H
2
O
[Co(OH)]
2
Cl
2
+ CO
2
różowofioletowy osad hydroksosoli kobaltu (II) o zmiennym składzie,
rozpuszczalny w rozcieńczonych kwasach, amoniaku i węglanach
NH
4
SCN 2%
+ alkohol amylowy
Co
2+
+ 4SCN
–
[Co(SCN)
4
]
2–
tetratiocyjanokobaltan (II); w alkoholu amylowym barwi się na niebiesko**
(reakcja Vogla)
K
4
[Fe(CN)
6
] 1%
2Co
2+
+ [Fe(CN)
6
]
4–
Co
2
[Fe(CN)
6
]
zielony osad heksacyjanożelazianu (II) kobaltu (II)
Na
2
S
2
O
3
0,5M
kryształek tiosiarczanu (VI) sodu zwilżony 1 kroplą roztworu zawierającego
jon Co
2+
tworzy błękitne zabarwienie
Na
2
HPO
4
0,5M
3Co
2+
+ 2HPO
4
2
Co
3
(PO
4
)
2
+ 2H
+
różowofioletowy osad fosforanu (V) kobaltu (II) rozpuszczalny w kwasach
mineralnych i w kwasie octowym
* odczynnik używa się tylko pod wyciągiem; **
mocno wstrząsnąć, jeśli nie pojawi się niebieskie zabarwienie krótko i delikatnie ogrzać
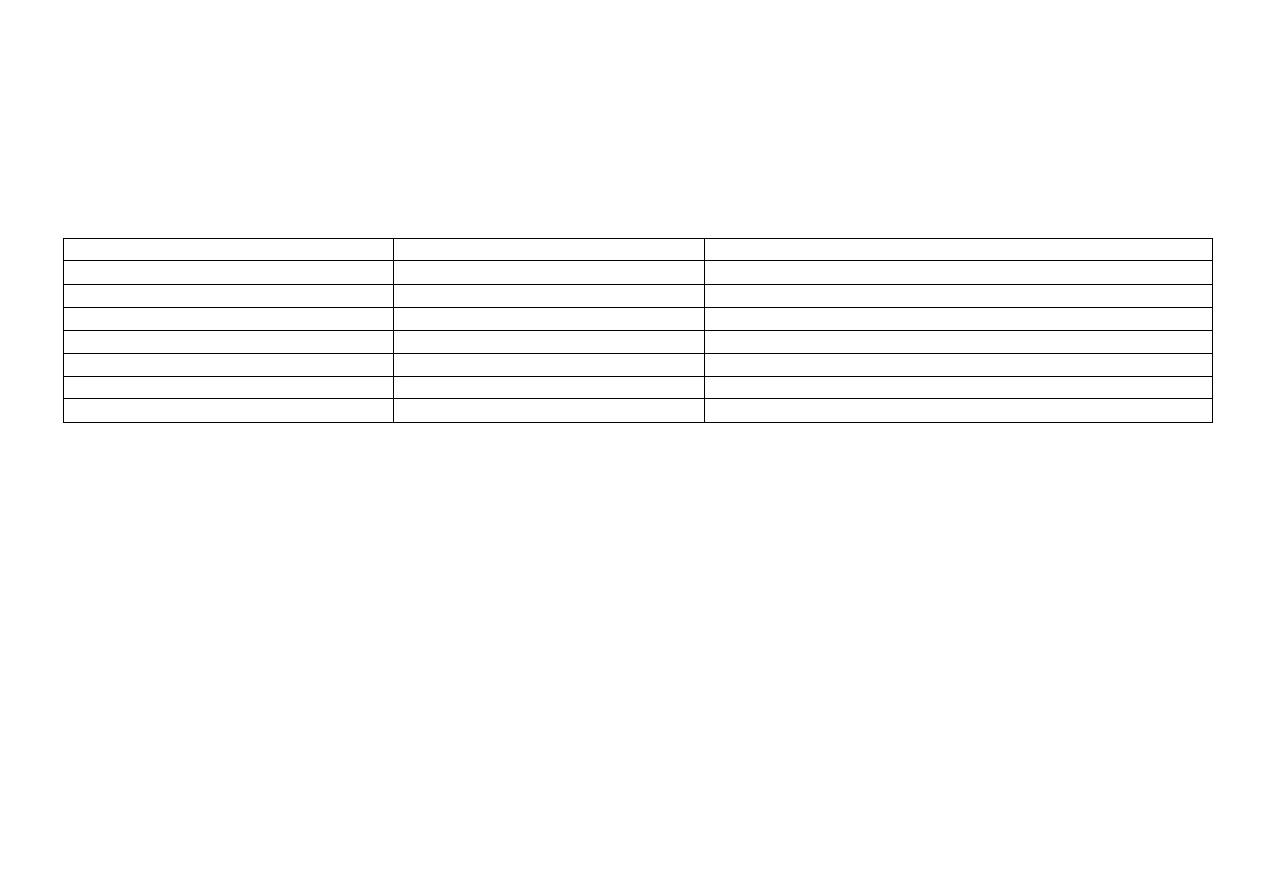
7
ŻELAZO (Ferrum) Fe
metal koloru srebrzystego, kowalny; chemicznie czyste żelazo jest odporne na działanie wilgoci i powietrza; żelazo zawierające różne domieszki łatwo się
utlenia („rdzewieje”); jest jednym z najlepiej przewodzących metali
Reakcje metalicznego żelaza
Odczynnik
Efekt działania odczynnika
Równanie reakcji
kwas solny
roztwarza żelazo
Fe + 2HCl
FeCl
2
+ H
2
kwas azotowy (V)
(zimny, rozcieńczony)
roztwarza żelazo
4Fe + 10HNO
3
4Fe(NO
3
)
2
+ NH
4
NO
3
+ 3H
2
O
kwas azotowy (V)
(gorący, rozcieńczony)
roztwarza żelazo
Fe+ 4HNO
3
Fe(NO
3
)
3
+ NO
+ 2H
2
O
kwas azotowy (V)
(zimny, stężony)
nie roztwarza żelaza (pasywacja)
kwas siarkowy (VI)
(rozcieńczony)
roztwarza żelazo
Fe + H
2
SO
4
FeSO
4
+ H
2
kwas siarkowy (VI)
(zimny, stężony)
nie roztwarza żelaza (pasywacja)
kwas siarkowy (VI)
(gorący, stężony)
roztwarza żelazo
2Fe + 6H
2
SO
4
Fe
2
(SO
4
)
3
+ 3SO
2
+ 6H
2
O
Związki żelaza
stopień utlenienia: +2 i +3 (rzadko +6); liczba koordynacyjna w związkach kompleksowych: 6
występuje w formie jonów Fe
2+
– bezwodnych (białe) lub uwodnionych (zielone) oraz Fe
3+
– żółtobrązowych lub jasnofioletowych
Rozpuszczalność związków żelaza (II):
dobrze rozpuszczalne: octan – Fe(CH
3
COO)
2
, bromek – FeBr
2
, chlorek – FeCl
2
, jodek FeI
2
, azotan (V) – Fe(NO
3
)
2
,siarczan (VI) – FeSO
4
,
tiocyjanian – Fe(SCN)
2
, tiosiarczan – FeS
2
O
3
trudno rozpuszczalne: węglan – FeCO
3
, heksacyjanożelazian (II) – Fe
3
[Fe(CN)
6
]
2
, ortofosforan (V) – Fe
3
(PO
4
)
2
, siarczek – FeS,
siarczan (IV) – FeSO
3
, wodorotlenek – Fe(OH)
2
, tlenek – FeO
Rozpuszczalność związków żelaza (III):
dobrze rozpuszczalne: bromek – FeBr
3
, chlorek FeCl
3
, azotan (V) – Fe(NO
3
)
3
, siarczan – Fe
2
(SO
4
)
3
, tiocyjanian – Fe(SCN)
3
trudno rozpuszczalne: zasadowy octan (dihydroksooctan żelaza (III)) – Fe(OH)
2
(CH
3
COO), heksacyjanożelazian (III) – Fe
4
[Fe(CN)
6
]
3
,
wodorotlenek – Fe(OH)
3
, ortofosforan (V) – FePO
4
, siarczek – Fe
2
S
3

8
Przykłady kompleksów:
[Fe(CN)
6
]
4–
(żółty)
heksacyjanożelazian (II)
[Fe(CN)
6
]
3–
(pomarańczowy)
heksacyjanożelazian (III)
[Fe(SCN)
6
]
3–
(krwistoczerwony)
heksatiocyjanożelazian (III); [heksarodanożelazian (III)]
Właściwości redoks:
jon Fe
2+
jest silnym reduktorem(żelazo jako reduktor – wypiera Sb, Pb, Ag, Cu z roztworów ich soli); jon Fe
3+
jest w środowisku kwaśnym dość silnym
utleniaczem, jednak począwszy od pH=2 z 0,01M roztworu soli Fe
3+
strąca się Fe(OH)
3
i właściwości utleniające Fe
3+
maleją ze wzrostem pH
Właściwości kwasowo-zasadowe:
zielonkawy Fe(OH)
2
zaczyna się strącać przy pH
7,5 (z 0,01M roztworów), a rdzawy Fe(OH)
3
zaczyna strącać się już przy pH
2 (z 0,01M roztworów);
oba wodorotlenki nie rozpuszczają się praktycznie w nadmiarze NaOH, co świadczy o ich charakterze zasadowym
Reakcje charakterystyczne jonu Fe
2+
[0,1M FeSO
4
]
Odczynnik
Równania reakcji
Efekt reakcji
AKT
*
(odczynnik grupowy)
+NH
3
aq.+NH
4
Cl 2M
CH
3
COOH 2M
Fe
2+
+ S
2–
FeS
FeS
+ 2CH
3
COOH
Fe(CH
3
COO)
2
+ H
2
S
czarny osad siarczku żelaza (II) łatwo rozpuszczalny w kwasach mineralnych i
rozpuszczalny w kwasie octowym
NaOH lub NH
3
aq. 2M
O
2
(z powietrza)
Fe
2+
+ 2NH
3
· H
2
O
Fe(OH)
2
+ 2NH
4
4Fe(OH)
2
+ O
2
+ 2H
2
O
4Fe(OH)
3
zielonkawy osad wodorotlenku żelaza (II);
w obecności nadmiaru jonów amonowych nie
wytrąci się (iloczyn rozpuszczalności Fe(OH)
2
nie zostanie przekroczony); łatwo utlenia się
na powietrzu do Fe(OH)
3
o brunatnym zabarwieniu
H
2
O
2
3%
2Fe
2+
+ H
2
O
2
+ 2H
+
2Fe
3+
+ 2H
2
O
Fe
2+
ma charakter
redukujący i może być utleniony za pomocą wielu utleniaczy, np. w
środowisku kwaśnym H
2
O
2
; zielony roztwór zmienia barwę na żółtą
Na
2
CO
3
1M
O
2
(z powietrza)
Fe
2+
+
CO
3
2
FeCO
3
4FeCO
3
+ O
2
+ 6H
2
O
4Fe(OH)
3
+ 4CO
2
biały osad węglanu żelaza (II), na powietrzu szybko brunatnieje wskutek utleniania i
powstawania Fe(OH)
3
Na
2
HPO
4
0,5M
3Fe
2+
+ 2HPO
4
2
Fe
3
(PO
4
)
2
+ 2H
+
biały osad rozpuszczalny w kwasach mineralnych i kwasie octowym
K
4
[Fe(CN)
6
] 1%
2Fe
2+
+ [Fe(CN)
6
]
4–
Fe
2
[Fe(CN)
6
]
biały osad heksacyjanożelazianu (II) żelaza (II); w obecności tlenu atmosferycznego
następuje natychmiastowe utlenienie żelaza (II) do żelaza (III) w wyniku czego osad
przyjmuje barwę niebieską pochodzącą od tworzącego się błękitu pruskiego
K
3
[Fe(CN)
6
] 1%
3Fe
2+
+ 2[Fe(CN)
6
]
3–
Fe
3
[Fe(CN)
6
]
2
w środowisku kwaśnym lub obojętnym powstaje ciemnoniebieski osad błękitu Turnbulla
odczynnik używa się tylko pod wyciągiem
9
Reakcje charakterystyczne jonu Fe
3+
[0,2M FeCl
3
]
Odczynnik
Równania reakcji
Efekt reakcji
AKT
*
(odczynnik grupowy)
NH
3
aq. + NH
4
Cl
2M
HCl 2M
2Fe
3+
+ 3S
2–
Fe
2
S
3
Fe
2
S
3
+ 6H
+
2Fe
3+
+ 3H
2
S
3Fe
2
S
3
+ 12H
+
6Fe
2+
+ 6H
2
S
+ 3S
czarny osad siarczku żelaza (III), łatwo rozpuszczalny w kwasach, również w kwasie
octowym;
podczas reakcji rozpuszczania może zajść redukcja Fe
3+
do Fe
2+
i utlenienie S
2–
do S
(wydzielanie koloidalnej siarki)
NaOH
2M
HCl 2M
2Fe
3+
+ 6OH
–
2Fe(OH)
3
Fe
2
O
3
+ 3H
2
O
Fe(OH)
3
+ 3H
+
Fe
3+
+ 3H
2
O
rdzawobrunatny
osad wodorotlenku żelaza (III); wodorotlenek żelaza jest
nierozpuszczalny w nadmiarze odczynnika; łatwo rozpuszcza się w kwasach; podczas
prażenia traci wodę przechodząc w tlenek żelaza (III)
NH
3
aq.
2M
Fe
3+
+ 3NH
3
· H
2
O
Fe(OH)
3
+ 3NH
4
rdzawobrunatny osad wodorotlenku żelaza (III) nierozpuszczalny w nadmiarze amoniaku,
osad wytrąca się ilościowo nawet w obecności soli amonowych cofających dysocjację
zasady amonowej, w przeciwieństwie do wodorotlenków żelaza (II), cynku, manganu (II),
kobaltu (II) i niklu (II)
Na
2
CO
3
1M
2Fe
3+
+ 3
3
2
CO
Fe
2
(CO
3
)
3
Fe
2
(CO
3
)
3
+ 6H
2
O
2Fe(OH)
3
+3H
2
CO
3
powstający brunatny osad węglanu żelaza (III), jako sól słabej zasady i słabego kwasu
ulega całkowitej hydrolizie z powstaniem rdzawobrunatnego osad wodorotlenku żelaza
(III)
K
4
[Fe(CN)
6
]
1%
NaOH 2M
4Fe
3+
+ 3[Fe(CN)
6
]
4–
Fe
4
[Fe(CN)
6
]
3
Fe
4
[Fe(CN)
6
]
3
+ 12OH
–
4Fe(OH)
3
+ 3[Fe(CN
6
)]
4–
W środowisku obojętnym lub słabo kwaśnym strąca się ciemnoniebieski osad heksacyjanożelazianu
(II) żelaza (III), tzw błękit pruski; osad rozpuszcza się w stężonym HCl i w kwasie szczawiowym,
nie rozpuszcza się w rozc. HCl, w roztworze zasadowym następuje rozkład błękitu pruskiego z
pojawieniem się rdzawobrunatnego osadu; przy małym stężeniu jonów Fe
3+
powstaje jedynie
niebieskie lub zielone zabarwienie roztworu, bez strącania osadu
NH
4
SCN 2%
Fe
3+
+ xSCN
–
[Fe(SCN)
x
]
3-x
x=1
6
krwistoczerwone kompleksy, przechodzące do warstwy eterowej [sole żelaza (II) tej
reakcji nie ulegają]; reakcja bardzo czuła; kwasy organiczne, ich sole, fosforany, fluorki ,
chlorek rtęci (II) przeszkadzają tej reakcji
Na
2
HPO
4
0,5M
Fe
3+
+ HPO
4
2
FePO
4
+ H
+
żółto-biały osad ortofosforanu (V) żelaza (III), rozpuszczalny w kwasach nieorganicznych,
nierozpuszczalny w kwasie octowym
SnCl
2
0,1M
2Fe
3+
+ Sn
2+
2Fe
2+
+ Sn
4+
żółtobrązowy roztwór zmienia barwę na jasnozieloną z powodu redukcji do jonów Fe
2+
CH
3
COONa 1M
Fe
3+
+ 3CH
3
COO
–
Fe(CH
3
COO)
3
Fe(CH
3
COO)
3
+ 2H
2
O
Fe(OH)
2
CH
3
COO
+2CH
3
COOH
octan sodu z jonami żelaza (III) tworzy octan żelaza (III) o zabarwieniu
czerwonobrunatnym; po zagotowaniu z rozcieńczonego roztworu wytrąca się
czerwonobrunatny osad dihydroksooctanu żelaza (III)
*odczynnik używa się tylko pod wyciągiem

10
MANGAN (Manganum) Mn
metal koloru białego; twardy, kruchy, na powietrzu pokrywa się cienką warstewką tlenku, która chroni mangan przed dalszym utlenianiem
Reakcje manganu
Odczynnik
Efekt działania odczynnika
Równanie reakcji
woda
(gorąca lub zimna)
rozkład wody
Mn + 2H
2
O
Mn(OH)
2
+ H
2
kwas solny
roztwarza mangan
Mn + 2HCl
MnCl
2
+ H
2
kwas siarkowy (VI)
(rozcieńczony)
roztwarza mangan
Mn + H
2
SO
4
MnSO
4
+ H
2
kwas siarkowy (VI)
(gorący, stężony)
roztwarza mangan
Mn + 2H
2
SO
4
MnSO
4
+ 2H
2
O + SO
2
kwas azotowy (V)
(rozcieńczony)
roztwarza mangan
3Mn + 8HNO
3
3Mn(NO
3
)
2
+ 2NO
+ 4H
2
O
kwas octowy
roztwarza mangan
Mn + 2CH
3
COOH
Mn(CH
3
COO)
2
+ H
2
Związki manganu
jony manganu na różnych stopniach utlenienia: +2 [Mn
2+
– jon manganu (II); różowy-uwodniony, biały-bezwodny]; liczba koordynacyjna
w związkach kompleksowych: 4
+3 [Mn
3+
– jon manganu (III); nietrwały]; +4 [nie istnieje kation Mn
4+
]
+6 [MnO
4
2
– manganian (VI) – zielony]; +7 [MnO
4
– manganian (VII) – fioletowy]
Rozpuszczalność związków manganu:
dobrze rozpuszczalne: bromek – MnBr
2
, chlorek – MnCl
2
, jodek – MnI
2
, azotan (V) – Mn(NO
3
)
2
, siarczan (VI) – MnSO
4
trudno rozpuszczalne: węglan – MnCO
3
, wodorotlenek – Mn(OH)
2
, ortofosforan (V) – Mn
3
(PO
4
)
2
, siarczek – MnS, octan – Mn(CH
3
COO)
2
Przykłady kompleksów:
jony manganu (II) nie tworzą trwałych kompleksów, które miałyby znaczenie w analizie kationów III grupy
Właściwości redoks:
jon Mn
2+
jest bardzo słabym reduktorem. Mn
2+
trudno utlenić do Mn
3+
; łatwiej utlenia się do trudno rozpuszczalnych związków Mn (IV) w środowisku
zasadowym (Mn(OH)
2
utlenia się na powietrzu natychmiast po strąceniu do MnO
2
· H
2
O); silne utleniacze utleniają Mn
2+
do MnO
4
; jon MnO
4
jest
utleniaczem: w środowisku zasadowym redukuje się do MnO
4
2
, w środowisku obojętnym lub słabo kwaśnym do MnO
2
· H
2
O , a w środowisku silnie
kwaśnym do Mn
2+
Właściwości kwasowo-zasadowe:
biały wodorotlenek manganu strąca się przy najwyższych wśród kationów II i III grupy wartościach pH (pH=8,5 dla 0,001M roztworu Mn
2+
); ma on
zdecydowanie zasadowy charakter (nie rozpuszcza się w nadmiarze NaOH); brunatnoczarny Mn
2
O
3aq
. ma nieco mniej zasadowy charakter (rozpuszcza się

11
bardzo nieznacznie w środowisku silnie zasadowym), MnO
2
· H
2
O (H
2
MnO
3
) ma charakter amfoteryczny, a MnO
4
2
słabo kwasowy (istnieje tylko w silnie
zasadowym środowisku); Mn (VII) istnieje tylko w postaci anionów MnO
4
; kwas HMnO
4
jest kwasem mocnym; ze wzrostem stopnia utlenienia manganu
maleje charakter zasadowy jego połączeń z tlenem i wodorem, a wzrasta charakter kwasowy
Reakcje charakterystyczne jonu Mn
2+
[0,25M MnCl
2
]
Odczynnik
Równania reakcji
Efekt reakcji
AKT
*
(odczynnik grupowy)
+ NH
3
aq.+NH
4
Cl 2M
O
2
(z powietrza)
HCl 2M
Mn
2+
+ S
2–
MnS
4MnS
+ 3O
2
+ 6H
2
O
4
Mn(OH)
3
+ 4S
MnS
+ 2H
+
Mn
2+
+ H
2
S
cielisty osad siarczku manganu (II), który na powietrzu utlenia się do brązowego
Mn(OH)
3
; dodatek NH
4
Cl sprzyja powstawaniu grubokrystalicznego osadu;
MnS jest rozpuszczalny w rozcieńczonych kwasach mineralnych i w kwasie
octowym
NaOH 2M
HCl
stęż.
NH
4
Cl 2M
O
2
(z powietrza)
Mn
2+
+ 2OH
–
Mn(OH)
2
Mn(OH)
2
+ 2H
+
Mn
2+
+ 2H
2
O
Mn(OH)
2
+ 2
4
NH
Mn
2+
+ 2(NH
3
·
H
2
O)
2Mn(OH)
2
+ O
2
2H
2
MnO
3
H
2
MnO
3
+ Mn(OH)
2
MnMnO
3
+ 2H
2
O
biały osad wodorotlenku manganu (II) rozpuszczalny w kwasach i solach
amonowych, nierozpuszczalny w nadmiarze odczynnika;
Mn(OH)
2
utlenia się na powietrzu do brunatnego kwasu manganowego (IV), który
następnie przechodzi w prawie czarny manganian (IV) manganu (II)
H
2
O
2
3%
2Mn(OH)
2
+ H
2
O
2
Mn
2
O
3
+ 3H
2
O
utlenianie wodorotlenku manganu (II) łatwiej zachodzi pod wpływem H
2
O
2
NH
3
aq. 2M
Mn
2+
+ 2NH
3
· H
2
O
Mn(OH)
2
+ 2NH
4
biały osad wodorotlenku manganu (II), brunatniejący pod wpływem tlenu z
powietrza
Na
2
CO
3
lub K
2
CO
3
1M
Mn
2+
+ CO
3
2
MnCO
3
MnCO
3
+ H
2
O
Mn(OH)
2
+ CO
2
biały osad węglanu manganu (II) rozpuszczalny w kwasach, po ogrzaniu ulega
hydrolizie z powstaniem wodorotlenku
Na
2
HPO
4
0,5M
3Mn
2+
+ 2HPO
4
2
Mn
3
(PO
4
)
2
+ 2H
+
biały osad fosforanu (V) manganu (II), rozpuszczalny w kwasach mineralnych i w
kwasie octowym (w odróżnieniu do AlPO
4
,
FePO
4
)
K
4
[Fe(CN)
6
] 1%
2Mn
2+
+ [Fe(CN)
6
]
4–
Mn
2
[Fe(CN)
6
]
biały osad heksacyjanożelazianu (II) manganu (II)
K
3
[Fe(CN)
6
] 1%
3Mn
2+
+ 2[Fe(CN)
6
]
3–
Mn
3
[Fe(CN)
6
]
2
brunatny osad heksacyjanożelazianu (III) manganu (II)
Pb
3
O
4
(minia) + st.HNO
3
2Mn
2+
+ 5PbO
2
+ 4H
+
2MnO
4
+ 5Pb
2+
+ 2H
2
O
**
po rozcieńczeniu wodą i ogrzaniu pojawia się fioletowe zabarwienie roztworu na
skutek utleniania w środowisku kwaśnym jonów Mn
2+
do manganu (VII)
(reakcja Cruma)
* odczynnik używa się tylko pod wyciągiem
** wykonanie: do probówki wprowadza się kroplę badanej substancji i dodaje się 3 krople stężonego HNO
3
, ogrzewa i do gorącego dodaje się niewielką ilość PbO
2
, wstrząsa się; jeśli nie
zauważy się zmiany zabarwienia ponownie należy dodać Pb
3
O
4
, ogrzewać i wstrząsnąć; roztwór można rozcieńczyć wodą.

12
CYNK (Zincum) Zn
metal koloru białego o niebieskim połysku, kruchy, w podwyższonej temperaturze kowalny i ciągliwy, odporny na działanie suchego powietrza, w wilgotnym
powietrzu pokrywa się nalotem zasadowych węglanów; nie rozkłada wyraźnie wody, co spowodowane jest tworzeniem się cienkiej warstwy tlenku chroniącej
przed dalszą reakcją.
Reakcje metalicznego cynku
Odczynnik
Efekt działania odczynnika
Równanie reakcji
kwas solny
roztwarza cynk
Zn + 2HCl
ZnCl
2
+ H
2
kwas siarkowy (VI)
(rozcieńczony)
roztwarza cynk
Zn + H
2
SO
4
ZnSO
4
+ H
2
kwas siarkowy (VI)
(stężony)
roztwarza cynk
Zn + 2H
2
SO
4
ZnSO
4
+ SO
2
+ 2H
2
O
kwas azotowy (V)
(rozcieńczony)
roztwarza cynk
3Zn + 8HNO
3
3Zn(NO
3
)
2
+ 2NO
+ 4H
2
O
kwas azotowy (V)
(stężony)
roztwarza cynk
Zn + 4HNO
3
Zn(NO
3
)
2
+ 2NO
2
+ 2H
2
O
kwas azotowy (V)
(bardzo rozcieńczony)
roztwarza cynk
4Zn + 10HNO
3
4Zn(NO
3
)
2
+ NH
4
NO
3
+ 3H
2
O
wodorotlenek sodu
(roztwór wodny)
roztwarza cynk
Zn + 2NaOH + 2H
2
O
Na
2
[Zn(OH)
4
] + H
2
kwas octowy
roztwarza cynk
Zn + 2CH
3
COOH
Zn(CH
3
COO)
2
+ H
2
Związki cynku
stopień utlenienia: +2; liczba koordynacyjna w związkach kompleksowych: 4
w roztworach wodnych występują: prosty jon Zn
2+
(w środowisku kwaśnym) oraz [Zn(OH)
4
]
2–
(w środowisku zasadowym), oba jony są bezbarwne
Rozpuszczalność związków cynku:
dobrze rozpuszczalne: octan – Zn(CH
3
COO)
2
, chlorek – ZnCl
2
, azotan (V) – Zn(NO
3
)
2
, siarczan (VI) – ZnSO
4
trudno rozpuszczalne: węglan – ZnCO
3
, dichromian (VI) – ZnCr
2
O
7
, wodorotlenek – Zn(OH)
2
, tlenek – ZnO, ortofosforan (V) – Zn
3
(PO
4
)
2
,
siarczek – ZnS
Przykłady kompleksów:
[Zn(NH
3
)
4
]
2+
(bezbarwny)
kation tetraaminacynku (II)
[Zn(OH)
4
]
2–
(bezbarwny)
tetrahydroksocynkan (II)
Właściwości redoks:
jon Zn
2+
jest słabym utleniaczem (metal jest dość mocnym reduktorem); nie tworzy związków na innym niż +2 stopniu utlenienia; ten stopień utlenienia we
wszystkich reakcjach stosowanych przy jego rozdzielaniu i wykrywaniu pozostaje nie zmieniony.

13
Właściwości kwasowo-zasadowe:
podczas alkalizowania roztworu, w którym znajdują się jony Zn
2+
najpierw pojawiają się sole zasadowe, które przechodzą w wodorotlenek Zn(OH)
2
w
środowisku bardziej zasadowym; wodorotlenek cynku jest amfoteryczny i rozpuszcza się przy pH
14 tworząc [Zn(OH)
4
]
2–
Reakcje charakterystyczne jonu Zn
2+
[ 0,1M ZnSO
4
]
Odczynnik
Równania reakcji
Efekt reakcji
AKT
*
(odczynnik grupowy)
NH
3
aq. + NH
4
Cl 2M
HCl 2M
Zn
2+
+ S
2–
ZnS
ZnS
+ 2H
+
Zn
2+
+ H
2
S
biały osad siarczku cynku;
rozpuszczalny w kwasach mineralnych, nie rozpuszcza się w kwasie octowym
AKT*
+ CH
3
COONa 1M
Zn
2+
+ H
2
S + 2CH
3
COO
–
ZnS
+ 2CH
3
COOH
biały osad siarczku cynku; octan sodu umożliwia całkowite wytrącenie osadu
NaOH 2M
HNO
3
2M
Zn
2+
+ 2OH
–
Zn(OH)
2
Zn(OH)
2
+ 2OH
–
[Zn(OH)
4
]
2–
Zn(OH)
2
+ 2H
+
Zn
2+
+ 2H
2
O
biały osad amfoterycznego wodorotlenku cynku, rozpuszcza się w kwasach i
zasadach
NH
3
aq. 2M
Zn
2+
+ 2(NH
3
·
H
2
O)
Zn(OH)
2
+ 2NH
4
Zn(OH)
2
+ 4NH
3
[Zn(NH
3
)
4
]
2+
+ 2OH
–
biały osad wodorotlenku cynku łatwo rozpuszczalny w nadmiarze amoniaku z
utworzeniem jonów kompleksowych tetraaminacynku
Na
2
CO
3
lub K
2
CO
3
1M
Zn
2+
+ CO
3
2
ZnCO
3
ZnCO
3
+ H
2
O
Zn(OH)
2
+ CO
2
biały osad węglanu cynku rozpuszczalny w kwasach, ulega hydrolizie z
powstaniem wodorotlenku; skład powstałego osadu można przedstawić jako
Zn
2
(OH)
2
CO
3
Na
2
HPO
4
0,5M
3Zn
2+
+ 2HPO
4
2
Zn
3
(PO
4
)
2
+ 2H
+
biały osad Zn
3
(PO
4
)
2
, rozpuszczalny w kwasach mineralnych, w kwasie
octowym (w odróżnieniu do AlPO
4
,
FePO
4
) i amoniaku
K
3
[Fe(CN)
6
] 1%
3Zn
2+
+ 2[Fe(CN)
6
]
3–
Zn
3
[Fe(CN)
6
]
2
żółtobrunatny osad heksacyjanożelazianu (III) cynku (Al
3+
tej reakcji nie daje)
K
4
[Fe(CN)
6
] 1%
32Zn
2+
+ [Fe(CN)
6
]
4–
Zn
2
[Fe(CN)
6
]
biały osad heksacyjanożelazianu (II) cynku (Al
3+
tej reakcji nie daje)
Co(NO
3
)
2
0,1%
Zn(OH)
2
ZnO + H
2
O
**
2ZnO + 2Co(NO
3
)
2
2CoZnO
2
+ 4NO
+ 3O
2
zielonkawe zabarwienie tlenków kobaltu i cynku czyli zieleni Rinmanna
* odczynnik używa się tylko pod wyciągiem; ** wykonanie: osad wodorotlenku cynku odsączyć na sączku bibułowym; niewielką ilość osadu przenieść do parowniczki i zwilżyć 1 kroplą
0,1% Co(NO
3
)
2
i kroplą roztworu H
2
SO
4
; wyprażyć; nie stosować zbytniego nadmiaru Co(NO
3
)
2
, gdyż podczas prażenia tworzy się czarny tlenek kobaltu (II).

14
GLIN (Aluminium) Al
jest metalem koloru białego, niezbyt twardym, kowalnym i ciągliwym; na powietrzu pokrywa się warstewką tlenku
Reakcje metalicznego glinu
Odczynnik
Efekt działania odczynnika
Równanie reakcji
woda
(100
o
C)
rozkład wody
2Al + 6H
2
O
2Al(OH)
3
+ 3H
2
kwas solny
roztwarza glin
2Al
+ 6HCl
2AlCl
3
+ 3H
2
kwas siarkowy (VI)
(rozcieńczony)
roztwarza glin powoli
2Al
+ 3H
2
SO
4
Al
2
(SO
4
)
3
+ 3H
2
kwas siarkowy (VI)
(gorący, stężony)
roztwarza glin szybko
2Al
+ 6H
2
SO
4
Al
2
(SO
4
)
3
+ 3SO
2
+ 6H
2
O
kwas azotowy (V)
(stężony)
nie roztwarza glinu (pasywacja)
wodorotlenek sodu
(gorący roztwór)
roztwarza glin szybko
2Al
+ 6H
2
O + 6NaOH
2Na
3
[Al(OH)
6
] + 3H
2
Związki glinu
stopień utlenienia: +3; liczba koordynacyjna w związkach kompleksowych: 4 i 6
występuje w formie jonów Al
3+
(środowisko kwaśne) lub [Al(OH)
6
]
3–
(środowisko zasadowe); oba jony są bezbarwne
Rozpuszczalność związków glinu
dobrze rozpuszczalne: bromek – AlBr
3
, chlorek – AlCl
3
, jodek – AlI
3
, azotan (V) – Al(NO
3
)
3
, siarczan (VI) – Al
2
(SO
4
)
3
;
[ałuny – AlM(SO
4
)
2
·12H
2
O (M = K, Na, NH
4
, Tl(I), Rb, Cs]
trudno rozpuszczalne: zasadowy octan – Al(OH)
2
(CH
3
COO), wodorotlenek – Al(OH)
3
, ortofosforan (V) – AlPO
4
Przykłady kompleksów:
[Al(OH)
4
]
–
(bezbarwny)
tetrahydroksoglinian (III)
[AlF
6
]
3–
(bezbarwny)
heksafluoroglinian (III)
Właściwości redoks:
glin występuje tylko na jednym stopniu utlenienia (+3); Al
3+
jest bardzo słabym utleniaczem; metal ten jest energicznym reduktorem, lecz w roztworach od pH
5 do 11 powleka się warstewką tlenku
Właściwości kwasowo-zasadowe:
biały wodorotlenek Al(OH)
3
strąca się przy pH
4 (z 0,01 M roztworu soli glinu) i rozpuszcza się ponownie w nadmiarze roztworu NaOH tworząc kompleksy
[Al(OH)
4
]
–
, świadczy to o jego charakterze amfoterycznym
15
Reakcje charakterystyczne jonu Al
3+
[0,2M Al(NO
3
)
3
]
Odczynnik
Równania reakcji
Efekt reakcji
AKT*
(odczynnik grupowy)
+NH
3
aq. + NH
4
Cl 2M
2Al
3+
+ 3S
2–
+ 6H
2
O
2Al(OH)
3
+ 3H
2
S
stężenie jonów OH
–
powstałych w reakcji hydrolizy siarczku amonu jest
wystarczające do przekroczenia iloczynu rozpuszczalności Al(OH)
3
i
powstaje biały galaretowaty osad wodorotlenku glinu (III); siarczek glinu
można otrzymać tylko w warunkach bezwodnych
NaOH 2M
HCl 2M
HCl 2M
Al
3+
+ 3OH
–
Al(OH)
3
Al(OH)
3
+ OH
–
Al OH
(
)
4
Al OH
(
)
4
+ H
+
Al(OH)
3
+ H
2
O
Al(OH)
3
+ 3H
+
Al
3+
+ 3H
2
O
biały galaretowaty osad wodorotlenku glinu (III) jest amfoteryczny, nie
rozpuszcza się w amoniaku (odróżnienie od cynku); rozpuszcza się w
kwasach i mocnych zasadach; po lekkim zakwaszeniu lub dodaniu NH
4
Cl
(zmniejsza stężenie OH
–
) ponownie wytrąca się wodorotlenek, który
rozpuszcza się w nadmiarze kwasu
NH
3
aq. 2M
Al
3+
+ 3(NH
3
· H
2
O)
Al(OH)
3
+ 3NH
4
biały galaretowaty osad wodorotlenku glinu (III)
Na
2
CO
3
lub (NH
4
)
2
CO
3
1M
2Al
3+
+ 3
3
2
CO
+ 3H
2
O
2Al(OH)
3
+ 3CO
2
powstaje biały galaretowaty osad wodorotlenku glinu (III), gdyż węglan
glinu ulega natychmiast całkowitej hydrolizie
K
2
HPO
4
0,5M
Al
3+
+ HPO
4
2
AlPO
4
+ H
+
biały galaretowaty osad fosforanu (V) glinu rozpuszczalny w kwasach
mineralnych i roztworach wodorotlenków alkalicznych, nierozpuszczalny
w kwasie octowym
CH
3
COONa 1M
Al
2
(SO
4
)
3
+ 6CH
3
COONa
2Al(CH
3
COO)
3
+ 3Na
2
SO
4
Al(CH
3
COO)
3
+ 2H
2
O
Al(OH)
2
CH
3
COO
+ 2CH
3
COOH
po zagotowaniu wytrąca się obfity osad dihydroksooctanu glinu; osad nie
wytrąca się ze stężonych roztworów soli glinu, w celu wytrącenia należy
roztwory rozcieńczyć wodą
Co(NO
3
)
2
0,1%
2Al(OH)
3
Al
2
O
3
+ 3H
2
O
**
2Al
2
O
3
+ 2Co(NO
3
)
2
2Co(AlO
2
)
2
+ 4NO
+ 3O
2
niebieski osad błękitu Thenarda
* odczynnik używa się pod wyciągiem
** wykonanie: osad wodorotlenku glinu odsączyć na sączku bibułowym; niewielką ilość osadu przenieść do parowniczki i zwilżyć 1 kroplą 0,1% Co(NO
3
)
2
i kroplą roztworu H
2
SO
4
;
wyprażyć; nie stosować zbytniego nadmiaru Co(NO
3
)
2
, gdyż podczas prażenia tworzy się czarny tlenek kobaltu (II).
16
PORÓWNANIE PRODUKTÓW REAKCJI KATIONÓW III GRUPY ANALITYCZNEJ
Odczynnik
Ni
2+
Co
2+
Fe
2+
Fe
3+
Mn
2+
Zn
2+
Al
3+
AKT
NiS
czarny
CoS
czarny
FeS
czarny
Fe
2
S
3
czarny
MnS
cielisty
ZnS
biały
Al(OH)
3
biały
NaOH
Ni(OH)
2
zielony
Co(OH)
2
**
różowy
Fe(OH)
2
****
zielonkawy
Fe(OH)
3
brunatny
Mn(OH)
2
***
biały
Zn(OH)
2
biały
Al(OH)
3
biały
NaOH
(nadmiar)
Ni(OH)
2
zielony
Co(OH)
2
**
różowy
Mn(OH)
2
***
biały
[Zn(OH)
4
]
2–
bezbarwny
[Al(OH)
4
]
–
bezbarwny
NH
3
aq.
Ni(OH)NO
3
zielony
Co(OH)NO
3
niebieski
Fe(OH)
2
****
zielonkawy
Fe(OH)
3
brunatny
Mn(OH)
2
***
biały
Zn(OH)
2
biały
Al(OH)
3
biały
NH
3
aq.
(nadmiar)
[Ni(NH
3
)
6
]
2+
szafirowofioletowy
r-r
[Co(NH
3
)
6
]
2+
*
różowy r-r
Mn(OH)
2
***
biały
[Zn(NH
3
)
4
]
2+
bezbarwny r-r
Al(OH)
3
biały
Na
2
CO
3
NiCO
3
zielony
[Co(OH)]
2
Cl
różowa hydroksosól
FeCO
3
****
biały, szybko
brunatniejący
Fe(OH)
3
brunatny
MnCO
3
biały
ZnCO
3
biały
Al(OH)
3
biały
K
3
[Fe(CN)
6
]
Ni
3
[Fe(CN)
6
]
2
zielonożółty
Fe
3
[Fe(CN)
6
]
2
błękit Turnbulla
Fe[Fe(CN)
6
]
brunatny
Mn
3
[Fe(CN)
6
]
2
brunatny
Zn
3
[Fe(CN)
6
]
2
żółtobrunatny
K
4
[Fe(CN)
6
]
Ni
2
[Fe(CN)
6
]
żółtozielony
Co
2
[Fe(CN)
6
]
zielony
Fe
2
[Fe(CN)
6
]
biały
(w atmosferze
pozbawionej tlenu)
Fe
4
[Fe(CN)
6
]
błękit pruski
Mn
2
[Fe(CN)
6
]
biały
Zn
2
[Fe(CN)
6
]
biały
NH
4
SCN lub
KSCN
(NH
4
)
2
Co(SCN)
4
niebieski
[Fe(SCN)
x
]
3–x
krwistoczerwony
Na
2
HPO
4
Ni
3
(PO
4
)
2
zielony
Co
3
(PO
4
)
2
różowofioletowy
Fe
3
(PO
4
)
2
biały
FePO
4
żółty
Mn
3
(PO
4
)
2
biały
Zn
3
(PO
4
)
2
biały
AlPO
4
biały
* nietrwały, utlenia się na powietrzu do [Co(NH
3
)
6
]
3+
(brązowożółty rortwór); ** osad utlenia się na powietrzu do Co(OH)
3
(brunatny); *** osad utlenia się na powietrzu
do H
2
MnO
3
(brunatny); **** osad utlenia się na powietrzu do Fe(OH)
3
(brunatny)

17
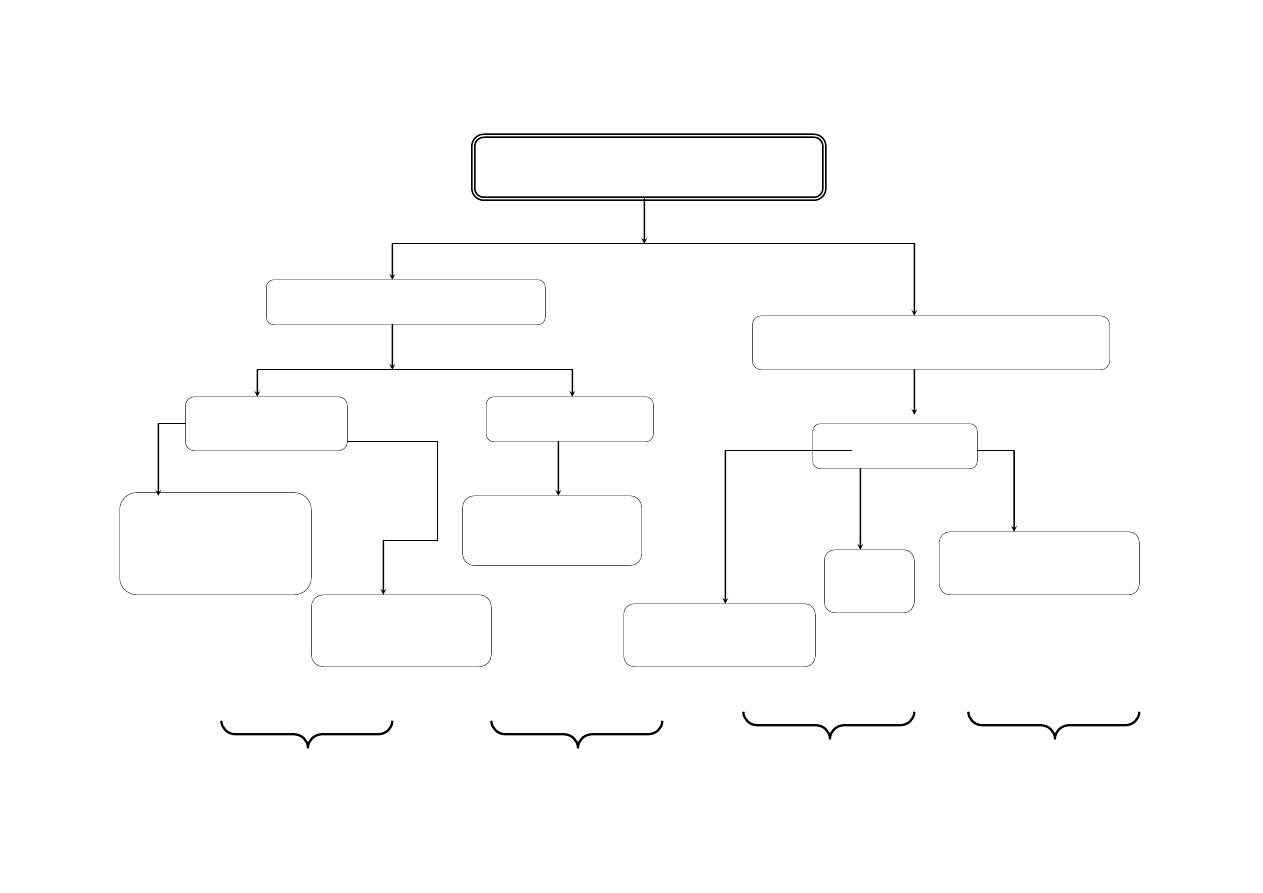
Analiza mieszaniny kationów III grupy analitycznej : (Ni
2+
, Co
2+
, Fe
2+
, Fe
3+
, Mn
2+
, Zn
2+
Al
3+
)
Na samym początku analizy w próbie pierwotnej sprawdzić za pomocą reakcji charakterystycznych obecność jonów Fe
2+
i Fe
3+
.
Do 2 ml próby pierwotnej dodać 2 ml 2M NH
4
Cl oraz kroplami 2M NH
3
aq do słabego zapachu amoniaku. Ogrzać do wrzenia i dodawać kroplami AKT aż do
całkowitego strącenia osadu, całość ogrzać do wrzenia i gotować 1 minutę. Osad wraz z roztworem pozostawić na ok. 10 minut. Wykonać próbę całkowitego
strącenia. Szybko przesączyć, lejek przykryć szkiełkiem zegarkowym. Otrzymuje się osad 1. W przesączu znajdują się kationy grup IV i V.
Osad 1 zawierający NiS
, CoS
, FeS
, Fe
2
S
3
, MnS
, ZnS
, Al(OH)
3
przemyć na sączku 3 ml gorącej wody z dodatkiem kilku kropli roztworu 2M
NH
4
Cl. Następnie osad z sączka przenieść szybko do zlewki, dodać ok. 10 ml 2M HCl (pod wyciągiem). Mieszać do zaprzestania wydzielania się H
2
S,
odsączyć. Otrzymuje się osad 2 i przesącz 2.
Osad 2 zawierający NiS
, CoS
przemyć wodą z dodatkiem 2 kropli AKT oraz kilku kropli 2M NH
4
Cl,
przenieść do zlewki, dodać 4 ml wody królewskie (3 ml stężonego HCl + 1 ml stężonego HNO
3
), ogrzać do
rozpuszczenia osadu i gotować tak długo, aż część roztworu odparuje. Dodać 3 ml wody i 3 ml 2M HCl i w
przypadku osadu przesączyć. Otrzymany przesącz 3 rozdzielić do 2 probówek.
Przesącz 2 zawierający Fe
2+
, Fe
3+
, Mn
2+
, Zn
2+
,
Al
3+
w postaci chlorków (analizować metodą
wodorotlenkową)
1
Do 2 ml przesączu 3 dodać 1M Na
2
CO
3
. Zielony
osad NiCO
3
świadczy o obecności
Ni
2+
2
Do 2 ml przesączu 3 dodać 1 ml 2% NH
4
SCN i 1 ml
alkoholu amylowego. Wstrząsnąć kilka razy.
Niebieskie zabarwienie warstwy organicznej
[Co(SCN)
4
]
2–
świadczy o obecności
Co
2+
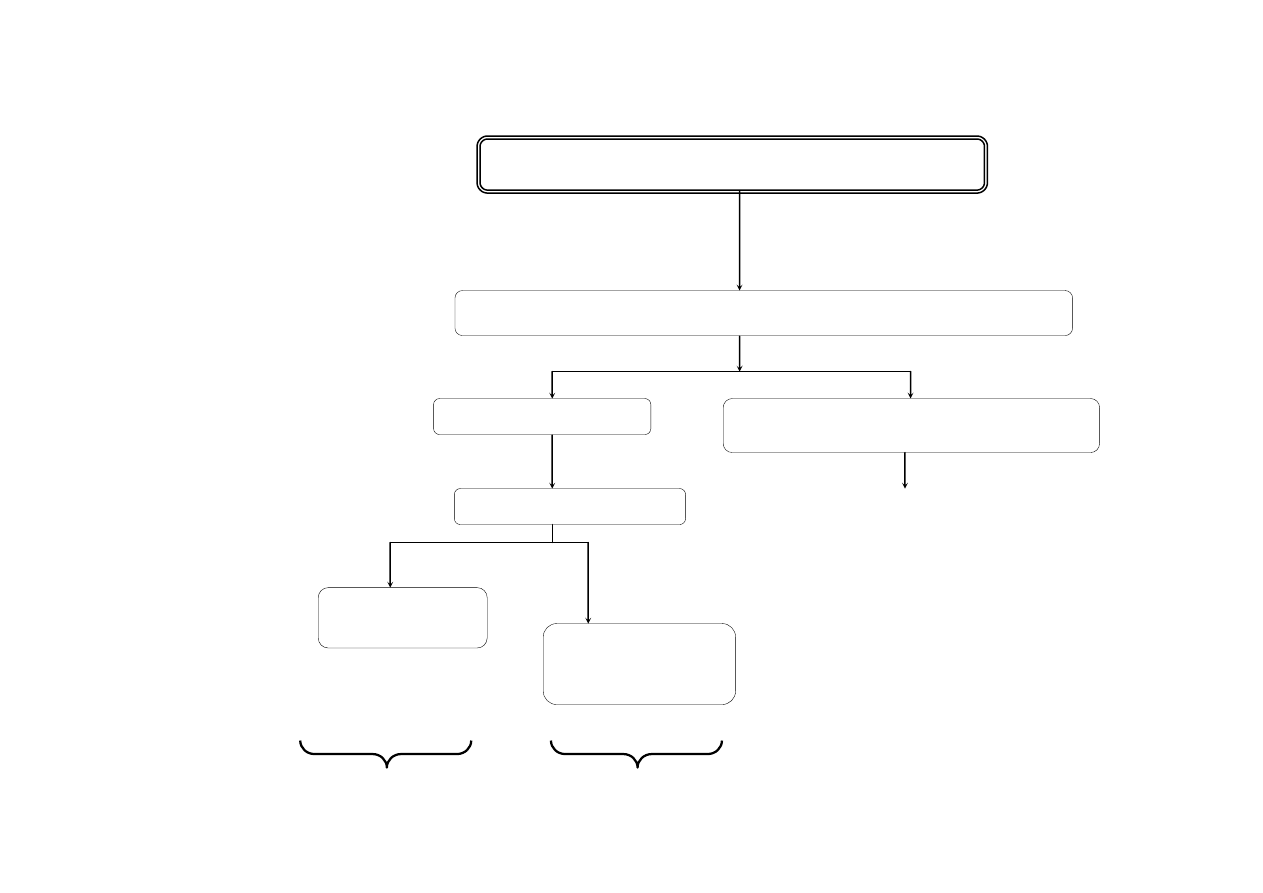
18
SCHEMAT ROZDZIELANIA MIESZANINY KATIONÓW III GRUPY ANALITYCZNEJ
Ni
2+
, Co
2+
, Fe
2+
, Fe
3+
, Mn
2+
, Zn
2+
, Al
3+
2M NH
4
Cl
NH
3
aq.
AKT
osad
NiS
, CoS
, FeS
Fe
2
S
3
, MnS
, ZnS
, Al(OH)
3
2M HCl
przesącz
Fe
2+
, Fe
3+
, Mn
2+
, Zn
2+
, Al
3+
osad
NiS
, CoS
st. HCl + st.HNO
3
przesącz
Ni
2+
Co
2+
1M Na
2
CO
3
2% NH
4
SCN +
alkohol amylowy
NiCO
3
jasnozielony osad
[Co(SCN)
4
]
2-
niebieskie zabarwienie
warstwy organicznej
Wynik: Ni
2+
Wynik: Co
2+
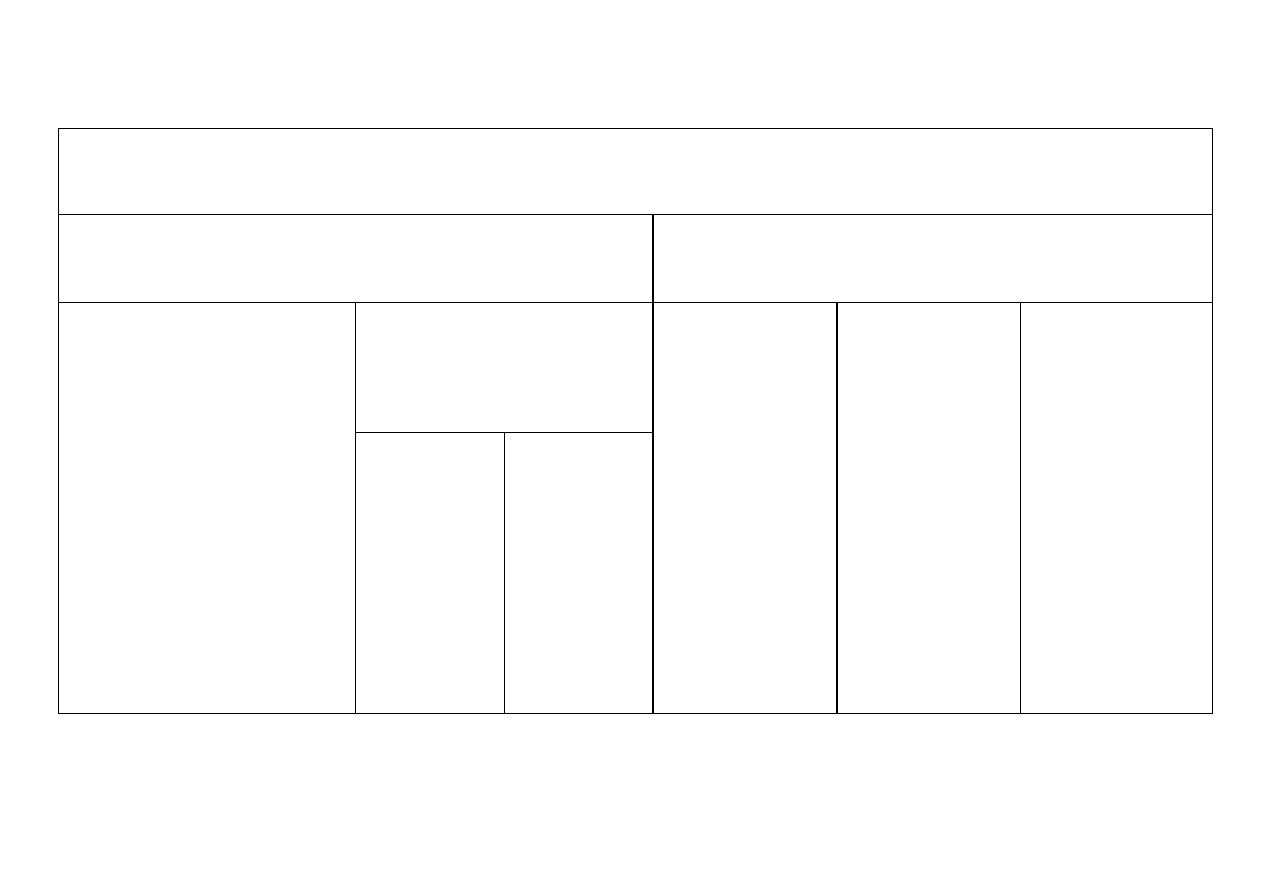
19
Analiza mieszaniny kationów III grupy analitycznej –
METODA WODOROTLENKOWA
Przesącz 2 zawierający Fe
2+
, Fe
3+
, Mn
2+
, Zn
2+
, Al
3+
w postaci chlorków odparować do objętości ok. 2 ml, przelać do zlewki, dodać 2 ml 3% H
2
O
2
i 4M
NaOH do odczynu zasadowego. Zlewkę przykryć szkiełkiem zegarkowym, gotować 5 min., przesączyć na gorąco. Otrzymuje się osad 1 i przesącz 1
Osad 1 zawierający Fe(OH)
3
, H
2
MnO
3
przemyć 3 ml gorącej wody,
następnie rozpuścić w 5 ml 2M HNO
3
, odsączyć. Otrzymuje się osad 2 i
przesącz 2.
Do przesączu 1 zawierającego jony [Zn(OH)
4
]
2–
, [Al(OH)
6
]
3–
dodawać
kroplami 2M H
2
SO
4
do odczynu kwaśnego. Odparować do ok. 4 ml i
rozdzielić do 3 probówek
Osad
2
zawierający
H
2
MnO
3
wprowadzić na pręciku szklanym do
probówki z Pb
3
O
4
(minia) i gotować z
st. HNO
3
.
Po oziębieniu i rozcieńczeniu wodą
destylowaną pojawia się fioletowe
zabarwienie jonów MnO
4
-
świadczące
o obecności jonów
Mn
2+
Przesącz 2 zawierający kationy Fe
3+
rozlać do dwóch probówek
1
1 ml przesączu 1 zadać
1 ml 1M CH
3
COONa i
tioacetamidem (AKT).
Biały osad ZnS
świadczy o obecności
2
1 ml przesącz 1 + 2 ml
1% K
4
[Fe(CN)
6
]. Biały
osad Zn
2
[Fe(CN)
6
]
potwierdza obecność
3
1 ml przesączu 1 dodać
1M CH
3
COONa i
ogrzewać.
Biały osad
Al(OH)
2
CH
3
COO
1
Do 1 ml
przesączu 2 dodać
1 ml 2% NH
4
SCN.
Pojawiające się
krwiste
zabarwienie
roztworu
[Fe(SCN)
x
]
3-x
świadczy o
obecności
Fe
3+
2
Do 1 ml
przesączu 2 dodać
1 ml 1%
K
4
[Fe(CN)
6
].
Granatowy osad
Fe
4
[Fe(CN)
6
]
3
świadczy o
obecności
Fe
3+
Zn
2+
Zn
2+
świadczy o obecności
Al
3+
20
SCHEMAT ROZDZIELANIA MIESZANINY KATIONÓW – METODA WODOROTLENKOWA
Wynik: Zn
2+
Wynik: Al
3+
Wynik: Fe
3+
Wynik: Mn
2+
3% H
2
O
2
4M NaOH
Fe
2+
, Fe
3+
, Mn
2+
, Zn
2+
, Al
3+
2M H
2
SO
4
przesącz
[Zn(OH)
4
]
2-
,
[Al(OH)
6
]
3-
1M CH
3
COONa
1M CH
3
COONa
AKT
Al(OH)
2
CH
3
COO
biały
Zn
2+
, Al
3+
ZnS
biały
1% K
4
[Fe(CN)
6
]
Zn
2
[Fe(CN)
6
]
biały
2M HNO
3
osad
Fe(OH)
3
, H
2
MnO
3
0,1%K
4
[Fe(CN)
6
]
[Fe(SCN)
x
]
3-x
x=1-6
krwiste zabarwienie
roztworu
przesącz
Fe
3+
Fe
4
[Fe(CN)
6
]
3
ciemnoniebieski
PbO
2
st. HNO
3
osad
H
2
MnO
3
MnO
4
-
fioletowy roztwór
2%NH
4
SCN

21
Uwagi do rozdzielania mieszaniny kationów III grupy analitycznej
1) Podczas dodawania do próbki kationów III grupy odczynnika grupowego [AKT i NH
4
Cl +
NH
3
aq.] pożyteczne jest obserwowanie zmian zachodzących w roztworze, co ułatwia dalszy tok analizy i
pozwala na przewidywanie składu próbki:
a)
obserwacje po dodaniu do próbki roztworu NH
4
Cl i NH
3aq
:
brak osadu wyklucza obecność jonów Al
3+
i Fe
3+
,
osad czerwonobrunatny wskazuje na obecność jonów Fe
3+
,
osad biały wskazuje na obecność jonów Al
3+
,
niebieskie zabarwienie roztworu wskazuje na obecność jonów Ni
2+
b) obserwacje po dodaniu do próbki roztworu AKT:
brak czarnego osadu wyklucza obecność jonów Ni
2+
, Co
2+
, Fe
2+
, Fe
3+
biały osad wskazuje na obecność jonów Zn
2+
lub Al
3+
osad cielisty wskazuje na obecność jonów Mn
2+
2) Strącone osady siarczków należy pozostawić na około 10 minut, aby umożliwić przejście lepiej
rozpuszczalnych odmian
siarczków niklu i kobaltu w odmiany
nie rozpuszczalne w 2M HCl.
3) Podczas przemywania osadu siarczków lejek należy przykryć szkiełkiem zegarkowym, aby
zapobiec ich utlenieniu do siarczanów (VI), a także ze względu na to, że wyschnięte siarczki trudno się
przemywają.
4) Rozpuszczanie siarczków i wodorotlenków kationów grupy III w 2M HCl należy prowadzić na
zimno i w krótkim czasie ze względu na możliwość całkowitego rozpuszczania NiS
i CoS
, co
zakłócałoby dalszy tok analizy.
5) Po rozpuszczeniu osadu siarczków w kwasie solnym zawartość mieszać w celu odpędzenia
siarkowodoru. Zapobiega to powtórnemu wytrącaniu się siarczków po zalkalizowaniu roztworu.
Wyszukiwarka
Podobne podstrony:
analiza kationów II gr (2)
ANALIZA KATIONÓW III GRUPY ANALITYCZNEJ
analiza kationów gr IV i V
ANALIZA KATIONÓW I,II,III GRUPY ANALITYCZNEJ
Kationy III A, Analiza Leków
Kationy III B, Analiza Leków
analiza kationów i anionów III, IV i V grupa
3 Analiza jakościowa III grupy kationów
MiTR Projekt 1 A B GiG III gr 1 niestacjonarne
analiza kationów I V (2)
Analiza kationow i anionow
Sprawozdanie analiza kationów
AJ Identyfikacja kationów III grupy, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
TEST III, gr. 10
TEST III, gr. 4
2545 Analiza kationów
Nr.9 BHP sem. III gr. A, 2011-2012
Analiza kationow i anionow wersja 2
więcej podobnych podstron