1
LIPIDY OSOCZA
1. Triacyloglicerole
2. Cholesterol wolny i zestryfikowany
3. Fosfolipidy
4. Wolne kwasy tłuszczowe
Transport lipidów w środowisku wodnym (we krwi) jest możliwy po ich połączeniu się z
białkami (apoproteinami) w związki wielkocząsteczkowe zwane lipoproteinami.
LIPOPROTEINY
sferyczne cząstki
- niestechiometryczne kompleksy białkowo-lipidowe
- rdzeń - triacyloglicerole i estry cholestrolu
- powierzchnia – cząsteczki amfipatycznych lipidów (fosfolipidy i cholesterol wolny)
i białek
oddziaływania pomiędzy cząsteczkami – niekowalencyjne
- wiązania wodorowe
- siły van der Waalsa
następuje wymiana lipidów i apoprotein pomiędzy lipoproteinami osocza oraz
pomiędzy lipoproteinami i błonami komórkowymi
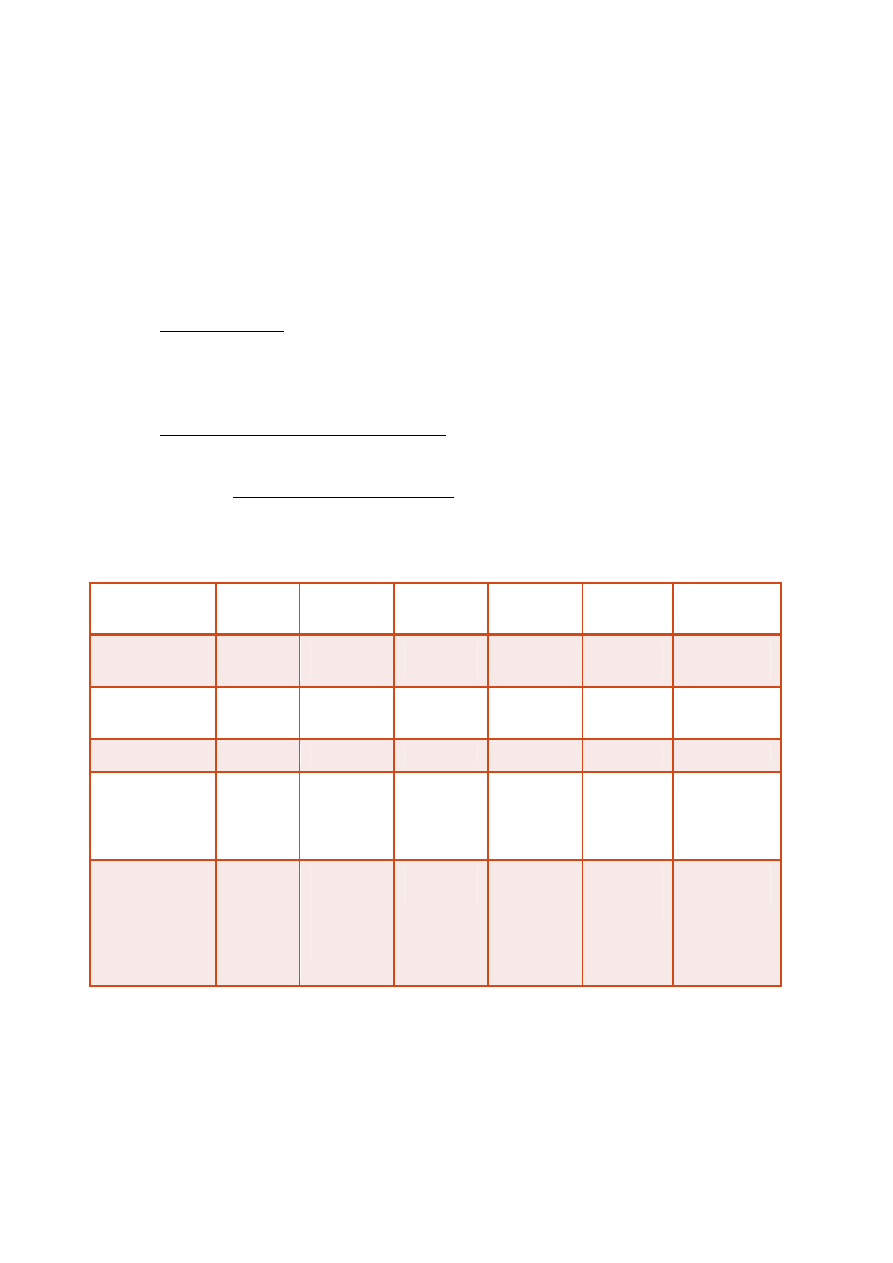
PODZIAŁ LIPOPROTEIN
Klasa/
Parametr
ChM
VLDL
IDL
LDL
HDL
Lp(a)
Gęstość
[g/mL]
<0,95
0,95-
1,006
1,006-
1,019
1,019-
1,063
1,063-
1,210
1,040-
1,130
Ruchliwość w
EF
start
prebeta
1
prebeta
2
beta
alfa
prebeta
Ś
rednica [nm]
>70
26-70
22-24
19-23
4-10
26-30
Główne lipidy
egzogenn
e TAG
endogenne
TAG
endogenne
TAG, estry
cholesterol
u
estry
cholesterol
u
fosfolipidy
estry
cholesterolu,
fosfolipidy
Główne białka
A-I
B-48
C-I
C-II
C-III
E
B-100
C-I
C-II
C-III
E
B-100
E
B-100
A-I
A-II
E
(a)
B-100
Podział uwzględniający różnice gęstości poszczególnych frakcji lipoproteinowych –
uzyskany metodą ultrawirowania
chylomikrony: 0,98 g/mL
lipoproteiny o bardzo małej gęstości (VLDL): <1,006 g/mL
lipoproteiny o pośredniej gęstości (IDL): 1,006- 1,019 g/mL
lipoproteiny o małej gęstości (LDL): 1,019-1,063 g/mL
2
lipoproteiny o dużej gęstości (HDL): 1,063-1,21 g/mL
Lp(a) – 1,040-1,130 g/mL
Podział uzyskany podczas elektroforezy (agaroza; pH 8,6):
α
-lipoproteiny (HDL)
pre-
β
-lipoproteiny (VLDL, IDL, Lp(a))
β
-lipoproteiny (LDL)
chylomikrony (ChM)
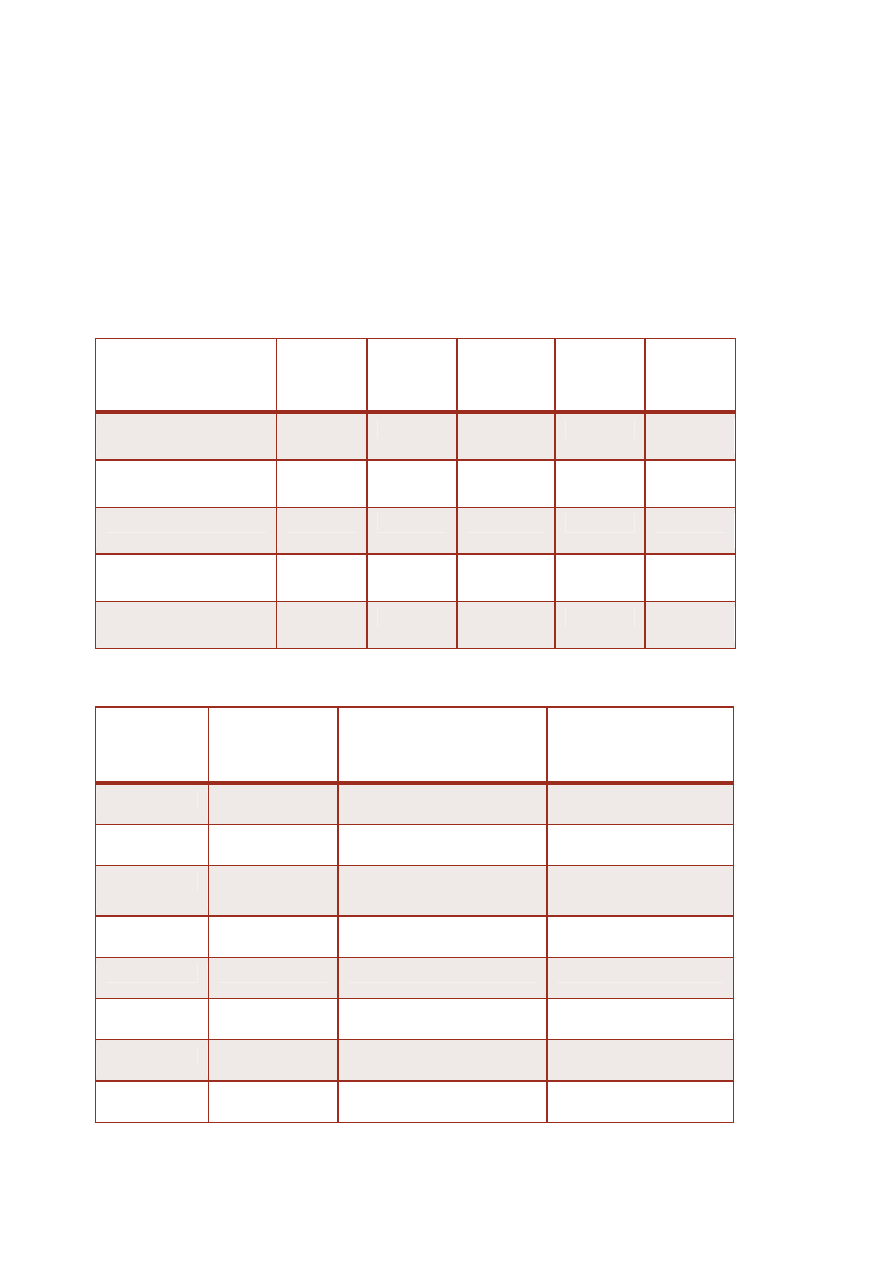
CHEMICZNY SKŁAD (%)PRAWIDŁOWYCH LIPOPROTEIN
Frakcja/
Skład (%)
ChM
VLDL
IDL
LDL
HDL
Triacyloglicerole
80-90
50-70
20-25
5-10
3-5
Cholesterol wolny
1-3
7-10
7-10
5-8
3-5
Estry cholesterolu
2-5
4-13
10-12
40-45
15-20
Fosfolipidy
3-7
15-20
15-20
20-22
20-30
Białka (apoproteiny)
1-2
8-12
18-20
20-25
45-55
APO(LIPO)PROTEINY
Apoproteina
Masa
cząsteczkowa
[Da]
Miejsce
syntezy
Stężenie w osoczu [g/L]
AI
28 300
Jelito, wątroba
1,0-1,2
AII
17 000
Wątroba, jelito
0,3-0,5
AIV
46 000
Wątroba, jelito, płuca,
ś
ledziona
0,16
B-48
265 000
Jelito
B-100
550 000
Wątroba
0,7-1,0
CI
6500
Wątroba, jelito
0,04-0,06
CII
8800
Wątroba, jelito
0,03-0,05
CIII
8900
Wątroba, jelito
0,12-0,14

3
D
20 000
Mózg, wątroba, nerki,
komórki endothelium
E-2, E-3, E-4
39 000
Wątroba, mózg, płuca,
ś
ledziona, mięśnie
0,025-0,100
Apoproteina
Funkcja
AI
Aktywator LCAT, ligand receptora HDL, rola strukturalna w HDL-ach
AII
Rola strukturalna, kofaktor HTGL, inhibitor LPL
AIV
Transport zwrotny cholesterolu, aktywator LCAT i LPL
B-48
Rola strukturalna
B-100
Ligand receptora apo B/E, rola strukturalna
CI
Kofaktor LCAT
CII
Aktywator LPL
CIII
Inhibitor apo-CII
D
Transport lipidów
E-2, E-3, E-4
Ligand receptora apo B/E i receptora LRP, transport cholesterolu
ENZYMY METABOLIZMU LIPOPROTEIN
Lipaza lipoproteinowa (LPL)
glikoproteina (55 000)
hydrolaza acyloglicerolu
występuje w: tkance tłuszczowej, mięśniach szkieletowych, mięśniu sercowym,
płucach, wątrobie, śledzionie
związana z powierzchnią komórek – głównie śródbłonka naczyniowego (za
pośrednictwem siarczanu heparanu)
aktywność w tkankach zależy od czasu jaki upłynął od posiłku oraz od wydzielania
hormonów (gł. insuliny)
- duża aktywność w tkance tłuszczowej po posiłku
- duża aktywność w mięśniach w okresie poresorpcyjnym
wstrzyknięcie heparyny powoduje:
- uwolnienie LPL do krwi
- zmianę wykorzystania kwasów tłuszczowych przez narządy
aktywatory: apo CII (na czczo na HDL-ach) i fosfolipidy (wiążą apo CII z
lipoproteiną)
4
Wątrobowa lipaza lipoproteinowa (HTGL/HL)
glikoproteina
syntetyzowana w wątrobie
wiąże się z powierzchnią śródbłonka w zatokach wątroby
hydrolizuje triacyloglicerole w:
- IDL-ach
- remnantach chylomikronów
- HDL (przekształca HDL
2
w HDL
3
)
Acylotransferaza acylo-CoA:cholesterol (ACAT)
enzym mikrosomalny
katalizuje reakcję estryfikacji cholesterolu w obecności CoA i ATP
inhibitory:
- kwasy żółciowe
- czynniki blokujące grupy sulfhydrylowe
wykazuje swoistość w stosunku do różnych kwasów tłuszczowych – szybkość
estryfikacji maleje w zależności od rodzaju kwasu w kolejności:
oleinian>palmitynian>stearynian>linoleinian
aktywność ACAT zależy od zawartości cholesterolu w komórce
Hydrolaza estrów cholesterolu (esteraza cholesterolowa)
w wątrobie, ścianie naczyniowej, nabłonku jelitowym, korze nadnerczy i jajnikach
(synteza hormonów steroidowych)
katalizuje odwracalną reakcję estryfikacji cholesterolu i hydrolizy estrów cholesterolu:
estry cholesterolu + H
2
O cholesterol wolny + kwas tłuszczowy
Acylotransferaza lecytyna:cholesterol (LCAT)
sekrecyjny enzym osocza
synteza w wątrobie
związana z frakcją HDL
katalizuje reakcję:
lecytyna + cholesterol ester cholesterolu + lizolecytyna
powstają głównie estry cholesterolu i nienasyconych kwasów tłuszczowych (kwasu
linolowego, oleinowego, arachidonowego)
aktywator: AI (CI)
BIAŁKO PRZENOSZĄCE ESTRY CHOLESTEROLU (CETP)
glikoproteina
posiada domeny wiążące triacyloglicerole, estry cholesterolu, fosfolipidy
synteza – wątroba, nadnercza, trzustka, mięśnie, tkanka tłuszczowa, jelito cienkie,
serce i nerki
odpowiada za transfer:
- estrów cholesterolu pomiędzy lipoproteinami osocza i ich wymianę na triacyloglicerole

5
(100%)
- fosfolipidów (w ok. 30%)
BIAŁKO PRZENOSZĄCE FOSFOLIPIDY (PTP)
odpowiedzialne za 70 % transferu fosfolipidów pomiędzy lipoproteinami osocza:
- z lipoprotein bogatych w TAG na HDL-e
- z HDL
3
na VLDL-e i LDL-e
- z CETP z HDL na inne lipoproteiny
RECEPTORY UCZESTNICZĄCE W PRZEMIANACH LIPOPROTEIN OSOCZA
receptor dla remnantów (LRP)
- w wątrobie
- rozpoznaje apo E
receptor dla LDL (receptor apo B100/E)
- w wielu komórkach organizmu
- rozpoznaje apo B100 i apo E
- jego synteza jest ściśle uzależniona od zapotrzebowania komórki na cholesterol i
zawartości w niej estrów cholesterolu
receptor SR-B1 (receptor zmiatający B1)
- w wątrobie i tkankach steroidogennych wiąże HDL za pośrednictwem apo AI i estry
cholesterolu są dostarczane do komórek
- w pozostałych tkankach pośredniczy w przenoszeniu cholesterolu z komórek do
HDL
3
(zwrotny transport choleterolu)
transportery kasetowe wiążące ATP: ABCA1 i ABCG1
- rodzina białek transportujących z towarzyszącą hydrolizą ATP w celu związania
substratu (co umożliwia jego transport przez błonę)
- ABCG1 – pośredniczy w transporcie cholesterolu z komórek do HDL-i (np. z
makrofagów)
- ABCA1 – preferencyjnie ułatwia wypływ cholesterolu i fosfolipidów do cząstek
pre
β
-HDL lub apo AI przekształcanych następnie w dyskoidalne HDL i HDL
3
6
7
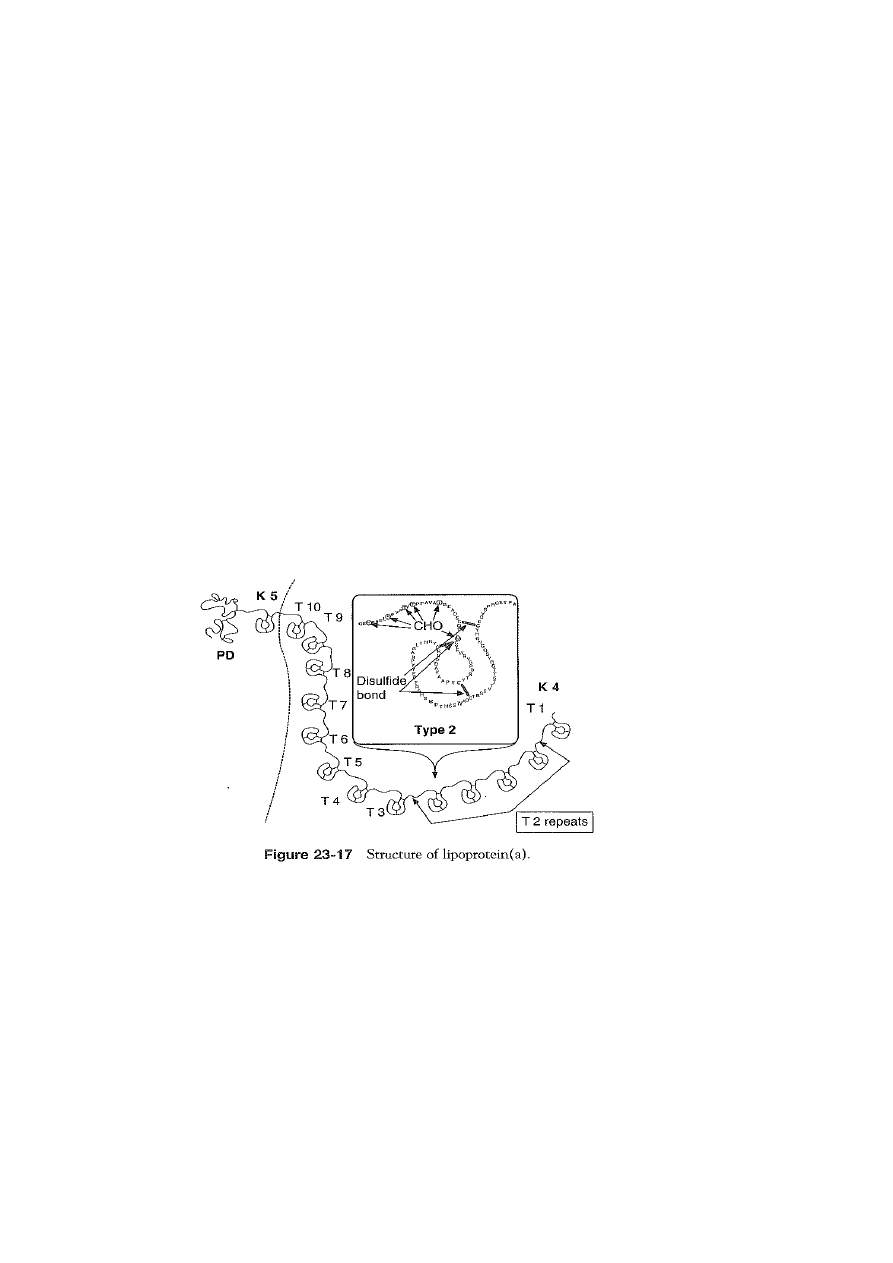
LIPOPROTEINA (a)
glikoproteina, białko ostrej fazy, zmodyfikowana cząstka LDL
apo (a) i apo B100 – połączone mostkiem dwusiarczkowym
apo (a) – peptyd sygnałowy, domena proteazowa i struktury obwarzankowe (kringles)
utrzymywane przez 3 wiązania dwusiarczkowe (podobne struktury są w
plazminogenie, protrombinie, tkankowym i urokinazowym aktywatorze
plazminogenu)
zakres stężeń w osoczu 1-100 mg/dL (prawidłowe nie powinno przekraczać 30
mg/dL)
podobieństwo budowy apo (a) do plazminogenu może hamować procesy fibrynolizy
(działanie prozakrzepowe)
pobudza regenerację i naprawę uszkodzonych naczyń
apo (a) występuje w izoformach:
- F (fast) – o ruchliwości elektroforetycznej większej niż apo B100
- B – o ruchliwości elektroforetycznej zbliżonej do apo B100
- S1, S2, S3, S4 (slow) o ruchliwości elektroforetycznej mniejszej niż apo B100
u osób z małym stężeniem Lp(a) przeważają duże izoformy apo (a) S3 i S4
u osób ze zwiększonym stężeniem Lp(a) przeważają izoformy małe F, B, S1, S2
Lp(a) nasila chemotaksję monocytów do blaszki miażdżycowej i aktywację płytek
krwi
Lp(a) jest pobierana przez receptory typu „scavenger”
LIPOPROTEINA X (LpX)
u pacjentów z cholestazą wątrobową
budowa – liposomy:
- podwójna warstwa fosfolipidowa (gł. lecytyny) – 66%
- wolny cholesterol – 25%
- białka (1/2 albumina) – 5%
nie wykazuje właściwości aterogennych
LIPOPROTEINA
β
β
β
β
-VLDL
powstaje w osoczu:
- podczas stosowania diety bogatotłuszczowej

8
- w otyłości brzusznej
- w insulinooporności
- cukrzycy typu 2
- gdy wytwarzana jest izoforma apo E2
gęstość <1,006 g/mL (VLDL)
ruchliwość elektroforetyczna b-lipoprotein (LDL)
zawartość
- 40% TAG + ok. 35% cholesterolu
aterogenna
ZMODYFIKOWANE LDL
utlenione LDL – retencja LDL i zaburzenie równowagi prooksydacyjno-
antyoksydacyjnej
- mm-LDL (wczesna faza modyfikacji)
- ox-LDL (późna faza modyfikacji)
insulinooporność i cukrzyca – podwyższone stężenia glukozy
- gli-LDL
- glioksy-LDL
APOPROTEINA E (Apo E)
chylomikrony, VLDL, IDL, HDL
rozpoznawana przez receptory: LRP i B/E
osłania apo AI
nasila aktywność białka CETP
wykazuje polimorfizm (3 allele w jednym locus + modyfikacja potranslacyjna)
6 fenotypów: apo E 2/2, apo E 3/2, apo E 3/3, apo E 4/2, apo E4/3, apo E 4/4
Poszczególne izoformy wykazują różną siłę wiązania z receptorami LRP:
izoforma apo E2
– wykazuje mniejsze powinowactwo do receptora LRP -> zmniejsza się zawartość
cholesterolu w komórkach wątroby -> zwiększa się ilość receptorów B/E
izoforma apo E4
- wykazuje większe powinowactwo do receptora LRP -> zwiększa się zawartość
cholesterolu w komórkach wątroby -> zmniejsz się ilość receptorów B/E
- bierze udział w patomechanizmie choroby Alzheimera (powstają kompleksy apo E4 i
peptydu powstającego z białka prekursorowego amyloidu)
DYSLIPIDEMIE / DYSLIPOPROTEINEMIE
Klasyfikacja hiperlipoproteinemii według Fredricksona
Typ
Wygląd
surowicy
CH
TAG
EF
ChT/TAG
I
mleczna
N/↑
↑↑↑
ChM
< 0,2
IIa
klarowna
↑↑↑
N
nadmiar LDL
> 1,5
IIb
klarowna,
opalizująca
↑↑
↑↑
nadmiar
LDL i VLDL
> 1,5

9
III
mętna
↑↑
↑↑
IDL
ok.1
IV
mętna
N/↑
↑↑↑
nadmiar VLDL
< 0,2
V
mleczna
↑↑
↑↑↑
ChM i nadmiar
VLDL
0,15-0,6
KLASYFIKACJA HIPERLIPIDEMII
(wg Europejskiego Towarzystwa Miażdżycowego)
CH
mmol/L (mg/dL)
TAG
mmol/L (mg/dL)
Hipercholesterolemia izolowana:
- łagodna
- umiarkowana
- znaczna
5,2-6,5 (200-250)
6,5-7,8 (250-300)
> 7,8 (> 300)
<1,7 (150)
<1,7 (150)
<1,7 (150)
Hipertriglicerydemia izolowana:
- umiarkowana
- znaczna
<5,2 (200)
<5,2 (200)
2,3-4,6 (200-400)
>4,6 (>400)
Hiperlipidemia mieszana:
- umiarkowana
- znaczna
5,2-6,5 (200-250)
>7,8 (>300)
2,3-4,6 (200-400)
>4,6 (400)
HIPERCHOLESTEROLEMIA
Klasyfikacja
genetyczna
Pierwotna przyczyna
Zaburzenia metaboliczne
Typ
Pospolita hiper-
cholesterolemia
liczne czynniki genetyczne/
ś
rodowiskowe
nadprodukcja LDL i
obniżony katabolizm
IIa
Rodzinna złożona
hipelipidemia
nieznana
nadprodukcja apo B frakcji
VLDL i LDL
IIa
Rodzinna hiper-
cholesterolemia
liczne mutacje powodujące
upośledzenie funkcji lub brak
receptora komórkowego dla
LDL
upośledzony katabolizm
LDL i nadprodukcja LDL
IIa
HIPERTRIGLICERYDEMIA
Klasyfikacja
genetyczna
Pierwotna przyczyna
Zaburzenia
metaboliczne
Typ
Pospolita hiper-
triglicerydemia
czynniki genetyczne/
ś
rodowiskowe
nadprodukcja VLDL
IV

10
Rodzinna złożona
hiperlipidemia
nieznana
nadprodukcja apo B
frakcji VLDL i LDL
IV
Rodzinna
hipertriglicerydemia
nieznana
nadprodukcja TAG
frakcji VLDL i/lub
upośledzony katabolizm
IV
HIPERLIPIDEMIA MIESZANA
Klasyfikacja
genetyczna
Pierwotna przyczyna
Zaburzenia
metaboliczne
Typ
Rodzinna złożona
hiperlipidemia
nieznana
nadprodukcja apo B
frakcji VLDL i LDL
IIb
Rodzinna hiper-
cholesterolemia
liczne mutacje powodujące
upośledzenie funkcji lub brak
receptora komórkowego dla
LDL
upośledzony katabolizm
LDL i nadprodukcja
LDL
IIb
Rodzinna hiper-
triglicerydemia
nieznana
nadprodukcja TAG
frakcji VLDL i/lub
upośledzony katabolizm
IV
Zespół hiper-
chylomikronemii
brak/niedobór LPL lub jej
aktywatora apo CII
upośledzony katabolizm
ChM, czasem wtórne
upośledzone usuwanie
VLDL
I lub V
INNE RODZAJE KLASYFIKACJI DYSLIPIDEMII
pierwotne i wtórne
jednogenowe,wielogenowe, złożone
PIERWOTNE DYSLIPIDEMIE
Związane z zaburzeniami transportu lipidów egzogennych
sitosterolemia (zwiększone wchłanianie steroli roślinnych)
abetalipoproteinemia (brak syntezy VLDL i ChM)
choroba Andersona (brak syntezy ChM)
rodzinna hipertriglicerydemia (chylomikronemia) związana z niedoborem LPL
rodzinna hipertriglicerydemia (chylomikronemia) związana z niedoborem apo CII
hiperlipidemia typu III (rodzinna dysbetalipoproteinemia) – izoforma apo E2 + inne
przyczyny
Związane z zaburzeniami transportu lipidów endogennych
złożone hiperlipidemie (złożone podłoże genetyczne) – izoforma apo E4 (najczęściej)
rodzinna złożona hiperlipidemia (nasilona sekrecja apo B100 i synteza VLDL w
wątrobie, wzrost aktywności apo CIII + inne)
rodzinna hipercholesterolemia (upośledzona funkcja receptora dla LDL )
rodzinny defekt apoproteiny apo B100
dyslipidemia z nadprodukcją Lp(a)
hipobetalipoproteinemia

11
brak aktywności lipazy wątrobowej
Związane z zaburzeniami drogi transportu zwrotnego cholesterolu do wątroby
rodzinna hipoalfalipoproteinemia
brak apo AI
zmieniona budowa apo AI
choroba tangierska (mutacje genu transportera ABCA-1)
upośledzenie aktywności LCAT
hiperalfalipoproteinemia związana z niedoborem CETP
brak apo AII
Przyczyna
Podwyższona frakcja
lipoprotein
HDL
Endokrynna, metaboliczna
- cukrzyca
LDL i/lub VLDL/ChM
↓
- niedoczynnośc tarczycy
LDL i/lub VLDL/ChM/IDL
↓
- choroba Cushinga
LDL i/lub VLDL
N
- akromegalia
VLDL
?
Nerkowa
- niewydolność nerek
IDL lub VLDL
↓
- zespół nerczycowy
LDL i/lub VLDL/ChM
↓
Wątrobowa
- cholestaza
LDL (LpX)
↓
- alkoholizm
VLDL, ChM
N
Przyczyna
Podwyższona frakcja
lipoprotein
HDL
Immunologiczna:
- toczeń rumieniowaty
ChM lub IDL
N
- gammapatie monoklonalne
LDL i/lub VLDL/ChM lub IDL
↓
Leki:
-
β
-blokery
VLDL, LDL
↓
- tiazydy
LDL i/lub VLDL
N/↓
- glikokortykoidy
VLDL i/lub ChM z/bez LDL
N/↓
- estrogeny
VLDL/ChM
N
- gestageny
LDL i VLDL
↓
12
WSKAZANIA DO PRZEPROWADZENIA BADAŃ LIPIDOWYCH
ocena ryzyka wieńcowego
pierwotne dyslipoproteinemie (objawy: żółtaki, obwódka starcza, zmętnienie rogówki,
barwnikowe zwyrodnienie siatkówki, hepatosplenomegalia)
wtórne dyslipoproteinemie
wyjaśnienie etiologii ostrego zapalenia trzustki
profilaktyka
kontrola leczenia obniżającego stężenie tłuszczów (dietetycznego, farmakologicznego)
i leczenia chorób wywołujących wtórne hipercholesterolemie
MATERIAŁ DO BADAŃ LIPIDOWYCH
krew żylna – krótkotrwały ucisk stazy
pacjent minimum 12-14 godzin na czczo (bez głodówek)
ostatni posiłek przed badaniem – z małą ilością tłuszczu, bez alkoholu (szczególnie
ważne podczas oznaczania stężenia TAG)
w ciągu 24 godzin przed pobraniem krwi nie wykonywać żadnej ciężkiej pracy
fizycznej
surowica lub osocze wersenianowe (1 mg EDTA na 1 mL krwi)
przechowywanie materiału – w szczelnie zamkniętych probówkach:
- do 4 dni w lodówce
- w temp. -20°C do 6 miesięcy
- w temp. -70°C do roku
Test zimnej flotacji
ocena wyglądu surowicy/osocza (na czarnym tle)
- mętny wygląd – zależy od nadmiaru TAG (VLDL lub ChM)
do wąskiej probówki nalewamy 2-5 mL surowicy i wstawiamy do lodówki na 12-18
godzin
wynik:
- gęsty kożuszek - kożuszek
- mętna
na powierzchni
- mętna surowica surowica
- przejrzysta surowica
↑
ChM - typ I ↑ ChM typ V ↑ VLDL – typ IV/IIB
↑ VLDL
OZNACZANIE CHOLESTEROLU CAŁKOWITEGO
Metody kolorymetryczne (chemiczne)
! Krew nie może być zhemolizowana – hemoliza wpływa na stężenie cholesterolu w osoczu
(zwiększa)!
w osoczu in vitro:
ChW : ChE = 1 : 3
w erytrocytach
ChW : ChE = 4 : 1
Bilirubina w stężeniu powyżej 10 mg% wpływa na oznaczenie cholesterolu – przyjmuje się
poprawki zależne od stężenia bilirubiny:
- przy stężeniu bilirubiny >5mg% na każdy 1 mg% należy dodać 2,5 mg% cholesterolu

13
Metody kolorymetryczne oznaczania cholesterolu dzielimy na:
jednostopniowe – reakcja barwna(rutynowe)
wielostopniowe
- czterostopniowe
ekstrakcja cholesterolu
zmydlanie
izolowanie
reakcja barwna
- trzystopniowe
ekstrakcja cholesterolu
zmydlanie
reakcja barwna
EKSTRAKCJA
Cholesterol jest związany z lipoproteinami – należy go z tych połączeń wyekstrahować
mieszaniną odczynników:
etanolu i eteru – całkowita ekstrakcja cholesterolu
etanolu i acetonu
metanolu i chloroformu (mieszanina Folcha)
ZMYDLANIE
Hydroliza estrów cholesterolu za pomocą alkoholowego roztworu KOH (na ciepło) –
uzyskanie postaci wolnej cholesterolu
IZOLOWANIE
najczęściej strącanie digitoniną
- powstają digitonidy
- stosunek molekularny cholesterolu do digitoniny 1:1
- podczas strącannia stosuje się nadmiar digitoniny (10:1)
- przed reakcją barwną należy pozbyć się digitonidów (pirydyną lub CH
3
COOH
REAKCJE BARWNE
A. Reakcja Liebermanna – Burcharda - najstarsza
do roztworu dodaje się mieszaninę bezwodnika CH
3
COOH i stężonego H
2
SO
4
Roztwór: cholesterol w chloroformie, kwasie octowym, dioksanie lub bezpośrednio
próbka surowicy/osocza
reakcja L-B nie jest swoista dla cholesterolu – z odczynnikiem reagują także
bilirubina, witaminy, inne steroidy.
B. Kwas p-toluenosulfonowy
z bezwodnikiem CH
3
COOH, CH
3
COOH lodowatym i H
2
SO
4
C. Reakcja z FeCl
3
, CH
3
COOH lodowatym i H
2
SO
4
Referencyjna metoda oznaczania cholesterolu całkowitego
Metoda Abell-Kendalla (chemiczna 3-stopniowa):
ekstrakcja: mieszanina alkoholu etylowego i eteru
zmydlanie : alkoholowy roztwór KOH
reakcja barwna: Libermanna-Burcharda
Metody enzymatyczne

14
HYDROLIZA
esteraza cholesterolowa
cholesterol zestryfikowany + H
2
O cholesterol + RCOOH
UTLENIENIE
oksydaza cholesterolowa
cholesterol + O
2
∆
4- cholestenon + H
2
O
2
OZNACZANIE
elektroda tlenowa – oznaczanie tlenu zużytego w tej reakcji
spektrofotometrycznie – pomiar powstałego D4- cholestenonu (l
max
- 240 nm)
reakcja Hanztscha – katalaza + metanol
- metanol utlenia się do aldehydu mrówkowego, który w obecności acetyloacetonu i
amoniaku daje barwny kompleks 3,5-diacetylo-1,4dihydrolutydyny (405-415 nm)
reakcja Trindera - kolorymetrycznie w obecności peroksydazy z 4-aminoantypiryną
w obecności fenolu (500-550 nm)
4-aminoantypiryna + fenol = odczynnik Trindera
peroksydaza
H
2
O
2
+ fenol + 4-aminoantypiryna barwnik chinoiminowy + 2H
2
O
Metoda CHOD-PAP = oksydaza + odczynnik
cholesterolowa Trindera
test optyczny
katalaza
H
2
O
2
+ etanol aldehyd octowy + 2H
2
O
dehydrogenaza aldehydu octowego
aldehyd octowy + NADP
+
kwas octowy + NADPH+H
+
Interferencje – metody enzymatyczne oznaczania cholesterolu
Interferują związki barwne lub uczestniczące w reakcji utleniania:
bilirubina o stężeniu powyżej 5 mg/dL (85,5
µ
mol/L) - dodaje się oksydazę bilirubiny
kwas askorbinowy
hemoglobina – stosuje się pomiar bichromatyczny
inne sterole zawierające grupę –OH (np. sitosterol) mogą reagować z zastosowanymi
odczynnikami
Oznaczanie estrów cholesterolu
ChT – ChW = ChE
ChT – cholesterol całkowity
ChW – cholesterol wolny (oznaczony bez etapu zmydlania)
ChE – estry cholesterolu

15
Metoda rozcieńczeń izotopowych z wykorzystaniem spektrometrii masowej
metoda definitywna oznaczania cholesterolu (ID/MS)
Ch + Ch znakowany (1:1) -> hydroliza estrów -> ekstrakcja
z przekształceniem cholesterolu w etery (analiza GC/MS)
oblicza się stosunek cholesterolu znakowanego do nieznakowanego i stężenie
cholesterolu w próbce
bardzo wysoka czułość i precyzja
Zakresy wartości prawidłowych stężeń cholesterolu całkowitego
zakres wartości prawidłowych trudny do zdefiniowania (odbiega od zakresu wartości
pożądanych = nie powodujących wzrostu ryzyka choroby niedokrwiennej serca)
- duża zmienność biologiczna (wiek, płeć, dieta, wahania
sezonowe, dobowe, faza cyklu menstruacyjnego, ciąża, zawał mięśnia sercowego,
zabiegi chirurgiczne)
- duża częstość hipercholesterolemii
- długi okres latencji do klinicznych objawów następstw hipercholesterolemii
zakłada się zakres wartości pomiędzy 10 i 90 percentylem
Wiek
Stężenie cholesterolu całkowitego
[mg/dL]
[mmol/L]
> 40 r. ż.
< 240
< 6,2
30-40 r. ż.
< 220
< 5,7
20-30 r. ż.
< 200
< 5,2
< 20 r. ż.
< 170
< 4,4
> 1 r. ż.
< 225
< 5,8
< 1 r. ż.
< 190
< 5,0
Przelicznik [mg/dL] na [mmol/L]: 0,026
Nieprawidłowe stężenia cholesterolu całkowitego
Wartości podwyższone:
pierwotne hipercholesterolemie
wtórne hipercholesterolemie - w przebiegu:
- przewlekła niewydolność nerek
- zespół nerczycowy
- przewlekłe choroby wątroby i dróg żółciowych (szczególnie pierwotna żółciowa
marskość wątroby)
- niedoczynność tarczycy
- cukrzyca (źle wyrównana)
leki: gestageny (doustne środki antykoncepcyjne), glikokortykoidy, leki moczopędne
złe nawyki żywieniowe
Wartości obniżone:
poniżej 140 mg/dL (3,6 mmol/L)

16
ciężkie choroby wyniszczające (nowotwory, przewlekłe zakżenia, operacje, urazy
wielonarządowe)
nadczynność tarczycy
niewydolność wątroby
głodzenie
OZNACZANIE STĘŻENIA TRIACYLOGLICEROLI (TAG)
Metody kolorymetryczne (chemiczne)
EKSTRAKCJA
odczynnikiem Bloora (etanol:eter etylowy; 3:1 v/v)
- ekstrakcji ulegają także fosfolipidy
- suszenie ekstraktu i ważenie
ADSORPCJA
usuwanie fosfolipidów – adsorpcja mieszaniną albuminy i zeolitu
usuwanie glukozy – adsorpcja mieszaniną Ca(OH)
2
i CuSO
4
ZMYDLANIE
etanolowym roztworem KOH
następuje uwolnienie glicerolu
REAKCJA BARWNA
glicerol utlenia się pod wpływem kwasu nadjodowego do formaldehydu
formaldehyd kondensuje z acetonem w obecności amoniaku – powstaje kompleks
barwny: 3,5-diacetylo-1,4-dihydrolutydyna (405 nm)
Metody fluorymetryczne
3,5-diacetylo-1,4-dihydrolutydyna (DDL) – może być oznaczana metodą
fluorymetryczną
Metody enzymatyczne
HYDROLIZA
lipaza
triacyloglicerol + 3H
2
O glicerol + 3 kwasy tłuszczowe
OZNACZANIE GLICEROLU
z wykorzystaniem testu optycznego
1.
kinaza glicerolowa
glicerol + ATP
glicerolofosforan + ADP
dehydrogenaza glicerolofosforanowa
glicerolofosforan + NAD
+
fosfodihydroksyaceton + NADH+H
+
2.
kinaza glicerolowa
glicerol + ATP
glicerolofosforan + ADP
kinaza pirogronianowa
ADP + fosfoenolopirogronian
pirogronian + ATP
LDH
pirogronian + NADH+H
+
mleczan + NAD
+

17
z wykorzystaniem pomiaru kolorymetrycznego
1.
kinaza glicerolowa
glicerol + ATP
glicerolofosforan + ADP
dehydrogenaza glicerolofosforanowa
glicerolofosforan + NAD
+
fosfodihydroksyaceton + NADH+H
+
diaforaza
NADH+H
+
+ barwnik tetrazoliowy formazan + NAD
+
Pomiar: 500 nm
2.
kinaza glicerolowa
glicerol + ATP
glicerolofosforan + ADP
oksydaza glicerolofosforanowa
glicerolofosforan + O
2
fosfodihydroksyaceton + H
2
O
2
peroksydaza
H
2
O
2
+ fenol + 4-aminoantypiryna barwnik chinoiminowy + 2H
2
O
Pomiar: 500-550 nm (metoda z odczynnikiem Trindera, PAP)
Reakcja Trindera - kolorymetrycznie w obecności peroksydazy z 4-aminoantypiryną w
obecności fenolu (500-550 nm)
4-aminoantypiryna + fenol = odczynnik Trindera
Interferencje – metody enzymatyczne oznaczania TAG
endogenny glicerol – w prawidłowych warunkach w niewielkich ilościach
(równowartość ok. 10 mg/dL TAG)
zwiększenie stężenia glicerolu:
- cukrzyca
- stres (emocjonalny)
- dożylne podawanie leków zawierających glicerol
- przedłużone przechowywanie w temperaturze >-20°C
Metoda stałego odcinka czasu (fixed time method)
- oparta na rożnicy wartości pomiarów w dwóch punktach czasowych
- pozwala na eliminację błędu wynikającego z obecności glicerolu
Zakres wartości prawidłowych stężeń TAG
50 -180 mg/dL (0,55-2,0 mmol/L)
Przelicznik z [mg/dL] na [mmol/L]: 0,0114
Nieprawidłowe stężenia TAG
Wartości podwyższone:
pierwotne hipertriglicerydemie
wtórne hipertriglicerydemie – w przebiegu:

18
- cukrzyca
- dna moczanowa
- choroba Cushinga
- gammapatie monoklonalne
- toczeń rumieniowaty układowy
- choroby spichrzania glikogenu
- ciąża
- skłonność: otyłość, nadużywanie alkoholu, dieta bogatowęglowodanowa
leki: blokery receptorów b, tiazydy, glikokortykoidy, estrogeny (doustne leki
antykoncepcyjne)
Oznaczanie stężenia cholesterolu frakcji HDL
Metody strąceniowe
precypitacja lipoprotein VLDL, IDL, Lp(a), LDL, ChM
- za pomocą polianionów (heparyna, siarczan dekstranu, fosforowolframian)
reagujących z dodatnio naładowanymi grupami lipoprotein
- w obecności kationów dwuwartościowych reakcja ulega przyśpieszeniu
- precypitacja 10-15 minut -> wirowanie 45 000g; 1 minuta lub 1500g; 30 minut
w supernantancie: cholesterol HDL (oznaczany metodą enzymatyczną)
Najczęściej stosowane mieszaniny polianionów z dwuwartościowymi kationami:
heparyna z Mn
+2
siarczan dekstranu z Mg
+2
(najlepszy przy wysokich stężeniach TAG)
kwas fosforowolframowy z Mg
+2
glikol polietylenowy 20 000 (wytrąca także HDL
2
)
!Gdy stężenie TAG>400 mg/dL precypitacja jest utrudniona – należy zastosować
wirowanie, filtrację lub rozcieńczenie badanej próbki osocza!
Metody bezpośrednie
Oznaczenie cholesterolu we frakcji HDL – metodą enzymatyczną z zastosowaniem:
przeciwciał poliwalentnych przeciwko apo-B
czynników kompleksujących
- cyklodekstryna – opłaszcza lipoproteiny (głównie z apo-B, HDL
są opłaszczone w niewielkim stopniu) = osłania cholesterol we frakcjach poza HDL
przed enzymami uczestniczącymi w reakcji
- specyficzny detergent usuwa cyklodekstrynę z frakcji HDL
Oznaczanie stężenia cholesterolu frakcji LDL
Metody pośrednie
1. Wzór Friedewalda
– oznaczenie stężenia cholesterolu całkowitego (ChT), triacylogliceroli (TAG), cholesterolu
frakcji HDL (Ch-HDL)-> podstawienie do wzoru:
TAG
Ch-LDL = ChT – Ch-HDL –
[mg/dL]
5
TAG
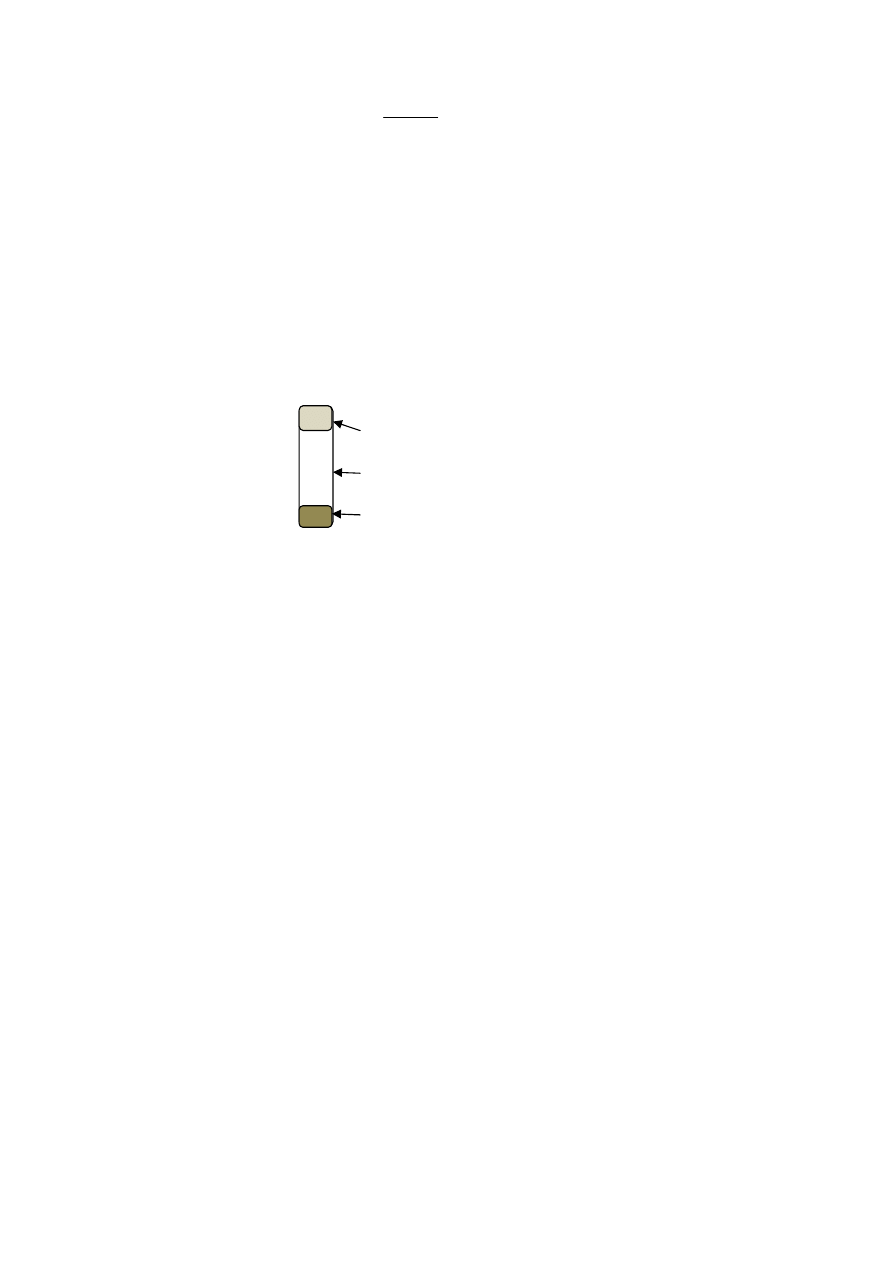
19
Ch-LDL = ChT – Ch-HDL –
[mmol/L]
2,2
Wzór Friedewalda nie powinien być stosowany, gdy:
stężenie TAG przekracza 300 mg/dL (400 mg/dL)
surowica zawiera znaczące ilości chylomikronów
- nie zostały pobrane na czczo
- u pacjentów z dysbetalipoproteinemią
2. Oznaczanie lipoprotein
ββββ
- metoda ultrawirowania z precypitacją polianionami
(metoda referencyjna)
- osocze wersenianowe (2 mL) z roztworem burowym o gęstości 1,006 g/mL (1 mL)
poddajemy wirowaniu (105 000 x g, 18 godzin, 10°C)
- uzyskujemy rozdział:
VLDL,
β
-VLDL, ChM (warstwa flotująca)
osocze
LDL, HDL (infranatant) + Lp(a), IDL
- infranatant - mieszany, rekonstytuowany do znanej objętości
- oznaczenie cholesterolu w infranatancie
- obliczenie stężenia cholesterolu frakcji LDL i VLDL:
[Ch-LDL] = [Ch frakcji o gęstości >1,006 g/mL] – [Ch-HDL]
[Ch-VLDL] = [ChT] - [Ch frakcji o gęstości >1,006 g/mL]
3. Elektroforeza lipoprotein
metoda półilościowa
pozwala uwidocznić różnice w szybkości wędrówki lipoprotein (wskazuje na
zmiany lub defekty genetyczne nie dające się ocenić innymi metodami) – np. szerokie
pasmo
ββββ
, odpowiadające flotującym b-lipoproteinom jest charakterystyczne dla
hipelipidemii typu III.
nośnik: bibuła, octan celulozy, agaroza, żel poliakrylamidowy
barwienie:
- czerwień olejowa O w 40-55% etanolu (najczęściej stosowana)
- czerń sudanowa B
- czerń amidowa
(lub) wytrącenie w żelu za pomocą polianionów
ocena densytometryczna
Metody bezpośrednie
selektywna precypitacja z:
- siarczanem poliwinylu
- heparyną w niskim pH
metody wykorzystujące mieszaninę przeciwciał poliklonalnych przeciwko apo-AI i
apo-E związanych z żywicą, które wiążą i usuwają VLDL, IDL, HDL
20
metody z homogennymi reagentami - pomiar stężenia cholesterolu LDL (metodą
enzymatyczną) po zamaskowaniu cholesterolu związanego z frakcjami innymi niż
LDL (przeciwciała poliklonalne przeciwko apo-AI i apo-E)
Zakresy wartości stężeń cholesterolu frakcji HDL i LDL
Ryzyko
choroby
wieńcowej
Cholesterol LDL
Cholesterol HDL
[mg/dL]
[mmol/L]
[mg/dL]
[mmol/L]
Kobiety
normalne
< 160
< 4,2
> 65
> 1,7
podwyższone
> 180
> 4,7
< 45
< 1,2
Mężczyźni
normalne
< 160
< 4,2
> 55
> 1,5
podwyższone
> 180
> 4,7
< 35
< 0,9
Wartości docelowe leczenia hipolipemicznego
Wynik badania
Ryzyko zawału
Docelowa wartość cholesterolu
LDL
Rozpoznana choroba
wieńcowa
Bardzo wysokie
< 100 mg/dL
Cholesterol > 300 mg/dL i
więcej niż jeden dodatkowy
czynnik ryzyka
Wysokie
< 130 mg/dL
Cholesterol 200-300 mg/dL i
jeden dodatkowy czynnik
ryzyka
Dość duże
< 155 mg/dL
Czynniki wpływające na stężenia cholesterolu frakcji LDL i HDL
LDL
HDL
Aktywność fizyczna
↓
↑
Brak aktywności fizycznej
↑
↓
21
Glikokortykoidy, androgeny,
β
-blokery, leki moczopędne
↑
↓
Estrogeny
N/↑
↑
Gestageny
↑
↓
Czynniki ryzyka choroby wieńcowej
palenie papierosów
nadciśnienie
hipercholesterolemia
niskie stężenie cholesterolu HDL
płeć męska (w okresie pomenopauzalnym ryzyko u kobiet jest takie samo jak u
mężczyzn)
cukrzyca
wczesna choroba wieńcowa u bliskich krewnych
choroba naczyń obwodowych i mózgowych u krewnych
otyłość
Układ odniesienia dla wyników laboratoryjnych
interpretacja stężeń lipidów i frakcji lipoproteinowych – ocena ryzyka zagrożenia
miażdżycą i chorobą niedokrwienna serca (wartości decyzyjne)
zalecane wartości decyzyjne: cholesterol całkowity < 200 mg/dL
Poziom
LDL
[mg/dL]
HDL
[mg/dL]
kobiety
HDL
[mg/dL]
mężczyźni
Pożądany
< 135
> 66
> 58
Graniczny
135-175
66-42
58-35
Wysokiego
ryzyka
> 175
< 42
< 35
Lipidowe czynniki ryzyka choroby wieńcowej
cholesterol całkowity / cholesterol HDL > 5
cholesterol LDL / cholesterol HDL > 4
duże stężenie TAG przy niskim stężeniu cholesterolu HDL
obecność małych gęstych LDL
Oznaczanie apolipoprotein
Metody:
radioimmunologiczne
immunoenzymatyczne
immunodyfuzja radialna (metoda referencyjna)
immunoturbidymetryczne
Zakresy wartości prawidłowych stężenia apolipoprotein

22
Apoproteina
Zakres normy [mg/dL]
Apo B100
50-130
Apo CI
110-205
Apo E
3-5
Apo CII
3-8
OZNACZANIE STĘŻENIA FOSFOLIPIDÓW
Metody chemiczne
I. 1. Ekstrakcja – odczynnikiem Bloora (etanol + eter etylowy), eterem naftowym,
izopropanolem, odczynnikiem Folcha (chloroform + metanol)
2. Hydroliza – uwolnienie fosforu i utlenienie fosforu organicznego do nieorganicznego
(HClO
4
, HNO
3
+ H
2
O
2
)
3. Reakcja barwna – reakcja fosforu nieorganicznego z molibdenianem amonu ->
fosfomolibdenian amonu -> reakcja z Zn
+2
do błękitu molibdenowego (660 nm)
II. 1. Wytrącanie fosfolipidów z białkami (TCA)
2. Utlenienie fosforu organicznego do fosforu nieorganicznego (HClO
4
)
3. Reakcja barwna
Metody enzymatyczne
lecytyna – główny fosfolipid osocza
fosfolipazy
- A
1
– uwalnia resztę acylową w pozycji
α
- A
2
– uwalnia resztę acylową w pozycji
β
- C – uwalnia resztę fosfocholiny
- D – uwalnia resztę choliny
1.
fofataza alkaliczna
fosfocholina + H
2
O cholina + P
i
kinaza choliny
cholina + ATP
fosfocholina + ADP
kinaza pirogronianowa
ADP + fosfoenolopirogronian
pirogronian + ATP
LDH
pirogronian + NADH+H
+
mleczan + NAD
+
2.
oksydaza choliny
cholina + 2O
2
+ H
2
O
betaina + H
2
O
2
H
2
O
2
+ fenol + 4-aminoantypiryna barwnik chinoiminowy + 2H
2
O

23
Pomiar: 500-550 nm (metoda z odczynnikiem Trindera, PAP)
Znaczenie kliniczne oznaczania fosfolipidów
zakres wartości prawidłowych w osoczu
- fosfor fosfolipidów 6-11 mg/dL
- stężenie fosfolipidów 150-300 mg/dL
- stosunek cholesterol/fosfolipidy ≈ 0,98 (wzrasta z wiekiem do ok. 1,4)
zwiększone stężenie fosfolipidów
- miażdżyca naczyń
- niewydolność wątroby
- cukrzyca
oznaczanie lecytyny w płynie owodniowym – ocena dojrzałości układu
oddechowego płodu
- stężenie > 5,1 mg/dL – prawidłowe dojrzewanie
- stężenie 4,7-5,1 mg/dL – zaburzenia dojrzewania
OZNACZANIE WOLNYCH KWASÓW TŁUSZCZOWYCH (WKT)
ocena poheparynowej aktywności lipolitycznej osocza (aktywność LPL)
znaczenie w hiperlipoproteinemii typu I i V
metoda miareczkowa
- ekstrakcja izopropanolem i heptanem
- miareczkowanie mianowanym roztworem NaOH wobec
wskaźnika (błękit tymolowy)
prawidłowe stężenie WKT w surowicy: 0,2-0,8 mmol/L
zwiększone stężenie WKT: cukrzyca, głodzenie, adrenalina, hormon wzrostu
Wyszukiwarka
Podobne podstrony:
lipidy 3 id 269476 Nieznany
lipidy izoprenowe id 269491 Nieznany
7 wyklad Lipidy 2011 id 45476 Nieznany (2)
5 Lipidy i pokrewne id 40241 Nieznany (2)
lipidy izoprenowe id 269491 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
więcej podobnych podstron