
dr inż. Aneta Białkowska
ANALIZA SKŁADU AMINOKWASOWEGO
Skład aminokwasowy białka wyznacza się zwykle po jego hydrolizie
kwasowej, np. w 6M HCl w temperaturze 105-110°C przez 24 godz. W
tych warunkach tryptofan ulega prawie całkowitemu rozłożeniu, a
częściowemu cystyna, cysteina i metionina.
W celu uwolnienia tryptofanu z łańcucha polipeptydowego
praktycznie bez strat stosuje się hydrolizę zasadową roztworem Ba(OH)
2
,
gotując hydrolizat przez 24 godziny.
W celu oznaczenia w białku cystyny, cysteiny i metioniny bez
strat, przed kwaśną hydrolizą poddaje się białko reakcji utleniania za
pomocą kwasu nadmrówkowego, w wyniku której z cystyny i cysteiny
powstaje kwas cysteinowy, a z metioniny sulfon metioniny, produkty te są
odporne na długotrwałe gotowanie z kwasem solnym.
Walina i izoleucyna uwalniają się dość trudno z białka i dlatego oznacza
się je dopiero po 96 godz. hydrolizy.
METODA CHEMICZNA
METODA ENZYMATYCZNA
Subtylizyna i pronaza (proteaza ze Streptomyces griseus) hydrolizują białka
całkowicie, ale reakcja enzymatyczna biegnie bardzo wolno
.
dr inż. Aneta Białkowska
ANALIZA SKŁADU AMINOKWASOWEGO
Rozdział i ilościowe oznaczanie aminokwasów w
hydrolizatach kwasowych
Chromatografia jonowymienna
na sulfonowanych żywicach
polistyrenowych
RP-HPLC (derywatyzacja przed
kolumną)
Reakcja z ninhydryną
Detekcja promieniowania w
zakresie światła widzialnego
Reakcja np. z N-(4-chinolilo)
karbaminianem N-sukcynoimidu
– przekształcenie aminokwasów
w pochodne fluorescencyjne
Detekcja promieniowania
fluorescencyjnego
Metoda Moore’a i Steina

dr inż. Aneta Białkowska
ANALIZA SKŁADU AMINOKWASOWEGO
ANALIZA SKŁADU AMINOKWASOWEGO POZWALA OKREŚLIĆ, W
JAKICH STOSUNKACH MOLOWYCH WYSTĘPUJĄ
POSZCZEGÓLNE AMINOKWASY W POLIPEPTYDZIE, ALE NIE
DOSTARCZA INFORMACJI O ICH KOLEJNOŚCI.
dr inż. Aneta Białkowska
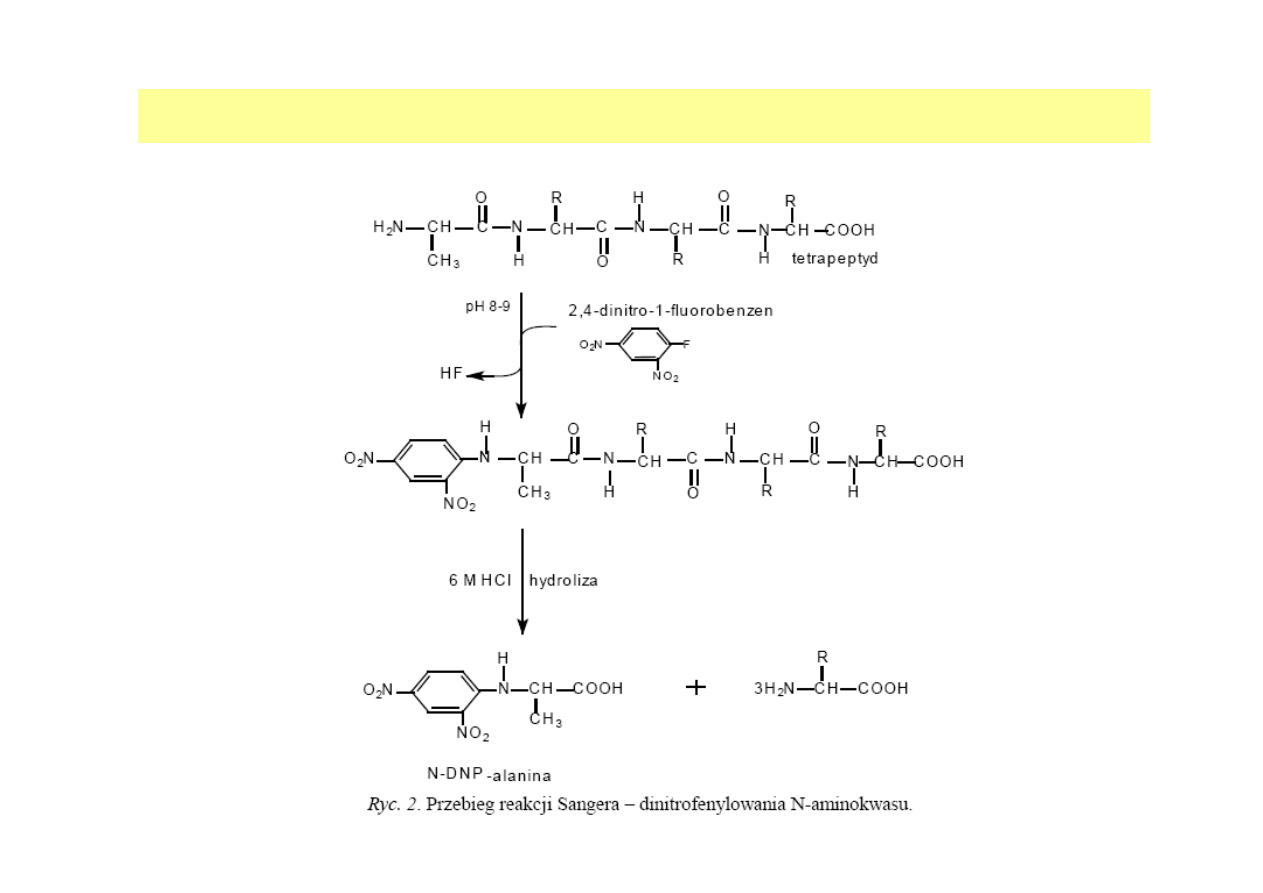
IDENTYFIKACJA N-TERMINALNEGO AMINOKWASU
dr inż. Aneta Białkowska
IDENTYFIKACJA N-TERMINALNEGO AMINOKWASU
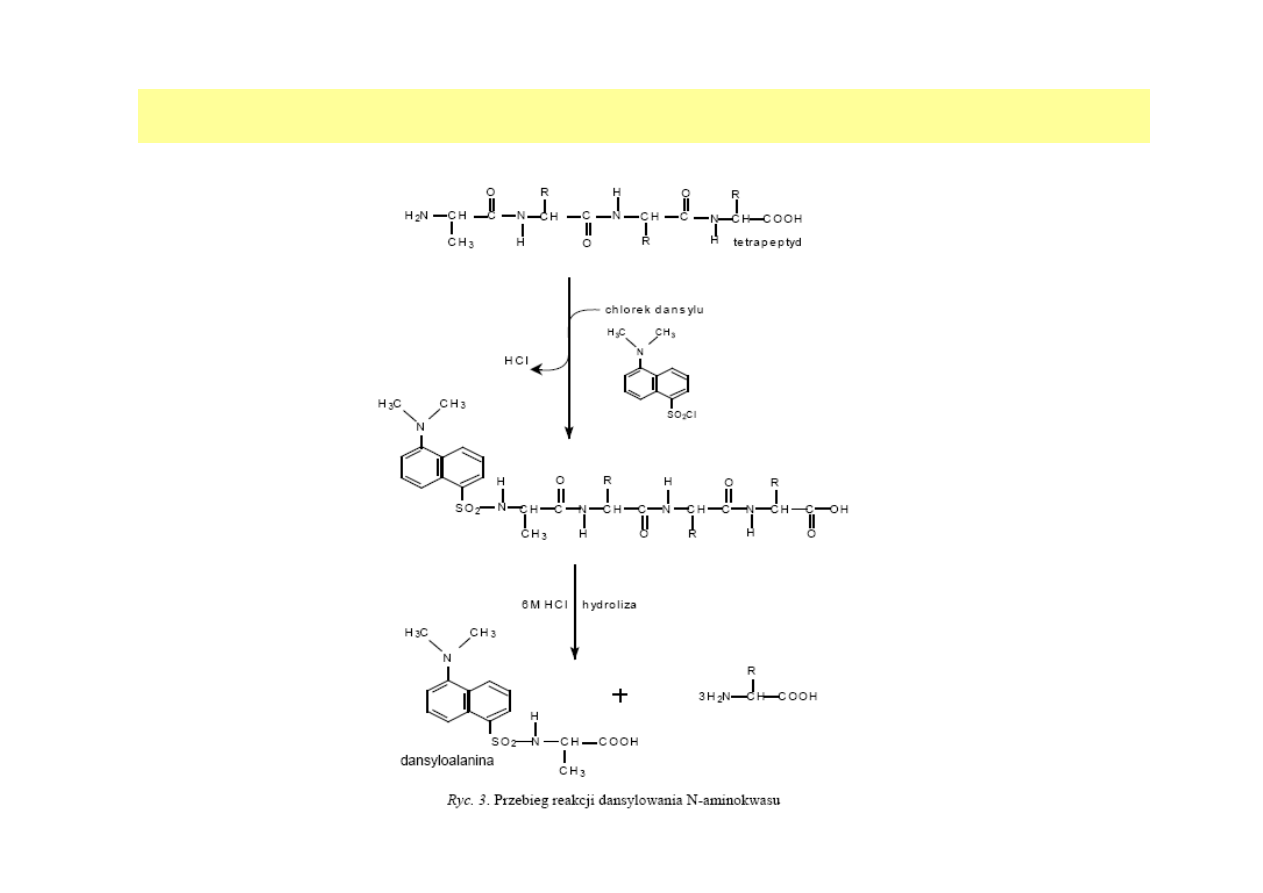
dr inż. Aneta Białkowska
IDENTYFIKACJA N-TERMINALNEGO AMINOKWASU

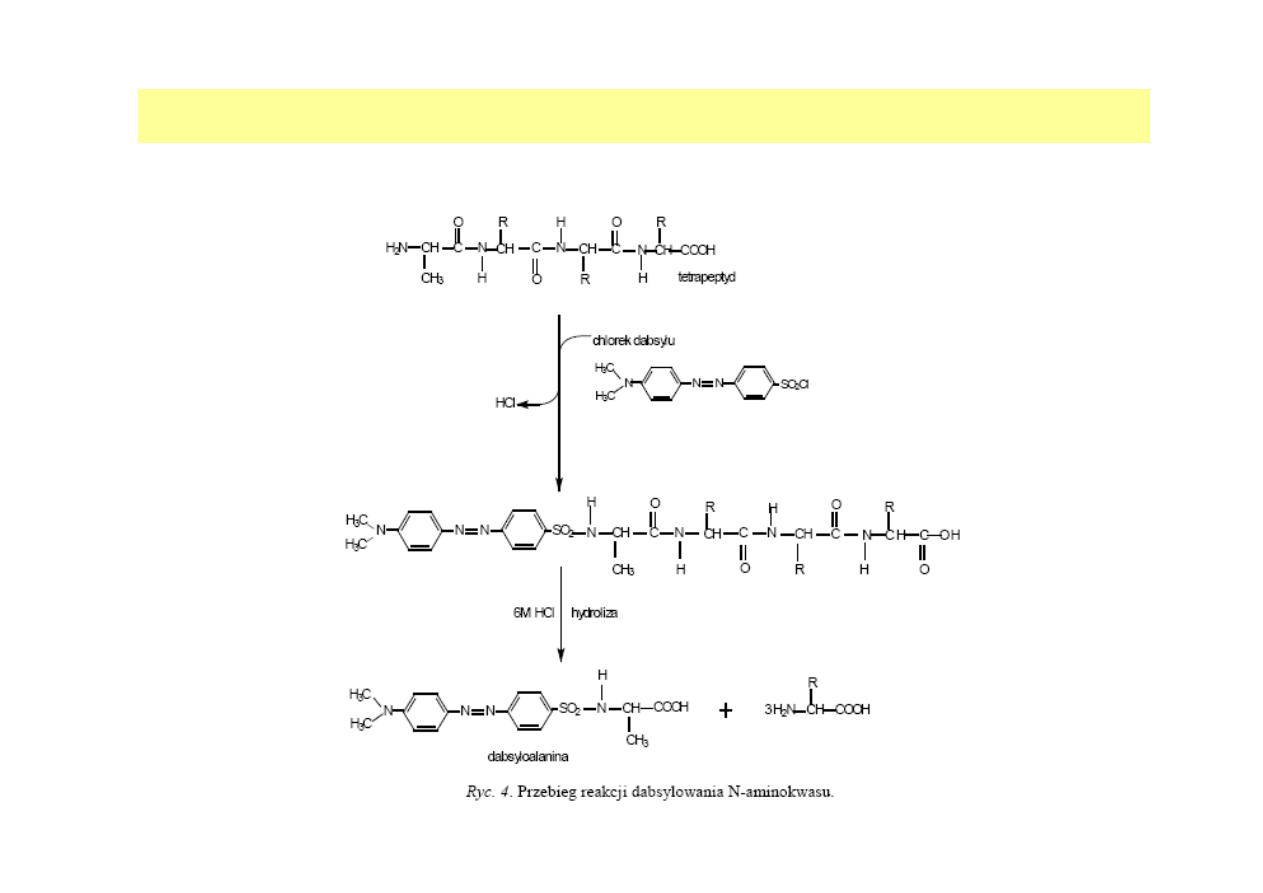
dr inż. Aneta Białkowska
IDENTYFIKACJA N-TERMINALNEGO AMINOKWASU
MIMO DUśEJ CZUŁOŚCI WIĘKSZOŚCI OMÓWIONYCH
METOD OZNACZANIA AMINOKWASÓW N-KOŃCOWYCH, NIE
MOśNA ICH STOSOWAĆ WIELOKROTNIE DO ANALIZY TEJ
SAMEJ PRÓBY POLIPETYDU, PONIEWAś PODCZAS
HYDROLIZY KWASOWEJ POLIPEPTYD ULEGA CAŁKOWITEJ
DEGRADACJI DO WOLNYCH AMINOKWASÓW.
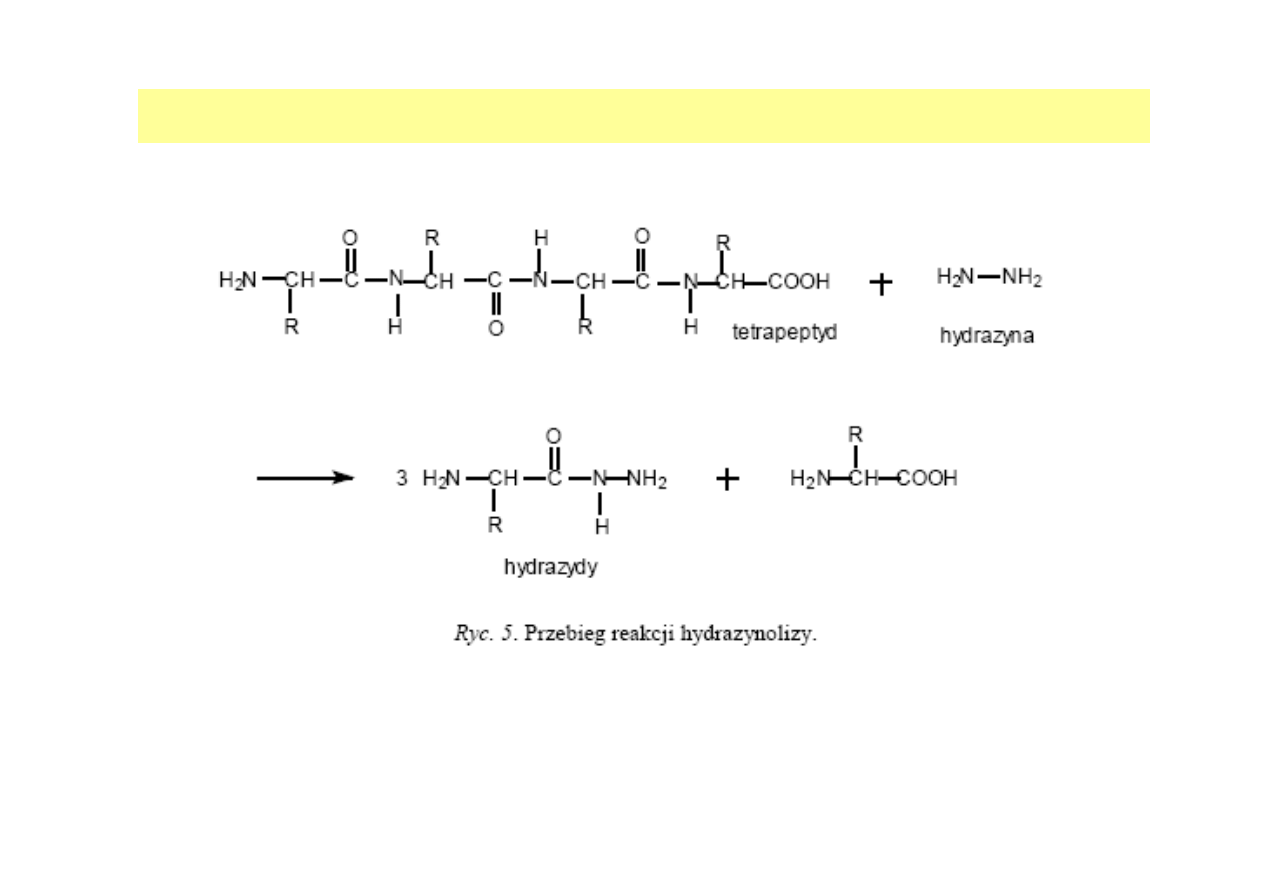
IDENTYFIKACJA C-TERMINALNEGO AMINOKWASU
dr inż. Aneta Białkowska
dr inż. Aneta Białkowska
SPECYFICZNE EGZOPEPTYDAZY
KARBOKSYPEPTYDAZY
(odszczepiają
po jednej reszcie aminokwasowej od C-
końca począwszy)
AMINOPEPTYDAZY
(odszczepiają
po jednej reszcie aminokwasowej od N-
końca począwszy)
Karboksypeptydaza A charakteryzuje
się
szeroką
specyficznością,
z
C-końca
polipeptydu najszybciej uwalnia Tyr, Phe,
Trp, Leu, Ile, Met, Thr, Gln, His, Ala, Val, nie
uwalnia Pro, ani Arg, natomiast pozostałe
aminokwasy odłącza wolno lub bardzo wolno.
Karboksypeptydaza B
odłącza od C-końca polipeptydu
tylko aminokwasy zasadowe.
IDENTYFIKACJA C- LUB N-TERMINALNEGO
AMINOKWASU (
HYDROLIZA ENZYMATYCZNA POLIPEPTYDU
)
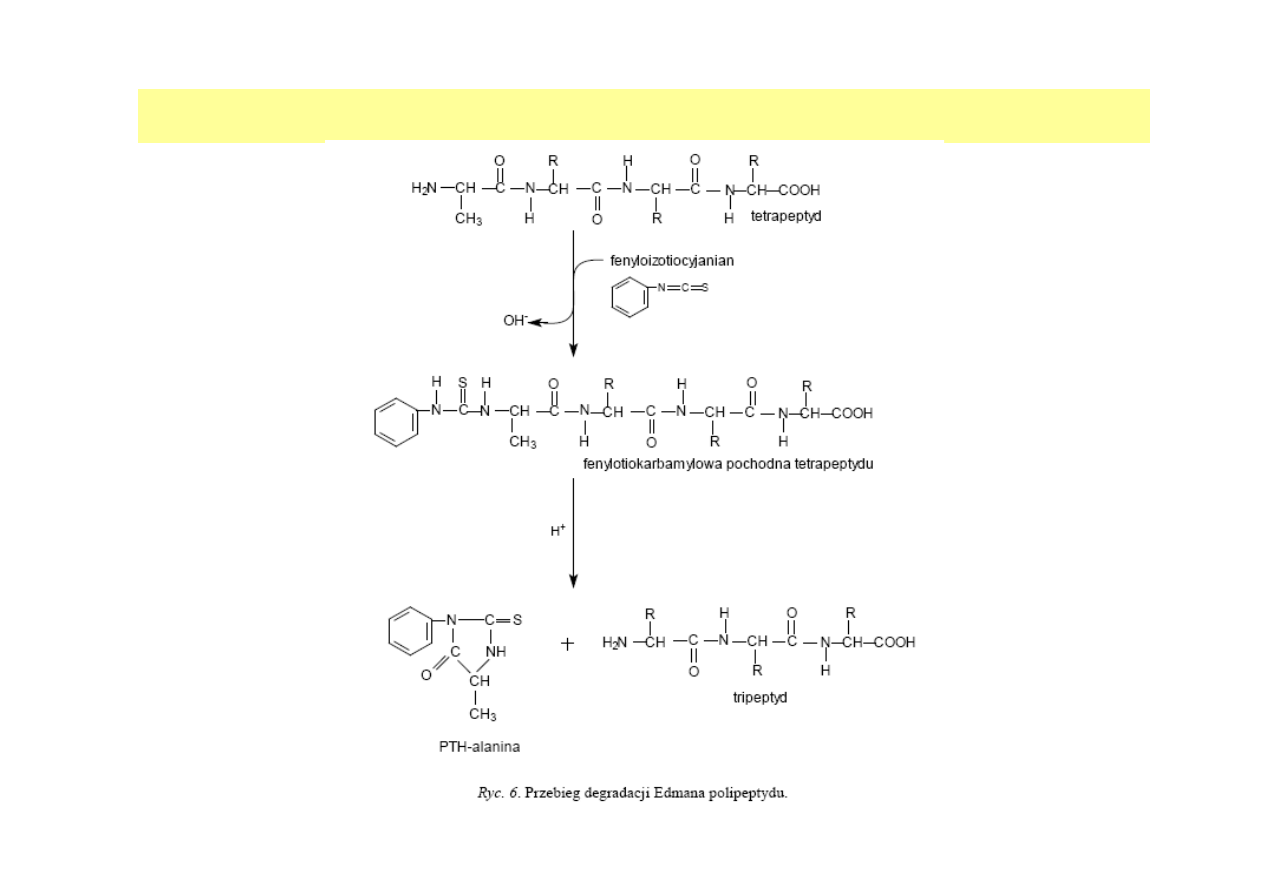
dr inż. Aneta Białkowska
SEKWENCJONOWANIE BIAŁKA ENZYMATYCZNEGO

dr inż. Aneta Białkowska
SEKWENCJONOWANIE BIAŁKA ENZYMATYCZNEGO
W CELU USTALENIA SEKWENCJI DŁUGIEGO POLIPEPTYDU NALEśY
GO NAJPIERW ROZCIĄĆ NA MNIEJSZE FRAGMENTY SKŁADAJĄCE
SIĘ Z 20-50 RESZT, KTÓRE PO ROZDZIELENIU PODDAJE SIĘ
SEKWENCJONOWANIU.
SPECYFICZNE POCIĘCIE POLIPEPTYDU MOśNA OSIAGNĄĆ
METODAMI CHEMICZNYMI LUB ENZYMATYCZNYMI
.
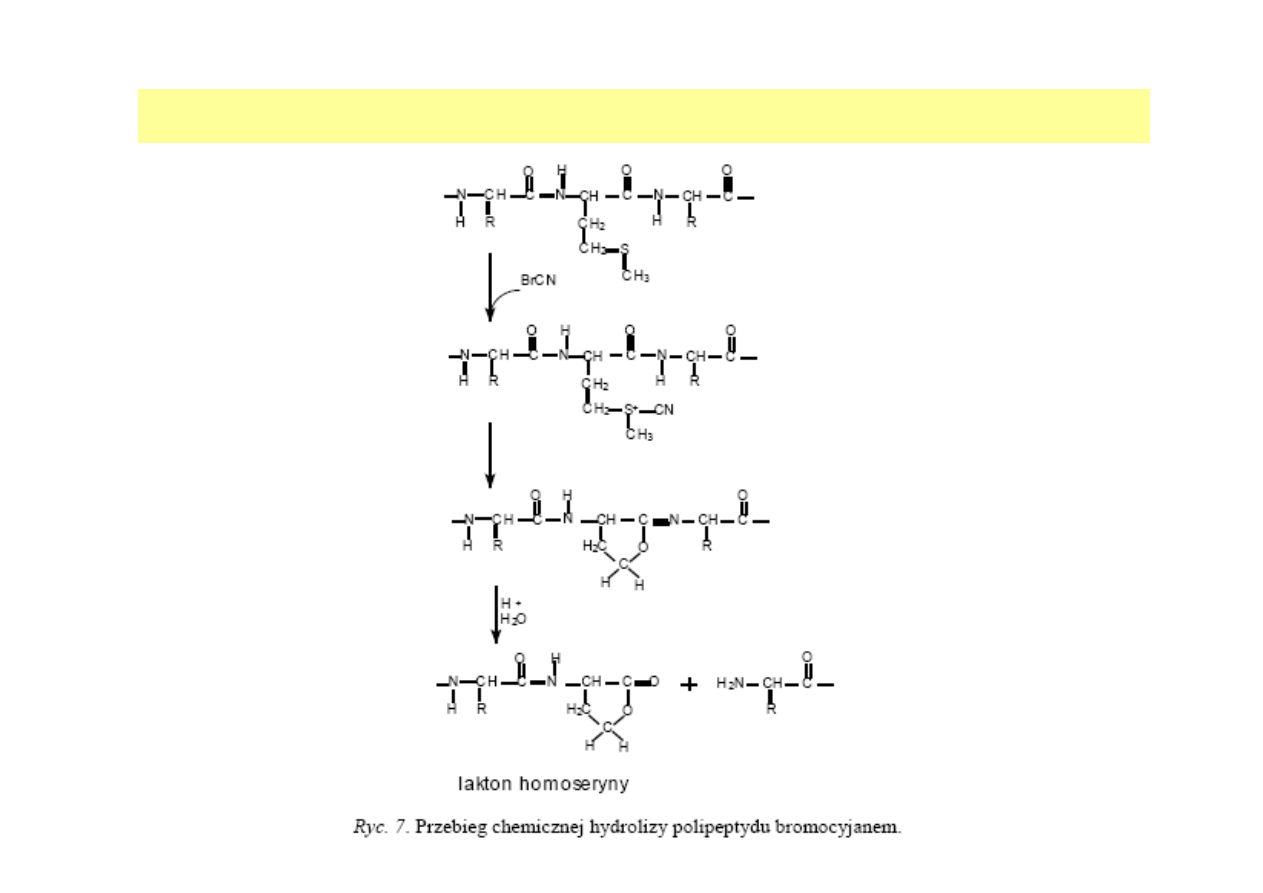
dr inż. Aneta Białkowska
CHEMICZNA HYDROLIZA POLIPEPTYDÓW
dr inż. Aneta Białkowska
ENZYMATYCZNA HYDROLIZA POLIPEPTYDÓW
ENDOPROTEINAZY
TRYPSYNA
(hydrolizuje białka po C-terminalnej stronie
reszt lizynowych i argininowych – a więc
aminokwasów zasadowych – zostawiając te
reszty na końcach C peptydów powstających
w wyniku jej działania)
CHYMOTRYPSYNA
(hydrolizuje białka po C-terminalnej stronie
reszt aminokwasów aromatycznych (Phe,
Tyr, Trp)
PROTEINAZA V
8
(Staphylococcus aureus)
(hydrolizuje białka po C-terminalnej stronie
reszt kwasu glutaminowego)
PROTEINAZA izolowana z opieńki
miodowej (Armillaria mellea)
(hydrolizuje białka po N-terminalnej stronie
reszt lizyny)

dr inż. Aneta Białkowska
SEKWENCJONOWANIE BIAŁKA ENZYMATYCZNEGO
METODA NAKŁADAJĄCYCH SIĘ FRAGMENTÓW PEPTYDÓW

dr inż. Aneta Białkowska
SEKWENCJONOWANIE BIAŁKA ENZYMATYCZNEGO-
SPEKTROMETRIA MAS

dr inż. Aneta Białkowska
SEKWENCJONOWANIE BIAŁKA ENZYMATYCZNEGO -
BADANIA PROTEOMICZNE
PROTEOMIKA – ZAJMUJE SIĘ BADANIEM RZECZYWISTEJ
EKSPRESJI INFORMACJI GENETYCZNEJ, A WIĘC SKUPIA SIĘ NA
BADANIU, KTÓRE BIAŁKA SĄ TAK NAPRAWDĘ PRODUKOWANE
PRZEZ DANY ORGANIZM BĄDŹ KOMÓRKI OKREŚLONEGO TYPU.
ETAPY W BADANIACH PROTEOMICZNYCH:
1. elektroforeza dwuwymiarowa
2. spektrometria mas

dr inż. Aneta Białkowska
ELEKTROFOREZA DWUKIERUNKOWA
1. ELEKTROFOREZA W PIERWSZYM WYMIARZE
Prowadzona jest z użyciem gradientu pH. Każde białko migruje do
takiego miejsca na żelu, w którym przestaje być obdarzone ładunkiem
(czyli do swojego punktu izoelektrycznego) i tam się zatrzymuje.
Technikę tę nazywamy
ogniskowaniem izoelektrycznym
.
2. ELEKTROFOREZA W DRUGIM WYMIARZE
Prowadzona jest w obecności dodecylosiarczanu sodu, zróżnicowanie
migracji białek opiera się w tym wypadku na różnicach w ich masach
cząsteczkowych.
Metodą elektroforezy dwuwymiarowej można rozdzielić ponad 1000
białek. Jest to przy tym metoda bardzo czuła: pozwala na wykrywanie
białek na poziomie fentomolowym (10
-15
mola).
SEKWENCJONOWANIE BIAŁKA ENZYMATYCZNEGO -
BADANIA PROTEOMICZNE
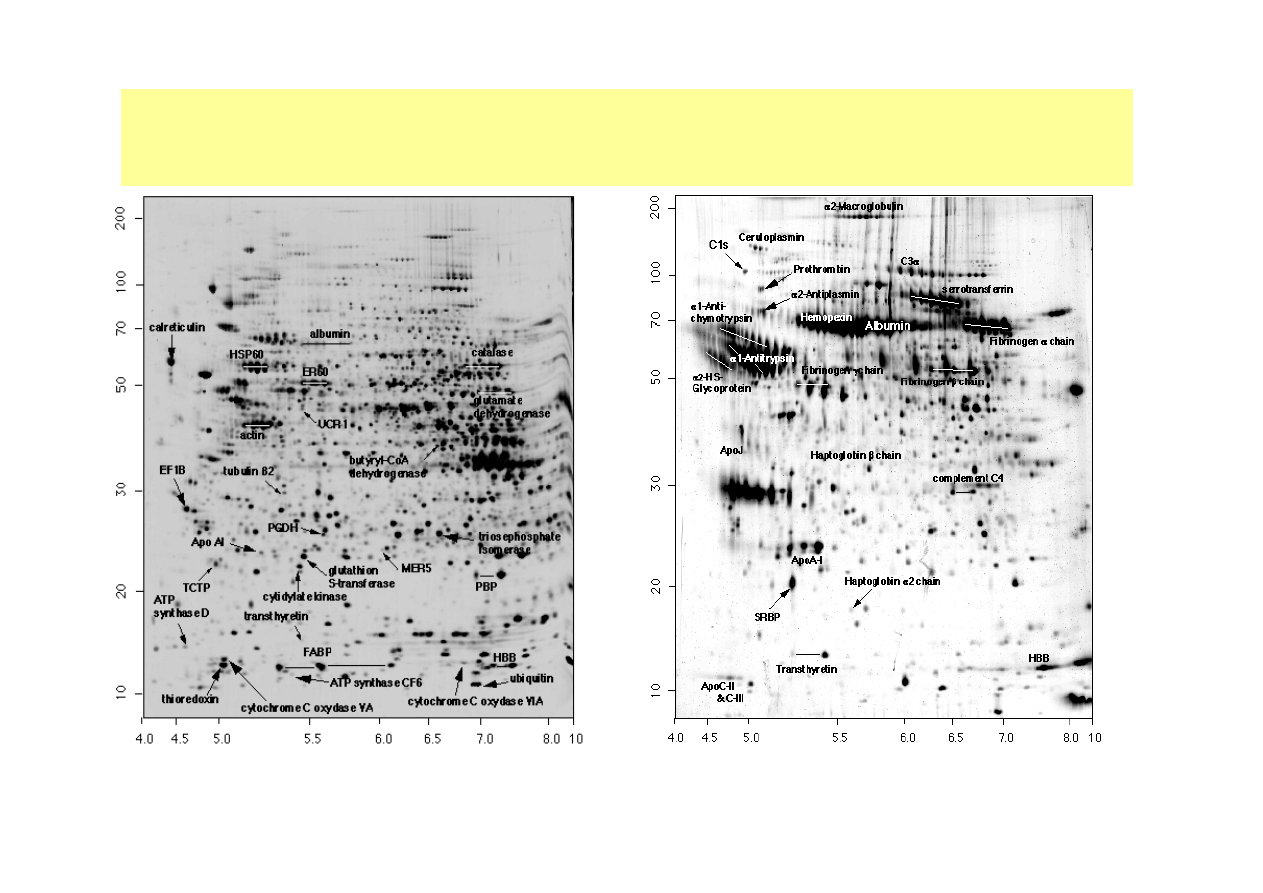
dr inż. Aneta Białkowska
Obraz po dwuwymiarowej elektroforezie białek ekstraktów komórkowych. Ogniskowanie
izoelektryczne przeprowadzono w poziomie, a elekktroforezę w obecności SDS – w pionie. Zdjęcia
zaczerpnięte z bazy danych SWISS-2DPAGE.
SEKWENCJONOWANIE BIAŁKA ENZYMATYCZNEGO -
BADANIA PROTEOMICZNE

dr inż. Aneta Białkowska
Obraz po dwuwymiarowej elektroforezie białek ekstraktów komórkowych. Ogniskowanie
izoelektryczne przeprowadzono w poziomie, a elekktroforezę w obecności SDS – w pionie. Zdjęcia
zaczerpnięte z bazy danych SWISS-2DPAGE.
SEKWENCJONOWANIE BIAŁKA ENZYMATYCZNEGO -
BADANIA PROTEOMICZNE
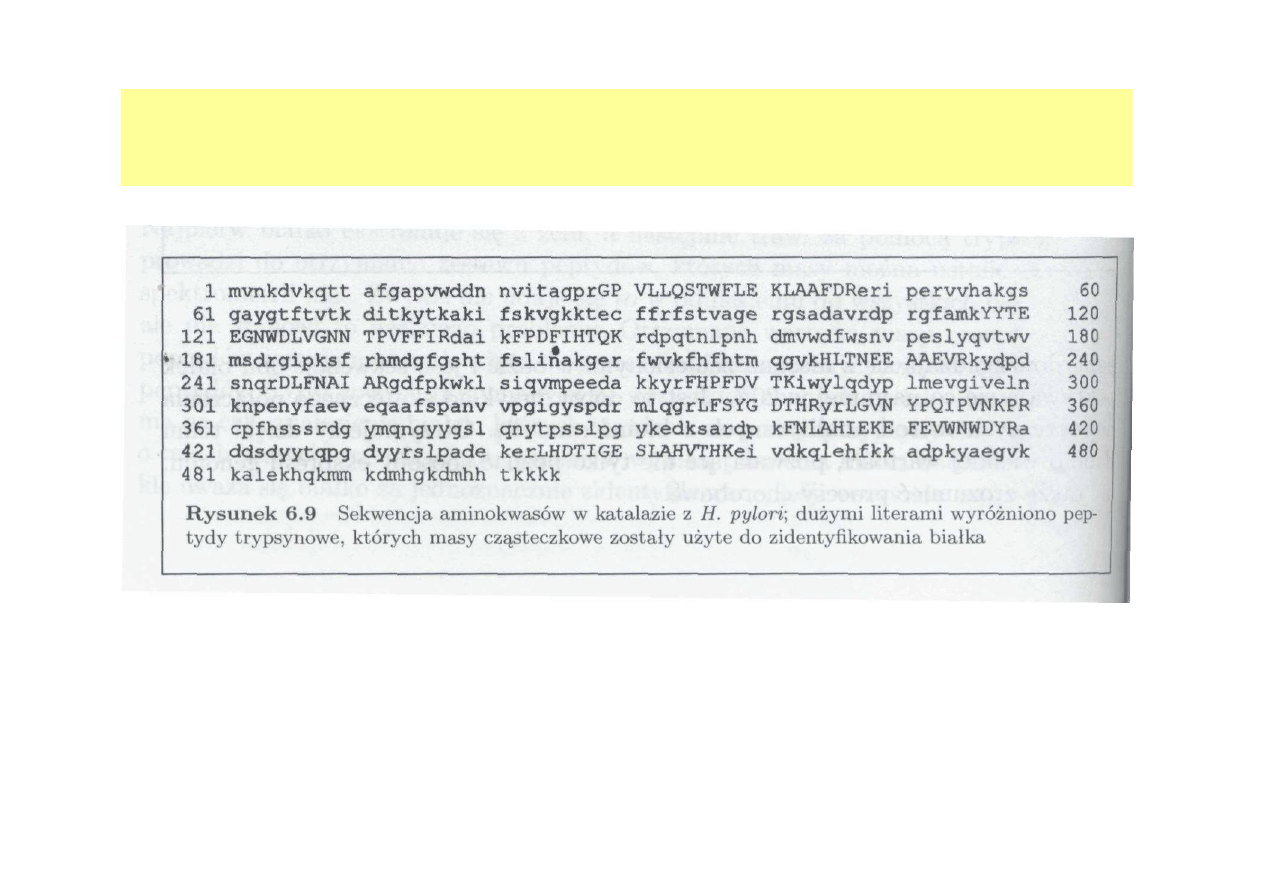
dr inż. Aneta Białkowska
SEKWENCJONOWANIE BIAŁKA ENZYMATYCZNEGO -
BADANIA PROTEOMICZNE

dr inż. Aneta Białkowska
OKREŚLENIE TRÓJWYMIAROWEJ STRUKTURY
(KONFORMACJI) BIAŁKA ENZYMATYCZNEGO
1. Rentgenografia strukturalna
Opiera się na rejestracji obrazów dyfrakcyjnych promieni
rentgenowskich, powstających na skutek subtelnych interakcji tego
promieniowania z chmurami elektronowymi atomów, tworzących
analizowany kryształ. Na podstawie rejestracji obrazów
dyfrakcyjnych promieniowania X przechodzącego przez kryształ pod
różnymi kątami wyznacza się trójwymiarową mapę gęstości
elektronowej w komórce elementarnej kryształu.
2. Modelowanie molekularne
Opiera się na domniemaniu, że dwa białka wykazujące homologię co
do sekwencji aminokwasowej mają podobną strukturę przestrzenną.
Usługa służąca do przewidywania struktury o nazwie SWISS-MODEL
jest dostępna na stronie ExPASy
(http://www.expasy.org/swissmod/SWISS-MODEL.html).
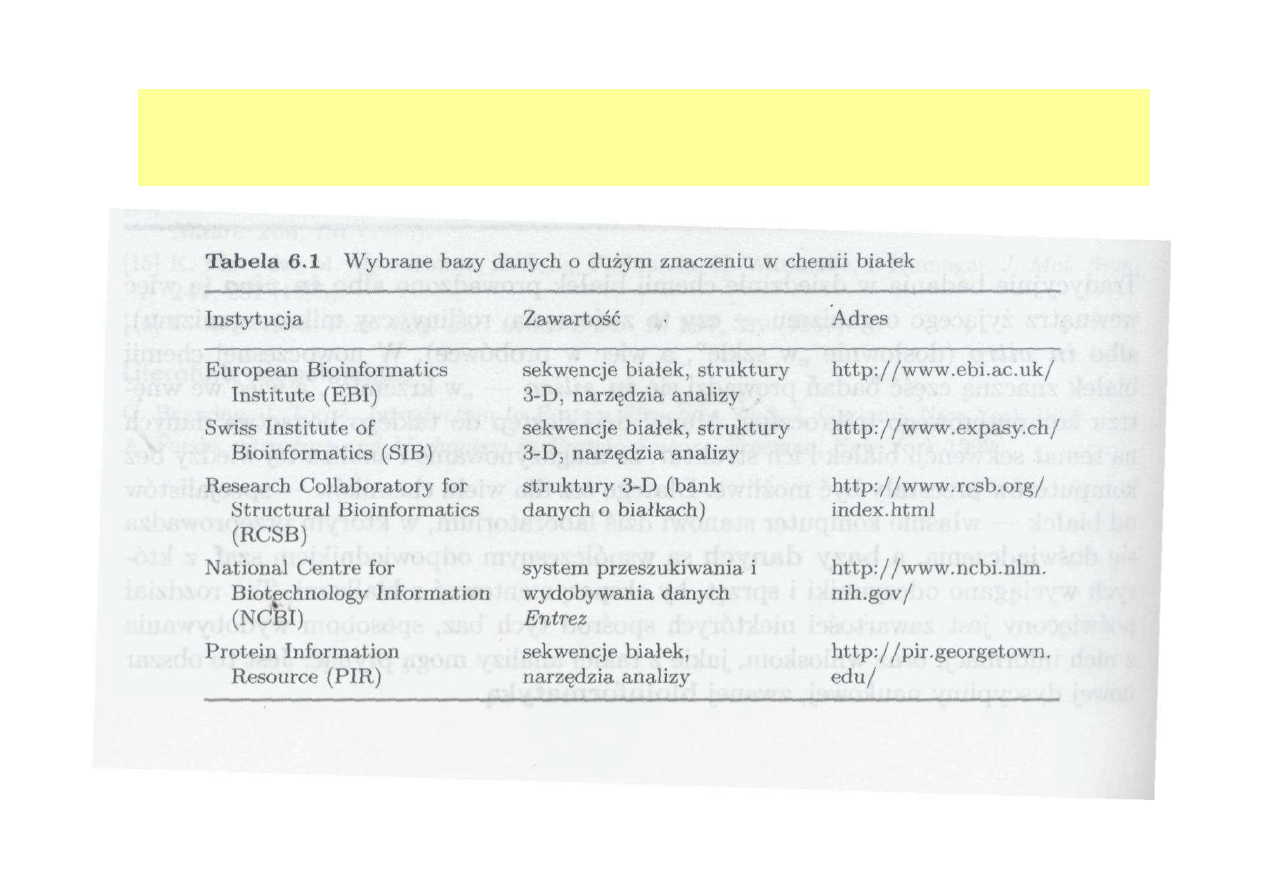
dr inż. Aneta Białkowska
OKREŚLENIE TRÓJWYMIAROWEJ STRUKTURY
(KONFORMACJI) BIAŁKA ENZYMATYCZNEGO
Wyszukiwarka
Podobne podstrony:
Microsoft PowerPoint Enzymologia cz V
Microsoft PowerPoint Enzymologia cz VI Ekstremozymy
Microsoft PowerPoint Enzymologia cz I
Microsoft PowerPoint Cz II CFD
Nowy Prezentacja programu Microsoft PowerPoint 5
Rola rynku i instytucji finansowych INowy Prezentacja programu Microsoft PowerPoint
ZADANIA PiP Prezentacja Microsoft PowerPoint
Nowy Prezentacja programu Microsoft PowerPoint ppt
MATERIALY DO WYKLADU CZ IV id Nieznany
Microsoft PowerPoint IP5 klasyfikacje tryb zgodnosci
Microsoft PowerPoint IP tryb zgodnosci
Microsoft PowerPoint 02 srodowisko bazy danych, modele
(Microsoft PowerPoint 2 KONWENCJA WIEDENSKAid 1358 (2)
Microsoft PowerPoint IP5 bazydanych tryb zgodnosci
więcej podobnych podstron