Analiza spektralna fluorowcopochodnych węglowodorów.
1. Spektroskopia w podczerwieni (IR)
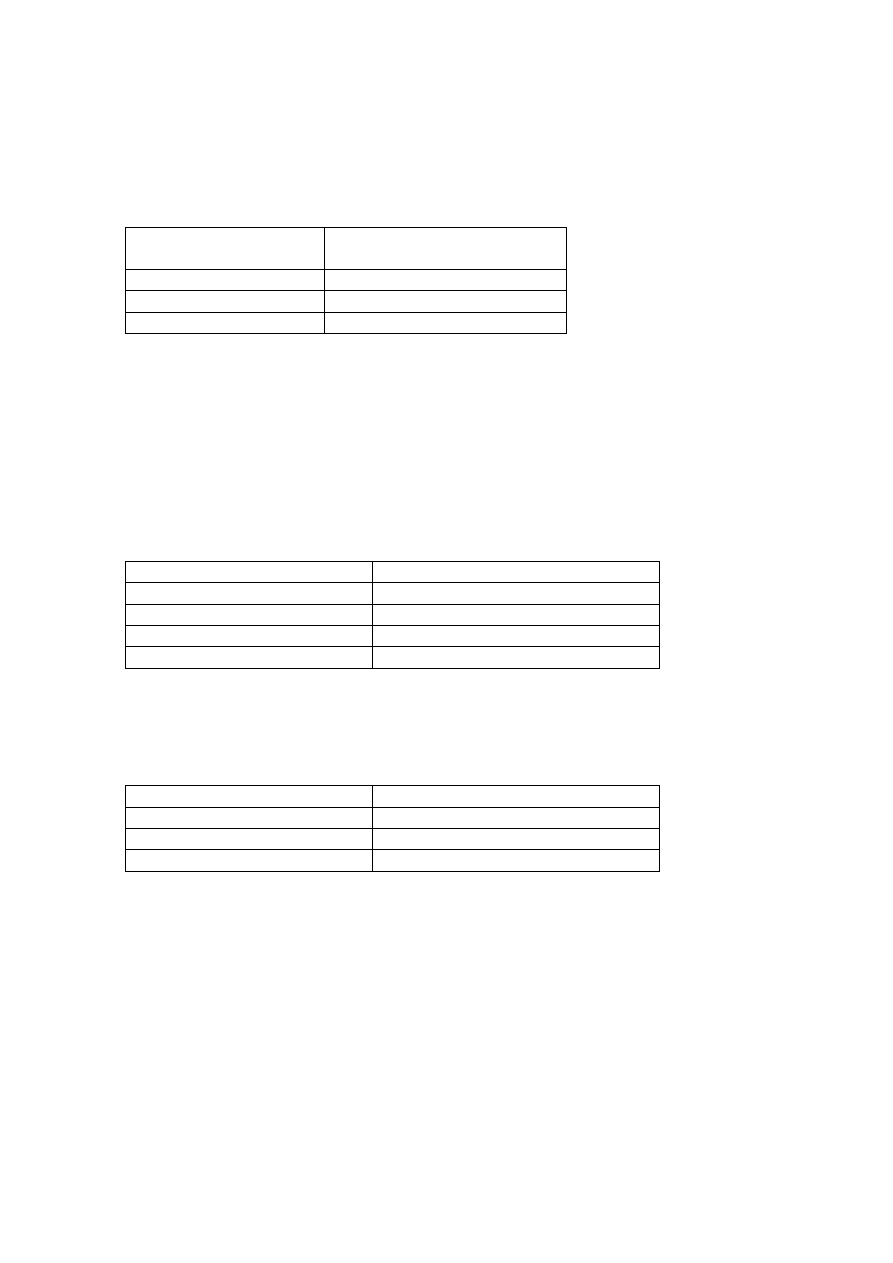
Charakterystyczne pasma absorpcyjne w IR:
Charakterystyczne
pasma absorpcji (cm
-1
)
Rodzaj drgań
750-700
C–Cl
650-510
C–Br
600-485
C–I
2. Spektroskopia magnetycznego rezonansu jądrowego
a)
1
H-NMR
Ze względu na dużą elektroujemność halogenków, sygnały protonów połączonych z tym
samym węglem co fluorowcopochodna są przesunięte w kierunku wyższych wartości ppm (a
mniejszego natężenia pola magnetycznego).
Charakterystyczne wartości położenia sygnałów:
Przesunięcie chemiczne (ppm)
Protony
2,0-4,0
–CH–I
2,7-4,1
–CH–Br
3,1-4,1
–CH–Cl
4,2-4,8
–CH–F
b)
13
C-NMR
Charakterystyczne wartości położenia sygnałów:
Przesunięcie chemiczne (ppm)
Węgiel
35-80
sp
3
C–Cl
25-65
sp
3
C–Br
0-40
sp
3
C–I
4. Spektrometria masowa (MS)
Analizując widmo masowe fluorowcopochodnych węglowodorów należy pamiętać, że w
przyrodzie występują izotopy chloru o liczbach masowych 35 i 37 (
35
Cl i
37
Cl) i izotopy
bromu o liczbach masowych 79 i 81 (
79
Br i
81
Br) (jod i fluor nie mają cięższych izotopów). W
związku z tym w widmie masowym chlorowych lub bromowych pochodnych węglowodorów
istotne znaczenie ma pik [M
+
+2]. Względna intensywność pików izotopowych koresponduje
z naturalną zawartością poszczególnych izotopów w przyrodzie. Zawartość izotopu chloru
37
Cl wynosi około 32,5% zawartości izotopu
35
Cl, a zawartości obu izotopów bromu są
prawie równe (występuje niewielka przewaga
79
Br).
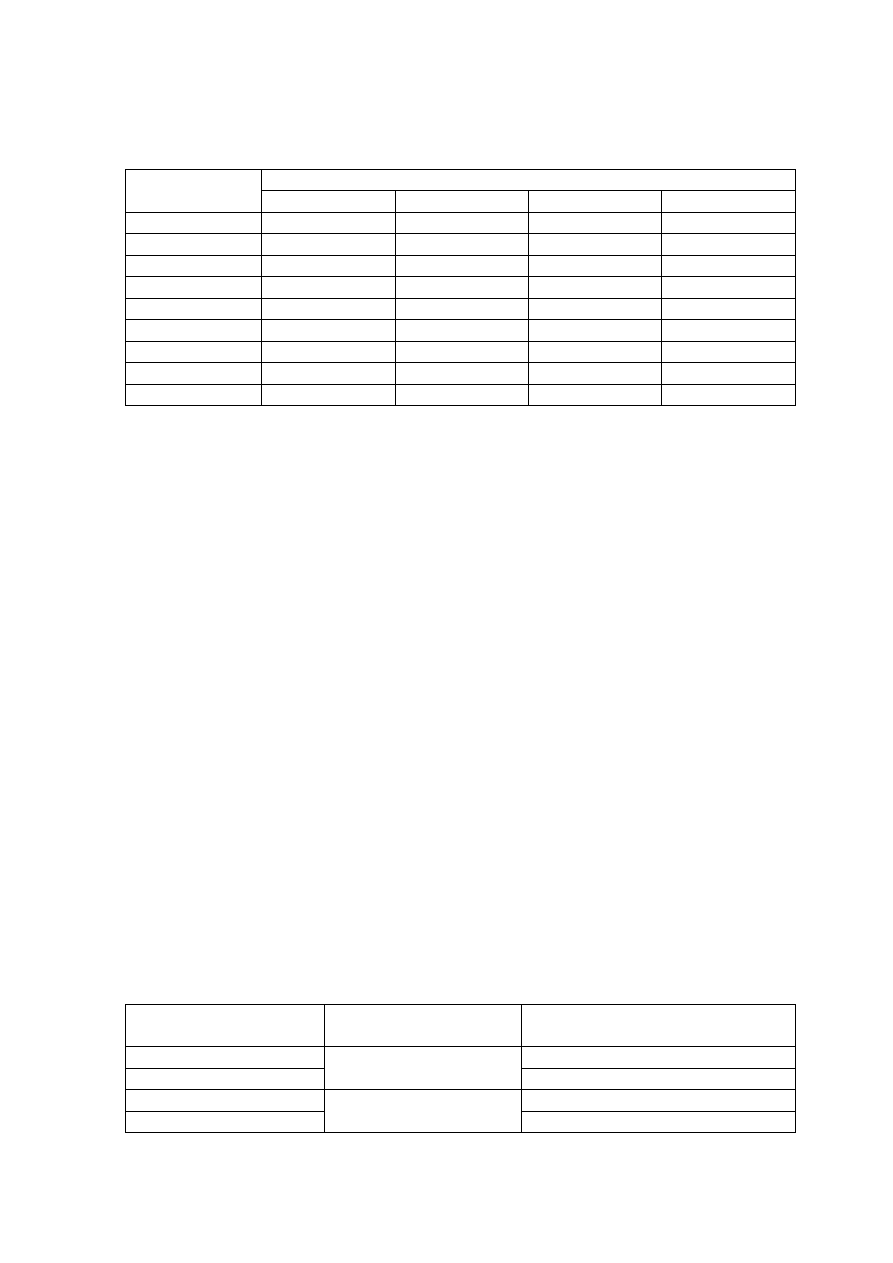
Wynikająca z tego względna intensywność pików związków zawierających chlor i/lub brom
w zależności od liczby ich atomów w cząsteczce została przedstawiona w poniższej tabeli.
Chlorowiec
Względna intensywność pików
M
+
M
+
+2
M
+
+4
M
+
+6
Cl
100
32,6
-
-
Cl
2
100
65,3
10,6
-
Cl
3
100
97,8
31,9
3,47
Br
100
97,7
-
-
Br
2
100
195,0
95,4
-
Br
3
100
293,0
286,0
93,4
BrCl
100
130,0
31,9
-
Br
2
Cl
100
228,0
159,0
31,2
BrCl
2
100
163,0
74,4
10,4
Znając te zależności można wnioskować o obecności chloru i/lub bromu w cząsteczce
związku jak i o liczbie poszczególnych atomów.
Oprócz jonu macierzystego i jego pików izotopowych w widmach chlorowcopochodnych
obserwuje się też inne piki, przy czym najbardziej prawdopodobne drogi fragmentacji to:
a) odszczepienie fluorowca (możliwość odszczepienia wzrasta ze wzrostem masy
fluorowca);
b) oderwanie HX przez eliminację 1,2 – daje to słabe lub umiarkowane pasmo
fluorowcowodoru;
c) rozpad prostołańcuchowej fluorowcopochodnej w miejscu wiązania C–C przy atomie
fluorowca, co skutkuje powstaniem piku [CH
2
X]
+
np. [CH
2
Cl]
+
m/e=49 i piku
izotopowego m/e=51.
Analiza spektralna związków nitrowych
1. Spektroskopia w nadfiolecie (UV)
Alifatyczne związki nitrowe dają słabe pasmo absorpcji w okolicy 270 nm odpowiadające
przejściu n→π*. Aromatyczne związki nitrowe wykazują absorpcję przy 270-280 nm i
słabszą przy 330 nm.
2. Spektroskopia w podczerwieni (IR)
Charakterystyczne pasma absorpcyjne w IR:
Charakterystyczne
pasma absorpcji (cm
-1
)
Grupa związków
Rodzaj drgań
1650-1500
alifatyczne związki
nitrowe
N–O rozciągające asymetryczne
1390-1250
N–O rozciągające symetryczne
1550-1490
aromatyczne związki
nitrowe
N–O rozciągające asymetryczne
1355-1315
N–O rozciągające symetryczne
3. Spektroskopia magnetycznego rezonansu jądrowego
a)
1
H-NMR
Związki nitrowe charakteryzuje przesunięcie sygnału wodorów połączonych z tym samym
węglem co grupa nitrowa (CH–NO
2
), wynoszące 4,1-4,3 ppm. Grupa nitrowa połączona z
pierścieniem aromatycznym powoduje przesunięcie sygnałów wodorów pierścienia w
kierunku niższych wartości natężenia pola magnetycznego.
b)
13
C-NMR
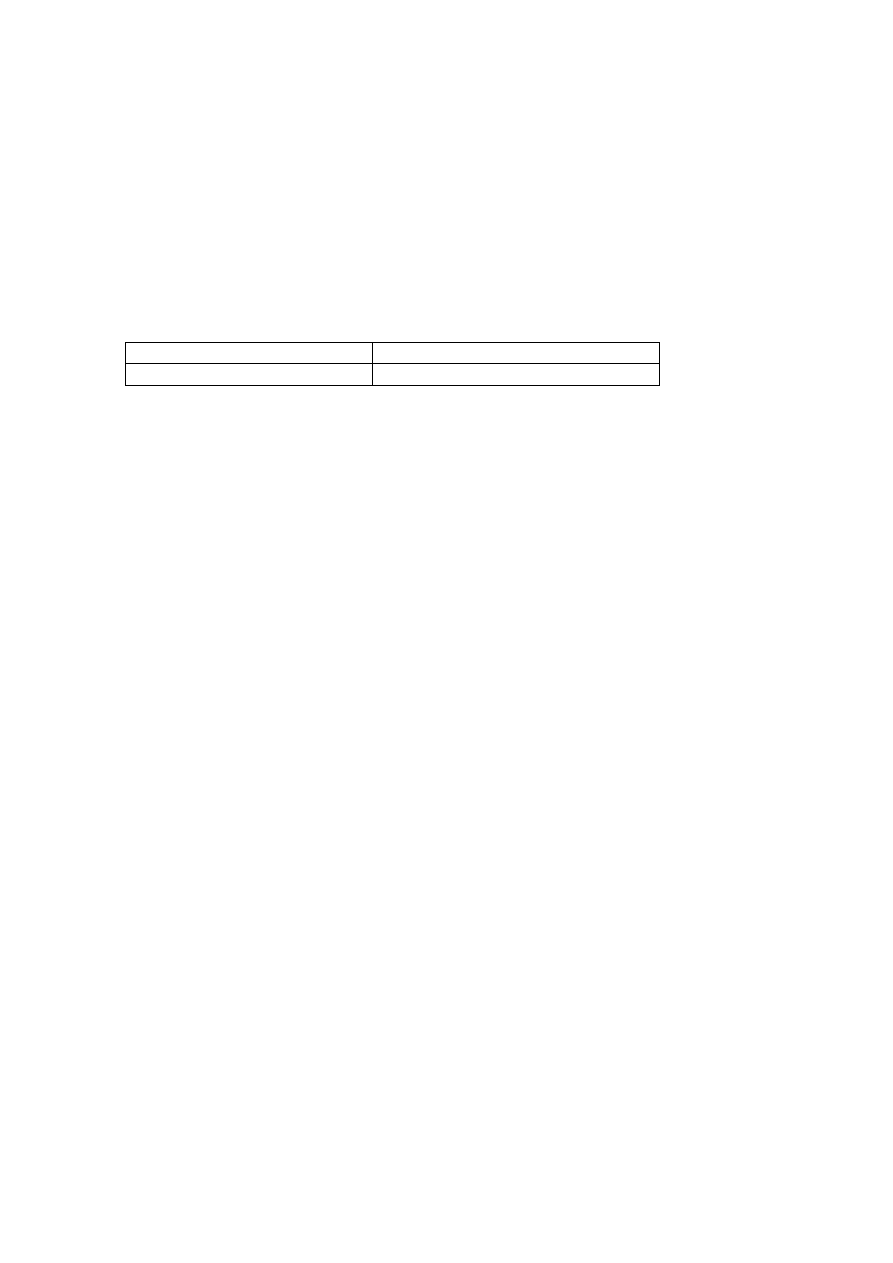
Charakterystyczne wartości położenia sygnałów:
Przesunięcie chemiczne (ppm)
Węgiel
30-65
C–N
4. Spektrometria masowa (MS)
Związki zawierające azot w cząsteczce charakteryzuje tzw. reguła azotu, zgodnie z którą, gdy
w cząsteczce występuje parzysta liczba atomów azotu, pik jonu molekularnego ma wartość
parzystą, a gdy liczba atomów azotu w cząsteczce jest nieparzysta to pik jonu molekularnego
ma wartość nieparzystą.
Piki macierzyste alifatycznych związków nitrowych są słabe lub niewidoczne, natomiast piki
macierzyste aromatycznych związków nitrowych są zazwyczaj silne. Na obecność grupy –
NO
2
w związku wskazuje pik m/e=30 pochodzący od jonu [NO
+
] i mniejszy pik m/e=46
pochodzący od jonu [NO
2
+
].
Wyszukiwarka
Podobne podstrony:
Analiza spektralna węglowodorów
Analiza spektralna widm (2), Matematyka - Fizyka, Pracownia fizyczna, Analiza spektralna widm
Związki nitrowe, Chemia
1 ćwiczenie (Analiza jakościowa wody) OZNACZANIE ZWIĄZKÓW AZOTU
72, P-77, Analiza spektralna - laboratorium z fizyki
Analiza spektroskopowa w mikroobszarach, ۞ Płyta Studenta Politechniki Śląskiej, Semestr 4, Bsiwm -
Enzymatyczna redukcja aromatycznych związków nitrowych
Analiza spektralna new
FIzyka metali, Spr 6 - Analiza spektralna, ZSE w Rzeszowie
Analiza spektralna i pom spektofotometryczne, analiza spektralna...
Analiza spektralna i pom spektofotometryczne, analiza spektralna...
Fluorowcopochodne weglowodorow
Fluorowcopochodne weglowodorow
fiz31 72a-Analiza spektralna i pomiary spektrofotometryczne
fluorowcpochodne weglowodorow otrzymywanie, biologia, chemia organiczna
Analiza spektralna widm, Matematyka - Fizyka, Pracownia fizyczna, Analiza spektralna widm
więcej podobnych podstron