Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
1
Miniskrypt:
CHEMIA ORGANICZNA
wersja 23
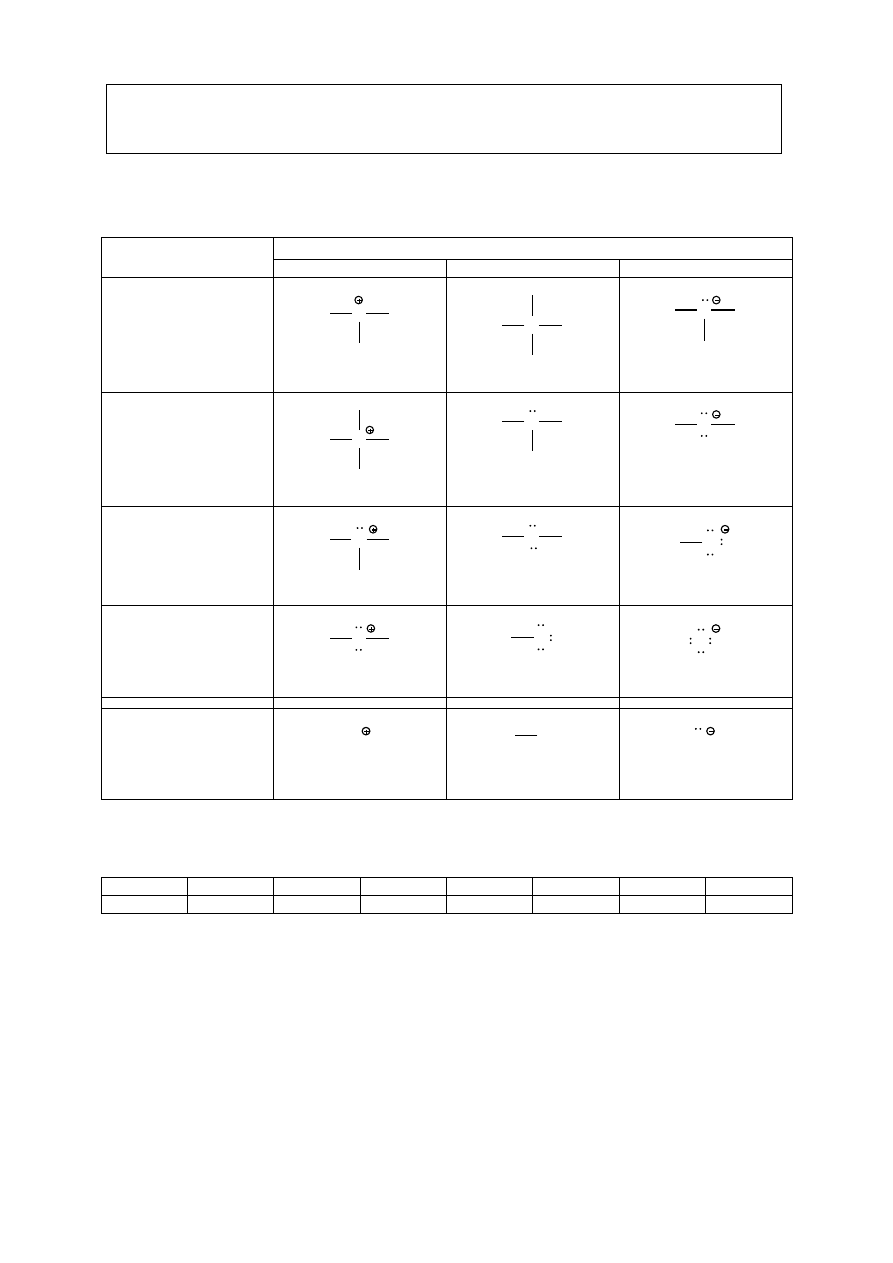
STRUKTURY LEWISA
Atom
Ładunek
+1
0
-1
C
C
C
C
wiązania
wolne pary el.
3
0
4
0
3
1
N
N
N
N
wiązania
wolne pary el.
4
0
3
1
2
2
O
O
O
O
wiązania
wolne pary el.
3
1
2
2
1
3
X
(halogen: F, Cl, Br, I)
X
X
X
wiązania
wolne pary el.
2
2
1
3
0
4
H
H
H
H
wiązania
wolne pary el.
0
0
1
0
0
1
ELEKTROUJEMNOŚĆ
H
C
S
I
N, Br
Cl
O
F
2.2
2.5
2.6
2.7
3.0
3.2
3.5
4.0

Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
2
GRUPY ALKILOWE I FUNKCYJNE
Wzór
Skrót
Nazwa grupy
CH
3
-Me
metylowa
CH
2
CH
3
-Et
etylowa
CH
2
CH
2
CH
3
-Pr
propylowa
CH
CH
3
CH
3
-iPr
izopropylowa
CH
2
CH
2
CH
2
CH
3
-Bu
butylowa
CH
2
CH
CH
3
CH
3
-iBu
izobutylowa
CH
CH
3
CH
2
CH
3
-sBu
sec-butylowa
C
CH
3
CH
3
CH
3
-tBu
tert-butylowa
-Ph
fenylowa
CH
2
-Bz
benzylowa
OH
---
hydroksylowa
OCH
3
-OMe
metoksylowa
OCH
2
CH
3
-OEt
etoksylowa
C
O
---
karbonylowa
C
O
H
---
formylowa
C
O
OH
---
karboksylowa
-NO
2
---
nitrowa
-NH
2
, -NHR, -NR
2
---
aminowe
Na kolejnych stronach wymienione są najważniejsze reakcje poszczególnych klas
związków. Nazwy reakcji, których znajomość jest dla Państwa obowiązkowa,
zostały podkreślone.
Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
3
I. ALKANY, CYKLOALKANY
I.A – REAKCJE
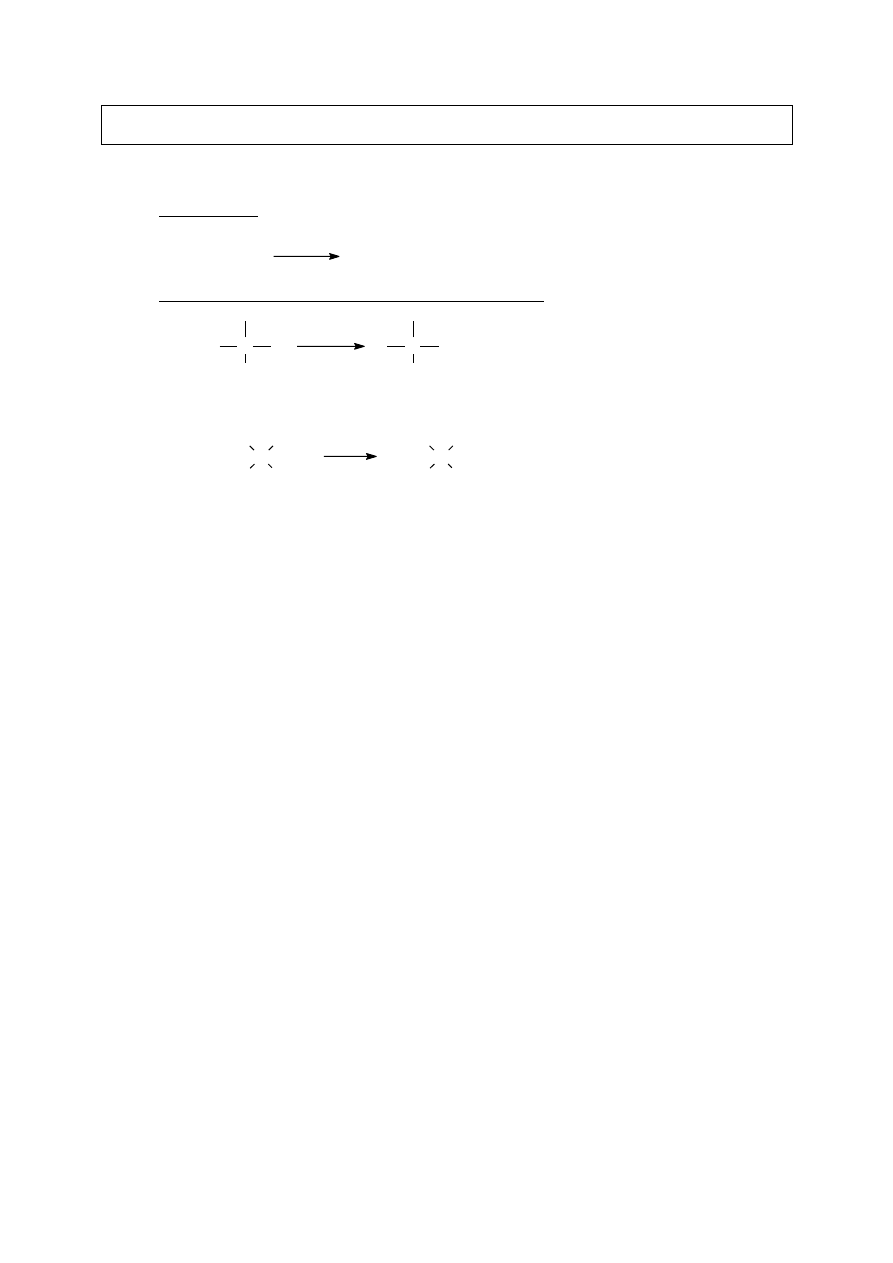
I.A.1. Spalanie
alkan
CO
2
+ H
2
O
płomień
I.A.2. Halogenowanie – tworzenie halogenków alkilowych
C
H
X
2
UV
C
X
+
HX
Szybkość reakcji: atom wodoru/węgla 3
> 2
> 1
halogen F
2
> Cl
2
> Br
2
> I
2
H
3
C
C
H
3
C
H
CH
3
Br
2
UV
H
3
C
C
H
3
C
Br
CH
3
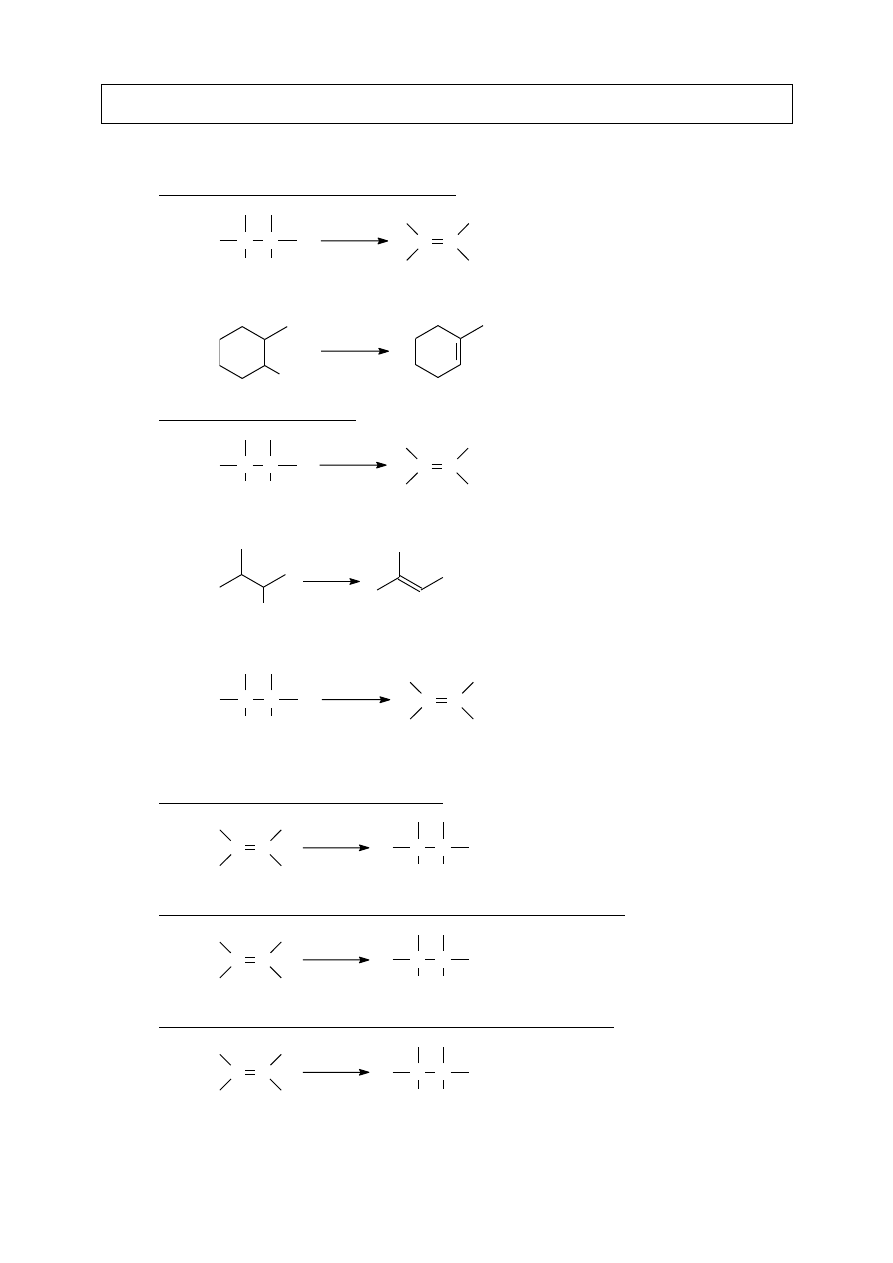
Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
4
II. ALKENY, CYKLOALKENY
II.A – OTRZYMYWANIE
II.A.1. Dehydrohalogenacja halogenku alkilu
C C
H X
C C
zasada
Szybkość reakcji: halogenek alkilowy 3
> 2
> 1
Produkt zgodny z regułą Zajcewa – bardziej podstawiony alken
Br
KOH
EtOH
II.A.2. Dehydratacja alkoholu (patrz też: V.B.1)
C C
H OH
C C
kwas
+
H
2
O
Szybkość reakcji: alkohol 3
> 2
> 1
Produkt zgodny z regułą Zajcewa – bardziej podstawiony alken
OH
H
2
SO
4
II.A.3. Dehalogenacja dihalogenopochodnych alkanów
C C
X X
C C
Zn
+
ZnX
2
II.B - REAKTYWNOŚĆ
II.B.1. Addycja wodoru – tworzenie alkanu
C C
H
2
C C
H H
Pt
II.B.2. Addycja halogenu – tworzenie wicynalnych dihalogenoalkanów
C C
X
2
C C
X X
II.B.3. Addycja halogenowodoru – tworzenie halogenków alkilowych
C C
HX
C C
H X
Reakcja biegnie zgodnie z regułą Markownikowa
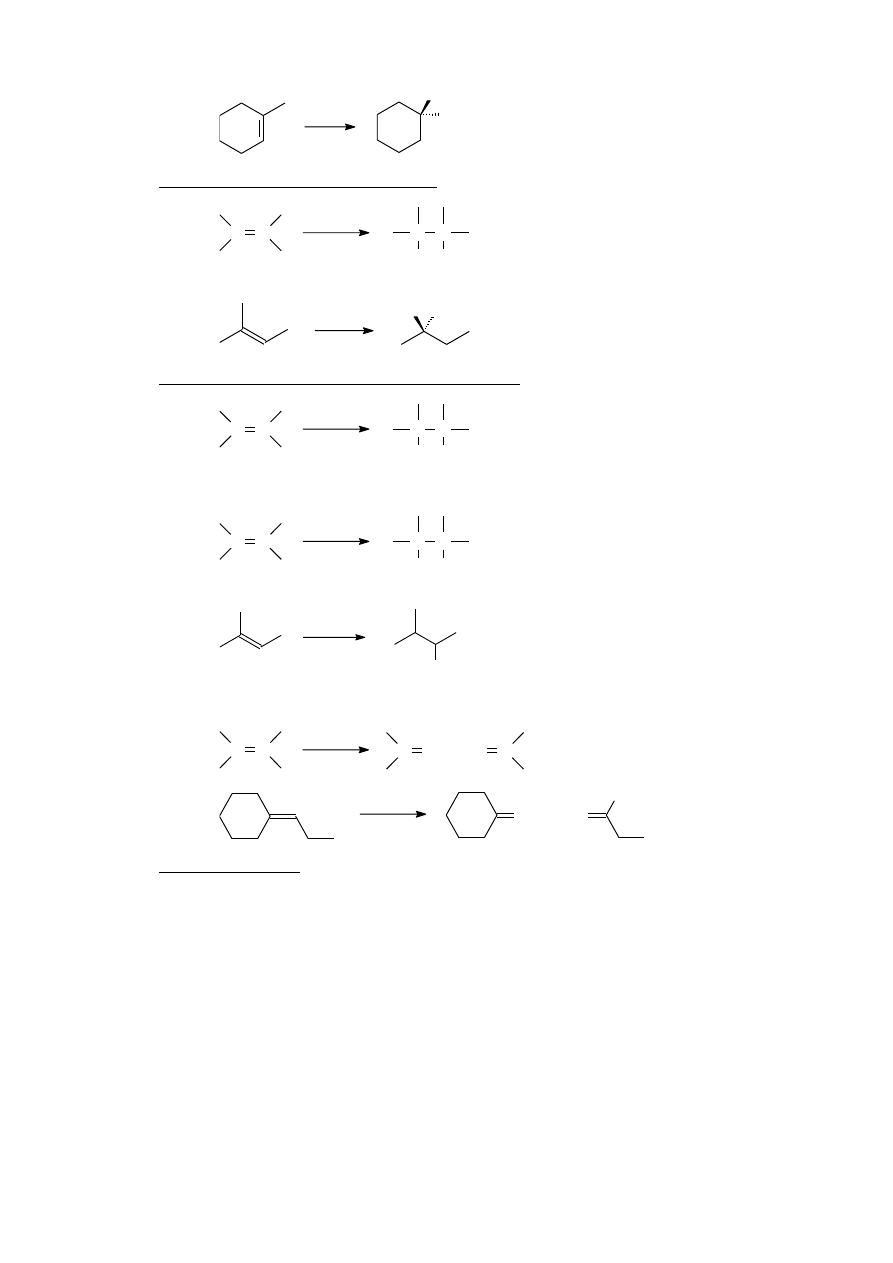
Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
5
HBr
CH
3
Br
II.B.4. Addycja wody – tworzenie alkoholi (patrz też: V.A.1)
C C
H
2
O
C C
H OH
H
+
Reakcja biegnie zgodnie z regułą Markownikowa
H
2
O
H
+
HO CH
3
II.B.5. Hydroksylowanie – tworzenie wicynalnych dioli
C C
KMnO
4
C C
OH OH
H
2
O
II.B.6. Borowodorowanie połączone z utlenieniem – tworzenie alkoholi
1. B
2
H
6
C C
C C
H OH
2. H
2
O
2
, OH
-
Reakcja biegnie niezgodnie z regułą Markownikowa
OH
1. B
2
H
6
2. H
2
O
2
, OH
-
II.B.7. Ozonoliza – tworzenie aldehydów i/lub ketonów
1. O
3
C C
2. (CH
3
)
2
S
C O +
C
O
1. O
3
2. (CH
3
)
2
S
O
O
H
+
II.B.8. Polimeryzacja
[schemat]
[przykład]
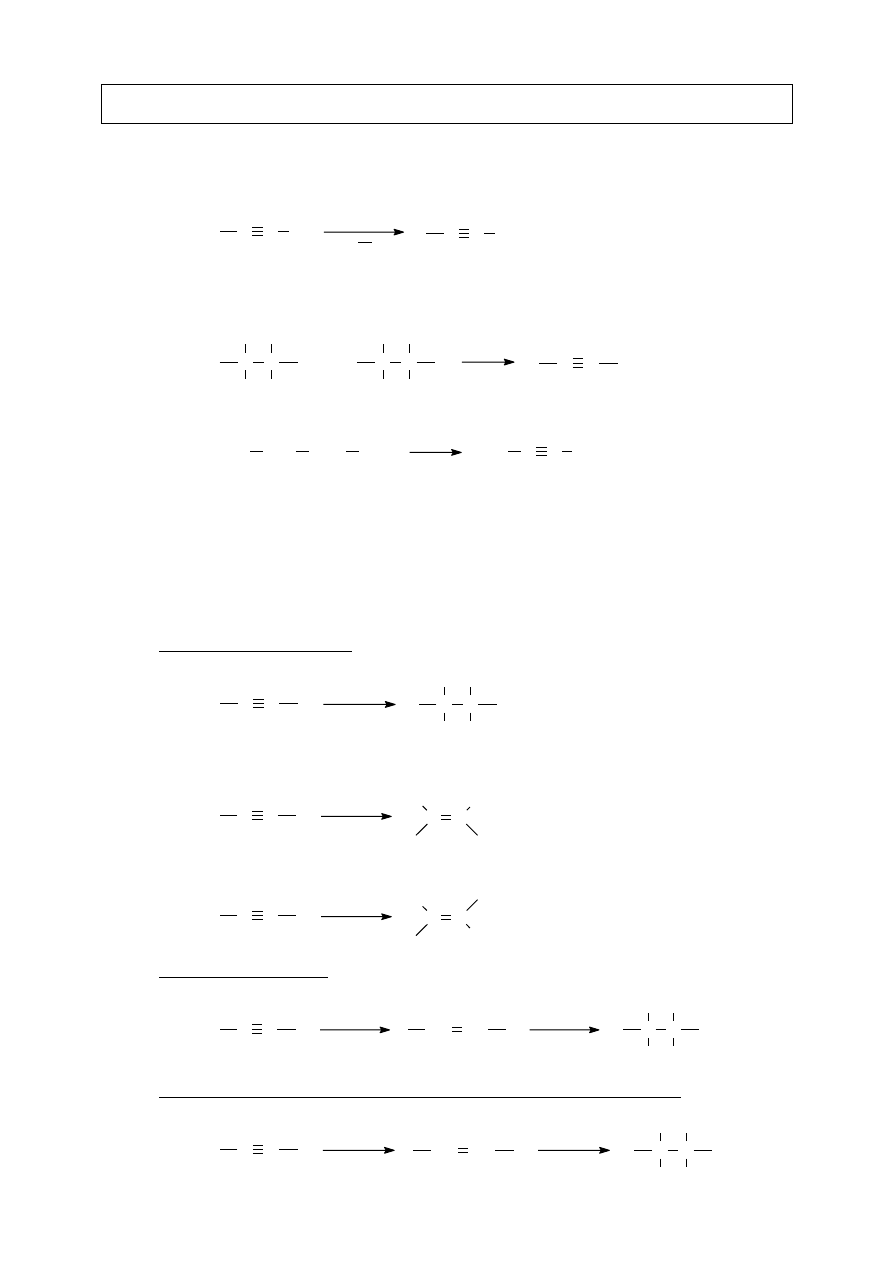
Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
6
III. ALKINY
III.A – OTRZYMYWANIE
III.A.1. Alkilowanie acetylenu
1. NaNH
2
2. R'
X
C C H
C C R'
R’-X musi być halogenkiem pierwszorzędowym
III.A.2. Podwójna dehydrohalogenacja dihalogenoalkanów
C
H
C
X
H
X
lub
C
H
C
H
X
X
KOH
temp.
C C
powstaje alkin dipodstawiony
CH
3
CH
2
CBr
2
CH
3
KOH
temp.
CH
3
C C CH
3
III.A.3. Hydroliza karbidu – otrzymywanie acetylenu
[schemat]
III.B – REAKTYWNOŚĆ
III.B.1. Redukcja do alkanów
C C
C C
H
H
H H
H
2
Pt
III.B.2. Redukcja do cis-alkenów
C C
H
2
Pd, BaSO
4
C C
H
H
III.B.3. Redukcja do trans-alkenów
C C
Na
NH
3
C C
H
H
III.B.4. Addycja halogenu
C C
CX CX
X
2
X
2
C C
X X
X
X
III.B.5. Addycja halogenowodoru – tworzenie geminalnych dihalogenoalkanów
C C
CH CX
HX
HX
C C
H X
X
H

Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
7
reakcja zachodzi zgodnie z regułą Markownikowa
CH
3
CH
2
C C H
HBr
C C
H
H
Br
CH
3
CH
2
HBr
CH
3
CH
2
C CH
3
Br
Br
III.B.6. Addycja wody – tworzenie ketonów
C C
H
2
O
HgSO
4
, H
2
SO
4
C C
H
H O
reakcja zawsze prowadzi do ketonu, z wyjątkiem addycji wody do acetylenu, kiedy to
powstaje aldehyd octowy CH
3
CHO
C C H
CH
3
H
2
O
HgSO
4
, H
2
SO
4
CH
3
C
CH
3
O
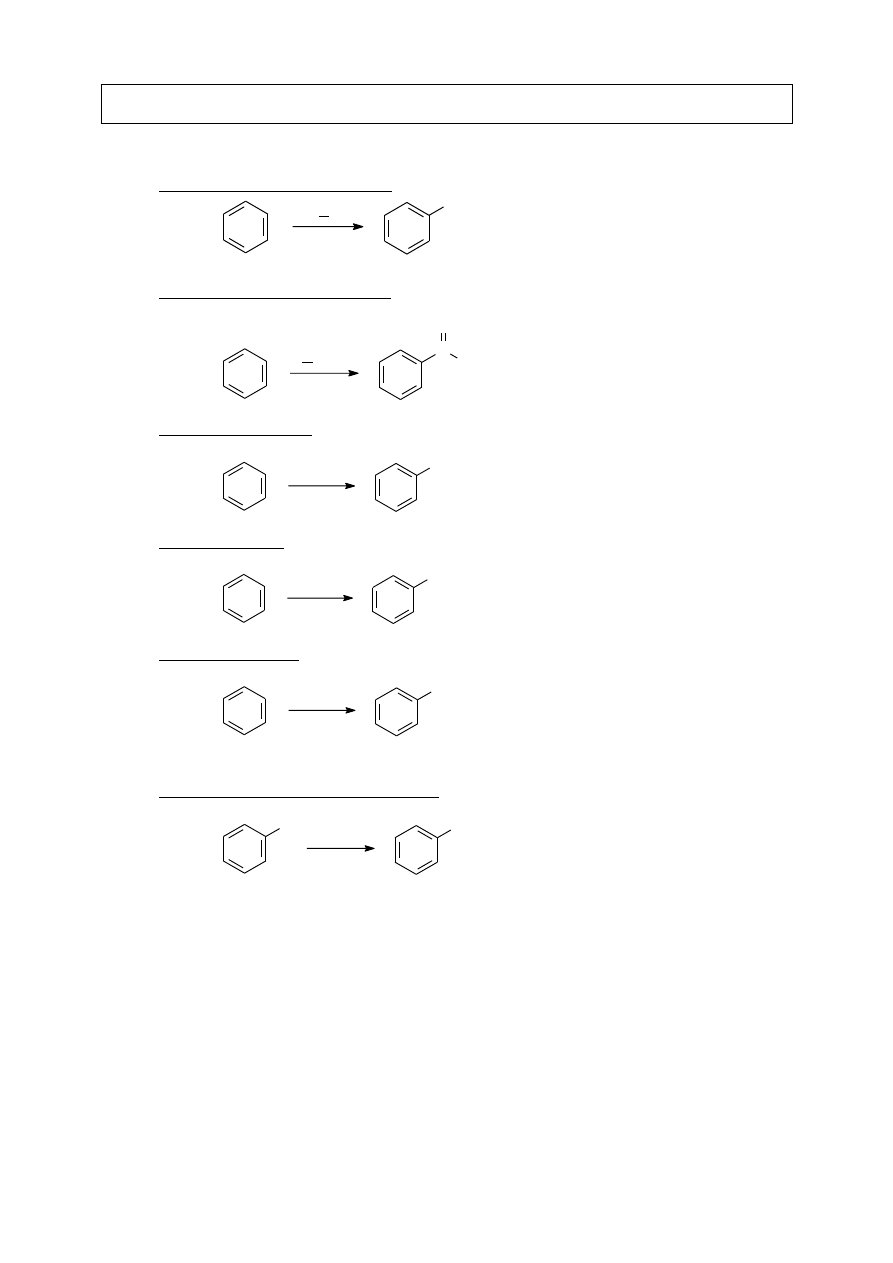
III.B.7. Utlenienie do kwasów karboksylowych
C C
1. KMnO
4
, OH
-
2. H
+
C
O
OH
C
O
HO
+
Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
8
IV. WĘGLOWODORY AROMATYCZNE
IV.A – REAKTYWNOŚĆ
IV.A.1. Alkilowanie Friedla-Craftsa
R X
AlX
3
R
pochodne benzenu z podstawnikiem dezaktywującym nie ulegają reakcji
IV.A.2. Acylowanie Friedla-Craftsa
R COCl
AlCl
3
C
O
R
IV.A.3. Halogenowanie
FeX
3
X
X
2
IV.A.4. Nitrowanie
NO
2
HNO
3
H
2
SO
4
IV.A.5. Sulfonowanie
SO
3
H
SO
3
H
2
SO
4
reakcja odwracalna
IV.A.6. Utlenianie alkilowych pochodnych
R
COOH
KMnO
4
H
2
O
reakcja nie zachodzi, gdy R to grupa tert-butylowa
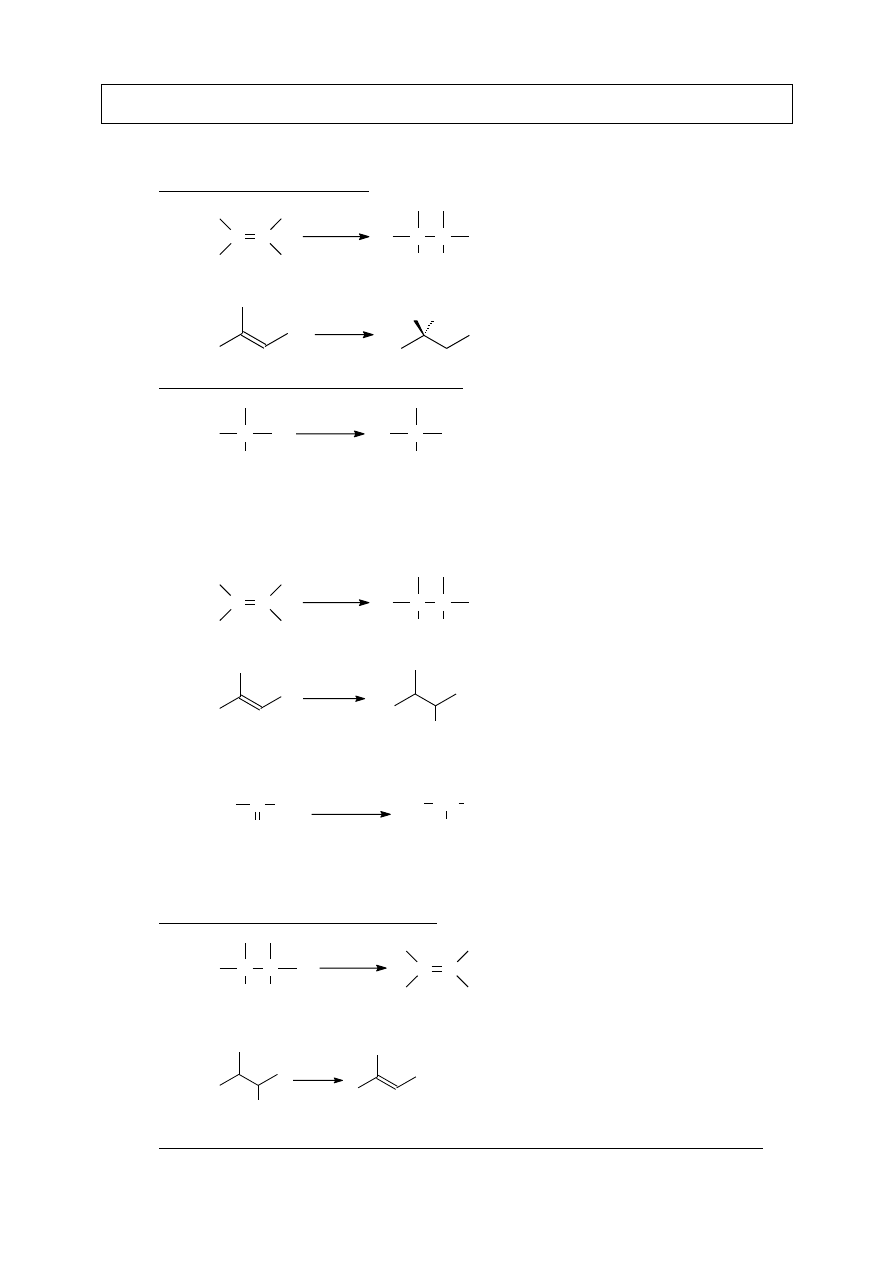
Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
9
V. ALKOHOLE
V.A – OTRZYMYWANIE
V.A.1. Addycja wody do alkenu (patrz też: II.B.4)
C C
H
2
O
C C
H OH
H
+
Reakcja biegnie zgodnie z regułą Markownikowa
H
2
O
H
+
HO CH
3
V.A.2. Substytucja w halogenkach alkilowych
H
2
O
zasada*
C
X
C
OH
W przypadku halogenków drugo- i trzeciorzędowych często zachodzi też eliminacja HX
z utworzeniem alkenu.
*Przy trzeciorzędowych nie stosuje się zasady, a jedynie ogrzewanie.
V.A.3. Borowodorowanie alkenów połączone z utlenieniem
1. B
2
H
6
C C
C C
H OH
2. H
2
O
2
, OH
-
Reakcja biegnie niezgodnie z regułą Markownikowa
OH
1. B
2
H
6
2. H
2
O
2
, OH
-
V.A.4. Redukcja aldehydów i ketonów
R
1
C R
2
O
1. NaBH
4
2. H
+
R
1
CH R
2
OH
V.B – REAKTYWNOŚĆ
V.B.1. Dehydratacja – tworzenie alkenów (patrz też: II.A.2)
C C
H OH
C C
kwas
+
H
2
O
Szybkość reakcji: alkohol 3
> 2
> 1
Produkt zgodny z regułą Zajcewa – bardziej podstawiony alken
OH
H
2
SO
4
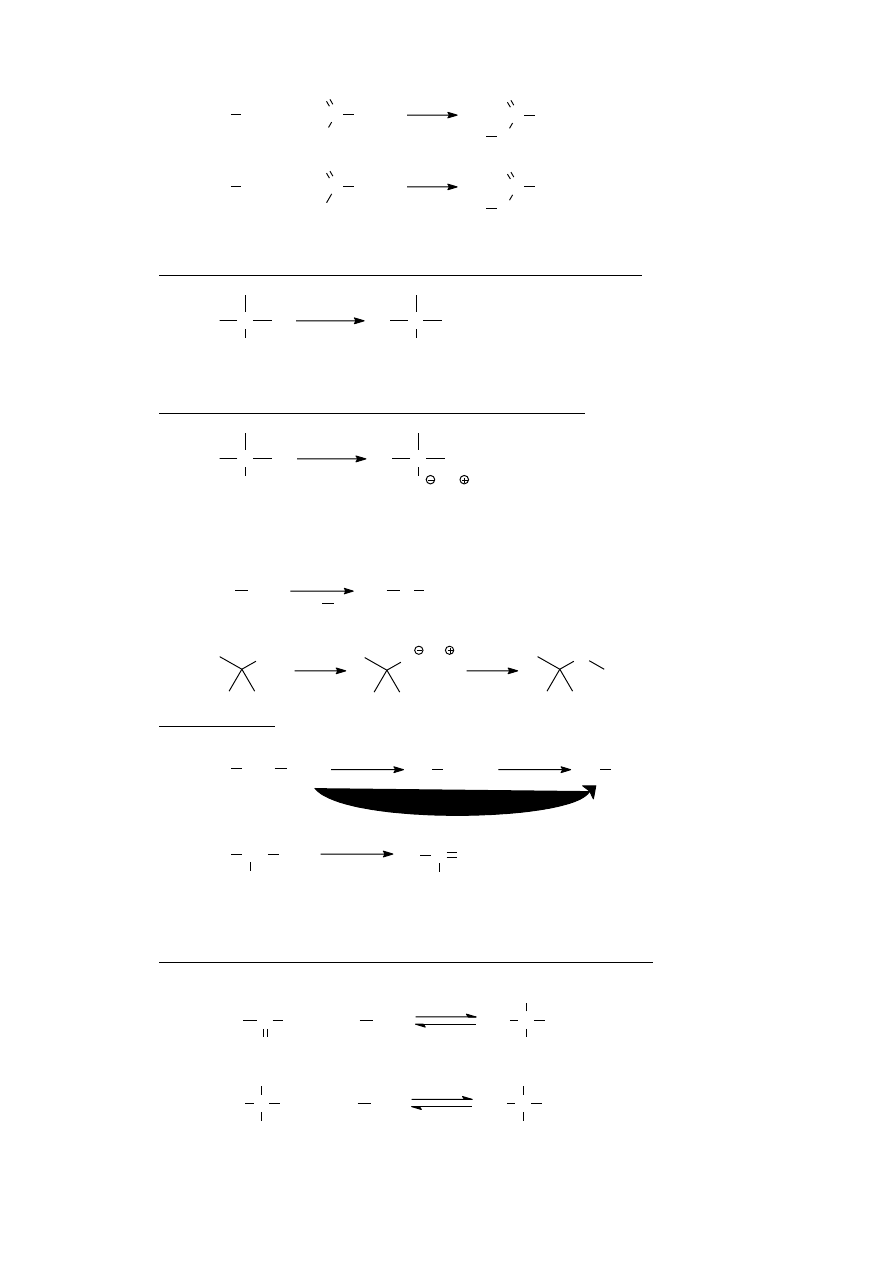
V.B.2. Reakcja z kwasami karboksylowymi lub z chlorkami kwasowymi – tworzenie estrów
(patrz też: VI.A.3)
Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
10
R OH +
R'
C
O
HO
R'
C
O
O
R
H
+
R OH +
R'
C
O
Cl
R'
C
O
O
R
W pierwszym przypadku jest to reakcja odwracalna
V.B.3. Reakcja z halogenowodorami - tworzenie halogenków alkilowych
HX
C
OH
C
X
Reakcja odwrotna do V.A.2. Zachodzi głównie dla drugo- i trzeciorzędowych alkoholi
V.B.4. Reakcja z metalami aktywnymi – tworzenie alkoholanów
Na
C
OH
C
O Na
Reaktywność: 1
> 2
> 3
V.B.5. Tworzenie eterów – synteza Williamsona (patrz też: VI.A.3)
R
1
OH
1. Na
2. R
2
X
R
1
O R
2
Halogenek alkilowy R
2
X musi być pierwszorzędowy
OH
Na
O Na
CH
3
Br
O
V.B.6. Utlenianie
R CH OH
R
KMnO
4
R C
R
O
R CH
2
OH
R CHO
R COOH
K
2
Cr
2
O
7
KMnO
4
KMnO
4
Alkohole trzeciorzędowe na zimno nie reagują. Ogrzewane w obecności KMnO
4
ulegają
rozpadowi z utworzeniem mieszaniny kwasów karboksylowych.
V.B.7. Reakcja z aldehydami i ketonami – tworzenie hemiacetali i acetali
R
1
C R
2
O
R
1
C R
2
OH
OR
3
H
+
+ R
3
OH
hemiacetal
R
1
C R
2
OH
OR
3
R
3
OH
+
H
+
R
1
C R
2
OR
3
OR
3
acetal

Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
11
VI. FENOLE
VI.A – REAKTYWNOŚĆ
VI.A.1. Reakcja z wodorotlenkami metali aktywnych – tworzenie fenolanów
Ar OH
NaOH
Ar O Na
Fenolany powstają także w reakcji z metalami aktywnymi
VI.A.2. Tworzenie eterów – synteza Williamsona (patrz też: V.B.5)
Ar
OH
1. NaOH
2. R X
Ar
O R
Halogenek alkilowy RX musi być pierwszorzędowy
VI.A.3. Reakcja z kwasami karboksylowymi lub z chlorkami kwasowymi – tworzenie
estrów
Ar
OH +
R'
C
O
HO
R'
C
O
O
Ar
H
+
Ar
OH +
R'
C
O
Cl
R'
C
O
O
Ar
VI.A.4. Substytucja w pierścieniu
-
nitrowanie
-
sulfonowanie
-
halogenowanie
-
alkilowanie metodą Friedla-Craftsa
-
acylowanie metodą Friedla-Craftsa
grupa –OH silnie aktywuje pierścień i kieruje podstawniki w pozycje para i orto;
często powstają pochodne di- oraz tripodstawione
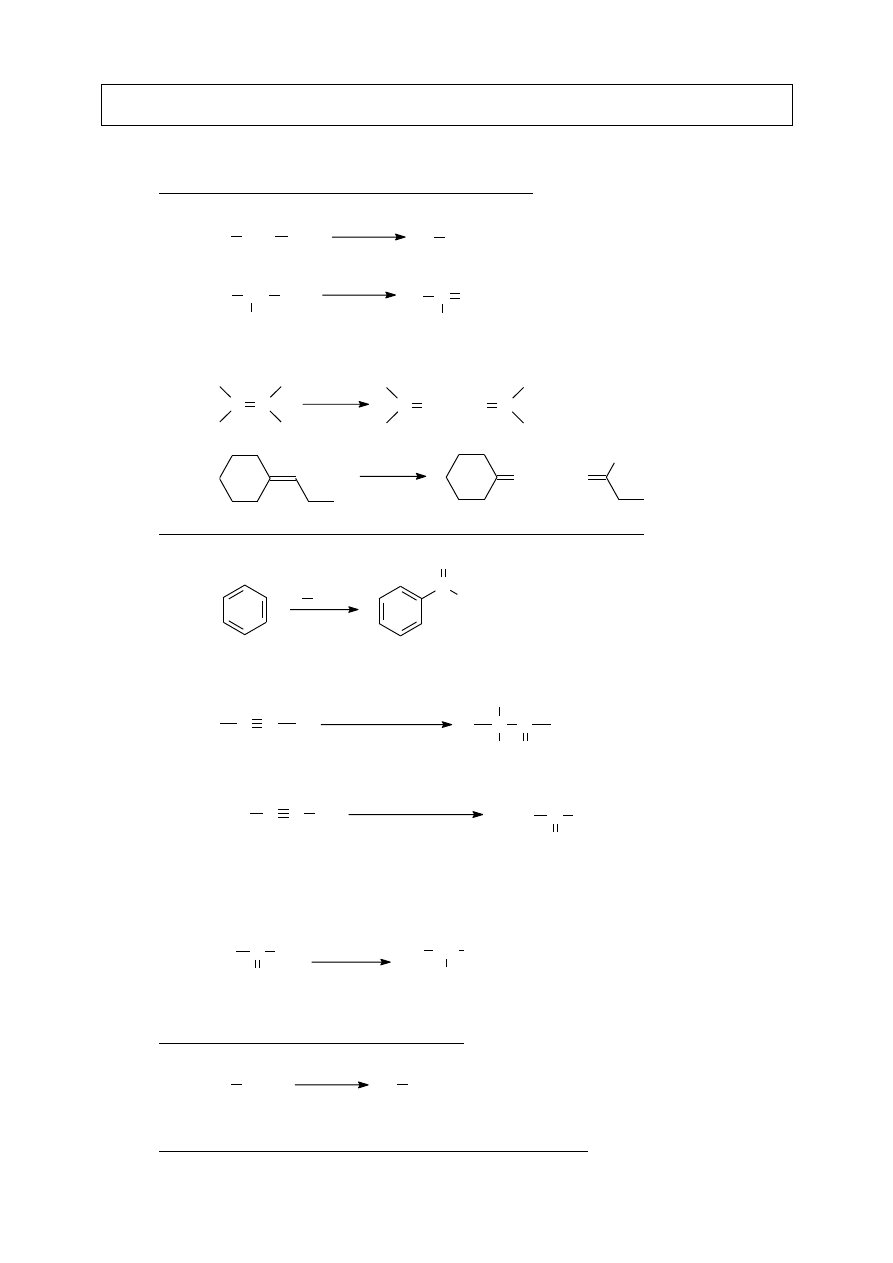
Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
12
VII. ALDEHYDY, KETONY
VII.A – OTRZYMYWANIE
VII.A.1. Utlenianie alkoholi pierwszo- i drugorzędowych
R CH OH
R
KMnO
4
R C
R
O
R CH
2
OH
R CHO
K
2
Cr
2
O
7
aldehyd
keton
VII.A.2. Ozonoliza alkenów – tworzenie aldehydów i/lub ketonów
1. O
3
C C
2. (CH
3
)
2
S
C O +
C
O
1. O
3
2. (CH
3
)
2
S
O
O
H
+
VII.A.3. Acylowanie Friedla-Craftsa – tworzenie ketonów aromatycznych
R COCl
AlCl
3
C
O
R
VII.A.4. Addycja wody do alkinów
C C
H
2
O
HgSO
4
, H
2
SO
4
C C
H
H O
w przypadku alkinu terminalnego reakcja zawsze prowadzi do ketonu metylowego
C C H
CH
3
H
2
O
HgSO
4
, H
2
SO
4
CH
3
C
CH
3
O
VII.B – REAKTYWNOŚĆ
VII.B.1. Redukcja do alkoholu
R
1
C R
2
O
1. NaBH
4
2. H
+
R
1
CH R
2
OH
Reakcja zachodzi dla aldehydów i ketonów
VII.B.2. Utlenienie do kwasu (tylko aldehydy)
R CHO
KMnO
4
R COOH
Gdy utleniaczem jest Ag
+
mamy reakcję Tollensa
VII.B.3. Reakcja haloformowa – utlenianie ketonów metylowych
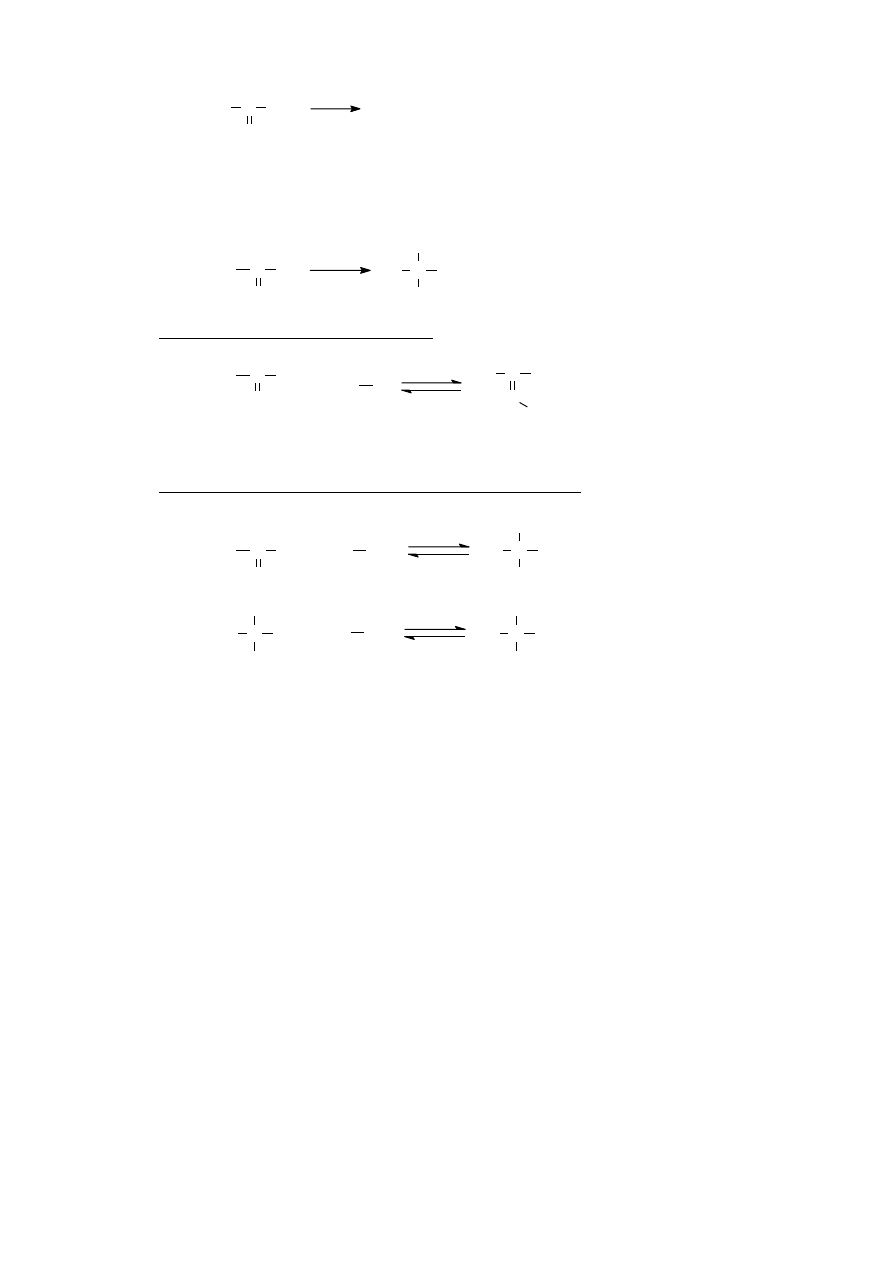
Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
13
R C CH
3
O
IO
-
RCOO
-
+ CHI
3
Dzięki powstawaniu żółtego osadu jodoformu CHI
3
jest to reakcja służąca do
wykrywania ketonów metylowych (tzw. próba jodoformowa)
VII.B.4. Reakcja z cyjankami – tworzenie cyjanohydryn
R
1
C R
2
O
R
1
C R
2
CN
OH
KCN
H
+
VII.B.5. Reakcje z pochodnymi amoniaku
NH
2
R
3
R
1
C R
2
O
R
1
C R
2
N
R
3
H
+
+
Reakcja zachodzi dla aldehydów i ketonów
Grupą R
3
może być wodór, grupa alkilowa, arylowa, aminowa
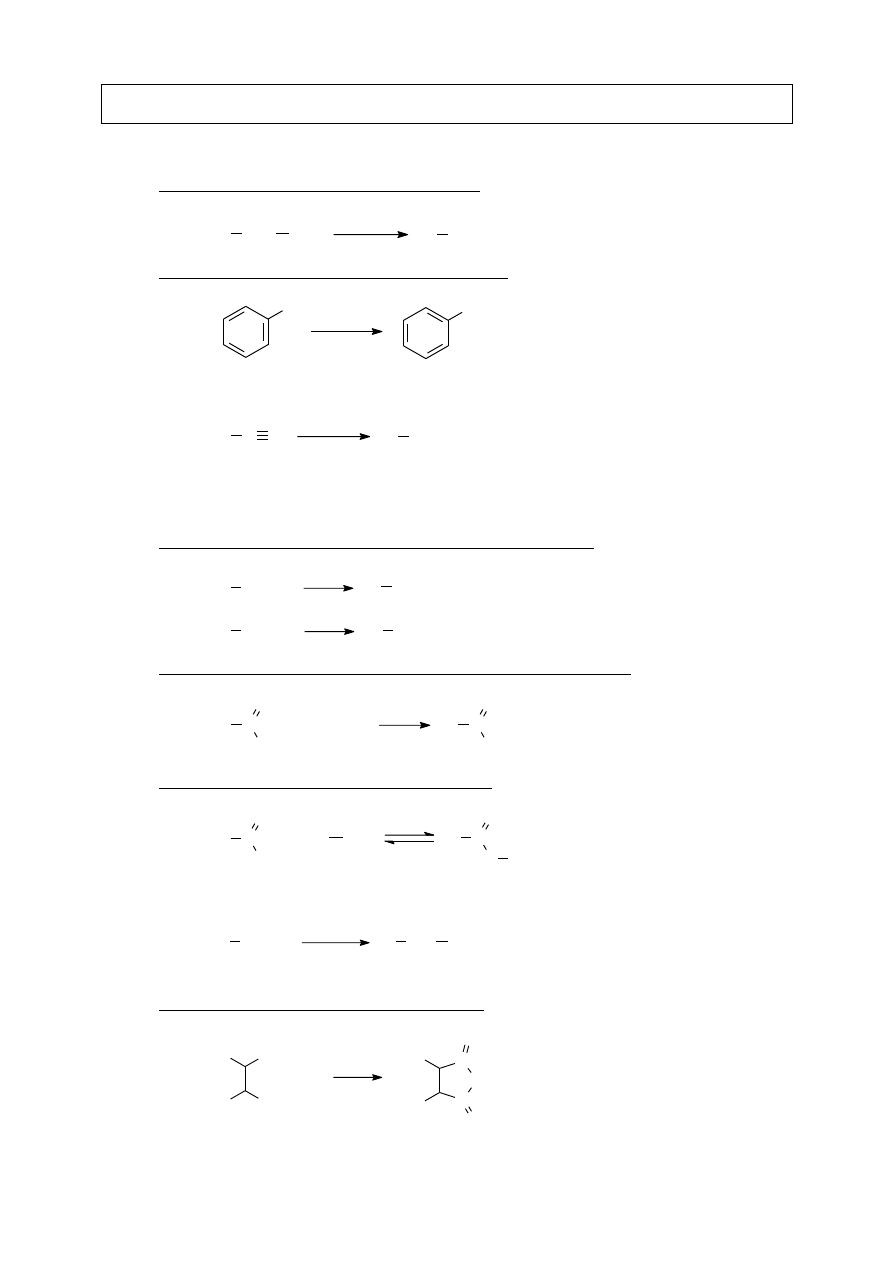
VII.B.6. Reakcja z alkoholami – tworzenie hemiacetali i acetali
R
1
C R
2
O
R
1
C R
2
OH
OR
3
H
+
+ R
3
OH
hemiacetal
R
1
C R
2
OH
OR
3
R
3
OH
+
H
+
R
1
C R
2
OR
3
OR
3
acetal
Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
14
VIII. KWASY KARBOKSYLOWE
VIII.A – OTRZYMYWANIE
VIII.A.1. Utlenianie alkoholi pierwszorzędowych
R CH
2
OH
R COOH
KMnO
4
VIII.A.2. Utlenianie alkilowych pochodnych benzenu
R
COOH
KMnO
4
VIII.A.3. Hydroliza nitryli
R C N
R COOH
H
2
O
H
+
R może być grupą alkilową lub arylową
VIII.B – REAKTYWNOŚĆ
VIII.B.1. Reakcje z metalami i z wodorotlenkami – tworzenie soli
R COOH
M
(R COO)
n
M + H
2
R COOH
M(OH)
n
(R COO)
n
M + H
2
O
VIII.B.2. Reakcja z chlorkiem tionylu – tworzenie chlorków kwasowych
+
R C
O
OH
SOCl
2
R C
O
Cl
VIII.B.3. Reakcja z alkoholami – tworzenie estrów
R'
OH
+
R C
O
OH
R C
O
O R'
H
+
VIII.B.4. Redukcja do alkoholi
R CH
2
OH
R COOH
LiAlH
4
Reakcja odwrotna do VIII.A.1
VIII.B.5. Dehydratacja – tworzenie bezwodników
COOH
COOH
R
R
T
C
O
C
O
O
R
R
Reakcja zachodzi łatwo jedynie dla niektórych kwasów dikarboksylowych
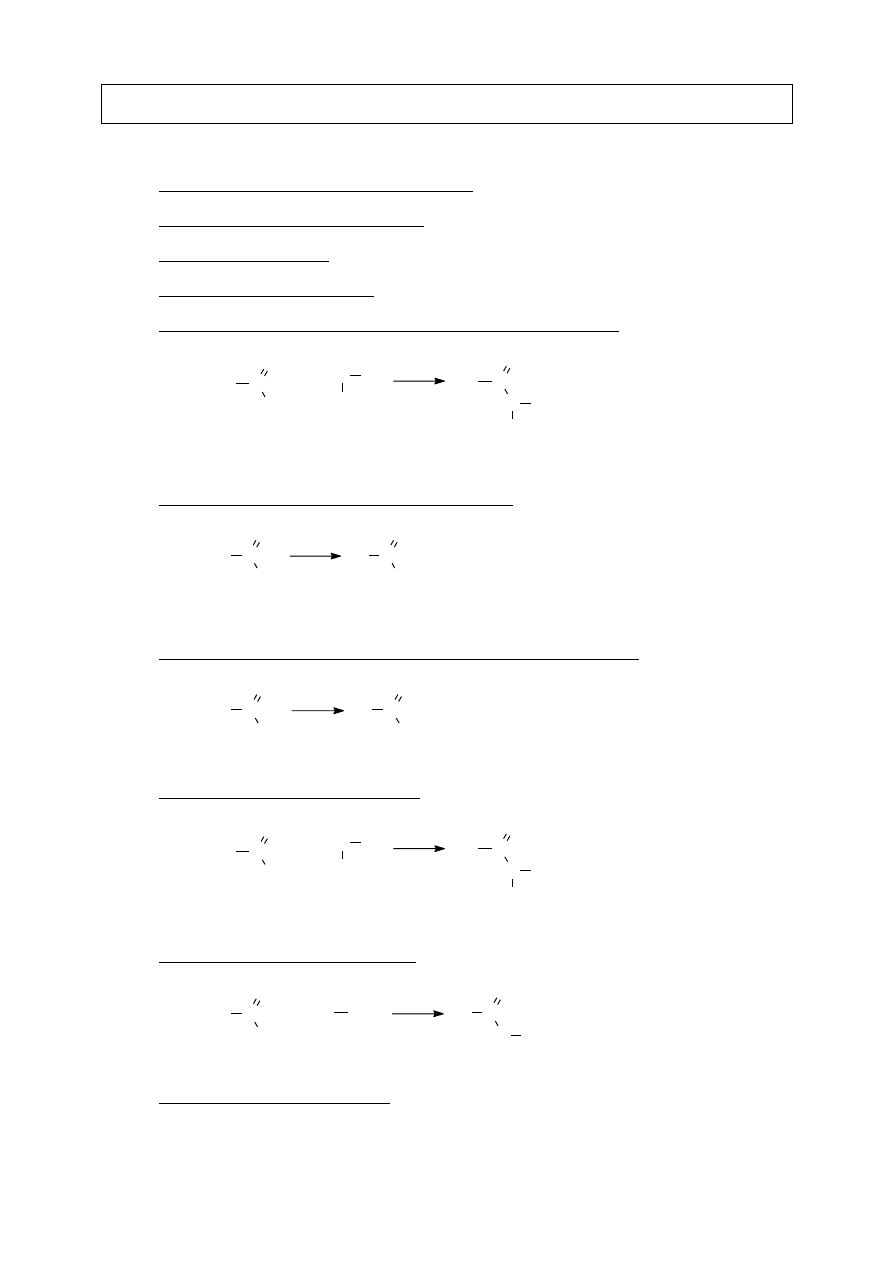
Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
15
IX. POCHODNE KWASÓW KARBOKSYLOWYCH
IX.A – OTRZYMYWANIE
IX.A.1. Tworzenie soli kwasów karboksylowych – patrz: VIII.B.1
IX.A.2. Tworzenie chlorków kwasowych – patrz: VIII.B.2
IX.A.3. Tworzenie estrów – patrz: VIII.B.3
IX.A.4. Tworzenie bezwodników – patrz: VIII.B.5
IX.A.5. Reakcja chlorków kwasowych z aminami – tworzenie amidów
+
R
1
C
O
Cl
HN R
2
R
3
R
1
C
O
N R
2
R
3
IX.B – REAKTYWNOŚĆ
IX.B.1. Hydroliza – przemiana w kwasy karboksylowe
R C
O
OH
R C
O
X
H
2
O
Reakcja zachodzi bardzo łatwo dla chlorków kwasowych i bezwodników.
Estry i sole reagują w środowisku kwaśnym
IX.B.2. Hydroliza zasadowa – przemiana w sole kwasów karboksylowych
R C
O
ONa
R C
O
X
H
2
O
NaOH
Amidy i estry reagują dużo wolniej niż chlorki kwasowe i bezwodniki
IX.B.3. Aminoliza – przemiana w amidy - patrz też: VIII.A.5
+
R
1
C
O
X
HN R
2
R
3
R
1
C
O
N R
2
R
3
Reakcja zachodzi tylko dla chlorków kwasowych i bezwodników
IX.B.4. Alkoholiza – przemiana w estry
R'
OH
+
R C
O
X
R C
O
O R'
Reakcja zachodzi tylko dla chlorków kwasowych i bezwodników
IX.B.5. Acylowanie Friedla-Craftsa

Miniskrypt z chemii organicznej – wersja 23
dr Oskar Michalski, Katedra Chemii i Fizyki UR w Krakowie, 2004-2010
16
R COCl
C
O
R
AlCl
3
+
Reakcja chlorków kwasowych
X. AMINY
X.A – OTRZYMYWANIE
X.B – REAKTYWNOŚĆ
Wyszukiwarka
Podobne podstrony:
Egzamin z chemii organicznej (2 Nieznany
13 Podstawy chemii organicznej Nieznany
4a Podstawy chemii organicznej Nieznany
9 Podstawy chemii organicznej P Nieznany
PROGRAM CWICZEN Z CHEMII ORGANICZNEJ BIOLOGIA 2010 2011
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
06 Projektowanie i organizowani Nieznany (2)
m wypych dobkowska organizacyj Nieznany
postawa, socjologia organizacji Nieznany (3)
Biomechanika sprawy organizacyj Nieznany (2)
aminy otrzymywanie, podstawy chemii organicznej
11 Podstawy chemii organicznej Profesor Boduszek
Wprowadzenie do chemii organicznej
POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ
więcej podobnych podstron