
Laboratorium mikrobiologiczne

Cel ćwiczenia
• Zapoznanie się z regulaminem ćwiczeń
• Poznanie podstawowego szkła i sprzętu
mikrobiologicznego i sposobów sterylizacji
• Zapoznanie się rodzajami i sposobem
przygotowywania podłoży mikrobiologicznych oraz
metodami hodowli mikroorganizmów
• Mikroskopy stosowane w badaniach
mikrobiologicznych

Podstawowe szkło
• Probówki bakteriologiczne (probówki Falcone)
• Płytki (szalki) Petriego
• Kolby Roux (inne butelki)
• Kolby Erlenmayera

Sprzęt do szczepienia
• Igła bakteriologiczna
• Eza bakteriologiczna
• Głaszczka Drygalskiego
• Palnik

Sprzęt do hodowli
• Termostat
• Wytrząsarka

Sprzęt do sterylizacji
• Suszarka do sterylizacji szkła
• Autoklaw do sterylizacji podłoży

Metody sterylizacji
• Fizyczne
• Chemiczne

Metody fizyczne
• Wysoka temperaturą (sucha – wyżarzanie,
opalanie, gorące powietrze i parą wodną –
dekoktacja, pasteryzacja, tyndalizacja, para wodna
pod zwiększonym ciśnieniem - sterylizacja)
• Promienie elektromagnetyczne: UV, radiacyjne
(jonizujące)
• Sączenie

Metoda chemiczna
• Sterylizacja gazowa (tlenek etylenu w mieszaninie
CO
2
, beta-propiolakton, ozon i chlor, fluor –woda)

Kontrola sterylizacji
• Sporotesty (sporal A do autoklawów, sporal S do
suszarek np. stericon plus Bioindicator do
autoklawu zawiera przetrwalniki
Geobacillus
stearothermophilus
w fiolce 2 ml). Po
autoklawowaniu ampułki inkubuje się 48 godz. w
temp. 60± 2
o
C. Nie wysterylizowane jako kontrola.
Jeśli kolor pozostanie czerwono-fioletowy to
sterylizacja poprawna.

Dezynfekcja
• Środki chemiczne (kwasy, zasady, środki
utleniające, alkohole, aldehydy, związki fenoli i ich
pochodne, związki powierzchniowo czynne,
jodofory, chloroheksydyna, sole metali ciężkich)
• Kontrola skażenia powierzchni i powietrza
drobnoustrojami

Zastosowanie podłoży mikrobiologicznych
• Izolacja
• Różnicowanie
• Identyfikacja
• Namnażanie
• Określenie właściwości fizjologicznych,
biochemicznych i hodowlanych

Rodzaje podłoży ze względu na zawartość
składników odżywczych
• Minimalne
• Pełne
• Wzbogacone

Rodzaje podłoży ze względu na skład
chemiczny
• Naturalne
• Półsyntetyczne
• Syntetyczne

Rodzaje podłoży ze względu na konsystencję
• Stałe (zaw. 1,5-2,0% agaru)
• Półpłynne (0,1-0,7 agaru)
• Płynne
• Agar - uniwersalny środek zestalający pożywki
mikrobiologiczne (z morskich krasnorostów
Selidum amansi
)
• Żelatyna (produkt hydrolizy kolagenu)

Rodzaje podłoży ze względu na przeznaczenie
i zastosowanie
• Namnażające
• Wybiórcze
• Namnażająco-wybiórcze
• Izolacyjne
• Różnicujące (identyfikacyjne, diagnostyczne)
• Podłoża „transportowe”

Metody hodowli
•Ze względu na rodzaj podłoża:
- hodowle płynne
- hodowle na podłożu stałym

Hodowle płynne
• W probówkach
• W kolbach
• W butlach
• W fermentorach
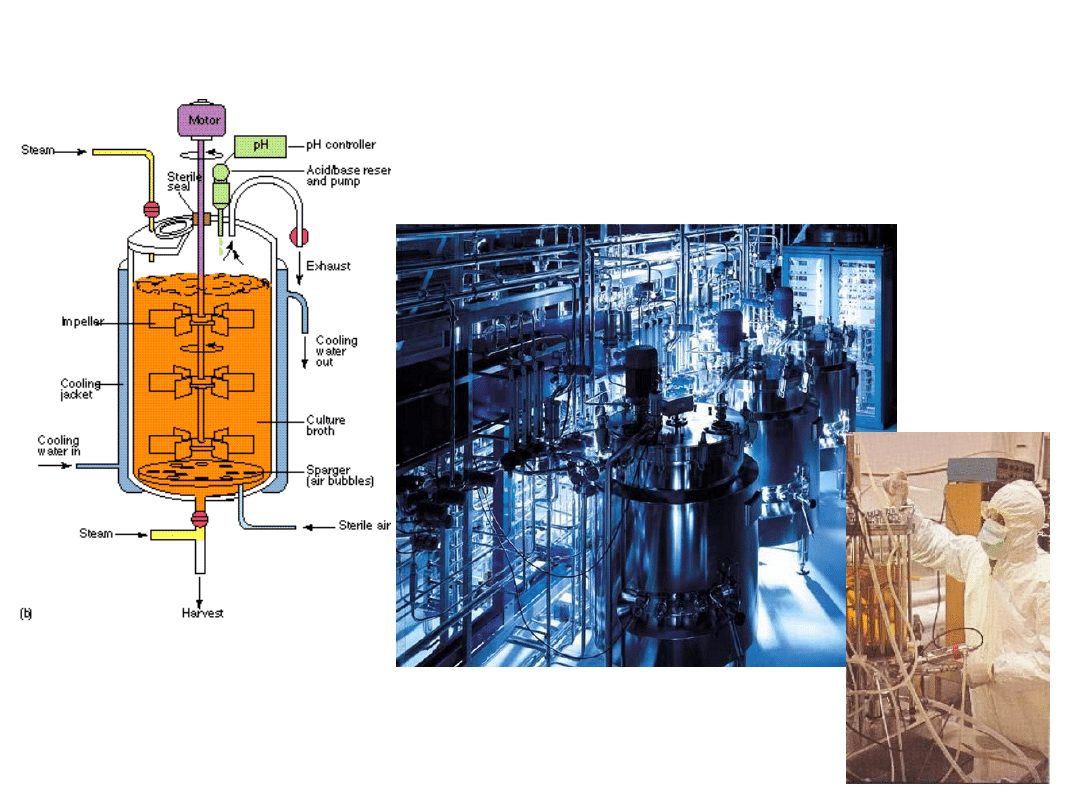
Fermentory

Hodowle na podłożach stałych
• Na płytkach Petriego
• Słupkach
• Skosach
• W butlach

Ze względu na czas hodowli oraz dostęp
składników pokarmowych
• Hodowle okresowe (zamknięte) – czynniki
ograniczające to wyczerpanie składników
pokarmowych, nagromadzenie metabolitów i zmiana
równowagi jonowej (głównie pH)
• Hodowle otwarte (ciągłe) – ciągła kontrola zużycie
substancji odżywczych, przyrost liczby i masy
drobnoustrojów oraz stężenie metabolitów
• Hodowle zsynchronizowane – wszystkie osobniki
dzielą się jednocześnie (w tym samym czasie)

Ze względu na stosunek bakterii do tlenu
• Hodowle tlenowców
• Hodowle beztlenowców

Hodowle tlenowców
• Hodowle powierzchniowe
• Hodowle wgłębne (wytrząsarki, fermentory)

Hodowle beztlenowców
• Metody fizyczne (warstwa oleju parafinowego, słój
próżniowy, hodowla w atmosferze gazu obojętnego,
przy użyciu zestawu np. „Gas-Pak”)
• Metody chemiczne (podłoża zawierające
substancje chemiczne absorbujące tlen np.
pirogallol, chlorek miedziowy lub związki chemiczne
obniżające potencjał oksydo-redukcyjny np. kwas
askorbinowy, siarczyn sodowy)
• Metody biologiczne – hodowla na tym samym
podłożu tlenowca i beztlenowca

Mikroskopy do obserwacji mikrobiologicznych
• Świetlny
• Z ciemnym polem widzenia
• Kontrastowo-fazowy
• Ultrafioletowy
• Fluorescencyjny
• Polaryzacyjno-interferencyjny
• Elektronowy transmisyjny
• Skaningowy

Mikroskop świetlny
• Najważniejsze pojęcia dla mikrobiologa to powiększenie
mikroskopu i zdolność rozdzielcza
• Powiększeniem mikroskopu to stosunek obrazu pozornego A
”
,
który widzimy w mikroskopie do wielkości przedmiotu
(iloczyn powiększenia okularu i powiększenia obiektywu)
• Zdolność rozdzielcza (najmniejsza odległość pomiędzy
dwoma punktami, przy której widzimy je w mikroskopie
oddzielnie)
• Olejek immersyjny pozwala zwiększyć zdolność rozdzielczą
mikroskopu do 0,19 mikrometra zwiększając aperturę
liczbową obiektywu (suchy – 0,3 mikrometra, „wodny” – 0,24
mikrometra)
• Zastosowanie odpowiednich filtrów lub światła UV może
zwiększyć zdolność rozdzielczą do 0,17 mikrometra

Mikroskop z ciemny polem widzenia
• Pole widzenia ciemne, a obserwowane obiekty –
jasne (kondensor ciemnego pola)
• Stosowany olejek immersyjny (górna soczewka
kondensora a dolna pow. preparatu)
• Zdolność rozdzielcza podobna jak w mikroskopie
świetlnym
• Obserwacje żywych bakterii
krętki

Mikroskop kontrastowo-fazowy
• Bezbarwne obiekty fazowe (przezroczyste)
przekształcane są w obiekty amplitudowe
powodujące zmiany natężenia światła widoczne dla
oka przy zastosowaniu płytki fazowej
• Umożliwia obserwacje żywych bakterii a w
szczególności ich ruchu (bez wybarwiania)
komórki
drożdży
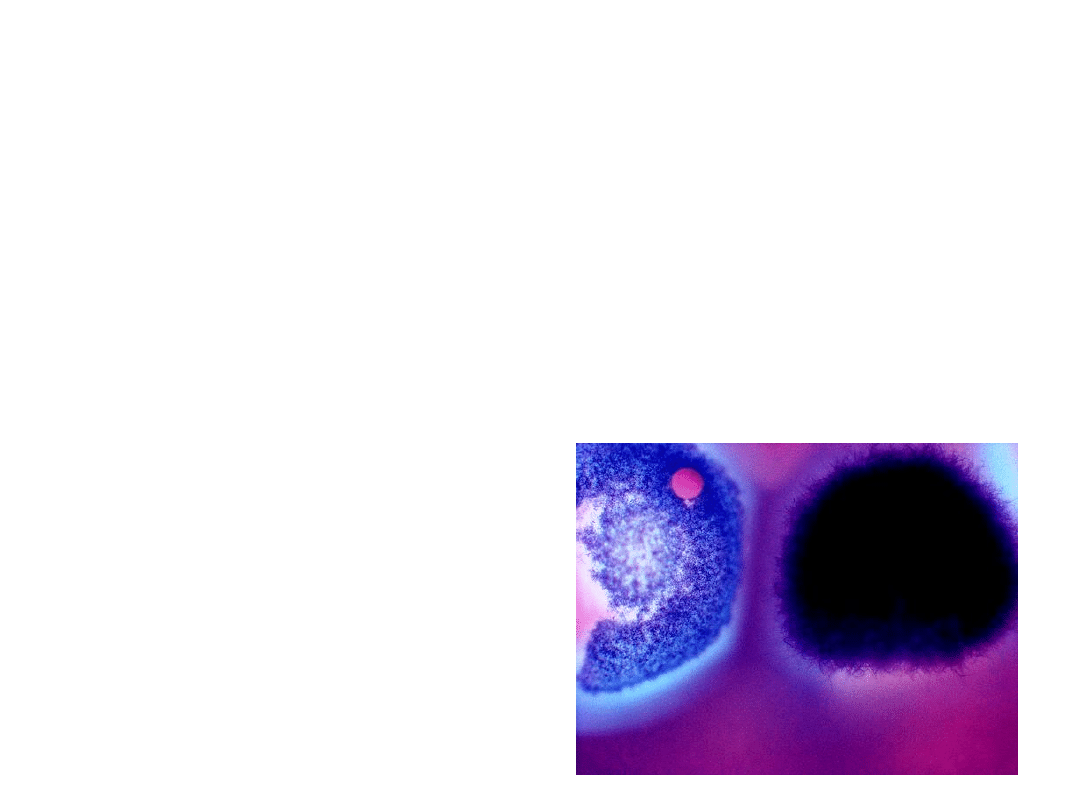
Mikroskop ultrafioletowy
• Stosowane są lampy rtęciowo-kwarcowe
• Poprzez zastosowanie światła UV ( o krótszej fali)
zwiększona została zdolność rozdzielcza do 0,1
mikrometra
dwie kolonie
Streptomyces sp.
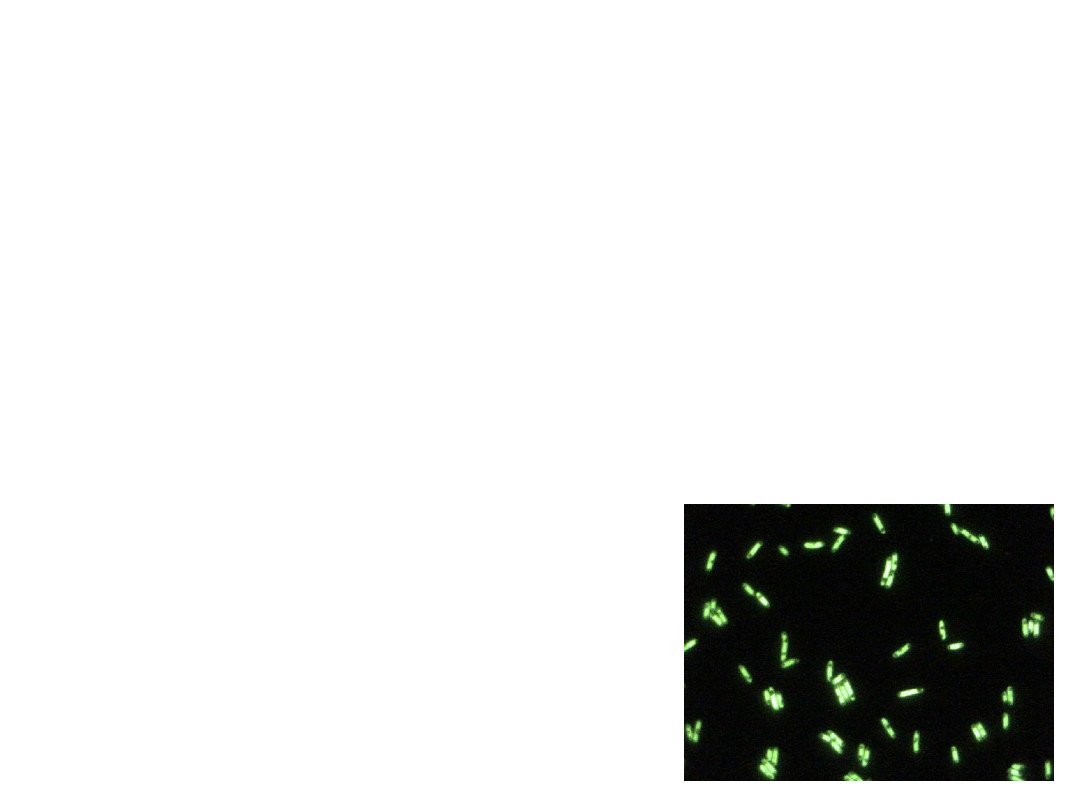
Mikroskop fluorescencyjny (luminescencyjny)
• Wykorzystywane zjawisko pobudzania świecenia
preparatów oświetlanych promieniami
ultrafioletowymi po wybarwieniu fluorochromami
(barwniki wysyłające światło o długiej fali po
wzbudzeniu promieniami UV) np. erytrozyną,
oranżem akrydynowym, rodaminą
bakterie
z fluoryzującym
na zielono
białkiem

Mikroskop polaryzacyjno-interferencyjny
• Służy do obserwacji przezroczystych i
pochłaniających światło obiektów
• Zastosowany pryzmat, polaryzator i analizator
• Oglądany przedmiot robi wrażenie przestrzennego

Inne mikroskopy
• Mikroskop elektronowy – transmisyjny (wykorzystywane są
trzy elektromagnesy i wiązka elektronów a obraz
przekazywany jest na ekran lub kliszę fotograficzną),
zdolność rozdzielcza 4-10 Å, siatki platynowe zamiast
szkiełka podstawowego, preparaty bardzo cienkie do 0,5
mikrometra, obraz trójwymiarowy
• Mikroskop skaningowy (elektrony przechodzą przez cały
preparat a powstały obraz może być fotografowany lub
obserwowany na monitorze) obraz trójwymiarowy, zdolność
rozdzielcza 0,02 mikrometra, obserwacja bakterii i ich
penetracji w komórkach gospodarza
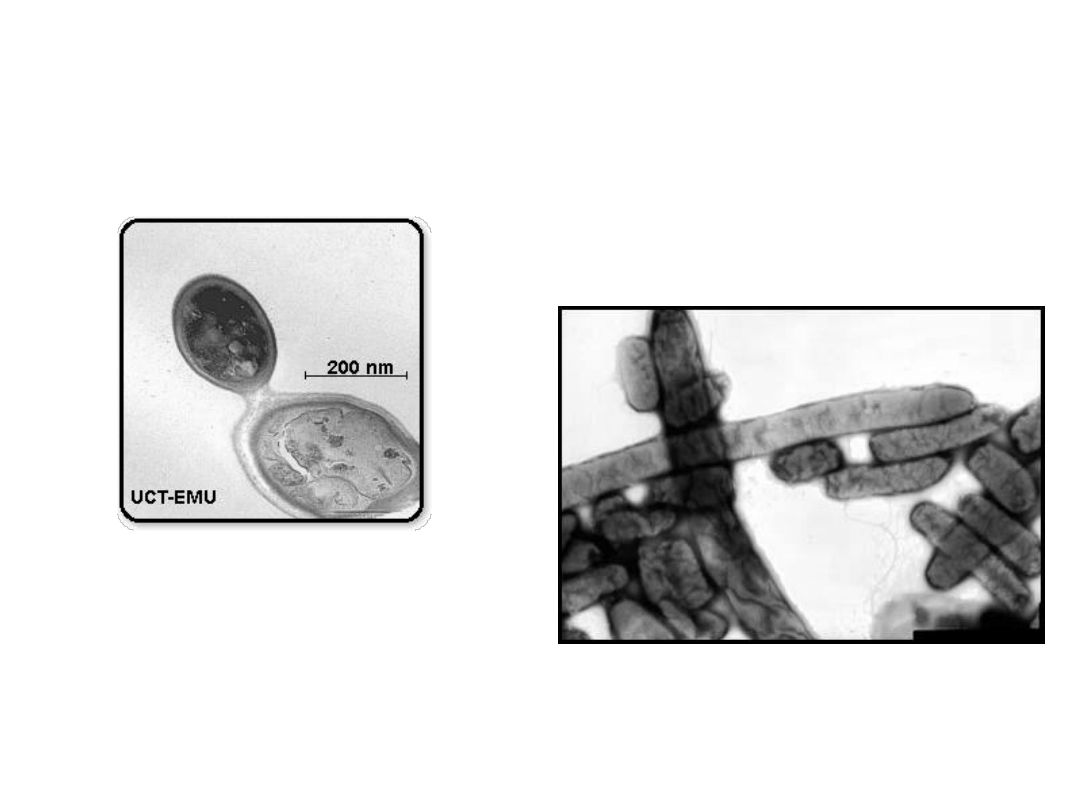
Obrazy z mikroskopu transmisyjnego
Salmonella sp.
pączkujące drożdże(przekrój)

Obrazy z mikroskopu skaningowego
Enterococcus faecalis
Bacillus anthrax

Typ mikroskopu
Oświetlenie
preparatu
Obraz
Zdolność
rozdzielcza
Powiększenia
świetlny
światło
widzialne
światło widzialne
(okular)
0.2 μm
5–1 500 x
fluorescencyjny
ultrafiolet
światło widzialne
(okular)
0.2 μm
5–1 500 x
elektronowy
transmisyjny
strumień
elektronów
światło widzialne
(ekran fluoresc.)
0.2- 1 nm
1000-500 000
elektronowy
skaningowy
strumień
elektronów
elektroniczny
(monitor)
3-10 nm
100-50 000 x
tunelowy
prąd
elektryczny
elektroniczny
(monitor)
001-0.1 nm
10 000 000 x
Wyszukiwarka
Podobne podstrony:
kk, ART 275 KK, Wyrok z dnia 16 lutego 2011 r
9 16 12 2011 grammaire descrip Nieznany (2)
5 16 marca 2011 Morfologia grz Nieznany
9 16 12 2011 grammaire descrip Nieznany (2)
5 16 marca 2011 Morfologia grz Nieznany
16 Ustalanie wyniku finansowego Nieznany (2)
LaboratoriumProcesorySygnaloweW Nieznany
LaboratoriumPodstawAutomatyki D Nieznany
2 23 lutego 2011 Izolowanie mikroorganizmów z różnych środowisk naturalnych
16 Wspieranie osoby niepelnospr Nieznany (2)
chemia kliniczna cw 1 2011 id Nieznany
Wstęp do filozofii 24 lutego 2011, Nauka, Kulturoznawstwo, Semestr II
MSR MSR 16 Rzeczowe aktywa trwa Nieznany
16 Wytwarzanie podstawowych pol Nieznany (2)
16 Rozpoznawanie stanow biologi Nieznany
16 rozdzial 15 EJCDLTJY3F3I2FKL Nieznany (2)
16 rozdzial 15 zpgg3d2etikxyjv3 Nieznany
lista nr5 EKONOMETRIA1 2011 12 Nieznany
więcej podobnych podstron