Test
1. Znaczenie 11-cis retinalu (pochodnej witaminy A) w procesie widzenia można
scharakteryzować następująco:
a) ważna jest zmiana konformacji jednego wiązania podwójnego
b) ważne jest utworzenie zasady Schiffa z jedną z reszt treoniny w rodopsynie
c) ważne jest utworzenie zasady Schiffa z jedną z reszt seryny białka opsyny
d) dobra rozpuszczalność w wodzie umożliwia szybkie przekazywanie impulsów do mózgu
e) ważna jest zmiana konfiguracji jednego wiązania podwójnego
2. Która z wymienionych modyfikacji zmniejsza wrażliwość łańcucha polirybonukleotydowego
na alkalia (wysokie pH):
a) deaminacja adeniny do hipoksantyny
b) depurynacja
c) rozerwanie wiązania fosfodiestrowego
d) metyalcja grupy 2’-OH rybozy
e) przekształcenie urydyny w pseudourydynę
3. Z wymienionych związków: I. 2,3-butandiol, II. kwas 2-bromo-2-chloropropionowy, III.
rybitol, IV. galaktoza, V. kwas mezowinowy optycznie czynne są:
a) II i IV
b) II, III i V
c) I
d) II i III
e) żaden
4. Ogrzanie układu spowoduje, że dla podanej reakcji chemicznej:
N
2
+ 3H
2
2NH
3
ΔH<0
a) wartość stałej równowagi nie zmieni się a wydajność reakcji wzrośnie
b) wartość stałej równowagi i wydajność reakcji zmaleją
c) wartość stałej równowagi i wydajność reakcji pozostaną bez zmian
d) wartość stałej równowagi i wydajność reakcji wzrosną
e) wartość stałej równowagi wzrośnie a wydajność reakcji zmaleje
5. Obniżenie pH w roztworze spowoduje wzrost rozpuszczalności następujących soli:
a) AgHCO
3
, BaSO
4
, Ag
2
HPO
4
, BaS
2
O
3
b) Ag
2
C
2
O
4
, BaS
2
O
3
, Ag
2
HPO
4
, BaCl
2
c) AgCl, AgSCN, Ba(HCO
3
)
2
, CH
3
COOAg, BaHPO
4
d) AgCl, BaHPO
4
, AgHCO
3
, BaS
2
O
3
e) CH
3
COOAg, BaHPO
4
, AgHCO
3
, BaS
2
O
3
6. Dimeryczny produkt hydrolizy kwasu hialuronowego
a) skręca płaszczyznę światła spolaryzowanego i ma właściwości redukujące
b) nie wykazuje czynności optycznej i nie ma właściwości redukujących
c) ma właściwości redukujące, ale nie wykazuje czynności optycznej
d) skręca płaszczyznę światła spolaryzowanego, ale nie ma właściwości redukujących
e) nie ma właściwości redukujących , ale wykazuje czynność optyczną
7. Stan uprotonowania grupy funkcyjnej w jonie obojnaczym peptydu o nazwie
waliloglutamylocysteinylolizyna (w innym teście – waliloglutaminylocysteinylolizyna) może
przedstawić następująco:
a) COO
-
, COO
-
, SH, NH
3
+
, NH
3
+
b) COO
-
, S
-
, NH
3
+
, NH
2
c) COO
-
, COOH, SH, NH
3
+
, NH
2
d) COO
-
, S
-
, NH
3
+
, NH
3
+
e) COO
-
, COOH, S
-
, NH
3
+
, NH
3
+
8. W ceramidzie kwas nerwonowy połączony jest ze sfingozyną wiązaniem:
a) glikozydowym
b) estrowym
c) amidowym
d) peptydowym
e) bezwodnikowym
9. Podwyższenie temperatury sprzyja destabilizacji podwójnej helisy DNA przez:
a) odpychanie reszt fosforanowych
b) niszczenie wiązań wodorowych
c) hydrolizę wiązań fosfodiestrowych
d) redukcję reszt deoksyrybozy
e) zmianę konfiguracji wiązań N-glikozydowych
10. Istnienie równowagi Gibasa-Donnana w organizmie powoduje:
a) wzrost stężenia tlenu w tkankach intensywnie metabolizujących
b) spadek pH krwi przy obniżeniu stężenia kwasów tłuszczowych
c) wędrówka koloidów przez błonę półprzepuszczalną w celu wyrównania ciśnień
d) wyrównanie liczby cząsteczek białka po obu stronach błony półprzepuszczalnej
e) różnice w składzie elektrolitów przestrzeni śródmiąższowej i elektrolitów osocza
11. Reakcji spalania glukozy w tlenie towarzyszy zmiana entalpii swobodnej równa -2872
kJ/mol. Ta sama reakcja w organizmie:
a) ma niższą zmianę entalpii swobodnej, ze względu na obecność enzymów
b) ma wyższą zmianę entalpii swobodnej, ze względu na obecność enzymów
c) nie jest procesem samorzutnym, jeżeli nie katalizują jej enzymy
d) przebiega wieloetapowo, a sumaryczna zmiana entalpii swobodnej jest taka sama
e) przebiega bez zmiany entropii
12. Po 10-krotnym rozcieńczeniu roztworu NaOH o stężeniu 0,1 mol/dm
3
:
a) pH roztworu zmaleje, a wartość iloczynu jonowego wody nie zmieni się
b) pH roztworu wzrośnie, a wartość iloczynu jonowego wody nie zmieni się
c) wartości pH i iloczynu jonowego wody wzrosną
d) pH roztworu zmaleje, a wartość iloczynu jonowego wody wzrośnie
e) pH roztworu i wartość iloczynu jonowego wody nie zmienią się
13. Wszystkie związki wędrowały do anody w czasie elektroforezy prowadzonej w buforze o
pH=9. Dla której z grupy związków jest to zdanie prawdziew:
a) kwas neuroaminowy, melatonina, oligonukleotyd: 5’–ATTTAATAT–3’
b) dipeptyd AspGlu, cholina, kwas winowy
c) witamina A, guanidyna, oligonukleotyd: 5’–GCCCGCGG–3’
d) kwas bursztynowy, oligonukleotyd: 5’–GCAATCGG–3’, kwas N-acetylonuroaminowy
e) 2-deoksy-2-amino-N-acetylo-α-D-glukopiranoza, inozytol, kwas fumarowy
14. Który z podanych poniżej kwasów ma najniższą wartość pK
a
:
a) CH
3
CHClCH
2
COOH
b) CH
3
CH
2
CHClCOOH
c) CH
3
(CH
2
)
3
COOH
d) CH
3
CH
2
CH
2
COOH
e) CH
3
CH
2
CCl
2
COOH
15. Jedną z modyfikacji posttranslacyjnych łańcucha polipeptydowego, która prowadzi do
zniesienia ładunku dodatniego aminokwasu jest:
a) fosforylacja
b) acetylacja
c) dekarboksylacja
d) hydroksylacja
e) O-glikozylacja
16. Stereoizomery i odmiany konformacyjne różną się energią. W której(ych) z poniższych par
steroizomerów lub konformerów zaznaczono właściwe różnice energii:
1/ C
2
H
6
odmiana naprzemianległa < naprzeciwległa
2/ glukoza odmiana łódkowa < krzesełkowa
3/ CHBr=CHBr cis < trans
a) w żadnej
b) w 2
c) w 1 i 3
d) tylko w 1
e) tylko w 3
17. Jeżeli do 1M roztworu szczawianu sodu dodamy równą objętość 1M azotanu baru, to
ciśnienie osmotyczne powstałego roztworu względem wody:
a) będzie wyższe od ciśnienia roztworu wyjściowego
b) nie zmieni się, gdyż roztwory mają to samo stężenie cząsteczek osmotycznie czynnych
c) będzie niższe od ciśnienia roztworu wyjściowego
d) nie zmieni się gdyż ciśnienie osmotyczne zależy tylko od temperatury
e) nie można odpowiedzieć na to pytanie
18. Które z poniższy zdań jest prawdziwe:
a) inozytol jest związkiem heterocyklicznym
b) jest monosacharydem wchodzącym w skład fosfatydyloinozytoli
c) inozytol tworzy wiązanie eterowe z kwasem fosfatydowym
d) inozytol należy do wielowodorotlenowych alkoholi cyklicznych
e) płaska struktura inozytolu umożliwia interkalację pomiędzy zasady azotowe DNA
19. Jony obojnacze aminokwasów są jonami amfiprotycznymi, co oznacza, że w określonych
reakcjach mogą odłączyć, a w innych przyłączyć proton. Dwa protony mogą zostać
odłączone od jonu obojnaczego:
a) kwasu glutaminowego, cysteiny, tyrozyny
b) argininy, lizyny, histydyny
c) kwasu glutaminowego , kwasu asparaginowego, histydyny
d) tyrozyny, cysteiny, histydyny
e) metioniny, argininy, lizyny
20. Które z poniższych zdań jest prawdziwe:
a) acetamid w roztworze wodnym jest zawsze uprotonowany
b) acetamid jest uprotonowany tylko w pH poniżej 5
c) w acetamidzie wszystkie atomy węgla, tlenu, azotu leżą w jednej płaszczyźnie
d) acetamid jest amidem acetonu
e) acetamid należy do niebiałkowych aminokwasów
21. Standardowa entalpia i entropia dla procesu rozpuszczania NaCl w wodzie wynoszą
odpowiednio +3,9 kJ i 42,9 J/K
a) proces jest samorzutny w standardowych warunkach
b) proces ten nie przebiega samorzutnie w warunkach 298K
c) proces jest endotermiczny i przez to nie jest samorzutny
d) proces ten jest endoergiczny i przez to nie jest samorzutny
e) procesowi temu towarzyszy wzrost entalpii i spadek entropii
22. Z podanych oligonukleotydów identyczną sekwencję komplementarną ma:
a) pGpCpG
b) pApT
c) pApTpT
d) pTpApA
e) pCpA
23. „Może powstać z glukozy w wyniku utleniania I-rzędowej grupy alkoholowej.”
Powyższe zdanie może opisywać jeden ze składników:
a) celulozy
b) amylopektyny
c) glikogenu
d) amylozy
e) chondroityny
24. Reszty asparaginy w łańcuchu polipeptydowym mogą stabilizować jego strukturę III-
rzędową dzięki tworzeniu wiązań:
a) hydrofobowych
b) kowalencyjnych
c) jonowych
d) wodorowych
e) peptydowych
25. Wartość ΔG < -40 kJ/mol reakcji chemicznej oznacza, że:
a) stała równowagi i wydajność reakcji są niskie
b) w stanie równowagi substraty przeważają nad produktami
c) reakcja przebiega z niską wydajnością
d) stała równowagi reakcji ma wartość ujemną
e) stała równowagi ma dużą wartość i reakcja przebiega z dużą wydajnością
26. Które z wiązań wodorowe czy van der Waalsa powstanie między:
1/ dwoma atomami wodoru związanymi z atomami węgla
2/ atomem azotu a atomem wodoru związanym z atomem węgla
3/ atomem azotu a atomem wodoru związanym z atomem tlenu
a) 1/ van der Waalsa 2/ wodorowe 3/ wodorowe i van der Waalsa
b) we wszystkich pytaniach wodorowe
c) 1/ van der Waalsa 2/ van der Waalsa 3/ wodorowe i van der Waalsa
d) 1/ wodorowe i van der Waalsa 2/ wodorowe 3/ wodorowe i van der Waalsa
e) we wszystkich przypadkach wodorowe i van der Waalsa
27. Strukturę cholesterolu można scharakteryzować następująco:
a) składa się z 4 pierścieni heterocyklicznych, z których jeden zawiera grupę alkoholową
b) składa się z 3 nienasyconych pierścieni, jednego pierścienia nasyconego i zawiera jedną
grupę alkoholową
c) jest związkiem aromatycznym zawierającym grupę alkoholową
d) składa się z 4 pierścieni, z których jeden zawiera wiązanie podwójne, inny zawiera
grupę alkoholową
e) składa się z 4 pierścieni leżących w jednej płaszczyźnie i wystających poza tę
płaszczyznę podstawników, do których należy m.in. grupa alkoholowa
28. Podwójna helisa zbudowana jest 1) zbudowana jest z dwóch komplementarnych łańcuchów
2) różniących się między sobą konfiguracją wiązań N-glikozydowych. 3) Te komplementarne
łańcuchy są określane jako antyrównoległe. Z podanych informacji opisujących strukturę B-
DNA prawdziwe są:
a) 1 i 2
b) 2 i 3
c) 1 i 3
d) wszystkie
e) żadne
29. Produktami organicznej (krótkotrwałej) hydrolizy substancji są oligosacharydy celobioza i
glukoza. Oznacza to, że hydrolizie poddano:
a) glikolipid
b) maltozę
c) laktozę
d) celulozę
e) amylozę
30. W którym z poniższych zestawień związków organicznych znajdują się wyłącznie cząsteczki,
których atomy węgla leżą w jednej płaszczyźnie:
a) benzen, hydrochinon, piran, 1,2–butadien
b) hydrochinon, pirydyna, 1,3-butadien, fenol
c) fenol, 1,2-butadien, benzen, piran
d) 1,2-butadien, 1,3-butadien, pirydyna, benzen
e) fenol, mleczan, hydrochinon, pirydyna
31. W następujących reakcjach redoks:
2I
-
+ H
2
O
2
+ 2H
+
I
2
+ H
2
O
8H
+
+ Cr
2
O
7
2-
+ 3H
2
O
2
2Cr
3+
+ 3O
2
+ 7H
2
O
nadtlenek wodoru pełni rolę:
a) w obu utleniacza
b) w obu reduktora
c) katalizatora
d) w pierwszej utleniacza, w drugiej reduktora
e) w pierwszej reduktora, w drugiej utleniacza
32. O amidzie kwasu tioeterowego (AKT) możemy powiedzieć, że:
a) posiada odmiany konformacyjne i według teorii Brönsteda jest kwasem
b) posiada odmiany konformacyjne i według teorii Brönsteda nie jest ani kwasem, ani
zasadą, ani związkiem amfiprotycznym
c) nie posiada odmian konformacyjnych i według teorii Brönsteda jest zasadą
d) posiada odmiany konformacyjne i według teorii Brönsteda jest związkiem
amfiprotycznym
e) nie posiada odmiany konformacyjne i według teorii Brönsteda jest zasadą
33. W cząsteczkach peptydów można odnaleźć fragmenty zawierające atomy leżące w jednej
płaszczyźnie. W peptydzie o sekwencji ProTyrLys liczba takich niezależnych płaszczyzn, z
których każda zawiera przynajmniej 6 atomów, jest równa:
a) 3
b) 2
c) 1
d) 4
e) brak takich płaszczyzn
34. Układy biologiczne są układami otwartymi. Oznacza to, że:
a) możliwe są tylko procesy egzotermiczne
b) układy te wymieniają z otoczeniem zarówno masę jak i energię
c) możliwe są tylko reakcje które prowadzą do wzrostu nieuporządkowania układu
d) przy stałej temperaturze zmiana entropii nie ma znaczenia dla samorzutności procesów
w nich zachodzących
e) układy te wymieniają energię a nie wymieniają masy
35. Który z wymienionych kwasów ma najwięcej izomerów optycznych :
a) kwas winowy
b) kwas mlekowy
c) kwas β-hydroksymasłowy
d) kwas jabłkowy
e) kwas α-ketoglutarowy
36. Wyższa pojemność buforu wodorowęglanowego w osoczu niż w zlewce wynika
a) z możliwości wytrącania nadmiaru węglanu w postaci nierozpuszczalnych soli
b) z odwracalnej wędrówki jonów sodowych i chlorkowych przez błonę erytrocytu
c) z wysokiego stężenia obu składników buforu : CO
2
i H
2
CO
3
w osoczu
d) z utrzymania pH osocza w pobliżu wartości pK
2
kwasu węglowego
e) ze zdolności usuwania nadmiaru CO
2
w płucach i HCO
3
-
w nerkach
37. Wolne pary elektronów w orbitalach sp
3
występują w cząsteczkach:
a) amoniaku i wody
b) metanu i chloroformu
c) acetylenu i wody
d) metanu i etanu
e) amoniaku i metanu
38. W roztworze znajdują się pirogronian, mleczan, acetooctan i β-hydroksymaślan w
stężeniach 1 mol/dm
3
. Która reakcja jest termodynamicznie najbardziej prawdopodobna,
jeżeli E
o
(pirogronianomleczan) = - 0,19 V, E
o
(hydroksymaślan) = -0,29V:
a) mleczan+ pirogronian acetooctan + β-hydroksymaślan
b) acetooctan + β-hydroksymaślan mleczan i pirogronian
c) mleczan + acetooctan pirogronian + β-hydroksymaślan
d) pirogronian + β-hydroksymaślan mleczan + acetooctan
e) nie jest możliwa żadna reakcja w tym roztworze
39. Płyn Tyrade’a o składzie 0,8% NaCl, 0,029% CaCl
2
, 0,02% KCl, 0,1% NaHCO
3
, 0,01%
glukoza, 0,01% MgCl
2
, 0,005% NaH
2
PO
4
w stosunku do surowicy, której ciśnienie
osmotyczne mieści się w przedziale 709-810 kPa
a) jest hipotoniczny ale izojonowy
b) jest izotoniczny ale nie jest izojonowy
c) jest izojonowy ale nie jest izotoniczny
d) jest izotoniczny i izojonowy
e) nie jest ani izojonowy ani izotoniczny
40. Białko Y wiąże się z białkiem X i powstaje kompleks XY. W komórce, w stanie równowagi
stężenie białka Y wynosi 1μmol, białka X 1μmol, a kompleksu XY również 1μmol. Stała
równowagi reakcji X + Y XY wynosi:
a) 1
b) 10
-6
c) 10
6
d) ½
e) 2
41. Poniższy wzór przedstawia:
CH
2
CH
2
∙SO
3
-
|
NH
3
+
a) homocysteinę
b) taurynę
c) cytrulinę
d) homoserynę
e) kwas homocysteinsulfonowy
42. Wiązania hydrofobowe:
a) należą do silnych oddziaływań elektrostatycznych
b) są odpowiedzialne za dobrą rozpuszczalność etanolu w wodzie
c) stabilizują strukturę III-rzędową białek
d) powstają między cząsteczkami wody i lipidów
e) ulegają rozerwaniu pod wpływem soli metali ciężkich
43. Tkanka kostna zbudowana jest zbudowana jest z części mineralnej i organicznej
zawierającej głównie kolagen. Do nierozpuszczalnych w wodzie składników nieorganicznych
należy hydroksyapatyt zbudowany z:
a) jonów wapniowych, fosforanowych i wodorotlenkowych
b) jonów potasowych, wapniowych i fosforanowych
c) jonów sodowych, fluorkowych i wodorotlenkowych
d) jonów hydroniowych, wapniowych i fosforanowych
e) jonów wapniowych, węglanowych i szczawianowych
44. Rozmieszczenie cząsteczek w lipoproteinie LDL jest następujące:
a) trójgliceryd i wolny cholesterol znajdują się wewnątrz, a białka, estery cholesterolu i
fosfolipidy na powierzchni
b) trójglicerydy i estry cholesterolu znajdują się wewnątrz, a białka, wolny cholesterol i
fosfolipidy na powierzchni
c) trójglicerydy, wolny i związany cholesterol znajdują się wewnątrz, a białka i i fosfolipidy
na powierzchni
d) wolny i związany cholesterol znajdują się wewnątrz, a białka, trójglicerydy i fosfolipidy
na powierzchni
e) trójglicerydy, fosfolipidy i wolny cholesterol znajdują się wewnątrz, a białka i estry
cholesterolu na powierzchni
45. Z których roztworów po wymieszaniu ich równych objętości powstanie bufor o największej
pojemności buforowej:
a) 0,1M K
2
HPO
4
i 0,05M HCl
b) 0,1M K
2
HPO
4
i 0,06M KH
2
PO
4
c) 0,1M K
2
HPO
4
i 0,1M KCl
d) 0,1M K
2
HPO
4
i 0,1M NaH
2
PO
4
e) żadna z mieszanin nie będzie miała właściwości buforu
46. Przekształceniu mleczanu w pirogronian towarzyszy zmiana stopnia utlenienia jednego z
atomów węgla:
a) z -1 na +1
b) z 0 na +2
c) z 0 na +1
d) z +1 na -1
e) z +2 na 0
47. Następujące związki są parami izomerów strukturalnych:
a) walina i leucyna, fenyloalanina i tyrozyna, kwas izomasłowy i kwas masłowy
b) izoleucyna i leucyna, cysteina i homocysteina, cytrulina i arginina
c) alanina i β-alanina, izoleucyna i leucyna, kwas masłowy i kwas izomasłowy
d) ornityna i lizyna, melatonina i tryptofan, kwas masłowy i kwas izomasłowy
e) walina i izoleucyna, kwas masłowy i kwas izomasłowy, alanina i β-alanina
48. Symetrią kulistą charakteryzuje się orbital typu:
a) sp
2
b) p
c) sp
3
d) s
e) sp
49. Witaminę C można scharakteryzować następująco:
a) uczestniczy w procesach oksydacyjnych komórki utleniając się do kwasu askorbinowego
b) jest kwasem L-askorbinowym, w komórce ulegającym redukcji do aldehydu L-
askorbinowego
c) jest rozpuszczalna w tłuszczach ze względu na zdecydowaną przewagę reszt
hydrofobowych
d) jej grupa endiolowa utlenia się, w wyniku czego powstaje kwas L-dehydroaskorbinowy
e) ma silne właściwości redukujące dzięki obecności wolnej grupy aldehydowej
50. cis-platyna jest lekiem przeciwnowotworowym. U podłoża działania tego leku leży:
a) powstawanie wiązań kowalencyjnych z cząsteczką DNA
b) tworzenie kompleksów z onkogennymi kinazami tyrozynowymi
c) powstawanie kompleksów interkalacyjnych z cząsteczką DNA
d) tworzenie kompleksów w rowku większym DNA
e) żaden z wymienionych mechanizmów
51. Który ze związków zawiera więcej niż jeden atom w stanie hybrydyzacji sp
2
:
a) leucyna
b) lizyna
c) kwas glukuronowy
d) kwas rybonowy
e) cysteina
52. Do związków heterocyklicznych zawierających azot w pierścieniu należą:
a) piran, pirol, pirydyna, puryna
b) imidazol, puryna, piran, pirymidyna
c) piran, pirymidyna, pirydyna, puryna
d) indol, pirol, pirydyna, pirymidyna
e) indol, imidazol, puryna, piran
53. W którym z poniższych roztworów Mg(OH)
2
będzie miał największą rozpuszczalność:
a) 0,1M NaOH
b) 0,1M CH
3
COONa
c) woda
d) 0,1M NH
4
Cl
e) 0,1M HCl
54. Reszta aminokwasu w AMP jest połączona z AMP wiązaniem:
a) amidowym
b) peptydowym
c) estrowym
d) bezwodnikowym
e) acetalowym
55. Wartość potencjału redoks dla cytochromu a, a
3
E
o
= 0,29V dla temperatury 25°C (pH = 7)
przy stosunku stężeń [Fe
3+
]/[Fe
2+
] = 10 wynosi:
a) 0,29 V
b) 0,231 V
c) 0,349 V
d) -0,29 V
e) -0,12 V
56. „Ma wyjątkowy skład aminokwasowy o dużej zawartości glicyny (do 35%), proliny,
hydroksyproliny, także alaniny, lizyny i hydroksylizyny” – jest to fragment opisu:
a) kolagenu
b) hemoglobiny sierpowatej
c) prionu
d) wazopresyny
e) histaminy
57. Dwa łańcuchy DNA można rozdzielić przez ogrzanie roztworu. W jakiej kolejności ulegną
denaturacji termicznej następujące trzy fragmenty DNA (podano sekwencję tylko nici
kodującej):
1/ 5’–ATAGGTCGTAAGGCC–3’
2/ 5’–ATAGGTCGTAAGGAA–3’
3/ 5’–GCAGGTCGTGAGCGA–3’
a) 3, 1, 2
b) 1, 2, 3
c) 3, 2, 1
d) 1, 3, 2
e) 2, 1, 3
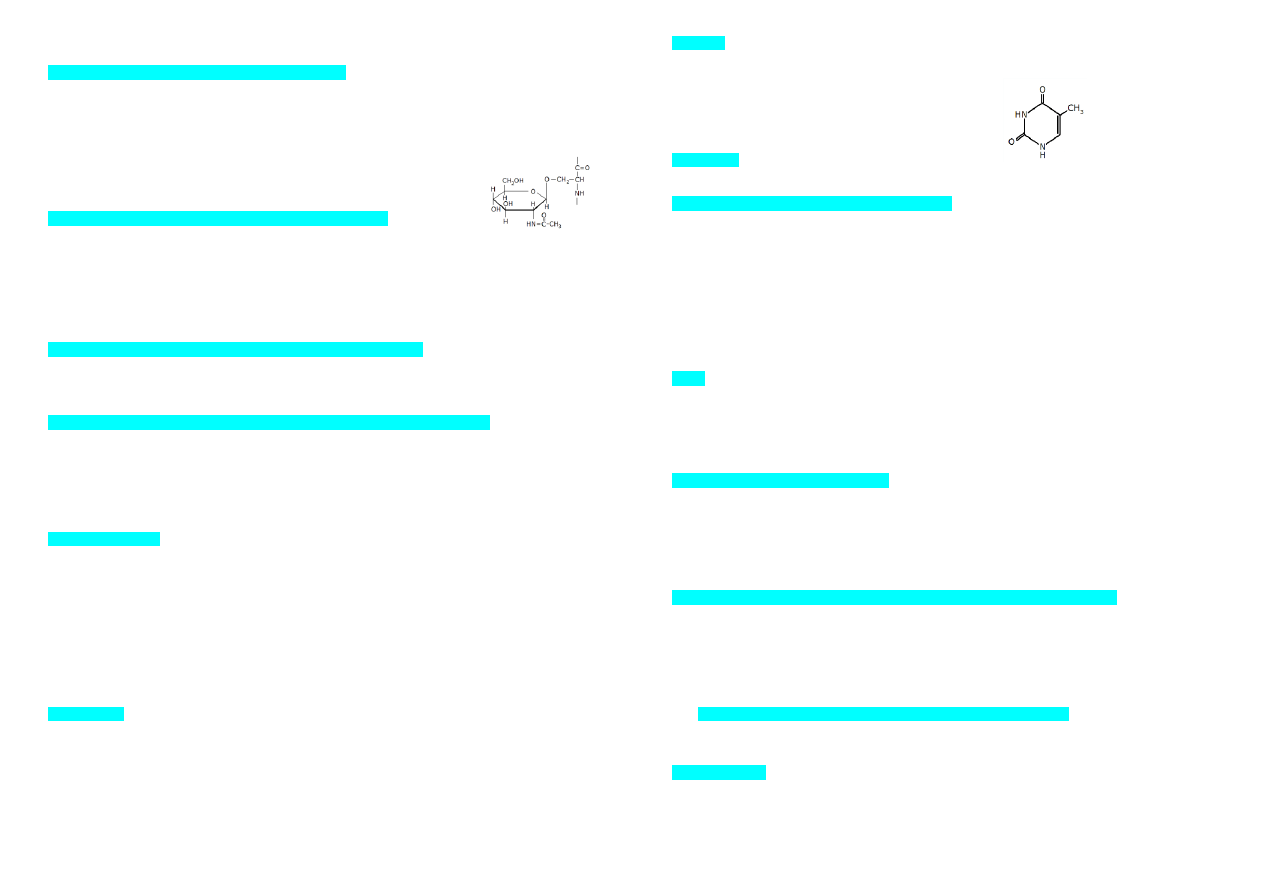
58. Redukcja D-galaktozy prowadzi do sześciowodorotlenowego alkoholu, który jest:
a) mieszaniną dwóch enancjomerów
b) identyczny z produktem redukcji L-galaktozy
c) mieszaniną dwóch ano merów
d) optycznie czynnym diastereoizomerem D-glukozy
e) związkiem, w którym wszystkie grupy –OH znajdują się w konfiguracji D
59. Rysunek obok przedstawia:
a) resztę seryny połączoną wiązaniem O-glikozydowym z heparyną
b) acetalowi połączenie seryny i glukozaminy
c) resztę seryny zmodyfikowaną w procesie glikozylacji
d) resztę alaniny zmodyfikowaną w procesie glikozylacji
e) acetalowi połączenie seryny i N-acetyloglukozaminy
60. Przenośniki elektronów w łańcuchu oddechowym: cytochrom a, a
3
(o,29 V), cytochrom b
(0,10 V), cytochrom c (0,23 V), cytochrom c
1
(0,23 V) (w nawiasach podano wartości E
o
)
uszeregowane są następująco wg kolejności, w której przyłączają elektrony:
a) cytochrom a, a
3
, cytochrom b, cytochrom c, cytochrom c
1
b) cytochrom c, cytochrom a, a
3
, cytochrom b, cytochrom c
1
c) cytochrom a, a
3
, cytochrom c, cytochrom c
1
, cytochrom b
d) cytochrom c
1
, cytochrom a, a
3
, cytochrom b, cytochrom c
e) cytochrom b, cytochrom c, cytochrom c
1
, cytochrom a, a
3
61. Dla reakcji H
2 (g)
+ I
2 (g)
2HI
(g)
wzrost ciśnienia:
a) spowoduje przesunięcie stanu równowagi w kierunku substratów i wzrost stałej
równowagi
b) nie wywoła zmian w wydajności reakcji i nie zmieni stałej równowagi
c) spowoduje przesunięcie stanu równowagi w kierunku produktów i wzrost stałej
równowagi
d) zmniejszy wydajność powstawania HI, ale nie zmieni wartości stałej równowagi
e) zmniejszy wydajność powstawania HI i spowoduje wzrost wartości stałej równowagi
62. Wartości ΔH i ΔS dla reakcji chemicznej wynoszą odpowiednio -94,5 kJ i -189,1 J/K. Stąd
ΔG dla tej reakcji w temperaturze 300 K wyniesie:
a) około -37,8 kJ
b) około -56,8 kJ
c) około -151,2 kJ
d) około 94,6 kJ
e) około 37,8 kJ
63. Poniższy wzór przedstawia:
CH
2
(CH
2
)
2
CHCOO
-
| |
NH
3
+
NH
3
+
a) homocysteinę
b) taurynę
c) ornitynę
d) homoserynę
e) cytrulinę
64. Warunkami koniecznymi do wystąpienia czynności optycznej są:
1/ obecność asymetrycznego atomu węgla
2/ brak symetrii wewnętrznej
3/ obecność węgla o hybrydyzacji sp
Prawdziwe jest:
a) tylko (?)
b) 2 i 3
c) Wszystkie
d) 1 i 2
e) 1 i 3
65. Wzór przedstawia jedną z form tautomerycznych:
a) cytozyny
b) adeniny
c) guaniny
d) uracylu
e) tyminy
66. Wszystkie samorzutne reakcje chemiczne cechuje dążność do:
a) maksymalnej entropii i minimalnej energii
b) minimalnej energii i entropii
c) wzrostu uporządkowania i wzrostu energii
d) maksymalnej entalpii swobodnej
e) redukcji energii i wzrostu uporządkowania
67. Kwasy winowe powstają w wyniku utlenienia aldotetroz. Liczba możliwych stereo izomerów
kwasu winowego wynosi:
a) 2
b) 4
c) 5
d) 6
e) 3
68. Interkalacja wielopierścieniowego układu aromatycznego do podwójnej helisy DNA powoduje
m.in.
a) denaturację DNA
b) rozerwanie wiązań fosfodiestrowych
c) zmiany w strukturze helisy
d) rozerwanie wiązań wodorowych
e) alkilację zasad w DNA
69. Po dodaniu 10 cm
3
amoniaku do 10 cm
3
nasyconego roztworu AgCl nad osadem tej soli:
a) rozpuszczalność i iloczyn rozpuszczalności soli wzrosną
b) rozpuszczalność soli zmaleje, iloczyn rozpuszczalności nie zmieni się
c) rozpuszczalność i iloczyn rozpuszczalności soli zmaleją
d) rozpuszczalność i iloczyn rozpuszczalności soli nie zmienią się
e) rozpuszczalność soli wzrośnie, iloczyn rozpuszczalności nie zmieni się
70. Wyznaczone doświadczalnie wartości R
r
dla dwóch różnych substancji poddanych
chromatografii bibułowej w solwencie n-propanol : woda (3:1) są takie same i wynoszą 0,5.
Który z wniosków jest prawdziwy:
a) obie substancje pozostają w miejscu startu
b) szybkość wędrówki jednej jest równa połowie szybkości wędrówki drugiej
c) obie substancje przesuwają się wraz z czołem rozpuszczalnika
d) zastosowany sol went nie pozwala na rozdział tych substancji
e) obie substancje są nierozpuszczalne w wodzie i n-propanolu
71. Wiązanie β-N-glikozydowe występuje w:
a) guanozynie
b) laktozie
c) N-acetylo-β-D-galaktozaminie
d) sacharozie
e) we wszystkich wymienionych związkach
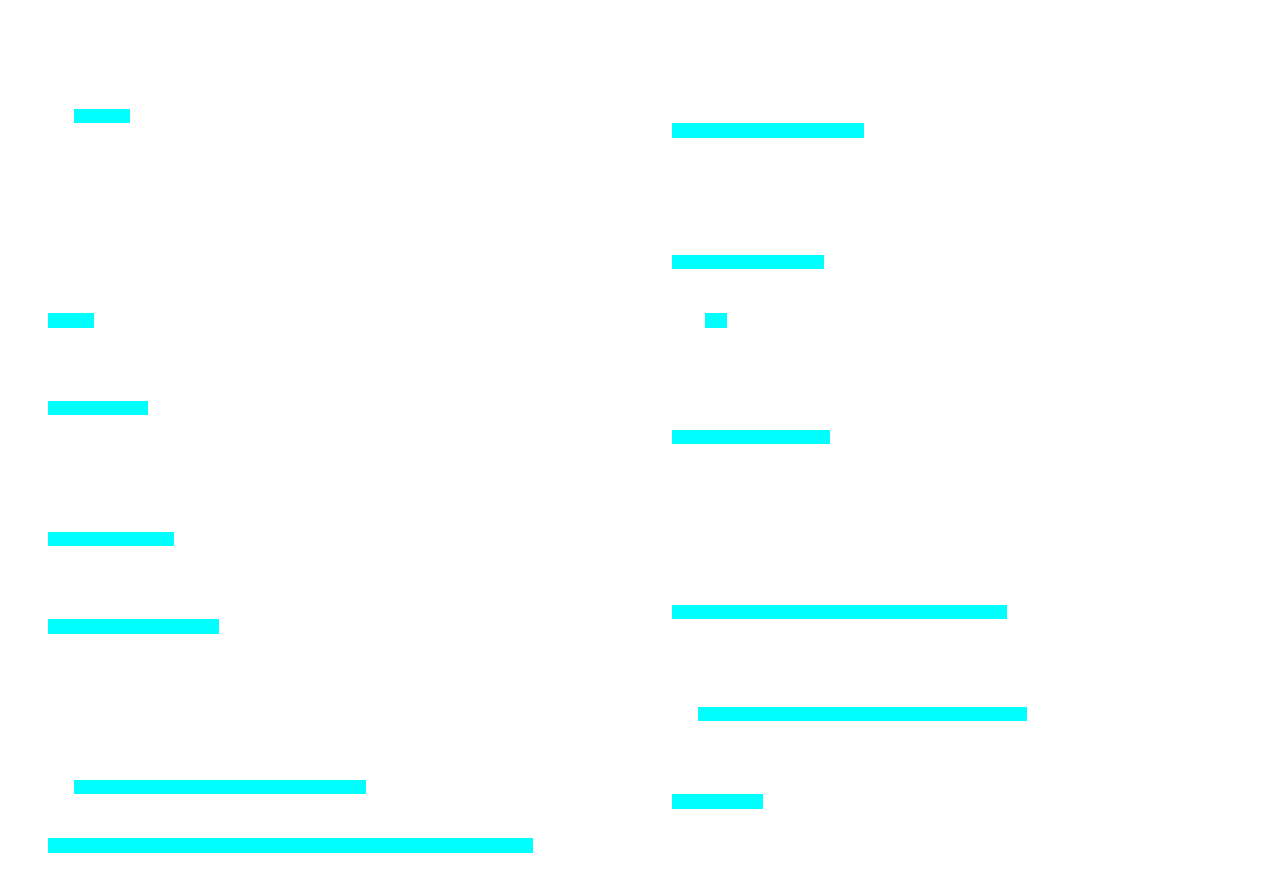
72. Długość rozwiniętego łańcucha DNA z chromosomu 22 człowieka wynosi ok. 1,5 cm.
Zmniejszenie liniowych wymiarów cząsteczki DNA i upakowanie jego łańcucha w
chromosomie jest możliwe dzięki interakcjom z:
a) komplementarnym RNA
b) albuminami
c) hialuronianem
d) histonami
e) glikoproteinami
73. Wartości pK lizyny wynoszą: pK1 = 2,2; pK2 = 9,0; pK3 = 10,5. Forma jonowa aminokwasu
opisana poniższym wzorem występuje w przewadze nad innymi formami w pH równym:
COO
-
|
+
H
3
N – C – H
|
(CH
2
)
4
|
NH
3
+
a) 2,0
b) 10,5
c) 2,4
d) 9,0
e) 9,75
74. Który z podanych kwasów jest związkiem mezo:
a) glukuronowy
b) galaktarowy
c) galakturonowy
d) glukonowy
e) galaktonowy
75. Reszty kwasu fosforowego w ATP połączone są ze sobą wiązaniem:
a) eterowym
b) estrowym
c) N-glikozydowym
d) bezwodnikowym
e) jonowym
76. Dla reakcji redukcji Fe
3+
+ e
-
Fe
2+
E
o
wynosi 0,77 V,
a dla reakcji redukcji MnO
4
-
+ 8H
+
+ 5e
-
Mn
2+
+ 4H
2
O E
o
wynosi 1,51 V. Oznacza to, że w
mieszaninie tych układów w warunkach standardowych:
a) jony żelaza utleniają się
b) jony żelaza ulegają redukcji
c) jony Mn (II) utleniają się
d) w obu przypadkach zachodzi redukcja, gdyż E
o
jest dodatnie
e) w obu przypadkach zachodzi utlenianie, gdyż E
o
jest dodatnie
77. Do biologicznie ważnych aminokwasów niebiałkowych należą m.in.:
a) ornityna, homocysteina, cytrulina, glutation
b) β-alanina, trijodotyronina, histamina, serotonina
c) adrenalina, ornityna, homocysteina, cyrtulina
d) tauryna, histamina, homocysteina, cytrulina
e) ornityna, homoseryna, cytrulina, dijodotyrozyna
78. Moment dipolowy cząsteczki CO
2
jest równy zero, ponieważ cząsteczka ta:
a) jest zbudowana z atomów o jednakowej elektroujemności
b) charakteryzuje się liniowym i symetrycznym ułożeniem centrów atomowych
c) składa się z atomów o różnej elektroujemności
d) zawiera atomy o bliskich liczbach atomowych
e) zawiera atomy pierwiastków należących do tego samego okresu
79. W czasie działania glutationu, dzięki któremu możliwe jest m.in. odtwarzanie grup tiolowych
(-SH) w białkach, w cząsteczce tego peptydu następuje:
a) redukcja grupy karboksylowej kwasu glutaminowego
b) redukcja siarki w cysteinie
c) utlenienie siarki w cysteinie
d) cyklizacja peptydu
e) hydroliza do aminokwasów
80. Denaturację białka przez zniszczenie wiązań wodorowych wywołują:
a) mocznik lub sole metali ciężkich
b) guanidyna lub benzen
c) silne reduktory lub etanol
d) mocznik lub silne reduktory
e) guanidyna lub etanol
81. Wskaż grupę funkcyjną, która sąsiadując w cząsteczce z grupą karboksylową obniża jej
właściwości kwasowe:
a) –CH
3
b) –C
6
H
5
c) –NH
3
+
d) –OH
e) –C=O
82. Która z grup aminokwasów wymienionych poniżej powinna występować najczęściej w
pobliżu środowiska pofałdowanego białka globularnego?
a) Ile, Trp, Leu, Phe, Val
b) Val, His, Lys, Ser, Cys
c) Phe, Arg, Asp, Ile, Val
d) Val, Leu, Ser, Arg, His
e) Glu, Ala, Trp, Asn, Tyr
83. DNA różni się od RNA wrażliwością na działanie zasad. Jest to przede wszystkim
spowodowane tym, że:
a) DNA występuje w konformacji A, a RNA w konformacji B
b) DNA jest nierozpuszczalny w wodzie
c) DNA tworzy podwójną helisę
d) duże fragmenty RNA występują w formie jednoniciowych łańcuchów
e) deoksyryboza nie zawiera grupy –OH przy węglu 2’
84. Za równowagę kwasowo-zasadową osocza krwi odpowiedzialne są bufory:
wodorowęglanowy, wodorofosforanowy i białczany o składzie:
a) H
2
CO
3
/CO
2
H
2
PO
4
-
/HPO
4
2-
H-białczan/białczan
-
b) H
2
CO
3
/CO
2
H
3
PO
4
/PO
4
3-
H-białczan/białczan
-
c) H
2
CO
3
/HCO
3
-
H
3
PO
4
/HPO
4
2-
H-białczan/białczan
-
d) H
2
CO
3
/HCO
3
-
H
2
PO
4
-
/HPO
4
2-
H-białczan/białczan
-
e) HCO
3
-
/CO
2
H
2
PO
4
-
/HPO
4
2-
H-białczan/białczan
-
85. Wiązania N-glikozydowe występujące w glikoproteinach łączą reszty cukrowe z rodnikami
bocznymi:
a) fenyloalaniny
b) asparaginy
c) seryny
d) glicyny
e) tyrozyny
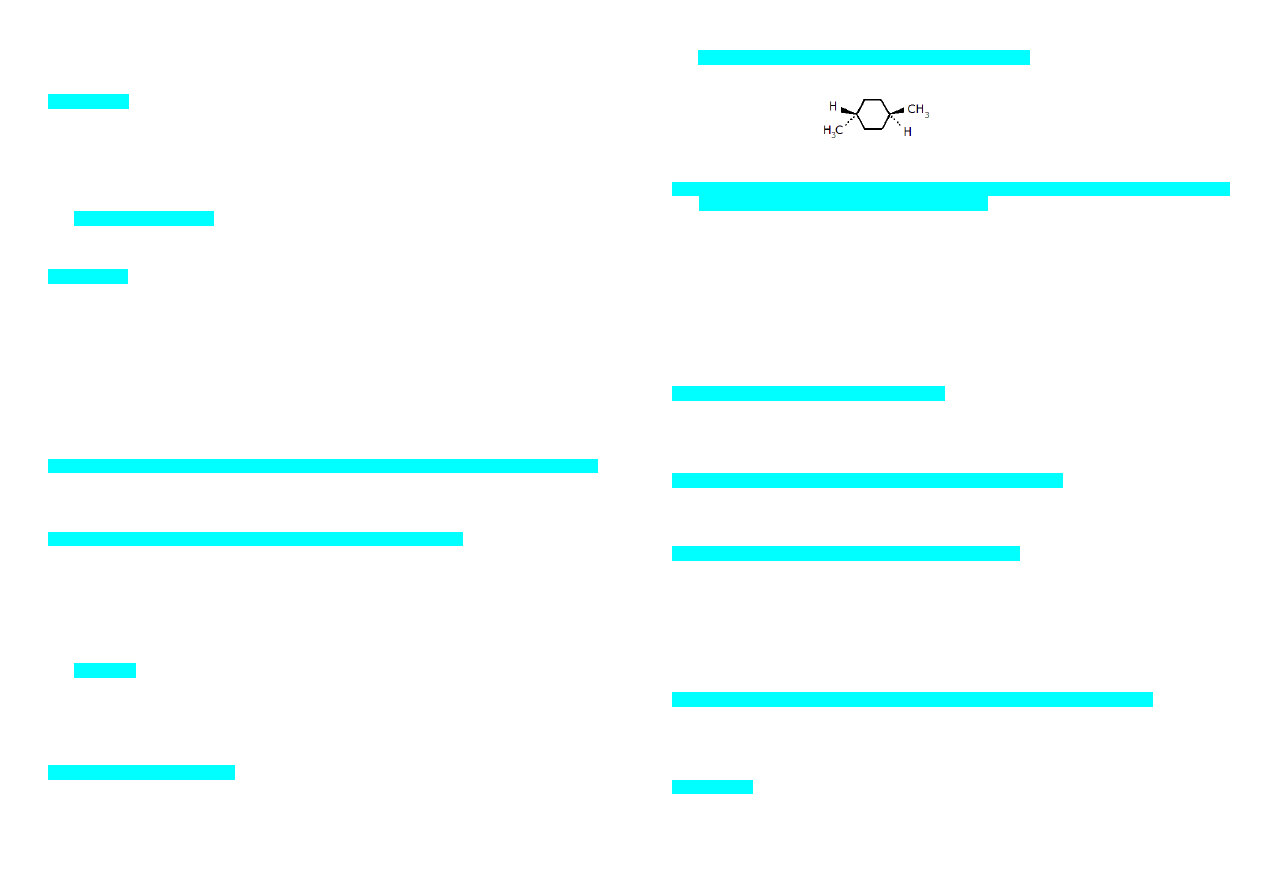
86. Zmydlanie tłuszczów można określić jako proces ich:
a) utleniania
b) redukcji
c) uwodornienia
d) estryfikacji
e) hydrolizy
87. Układ opisany równaniem: A + B AB; ΔH < 0 znajduje się w stanie równowagi. Jeżeli
podwyższymy jego temperaturę, to nowy stan równowagi będzie się charakteryzował:
a) zmniejszeniem stężeń substratów
b) taką samą stałą równowagi
c) zwiększeniem stężenia produktów
d) wyższą stałą równowagi
e) niższą stałą równowagi
88. Struktura pierwszorzędowa DNA stabilizowana jest przez wiązania:
a) estrowe
b) amidowe
c) eterowe
d) wodorowe
e) disiarczkowe
89. Z równowagi Gibbsa-Donnana wynika, że:
a) rozmieszczenie białka po obu stronach błony półprzepuszczalnej nie wypływa na pH i
rozkład jonów
b) pH roztworu buforowego zależy od stężenia buforu
c) osmoza jest wędrówką koloidów przez błonę półprzepuszczalną w celu wyrównania
ciśnień
d) następuje wyrównanie liczby cząsteczek białka po obu stronach błony
półprzepuszczalnej
e) rozkład jonów i pH zależy od stężenia białka po obu stronach błony półprzepuszczalnej
90. Katalizator:
a) przyśpiesza osiągnięcie stanu równowagi i zwiększa stałą równowagi
b) obniża stałą szybkości reakcji i stałą równowagi
c) obniża energię aktywacji i zwiększa szybkość reakcji chemicznej
d) przyśpiesza osiągnięcie stanu równowagi i zwiększa entalpię swobodną
e) obniża energię aktywacji i zwiększa stałą równowagi
91. Wiązania chemiczne łączące dwie komplementarne nici DNA określamy jako:
a) kowalencyjne
b) glikozydowe
c) jonowe
d) metaliczne
e) wodorowe
92. Wzór przedstawia:
O
||
CH
3
– CH
2
– C – NH
2
a) kwas amino propionowy
b) amid kwasu propionowego
c) etyloaminoketon
d) eter etyloaminowy
e) żaden z powyższych związków
93. W którym szeregu prawidłowo wymieniono kwasy wg wzrastających wartości pK:
a) kwas masłowy, pirogronowy, acetooctowy, szczawiowy
b) kwas szczawiowy, acetooctowy, masłowy, pirogronowy
c) kwas masłowy, acetooctowy, pirogronowy, szczawiowy
d) kwas szczawiowy, pirogronowy, acetooctowy, masłowy
e) kwas szczawiowy, pirogronowy, masłowy, acetooctowy
94. Wzór przedstawia:
a) trans-1,4-dimetylocykloheksan, dla którego bardziej stabilna jest konformacja, w której
obie grupy metylowe są w pozycji aksjalnej
b) trans-1,4-dimetylocykloheksan, dla którego bardziej stabilna jest konformacja, w której
obie grupy metylowe są w pozycji ekwatorialnej
c) cis-1,4-dimetylocykloheksan, dla którego bardziej stabilna jest konformacja, w której
obie grupy metylowe są w pozycji ekwatorialnej
d) cis-1,4-dimetylocykloheksan, dla którego bardziej stabilna jest konformacja, w której
obie grupy metylowe są w pozycji aksjalnej
e) cis-1,4-dimetylocykloheksan, który ma dwie równocenne konformacje, z których każda
posaida jedną grupę metylową w pozycji aksjalnej i jedną w pozycji ekwatorialnej
95. Odmiany konformacyjne etanu różnią się między sobą:
a) sposobem połączenia atomów w cząsteczce
b) stanem hybrydyzacji atomów węgla
c) różną ilością wiązań typu sigma
d) konfiguracją cząsteczek
e) ułożeniem atomów wodoru w przestrzeni
96. Wiązanie typu δ (sigma)
a) jest jedynym typem wiązania występującym w cząsteczce C
2
H
4
b) może powstać jedynie w wyniku przenikania się orbitali typu s
c) może powstać jedynie w wyniku przenikania się orbitali typu p
d) jest jedynym typem wiązania występującym w cząsteczce F
2
e) nie może powstać w wyniku nałożenia się orbitali typu s i orbitali typu sp
3
97. Wśród produktów hydrolizy siarczanu chondroityny występują:
a) kwas glukuronowy, N-acetyloglukozamina i kwas siarkowy
b) kwas glukuronowy i siarczan N-acetylogalaktozaminy
c) kwas galakturonowy, N-acetyloglukozamina i kwas siarkowy
d) siarczan kwasu glukuronowego i N-acetyloglukozamina
e) kwas galakturonowy, N-acetylogalaktozamina i kwas siarkowy
98. Glutation jest nietypowym peptydem ponieważ:
a) zawiera cysteinę
b) ulega redukcji z wytworzeniem mostków –S-S-
c) jest tri peptydem
d) zawiera glicynę
e) wiązanie peptydowe tworzy grupa COOH w pozycji γ kwasu glutaminowego
99. Aminokwas, w którego cząsteczce występuje więcej niż jeden atom węgla o hybrydyzacji sp
2
to:
a) leucyna
b) lizyna
c) tryptofan
d) walina
e) cysteina
100. Reszta aminoacylowa wiąże się z grupą hydroksylową w pozycji 3’ rybozy końca pCpCpA
cząsteczki tRNA wiązaniem:
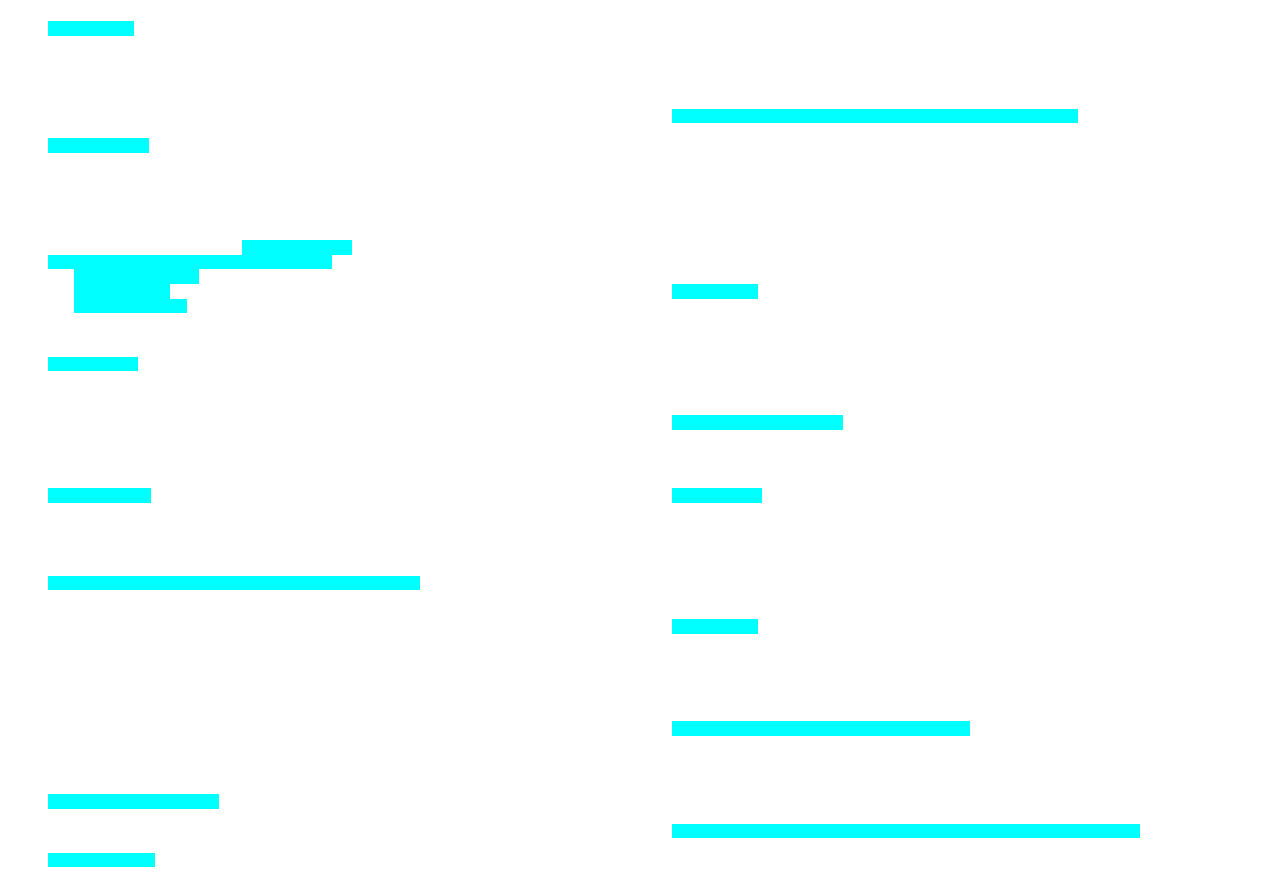
a) estrowym
b) eterowym
c) laktonowym
d) amidowym
e) peptydowym
101. Jedną z modyfikacji łańcucha polipeptydowego, która prowadzi do zniesienia ładunku
dodatniego jest:
a) N-acetylacja
b) fosforylacja
c) O-glikozylacja
d) hydroksylacja
e) dekarboksylacja
102. Posttranslacyjna modyfikacja białek może polegać np. na:
a) acetylacji fenyloalaniny lub fosforylacji seryny
b) glikozylacji seryny lub metyzacji histydyny
c) hydroksylacji proliny lub fosforylacji glutaminy
d) acetylacji lizyny lub γ–karboksylacji alaniny
e) utlenianiu cysteiny lub fosforylacji metioniny
103. Kwas nerwonowy można opisać następująco:
a) 18 : 1, Δ
9
b) 24 : 1, Δ
15
c) 18 : 3, Δ
9,12,15
d) 20 : 3, Δ
5,8,11,14
e) 18 : 2, Δ
9,12
104. Który z podanych związków jest najlepiej rozpuszczalny w wodzie:
a) kwas palmitynowy
b) cholesterol
c) witamina A
d) kwas octowy
e) butan
105. Amfipatyczny charakter lipidów wynika przede wszystkim z występowania w ich
cząsteczkach obok siebie:
a) grup o charakterze anionu (np. fosforanowa) i kationu (np. cholina)
b) fragmentów o charakterze hydrofobowym i hydrofilowym
c) reszt nasyconych i nienasyconych kwasów tłuszczowych o różnym stopniu „sztywności”
d) wiązań o konfiguracji cis i trans
e) grup tworzących wiązania wodorowe
106. Poniższy wzór przedstawia
CH
3
|
CH
3
– C – NH
2
|
H
a) aminę drugorzędową
b) aminę trzeciorzędową
c) aminę czwartorzędową
d) amid
e) aminę pierwszorzędową
107. Synteza wiązania peptydowego wymaga przeprowadzenia aminokwasu w pochodną o
wyższej zawartości energii. Taką pochodną w przypadku glicyny może być:
a) H
3
+
NCH
2
COCl
b) H
3
+
NCH
2
COOH
c) H
2
NCH
2
COOH
d) H
3
+
NCH
2
COO
-
e) H
2
NCH
2
COO
-
108. Bufor wodorowęglanowy w osoczu działa w układzie otwartym. Oznacza to, że
a) pojemność tego buforu jest wyższa niż w układzie zamkniętym
b) w zależności od potrzeb organizmu bufor wodorowęglanowy może być zastąpiony przez
bufor węglanowy
c) bufor ten skutecznie przeciwdziała podwyższaniu pH, które jest wynikiem metabolizmu
tkankowego
d) stężenia obu składników buforu: CO
2
i H
2
CO
3
pozostają stałe wskutek wymiany CO2 z
otoczeniem
e) zdanie to jest nieprawdziwe, gdyż krwioobieg jest układem zamkniętym
109. Przekształcenie bursztynianu w fumaran towarzyszy zmiana stopnia utlenienia atomów
węgla:
a) z -1 na 0
b) z -2 na -1
c) z -2 na 0
d) z -1 na +1
e) z 0 na -1
110. Epimerami D-glukozy są:
a) kwas glukonowy i kwas glukuronowy
b) α-D-glukopiranoza i β-D-glukopiranoza
c) α-D-glukopiranoza iα-L-glukopiranoza
d) D-mannoza i D-fruktoza
e) D-glukoza i L-glukoza
111. LDL i HDL zawierające m.in. cholesterol należą do:
a) glikoprotein
b) lipoprotein
c) heteroglikanów
d) sufatydów
e) nukleoprotein
112.
Jeżeli rozpatrujemy sfingomieliny (1), chondroitynę (2), peptydy (3), to wiązanie
amidowe występuje w:
a) wszystkich wymienionych związkach
b) tylko 1 i 2
c) tylko 1 i 3
d) tylko 2 i 3
e) tylko 3
113.
Według wzrastających właściwości zasadowych uszeregowane są związki:
a) dimetyloamina, cholina, anilina, amoniak
b) amoniak, cholina, etyloamina, dimetyloamina
c) anilina, amoniak, etyloamina, dimetyloamina
d) anilina, etyloamina, dimetyloamina, cholina
e) amoniak, etyloamina, dimetyloamina, cholina
114.
Które ze stwierdzeń dotyczących miareczkowania argininy mocną zasadą jest
nieprawdziwe:
a) w pH = pK pojemność buforowa jest najwyższa
b) w punkcie równoważnikowym 1 (PR
1
) występuje wyłącznie jon obojnaczy
c) pomiędzy PR
1
i pK
2
kation amfiprotyczny jest w przewadze nad jonem obojnaczym
d) w pK
2
kation amfiprotyczny i jon obojnaczy są w równowadze
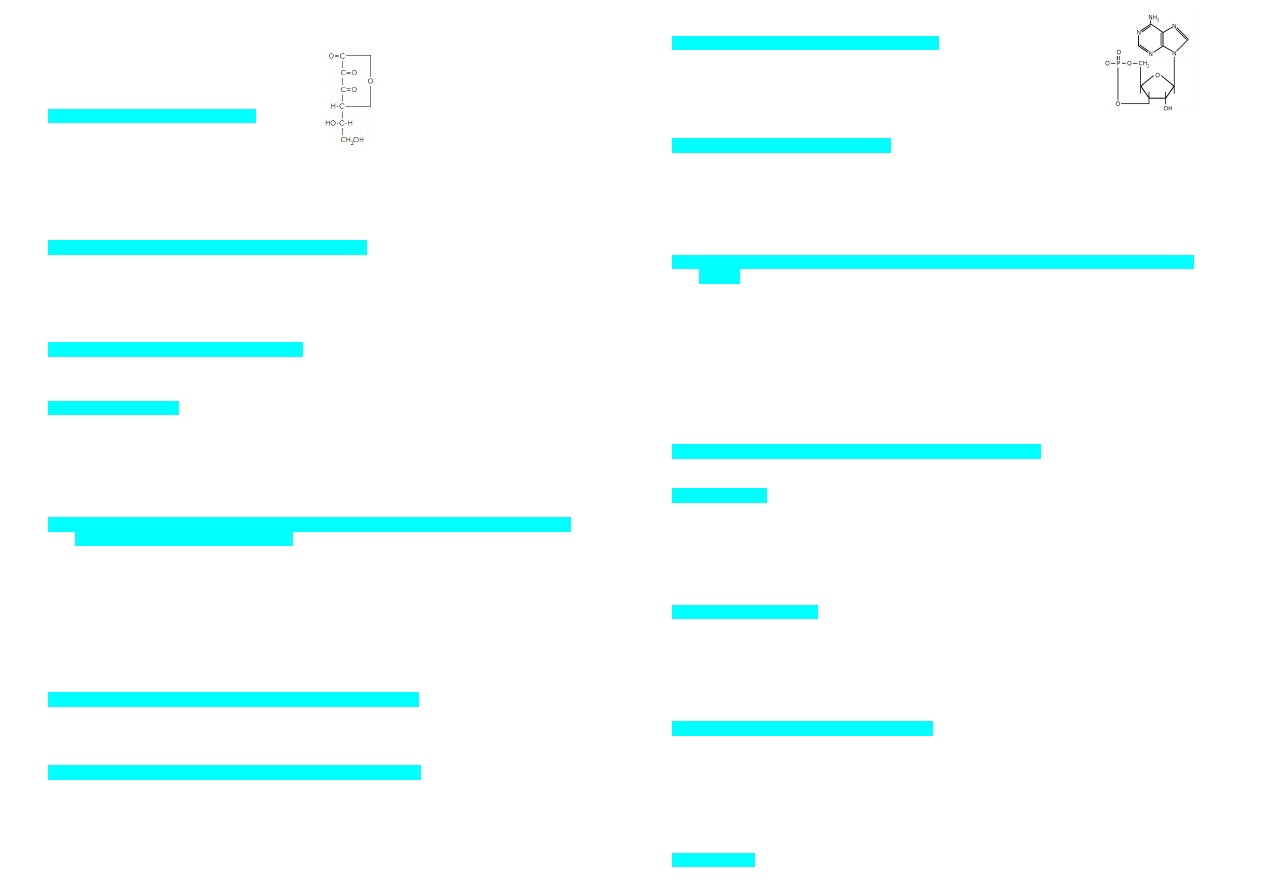
e) pomiędzy PR
2
i pK
3
jon obojnaczy jest w przewadze nad zasadą anionową
115.
Wzór przedstawia
a) produkt redukcji witaminy C
b) kwas L-askorbiniwy
c) kwas D-dehydroaskorbinowy
d) produkt utlenienia witaminy C
e) kwas L deoksyaskorbinowy
116.
Wartości pK kwasu glutaminowego wynszą odpowiednio: 2,2; 4,2 i 9,7. Dla tego
aminokwasu możliwe są m.in. następujące układy buforowe:
a) Glu
0
/Glu
-
w pH ok. 2 oraz Glu
-
/Glu
2-
w pH ok. 10
b) Glu
+
/Glu
0
w pH ok. 2 oraz Glu
-
/Glu
2-
w pH ok. 4
c) Glu
+
/Glu
0
w pH ok. 4 oraz Glu
-
/Glu
2-
w pH ok. 10
d) Glu
0
/Glu
-
w pH ok. 4 oraz Glu
-
/Glu
2-
w pH ok. 2
e) Glu
0
/Glu
-
w pH ok. 4 oraz Glu
-
/Glu
2-
w pH ok. 10
117.
Które z poniższych zdań jest prawdziwe:
a) kwas D-glukuronowy nie ma właściwości redukcyjnych
b) D-fruktoza ma właściwości redukcyjne
c) L-fruktoza ma właściwości redukcyjne
d) L-glukoza nie ma właściwości redukcyjnych
e) D-glukoza ma właściwości redukcyjne
118.
Substancji o nazwie 1,2-dimetylocyklopenten odpowiadają dwa:
a) epimery
b) izomery cis-trans
c) konformery syn-anty
d) ano mery
e) (?)
119.
Jony wapniowe wchłaniają się w górnych odcinkach jelita cienkiego. Które twierdzenie
jest prawdziwe:
a) zmiana pH zupełnie nie wpływa na wchłanianie soli wapnia z przewodu pokarmowego
b) zasadowa terść przewodu pokarmowego powoduje obniżenie rozpuszczalności soli
wapnia, a zatem gorsze wchłanianie
c) podwyższenie pH w tym odcinku jelita powoduje wzrost rozpuszczalności soli wapnia, a
zatem lepsze wchłanianie
d) obniżenie pH w tym odcinku jelita powoduje obniżenie rozpuszczalności soli wapnia, a
zatem gorsze wchłanianie
e) kwaśna treść przewodu pokarmowego powoduje obniżenie rozpuszczalności soli wapnia,
a zatem gorsze wchłanianie
120.
W reakcji MnO
4
-
+ 8H
+
+ 5Fe
2+
Mn
2+
+ 5Fe
3+
+ 4H
2
O nadmanganian
a) jest utleniaczem ze względu na niższy potencjał redoks
b) jest reduktorem ze względu na niższy potencjał redoks
c) jest utleniaczem ze względu na wyższy potencjał redoks
d) jest reduktorem ze względu na niższy potencjał redoks
e) nie uczestniczy w reakcji redukcji i utlenienia
121.
Zasada Schiffa
a) powstaje w wyniku reakcji grupy aldehydowej z aminową
b) tworzy parę sprzężoną z kwasem Schiffa
c) jest płaska ze względu na hybrydyzację atomów węgla
d) powstaje w wyniku hydrolizy rodopsyny
e) jest produktem kondesacji aldolowej
122.
Przedstawiony na rysunku obok związek jest:
a) produktem pośrednim hydrolizy alkilowej/alkalicznej (?) RNA
b) cyklicznym nukleotydem o nazwie cAMP
c) produktem pośrednim hydrolizy alkilowej/alkalicznej DNA
d) produktem pośrednim hydrolizy kwasowej RNA
e) cyklicznym nukleotydem istotnym w procesie (…)
123.
Obniżenie siły jonowej sprzyja destabilizacji podwójnej helisy
DNA ze względu na:
a) odpychanie reszt fosforanowych
b) zrywanie wiązań wodorowych
c) hydrolizę wiązań fosfodiestrowych
d) zmianę konfiguracji wiązań N-glikozydowych
e) redukcję reszt deoksyrybozy
124.
Wskutek istnienia równowagi Gibbsa-Donnana w organizmie:
a) następują zaburzenia w transporcie tlenu
b) w skład elektrolitów przestrzeni śródmiąższowej różni się od składu elektrolitów w
osoczu
c) koloidy wędrują przez błonę półprzepuszczalną w celu wyrówania ciśnień
d) następuje wyrównanie liczby cząsteczek białka po obu stronach błony
półprzepuszczalnej
e) spada pH krwi przy obniżeniu stężenia kwasów tłuszczowych
125.
Podczas elektroforezy mieszaniny kwasu glutaminowego (pI = 5,2) i lizyny (pI = 9,7) w
buforze o pH = 8, aminokwasy te:
a) pozostają w miejscu startu
b) kwas glutaminowy wędruje do katody, a lizyna do anody
c) oba aminokwasy wędrują do katody
d) oba aminokwasy wędrują do anody
e) kwas glutaminowy wędruje do anody, a lizyna do katody
126.
Następująca modyfikacja zwiększa ujemny ładunek cząsteczki białka (?)
a) fosforylacja
b) acetylacja
c) dekarboksylacja
d) metylacja
e) częściowa proteoliza
127.
Wiązania wodorowe decydują o dobrej rozpuszczalności w wodzie wszystkich
wymienionych poniżej grup związków z wyjątkiem:
a) chlorków alkilowych
b) alkoholi
c) amin
d) kwasów karboksylowych
e) monosacharydów
128.
Lakton kwasu D-galaktonowego
a) posiada wiązanie podwójne (?)
b) zawiera atom węgla o hybrydyzacji sp
2
c) jest nieczynny optycznie
d) występuje w postaci odmian anomerycznych
e) ulega (…)
129.
Reszty glutaminy w łańcuchu polipeptydowym mogą stabilizować strukturę
trzeciorzędową dzięki tworzeniu wiązań:
a) hydrofobowych
b) peptydowych
c) jonowych

d) kowalencyjnych
e) (?)
130.
Do opisu położenia pierścienia zasady azotowej w stosunku do pierścienia furanozowego
(deoksy)rybozy w cząsteczkach kwasu rybonukleinowego używa się określenia:
a) cis i trans
b) syn i anty
c) anomer α i β
d) forma łódkowa i krzesełkowa
e) forma (?)
Opisówka
1. Co to jest tautomeria? Wyjaśnij to zjawisko pisząc wzory odmian tautomerycznych
cytozyny. Która z odmian występuje w DNA?
2. Narysuj wzór półstrukturalny cerebrozydu, w skład którego wchodzi reszta kwasu
cerebronowego. Określ rodzaje wiązań, które łąćzą poszczególne składniki oraz zaznacz
fragmenty, które mają charakter hydrofilowy lub hydrofobowy.
3. Napisz równanie syntezy amoniaku z wodoru i azotu, równanie kinetyczne reakcji prostej
oraz wyrażenie na stałą równowagi dynamicznej (ΔH < 0). Czy i jak zmieni się stała
równowagi i szybkość reakcji chemicznej, jeżeli:
a. podwyższymy temperaturę
b. obniżymy ciśnienie?
4. Narysuj wzór D-galaktozy oraz wszystkich produktów utleniania tego cukru (bez zmiany
liczby atomów węgla). We wzorach zaznacz asymetryczne atomy wegla. Które z
narysowanych związków są czynne optycznie? Podaj nazwę jednego diastereoizomery
oraz jednego enencjomeru D-galaktozy.
5. Co to jest struktura III-rzędowa białek. Podaj 3 rodzaje oddziaływań, które ją stabilizują
oraz przykłady aminokwasów, które mogą uczestniczyć w tych oddziaływaniach. Jeden z
przykładów zilustruj odpowiednimi wzorami.
Zadania rachunkowe
1. Ile mg NaH
2
PO
4
potrzeba na przygotowanie 130 g 0,0065 molowego roztworu tej soli o
gęstości
d = 1,02 g/cm
3
(masa at.: Na = 23, O = 16, P = 31)
2. Ile cm
3
1M roztworu CH
3
COOH należy dodać do 150 cm
3
0,1M roztworu CH
3
COONa, aby
otrzymać roztwór buforowy o pH = 4. Stała dysocjacji K
a
= 1,8 ∙ 10
-5
3. Oblicz masę molową pewnego nieelektrolitu, którego 1,5% roztwór (d = 1,04 g/cm
3
) w
temperaturze 20°C wykazuje ciśnienie osmotyczne 258,2 kPa (R = 8,313 kPa∙dm
3
/K∙mol)
4. O ile jednostek zmieni się pH Zn(OH)
2
po dodaniu do 1 dm
3
nasyconego roztworu 82 mg
ZnSO
4
(bez zmiany objętości), gdy iloczyn rozpuszczalności wodorotlenku cynku wynosi
1,1 ∙ 10
-17
Wyszukiwarka
Podobne podstrony:
hiper giełda-i odpowied, lekarski umed łódź, giełdy, 1 rok, chemia
hiper giełda-i odpowiedziidruk, lekarski umed łódź, giełdy, 1 rok, chemia
Chemia Egzamin Odpowiedzi
Chemia fizyczna sprawozdanie (6 1) id 112219
Chemia giełda
chemia fizyczna lab id 112228 Nieznany
Chemia kliniczna kontrola id 11 Nieznany
chemia okiem niechemika id 1126 Nieznany
Klucz odpowiedzi id 236518 Nieznany
odpowiedzibezpieczenstwo id 332 Nieznany
chemia fizyczna egzamin id 1122 Nieznany
chemia maj 2005 id 112453 Nieznany
chemia 13 odpowiedzi
Dowody zalozeniowe nie wprost odpowiedzi id 141384
Poziom podstawowy odpowiedzi(1) id 380127
więcej podobnych podstron