
Numer grupy: 5
Data wykonywania ćwiczenia:
11.10.2009r.
Symbol zespołu: F
Symbol i tytuł ćwiczenia:
Ćwiczenie 6-1
„Wyznaczanie stałej szybkości reakcji pierwszego
rzędu. Wyznaczanie stałej szybkości reakcji
inwersji sacharozy metodą polarymetryczną.”
Sk
ład zespołu:
1)
Głąbikowski Łukasz
2)
Jastrzębska Beata
3) Kalyta Martyna
Ocena wystawiona przez prowadzącego:
1.
CEL ĆWICZENIA:
Celem ćwiczenia jest wyznaczenie stałej szybkości reakcji inwersji sacharozy, oraz
zapoznanie się z metodami pomiaru szybkości reakcji pierwszego rzędu.
2.
WSTĘP TEORETYCZNY
Szybkością reakcji chemicznej nazywamy stosunek zmiany stężenia substratu lub produktu
do czasu, w którym ta zmiana nastąpiła, co możemy zapisać następująco:
Gdzie, c
A
– stężenie substratu A w chwili t
C
X
– stężenie produktu X w chwili t
Reakcją pierwszego rzędu – określamy reakcje, których szybkość wyznaczona
eksperymentalnie jest proporcjonalna do pierwszej potęgi stężenia składnika reagującego.
Równanie kinetyczne dla reakcji I rzędu można zapisać
Gdzie, k
– jest stałą szybkości reakcji róną szybkości reakcji gdy
stężenie substratu jest jednostkowe (wartość charakter. Dla danej
reakcji w danej T)
Po scałkowaniu równania i rozwiązaniu względem k otrzymujemy:
Gdzie, cº
A
– oznacza stężenie początkowe substratu
c
A
– oznacza stężenia substratu po czasie t
SACHAROZA
– jest optycznie czynna i skręca płaszczyzną światła spolaryzowanego w
prawo.
Dwucukier ten ulega w roztworze wodnym hydrolizie wg następującego równania:
C
12
H
22
O
11
+ H
2
O C
6
H
12
O
6
+ C
6
H
12
O
6
Sacharoza
glukoza + fruktoza
Jej produkty natomiast skręcają płaszczyznę światła spol. W lewo stąd też w trakcie reakcji
możemy obserwować zmianę kąta skręcenia światła w polarymetrze (z wartości dodatnich
na ujemne
– czyli inwersję kąta skręcania). Szybkość reakcji hydrolizy sacharozy zależy
dt
dc
dt
dc
v
X
A
A
A
kc
dt
dc
v
A
A
c
c
t
k
ln
1

odjej początkowego stężenia oraz stężenia jonów wodorowych niezbędnych do
zapoczątkowania reakcji (konieczność użycia kwasu).
Mierząc kąt skręcenia płaszczyzny światła spolaryzowanego przepuszczonego przez
rea
gującą mieszaninę umieszczoną w rurce polarymetrycznej możemy śledzić szybkość
reakcji hydrolizy sacharozy (kąt skręcenia światła spolaryzowanego jest liniową funkcją
stężenia substratu). Jeżeli przyjmiemy że:
α
0
– kąt skręcenia płaszcz. Przed zapoczątkowaniem reakcji
α
∞
-
kąt skęcenia po zakończeniu reakcji
α
t
– kąt skręcenia w chwili t od zapoczątkowania reakcji
to
c°
A
= u(α
0
-
α
∞
)
c
A
= u (α
t
-
α
∞
)
po podstawieniu do wzoru na stałą szybkości reakcji dla r. pierwszego rzędu otrzymujemy
wzór dzięki któremu obliczymy stałą szybkości reakcji inwersji sacharozy:
3.
WYKONANIE ĆWICZENIA:
Układ doświadczalny składał się z: polarymetru, kolby Erlenmayera na 100cm
3
, kwas
solny 2mol∙dm
-3
; waga analityczna, sacharoza, pipety o objętości 25cm
3
, stopera
1. Przygotowanie roztworu sacharozy
– do 60cm
3
wody destylowanej umieszczonej
w erlenmajerce wsypano 40g odważonej sacharozy (roztwór 40%) i dokładnie
wymieszano!
2.
Próbka kontrolna – do 25cm
3
40% roztworu sacharozy umieszczonego w czystej
kolbie wprow
adzono za pomocą pipety 25cm
3
wody destylowanej, dokladnie
wmieszano i wypełniono otrzymanym roztworem rurkę polarymetryczną. Zmierzono
początkową wartość kąta skręcenia (α
0
)
3.
Roztwór właściwy – 25cm
3
roztworu sacharozy umieszczono za pomocą pipety w
czystej kolbie stożkowej. Następnie za pomoca czystej pipety odmierzono taka samą
objętość kwasu solnego i wprowadzono do kolby z roztworem. W tym momencie
włączono stoper, który mierzył dokładny czas trwania reakcji.
Otrzymany roztwór wprowadzono do rurki polarymetrycznej, którą uprzednio
opróżniono i oczyszczono. Rurkę umieszczono w polarymetrze. Odczytując na
stoperze czas reakcji
mierzono wartość kąta skręcenia płaszczyzny światła
spolaryzowanego, co 10 minut. Wyniki zestawiono w tabeli 1.
4. Obliczono
wartości stałej szybkości reakcji ze wzoru (1) dla każdego pomiaru
5.
Sporządzono wykres zależności
kt
t
)
ln(
)
ln(
0
a następnie
wyznaczono stałą szybkości k, której wartość równa jest tangensowi kąta nachylenia
otrzymanej prostej.
t
t
k
0
ln
1
4. OBLIC
ZENIA i OPRACOWANIE WYNIKÓW
kąt skręcenia światła spolaryzowanego po zakończeniu reakcji obliczamy ze wzoru
)
005
,
0
44
,
0
(
0
T
Natomiast stała szybkość k ze wzoru
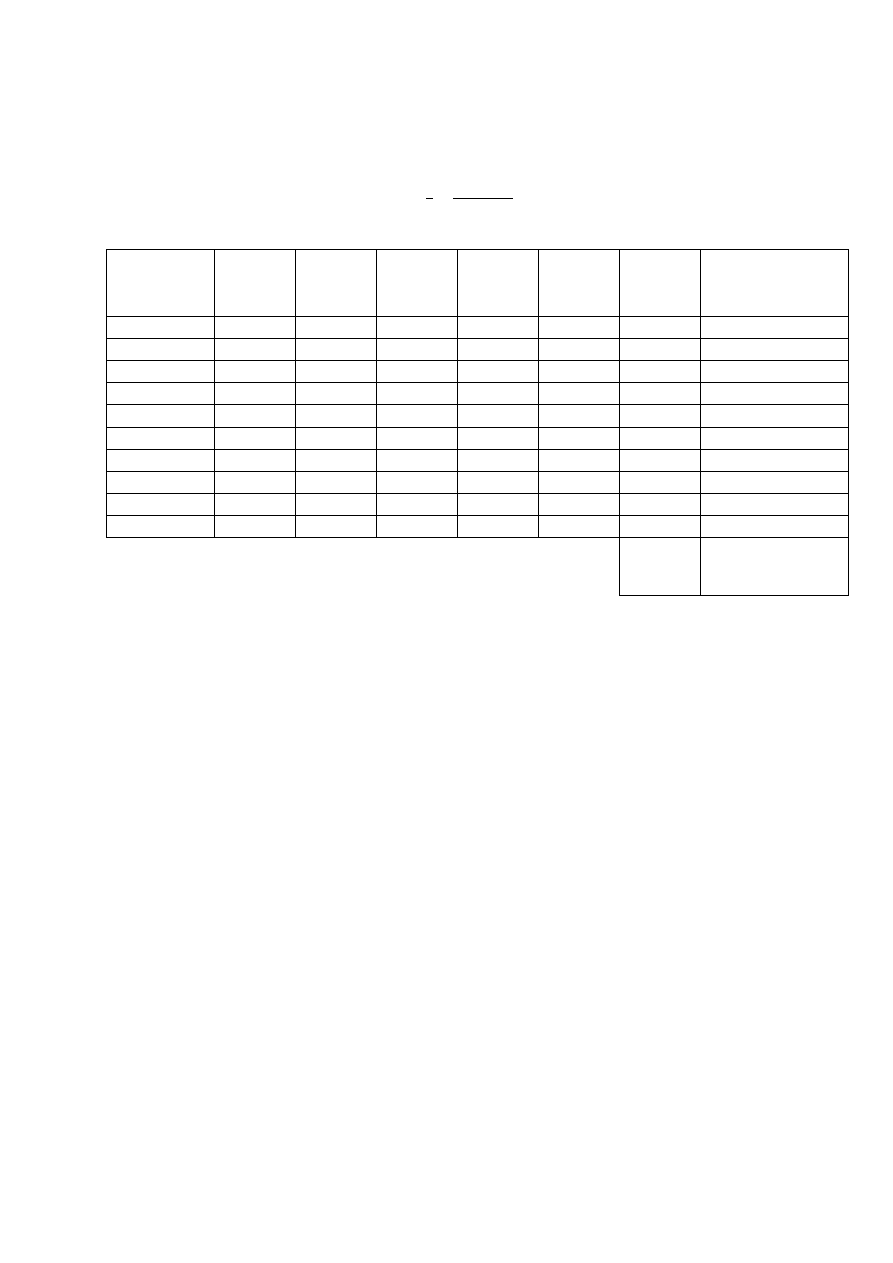
Czas
trwania
reakcji [min]
α
0
α
t
α
∞
(α
0
-
α
∞
)
(α
t
-
α
∞
)
ln(α
t
-
α
∞
)
Stała szybkości k
5
15,35
14
-4,98875 20,33875 18,98875 2,943847 13,736*10
-3
min
-1
10
15,35
13,95
-4,98875 20,33875 18,93875 2,94121
7,132*10
-3
min
-1
15
15,35
11,35
-4,98875 20,33875 16,33875 2,79354
14,599*10
-3
min
-1
20
15,35
10,1
-4,98875 20,33875 15,08875 2,713949 14,929*10
-3
min
-1
25
15,35
8,85
-4,98875 20,33875 13,83875 2,627473 15,402*10
-3
min
-1
30
15,35
7,8
-4,98875 20,33875 12,78875 2,548566 15,465*10
-3
min
-1
35
15,35
6,65
-4,98875 20,33875 11,63875 2,45434
15,102*10
-3
min
-1
40
15,35
5,8
-4,98875 20,33875 10,78875 2,378504 13,955*10
-3
min
-1
50
15,35
4,75
-4,98875 20,33875 9,73875
2,276113 13,389*10
-3
min
-1
60
15,35
2,1
-4,98875 20,33875 7,08875
1,958509 16,218*10
-3
min
-1
k
średnie
14 *10
-3
min
-1
t
t
k
0
ln
1
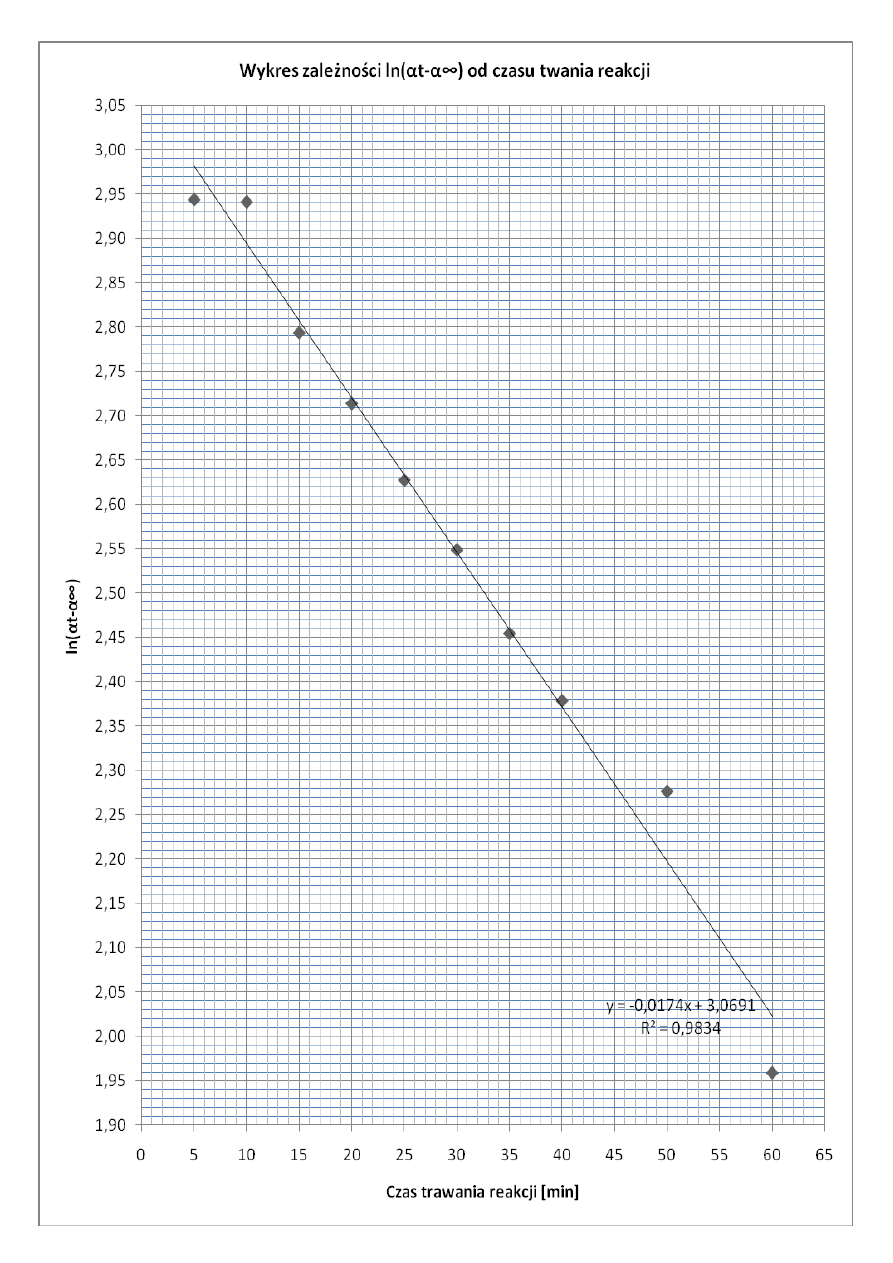

Wyznaczamy stałą szybkości reakcji k metoda graficzna. W tym celu korzystamy ze wzoru
linii trendu (wzorcowej) wyznaczonej przez arkusz kalkulacyjny Excel
, wartość
współczynnika a wynosi tg
.
k = -tg
= -a, gdzie a = -0,0174
5.
SPOSTRZEŻENIA i WNIOSKI
Cel ćwiczenia został osiągnięty.
Metodą polarymetryczną wyznaczyłyśmy potrzebne
α
0,
natomiast
α
∞
wyliczyłyśmy ze wzoru.
W miarę postępu hydrolizy sacharozy zmniejsza się kąt skręcenia (po 5
minutach z wartości 13,95 do wartości 2,1 po 60 minutach trwania reakcji).
Szybkość reakcji zależy od stężenia sacharozy i stężenia kationów
wodorowych, które katalizują tę reakcję.
Reakcja inwersji sacharozy można uznać za reakcję pseudopierwszorzędową
dlatego że, stężenie kationów wodorowych nie ulega zmianie, a stężenie
sacharozy praktycznie się nie zmienia.
Porównując k wyznaczone metodą graficzną k=
0,0174
z średnią stałą
szybkości reakcji k=
14
*10
-3
= 0,014
możemy uznać że doświadczenie
wykonaliśmy poprawnie, jednakże wartości stałej uzyskane tymi dwiema
metodami znacznie od siebie odbiega
. Wszelkie różnice mogą być skutkiem
błędów pomiarowych, niedoskonałości oka ludzkiego, przyrządów, braku
doświadczenia w obsłudze polarymetru, niedokładnym oczyszczeniem
elementów, przez które przechodziły promienie świetlne.
Wyszukiwarka
Podobne podstrony:
Chemia fizyczna - sprawozdanie 2-1, Chemia Fizyczna
Chemia fizyczna - sprawozdanie (4-1), Chemia Fizyczna
chemia fizyczna lab id 112228 Nieznany
7[1].1(2), Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna, s
SPRAWOZDANIE-4-1-1, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fi
10-1-gr-11-A, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chemia fizyczna
chemia fizyczna egzamin id 1122 Nieznany
Chemia Fizyczna sprawozdanie cw5
5.5L, technologia chemiczna, chemia fizyczna, sprawozdania z chemi fizycznej, 5.5
Iloczyn rozpuszczalności soli trodno rozpuszczalnych, studia, chemia, chemia fizyczna, sprawozdania,
HCOOH, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Diagram fazowy Gibbsa, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Przewodnrównow 2, studia, chemia, chemia fizyczna, sprawozdania
Entropia mieszania, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Numer i tytuł ćwiczenia, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chem
Chemia fizyczna sciaga id 112218
(),Chemia fizyczna L,sprawozdanie prawo podziału nersta
więcej podobnych podstron