2010-01-22
1
Chemia XIV
HYDROLIZA
Hydrolizą to
- reakcja
związku chemicznego z wodą,
-
szczególnym rodzajem reakcji hydrolizy jest
odwracalny proces hydrolizy soli.
Proces taki występuje w czasie rozpuszczania
soli w wodzie.
Produktami reakcji hydrolizy są kwas i zasada.
2010-01-22
2
• W przypadku reakcji hydrolizy soli
pochodzącej od kwasu 1-wodorowego (HA)
i 1-wodorotlenowej zasady (MeOH),
• reakcję hydrolizy można zapisać
schematycznie.
Me
+
+ A
-
+ H
2
O <=> MeOH + HA
• Reakcją odwrotną do reakcji hydrolizy jest
reakcja
zobojętnienia.
Solami nie ulegające reakcji
hydrolizy
• Solami, które nie ulegają reakcji
hydrolizy są sole mocnych kwasów i
mocnych zasad (NaCl, KNO
3
,
K
2
SO
4
,...).
• Mocne kwasy – HCl, HNO
3,
H
2
SO
4,
• Mocne zasady NaOh, KOH, Ca(OH)
2
2010-01-22
3
Hydrolizują sole - 1
• sole słabych jednoprotonowych kwasów i mocnych
jednowodorotlenowych zasad (CH
3
COOK, NaCN) -
odczyn
zasadowy
.
Przebieg procesu hydrolizy dla CH
3
COOK
przedstawia równanie.
• CH
3
COO
-
+ K
+
+ H
2
O <=> CH
3
COOH + K
+
+ OH
-
• Z równania widzimy, że jon potasowy nie
uczestniczy w równowadze kwasowo-zasadowej,
dlatego powyższe równanie możemy zapisać w
postaci CH
3
COO
-
+ H
2
O <=> CH
3
COOH + OH
-
• Ten stan równowagi nazywany jest reakcją
hydrolizy anionowej (
zasadowej
)
2
• sole mocnych jednoprotonowych kwasów i
słabych jednowodorotlenowych zasad
(NH
4
NO
3
) - odczyn
kwasowy
• NH
4
+
+ H
2
O <=> NH
3
+ H
3
O
+
• Jon NO
3
-
nie uczestniczy w równowadze
kwasowo-
zasadowej. Ten stan równowagi
nazywany jest
reakcją hydrolizy kationowej
(kwasowej)

2010-01-22
4
3
• sole słabych jednoprotonowych kwasów i słabych
jednowodorotlenowych zasad.
• Np. HCOONH
4
-
odczyn może być obojętny,
kwasowy
lub
zasadowy
, zależnie od wartości
stałych dysocjacji odpowiednich kwasów i zasad
• sole słabych dwuprotonowych kwasów i mocnych
jednowodorotlenowych zasad
– np. K
2
S - odczyn
zasadowy
• sole trójprotonowych kwasów i mocnych
jednowodorotlenowych zasad
–
• np. Na
3
PO
4
- odczyn
zasadowy
, Na
2
HPO
4
- odczyn
zasadowy
, NaH
2
PO
4
- odczyn
kwaśny
Hydroliza soli mocnych kwasów i
słabych zasad (przykłady)
• Hydrolizę soli mocnego kwasu i słabej
zasady można opisać reakcją dysocjacji
(wszystkie sole rozpuszczone w wodzie są
całkowicie zdysocjowane):
M
m
A
n
mM
n+
+ nA
m-
• oraz reakcją kationu z cząsteczkami wody:
•
M
n+
+ H
2
O
MOH
(n-1)+
+ H
+
2010-01-22
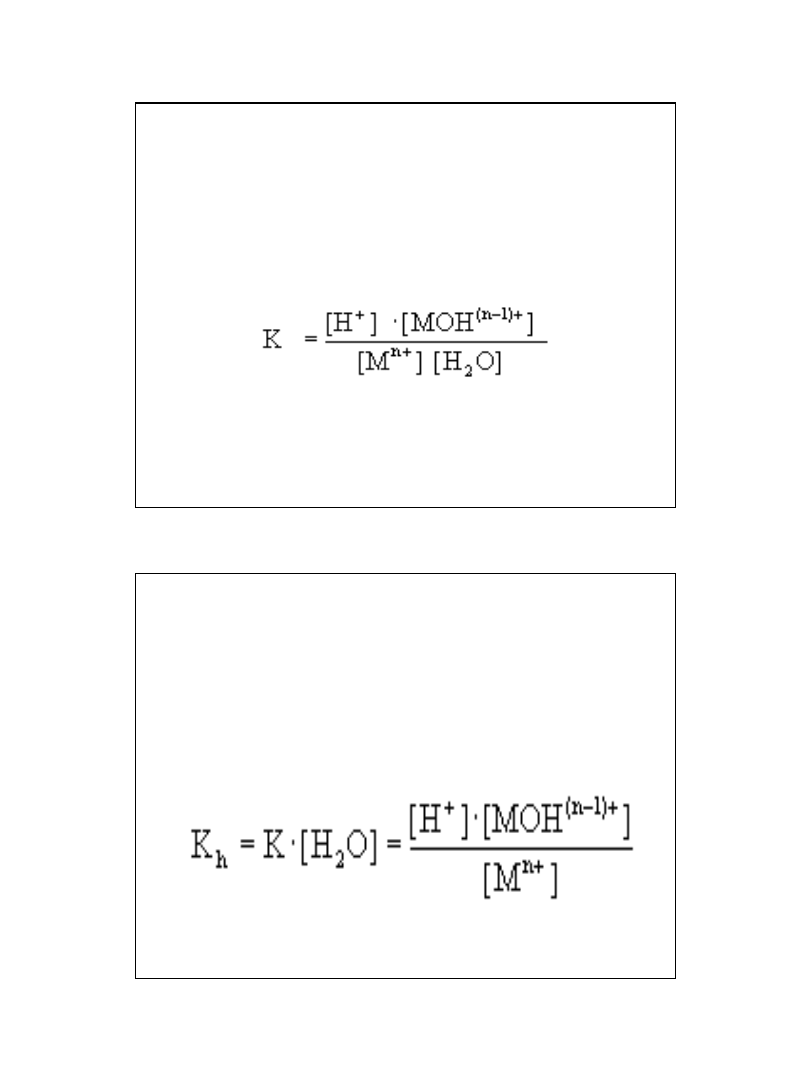
5
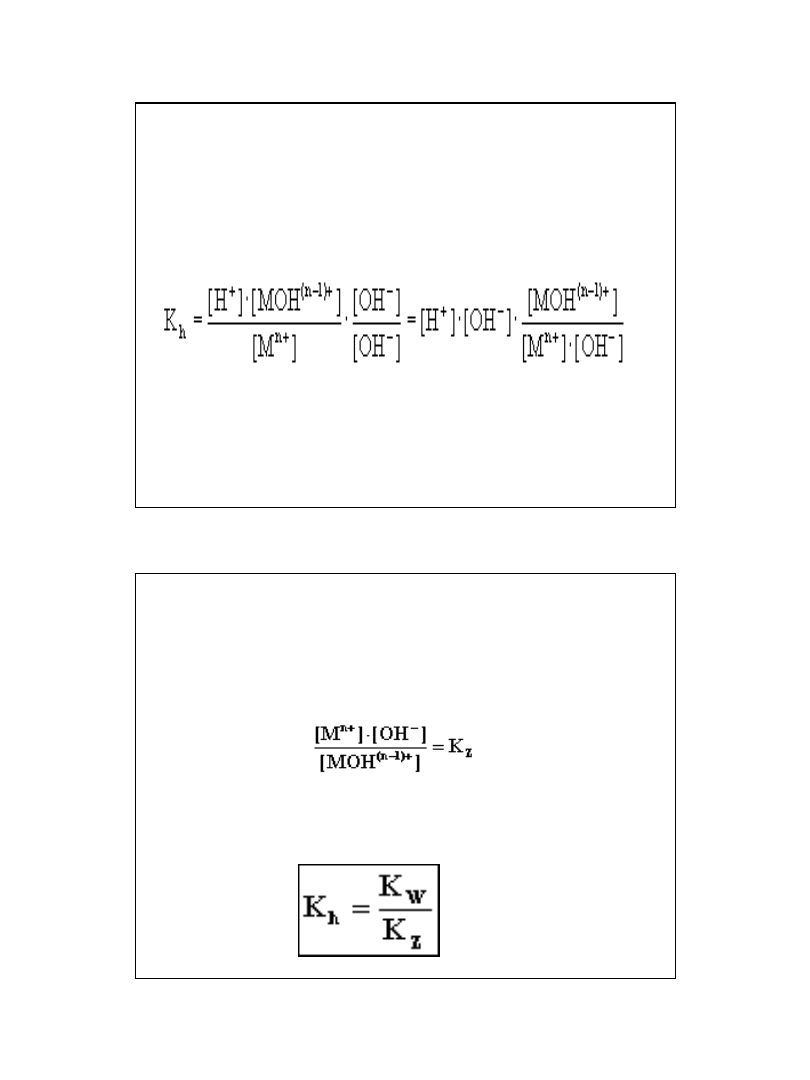
Reakcja jest reakcją równowagową i
można jej przypisać stałą równowagi
K:
Przyjmując, że stężenie wody [H
2
O]
jest praktycznie stałe i oznaczając iloczyn
K x [H
2
O] stałą hydrolizy K
h
możemy
równanie zapisać w postaci:
2010-01-22
6
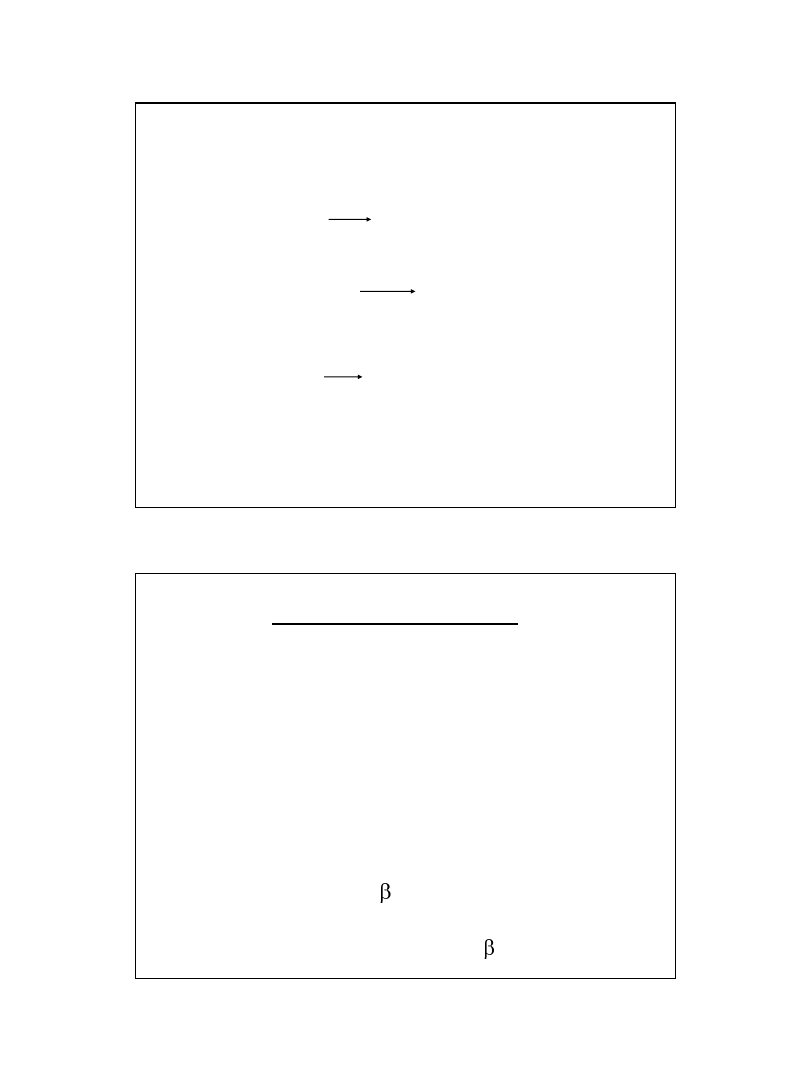
Jeśli pomnożymy mianownik i licznik
przez [OH
-
] to otrzymamy wyrażenie:
Ponieważ iloczyn: K
w
= [H
+
][OH
-
]
jest iloczynem jonowym wody,
a wyrażenie
jest stałą dysocjacji słabej zasady
mamy po podstawieniu do równania
2010-01-22
7
Hydroliza chlorku amonu
NH
4
Cl + H
2
O
NH
4
+
+ Cl
-
+ H
+
+ OH
-
NH
4
+
+ H
2
O
NH
4
OH + H
+
NH
4
Cl + H
2
O
NH
4
OH + H
+
+ Cl
-
K
h
= K
H2O
/ K
NH4OH
= 10-14 / K
NH4OH
Stopień hydrolizy
Przykład - hydroliza CH
3
COONa
Równanie reakcji hydrolizy .
• CH
3
COO
-
+ HOH <=> CH
3
COOH + OH
-
Z równania hydrolizy wynika, że z każdego jonu
octanowego CH
3
COO
-
powstaje jedna cząsteczka
kwasu octowego i jeden jon wodorotlenowy
• [CH
3
COOH] = [OH
-
]
przy zaniedbaniu jonów OH
-
pochodzących z dysocjacji H
2
O.
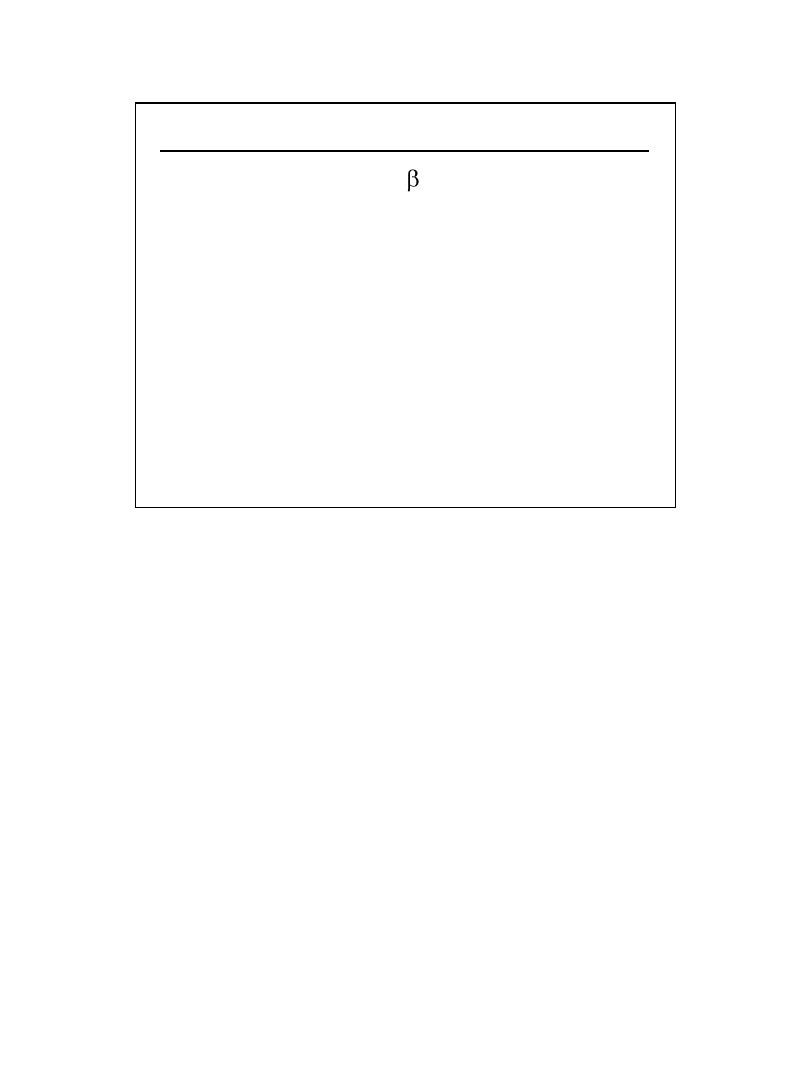
Jeżeli stężenie soli CH
3
COONa oznaczymy przez c,
stopień hydrolizy przez
h
, to stężenie
zhydrolizowanych cząsteczek wyraża równanie.
[CH
3
COOH] = [OH
-
] =
h
* c
2010-01-22
8
Stężenie jonów wodorowych (pH)
Jeżeli stopień hydrolizy
h
< 1,
to nie popełniając
dużego błędu
można przyjąć, że stężenie jonów
octanowych [CH
3
COO
-
] jest bliskie stężeniu c.
Zatem równanie na stałą hydrolizy K
h
:
K
h
= [OH
-
]
2
/c
• podstawiając w miejsce [OH
-
] zależność
• [OH
-
] = K
H2O
/ [H
3
O
+
]
• oraz uwzględniając, że K
h
= K
H2O
/ K
HA
• otrzymamy K
H2O
/K
HA
= K
2
H2O
/[H
3
O
+
]
2
*c
[H
3
O
+
]
2 =
K
H2O
* K
HA
/c
Wyszukiwarka
Podobne podstrony:
Chemia XIV-HYDROLIZA
Chemia labolatorium, Hydroliza2, Hydroliza - reakcja niektórych zwiazków chemicznych z wodą, która p
Cwiczenie4 chemia ogolna- hydroliza elektroliza ogniwa, Studia, Chemia, Chemia laboratoria
instrukcja - HYDROLIZA SOLI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
Reakcje Hydrolizy, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki
hydroliza polifosforanów, Chemia Przydatne dla studentów
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
Chemia fizyczna - Ćw. 13 i 14 - Dysocjacja, Dysocjacja, hydroliza, pH,
hydroliza v2, Studia, Chemia
chemia, Hydroliza soli i pH roztworów
więcej podobnych podstron