
8 marca 1999 20:43
s1-99
PL ISSN 0028–3843
Neurologia
i Neurochirurgia
Polska
Polish Neurology and Neurosurgery
Organ Polskiego Towarzystwa
Neurologicznego
i
Polskiego Towarzystwa Neurochirurgów
Materiały Sympozjum
Wczesne Stadium Choroby Alzheimera
Warszawa 28 listopada 1997
Suplement
1/1999
Kartka nr: 1 Strona nr: 1

8 marca 1999 20:43
s1-99
Neurologia i Neurochirurgia Polska
Polish Neurology and Neurosurgery
Organ Polskiego Towarzystwa Neurologicznego
i Polskiego Towarzystwa Neurochirurgów
Suplement
1999
T. 33 (XLIX) Nr 1
Redaktor Naczelny i Redaktor Działu Neurologicznego
Prof. dr med. Jerzy Kulczycki
Zastępca Redaktora Naczelnego i Redaktor Działu Neurochirurgii
Prof. dr med. Juliusz Wocjan
Zastępca Redaktora Naczelnego d/s organizacyjno-technicznych
Dr med. Witold Świderski
Redaktor Działu Kroniki i Informacji (neurologia)
Prof. dr med. Jerzy Dymecki
Sekretarz Redakcji: Dr med. Wanda Łojkowska
Komitet Redakcyjny Działu Neurologii
Prof. dr med. Anna Członkowska,
Prof. dr med. Teofan Domżał,
Prof. dr med. Barbara Emeryk-Szajewska,
Prof. dr med. Piotr Kozłowski,
Prof. dr med. Irena Hausmanowa-Petrusewicz, Prof. dr med. Jacek Zaremba
Komitet Redakcyjny Działu Neurochirurgii
Prof. dr med. Zbigniew Jagodziński, Prof. dr med. Ireneusz Kojder,
Doc. dr hab. Andrzej Marchel
Dr hab. med. Konrad Moszyński
Kolegium Redakcyjne Działu Neurologii
Prof. dr med. Jagna Czochańska,
Prof. dr med. Cezary Fryze,
Prof. dr med. Wanda Horyd,
Prof. dr med. Hanna Jędrzejowska,
Prof. dr psych. Danuta Kądzielawa,
Prof. dr med. Hubert Kwieciński,
Prof. dr med. Mirosław Mossakowski, Prof. dr med. Antoni Prusiński,
Prof. dr med. Zbigniew Stelmasiak,
Prof. dr med. Barbara Stroińska-Kuś,
Doc. dr hab. Andrzej Szczudlik,
Prof. dr med. Andrzej Wajgt,
Prof. dr med. Mieczysław Wender
Kolegium Redakcyjne Działu Neurochirurgii
Prof. dr med. Zbigniew Czernicki, Prof. dr med. Igor Gościński,
Prof. dr med. Jan Haftek,
Prof. dr med. Brunon Imieliński,
Dr med. Jan Jakubowski,
Prof. dr med. Andrzej Radek,
Doc. dr hab. Marcin Roszkowski,
Prof. dr med. Stefan Żarski
Teksty angielskie: Dr med. Przemysław Słomski
Adiustator: Dr med. Danuta Milewska
Sekretarz Techniczny Redakcji: Małgorzata Gorzeń
Adres Redakcji: 02–957 Warszawa, Sobieskiego 1/9
Instytut Psychiatrii i Neurologii, tel 642–66–11
Nr konta: PTN, PKO BP VI O. W-wa, 10201068–298511–270–1–111
Internet: http://www.ia.pw.edu.pl/˜wujek/neurol/index.html
Skład komputerowy: Elżbieta Styczek, Włodzimierz Macewicz
Druk: „EFEKT” s. c. Warszawa ul. Lubelska 30/32, tel. 618 57 07
Kartka nr: 2 Strona nr: 2

8 marca 1999 20:43
s1-99
Neurologia
i Neurochirurgia
Polska
Polish Neurology and Neurosurgery
Organ Polskiego Towarzystwa
Neurologicznego
i
Polskiego Towarzystwa Neurochirurgów
Materiały Sympozjum
Wczesne Stadium Choroby Alzheimera
Warszawa 28 listopada 1997
Kartka nr: 3 Strona nr: 3

8 marca 1999 20:43
s1-99
4
Kartka nr: 4 Strona nr: 4

8 marca 1999 20:43
s1-99
NEUR. NEUROCHIR. POL. 1999, Suplement 1
5
Treść
J. Kulczycki: Słowo wstępne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
9
T. Gabryelewicz: Rozpowszechnienie zespołów otępiennych . . . . . . . . . . . . .
11
J. Vetulani: Biologia pamięci . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
19
M. Barcikowska: Obraz kliniczny wczesnej fazy choroby Alzheimera . . . . . . .
29
T. Parnowski: Depresja a choroba Alzheimera . . . . . . . . . . . . . . . . . . . . .
39
A. Pfeffer: Diagnostyka różnicowa wczesnej fazy otępienia . . . . . . . . . . . . .
51
J. Kulczycki: Wczesne rozpoznawanie choroby Alzheimera za pomocą metod neu-
roobrazowania . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
63
Mariusz Zarajczyk: Jumex w leczeniu choroby Alzheimera . . . . . . . . . . . . .
73
Kartka nr: 5 Strona nr: 5

8 marca 1999 20:43
s1-99
6
Kartka nr: 6 Strona nr: 6

8 marca 1999 20:43
a0.tex
NEUR. NEUROCHIR. POL. 1999, Suplement 1
7
Contents
J. Kulczycki: Editorial . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
9
T. Gabryelewicz: Prevalence of dementia syndromes . . . . . . . . . . . . . . . . .
11
J. Vetulani: The biology of memory . . . . . . . . . . . . . . . . . . . . . . . . . . .
19
M. Barcikowska: Clinical pattern of early phase of Alzheimer’s disease . . . . . .
29
T. Parnowski: Depression and Alzheimer’s disease . . . . . . . . . . . . . . . . . . .
39
A. Pfeffer: Differential diagnosis of early dementia . . . . . . . . . . . . . . . . . .
51
J. Kulczycki: Early diagnosis of Alzheimer’s disease by neuroimaging methods .
63
Mariusz Zarajczyk: Jumex in treatment of Alzheimer’s disease . . . . . . . . . . .
73
Kartka nr: 7 Strona nr: 7

8 marca 1999 20:43
a0.tex
8
Kartka nr: 8 Strona nr: 8

8 marca 1999 20:43
a1.tex
9
Słowo wstępne
Ze znacznym opóźnieniem, z różnych, nie zawsze zawinionych przez nas
przyczyn, oddajemy Czytelnikom ten suplement zawierający teksty referatów
z sympozjum „Wczesne stadium choroby Alzheimera”. Były już nawet wahania,
czy po upływie roku od czasu, kiedy to sympozjum miało miejsce, powracać
jeszcze do przygotowania tej publikacji. Zdecydowało o tym wreszcie przekona-
nie kilku osób, że temat wczesnej diagnostyki klinicznej choroby Alzheimera nic
w tym czasie nie stracił, a może nawet zyskał na aktualności, w związku z nieco
większymi, niż się na ogół przyjmowało, możliwościami zmniejszenia uciążli-
wości tej choroby w jej pierwszym okresie. Zainteresowanie lekarzy tą tematyką
jest bardzo duże, czego dowodem była choćby ogromna liczba uczestników na-
szego sympozjum. Wysiłki organizatorów spotkania, głównie pracowników firmy
Sanofi-Biocom, którym należy się szczególne za to podziękowanie, no i praca au-
torów wykładów, zasługuje chyba również na to, ażeby pozostały trwalsze ślady
Sympozjum, na zasadzie „scripta manent”. Ostateczna ocena prezentowanych tu
materiałów należy, oczywiście, do Czytelników.
Jerzy Kulczycki
Warszawa, dnia 2 lutego 1999 r.
Kartka nr: 9 Strona nr: 9

8 marca 1999 20:43
a1.tex
10
Kartka nr: 10 Strona nr: 10

8 marca 1999 20:43
a1.tex
NEUR. NEUROCHIR. POL. 1999, Suplement 1
11
Tomasz Gabryelewicz
Rozpowszechnienie zespołów otępiennych
Z II Kliniki Psychiatrycznej Instytutu Psychiatrii i Neurologii w Warszawie
Kierownik: prof. dr S. Pużyński
Summary
Prevalence of dementia syndromes –
A survey is presented of epidemiological
data on the prevalence of dementia syndromes. Most studies have demonstrated that the
prevalence index of dementia is doubled after the age of 60 years at intervals of 5.1
years.The data on Alzheimer’s disease point out that its prevalence after the age of 65
years is between 1.9% and 5.8%. In the study of the population of the Mokotów City
District of Warsaw aged 65–84 years the prevalence of dementia was 5.7%.
Streszczenie
Praca stanowi przegląd danych epidemiologicznych dotyczących rozpowszechnienia
zespołów otępiennych. Większość badań wskazuje że wskaźnik rozpowszechnienia otę-
pienia podwaja się po 60 r.ż. co 5.1 lat. Dane dotyczące choroby Alzheimera określają
jej rozpowszechnienie po 65 r.ż. w granicach pomiędzy 1.9 do 5.8%. W badaniu roz-
powszechnienia otępienia w warszawskiej dzielnicy Mokotów ustalono, że wynosi ono
5.7% w przedziale wieku 65–84 lat.
Ostatnie lata przyniosły znaczne zainteresowanie problematyką zaburzeń
zdrowia psychicznego u osób w podeszłym wieku. Jedną z przyczyn tego zja-
wiska jest istotne zwiększanie się światowej populacji osób starych. W roku
2000 liczba osób 65 letnich i starszych będzie wynosiła około 423 miliony
[4]. Wraz z rosnącą liczbą osób starych zwiększa się liczba chorych z zaburze-
niami otępiennymi, dla których starzenie się jest najistotniejszym czynnikiem
ryzyka. Badania epidemiologiczne pozwalają ocenić rozmiar zjawiska oraz po-
móc w organizacji opieki. Badania analityczne służą poszukiwaniu czynników
ryzyka. Opublikowano wyniki ponad 100 badań ustalających rozpowszechnienie
Kartka nr: 11 Strona nr: 11
8 marca 1999 20:43
a1.tex
12
T. Gabryelewicz
Nr 1
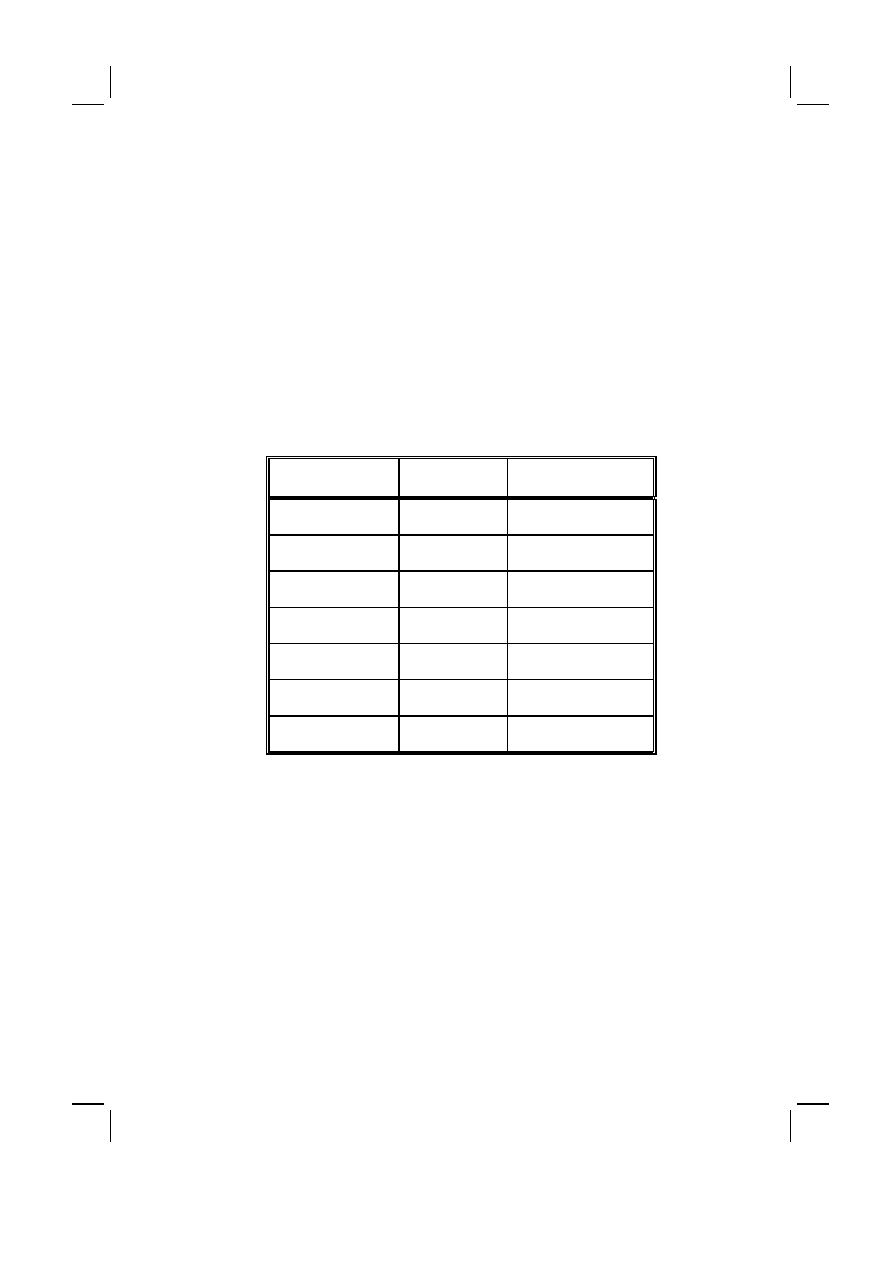
otępienia, w różnych regionach świata. W 1985 roku Jorm i wsp. [2] opubliko-
wali pracę analizującą wyniki 47 badań epidemiologicznych przeprowadzonych
w latach 1945–1985 dotyczących rozpowszechnienia otępienia. Na podstawie
wyników tych badań określono ogólne rozpowszechnienie zespołów otępiennych
w pięcioletnich przedziałach czasowych od 60 do 94 roku życia odpowiednio
na: 0.7, 1.4, 2.8, 5.6, 10.5, 20.8 i 38.6%, tak więc wskaźnik rozpowszechnienia
otępienia podwajał się co 5.1 lat (4.8–5.4 lat), aż do 94 roku życia.
Tabela I :
Rozpowszechnienie zespołów otępiennych w populacji ogólnej na świecie, za A.F.
Jorm i wsp. [2]
Table I :
Prevalence of dementia syndromes in the general population worldwide (according to
A.F. Jorm et al.)
Przedział wieku (lat)
Age groups (yrs)
Średni wiek (lat)
Mean age (yrs)
Rozpowszechnienie (%)
Prevalence (%)
60–64
62.5
0.7
65–69
67.5
1.4
70–74
72.5
2.8
75–79
77.5
5.6
80–84
82.0
10.5
85–89
87.0
20.8
90–94
91.5
38.6
W 1991 roku opublikowano analizę badań epidemiologicznych dotyczących
rozpowszechnienia otępienia, przeprowadzonych w różnych krajach europejskich
w latach 1980–1990 [1]. Spośród 23 badań wyselekcjonowano dwanaście, które
można było porównać. Badania te przeprowadzone w RFN, Finlandii, Włoszech,
Holandii, Norwegii, Hiszpanii, Szwecji i Wielkiej Brytanii miały charakter ba-
dań populacyjnych, w których stosowano kryteria diagnostyczne zgodne z DSM-
III. Wszystkie uczestniczące w nich osoby były badane bezpośrednio. Stwier-
dzane ogólne rozpowszechnienie otępienia różniło się nieznacznie pomiędzy ba-
daniami, chociaż występowały różnice w poszczególnych badaniach zależne od
wieku i płci.
Najczęstszą przyczyną otępienia jest choroba Alzheimera (przyczyna około
60% ogółu otępień). Dostępne dane określają jej rozpowszechnienie w granicach
Kartka nr: 12 Strona nr: 12
8 marca 1999 20:43
a1.tex
Nr 1
Rozpowszechnienie zespołów otępiennych
13
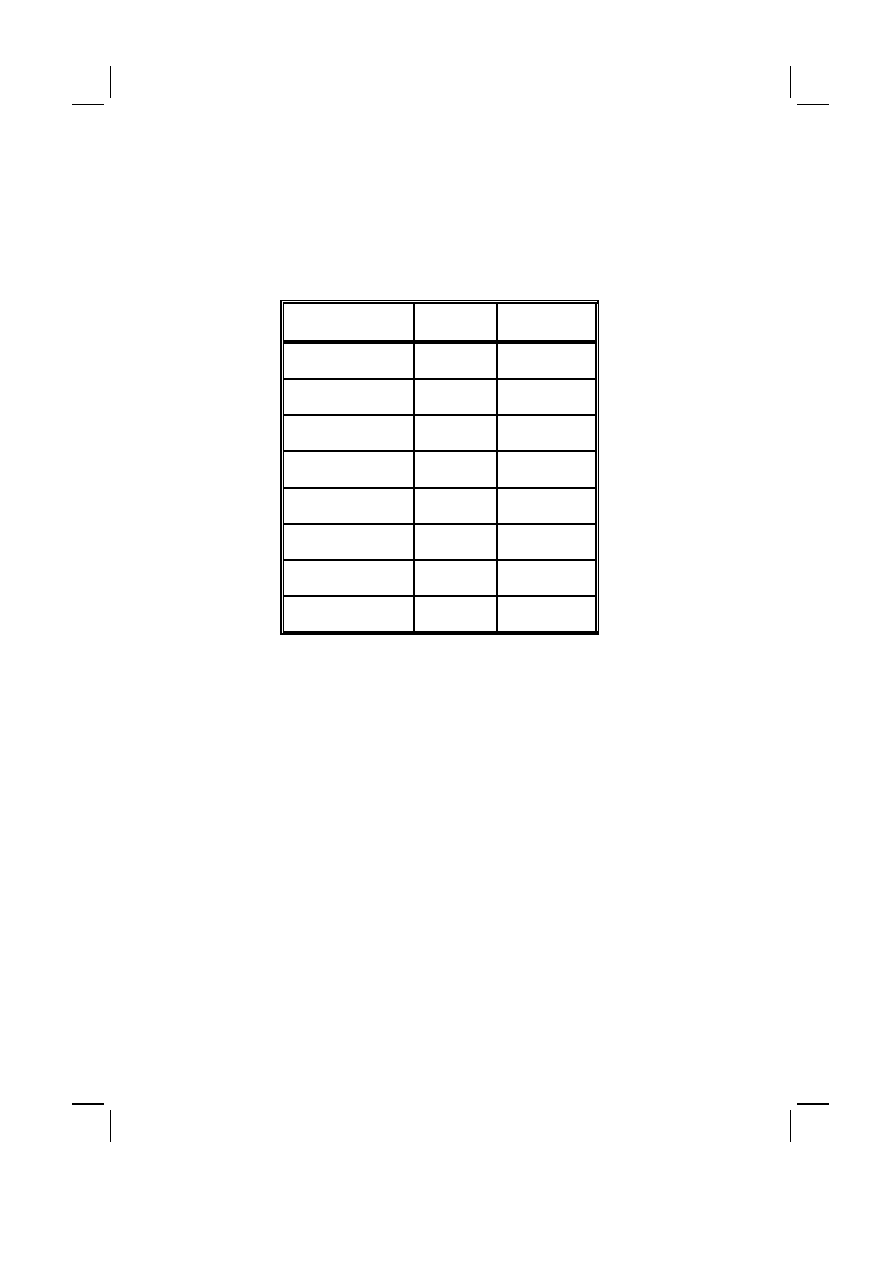
Tabela II :
Rozpowszechnienie zespołów otępiennych w Europie – EURODEM Prevalence Re-
search Group (1980–1990) [1]
Table II :
Prevalence of dementia syndromes in Europe – EURODEM Prevalence Research
Group (1980–1990) [1]
Przedział wieku (lat)
Age groups (yrs)
Kobiety (%)
Women (%)
Mężczyźni (%)
Men (%)
60–69
0.5
1.6
65–69
1.1
2.2
70–74
3.9
4.6
75–79
6.7
5.0
80–84
13.5
12.1
85–89
22.8
18.5
90–94
32.2
32.1
95–99
36.0
31.6
pomiędzy 1.9 do 5.8% ogólnej populacji osób 65 letnich i starszych. Większość
doniesień wykazuje wzrost wskaźnika rozpowszechnienia wraz z wiekiem. Czę-
stość występowania choroby Alzheimera podwaja się po 65 roku życia co 4.5
lat. Choroba ta jest najczęstszą przyczyną otępienia w Europie i w krajach gdzie
ludność wywodzi się z europejskiej emigracji (jak np. Ameryka Północna). Więk-
szość badań wykazuje przewagę występowania choroby wśród kobiet, szczegól-
nie w grupach bardziej zaawansowanych wiekowo. Analiza badań epidemiolo-
gicznych przeprowadzonych w Europie w latach 1980–1990 wskazuje na brak
istotnych różnic zależnych od czynników geograficznych, w rozpowszechnieniu
choroby Alzheimera. Rozpowszechnienie tej choroby w Europie w przedzia-
łach wieku 30–59, 60–69, 70–79 i 80–89 lat wynosi odpowiednio 0.02, 0.3, 3.1
i 10.8% [3].
W 1993 roku Światowa Federacja Stowarzyszeń Alzheimerowskich ogłosiła
raport, na który złożyły się doniesienia 21 państw członkowskich. Liczba osób
z chorobą Alzheimera w tych krajach wynosi 14 370 050, w tym w Australii –
50 000, we Francji – 300 000, we Włoszech – 500 000, w Holandii – 300 000,
w Południowej Afryce – 60 000, w Stanach Zjednoczonych – 4 miliony.
Kartka nr: 13 Strona nr: 13

8 marca 1999 20:43
a1.tex
14
T. Gabryelewicz
Nr 1
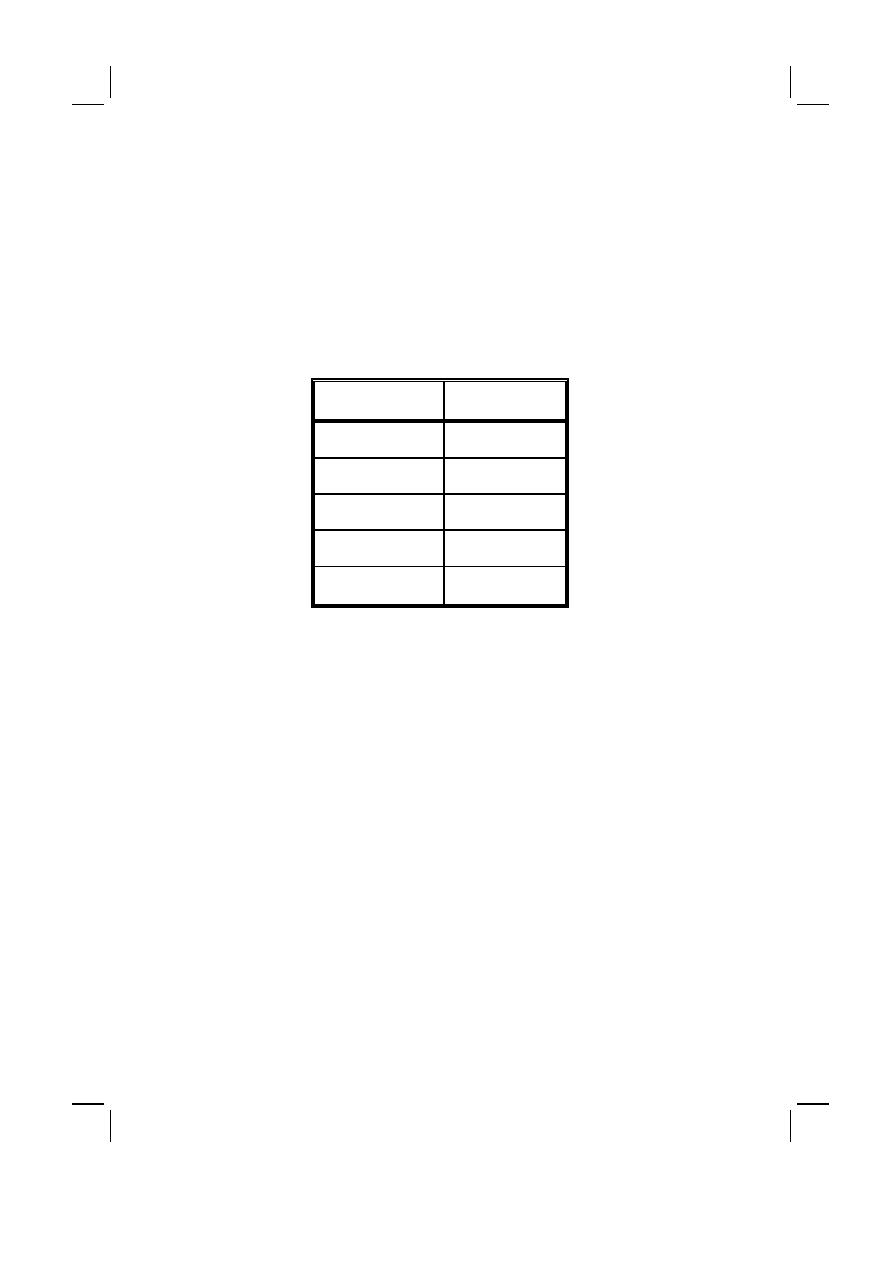
Tabela III :
Rozpowszechnienie choroby Alzheimera w Europie (EURODEM Prevalence Rese-
arch Group) [3]
Table III :
Prevalence of Alzheimer’s disease in Europe (EURODEM Prevalence Research
Group) [3]
Przedział wieku (lat)
Age groups (yrs)
Choroba Alzheimera (%)
Alzheimer’s disease (%)
30–59
0.02
60–69
0.30
70–79
3.10
80–89
10.80
Otępienie w chorobie Alzheimera może współistnieć z otępieniem naczynio-
pochodnym, gdy epizody naczyniowo-mózgowe (objawy wielozawałowe) nakła-
dają się na obraz kliniczny i wywiad sugerujący chorobę Alzheimera. Rezultatem
tych epizodów jest nagłe zaostrzanie się objawów otępienia. W badaniach po-
śmiertnych otępienie mieszane stanowi 10–15% wszystkich otępień.
Podstawowym problemem w porównywaniu i interpretowaniu danych do-
tyczących rozpowszechnienia otępienia naczyniopochodnego jest niepewność
związana z definicją choroby, którą początkowo nazywano „otępieniem miażdży-
cowym”, potem zmieniono na „otępienie wielozawałowe”, a obecnie określana
jest nazwą „otępienie naczyniopochodne”. Termin ten odnosi się do wszystkich
zespołów otępiennych związanych z etiologią naczyniową. Podstawą rozpozna-
nia są kryteria kliniczne – głównie wywiad chorobowy i badanie neurologiczne.
Kliniczne rozpoznanie wymaga stwierdzenia: otępienia, choroby naczyniowej
mózgu potwierdzonej metodami neuroobrazowania, ogniskowych objawów neu-
rologicznych, ponadto stwierdzenie czasowego związku pomiędzy chorobą na-
czyniową i otępieniem. Brak jest wciąż powszechnie akceptowanych międzynaro-
dowych kryteriów diagnostycznych. Wszystko to jest przyczyną znacznie mniej-
szej liczby badań epidemiologicznych otępień naczyniopochodnych niż choroby
Alzheimera.
Przyjmuje się, że otępienie naczyniopochodne jest drugim, najczęściej wystę-
pującym typem otępienia, po chorobie Alzheimera w populacjach pochodzenia
kaukaskiego Europy Zachodniej i Ameryki Północnej (12–30%) i pierwszym
(do 60%) w niektórych populacjach azjatyckich i wschodnich (Japonia, Chiny,
Rosja). Niektórzy autorzy wskazują, że otępienia naczyniopochodne mogą być
Kartka nr: 14 Strona nr: 14
8 marca 1999 20:43
a1.tex
Nr 1
Rozpowszechnienie zespołów otępiennych
15
niedoceniane również w populacji kaukaskiej i szacują rozpowszechnienie tego
typu otępienia na ok. 50% wszystkich otępień.
W ubiegłym roku zakończono badanie ustalające rozpowszechnienia otę-
pienia w warszawskiej dzielnicy Mokotów. Uzyskane wyniki przeprowadzonych
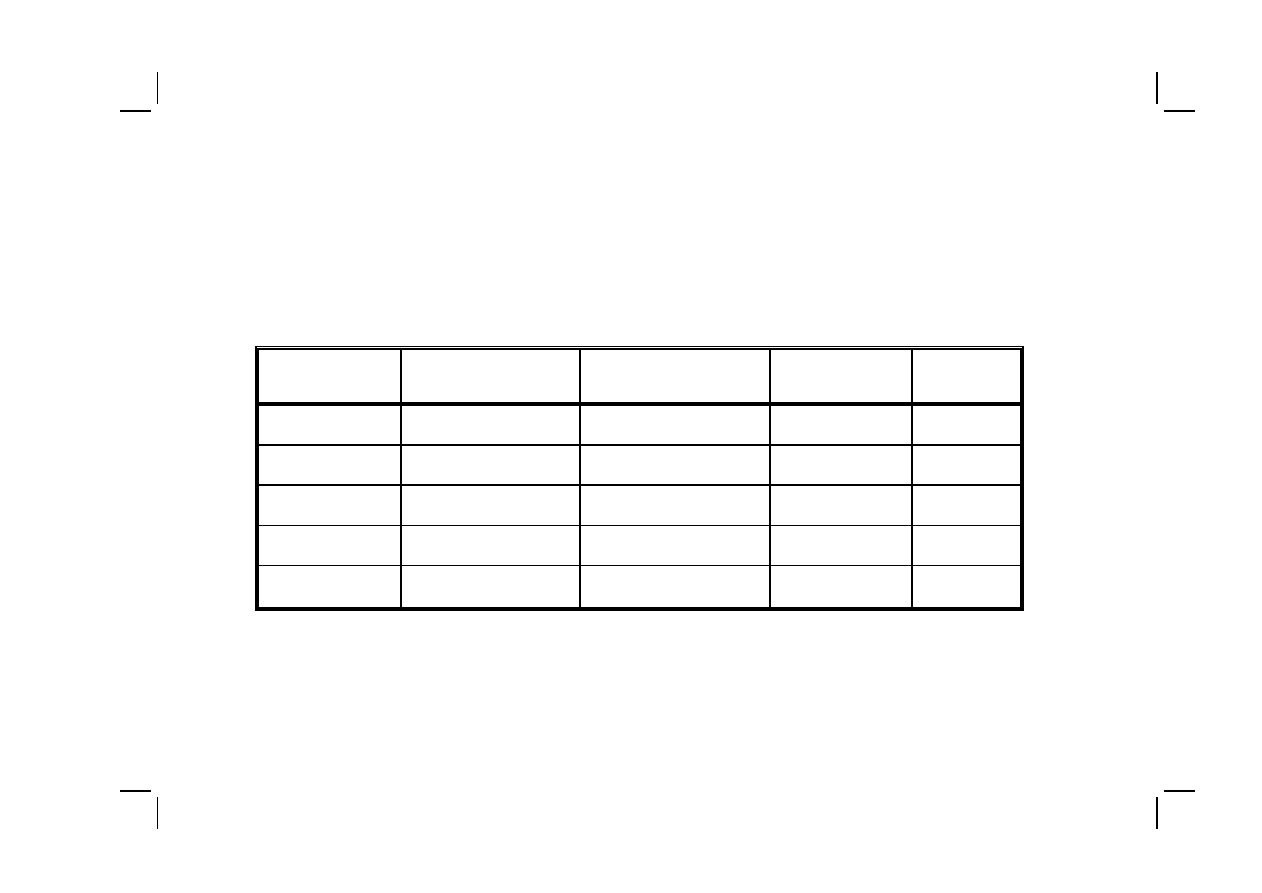
Tabela IV :
Rozpowszechnienie otępienia w populacji Mokotowa w zależności od wieku
Table IV :
Prevalence of dementia in the Mokotów population in relation to age
Przedział wieku (lat)
Age group (yrs)
Rozpowszechnienie
Prevalence (%)
65–69
1.9
70–74
5.8
75–79
8.6
80–84
16.5
Razem
Total
5.7
badań epidemiologicznych rozpowszechnienia zaburzeń otępiennych w populacji
osób, które przekroczyły 65 rok życia zamieszkałych w dzielnicy Mokotów w du-
żym stopniu korespondują z wynikami takich badań w innych krajach Europy,
które wykonano w minionym dwudziestoleciu. Większość takich badań wska-
zuje na stopniowy wzrost rozpowszechnienia otępienia w zależności od wieku.
Potwierdziło to również obecne badanie, w którym wskaźniki rozpowszechnienia
rosły stopniowo z wiekiem. Ustalono, że w przedziale wieku od 65 do 84 roku
populacji ludności Mokotowa najczęściej występującym typem otępienia jest
otępienie naczyniopochodne (2.7%), którego rozpowszechnienie jest najwyższe
w dwóch młodszych grupach wieku (65 do 74 r.ż.). W dwóch starszych grupach
wieku (75 do 84 r.ż.) najczęściej występuje otępienie typu alzheimerowskiego.
Trzecie miejsce zajmuje otępienie mieszane, czwarte zaś otępienie w innych cho-
robach (w chorobie Parkinsona i w chorobach nowotworowych). Podobne pro-
porcje występowały w badaniach EURODEM, gdzie do 80 roku życia otępienie
naczyniopochodne występowało równie często, albo częściej niż choroba Alzhe-
imera (np. w Finlandii 65–74 lat – otępienie naczyniopochodne 44%, otępienie
alzheimerowskie 30%). Po 80 roku życia proporcja odwracała się i rozpowszech-
nienie choroby Alzheimera było wyraźnie większe. Można to tłumaczyć tym, że
otępienie naczyniopochodne dotyka ludzi młodszych – odpowiednio wcześnie
Kartka nr: 15 Strona nr: 15
8
m
ar
ca
1999
20:43
a1
.te
x
16
T
.Ga
b
ry
el
ewi
cz
Nr
1
Tabela V :
Rozpowszechnienie różnych typów otępienia w populacji Mokotowa w zależności od wieku
Table V :
Prevalence of various dementia types in the Mokotów population in relation to age
Przedział wieku (lat)
Age group (yrs)
Otępienie alzheimerowskie
Alzheimer dementia (%)
Otępienie naczyniopochodne
Vascular dementia (%)
Otępienie mieszane
Mixed dementia (%)
Otępienie inne
Other dementia
types (%)
65–69
0.5
1.4
0.0
0.0
70–74
1.9
3.0
0.9
0.0
75–79
3.9
3.0
0.3
0.6
80–84
7.9
6.5
1.2
0.9
Razem
Total
2.3
2.7
0.5
0.2
Ka
rt
ka
nr
:
1
6
S
tr
ona
nr
:
1
6

8 marca 1999 20:43
a2.tex
Nr 1
Rozpowszechnienie zespołów otępiennych
17
ujawniają się jego czynniki ryzyka. Ma to szczególne znaczenie w Polsce, gdzie
długość życia, zwłaszcza wśród mężczyzn, jest znacznie krótsza niż w krajach
zachodnich, stąd ogólnie w grupie wiekowej od 65 do 84 r.ż. najwyższe było
rozpowszechnienie otępienia naczyniopochodnego (najwyższe rozpowszechnie-
nie choroby Alzheimera przypada na lata późniejsze niż wynosi średnia długość
życia w Polsce). Drugim czynnikiem, który może mieć istotne znaczenie jest
czas przeżycia pacjentów z otępieniem naczyniopochodnym, który jest istotnie
krótszy niż u pacjentów z chorobą Alzheimera.
Piśmiennictwo
[1] Hofman A., Rocca W.A., Brayne C., Breteler M.M.B., Clarke M., Cooper B.,
Copeland J.R.M., Dartigues J.F., da Silva Droux A., Hagnell O., Heeren T.J.,
Engedal K., Jonker C., Lindesey J., Lobo A., Mann A.H., Molsa P.K., Morgan
K., O’Connor D.W., Sulkava R., Kay D.W.K., Amaducci L.: The prevalence of
dementia in Europe: A collaborative study of 1980–1990 findings. EURODEM
Prevalence Research Group. Int J. Epidemiol. 1991, 20(3), 736-748.
[2] Jorm A.F., Korten A.E., Henderson A.S.: The prevalence of dementia: A quanti-
tative integration of the literature. Acta Psychiatr. Scand., 1987, 76, 465-479.
[3] Rocca W.A., Hofman A., Brayne C., Breteler M.M.B., Clarke M., Copeland J.R.M.,
Dartigues J.F., Engedal K., Hagnell O., Heeren T.J., Jonker C., Lindesay J., Lobo
A., Mann A.H., Molsa P.K., Morgan K., O’Connor D.W., da Silva Droux A., Sul-
kava R., Kay D.W.K., Amadocci L.: Frequency and distribution of Alzheimer’s
disease in Europe: A collaborative study of 1980–1990 prevalence findings. The
EURODEM Prevalence Research Group. Ann. Neurol. 1991, 30(3), 381–390.
[4] World Health Organization. Eight Report on the World Health Situation 1991, EB
89, 10.
Kartka nr: 17 Strona nr: 17

8 marca 1999 20:43
a2.tex
18
Kartka nr: 18 Strona nr: 18

8 marca 1999 20:43
a2.tex
NEUR. NEUROCHIR. POL. 1999, Suplement 1
19
Jerzy Vetulani
Biologia pamięci
Instytut Farmakologii Polskiej Akademii Nauk w Krakowie
Dyrektor: Prof. dr E. Przegaliński
Summary
The biology of memory –
The memory phenomenon is described and characterized
giving also definitions connected with it – engrams and learning. Several classifications
of memory are reviewed discussing differences between instant and “processed” mem-
ory, and memory declarative and procedural. Theories are presented briefly of the nature
of memory, the hypothesis of closed neuronal circuits, synaptic plasticity, neurochemi-
cal theory, and Fuster’s new network theory, including arguments for and against them.
Attention is called to the possibility of “watching” of the mechanisms of memory, pro-
vided by the introduction of neurovisual methods PET and MRI. Finally, observations
are mentioned indicating that subconscious learning occurs more frequently than it is
supposed, and the mechanisms of knowledge acquiring in this way are diverse.
Streszczenie
W artykule scharakteryzowano zjawisko pamięci i podano definicje związanych z nią
pojęć – engramów i uczenia się. Wymieniono kilka klasyfikacji pamięci i omówiono róż-
nice między pamięcią natychmiastową i „przerabianą” oraz deklaratywną i procedu-
ralną. Przedstawiono pokrótce, podając argumenty „za” i „przeciw”, teorie dotyczące
istoty pamięci: hipotezę zamkniętych obwodów neuronalnych, neurochemiczną, plastycz-
ności synaptycznej oraz nową teorię sieciową Fustera. Zwrócono uwagę na istniejące
obecnie, dzięki wprowadzeniu metod neurowizualnych – PET i MRI, pewne możliwości
„podglądania” mechanizmów działania pamięci. W zakończeniu przypomniano obserwa-
cje świadczące o tym, że, częściej niż przypuszczamy, występuje zjawisko nieświadomego
uczenia się, o różnych mechanizmach przyswajania sobie informacji.
Pamięć jest czymś takim, z czym wszyscy istniejemy i co nas w jakiś spo-
sób definiuje. Czujemy się sobą dlatego, że pamiętamy się właściwie od około
drugiego roku życia. Pamiętamy to co się z nami działo i mamy bardzo silne
Kartka nr: 19 Strona nr: 19

8 marca 1999 20:43
a2.tex
20
J. Vetulani
Nr 1
poczucie tego, że jesteśmy sobą, ponieważ pamiętamy i nasze dzieciństwo i na-
szą młodość. Utrata pamięci, stanowiącej jeden z wewnętrznych zmysłów duszy,
jest jedną z najgorszych rzeczy, jaka się może zdarzyć człowiekowi. W mo-
mencie utraty pamięci, tracimy swą osobowość. I dlatego właśnie zaburzenia
pamięci tak bardzo nas przerażają. U innych, a zwłaszcza jeśliby miałyby do-
tknąć nas samych.
Pamięć jest bardzo specjalną cechą charakteru. W większości wypadków
wstydzimy się ułomności naszego charakteru. Mało kto publicznie mówi: „je-
stem kłamcą”, „mam podły charakter” itp. Natomiast kłopotów z pamięcią się
nie wstydzimy. Mówimy chętnie: „mam pamięć dobrą, ale krótką”. Zależy nam
na polepszeniu pamięci i dzięki temu ludzie, kiedy mają kłopoty z pamięcią nie
wahają się o tych kłopotach mówić.
Pamięć jest tym zmysłem, dla którego łatwo możemy stworzyć skuteczne
protezy. Wydawałoby się rzeczą niemożliwą, aby z mniej więcej dwóch tysięcy
chaotycznie rozrzuconych na firmamencie gwiazd stworzyć jakiś sensowny, na-
dający się do zapamiętania obraz, który pomógłby żeglarzowi obrać poprawny
kurs. A jednak prosty zabieg mnemotechniczny, uporządkowanie gwiazd w kon-
stelacje, pozwala na wykorzystanie niezmienności gwiaździstego nieba do orien-
tacji w nocy. Oczywiście najlepszą protezą pamięci w tej chwili jest pismo oraz
różnego rodzaju środki audiowizualne. Protezą pamięci dla wykładowcy są prze-
zrocza. Pamięć i uczenie wykształcały się od samego początku życia na ziemi.
Najprymitywniejsze formy życia posługiwały się taksjami, odruchami, instynk-
tami, a im później, zwłaszcza na poziomie głowonogów i kręgowców, coraz
większą rolę zaczęło odgrywać uczenie się i rozumowanie. Uczenie się czy ro-
zumowanie jest niemożliwe bez pamięci.
Jeżeli chcemy coś powiedzieć o pamięci, najpierw musimy zdefiniować, czy
przypomnieć pewne podstawowe pojęcia. Otóż, podstawowym pojęciem jest ślad
pamięciowy czyli engram. Tak nazywamy pewną trwałą zmianę w układzie ner-
wowym wywołaną przez chwilowe pobudzenie, a stanowiącą reprezentację do-
znań zmysłowych. Pamięć to zdolność manipulowania tymi engramami, two-
rzenie ich, przechowywanie i umiejętne – co jest ważne – ich przywoływanie.
Bardzo częstym problemem w piątej, a zwłaszcza szóstej dekady życia staje się
fakt, że wiemy, że coś pamiętamy i mamy to „a końcu języka”, ale mamy kłopot
z przywołaniem tego i wykorzystaniem.
Uczenie się jest tworzeniem nowych, trwałych engramów albo przekształ-
caniem już istniejących engramów pod wpływem doświadczenia. Tworzenie pa-
mięci następuje w pewnych ściśle określonych fazach, a znajomość tego jest
ważna, gdyż różnego rodzaju zaburzenia pamięci łączą się z zaburzeniem po-
szczególnych jej faz. Pierwsza faza uczenia to zapamiętywanie; w tym procesie
Kartka nr: 20 Strona nr: 20

8 marca 1999 20:43
a2.tex
Nr 1
Biologia pamięci
21
tworzy się tzw. pamięć natychmiastowa, której engramy trwają bardzo krótko.
Często jest to pamięć ikoniczna, reprezentacja obrazu padającego na siatkówkę.
Dalsza faza to tworzenie pamięci roboczej, krótkotrwałej. Engramy tej pamięci
również nie utrzymują się długo, i w procesie zwanym konsolidacją ulegają prze-
kształceniu w engramy pamięci trwałej, które mogą być przechowywane latami.
Aby engramy te wykorzystać, musi nastąpić przypominanie czyli przywoływanie
pewnych faktów: engramy z pamięci trwałej przechodzą znów do pamięci robo-
czej. Tam też może nastąpić proces rozpoznawania, który polega na porównaniu
przywołanego engramu z engramem, który w danym momencie się tworzy. Tak
np. porównujemy engramy aby stwierdzić, czy osoba, którą właśnie spotykamy,
jest osobą nam już znaną, czy obcą.
Obecna wiedza na temat pamięci wynika ze wspólnych badań fizjologów
i psychologów. Połączenie wysiłków badaczy reprezentujących te dwie dziedziny
jest rzeczą stosunkowo nową. Jeszcze niedawno mówiono, że jak badają pamięć
psycholodzy to jest zła fizjologia, a jak badają ją fizjolodzy, to jest to zła psycho-
logia. W tej chwili, na szczęście dla rozwoju wiedzy o procesach kognitywnych,
poglądy te się zmieniły.
Można wyróżnić bardzo wiele rodzajów pamięci, a istniejące klasyfikacje
są dość różne. Jedna z nich dzieli różne rodzaje pamięci ze względu na czas
trwania engramu – wyróżnia wspomniane już pamięć natychmiastową, trwającą
sekundy, pamięć krótkotrwałą czyli roboczą, która trwa przez kilka minut do
kilku godzin, oraz „przerabianą” z niej pamięć długotrwałą, która może trwać
przez całe lata, do końca życia.
Innym sposobem podziału pamięci jest wyróżnienie pamięci deklaratywnej
i proceduralnej. Pamięć deklaratywna to pamięć faktów, twarzy, zdarzeń. Mo-
żemy wydzielić w niej dwie podklasy. Pierwsza to pamięć epizodyczna, czyli
pamiętanie pewnych sytuacji. Jest ona charakterystyczna tak samo dla ludzi jak
i dla zwierząt. Drugim rodzajem jest pamięć semantyczna, pamięć słów, cha-
rakterystyczna dla ludzi. Pamięć deklaratywna może być łatwo zwerbalizowana,
a więc przekazywana innym. Jest jednak podatna na proces amnezji. Poza pa-
mięcią deklaratywną istnieje pamięć proceduralna, dzięki której zapamiętujemy,
jak wykonać pewne czynności, pewne ruchy. Ten rodzaj pamięci nie ulega amne-
zji, ale ślady pamięciowe jest trudno zdobyć i nie można ich przekazać innej
osobie werbalnie. Nikt nikogo samym mówieniem nie nauczy np. jak jeździć
na nartach czy na rowerze. To trzeba samemu sprawdzić metodą prób i błędów,
trochę ucząc się przez podglądanie („małpowanie”), ale nie werbalizując. Dobre
wyuczenie się danego zachowania motorycznego powoduje, że pamiętamy je na
całe życie. Kto raz nauczył się jeździć na rowerze, będzie to umieć do końca
życia, a tylko ograniczenia fizyczne narastające z wiekiem, a nie uszkodzenia
Kartka nr: 21 Strona nr: 21

8 marca 1999 20:43
a2.tex
22
J. Vetulani
Nr 1
pamięci motorycznej, mogą mu przeszkadzać w bezbłędnym skoordynowaniu
ruchów. Klasycznym literackim przykładem tego, jak może nastąpić taka dycho-
tomia: amnezja pamięci deklaratywnej, a trwałość pamięci proceduralnej, jest
tytułowy bohater powieści Dołęgi-Mostowicza „Znachor”, gdzie wybitny chi-
rurg po urazie głowy zapomina kompletnie kim jest. Zostaje jednak wiejskim
znachorem, ponieważ pamięta dokładnie wszystkie procedury medyczne i chi-
rurgiczne i dzięki temu może bardzo skutecznie leczyć.
Istnieje kilka teorii dotyczących istoty pamięci. Przez pewien czas uważano,
że pamięć polega na krążeniu pewnych impulsów elektrycznych po zamkniętych
obwodach neuronalnych. Teorię tę nazwano teorią rewerberacyjną. Doświadcze-
nia wykazały jednak nieprawdziwość tego wyobrażenia, przynajmniej jeżeli cho-
dzi o pamięć długotrwałą. Kiedy chomika wyuczono pewnych odruchów, a na-
stępnie poddano głębokiej hibernacji, zamrażając do momentu zaniku aktywno-
ści elektrycznej mózgu, a następnie rozmrożono i przywrócono do życia, okazało
się, że chomik pamięta to, czego nauczono go przed doświadczeniem. Wyka-
zano więc, że przerwanie pracy wszystkich obwodów neuronalnych w mózgu
nie prowadzi do zaniku pamięci. Gdyby tak było, to pacjent po elektrowstrząsie
byłby dotknięty całkowitą amnezją.
Inną fascynującą teorią pamięci była teoria neurochemiczna. Bardzo atrak-
cyjną wydawała się hipoteza, że w mózgu w czasie rejestracji jakiegoś faktu
tworzy się odpowiednie, swoiste „chemikalium” które lokuje się w odpowied-
nich miejscach, stając się chemicznym śladem pamięci. Sądzono, że może to
być albo kwas nukleinowy, albo oligopeptyd. Doświadczenia popierające tę teo-
rię przeprowadzano początkowo na wypławkach. Te małe stworzenia, należące
do typu robaków płaskich, jak są głodne, nie cofają się przed kanibalizmem.
Ponieważ wykazano, że wypławki da się uczyć, przeprowadzono doświadcze-
nie, w którym jedne wypławki uczono czegoś, a drugich nie uczono. A potem
robaki z obu tych grup dawano do pożarcia kolegom. Następnie sprawdzano,
czy te, które zjadły „mądrych” kolegów lepiej pamiętały niż te, które zjadły
kolegów nieuczonych. I okazało się, że pewne doświadczenia dały wyniki po-
zytywne. Teorię chemiczną później rozszerzono, wydawało się, że znaleziono
oligopeptyd tworzący się w czasie uczenia szczurów unikania ciemności. Peptyd
ten, nazwany skotofobiną, powodował, że potraktowane nim normalne osobniki
również zaczynały ciemności unikać. Tych fascynujących wyników nie udało się
niestety powtórzyć poza laboratorium George’a Ungara w Teksasie i chemiczna
teoria pamięci przeszła do lamusa.
W tej chwili ogólnie akceptowaną teorią pamięci jest teoria plastyczności sy-
naptycznej. Zakłada ona, że synapsy zmieniają się w czasie procesu uczenia i te
ich zmiany stanowią ślady pamięciowe pamięci trwałej. Należy tu wspomnieć
Kartka nr: 22 Strona nr: 22

8 marca 1999 20:43
a2.tex
Nr 1
Biologia pamięci
23
o prof. Jerzym Konorskim, który jako jeden z bardzo niewielu polskich uczo-
nych jest cytowany w amerykańskich podręcznikach neurobiologii. Właśnie Je-
rzy Konorski równolegle z Donaldem Hebbem zaproponowali tę teorię. Niejako
pogłębieniem teorii plastyczności jest teoria genomowa pamięci, która zakłada,
że engram, którego istotą jest przebudowa połączeń synaptycznych między neu-
ronami, tworzy się w wyniku swoistego pobudzenia ekspresji genów. Jednym
z pierwszych uczonych, który to zaproponował, jest profesor Leszek Kaczmarek
z Instytutu Nenckiego, którym kiedyś kierował Jerzy Konorski.
Teoria genomowa zakłada, że kiedy następuje pobudzenie, mogące prowa-
dzić do wytworzenia engramu, uwolniony w wyniku aktywacji receptora wtórny
przekaźnik uruchamia procesy fosforylacji w komórce. Fosforylacji może ule-
gać m.in. białko regulatorowe, które zostaje aktywowane i uruchamia z kolei
białko promotorowe, co zapoczątkowuje ekspresję odpowiednich genów, a w
konsekwencji tego powstaje nowe białko. To nowe białko może np. albo tworzyć
dodatkowe synapsy albo dodatkowe enzymy. Obecnie uważa się, że pierwotne
zmiany, które zachodzą w procesie uczenia, zachodzą właśnie na poziomie jąder
komórkowych.
W tym roku Fuster opublikował bardzo ciekawą teorię sieciową pamięci,
która zakłada, że powodowane przez plastyczność synaptyczną zmiany przewod-
ności synaptycznej prowadzą do powstawania w mózgu różnego rodzaju sieci
neuronalnych. Istniałyby więc obwody, w których sygnały łatwiej by się tworzyły
i szybciej przebiegały. Tworzyłyby się więc różnego rodzaju sieci pamięciowe
w mózgu, które mogłyby ze sobą oddziaływać, wzajemnie się pobudzając lub
hamując. One właśnie stanowiłyby dynamiczne engramy. Co ważniejsze, moż-
liwa liczba asocjacji pomiędzy sieciami jest praktycznie nieskończona. Różne
fragmenty pamięci mogą się nam w różny sposób asocjować. To powoduje, że
każdy z nas jest pod względem pamięci osobą absolutnie wyjątkową. Pamięciami
naszymi różnimy się znacznie bardziej, niż np. liniami daktyloskopijnymi.
To, że sieci neuronalne w mózgu naprawdę istnieją i ulegają aktywacji kiedy
tworzą się ślady pamięciowe można obecnie zobaczyć, bo metody obrazowania
mózgu pozwalają na oglądanie pracy jego poszczególnych obszarów w czasie za-
chodzenia procesów intelektualnych. Bez względu na zastosowaną metodę (PET,
NMR) możemy na obrazie mózgu oglądać, w których jego obszarach zacho-
dzą zmiany związane z aktywacją neuronów. Wprowadzenie metod obrazowania
pracy mózgu doprowadzi prawdopodobnie do zastąpienia klasycznej neurofarma-
kologii, którą reprezentuję, metodami wglądu w mózg ludzki bez konieczności
używania do badań zwierząt laboratoryjnych. Badania prowadzone powyższymi
metodami, pozwoliły zobrazować pola aktywności w różnych strukturach mózgu
wywołane procesami zapamiętywania. I tak np. podczas pokazywania liter, które
Kartka nr: 23 Strona nr: 23

8 marca 1999 20:43
a2.tex
24
J. Vetulani
Nr 1
badany miał zapamiętać pojawia się obszar podwyższonej aktywności w tylnych
obszarach korowych, w asocjacyjnej korze sensorycznej. Po bardzo krótkim cza-
sie aktywność ta znika z kory sensorycznej, przenosi się w kierunku czołowym,
w kierunku kory motorycznej. Natomiast, jeżeli ten sam osobnik rozwiązuje
test z zapamiętaniem twarzy, to początkowo inne fragmenty kory sensorycznej
podlegają aktywacji, która następnie obejmuje znowu obszar kory motorycznej.
Interesujący wydaje się fakt, że właśnie kora motoryczna jest ściśle związana
z pamięcią.
W innym interesującym doświadczeniu badanemu pokazuje się na krótką
chwilę pewien obraz na monitorze. Następnie pokazuje się drugi obraz, bądź
identyczny, bądź różny. Jeżeli obraz jest taki sam, badany musi nacisnąć gu-
zik. Otóż jeżeli ten drugi obraz pokazuje się prawie natychmiast, po upływie
pół sekundy, badany angażuje w zadanie tylko pamięć natychmiastową i aktyw-
ność struktur jego mózgu jest na średnim poziomie. Jeżeli jednak drugi obraz
pojawia się po odstępie ośmiu sekund, to pierwszy obraz, z którym należy po-
równać następny, musi zostać zapamiętany mechanizmami pamięci roboczej i w
tym przypadku aktywność przednich czołowych struktur mózgu wyraźnie się
podnosi. Badania te wykazały, że rzeczywiście istnieją sieci pamięciowe i co
ważniejsze, że pamięć ma pewne wymierne podłoże i nie jest zjawiskiem tak
ulotnym, jak nam się kiedyś wydawało.
Warto wspomnieć o jeszcze jednym typie klasyfikacji pamięci, związanym
z teorią sieciową i hierarchią tych sieci. Według niej każdy z nas rodzi się
z pewną pamięcią wrodzoną, określaną jako pamięć filetyczna lub gatunkowa.
To są te układy synaps, które zostały wytworzone w czasie ewolucji. Muszą
one oczywiście zostać jakoś uruchomione po urodzeniu, ale fakt że szybko, nie-
jako automatycznie uczymy się pewnych rzeczy, zwłaszcza odruchów, wynika
właśnie z posiadania pamięci gatunkowej. Przykładem pamięci filetycznej jest
umiejętność odwracania głowy na bok po położeniu noworodka na brzuszku,
czy umiejętność chodzenia, pojawiająca się u dzieci w okresie pierwszego roku
życia. Ta ostatnia wynika z faktu, że nasi przodkowie kilkadziesiąt milionów lat
temu nauczyli się chodzić. Pamięć filetyczna jest podstawową pamięcią na którą
nakłada się pamięć indywidualna, ta którą zdobywamy sobie w czasie życia.
Pamięć sieciowa dzieli się na pamięć sensoryczną i motoryczną: odpowied-
nie sieci zlokalizowane są bądź w czuciowych, bądź ruchowych obszarach kory
mózgowej. Odpowiada to w pewnym zakresie podziałowi pamięci na deklara-
tywną i operacyjną. Również poszczególne hierarchie pamięci zajmują różne
obszary. Najniżej w hierarchii znajduje się pamięć filetyczna: wrodzone ruchy
czy też wrodzona pamięć zmysłowa. Od samego początku świeżo narodzony or-
ganizm widzi światło, czuje ból, słyszy dźwięki, może wykonywać pewne ruchy.
Kartka nr: 24 Strona nr: 24

8 marca 1999 20:43
a2.tex
Nr 1
Biologia pamięci
25
Sieci tej pamięci są ściśle zlokalizowane i łatwo przez punktowe uszkodzenie
mózgu wyeliminować pewne rodzaje pamięci. Potem pamięć sensoryczna prze-
chodzi w pamięć polisensoryczną. Pojawia się kojarzenie wrażeń pochodzących
z różnych zmysłów, zapamiętywanie kilku cech jednego przedmiotu naraz. Dalej
następuje kojarzenie poszczególnych obiektów i dochodzimy do pamięci epi-
zodycznej i semantycznej. Sieci związane z tą pamięcią są znacznie bardziej
rozprzestrzenione w mózgu. Ich integracja prowadzi do powstania pamięci kon-
ceptualnej, obejmującej tak szerokie obszary kory mózgowej, że nawet poważne
lezje nie zmieniają naszego poglądu na świat i naszej samoświadomości, chociaż
poszczególne funkcje związane z pamięcią (np. umiejętność czytania czy wysła-
wiania się) mogą ulec zniszczeniu. Istniejące poziomy pamięci oczywiście się
wzajemnie przenikają. Przenikanie to nie zachodzi tylko „w górę” i „w dół”, ale
również, na każdym „poziomie”, pomiędzy sieciami pamięci sensorycznej i mo-
torycznej. Jest to konieczne, bo praktycznie nie ma pamięci bez jej wykonania,
a więc uruchomienia motoryki. Istotną cechą pamięci jest jej dynamizm, w wy-
niku czego pamięć zmysłowa z reguły aktywuje pamięć motoryczną, a pamięć
motoryczna aktywuje pamięć zmysłową.
Większość wiadomości o podstawach pamięci nie powstała w wyniku ba-
dań na człowieku. Podstawowe mechanizmy pamięci są tak uniwersalne, że nie
jest rzeczą dziwną, iż nasza wiedza o podłożu molekularnym pamięci pochodzi
głównie z badań na ślimaku skrzelodysznym zwanym zającem morskim, Aplysia
californica. Jego „mózg” jest bardzo prosty, liczy zaledwie około 20 000 komó-
rek nerwowych, a więc łatwo badać podstawowe zachodzące w nim procesy.
Otóż na tym ślimaku przeprowadzano badania nad prostymi formami uczenia,
takie jak przyzwyczajanie i uwrażliwianie. Przyzwyczajanie się do czegoś czyli
habituacja polega na zaniku reakcji na stale powtarzany, a obojętny dla zwierzę-
cia bodziec. Odwrotnym do habituacji jest proces uwrażliwienia czyli sensytyza-
cji. Jeżeli nowe wrażenie łączy się z czymś ważnym, najczęściej nieprzyjemnym,
i stale powtarza się w tej kombinacji, reakcja na ten bodziec jest coraz silniejsza.
Dobrą analogią jest nie zauważanie dobrze wyprofilowanej podkładki w bucie,
a narastający dyskomfort, kiedy wpadnie nam do niego kamień. Badania prowa-
dzone właśnie na Aplyzji wykazały, że w czasie procesu habituacji zmniejsza
się ilość połączeń neuronalnych, a w czasie sensytyzacji ilość tych połączeń się
zwiększa. Tworzenie się sieci pamięciowych polega właśnie na zwiększeniu się
różnych połączeń.
Uczenie jest istotną cechą przystosowawczą i istnieją różne jego formy i ro-
dzaje. Habituacja i sensytyzacja to najprostsze rodzaje uczenia nieasocjacyjnego.
Znacznie ważniejsze jest uczenie asocjacyjne, w którym łączymy ze sobą różne
zjawiska i poznajemy związki przyczynowe. Klasyczne doświadczenia Iwana
Kartka nr: 25 Strona nr: 25

8 marca 1999 20:43
a2.tex
26
J. Vetulani
Nr 1
Pawłowa dotyczyły właśnie uczenia asocjacyjnego – pies uczył się, że jeden
bodziec, neutralny, (była to zapalająca się lampka) poprzedzał zawsze wystąpie-
nie bodźca o istotnym znaczeniu, jakim było podawanie pożywienia. Po pew-
nym czasie pies uczył się asocjować bodziec neutralny, zwany warunkowym,
i reagował nań ślinieniem, tak, jak na bodziec bezwarunkowy czyli pożywienie.
Ten typ uczenia, nazywany warunkowaniem klasycznym lub pawłowowskim, od-
grywa niesłychanie ważną rolę w życiu zwierząt i ludzi.
W warunkowaniu klasycznym uczony osobnik obserwuje świat, ale pozostaje
bierny. Inny typ uczenia to warunkowanie operacyjne, w którym po wystąpieniu
bodźca warunkowego zwierzę czy człowiek musi coś wykonać, aby uniknąć kary
czy otrzymać nagrodę, np. nacisnąć dźwignię czy przejść na drugą stronę klatki.
Pojawienie się bodźca warunkowego jest jedynie sygnałem, że teraz należy coś
wykonać. Uczenie się jest dość długie, bo następuje metodą prób i błędów.
Wykształcenie mowy u człowieka było niesłychanie korzystne, bo znacznie zre-
dukowało czas uczenia asocjacyjnego – zamiast prób i błędów możemy słuchać
instrukcji.
Chociaż wydawałoby się, że uczenie asocjacyjne wymaga uczestnictwa świa-
domości, okazuje się, że nie zawsze tak być musi. Stosunkowo niedawno odkryto
taki typ uczenia nieświadomego, zwanego asocjacyjnym uczeniem awersyjnym.
Dotyczy ono jedynie uczenia się reakcji na bodźce smakowe, a polega na tym, że
jeżeli po nowym bodźcu smakowym wystąpi, nawet z opóźnieniem wielogodzin-
nym, stan złego samopoczucia czy dyskomfortu, to ten nowy smak będzie dla
nas do końca życia obrzydliwy. Jest to ważny typ uczenia, gdyż pozwala znacz-
nie zredukować ilość zatruć pokarmowych, chociaż oczywiście nie zawsze działa
bezbłędnie. Klasycznym przykładem jest historia młodego człowieka, który bę-
dąc po raz pierwszy w Grecji zjadł tam po raz pierwszy w życiu melona, a potem
poszedł na plażę, i przebywając tam za długo doznał lekkiego udaru słonecz-
nego. Człowiek ten do dziś dnia wzdryga się na myśl o smaku melona, chociaż
już dokładne nie pamięta, w jaki sposób powstała awersja, a rzeczą ewidentną
jest, że to nie melon spowodował udar słoneczny. Tworzenie się w pamięci połą-
czeń awersyjnych jest dość częste, chociaż w wielu wypadkach nieuświadomione,
zupełnie nie wiemy dlaczego coś lubimy a czegoś nie lubimy.
Opisane powyżej typy uczenia należą do prostych jego form. Istnieją ponadto
bardziej złożone formy uczenia. Dzięki nim możemy, często w sposób niezau-
ważony, zgromadzić ślady pamięciowe niezbędne dla naszego sukcesu w życiu.
Należy tu wpajanie czyli imprinting – zjawisko polegające na tym, że pewne
bodźce działające w tzw. okresie krytycznym, zazwyczaj krótko po urodzeniu,
sterują naszym dalszym życiem. Tak np. pierwsze spotykane duże obiekty iden-
tyfikujemy z rodzicami, a pozwala nam to samookreślić swoją przynależność
Kartka nr: 26 Strona nr: 26

8 marca 1999 20:43
a2.tex
Nr 1
Biologia pamięci
27
gatunkową, bez czego nie ma potem dobrego życia społecznego. To samo wy-
stępuje u zwierząt. Ale jeżeli na przykład pisklę kury zamiast kwoki zobaczy
czerwony balonik, to uzna go za matkę, i za nim, a nie za kwoką będzie podążać.
Małpy wychowywane od urodzenia w izolacji od rodziców i innych małp nie na-
uczą się nigdy normalnego życia społecznego, ze względu na brak identyfikacji
z gatunkiem.
Innym rodzajem uczenia złożonego jest tzw. uczenie opóźnione lub uśpione.
Przykładowo, jeżeli szczur, który po przebywaniu jakiś czas w labiryncie, gdzie
nie był poddawany żadnym testom, dostanie po pewnym czasie do wykonania
jakieś zadanie typu operacyjnego w tymże labiryncie, to uczy się znacznie le-
piej niż szczur, który w tym labiryncie znalazł się po raz pierwszy. Ten rodzaj
uczenia jest bardzo ważny, ponieważ od niego zależy dalszy rozwój osobnika.
Zarówno szczury hodowane w tzw. środowisku wzbogaconym, jak i dzieci cho-
wane w rodzinach, gdzie mają ciekawe życie i wiele kontaktów intelektualnych,
znacznie lepiej się uczą i mają wyższy współczynnik inteligencji, niż szczury
czy dzieci żyjące w środowisku ubogim, w środowisku, w którym prawie nic się
nie dzieje, a mózg nie jest poddawany nowym bodźcom.
Inny typ uczenia złożonego to uczenie zastępcze, zwane też obserwacyj-
nym, polegające na uczeniu się przez naśladowanie. Odgrywa ono ważną rolę
w rozwoju osobników i jest potężnym czynnikiem tworzącym pewne kultury czy
też typy zachowania. Przykładem takiego uczenia może być wydarzenie, które
miało miejsce w Wielkiej Brytanii w końcu lat 60. Firmy mleczarskie musiały
zrezygnować z pozostawiania na zewnątrz domów butelek z mlekiem zamyka-
nych folią aluminiową, ponieważ najprawdopodobniej jedna sikorka nauczyła się
przypadkiem, że może przebić dzióbkiem tę folię i wypić śmietankę. W prze-
ciągu trzech lat sikorki brytyjskie nauczyły się tego zachowania jedne od drugich
i butelki trzeba było zastąpić kartonami. Oczywiście u innych zwierząt, a zwłasz-
cza u ludzi, uczenie przez obserwację („małpowanie”) odgrywa bardzo istotną
rolę. Bardzo często dzieci bawią się w dom czy w rodzinę, naśladując postawy,
jakie podpatrzyły w domu rodzinnym. W ten sposób w różnych kulturach ina-
czej jest np. określona rola kobiety, stosunek do kary cielesnej czy nadużywania
alkoholu.
Na zakończenie chciałbym jeszcze powiedzieć parę słów o osłabianiu pa-
mięci u ludzi starszych. Fakt ten wynika z postępującego utrudniania pracy
komórek nerwowych w wyniku zmniejszenia krążenia mózgowego (miażdżyca)
i odkładania barwnika starczego, lipofuscyny, a głównie ze stałego ubytku neu-
ronów, które są komórkami, które utraciły zdolność rozmnażania. Z wiekiem,
począwszy od trzeciego roku życia, ich liczba się zmniejsza i w końcu, zazwy-
czaj w siódmej czy ósmej dekadzie, ich ilość już nie wystarcza na normalne
Kartka nr: 27 Strona nr: 27

8 marca 1999 20:43
a3.tex
28
J. Vetulani
Nr 1
funkcjonowanie mózgu. Powstaje jednak pytanie, dlaczego niektóre stare osoby
świetnie sobie dają z tym radę, a inne nie. Sądzę, że w sytuacji, w której liczba
neuronów się zmniejsza, bardzo istotne jest organizowanie i gospodarka naszymi
zasobami pamięci. Zasadniczą rolę odgrywa tu intelekt. Kształcenie intelektu to
jest to, co pozwala do późnych lat zachować świetną świeżość umysłu. Utrzyma-
nie sprawności intelektualnej, kontaktów towarzyskich i prowadzenie aktywnego
trybu życia, może prowadzić do zachowania sprawnej pamięci znacznie dłużej,
niż przy biernym i nieaktywnym trybie życia.
Jako farmakologowi nie wypada mi nie wspomnieć, że istnieją jeszcze różne
leki, którymi można usprawniać pamięć. Istnieje ich wiele, jak dotychczas żaden
nie przyniósł przełomu, ale w wielu wypadkach pomagają, zwłaszcza wówczas,
gdy uszkodzenia pamięci są jeszcze niewielkie.
Lektura uzupełniająca: J. Vetulani: Jak usprawnić pamięć? Wyd. III. Platan, Kra-
ków, 1998.
Kartka nr: 28 Strona nr: 28

8 marca 1999 20:43
a3.tex
NEUR. NEUROCHIR. POL. 1999, Suplement 1
29
Maria Barcikowska
Obraz kliniczny wczesnej fazy choroby Alzheimera
Z Zakładu Neuropatologii, Centrum Medycyny Doświadczalnej i Klinicznej
PAN w Warszawie
Kierownik: Prof. dr hab. A. Kapuściński
Summary
Clinical pattern of early phase of Alzheimer’s disease –
Modern views are pre-
sented on the sequence of neuropathological changes in Alzheimer’s disease and their
correlation with clinical symptoms in early phase of that process. Attention is called to
difficulties in interpretation of the influence of morphotic changes, such as neurofibril-
lary degeneration and senile plaques, on the progression of clinical symptoms. Data are
compared as published by various authors suggesting a diversity of neuropsychological
abnormalities manifesting themselves in the early phases of the disease. Genetic studies
seem also to confirm the complexity of the Alzheimer process and they may explain the
imperfection of clinical diagnostic methods used as yet.
Streszczenie
Przedstawiono obecne poglądy na sekwencję zmian neuropatologicznych w choro-
bie Alzheimera i ich korelację z objawami klinicznymi we wczesnym okresie tego pro-
cesu. Zwrócono uwagę na trudności w interpretowaniu wpływu zmian morfologicznych,
jak zwyrodnienie neurowłókienkowe i płytki starcze, na narastanie zmian klinicznych.
Zestawiono dane publikowane przez poszczególnych badaczy przemawiające za różno-
rodnością odchyleń neuropsychologicznych, ujawniających się w pierwszych fazach tej
choroby. Badania genetyczne wydają się również potwierdzać złożoność procesu alzhe-
imerowskiego i mogą tłumaczyć dotychczasową niedoskonałość diagnostyki klinicznej.
Kartka nr: 29 Strona nr: 29

8 marca 1999 20:43
a3.tex
30
M. Barcikowska
Nr 1
Wstęp
Choroba Alzheimera stanowi diagnostyczne wyzwanie dla klinicysty, głów-
nie dlatego, że zgodnie z kryteriami NINCDS-ADRDA [18] jej pewne rozpozna-
nie jest możliwe wyłącznie na podstawie badania neuropatologicznego. Specy-
fiką schorzenia jest także i to, że zanim pojawiają się kliniczne objawy choroby,
musi dojść do pełnego rozwinięcia jej typowych wykładników morfologicznych
takich jak: degeneracja neurofibrylarna neuronów i obecność licznych złogów
amyloidu, pod postacią blaszek starczych i depozytów rozlanych. Często także
rozpoznanie różnicowe przyczyny otępienia można przeprowadzić tylko opie-
rając się na obrazie morfologicznym otępienia naczyniopochodnego i choroby
Alzheimera (chA), a przede wszystkim innych chorób zwyrodnieniowych, któ-
rych wiodącym objawem jest demencja.
Przykładem opracowania bardzo dużego materiału histopatologicznego jest
praca Jelingera i wsp. z 1994 [11]. Ocena neuropatologiczna dotyczyła 1200
mózgów osób z rozpoznanym klinicznie otępieniem. Wykazała ona, że tzw. czy-
ste zwyrodnienie alzheimerowskie było przyczyną otępienia w 43%, tzw. czyste
otępienie naczyniopochodne, w którym udowodniono wyłącznie uszkodzenie na-
czyń – w 13%, a przypadki mieszane, czyli takie, które wykazują cechy zwyrod-
nienia alzheimerowskiego i naczyniopochodnego – w 25%. Pozostałe przypadki
stanowiły rzadsze choroby zwyrodnieniowe ośrodkowego układu nerwowego.
O ile bezwzględnie potrzebne jest wykonanie badania neuropatologicznego,
ażeby postawić stuprocentowo pewne rozpoznanie choroby Alzheimera, to na-
leży także mieć świadomość tego, że wraz z rozwojem coraz bardziej precyzyj-
nych metod oceny klinicznej, prawdopodobne rozpoznania przyżyciowe znajdują
potwierdzenie w badaniach autopsyjnych w coraz wyższym procencie. W bada-
niach CERAD aż w 87% zanotowano trafność rozpoznania klinicznego choroby
Alzheimera po weryfikacji morfologicznej, w badaniu histopatologicznym [8].
A więc nie musimy popadać jako klinicyści w nihilizm. Jest bowiem możliwe,
ażeby na podstawie oceny klinicznej rozpoznać chA z bardzo dużym prawdopo-
dobieństwem.
Obraz neuropatologiczny
Większość autorów uważa, że zajęcie przez proces patologiczny hipokampa
[1] powoduje zaburzenia pamięci [3, 4, 10]. Wiadomo również, że uszkodzenie
kory nowej może niekiedy wyprzedzać pojawienie się zmian w hipokampie [14].
Od 1993 roku jednakże stosuje się powszechnie, w celu neuropatologicz-
nej diagnostyki chA – kryteria stopniowania narastania zmian typu alzheime-
rowskiego opracowane przez Braak’a i wsp. z 1993 [5] roku. Stopniowanie to
Kartka nr: 30 Strona nr: 30

8 marca 1999 20:43
a3.tex
Nr 1
Obraz kliniczny wczesnej fazy choroby Alzheimera
31
opiera się na korelacji zaawansowania cech otępienia stwierdzanych w bada-
niu klinicznym i nasilenia liczby neuronów ze zwyrodnieniem neurofibrylarnym
w obszarze hipokampa i kory śródwęchowej z subiculum. Autorzy metody uwa-
żają, że w chA najwcześniejsze zmiany pojawiają się w korze śródwęchowej
i hipokampie, a następnie dopiero w korze nowej – w płatach skroniowych
i czołowych. Według cytowanego powyżej stopniowania w. Braaka i wsp. [5]
liczba neuronów z cechami zwyrodnienia neurofibrylarnego, świadcząca o po-
jawianiu się zmian typu alzheimerowskiego w mózgach pacjentów, początkowo
bez cech klinicznie rozpoznawanego otępienia to stadia – I do IV. Przypadki,
w których już klinicznie stwierdza się cechy otępienia, to stadium V i VI. Ażeby
pojawiło się otępienie liczba zmienionych neuronów musi być bardzo znaczna,
odpowiadająca stadium IV, V i VI. W chwili obecnej hipoteza dotycząca pier-
wotnego objęcia alzheimerowskim procesem zwyrodnieniowym w pierwszej ko-
lejności układu limbicznego, znajduje potwierdzenie w większości przypadków
klinicznych.
Wyniki badań opublikowanych w 1997 roku przez Price’a i Morris’a [21] –
dwu bardzo znanych i doświadczonych neuropatologów amerykańskich, którzy
zajmują się badaniami nad chorobą Alzheimera od wielu lat, oparte były na ma-
teriale złożonym z 35 mózgów osób, w wieku od 51 do 89 roku życia z pełną
diagnostyką neuropsychologiczną. Byli to chorzy z bardzo łagodnym otępieniem
(CDR-0.5) i bez cech otępienia (CDR -0). CDR (Clinical Dementia Rating) jest
jednym ze znanych testów przesiewowych. Okazało się, że w grupie osób zdia-
gnozowanych jako CDR-0 zwyrodnienie neurofibrynalne neuronów było obecne
we wszystkich przypadkach w okolicach predysponowanych do pojawiania się
tych zmian, co odpowiadało wczesnym fazom skali Braaka i wsp. [5] – od I do
IV. W 30 przypadkach nie stwierdzono obecności anyloidowych blaszek star-
czych. W pięciu mózgach stwierdzono złogi amyloidu w układzie limbicznym
i w korze nowej i uznano je za przypadki przedkliniczne. Gdyby tych pięciu
chorych żyło dłużej, nie zginęło w czasie np. wypadku samochodowego, rozwi-
nęliby oni objawy choroby Alzheimera. W tej fazie, którą się określa CDR-0.5
jako łagodne otępienie, właściwie zmiany morfologiczne odpowiadały już V i
VI fazie Braaka i wsp. [5].
Znane są jednakże przypadki otępienia z wybiórczym zajęciem płatów czoło-
wych [7], skroniowych [24] potylicznych [13], a nawet wyłącznie jąder podkoro-
wych [15]. Przypadki takie budzą wątpliwość, czy rzeczywiście hipokamp i kora
śródwęchowa są jedynymi strukturami, których zajęcie przez amyloidowe złogi
prowadzi do zaburzeń pamięci [10]. Istotne znaczenie może mieć także zajęcie
przez proces patologiczny jądra Meynerta. Wraz z zaawansowaniem procesu pa-
Kartka nr: 31 Strona nr: 31

8 marca 1999 20:43
a3.tex
32
M. Barcikowska
Nr 1
tologicznego neurony z cechami zwyrodnienia neurofibrylarnego znajdowano we
wszystkich strukturach istoty szarej ośrodkowego układu nerwowego.
Oprócz nieustalonej dotychczas typowej dla chA topografii charakterystycz-
nych zmian patologicznych, nie rozstrzygnięto również, jakie jest progowe na-
silenie blaszek starczych i neuronów z cechami zwyrodnienia neurofibrylarnego
niezbędne dla ujawnienia się wyraźnych niedoborów pamięci. Znanych jest jed-
nakże, współcześnie, kilka skal mających służyć temu celowi. Między innymi
od 1985 roku obowiązują kryteria Khachaturiana [12], definiujące neuropatolo-
giczne rozpoznanie chA. Według tej skali, dla rozpoznania chA w poszczegól-
nych przedziałach wiekowych, liczba blaszek starczych przypadających na 1 mm
kwadratowy powierzchni kory powinna być większa niż: 2–5 w grupie osób po-
niżej 50 roku życia, 8 w wieku 50-65 lat, 10 pomiędzy 66 do 75 roku życia
i 15 powyżej 75 roku życia. Kryteria Khachaturiana (1985) przyjęto dla zmian
ujawnionych przy pomocy impregnacji srebrowej. Nie mogą być one obecnie
uznawane za jedyne, w związku z rozwojem znacznie czulszych technik immu-
nohistochemicznych. Obecnie, oprócz kryteriów Khachaturiana, stosowane są
także kryteria CERAD (ang. Consortium to Establish a Registry for Alzheimer’s
Disease). Są one również oparte o metody klasyczne (impregnację srebrową
i barwienie tioflawiną S) [8].
Objawy kliniczne
Wiadomo, że pierwsze objawy kliniczne związane są z uszkodzeniem układu
limbicznego. Są to przede wszystkim zaburzenia pamięci i orientacji. Rozpozna-
nie wstępnej fazy choroby ma bardzo istotne znaczenie, dlatego, że jeżeli ist-
nieją jakiekolwiek leki, które mogą pomóc choremu; opóźnić przebieg choroby;
wpłynąć na jej dynamikę, to można je zastosować wyłącznie we wczesnej fazie
choroby. W tym pierwszym stadium, które najtrudniej jest rozpoznać i które bar-
dzo często w Polsce nie jest rozpoznawane. Dlatego należy uwrażliwić, przede
wszystkim lekarza pierwszego kontaktu, na objawy, które powinny kazać zasta-
nowić się nad tym, czy u chorego nie zaczyna się proces otępienny.
Te pierwsze objawy to, jak powiedziano: zaburzenia pamięci i orientacji, te
które zazwyczaj pierwsze, choć nie zawsze, są przyczyną tego, że pacjent szuka
pomocy u lekarza. Często towarzyszą im zaburzenia zachowania lub//i nastroju.
Rola skarg na zaburzenia pamięci wydaje się być bardzo ważna, nie należy jej
bagatelizować. Wieloletnie badania wykazały, że wśród osób ze skargami na
zaburzenia pamięci w wywiadzie otępienie rozwija się znacznie szybciej, niż
u osób bez takiego wywiadu [22].
Kartka nr: 32 Strona nr: 32

8 marca 1999 20:43
a3.tex
Nr 1
Obraz kliniczny wczesnej fazy choroby Alzheimera
33
Jeżeli lekarz pierwszego kontaktu, podejrzewa, że skargi chorego są uza-
sadnione, zazwyczaj szuka pomocy lekarza psychiatry (w przypadkach domi-
nowania zaburzeń zachowania i nastroju) lub neurologa. Rola neurologa w po-
czątkowym okresie polega głównie na wykluczeniu innych, niż zwyrodnienie
alzheimerowskie przyczyn otępienia. Jeżeli jest to początek chA, jedynym, naj-
częściej spotykanym odchyleniem w badaniu neurologicznym jest stwierdzenie
obecności objawów deliberacyjnych, przy braku zaburzeń równowagi i odchyleń
ogniskowych.
Najważniejszą oceną we wstępnej fazie choroby Alzheimera jest badanie
psychologiczne. W okresie, w którym badanie przesiewowe wykonane przez
neurologa czy psychiatrę nie wykaże jeszcze cech otępienia, w badaniu neurop-
sychologicznym cechy te już są obecne.
Objawy wczesnej fazy choroby Alzheimera, te najmniej charakterystyczne, to
zapominalstwo i roztrzepanie. Poza tym występują: uczucie ciągłego zmęczenia,
trudności w przypominaniu znanych sobie słów, niemożność uczenia się nowych
informacji, pogorszenie oceny wydarzeń i możliwości funkcjonowania w społe-
czeństwie. Przytoczone, ostatnio opublikowane badania hiszpańskie z 1997 roku,
dotyczyły przyczyn, dla których chory zgłasza się do lekarza. Przede wszystkim
były to zaburzenia poznawcze w 93%, zaburzenia nastroju w 34%, zaburzenia
czynności dnia codziennego – w 31%, i zaburzenia zachowania – 30%. Zabu-
rzenia poznawcze, to pogorszenie pamięci w 63% i znacznie rzadziej funkcji ko-
rowych, takich jak: apraksja, afazja i agnozja (w 23%), zaś zaburzenia nastroju,
to znaczy: depresja w 20%, niepokój w 6% i rozdrażnienie w 6%. Zaburze-
nia zachowania niekiedy mogą wyprzedzać zaburzenia pamięci, chociaż w 93%
pierwszym objawem są najczęściej jednak skargi na pogorszenie pamięci. Zabu-
rzenia zachowania to najczęściej: apatia (72% chorych), pobudzenie: 60%, lęk
– 48% i drażliwość w 42%. Odchylenia te w sposób statystycznie znamienny
zależą od pogłębiających się zaburzeń poznawczych [19]. Istotne znaczenie ma
także przedchorobowa osobowość chorego. Przede wszystkim osoby z depresją
w wywiadzie częściej chorują na chA [23].
Innym objawem klinicznym, który powinien wzbudzić czujność lekarza
pierwszego kontaktu, jest ubytek wagi. Obniżenie wagi ciała jest typowe dla
wczesnej fazy chA. Udowodniły to ostatnio opublikowane badania Cronin-Stubs
i wsp. z 1997 roku [6]. Autorzy tej pracy udowadniają, że najczęstszą przyczyną
utraty wagi w wieku podeszłym jest choroba Alzheimera. Nawet nie choroba no-
wotworowa i nie przewlekła niewydolność krążenia.
Kartka nr: 33 Strona nr: 33

8 marca 1999 20:43
a3.tex
34
M. Barcikowska
Nr 1
Badania genetyczne w chorobie Alzheimera
Amyloid został wyizolowany z naczyń oponowych przez Glennera i Wonga
w 1984 [9] roku, zaś ze złogu amyloidu, znajdującego się w neuropilu przez
Mastersa w 1985 roku [16]. Autorzy Ci określili skład aminokwasowy N-końca
tego białka. W trzy lata później sklonowano gen kodujący Aβ mapując go do
chromosomu 21. Do tej pory opisano już kilka mutacji w obrębie tego genu,
powodujące dziedziczną postać chA o wczesnym i późnym początku. Wiadomo,
że Aβ, wchodzący w skład blaszek starczych, o charakterystycznej konformacji
β fałdowej, jest częścią większego białka błonowego zwanego białkiem pre-
kursorowym dla amyloidu (beta amyloid prekursor protein, β APP). Nie jest
znana biologiczna funkcja βAPP, wiadomo jednak, że występuje powszechnie
w oun oraz w innych tkankach. Przemiana patologiczna βAPP, przy zaangażowa-
niu nieznanych jeszcze enzymów, prowadzi do uwalniania nierozpuszczalnego
fragmentu Aβ odkładającego się zewnątrzkomórkowo. Aβ – stanowi główny
czynnik patogenetyczny w chorobie Alzheimera. Nie jest to jednak czynnik je-
dyny. O ile Aβ stanowi fragment białka kodowanego przez gen na chromosomie
21, to geny kodujące preseniliny zlokalizowano na chromosomach 14 i 1 (wg
kolejności odkrycia), zaś gen dla apolipoproteiny E na chromosomie 19. W ob-
rębie genów na chromosomie 14 i 1 opisano już także znaczną liczbę mutacji,
głównie w przypadkach rodzinnych chA, o wczesnym początku. Rola tych białek
w dużym uproszczeniu i hipotetycznie sprowadza się do tego, że nasilają one,
w niejasny jeszcze sposób, odkładanie się Aβ w neuropilu mózgów osób z chA.
Ostatnio badania przez „linkage” wykazały związek chromosomu 12 z przypad-
kami późnymi, sporadycznymi o początku zachorowania po 75 roku życia i 17
z postacią czołowo- skroniową otępienia [20].
Fakt, że w patogenezie chA rozważa się udział sześciu różnych genów świad-
czy o złożoności tego procesu. Ważne jest także pamiętanie, że przypadki uwa-
runkowane genetycznie to zaledwie 5% w porównaniu z 95% przypadków spo-
radycznych. Z kolei przypadki sporadyczne wiąże się z obecnością alleli e4e4
lub e3e4 genu dla apolipoproteiny E (APO E) [17].
Kliniczne rozpoznanie wczesnej fazy choroby Alzheimera
Badania pracowniane, które należy wykonać w okresie, kiedy pacjent do-
piero zaczyna chorować to PET, którego w Polsce nie mamy, SPECT, który
już działa w różnych ośrodkach, ale ciągle jeszcze nie jest metodą rutynową
w przypadku choroby Alzheimera. W Stanach Zjednoczonych SPECT, jako naj-
tańszy, jest traktowany jako badanie z wyboru, rutynowe przed tomografią kom-
puterową. Spektroskopia rezonansu magnetycznego: są już w Polsce pierwsze
Kartka nr: 34 Strona nr: 34

8 marca 1999 20:43
a3.tex
Nr 1
Obraz kliniczny wczesnej fazy choroby Alzheimera
35
nieśmiałe próby dostosowania tego badania, również daleko im do użycia ruty-
nowego.
Ciągle jeszcze nie istnieje biochemiczny, przyżyciowy test pozwalający z całą
pewnością rozpoznać chA. Badania takie powinny informować lekarza o toczą-
cych się procesach amyloidogenezy i rozwijaniu się zwyrodnienia neurofibrylar-
nego w neuronach. To nie oznacza jednak, że nie są znane liczne próby ma-
jące na celu wypełnienie tej luki. W płynie mózgowo-rdzeniowym możemy na
początku oznaczyć obniżony poziom beta amyloidu (1-42), albo podwyższony
poziom białka τ wchodzącego w skład włókieniek zwyrodnienia neurofibrylar-
nego). Badania te są ciągle niejednoznaczne. Nie są one wykonywane rutynowo,
ani w Polsce, ani na świecie, ponieważ są bardzo drogie.
Zakończenie
Na zakończenie chcę zwrócić uwagę na to, że po 90 latach badań nad chorobą
Alzheimera [2] w gruncie rzeczy to wszystko co wiemy, o naszych pacjentach,
niewiele różni się od pierwszego klasycznego opisu. Pierwsza pacjentka doktora
Alzheimera zaczęła chorować od zaburzeń zachowania, od patologicznej zazdro-
ści, potem dopiero pojawiły się zaburzenia pamięci, apraksja, niemożność za-
rządzania finansami i nadmierna podejrzliwość. Przypomina to opis niejednego
pacjenta, z którym mamy do czynienia w codziennej praktyce.
Piśmiennictwo
[1] Akiyama H., Tago H., Itagaki S., Mc Geer P.L.: Occurrence of diffuse amyloid
deposits in the presubicular parvopyramidal layer in Alzheimer’s disease. Acta
Neuropathol. 1990, 79, 537.
[2] Alzheimer A.: ¨
Uber eine eigenartige Erkrankung der Hirnrinde. Algemeine Z Psy-
chiatr. Gerichtl. Med. 1907, 64, 146.
[3] Armstrong R.A.: The spatial patterns of β//A4 deposits subtypes in Down’s syn-
drome. Acta Neuropathol. 1994, 88, 353.
[4] Ball M., Hachinski V., Fox A., Kirshen A.J., Fisman M., Blume W., Kral V.A.,
Fox H., Merskey H.: A new definition of Alzheimer’s disease: A hippocampal
dementia. Lancet. 1985, 14.
[5] Braak H., Braak E., Bohl J.: Staging of Alzheimer-related cortical destruction.
Eur. Neurol. 1993, 33, 403.
[6] Cronin-Stubbs D., Beckett L.A., Scherr P.A., Field T.S., Chown M.J., Pilgrim
D.M., Bennet D.A., Evans D.A.: Weight loss in people with Alzheimer’s disease:
a prospective population based analysis, BMJ, 1997, 314, 178.
[7] Foster N.L., Chase T.N., Mansi L.: Cortical abnormalities in Alzheimer’s disease.
Ann. Neurol. 1984, 16, 649.
Kartka nr: 35 Strona nr: 35

8 marca 1999 20:43
a3.tex
36
M. Barcikowska
Nr 1
[8] Gearing M., Mirra S.S., Hedreen J.C., Sumi S.M., Hansen L.A., Heyman A.:
The Consortium to establish a registry for Alzheimer’s disease (CERAD). Part
X., Neuropathology confirmation of the clinical diagnosis of Alzheimer’s disease,
Neurology, 1995, 45, 461.
[9] Glenner G.G., Wong C.W.: Initial report of the purification and characterization
of a novel cerebrovascular amyloid protein. Biochem. Biophys. Res. Commun.,
1984, 120, 885.
[10] Hyman B.T., Kromer B.A., Van Hoesen G.W.: Reinnervation of the hippocampal
perforant pathway zone in Alzheimer’s disease. Ann Neurol. 1987, 21, 259.
[11] Jellinger K.A., Bancher C., Boltzman L.: Incidence of different types of dementia
disorders in a large consecutive autopsy series, Neurobiology of Aging, 1994, 15,
suppl. 1, 577.
[12] Khachaturian Z.S.: Diagnosis of Alzheimer’s Disease. Arch. Neurol. 1985, 42,
1097.
[13] Leuba G., Kraftsik R.: Visual cortex in Alzheimer’s disease: occurrence of neu-
ronal death and glial proliferation, and correlation with pathological hallmarks.
Neurobiol. Aging, 1994, 15, 29.
[14] Mann D.M.A., Yates P.O., Marcyniuk B.: Some morphometric observations on the
cerebral cortex and hippocampus in presenile Alzheimer’s disease, senile demen-
tia of Alzheimer type and Down’s syndrome in middle age. J Neurol. Sci. 1985,
69, 139.
[15] Mann D.M.A., Esiri M.M.: The pattern of acquisition of plaques and tangles in
the brains of patients under 50 years of age with Down’s syndrome. J. Neurol.
Sci. 1989, 89, 169.
[16] Masters C.L., Multhaup G., Simms G., Pottgiesser J., Martins RN., Beyreuther K.:
Neuronal origin of a cerebral amyloid: neurofibrillary tangles of Alzheimer’s di-
sease contain the same protein as the amyloid of plaque cores and blond vessels.
EMBO J. 1985, 11, 2757.
[17] Mayeux R., Saunders A.M., Shea S., Mirra S., Evans D., Roses A.D., Hyman B.,
Crain B., Ming-Xin T., Creighton H., Utility of the apolipoprotein E genotype in
the diagnosis of Alzheimer’s disease, The New Engl. J. Med., 1998, 338, 506.
[18] Mc Khan G. Drachman D., Folstein M., Katzman R., Price D., Stadlan EM.,: Clini-
cal diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDA Work Group
under the suspicies of Department of Health Services Task Force on Alzheimer’s
disease. Neurology, 1984, 34, 939.
[19] Mega M.S., Cummings J.L., Fiorello T., Gornbein J.: The spectrum of behavioral
changes in Alzheimer’s disesase, Neurology, 1996, 46, 130.
[20] Periac-Vance M.A. Bass M.P., Yamoaka L.H., Gaskell P.C., Scott W.K., Terwe-
dow H.A., Menold M.M., Conneally P.M., Smaal G.W., Vance J.M., Saunders
A.M., Roses A.D., Haines J.L.: Complete genomic screen in late-onset Familial
Alzheimer Disease, JAMA, 1997, 278, 1237.
Kartka nr: 36 Strona nr: 36

8 marca 1999 20:43
a4.tex
Nr 1
Obraz kliniczny wczesnej fazy choroby Alzheimera
37
[21] Price J., Morris J.C.: Neuropathologic changes in aging and early AD, Oholo 41st
Conference ”Progress in Alzheimer’s and Parkinson’s Diseases” , Eilat, May 18-
23, 1997, 51.
[22] Schofield P.W., Jacobs D., Marder K., Sano M., Stern Y.: The validity of new
memory complaints in the elderly, Arch. Neurol. 1997, 54, 756.
[23] Strauss M.E., Lee M.M., Di Filippo J.M.: Premorbid personality and behavioral
symptoms in Alzheimer’s disease. Arch. Neurol., 1997, 54, 257.
[24] Wilcock E.: The temporal lobe dementia of Alzheimer’s type. Gerontology. 1983,
29, 320.
Kartka nr: 37 Strona nr: 37

8 marca 1999 20:43
a4.tex
38
Kartka nr: 38 Strona nr: 38

8 marca 1999 20:43
a4.tex
NEUR. NEUROCHIR. POL. 1999, Suplement 1
39
Tadeusz Parnowski
Depresja a choroba Alzheimera
Z II Kliniki Psychiatrycznej Instytutu Psychiatrii i Neurologii
Kierownik: Prof. dr hab. S. Pużyński
Summary
Depression and Alzheimer’s disease –
Despite numerous studies the relationship
between depression and Alzheimer’s disease has not yet been clarified. The high preva-
lence of depression in Alzheimer’s disease has been confirmed but the data on its
incidence vary.
Generally, depressed mood is the most prevalent symptom in 0–86% of dementia
syndrome, minor depression, dysthymia is considered to be present in 20–30% of pa-
tients and major depression is least frequent. It seems confirmed that depression may
be considered to be a risk factor for dementia, but the coincidence of these two diseases
remains still unknown.
Since the symptoms of depression and dementia are very similar, the clinical picture
brings other controversies. Loss of energy, speech paucity, poor attention and concentra-
tion, diminished interest and psychomotor slowness cannot differentiate dementia from
depression, the disability level seems to be the only differentiating factor. Depression
may be suspected in case of changes in functional level, complaints about pain and di-
urnal variation of symptoms. From the practical point of view the type of contact and
the willingness to perform tests are among the crucial symptoms.
Sometimes, it is difficult to separate apathy and pathological crying from depression.
The pathomechanism of depression in dementia is not known. The role of serotoninergic
and cholinergic transmission changes, alterations of glucocorticoid cascade and pres-
ence of apoE are considered but without evident results.
Streszczenie
Związek pomiędzy depresją i chorobą Alzheimera, mimo licznych badań, nie został
ustalony. Wszystkie publikacje analizujące to zagadnienie zwracają uwagę na częstość
występowania depresji w chorobie Alzheimera, ale dane dotyczące rozpowszechnienia
nie są zgodne. W artykule omówiono rodzaje związku depresji z otępieniem alzheime-
rowskim oraz przypuszczalne patomechanizmy.
Kartka nr: 39 Strona nr: 39

8 marca 1999 20:43
a4.tex
40
T. Parnowski
Nr 1
Obserwacje dotyczące współwystępowania depresji i zaburzonych funkcji
poznawczych odnotowywane były już dawno. W X wieku Ishaq ibn Imran pi-
sał o tym, że „melancholia to osłabienie intelektu, zaburzenia pamięci i rozu-
mienia”, a w XIX wieku Albert Mairet opisał w swojej monografii „otępienie
melancholiczne” (De la demence melancolique. Contribution a l’etude de la pe-
riencephalite chronique localisee et a l’etude des localizations cerebrales d’ordre
psychique), czego efektem było umieszczenie w encyklopedii francuskiej w de-
finicji otępienia informacji, że otępienie „poprzedzone jest wystąpieniem smutku
i zmęczeniem umysłu”.
Niejasność rodzaju związków i częstości występowania depresji w zespo-
łach otępiennych spowodowała powstanie szeregu terminów usiłujących opisać
to zjawisko. W 1979 roku Wells na określenie zespołu depresyjnego imitującego
klinicznie otępienie o nasileniu niewielkim wprowadził pojęcie „pseudodemen-
cji”. Uważał on, że pojęcie to opisuje zjawisko odmienne od współwystępowania
depresji i otępienia, gdzie depresja „nakładałaby się” na proces otępienny [47].
„Otępienie rzekome” występować ma u pacjentów młodszych – w wieku 50-
55 r.ż. i dotyczy 10–20% chorych. Cechami odróżniającymi tych chorych od
chorych z otępieniem ma być niższy iloraz inteligencji, gorsze funkcjonowanie
społeczne, częstsze choroby somatyczne, płeć kobieca.
Pojęcie „pseudodemencji”, jako nie wyczerpujące całości problemu było
krytykowane. Kolejne próby stworzenia użytecznego klinicznie terminu zostały
przedstawione przez Folsteina i Rabinsa [13]. Autorzy zaproponowali stosowa-
nie takich terminów jak: otępienie depresyjne, depresja z zaburzeniami poznaw-
czymi, zespół jąder aminergicznych. Jednocześnie czynione były próby określe-
nia związku pomiędzy depresją a zespołem otępiennym w przebiegu choroby
Alzheimera.
Mimo stwierdzenia różnic w obrazie klinicznym pomiędzy chorymi z depre-
sją i chorobą Alzheimera o nasileniu niewielkim, różnice jakościowe nie zostały
dotychczas przekonywująco udokumentowane. W depresji występują wyraźne
zaburzenia takich funkcji poznawczych jak zaburzenia koncentracji uwagi, szyb-
kości przetwarzania informacji, umiejętności rozwiązywania problemów, pamięci
i uczenia się, jednak w nielicznych tylko badaniach stwierdzono podobieństwo
do zmian w wczesnym etapie choroby Alzheimera [39]. W wykonywanych za-
daniach chorzy z depresją z trudnością rozkodowywują informacje wymagające
wysiłku, natomiast informacje odkodowywane automatycznie nie sprawiają im
kłopotów, w przeciwieństwie do chorych z otępieniem, u których proces auto-
matycznego odkodowywania jest uszkodzony. Nie stwierdzono różnic pomiędzy
chorymi z depresją i z chorobą Alzheimera w zadaniach rozpoznawania i różni-
cowania materiału słownego i wzrokowego. Sądzić można, że chorzy z depresją
Kartka nr: 40 Strona nr: 40

8 marca 1999 20:43
a4.tex
Nr 1
Depresja a choroba Alzheimera
41
wykazują deficyt głównie w zadaniach wymagających szybkości i koncentracji
uwagi [8].
Najbardziej całościowo problematykę związku pomiędzy depresją i otępie-
niem sformułowali Kral [20] i Reifler [38] (por. także [41]):
1. depresja jest przyczyną otępienia. Występowanie nawracających zespołów
depresyjnych w okresie 10 lat przed wystąpieniem otępienia jest uważane za
prawdopodobny czynnik ryzyka [17]. Także występowanie depresji w cza-
sie krótszym niż 10 lat przed pojawieniem się objawów otępienia może mieć
znaczenie predykcyjne lub przyczynowe [6]. W 5-letnich badaniach kata-
mnestycznych przeprowadzonych przez Kivela [19], u 12% chorych z dużą
depresją wystąpił zespół otępienny;
2. depresja jest wczesnym objawem otępienia. Stwierdzono, że depresja u cho-
rych z zespołem otępiennym występuje później niż u chorych bez otępienia
[2]. Stwierdzono zwiększone ryzyko występowania chA u chorych z średnio
nasilonym zespołem depresyjnym [11];
3. depresja i otępienie są odrębnymi chorobami o różnej patogenezie i wystę-
pują niezależnie od siebie.
Ostatnie wyniki badań Pearlsona [33] zwiększają niejasności dotyczące
związków pomiędzy chorobą afektywną i chorobą Alzheimera. Wykazały one, że
u krewnych I i II stopnia depresyjnych pacjentów z chorobą Alzheimera częściej
występuje depresja, a ryzyko wystąpienia depresji u tych krewnych jest wyż-
sze, niż u krewnych pacjentów z chorobą Alzheimera, u których nie stwierdzono
objawów depresji. Depresja jest też najczęstszym zaburzeniem psychicznym wy-
stępującym w przeszłości u chorych z chA (występuje u 14% chorych) [12].
W badaniach neuropatologicznych stwierdzono znaczniejsze zmniejszenie liczby
komórek miejsca sinawego u depresyjnych pacjentów z chorobą Alzheimera niż
u pacjentów z chorobą Alzheimera bez objawów depresji. Hipoteza ta uzasadnia
stosowanie w leczeniu prekursorów serotoniny (5 HT). Diagnostyka różnicowa
zespołów depresyjnych i otępiennych napotyka wiele trudności. Mimo ogólnego
przekonania, że w otępieniu naczyniopochodnym jest więcej objawów depresji,
które mogą być czynnikiem różnicującym od otępienia w chorobie Alzheimera,
badania porównawcze nie stwierdziły różnicy w nasileniu psychologicznych ob-
jawów depresji [41]. Przydatna w diagnostyce różnicowej choroby Alzheimera
i zespołów depresyjnych może być elektroencefalograficzna analiza snu i badania
z użyciem technik obrazowych.
Częstość występowania depresji w chorobie Alzheimera
Częstość występowania objawów depresji w chorobie Alzheimera wynosi
od 0% (rozpoznanie według kryteriów klinicznych) do 86% (rozpoznanie na
Kartka nr: 41 Strona nr: 41

8 marca 1999 20:43
a4.tex
42
T. Parnowski
Nr 1
podstawie informacji uzyskiwanych od krewnych). U ok. 15–40%, a w niektó-
rych badaniach aż u 60% pacjentów z chorobą Alzheimera występuje zespół
depresyjny [41]. Próba uściślenia tych danych natrafia na trudności wynikające
z odmienności metodologicznych badań.
W badaniach Reiflera [37] stwierdzono objawy depresyjne u 23% pacjen-
tów z chorobą Alzheimera leczonych ambulatoryjnie. Alexopoulos [1] określił
częstość występowania depresji w chorobie Alzheimera na 17–50%, Forsell [14]
na 11.4% w populacji osób w wieku powyżej 75 r.ż. Wpływ doboru metod ba-
dawczych na określenie częstości występowania przedstawił Troisi [45] w grupie
26 pacjentów ambulatoryjnych z chA o nasileniu głębokim. Zastosowanie Skali
Oceny Depresji Hamiltona (HRSD) wykazało, że depresja występowała u 38%
pacjentów, natomiast zgodnie z kryteriami DSM-IIIR (Diagnostic and Statistical
Manual) tylko u 23%. W badaniu Brodatego [5] częstość występowania depresji
w otępieniu zgodnie z kryteriami HRSD wynosiła 7.4%, na podstawie Geria-
trycznej Skali Oceny Depresji (GRS) – 8%, a zgodnie z kryteriami DSM-IV –
u 6.3%. W celu bardziej precyzyjnego określenia częstości występowania au-
torzy próbują określić bądź poszczególne objawy depresji, bądź ich nasilenie.
Reichman [36] stwierdził występowanie nastroju depresyjnego z towarzyszącą
anhedonią u 40.3% chorych, natomiast innych objawów depresyjnych u 49.3%
chorych. Lyketsos [27] stwierdził, że u 51% chorych z chA występowało niewiele
objawów depresji, u 27% występowała „mała depresja”, a u 22% duża depre-
sja. W kolejnym badaniu 120 chorych z prawdopodobną chA stwierdził u 28%
obecność „dużej depresji” a u 17% „małą depresję” [26].
Dane dotyczące występowania dużej depresji w chorobie Alzheimera wy-
kazują także dużą niezgodność – od 1.5% do 20–30% pacjentów [46]. Rozpo-
wszechnienie i zapadalność na depresję w możliwej lub prawdopodobnej cho-
robie Alzheimera oceniała Weiner i wsp. [46] na podstawie informacji zawar-
tych w bazie danych CERAD u 1095 chorych. W 2-letniej katamnezie stwier-
dzono, że zapadalność na depresję w chA wynosiła 1.3% a rozpowszechnienie
1.5%. W ostatnio przeprowadzonych badaniach w grupie 1101 osób w podeszłym
wieku stwierdzono częstsze występowanie depresji u osób z otępieniem w porów-
naniu z ludźmi starymi bez otępienia (11.8%/3.9%) [14]. Częstość występowania
depresji jest podobna w chA i otępieniu naczyniopochodnym (ON) – w bada-
niach Ballarda [3] – 24.1%, ale jest odmienna od wyników badań Reichmana
[36] częściej występuje w ON – u 29% chorych niż w chA – u 10.5%. Także
w populacyjnych badaniach japońskich depresja częściej występowała u cho-
rych z ON (42.8%), niż u chorych z chA (11.1%). Odsetek chorych z depresją
w przebiegu otępienia zwiększał się wraz z wiekiem, natomiast procent chorych
z depresją bez otępienia nie zmieniał się.
Kartka nr: 42 Strona nr: 42

8 marca 1999 20:43
a4.tex
Nr 1
Depresja a choroba Alzheimera
43
Obraz kliniczny
W rozpoznawaniu depresji w chorobie Alzheimera znaczenie mają takie dane
kliniczne, jak obecność objawów depresji, wywiad w kierunku występowania
depresji w przeszłości, dokładny wywiad od opiekuna, szybki początek i nara-
stanie objawów, rodzaj kontaktu z chorym i reakcja na dotychczasowe leczenie.
Chorzy z niewielkim nasileniem otępienia rzadziej zgłaszają skargi na objawy
depresyjne, w otępieniu o nasileniu średnim – nadmiernie je eksponują. W tej
sytuacji niejednokrotnie konieczne jest uzyskanie szczegółowego wywiadu od
opiekuna chorego, który urealnia skargi chorego. Badając chorego z depresją
w przebiegu otępienia zaleca się postępowanie dwuetapowe: zebranie wywiadu
od opiekuna i uzyskanie wypełnionego kwestionariusza nt objawów depresji,
wykluczając w ten sposób chorych bez objawów depresji, a następnie przepro-
wadzenie badania chorego w obecności opiekuna [22].
Chorobę Alzheimera charakteryzuje występowanie licznych objawów psy-
chopatologicznych, takich jak zaburzenia nastroju, postrzegania, myślenia. Czę-
stość występowania objawów związana jest z nasileniem zespołu otępiennego
– we wczesnych etapach otępienia najczęściej występują zaburzenia nastroju,
w nasileniu średnim omamy i urojenia. W 5-letnim badaniu katamnestycznym
Devanand [12] stwierdził znaczące różnice częstości występowania nastroju de-
presyjnego (u 23.9%) i nastroju depresyjnego połączonego z skargami na ob-
jawy somatyczne (u 19.4%) u chorych z chA o nasileniu lekkim i umiarkowanym.
W miarę narastania otępienia częstość występowania nastroju depresyjnego i ob-
jawów somatycznych uległa zmniejszeniu (odpowiednio do 8.3% i 1.1 %).
Różna jest także częstość występowania zaburzeń nastroju w chA w zależno-
ści od stosowanych definicji. Dane wskazują, że zespoły depresyjne i dystymia
występują częściej, izolowane zaburzenia nastroju, depresja jako nastrój, zabu-
rzenia snu – rzadziej. Migliorelli i wsp. [30] stwierdził częste występowanie
zarówno dystymii (28%) jak i depresji (23%). Dystymię stwierdzano po wystą-
pieniu objawów otępienia i była znacząco częstsza w wczesnych etapach choroby.
Autorzy konkludują, że dystymia jest emocjonalną reakcją na narastające otę-
pienie, natomiast depresja spowodowana jest przez czynniki biologiczne. Istotne
wydaje się tu pytanie o definicje stosowanych przez autorów terminów. Dystymia
w wczesnych etapach chA może de facto wyrażać zmiany osobowości, wśród
których mogą znaleźć się objawy uszkodzenia struktur czołowych.
Trudności w rozpoznaniu polegają na odróżnianiu objawów depresji od otę-
pienia. Forsell i wsp. [14] stwierdzili w badaniu populacyjnym, że takie objawy
jak brak energii, zaburzenia koncentracji uwagi, utrata zainteresowań i zaburze-
nia psychoruchowe nie różnicowały depresji od otępienia, natomiast jedynym
Kartka nr: 43 Strona nr: 43

8 marca 1999 20:43
a4.tex
44
T. Parnowski
Nr 1
znaczącym objawem odróżniającym osoby z otępieniem od osób bez otępie-
nia był stopień inwalidztwa. U chorych z otępieniem wystąpienie depresji mogą
sygnalizować takie objawy jak zmiany funkcjonowania, wystąpienie skarg na
dolegliwości bólowe i wahania dobowe objawów [25]. Zarówno depresja jak
i zaburzenia funkcji poznawczych byty związane z zmniejszeniem liczby aktyw-
ności sprawiających przyjemność, było to znacznie bardziej wyrażone u chorych
z chA i nie związane z głębokością uszkodzeń poznawczych [23].
Zarówno w depresji jak i w chA stwierdza się objawy uszkodzenia kory
przedczołowej. Uszkodzeniu środkowych części płatów czołowych i kory ob-
ręczy towarzyszy apatia, obojętność, brak napędu psychoruchowego, natomiast
uszkodzeniu okolic oczodołowych płatów czołowych towarzyszy dowcipkowanie,
seksualne odhamowanie, brak empatii. Jednocześnie apatia, brak napędu psycho-
ruchowego, abulia i wycofanie społeczne są także objawami depresji [15]. Ob-
serwacje kliniczne poparte są badaniami nad metabolizmem i przepływem krwi ,
szczególnie w lewej przedniobocznej korze przedczołowej i korze prawego płata
ciemieniowego i zakrętu tylnego obręczy [10]. Obniżenie przepływu w lewym
środkowym polu przedczołowym związane było z pogorszeniem funkcji po-
znawczych, podczas gdy lęk związany był z zwiększoną aktywnością w prawym
bocznym zakręcie obręczy [4]. Stwierdzono także, że zmniejszenie metabolizmu
glukozy w depresji o późnym początku jest porównywalne z hipometabolizmem
stwierdzonym w chA. Stwierdził znaczące obniżenie metabolizmu w regionach
neokorowych, podkorowych i paralimbicznych [21]. Wyniki badań MRI doty-
czące zmian w depresji i chA nie są jednoznaczne. 0’Brien [32] stwierdził, że
głębokie uszkodzenia istoty białej częściej występują u chorych z depresją, nato-
miast uszkodzenia okołokomorowe – w chA. W badaniach elektrofizjologicznych
stwierdzono także, że chorzy z depresją w przebiegu chA wykazują znacząco
wyższy odsetek fal theta w tylnych częściach mózgu niezależnie od głębokości
otępienia, natomiast u chorych z otępieniem o nasileniu umiarkowanym bez de-
presji częstość występowania fal theta była podobna do chorych depresyjnych
z otępieniem o nasileniu nieznacznym [34].
Obraz kliniczny zespołów depresyjnych przejawia się w postaci zarówno po-
jedynczych objawów jak i pełnego zespołu różnych objawów psychopatologicz-
nych o znacznym nasileniu. Brak wiedzy na temat patomechanizmów powodu-
jących występowanie poszczególnych objawów często prowadzi do niezgodności
w ich ocenie. Dyskutowane jest w piśmiennictwie współwystępowanie apatii
i depresji, czy obecność afektu patologicznego w chA [43]. Wykazano związek
pomiędzy apatią i innymi objawami depresji w otępieniu naczyniopochodnym
i w uogólnionych zmianach naczyniowych w jądrach podstawy, wzgórzu i istocie
białej płatów czołowych, natomiast nie stwierdzono takiego związku pomiędzy
Kartka nr: 44 Strona nr: 44

8 marca 1999 20:43
a4.tex
Nr 1
Depresja a choroba Alzheimera
45
apatią i chA [42, 44]. Określenie częstości współwystępowania apatii i obniżo-
nego nastroju wydaje się jednak zasadne także w odniesieniu do chA, w której
często współwystępują zmiany naczyniowe [28].
Starkstein [43] stwierdził w badaniu grupy 103 chorych z chA, że u 39%
występowały patologiczne zaburzenia afektu: u 25% napady płaczu, a u 14%
napady śmiechu. Chorzy ci charakteryzowali się bardziej nasilonymi cechami
depresji i dystymii (u 47% chorych z depresją występował afekt patologiczny).
Częstsze jest występowanie u tych chorych anosognozji, co umożliwia stawianie
hipotez dotyczących patomechanizmu zmian. Być może afekt patologiczny po-
wstaje wskutek osłabienia kontroli nowej kory i uszkodzenia torebki wewnętrznej
i jąder podstawy, substancji czarnej, konarów mózgu i drogi piramidowej. Uszko-
dzenie jąder szwu w pniu mózgu i wstępujących włókien serotoninergicznych ma
znaczenie terapeutyczne w postaci stosowania leków przeciwdepresyjnych (sero-
toninergicznych) lub agonistów dopaminergicznych.
Możliwe patomechanizmy występowania depresji w chorobie
Alzheimera
Mechanizmy etiologiczne odpowiedzialne za występowanie depresji w chA
są słabo poznane. W chA potwierdzono liczne uszkodzenia strukturalne w licz-
nych układach neuroprzekaźnikowych, szczególnie cholinergicznym, serotoniner-
gicznym i noradrenergicznym. Potwierdzono obniżenie aktywności cholinergicz-
nej i serotoninergicznej, natomiast postuluje się kompensacyjną nadaktywność
układu serotoninergicznego pozostałych neuronów adrenergicznych. Wiedza ta
ma istotne znaczenie w kontekście stosowanego leczenia objawów pozapoznaw-
czych [35].
W badaniu 120 mózgów chorych z chA stwierdzono znaczącą redukcję
liczby miejsc wychwytu serotoniny, głównie w korze skroniowej. W innych
regionach mózgu nie stwierdzono zmian w stężeniu serotoniny ani kwasu 5-
hydroksyindolooctowego(5-HIAA). Chorzy z zespołem depresyjnym w prze-
biegu chA przyżyciowo mieli znacząco mniej miejsc wychwytu serotoniny w po-
lach korowych niż chorzy z chA bez depresji. Stwierdzono także, że chorzy,
którzy leczeni byli neuroleptykami wykazywali znacząco mniejsze stężenie se-
rotoniny w korze czołowej i stężenie 5-HIAA w korze skroniowej [7].
Podnoszona jest także rola układu cholinergicznego w depresji w chA. Wy-
daje się, że deficyt układu cholinergicznego może pełnić rolę ochronną w za-
pobieganiu wystąpienia depresji. Potwierdzono występowanie depresji w przy-
padku stosowania agonistów cholinergicznych lub inhibitorów acetylocholine-
sterazy [18]. Można postawić hipotezę, że chorzy z osobowością skłonną do
Kartka nr: 45 Strona nr: 45

8 marca 1999 20:43
a4.tex
46
T. Parnowski
Nr 1
depresji, u których z powodu chA zastosowano leczenie agonistami receptora
nikotynowego lub muskarynowego, są szczególnie podatni na wystąpienie de-
presji [48].
Wśród możliwych patomechanizmów mogących mieć udział w współwy-
stępowaniu depresji i choroby Alzheimera wymienia się rolę neuropeptydu Y,
(mającego związek m.in. z depresją, funkcjami neuroendokrynnymi i chA), za-
burzenia równowagi gluko- i mineralokortykoidów, udziału czynników naczy-
niowych i apolipoproteiny E.
Hipoteza kaskady glukokortykoidowej uzyskała potwierdzenie w licznych ba-
daniach od czasu jej przedstawienia przez McEwena w 1992 roku [29]. W ukła-
dzie podwzgórze-przysadka-nadnercza (PPN) glukokortykoidy pełnią rolę ha-
mującą, głównie poprzez działanie na receptory gluko i mineralokortykoidów
w hipokampie. Uszkodzenie pętli kortykosterydów przez czynniki stresowe pro-
wadzi do nadmiernej aktywacji, a w efekcie hyperkortizolemii. Nadaktywność
układu PPN stwierdzono nie tylko w chA, ale także w psychozie Korsakowa,
schizofrenii i gwałtownych zmianach naczyniowych [31]. Normalizacja ośrod-
kowej hyperkortizolemii koreluje z poprawą depresji i wynikami badań neuro-
psychologicznych [40].
Od czasu wyników badań Jorma i wsp. [17] uważa się, że wystąpienie de-
presji 10 lat przed pojawieniem się otępienia jest czynnikiem ryzyka w chA.
Nadal jednak nieznany jest mechanizm odpowiedzialny za występowanie obja-
wów depresji w chA.
Wyniki badań ostatnich lat nad rolą apolipoproteiny E (ApoE) w chA spo-
wodowały wzrost zainteresowania nad związkiem pomiędzy ApoE i depresją
o późnym początku, a także ApoE i depresją w chA. W badaniach potwierdzono
wcześniejsze odkrycia, że występowanie genotypu ApoE ε 4/4 jest związane
z częstszym występowaniem chA i że choroba występuje w wieku wcześniej-
szym [24]. Potwierdzono także zaburzenia funkcji poznawczych u osób zdrowych
posiadających w genotypie ApoE przynajmniej 1 allel ε 4 [50].
Odnośnie roli ApoE ε 4 w depresji o późnym początku nie uzyskano jed-
noznacznych wyników. Tylko w jednym badaniu stwierdzono wzrost częstości
występowania ApoE ε 4 w depresji o późnym początku, lecz wyniki te nie zo-
stały to potwierdzone w innych badaniach [16]. Badania Holmesa i wsp. [16]
wykazały ponadto, że związek pomiędzy ApoE i depresją odnosi się raczej
do ApoE ε 2. Stwierdzono, że wyższa częstość występowania ε 2 związana jest
z znacząco późniejszym początkiem depresji w chA. Autorzy postulują obecność
wspólnego genetycznego czynnika ryzyka dla depresji wieku późnego i chA. Być
może hipoteza ta uzyskuje pośrednie potwierdzenie w pracy Zubenki [49], gdzie
Kartka nr: 46 Strona nr: 46

8 marca 1999 20:43
a4.tex
Nr 1
Depresja a choroba Alzheimera
47
stwierdził 4-krotnie częstsze występowanie ε 4 tylko u chorych z depresją o na-
sileniu psychotycznym w przebiegu chA. Zubenko uważa, że ryzyko wystąpienia
depresji w chA jest niezależne od częstości występowania ε 4. Związek taki nie
został potwierdzony w innych badaniach. Forsell [14] uważa, że depresja nie jest
związana z polimorfizmem ApoE, Lyketsos [26] także nie stwierdza, żeby ApoE
była czynnikiem ryzyka występowania w chA objawów psychopatologicznych,
a w szczególności zaburzeń nastroju.
Podsumowanie
Zaburzenia nastroju występują w chA często i są związane z głębokością
otępienia. W otępieniu o nasileniu niewielkim zaburzenia nastroju mogą wy-
stępować pod postacią dystymii lub zespołu depresyjnego, w miarę narastania
procesu chorobowego częściej występuje izolowane obniżenie nastroju, napady
płaczu patologicznego, zaburzenia snu, apatia. Depresja u pacjentów z chorobą
Alzheimera mimo, że charakteryzuje się liczniejszymi objawami uszkodzenia
funkcjonalnego i poznawczego, może być traktowana jako stan poddający się le-
czeniu. Wyniki badań nad patomechanizmami wskazują na możliwość efektyw-
nego stosowania leków przeciwdepresyjnych działających serotoninergicznie.
Piśmiennictwo
[1] Alexopoulos G.S., Abrams R.C.: Depression in Alzheimer’s disease. Psychiatr.
Clin. North. Am., 1991, 14, 327-340.
[2] Alexopoulos G.S., Young R.C., Meyers B.S.: Geriatric depression: Age of onset
and dementia. Biol. Psychiatr., 1993, 34, 141-145.
[3] Ballard C.G., Cassidy G., Bannister C., Mohan R.N.: Prevalence, symptom pro-
file, and aetiology of depression in dementia sufferers. J. Affect. Disord., 1993,
29, 1-6.
[4] Bench C.J., Friston K.J., Brown R.G., Frackowiak R.S.W.J., Dolan R.J.: Regio-
nal cerebral blond flow in depression measured by positron emission tomography:
The relationship with clinical dimensions. Psychol. Med., 1993, 23, 579-590.
[5] Brodaty H., Luscombe G.: Depression in persons with dementia. Int. Psychoge-
riatr., 1996, 8, 609-622.
[6] Buntinx F., Kester A., Bergers J., Knottnerus J.A.: Is depression in elderly people
followed by dementia? A retrospective cohort study based in general practice. Age
Aging, 1996, 25, 231-233.
[7] Chen C.P., Alder J.T., Bowen D.M., Esir M.M., McDonald B., Hope T., Jobst K.A.,
Francis P.T.: Presynaptic serotonergic markers in community- acquired cases of
Alzheimer’s disease: correlations with depression and neuroleptic medication. J.
Neurochem., 1996, 66, 1592-1598.
Kartka nr: 47 Strona nr: 47

8 marca 1999 20:43
a4.tex
48
T. Parnowski
Nr 1
[8] Christensen H., Griffiths K., Mackinnon A., Jacomb P.: A quantitative review of
cognitive deficits in depression and Alzheimer-type dementia. J. Int. Neuropsychol.
Soc., 1997, 3, 631-651.
[9] Cohen D., Eisdorfer C., Gorelick P., Paveza G., Luchins D.J., Freels S., Ashford
J.W., Semla T., Levy P., Hirschman R.: Psychopathology associated with Alzhe-
imer’s disease and related disorders. J. Gerontol., 1993, 48, 255-260.
[10] Curran S.M., Murray C.M., Van Beck M., Dougall N., O’Carroll R.E., Austin
M.-P., Ebmeier K.P., Goodwin G.M.: A single photon emission computerized to-
mography study of regional brain function in elderly patients with major depression
and with Alzheimer-type dementia. Brit. J. Psychiatr., 1993, 163, 155-165.
[11] Devanand D.P., Sano M., Ming-Xin T., Taylor S., Gurland B.J., Wilder D., Stern
Y., Mayeux R.: Depressed mood and the incidence of Alzheimer’s disease in the
elderly living in the community. Arch. Gen. Psychiatr., 1996, 53, 175-182.
[12] Devanand D.P., Jacobs D.M., Ming-Xin T., Castillo-Castaneda C.D., Sano M.,
Marder K., Bell K., Bylsma F.W., Brandt J., Albert M., Stern Y.: The course
of psychopathologic features in mild to moderate Alzheimer disease. Arch. Gen.
Psychiatr., 1997, 54, 257-263.
[13] Folstein M.F., Rabins P.V.: Replacing pseudodementia. Neuropsychiat. Neuropsy-
chol. Behav. Neurol., 1991, 4, 36-40.
[14] Forsell Y., Corder E.H., Basun H., Lannfelt L., Viitanen M., Winblad B.: Depres-
sion and dementia in relation to apolipoprotein E polymorphism in a population
sample age 75+. Biol. Psychiatry 1997, 42, 98-903.
[15] George M.S., Ketter T.A., Post R.M.: Prefrontal cortex dysfunction in clinical
depression. Depression, 1994, 2, 59-72.
[16] Holmes C., Russ C., Kirov G., Aitchison K.J., Powell J.F., Collier D.A., Lovestone
S.: Apolipoprotein E: depressive illness, depressive symptoms and Alzheimer’s di-
sease. Biol. Psychiatr., 1998, 43, 159-164.
[17] Jorm A.F., van Duijn C.M., Chandra V., Fratiglioni L., Graves A.B., Heyman A.:
Psychiatric history and related exposures as risk factors for Alzheimer’s disease:
A collaborative re-analysis of case-control studies. Int. J. Epidemiol., 1991, 20,
43-47.
[18] Kapen S., Fleming P.D., Drachman D.A.: Cholinergic enhancement and REM sleep
latency in the aged: lecithin does not reproduce physostigmine effect. Neurology,
1986, 36, 1079-1083.
[19] Kivela S.L.: Long-term prognosis of major depression in old age: a comparison
with prognosis of dysthymic disorder. Int. Psychogeriatr., 1995, suppl. 7, 69-82.
[20] Kral V.A.: The relationship between senile dementia (Alzheimer type) and depres-
sion. Can. J. Psychiatr., 1983, 28, 304-306.
[21] Kumar A., Newberg A., Alavi A., Berlin J., Smith R., Reivich M.: Regional cere-
bral glucose metabolism in late- life depression and Alzheimer disease: a prelimi-
nary positron emission tomography study. Proc. Natl. Acad. Sci. USA, 1993, 90,
7019-23.
Kartka nr: 48 Strona nr: 48

8 marca 1999 20:43
a4.tex
Nr 1
Depresja a choroba Alzheimera
49
[22] Logsdon R.G., Teri L.: Depression in Alzheimer’s disease patients: caregivers as
surrogate reporters. J. Am. Geriatr. Soc., 1995, 43, 150-155.
[23] Logsdon R.G., Teri L.: The Pleasant Events Schedule-AD: psychometric proper-
ties and relationship to depression and cognition in Alzheimer’s disease patients.
Gerontologist. 1997, 37, 40-45.
[24] Lopez O.L., Kamboh M.L, Becker J.T., Kaufer D.I., DeKosky S.T.: The apolipo-
protein E ε4 allele is not associated with psychiatric symptoms or extrapyramidal
signs in probable Alzheimer’s disease. Neurology, 1997, 49, 794-797.
[25] Lundquist R.S., Bernens A., Olsen C.G.: Comorbid disease in geriatric patients:
dementia and depression. Am. Fam. Physician., 1997, 55, 2687-2694.
[26] Lyketsos C.G., Baker L., Warren A., Steele C., Brandt J., Steinberg M., Kopunek
S., Baker A.: Depression, delusions, and hallucinations in Alzheimer’s disease:
no relationship to apolipoprotein E genotype. J. Neuropsychiatry Clin. Neurosci.,
1997, 9, 64-67.
[27] Lyketsos C.G., Steele C., Baker L., Galik E., Kopunek S., Steinberg M., Warren
A.: Major and minor depression in Alzheimer’s disease: prevalence and impact. J.
Neuropsychiatry Clin. Neurosci., 1997, 9, 556-561.
[28] Martin R.S., Firinciogullari S., Biedrzycki R.C.: The sources of convergence be-
tween measures of apathy and depression. J. Affect. Disord., 1993, 28, 7-14.
[29] McEwen B.S.: Reexamination of the glucocorticoid hypothesis of stress and aging.
Prog. Brain Res., 1992, 93, 365-383.
[30] Migliorelli R., Teson A., Sabe L., Petracchi M., Leiguarda R., Starkstein S.E.:
Prevalence and correlates of dysthymia and major depression among patients with
Alzheimer’s disease. Am. J. Psychiatr., 1995, 152, 37-44.
[31] Mitchell A.J.: Glucokorticoids and the genesis of depressive illness. Br. J. Psy-
chiatr., 1994, 164, 853-854.
[32] 0’Brien J.T., Desmond P., Ames D., Schweitzer L., Harrigan S., Tress B: A Magne-
tic Resonance Imaging study of white matter lesions in depression and Alzheimer’s
disease. Brit. J. Psychiatr., 1996, 168, 477-485.
[33] Pearlson G.D., Ross C.A., Lohr W.D., Rovner B.W., Chase G.A., Folstein M.F.:
Association between family history of affective disorder and the depressive syn-
drome of Alzheimer’s disease. Am. J. Psychiatr., 1990, 147, 452-456.
[34] Pozzi D., Golimstock A., Migliorelli R., Teson A., Garcia H., Starkstein S.: Qu-
antified electroencephalographic correlates of depression in Alzheimer’s disease.
Biol. Psychiatr., 1993, 34, 386-391.
[35] Raskind M.A., Peskind E.R.: Neurobiologic bases of noncognitive behavioral pro-
blems in Alzheimer disease. Alzheimer Dis. Assoc. Disord., 1994, 8, Suppl. 3,
54-60.
[36] Reichman W.E., Coyne A.C.: Depressive symptoms in Alzheimer’s disease and
multi-infarct dementia. J. Geriatr. Psychiatry Neurol., 1995, 8, 96-99.
[37] Reifler B.V., Larson E., Hanley R.: Coexistence of cognitive impairment and de-
pression in geriatric outpatients. Am. J. Psychiatr., 1982, 139, 623-629.
Kartka nr: 49 Strona nr: 49

8 marca 1999 20:43
a5.tex
50
T. Parnowski
Nr 1
[38] Reifler B.V., Larson E., Teri L., Poulsen M.: Dementia of Alzheimer’s type and
depression. J. Am. Geriatric. Soc., 1986, 34, 855-859.
[39] Rubin E.H., Kinscherf D.A., Grant E.A., Storandt M.: The influence of major
depression on clinical and psychometric assessment of senile dementia of the Al-
zheimer type. Am. J. Psychiatr., 1991, 148, 1164-1171.
[40] Rubin R.T., Phillips J.J., Sadow T.F., McCracken J.T.: Adrenal gland volume in
major depression. Increase during the depressive episode and decrease with suc-
cessful treatment. Arch. Gen. Psychiatr., 1995, 52, 213-218.
[41] Sano M., Stern Y., Wiliams J., Cote L., Rosenstein R., Mayeux R.: Coexisting de-
mentia and depression in Parkinson’s disease. Arch. Neurol. 1989, 46, 1284-1286.
[42] Starkstein S.E., Fedoroff J.P., Price T.R., Leiquarda R., Robinson R.G.: Apathy
following cerebrovascular lesions.Stroke, 1993, 24, 1625-1630.
[43] Starkstein S.E., Migliorelli R., Teson A., Petracca G., Chemerinsky E., Manes F.,
Leiguarda R.: Prevalence and clinical correlates of pathological affective display
in Alzheimer’s disease. J. Neurol. Neurosurg. Psychiatry, 1995, 59, 55-60.
[44] Sultzer D.L., Levin H.S., Mahler M.E., High W.M., Cummings J.L.: A compari-
son of psychiatric symptoms in vascular dementia and Alzheimer’s disease. Am.
J. Psychiatr., 1993, 150, 1806-1812.
[45] Troisi A., Pasini A., Gori G., Sorbi T., Biagini C., Aulisi A., Baroni A., Ciani
N.: Assessment of depression in Alzheimer’s diseaseaymptoms, syndrome, and
computed tomography findings. Dementia, 1993, 4, 87-93.
[46] Weiner M.F., Edland S.D., Luszczynska H.: Prevalence and incidence of major
depression in Alzheimer’s disease. Am. J. Psychiatr., 1994, 151, 1006-1009.
[47] Wells C.E.: Pseudodementia. Am. J. Psychiatr., 1979, 136, 895-900.
[48] Whitehouse P.J.: Intraventricular bethanechol in Alzheimer’s disease: a continuing
controversy. Neurology, 1988, 38, 307-308.
[49] Zubenko G.S., Henderson R., Stiffler J.S., Stabler S., Rosen J., Kaplan B.B.: As-
sociation of the APOE ε4 allele with clinical subtypes of late life depression. Biol.
Psychiatr., 1996, 40, 1008-1016.
[50] Yaffe K. , Cauley J., Sands L., Browner W.: Apolipoprotein E phenotype and co-
gnitive decline in a prospective study of elderly community women. Arch. Neurol.,
1997, 54, 1110-1114.
Otrzymano: 18.06.1998 r.
Instytut Psychiatrii i Neurologii
II Klinika Psychiatryczna
tel. 642–66–11
e-mail:parnow@edu.ipin.pl
Kartka nr: 50 Strona nr: 50

8 marca 1999 20:43
a5.tex
NEUR. NEUROCHIR. POL. 1999, Suplement 1
51
Anna Pfeffer
Diagnostyka różnicowa wczesnej fazy otępienia
Z Zakładu Neuropatologii Centrum Medycyny Doświadczalnej i Klinicznej
PAN
Kierownik: Prof. dr A. Kapuściński
Summary
Differential diagnosis of early dementia –
The principles of differential diagno-
sis are discussed of dementia in Alzheime’s disease against similar syndromes of other
origin. Among the syndromes which should be differentiated from Alzheimer’s disease
those are considered: syndromes erroneously diagnosed as dementia, potentially re-
versible dementia, vascular dementia and dementia in certain degenerative diseases. In
the differential diagnosis history data, results of neurological and neuropsychological
examinations are helpful, while among laboratory investigations brain imaging by CT,
MRI and SPECT are most important.
Streszczenie
W pracy przedstawiono zasady klinicznego różnicowania otępienia występującego
w chorobie Alzheimera z podobnymi zespołami innego pochodzenia. Wśród zespołów,
które winny być we wczesnej fazie różnicowane z otępieniem alzheimerowskim, wzięto
pod uwagę: zespoły mylnie rozpoznawane jako demencja, otępienia potencjalnie odwra-
calne, otępienie pochodzenia naczyniowego i otępienia w niektórych chorobach zwyrod-
nieniowych. Pomocne w różnicowaniu są zarówno dane z wywiadu jak i wyniki badania
neurologicznego oraz neuropsychologicznego. Wśród badań pracownianych istotne zna-
czenie mają obrazy mózgu w CT, MRI i SPECT.
Otępienie (wg kryteriów ICD-10) jest zespołem spowodowanym chorobą mó-
zgu, zwykle o charakterze przewlekłym i postępującym, w którym zaburzone są
takie wyższe funkcje korowe jak: pamięć, myślenie, orientacja, rozumienie, li-
czenie, zdolności językowe, uczenia się i oceny. Świadomość nie jest zaburzona.
Uszkodzeniu funkcji poznawczych towarzyszy zwykle, a czasami je poprzedza,
Kartka nr: 51 Strona nr: 51

8 marca 1999 20:43
a5.tex
52
A. Pfeffer
Nr 1
obniżenie kontroli nad reakcjami emocjonalnymi, społecznymi, zachowaniem
i motywacją. Taki zespół objawów występuje w chorobie Alzheimera, w choro-
bie naczyń mózgowych i innych stanach pierwotnie lub wtórnie wpływających
na mózg. Początkowe objawy mogą być bardzo różne, zarówno ze sfery poznaw-
czej jak i pozapoznawczej, różny może być początek i przebieg. W konsekwen-
cji zespół może być nie rozpoznawany we wczesnej fazie, dopiero w bardziej
zaawansowanych stadiach. Niekiedy niewłaściwa diagnoza stawiana może być
w przypadkach, które choć mają podobny obraz kliniczny, to jednak otępieniem
nie są. Właściwe zaś postawienie rozpoznania już we wczesnej fazie otępienia
nabiera coraz większego znaczenia nie tylko wobec możliwości wychwycenia
jego potencjalnie odwracalnych przyczyn, ale także wobec pojawiających się no-
wych możliwości terapeutycznych.
W związku z tym opracowano ujednolicony system postępowania diagno-
stycznego mający za zadanie pomoc przy rozpoznawaniu otępienia, jak również
przy jego różnicowaniu [2].
Ponieważ najczęstszą przyczyną otępienia w grupie osób w wieku pode-
szłym jest choroba Alzheimera (AD), stąd zarówno postępowanie diagnostyczne
jak i następnie różnicowanie przeprowadzane jest w odniesieniu do niej.
Metody diagnostyczne
Rozpoznanie ustalamy na podstawie:
− wywiadu,
− oceny stanu psychicznego,
− badania neuropsychologicznego,
− badania neurologicznego
− i badań dodatkowych.
Wywiad
Zebrany wyłącznie od pacjenta może być niemiarodajny. Dlatego wszystkie
informacje powinny być uzyskane od opiekuna, bądź przez niego potwierdzone.
Istotne przy rozpoznawaniu otępienia i przy różnicowaniu są: czas trwania
zaburzeń (co najmniej 6 miesięcy wg ICD10), początek – powolny czy nagły
(nagły jest zupełnie nietypowy dla chA, natomiast jest charakterystyczny np. dla
otępienia naczyniowego (ON)), tempo narastania zmian – wolne (tak jak w AD
i innych chorobach neurodegeneracyjnych), ostre (np. zaburzenia metaboliczne,
zatrucie lekami, infekcje CUN), czy podostre (np. procesy rozrostowe CUN,
krwiak podtwardówkowy), przebieg – postępujący (np. AD w której mogą być
Kartka nr: 52 Strona nr: 52

8 marca 1999 20:43
a5.tex
Nr 1
Diagnostyka różnicowa wczesnej fazy otępienia
53
pewne okresy stabilizacji, natomiast nigdy nie ma okresów poprawy), skokowy
(jak w ON), czy też stacjonarny (np. po nagłym zatrzymaniu krążenia), oraz
kolejność pojawiania się objawów – czy pierwsze były zaburzenia pamięci czy
np. zaburzenia zachowania, kiedy pojawiły się objawy parkinsonowskie (często
występujące w różnych chorobach zwyrodnieniowych) itd.
Prawidłowo zebrany wywiad może pomóc w ujawnieniu lub potwierdzeniu
istniejących we wczesnym okresie choroby zaburzeń pamięci, praksji, języko-
wych, wzrokowo-przestrzennych czy sądu. Stąd konieczność zebrania informacji
na temat możliwości przyswajania nowych danych, zawiadywania własnymi fi-
nansami, wypełniania różnego typu formularzy, planowania i przygotowywania
posiłków, samodzielnego robienia zakupów, prowadzenia samochodu itp.
Z wywiadu uzyskujemy również dane na temat przebytych bądź towarzyszą-
cych chorób ze szczególnym uwzględnieniem takich, jak: choroby serca, nadci-
śnienie tętnicze, cukrzyca, choroby tarczycy, udary mózgu, inne neurologiczne,
choroby nowotworowe, depresja, nadużywanie leków i używek (alkohol). Istotny
jest również wywiad rodzinny.
Ocena stanu psychicznego
Przeprowadzana jest przy użyciu co najmniej kilku standaryzowanych skal,
przy pomocy których możemy ocenić stopień głębokości i aktualne stadium
zaawansowania procesu otępiennego, funkcjonowanie chorego w codziennych
sytuacjach życiowych, jak również zaburzenia pozapoznawcze. Ocena taka po-
zwala po pierwsze na stwierdzenie, czy mamy do czynienia z otępieniem czy
nie, a po drugie powtarzana regularnie co 6 – 12 miesięcy umożliwia wery-
fikację rozpoznania w przypadkach wątpliwych, a także ocenę tempa narasta-
nia zmian. Najprostszą skalą, pozwalającą na wstępną ocenę pacjenta jest skala
MMSE (Mini-Mental State Examination) [4]. Może być przeprowadzona przez
każdego lekarza i powinna być wykonana u każdego pacjenta skarżącego się na
problemy z pamięcią.
Badanie neuropsychologiczne
Jest szczególnie istotne na początku i we wczesnej fazie otępienia. Pomaga
postawić prawidłowe rozpoznanie w sytuacji, kiedy niektóre nieznaczne objawy
mogą zostać nieuchwycone przy użyciu jedynie skal przesiewowych; pomaga
również w różnicowaniu np. pomiędzy otępieniem a depresją, czy AD a otępie-
niem czołowo-skroniowym (FTD).
Kartka nr: 53 Strona nr: 53

8 marca 1999 20:43
a5.tex
54
A. Pfeffer
Nr 1
Badanie neurologiczne
Nie ma oczywiście znaczenia przy rozpoznawaniu otępienia, natomiast może
być pomocne przy jego różnicowaniu. We wczesnej fazie AD poza obecnością
objawów deliberacyjnych nie spodziewamy się w zasadzie innych odchyleń. Nie-
kiedy mogą występować objawy pozapiramidowe (sztywność mięśniowa, brady-
kinezja, rzadko drżenie) choć z reguły pojawiają się w bardziej zaawansowanych
stadiach [18]. Natomiast stwierdzenie we wczesnej fazie otępienia objawów ta-
kich jak: niedowład połowiczy, zaburzenia czucia, zaburzenia pola widzenia,
zaburzenia koordynacji, zaburzenia chodu, występowanie zaburzeń zwieraczo-
wych, napadów padaczkowych pozwala z dużym prawdopodobieństwem wyłą-
czyć rozpoznanie AD [14].
Badania pracowniane
Wykonywane są w celu wyłączenia innych niż alzheimerowskie przyczyn
otępienia (głównie potencjalnie odwracalnych). Obejmują podstawowe badania
biochemiczne, badanie poziomu witaminy B12 i kwasu foliowego badanie hor-
monów tarczycy i WR, ekg, rtg kl. piersiowej, eeg, CT lub NMR. Badania neu-
roobrazujące pozwalają wykluczyć rozpoznanie guza czy przewlekłego krwiaka,
zwracają uwagę na możliwość zespołu Hakima i uwidaczniają istniejącą pa-
tologię naczyniową. Natomiast ich przydatność w różnicowaniu pomiędzy AD
a innymi otępieniami zwyrodnieniowymi nie jest duża, choć określając topogra-
fię zaniku (w AD najwcześniej dotyczącego hipokampa a np. w FTD płatów
czołowych i skroniowych) mogą we wczesnej fazie w połączeniu z innymi da-
nymi potwierdzić wstępne rozpoznanie. Najczulsze zarówno przy rozpoznawaniu
AD jak i przy jego różnicowaniu zwłaszcza z FTD jest badanie przepływów –
SPECT [19]. Nie wchodzi ono jednak w zakres rutynowego postępowania dia-
gnostycznego.
Różnicowanie.
Przy różnicowaniu otępienia należy brać pod uwagę:
1. zespoły mogące być mylnie rozpoznawane jako demencja,
2. otępienia potencjalnie odwracalne,
3. otępienie naczyniowe,
4. otępienia pierwotnie zwyrodnieniowe.
Zespoły mogące być mylnie rozpoznawane jako demencja.
Pierwszym kro-
kiem w postępowaniu diagnostycznym jest odpowiedź na pytanie „czy rzeczy-
wiście mamy do czynienia z otępieniem?”, ponieważ istnieje szereg zespołów
mogących być niewłaściwie diagnozowanych jako demencja.
Kartka nr: 54 Strona nr: 54

8 marca 1999 20:43
a5.tex
Nr 1
Diagnostyka różnicowa wczesnej fazy otępienia
55
Zespół zaburzeń pamięci związany z wiekiem.
Wczesna faza otępienia wy-
maga przede wszystkim różnicowania z osłabieniem pamięci, jak również in-
nych funkcji poznawczych, pojawiającym się wraz z wiekiem. Na ujawnienie
się i obraz kliniczny tych zmian w dużym stopniu wpływają także inne czyn-
niki, takie jak ich poprzedni poziom, wykształcenie, aktywność umysłowa, czy
też ogólna kondycja fizyczna. W 1986 r. została wprowadzona definicja zespołu
tzw. zaburzeń pamięci związanych z wiekiem (AAMI). Obejmuje ona osoby po
50 r.ż. z subiektywnymi zaburzeniami pamięci, przeszkadzającymi w codziennej
aktywności, ale nie postępującymi [3]. Kryteria dla AAMI zostały w 1994 r. po-
szerzone o możliwość występowania zaburzeń którejkolwiek z 5 funkcji poznaw-
czych (pamięci, myślenia, koncentracji, językowych i wzrokowo-przestrzennych).
W ten sposób powstał tzw. zespół zaburzeń poznawczych związanych z wiekiem
(AACD). Początek również powinien być stopniowy, czas trwania co najmniej
6 m, przebieg zaś nie postępujący [10].
Brak progresji jest najważniejszą cechą różnicującą te dwa zespoły z wczesną
fazą otępienia. Stąd konieczność badania kontrolnego co 6–12 m.
Depresja.
Pamiętanie o tym, że depresja może imitować otępienie, jest bardzo
istotne, ze względu na możliwość podjęcia właściwego leczenia przy postawie-
niu prawidłowego rozpoznania. Różnicowanie jest trudne, zwłaszcza dlatego, że
oba te zespoły często ze sobą współistnieją. Objawy pomocne przy różnico-
waniu to występujące w depresji: zachowana zdolność uczenia się, dyspropor-
cja pomiędzy skargami a wynikami badań, niechęć do podejmowania wysiłku
przy rozwiązywaniu testów, spowolnienie psychoruchowe, zazwyczaj krótki czas
trwania i wyraźny początek, obecność depresji w wywiadzie, lub pozytywny wy-
wiad rodzinny [17]. Szczegółowe omówienie depresji i jej związku z otępieniem
przedstawione jest w innym miejscu tego suplementu.
Delirium.
Często występuje u osób w wieku podeszłym, np. w prospektywnym
badaniu Francisa i wsp. u 22% wszystkich hospitalizowanych osób powyżej 70
r.ż. [5]. Może również współistnieć z otępieniem, a także być pierwszym wyraź-
nym przejawem istniejącej demencji, na tyle łagodnej, że jej objawy wcześniej
nie były zauważalne przez otoczenie.
Objawy są zazwyczaj przejściowe, obejmują globalne zaburzenia poznawcze
z towarzyszącymi zaburzeniami świadomości o zmiennym nasileniu objawów
w ciągu doby (często największym w nocy), o ostrym początku i krótkim cza-
sie trwania. Mogą być spowodowane przez wiele różnych czynników, takich jak
odwodnienie, leki, infekcje czy inne ostre choroby nie dotyczące bezpośred-
nio CUN.
Otępienia potencjalne odwracalne.
Przyczyn mogących wywołać otępienie
w tej grupie jest wiele (tab. I). Choć ocenia się, że procentowo stanowią one za-
Kartka nr: 55 Strona nr: 55
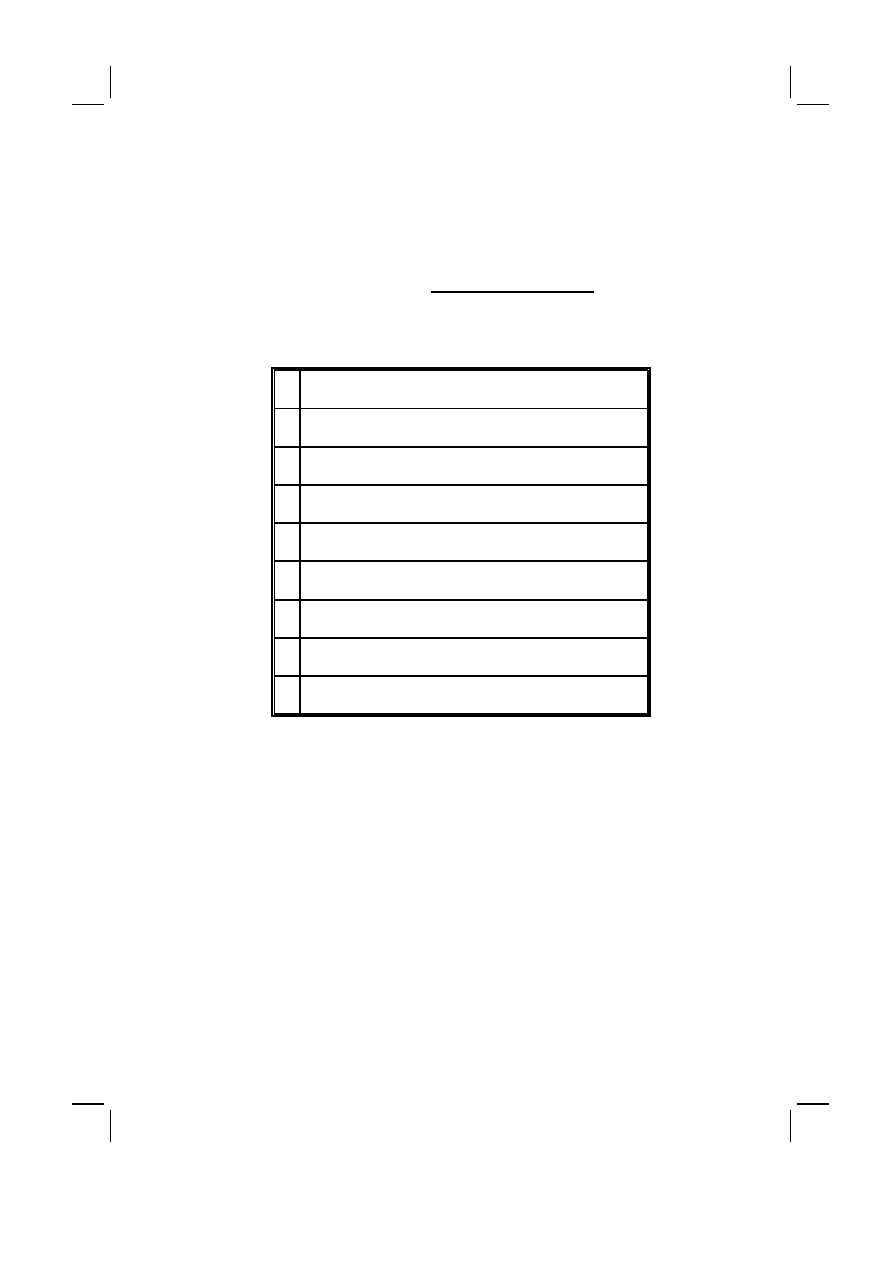
8 marca 1999 20:43
a5.tex
56
A. Pfeffer
Nr 1
ledwie około 1% wśród otępień wieku podeszłego [20], zawsze trzeba brać pod
uwagę taką możliwość i wykonać odpowiednie badania. Prawidłowe rozpozna-
nie pozwala bowiem na wdrożenie leczenia przyczynowego, co jest niemożliwe
w pozostałych przypadkach. Otępienie w tej grupie na ogół nie ma charaktery-
Tabela I :
Potencjalnie odwracalne przyczyny otępienia
Table I :
Potentially reversible causes of dementia
1.
zaburzenia hormonalne (niedoczynność tarczycy)
hormonal disturbances (hypothyroidism)
2.
zaburzenia niedoborowe (vit. B12, kw. foliowy)
deficiency–related (vitamin B12, folic acid)
3.
zaburzenia wynikające z dysfunkcji narządów wewnętrznych
disturbances of functions of internal organs
4.
zaburzenia elektrolitowe (hyponatremia)
electrolyte disturbances (hyponatraemia)
5.
nowotwory: pierwotne i przerzutowe
primary and metastatic tumours
6.
krwiak podtwardówkowy
subdural haematoma
7.
zespół Hakima (wodogłowie normotensyjne)
Hakim syndrome (normotensive hydrocephalus)
8.
zatrucia egzogenne
exogenous intoxications
9.
choroby infekcyjne CUN
CNS infections
stycznych cech pozwalających podejrzewać przyczynę je wywołującą. W więk-
szości rozwija się w sposób ostry lub podostry i rzadko występują tu typowe
dla AD zaburzenia wyższych czynności korowych (afazja, apraksja, akalkulia,
agnozja) [6].
Niekiedy jednak obraz kliniczny może być znamienny. Np. zespół Hakima
z typową triadą objawów pod postacią zaburzeń chodu, moczowych i zaburzeń
poznawczych zazwyczaj pojawiających się w tej właśnie kolejności, co powinno
pozwolić na wyłączenie AD gdzie sekwencja zdarzeń jest odwrotna, czy np.
niedobór vit. B12, jeżeli otępieniu towarzyszą typowe objawy neurologiczne
i/lub anemia.
Otępienie naczyniowe (ON).
Wywołane jest uszkodzeniem mózgu spowodowa-
nym chorobą naczyń mózgowych. Jest drugą co do częstości po AD przyczyną
otępienia w grupie osób w wieku podeszłym, [8] stąd też oba te schorzenia wy-
magają najczęściej różnicowania między sobą.
Kartka nr: 56 Strona nr: 56
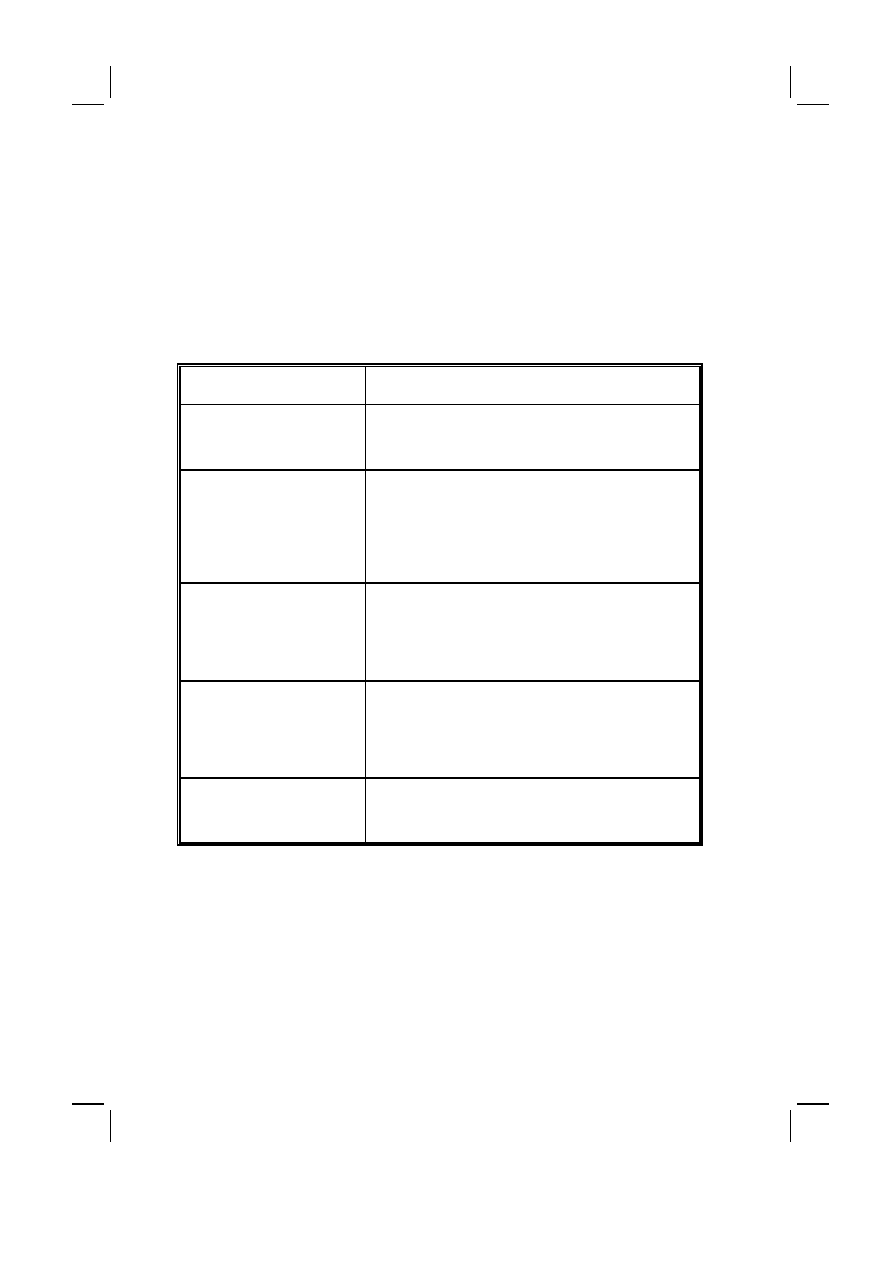
8 marca 1999 20:43
a5.tex
Nr 1
Diagnostyka różnicowa wczesnej fazy otępienia
57
To co jest typowe dla ON, to różnorodność obrazu klinicznego odpowiada-
jąca różnym zmianom naczyniowym stwierdzanym w CT (tab. II). Najbardziej
Tabela II :
Objawy kliniczne otępienia naczyniowego w zależności od obrazu CT (Knopman
i wsp. 1996)
Table II :
Clinical symptoms of vascular dementia in relation to CT findings (Knopman et al.
1996)
Obraz CT
CT image
objawy kliniczne
Clinical symptoms
Liczne udary
Numerous strokes
skokowo pojawiające się zaburzenia pamięci i funkcji
poznawczych, deficyt ruchowy
sudden disturbances of memory and cognitive functions,
motor function dusorders
Pojedynczy udar tzw.
strategiczny
Single (so called strategic)
stroke
nagły początek, zaburzenia pamięci, objawy
neurologiczne w zależności od lokalizacji:
afazja,aleksja,agnozja, apraksja, zespół czołowy,
pobudzenie, objawy psychotyczne
sudden onset, memory loss, neurological signs depending
on localization: aphasia, alexia, agnosia, apraxia, frontal
lobe syndrome, agitation, psychotic symptoms
Ogniska lacunarne
Lacunar lesions
postępujące otępienie spowolnienie psychoruchowe,
apatia, objawy ogniskowe, zespół czołowy, może nie być
udaru w wywiadzie
progressing dementia, psychomotor sluggishness, apathy,
focal signs, frontal lobe syndrome, history of stroke may
be absent
Choroba Binswangera
Binswanger disease
otępienie, spowolnienie psychoruchowe, pobudzenie,
zespół rzekomoopuszkowy, zaburzenia chodu,
nietrzymanie moczu
dementia, psychomotor sluggishness, agitation,
pseudobulbar syndrome, gait disturbances, urinary
incontinence
Proces mieszany
naczyniowo-alzheimerowski
Mixed vascular-Alzheimer
process
postępujące otępienie, udar w wywiadzie
progressive dementia, history of stroke
charakterystyczny i nie budzący z reguły wątpliwości co do rozpoznania obraz to:
nagły początek, skokowy przebieg, nierównomierne rozłożenie deficytu funkcji
poznawczych, obecność ogniskowych objawów neurologicznych, udar i choroby
naczyniowe, zwłaszcza nadciśnienie tętnicze w wywiadzie.
Jednak po wprowadzeniu do rutynowej diagnostyki technik neuroobrazowa-
nia okazało się, że obraz ten stanowi tylko jeden z podtypów ON odpowiadający
licznym udarom stwierdzanym w CT. W innych natomiast początek może być
Kartka nr: 57 Strona nr: 57

8 marca 1999 20:43
a5.tex
58
A. Pfeffer
Nr 1
powolny, przebieg postępujący, może nie być stwierdzanego udaru w wywiadzie,
różne mogą być zaburzenia poznawcze (korowe lub czołowo-podkorowe).
Niejednolitość obrazu klinicznego, brak specyficznego markera biologicz-
nego, możliwość współistnienia z chorobą Alzheimera stwarzać może niekiedy
duże trudności diagnostyczne. Znalazło to odzwierciedlenie w zaproponowa-
nych w 1993 r przez Romanofa i wsp. kryteriach klinicznych ON [16]. Wg. nich
pewne rozpoznanie podobnie jak i w AD stawiamy dopiero po potwierdzeniu
neuropatologicznym. Przyżyciowo zaś, przy stwierdzeniu otępienia, choroby na-
czyniowej mózgu i związku przyczynowego między nimi możemy rozpoznać co
najwyżej prawdopodobne ON (tab. III). Dodatkowo rozpoznanie potwierdzają
Tabela III :
Kryteria
diagnostyczne
prawdopodobnego
otępienia
naczyniowego
wg
NINDS/AIREN, (Roman i wsp. 1993)
Table III :
Diagnostic criteria of probable vascular dementia according to NINDS/AIREN (Ro-
man i wsp. 1993)
Otępienie
Dementia
upośledzenie pamięci i co najmniej dwu innych funkcji
poznawczych w odniesieniu do ich poprzedniego poziomu
i w stopniu utrudniającym życie codzienne chorego
impairment of memory and at least two other cognitive
functions in relation to previous function level, everyday
life impaired
Objawy choroby naczyniowej
mózgu
Symptoms of cerebrovascular
disease
ogniskowe objawy neurologiczne w badaniu (z
obecnością lub bez udaru w wywiadzie) dowody na
uszkodzenie naczyń mózgowych w neuroobrazowaniu
focal neurological signs found on examination (with or
without stroke in history), evidence of cerebrovascular
lesions in neuroimaging
Dowody na związek
przyczynowy pomiędzy
otępieniem a chorobą
naczyniową mózgu
Evidence of causative
relationship between dementia
and cerebrovascular disease
wystąpienie otępienia w ciągu 3 m po udarze nagły
początek falujący skokowo postępujący przebieg
dementia development within 3 months after stroke,
audden onset, progression undulating, step-like
następujące objawy kliniczne występujące we wczesnym okresie choroby: zabu-
rzenia chodu, częste nieumotywowane upadki, zaburzenia moczowe, labilność
emocjonalna i spowolnienie psychoruchowe.
Otępienia pierwotnie zwyrodnieniowe.
Poza chorobą Alzheimera możemy wy-
różnić w tej grupie: otępienie czołowo-skroniowe i otępienia, w których wyróż-
niającą cechą obrazu klinicznego jest obecność zespołu parkinsonowskiego.
Otępienie czołowo-skroniowe.
Jest to grupa chorób bardzo niejednorodna pato-
logicznie, ale charakteryzująca się podobną topografią zmian dotyczących zawsze
Kartka nr: 58 Strona nr: 58

8 marca 1999 20:43
a5.tex
Nr 1
Diagnostyka różnicowa wczesnej fazy otępienia
59
wybiórczo płatów czołowych i skroniowych i dających tym samym podobne ob-
jawy kliniczne. Należy tutaj choroba Picka, tzw. otępienie czołowe typu nie-
alzheimerowskiego i choroba neuronu ruchowego z demencją. Częstość wystę-
powania FTD oceniana jest na podstawie badań neuropatologicznych na około
10% wśród otępień wieku podeszłego [15]. Kryteria kliniczne zostały opraco-
wane w 1994 r. przez grupę z Lund i Manchester [1].
Najbardziej różnicującą cechą jest wczesne występowanie zaburzeń zacho-
wania. Są to zachowania niestosowne społecznie, brak higieny, zaniedbywa-
nie własnego wyglądu, odhamowanie (hyperseksualizm, wesołkowatość, brak
opanowania zarówno w sferze emocjonalnej jak i ruchowej) zachowania ob-
sesyjne, stereotypowe, hyperoralność, brak krytycyzmu i świadomości własnej
choroby. Występują one jako objaw początkowy wyprzedzający zaburzenia pa-
mięci w przeciwieństwie do AD w której zaburzenia pamięci są pierwszym
objawem, a zaburzenia zachowania pojawiają się z reguły w późniejszych jej
stadiach. Wczesne są również zaburzenia afektywne. Część ich, jak depresja,
niepokój sentymentalność, myśli samobójcze, urojenia i hipochondria mogą być
przejściowe, inne (obojętność uczuciowa, inercja, aspontaniczność) trwałe. Nie
mają one dużego znaczenia różnicującego, ponieważ mogą pojawiać się wcze-
śnie także w innych otępieniach. Charakterystyczne są też zaburzenia mowy:
stereotypie, echolalia, perseweracje, a zwłaszcza postępujące zubożenie mowy
doprowadzające w późnym okresie do mutyzmu. Następne istotne cechy w obra-
zie klinicznym to niezaburzona orientacja przestrzenna i praksja, w odróżnieniu
od AD. Natomiast w FTD ich obecność w początkowym okresie choroby po-
dobnie, jak wcześnie występujące wyraźne zaburzenia pamięci, stanowią jedne
z kryteriów wykluczających.
Jeśli chodzi o objawy neurologiczne, to poza objawami deliberacyjnymi,
wcześnie mogą również występować zaburzenia zwieraczowe, co pozwala na
wyłączenie AD. W zaawansowanym okresie choroby pojawiają się objawy po-
zapiramidowe pod postacią bradykinezji, sztywności i drżenia.
Z badań dodatkowych najczulsze jest badanie SPECTu, które wykazuje cha-
rakterystyczne obniżenie perfuzji w płatach czołowych i przedniej części płatów
skroniowych, podczas gdy dla AD typowe jest obniżenie perfuzji w płatach cie-
mieniowych i tylnej części płatów skroniowych [19].
Przy podejrzeniu FTD objawami dodatkowo potwierdzającymi rozpoznanie
są: początek przed 65 r.ż., dodatni wywiad rodzinny u krewnych pierwszego stop-
nia (potwierdzeniem predyspozycji genetycznej jest zmapowanie w 1997 r. [7]
genu dla 3 rodzin z FTD w obszarze chromosomu 17) oraz objawy choroby
neuronu ruchowego.
Kartka nr: 59 Strona nr: 59

8 marca 1999 20:43
a5.tex
60
A. Pfeffer
Nr 1
Otępienia z obecnością zespołu parkinsonowskiego
Choroba rozsianych ciał Lewy’ego.
Jest najważniejszą spośród demencji z to-
warzyszącymi objawami parkinsonowskimi. Wg. niektórych autorów [9] stanowi
drugą co do częstości po AD przyczynę otępień. Neuropatologicznie poza ko-
rowymi i podkorowymi ciałami Lewy’ego stwierdzane są zazwyczaj w różnym
stopniu zmiany alzheimerowskie. Stąd klinicznie bardzo trudna do odróżnienia
od AD. Powinna być brana pod uwagę zawsze, gdy objawy parkinsonowskie po-
jawiają się przed, jednocześnie lub tylko nieco później, niż zaburzenia poznaw-
cze. Kryteria kliniczne opracowane przez Mc Keitha (1994) obejmują ponadto:
falujący przebieg zaburzeń poznawczych, występowanie przejściowych zaburzeń
świadomości, halucynacje wzrokowe (wcześnie), częste nieumotywowane upadki
i nadwrażliwość na neuroleptyki.
Choroba Parkinsona z demencją.
Otępienie w chorobie Parkinsona wystę-
puje częściej niż w zdrowej populacji (Mayenx i Suttclife). Ryzyko wzrasta
wraz z wiekiem i przy obecności dodatniego wywiadu rodzinnego. Najistotniej-
szą cechą różnicującą jest kolejność pojawienia się objawów. W chorobie Par-
kinsona objawy pozapiramidowe zawsze wyprzedzają pojawienie się zaburzeń
poznawczych.
Postępujące porażenie nadjądrowe (PSP).
Demencja o typie otępienia czoło-
wego występuje u około 50 % chorych i jej obecność nie jest konieczna do po-
stawienia rozpoznania. Typowe objawy neurologiczne to porażenie nadjądrowe
(zaczynające się z reguły od porażenia ruchów gałek ocznych ku dołowi), syme-
tryczny zespół parkinsonowski (bradykinezja i sztywność mięśniowa zazwyczaj
bez drżenia), brak odpowiedzi na leczenie L-dopą, częste nie umotywowane
upadki, zespół rzekomoopuszkowy (xx).
Piśmiennictwo
[1] Brun A., Englund B., Gustafson L. i wsp.: Clinical and neuropathological criteria
for frontotemporal dementia. J. Neurol. Neurosurg. Psychiatr., 1994, 4, 416.
[2] Corey-Bloom J., Thal L. J., Galasko D. i wsp.: Diagnosis and evaluation of de-
mentia. Neurology 1995, 45, 211.
[3] Crook T., Bartus R.T., Ferris S.H. i wsp.: Age – associated memory impairment:
proposed diagnostic criteria and measures of clinical change. Report of a National
Institute of Mental Health Work Group. Dev. Neuropsychol 1986, 2, 261.
[4] Folstein M.F., Folstein S.E., Mc Hugh P.R. Mini-Mental State: a practical method
for grading the cognitive state of patients for the clinician. J. Psychiatr. Res., 1975,
12, 189.
[5] Francis J., Martino D., Kapoor W.N.: A prospective study of delirium in hospita-
lised elderly. JAMA 1990, 263, 1097.
Kartka nr: 60 Strona nr: 60

8 marca 1999 20:43
a6.tex
Nr 1
Diagnostyka różnicowa wczesnej fazy otępienia
61
[6] Geldmacher D.S., Whitehouse P.J.: Differential diagnosis of Alzheimer‘s disease.
Neurology 1997, 48 (suppl. 6), S2.
[7] Heutink P., Stevens M., Rizzu P. i wsp.: Hereditary frontotemporal dementia is
linken to chromosome 17q21-22 a genetic and clinicopathological study of three
Dutch families. Ann. Neurol., 1997, 41, 150.
[8] Jellinger K.A.: Alzheimer‘s changes in non demented and demented patients. Acta
Neuropath., 1995, 89, 112.
[9] Kalra S., Bergeron C., Lang A.E.: Lewy body disease and dementia. A review.
Arch. Intern. Med., 1996, 156, 487.
[10] Levy R.: Aging – associated cognitive decline. Working Party of the International
Psychogeriatric Association in collaboration with the World Health Organisation.
Int. Psychogeriatr., 1994, 6, 63.
[11] Litvan J., Agid Y., Calne D. i wsp.: Clinical research criteria for the diagnosis
of progressive supranuclear palsy (Steele – Richardson – Olszewski syndrome):
report of the NINDS – SPSP international workshop. Neurology 1996, 47, 1.
[12] Mayeux R., Chen J., Mirabello E. i wsp.: An estimate of the incidence of dementia
in idiopathic Parkinson‘s disease. Neurology 1990, 40, 1513.
[13] Mc Keith I.G., Fairbairn A.F., Bothwell R.A. i wsp.: An evaluation of the pre-
dictive validity and inter- rater reliability of clinical diagnostic criteria for senile
dementia of the Lewy body type. Neurology 1994, 44, 872.
[14] Mc Khann G., Drachmann D., Folstein M. i wsp.: Clinical diagnosis of Alzhe-
imer‘s disease: report of the NINCDS-ADRDA Work Group under the auspices of
Department of Health and Human Services Task Force on Alzheimer‘s Disease.
Neurology 1984, 34, 939.
[15] Mendez M.F., Chrrier M., Kent M. i wsp.: Frontotemporal dementia versus Al-
zheimer‘s disease. Differential cognitive features. Neurology 1996, 47, 1189.
[16] Roman G.C., Tatemichi T.K., Erkinjunti i wsp.: Vascular dementia diagnostic cri-
teria for research studies Report of the NINDS-AIREN International Workshop.
Neurology 1993, 43, 250.
[17] Sahakian B.J.: Depressive pseudodementia in the elderly. Int. J. Geriatr. Psychiatry
1991, 6, 453.
[18] Stern Y., Mayeux R., Sano M. i wsp.: Predictors of disease course in patients with
probable Alzheimer‘s disease. Neurology 1987, 37, 1649.
[19] Talbot P.R., Lloyd J., Snowden J.S. i wsp.: A clinical role for 99m Tc-HMPAO
SPECT in the investigation of dementia. J. Neurol. Neurosurg. Psychiatry 1998,
64, 306.
[20] Walstra G.J., Teunisse S., van Gool W.A., Crevel H.: Reversible dementia in elderly
patients referred to a memory clinic. J. Neurol., 1997, 244, 17.
Kartka nr: 61 Strona nr: 61

8 marca 1999 20:43
a6.tex
62
Kartka nr: 62 Strona nr: 62

8 marca 1999 20:43
a6.tex
NEUR. NEUROCHIR. POL. 1999, Suplement 1
63
Jerzy Kulczycki
Wczesne rozpoznawanie choroby Alzheimera za
pomocą metod neuroobrazowania
Z I Kliniki Neurologicznej Instytutu Psychiatrii i Neurologii w Warszawie
Kierownik: prof. Dr J. Kulczycki
słowa kluczowe:
otępienie, choroba Alzheimera, diagnostyka różnicowa
key words:
dementia, Alzheimer’s disease, differential diagnosis
Summary
Early diagnosis of Alzheimer’s disease by neuroimaging methods –
Visual ex-
aminations of the brain, MRI in particular, are very important but always only auxiliary
methods in the diagnosis of Alzheimer’s disease. Since several years the results obtained
in them could have been confirmed objectively by introduction of various methods for
measurement of cerebral structures undergoing atrophy. The development of functional
MRI programmes, particularly those of regional blood flow in capillaries, has helped
in detection of early Alzheimer lesions. The main difficulty in these diagnostic meth-
ods is the continuum of lesions resulting from physiological senescence and those being
pathological atrophy of Alzheimer type.
Streszczenie
Badania wizualne mózgowia, szczególnie MRI, mają duże, ale zawsze tylko pomocni-
cze znaczenie w diagnostyce choroby Alzheimera. Otrzymywane w tych badaniach wyniki
są już od kilku lat zobiektywizowane przez wprowadzenie różnych metod pomiarów struk-
tur mózgu ulegających zanikowi. Rozwój funkcjonalnych programów w MRI, szczególnie
dotyczących regionalnego przepływu w naczyniach włosowatych, pomaga w wykrywa-
niu wczesnych zmian alzheimerowskich. Główną trudność w tej diagnostyce stanowi
kontinuum zmian pomiędzy procesem fizjologicznej starości i patologiczną atrofią typu
Alzheimera.
Kartka nr: 63 Strona nr: 63

8 marca 1999 20:43
a6.tex
64
Jerzy Kulczycki
Nr 1
Tytuł tego poglądowego referatu sformułowałem nieco wyzywająco i w spo-
sób mylący. Nie ulega bowiem dla nikogo wątpliwości, że nawet obecnie, przy
ogromnym postępie technicznym w zakresie różnych metod neuroobrazowania,
rozstrzygające znaczenie w diagnostyce choroby Alzheimera (AD), szczególnie
we wczesnym jej okresie, ma nadal badanie kliniczne, a więc psychiatryczne,
psychologiczne i neurologiczne. Uzyskiwane różnymi metodami obrazy zmian
mózgowych nie są nigdy patognomoniczne, a co najwyżej mogą być w znacznej
części przypadków na tyle typowe, że bardzo pomagają w umocnieniu podej-
rzenia lub w ustaleniu prawdopodobnego bądź pewnego klinicznie rozpozna-
nia. Mówiąc o „różnych metodach” wizualnych w kontekście choroby Alzhe-
imera myślimy obecnie przede wszystkim o tomografii rezonansu magnetycznego
(MRI), która wykonywana według różnych programów, dostarcza tu najwięcej
informacji. Inne metody obrazowania są w tej dziedzinie zdecydowanie mniej
użyteczne.
Od lat wiadomo, głównie na podstawie pośmiertnych badań neuropatologicz-
nych, że zmiany mózgowe w AD rozpoczynają się najczęściej w obrębie pła-
tów skroniowych i w związku z tym w późniejszych fazach choroby są w tych
okolicach najbardziej nasilone. Makroskopowo jest to widoczne zwykle jako
szczególnie zaawansowany, symetryczny zanik tych płatów. Przyżyciowo uwi-
daczniano dawniej tę atrofię w obrazach pneumoencefalograficznych, obecnie
zaś, nieinwazyjnie, w badaniu CT lub, znacznie dokładniej – w MRI (ryc. 1,
2). U osób badanych po kilku latach trwania choroby zmiany zanikowe mózgu
są zazwyczaj łatwo dostrzegalne. Znacznie trudniejsza jest diagnostyka przypad-
ków wczesnych lub przebiegających nietypowo pod względem symptomatologii
lub dynamiki choroby. Zwykłe oglądanie zdjęć MR lub CT mózgu i ocenianie
ich „na oko” nie jest tu wystarczające ze względu na rozlany charakter zmian
i duży wpływ czynnika subiektywnego. Dla wykazania znaczenia tego czynnika
przeprowadzono niedawno porównanie opinii czterech ekspertów, którym przed-
stawiono do oceny 75 badań MR głowy, w których mieli oni określić stopień
zaniku w 13 strukturach (w skali od 1 do 3). Zgodność werdyktów nie prze-
kraczała 50%. Co więcej znaleziono znaczne różnice w ocenach dokonanych
dwukrotnie przez tego samego eksperta, w przypadkach, w których badanie po-
wtórzono po pewnym czasie [11]. Nic w tym więc dziwnego, że w wielu pra-
cowniach wprowadzono już przed laty różne metody pomiarów struktur mózgu
uwidocznionych na zdjęciach, ażeby zobiektywizować wyniki badania. Począt-
kowo stosowano pomiary liniowe (np. szerokość i wysokość płata skroniowego
w płaszczyźnie czołowej), potem rozwinięto pomiary powierzchni poszczegól-
nych struktur, oceniając ich atrofię przez porównanie z powierzchnią całej pół-
kuli mózgu [3, 7]. W miarę doskonalenia techniki i programów komputerowych
wprowadzono także pomiary objętości badanych struktur mózgu [1]. W Polsce
w roku 1997 opublikowano również podobne badania [5].
Kartka nr: 64 Strona nr: 64
8 marca 1999 20:43
a6.tex
Nr 1
Rozpoznawanie choroby Alzheimera metodą neuroobrazowania
65
Ryc. 1 :
MRI mózgu pacjenta z chorobą Alzheimera. Płaszczyzna osiowa na poziomie
wzgórz wzrokowych, obraz PD. Widoczne poszerzenie rowków kory; szczególnie
szerokie są szczeliny boczne mózgu
Fig. 1 :
Brain MRI in a patient with AD. Axial plane at the level of thalami, PD image.
Windening of cortical sulci, particulary wide are the lateral cerebral fissures
Ryc. 2 :
MRI mózgu pacjenta z chor. Alzheimera. Płaszczyzna osiowa na poziomie gór-
nej krawędzi jąder podstawy. Widoczne uogólnione poszerzenie komór bocznych oraz
rowków kory
Fig. 2 :
Brain MRI in a patient with AD. Axial plane at the level of upper borders of
basal nuclei. Generalized dilatation of lateral ventricles and windening of cortical
sulci
Kartka nr: 65 Strona nr: 65

8 marca 1999 20:43
a6.tex
66
Jerzy Kulczycki
Nr 1
Różne programy pomiarów powierzchni i objętości struktur mózgu nie tylko
uściśliły kryteria rozpoznawania zmian alzheimerowskich, ale wniosły nowe ele-
menty poznawcze, a w pierwszym rzędzie zwróciły uwagę na różnice dynamiki
procesu atrofii poszczególnych struktur w obrębie płata skroniowego. Tu jednak
pojawiły się różnice pomiędzy wynikami otrzymanymi przez poszczególnych
autorów, wynikające niekiedy z doboru materiału, a zapewne również ze stoso-
wania odmiennych metod wizualizacji. Porównywalność uzyskiwanych wyników
stała się problemem szeroko dyskutowanym [12].
Zwrócono także uwagę na zmiany zanikowe w obrębie innych niż płat skro-
niowy części mózgu. Badania neuropatologiczne ujawniają nierzadko atrofię pła-
tów ciemieniowych i potylicznych. Pojawia się ona zwykle nieco później niż
zmiany w przyśrodkowo-podstawnych częściach płatów skroniowych, ale wy-
przedza wyraźnie postępowanie procesu w okolicach czołowych. W przyżycio-
wym badaniu MR obrazy zmian ciemieniowo-potylicznych są często mało cha-
rakterystyczne i trudne do dokładnego prześledzenia. Pewną możliwość oceny
rozmiaru ubytków neuronalnych w korze dają obrazy zaniku włókien projek-
cyjnych w spoidle wielkim (ryc. 3 i 4). Pierwsze przekonywające badania nad
zmianami zanikowymi w ciele modzelowatym w kontekście z atrofią kory mó-
zgu w chorobie Alzheimera przedstawili badacze japońscy w roku 1993 [13].
Porównali oni stopień scieńczenia spoidła wielkiego w różnych jego sektorach
z odchyleniami w zakresie metabolizmu kory mózgu, znajdowanymi w obra-
zach PET. Już w pierwszych doniesieniach na ten temat zwrócono uwagę na
to, że u osób z chorobą Alzheimera występuje atrofia tylnych odcinków spoidła
wielkiego, przy czym stopień jej nasilenia odpowiada obniżeniu metabolizmu
glukozy w korze płatów ciemieniowych i potylicznych. Badania nad tą zależno-
ścią są nadal prowadzone [8] w nieco zmodyfikowanej formie, z poszerzeniem
oceny zaniku spoidła na pomiary szerokości przestrzeni płynowych okołospo-
idłowych. Do badania przepływu krwi w poszczególnych okolicach mózgu używa
się w wielu ośrodkach metody SPECT (komputerowa tomografia emisyjna po-
jedynczego fotonu), natomiast metabolizm tkanki ocenia się na podstawie obra-
zów PET (pozytronowej tomografii emisyjnej). Obie te metody odznaczają się
dość wysoką czułością i swoistością (ok. 85%), jednak w diagnostyce różnico-
wej obejmującej kilka grup chorych czułość badań znacznie się obniża [9]. Poza
tym dość duże (kilka milimetrów średnicy) rozmiary pikseli obniżają rozdziel-
czość i ostrość uzyskiwanych obrazów. Poprawę diagnostyki obrazowej z uzyska-
niem informacji o niektórych stanach czynnościowych tkanki usiłuje się osiągnąć
w ostatnich latach poprzez wprowadzenie nowych programów do badania MR
(tzw. funkcjonalne MRI – fMRI). Kilka z nich jest już stosowanych w praktyce
klinicznej.
Pierwszy z tych programów polega na określaniu ilości krwi zawierającej
środek kontrastowy w naczyniach przedwłosowatych i włosowatych wybranych
Kartka nr: 66 Strona nr: 66
8 marca 1999 20:43
a6.tex
Nr 1
Rozpoznawanie choroby Alzheimera metodą neuroobrazowania
67
Ryc. 3 :
MRI mózgu pacjenta z chor. Alzheimera. Płaszczyzna strzałkowa w linii środko-
wej, obraz T1. Widoczne jest scieńczenie tylnej części spoidła wielkiego i poszerzenie
układu komorowego
Fig. 3 :
Brain MRI in a patient with AD. Sagittal plane in midline, T1 image. Thinning
of the posterior part of corpus callosum and dilatation of ventricular system
Ryc. 4 :
MRI mózgu pacjenta z chorobą Alzheimera. Płaszczyzna czołowa na wysoko-
ści wzgórza, obraz PD. Układ komorowy symetrycznie poszerzony, obustronny zanik
płatów skroniowych
Fig. 4 :
Brain MRI in a case of AD. Frontal plane at thalamus level. PD image. Ventric-
ular system symmetrically dilated, bilateral atrophy of temporal lobes
Kartka nr: 67 Strona nr: 67
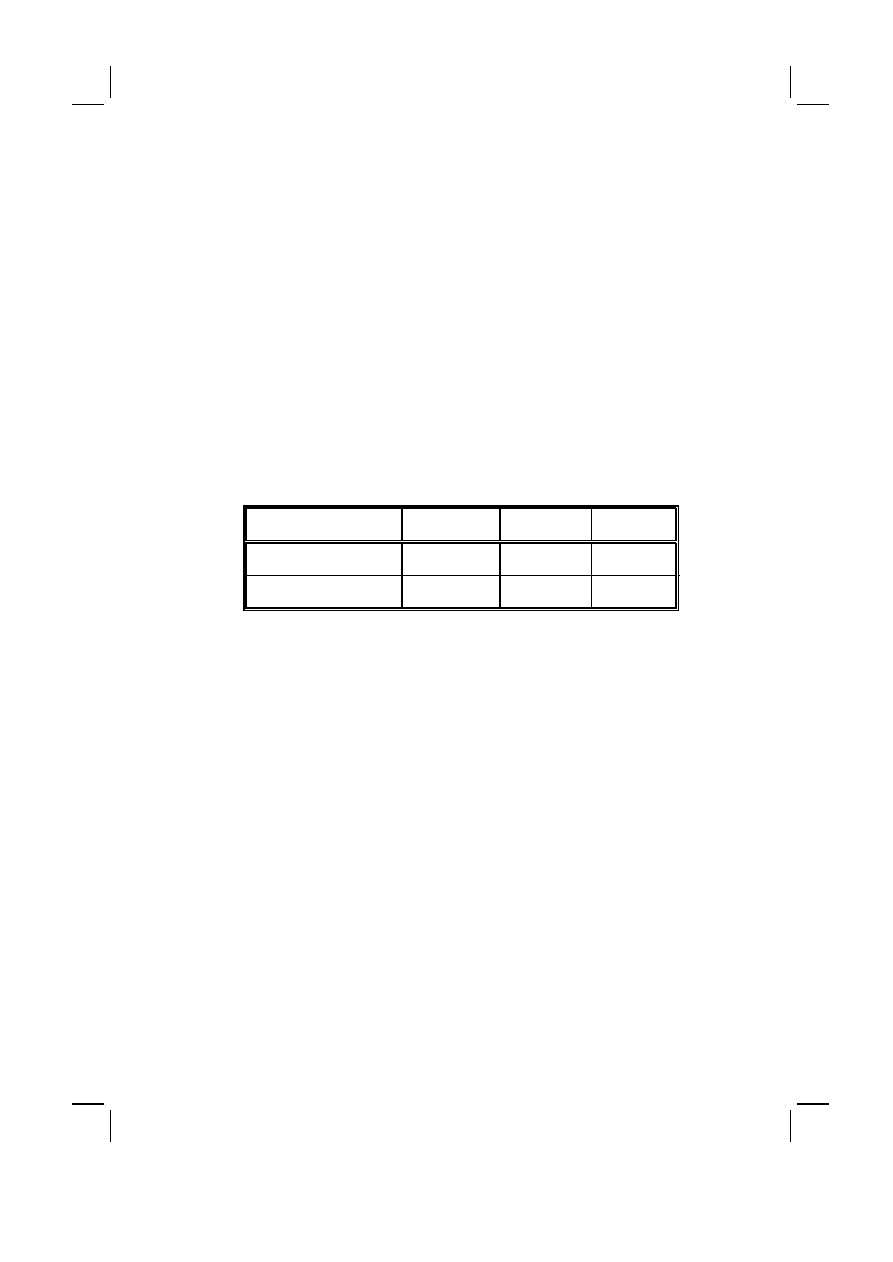
8 marca 1999 20:43
a6.tex
68
Jerzy Kulczycki
Nr 1
struktur mózgu. Wielkość przepływu włośniczkowego w korze mózgu porów-
nywano w badaniach nad chorobą Alzheimera z przepływem w obrębie kory
móżdżku, a więc w okolicy zazwyczaj w tym schorzeniu oszczędzonej. Przy
zestawieniu wielkości przepływów w korze ciemieniowo-skroniowej u chorych
z AD i u osób zdrowych w tym samym wieku uzyskiwano różnicę około 17%
na niekorzyść pierwszej grupy [6] w technice echo-planar (tab. I). Badanie to
daje wyniki powtarzalne i może być wykonywane w połączeniu z konwencjo-
Tabela I :
Ocena w MRI miejscowego wysycenia tkanek mózgu środkiem cieniującym – CBF
w echo-planar MRI – u osób z AD (wg. G.J. Harrisa i wsp., Am. J. Psychiatry, 1996, 153,
721)
Table I :
MRI assessment of local saturation of brain tissues with contrast medium – CBF in
echo-planar MRI in AD patients (after G.J. Harris et al., Am. J. Psychiatry, 1996, 153, 721)
Porównanie z rCBF w móżdżku (% CBV móżdżku)
Comparison with rCBF in cerebellum (% of CBF in cerebellum)
Pacjenci z AD
Patients with AD
Osoby zdrowe
Healthy persons
Różnica (%)
Difference (%)
Ok. skroniowo-ciemieniowa
Temporo-parietal area
P 94
L 93
P 113
L 112
17
17
Ok. czuciowo-ruchowa
Sensorimotor area
P 98
L 98
P 108
L 106
9
8
Zalety w porównaniu do PET i SPECT:
Advantages in comparison with PET and SPECT
1. wysoka rozdzielczość (high resolution);
2. badanie bez użycia promieni jonizujących (examination without ionizing radiation);
3. badanie połączone z konwencjonalnym MRI (examination connected with conventional MRI)
nalnym badaniem MR mózgu. Istotna jest wysoka rozdzielczość otrzymywanych
obrazów. Badanie miejscowego przepływu może być wykonywane również bez
używania środka cieniującego. Jeden z programów, który to umożliwia, nosi na-
zwę EPISTAR (tab. II). Technika badania wywodzi się z metod stosowanych
w angio-MR. W aparatach wysokiej klasy możliwa jest przy użyciu tego pro-
gramu w czasie inwersji 1400 i 1800 msek wybiórcza akwizycja sygnałów wody
krwi włośniczkowej w określonej okolicy mózgu. Przy tych wartościach IT więk-
sze naczynia nie dają sygnału i obraz jest jednolity. Obrazy są dobrze czytelne
po zastosowaniu subtrakcji. Wykazano w nich u chorych z AD wyraźne obni-
żenie perfuzji w okolicach ciemieniowo-skroniowych. Również to badanie może
być wykonywane łącznie z czysto morfologicznym badaniem MR i niewiele je
przedłuża [10].
Ogólnie przyjmuje się dzisiaj, że przyszłość diagnostyki obrazowej wielu
zwyrodnieniowych chorób ośrodkowego układu nerwowego, w tym również AD,
leży w postępie różnych form funkcjonalnego MRI. W praktyce klinicznej przy
Kartka nr: 68 Strona nr: 68

8 marca 1999 20:43
a6.tex
Nr 1
Rozpoznawanie choroby Alzheimera metodą neuroobrazowania
69
Tabela II :
Nieinwazyjne badanie MR perfuzji mózgu u osób z AD (wg. T.A. Sandson i wsp.,
Neurology, 1996, 47, 1339)
Table II :
Non-invasive MR study of cerebral perfusion in AD patients (after T.A. Sandson et
al. Neurology 1996, 47, 1339)
Metoda:
Methods:
Echo
Planar
Imaging and Signal
Targeting with Alternating
Radio-frequency = EPISTAR
Badanie nieinwazyjne, bez stosowania środków cieniujących, łączone ze strukturalnym,
konwencjonalnym badaniem mózgu przedłuża je o 10–15 min.
Non-invasive examination without contrast media connected with structural conventional brain
examination prolongs it by 10–15 minutes
W obrazach przy IT 1400 i 1800 ms u 7 (z 11) przypadków AD znaleziono znaczną
hipoperfuzję w ok. skroniowo-ciemieniowej.
In images at IT 1400 and 1800 ms in 7 (out of 11) AD cases high-grade hypoperfusion was
found in temporal-parietal area
rozpoznawaniu AD nie tracą jednak na znaczeniu badania, w których stosuje
się zupełnie proste pomiary części mózgu zazwyczaj w tej chorobie zmienio-
nych, przede wszystkim całego płata skroniowego [4], a szczególnie struktur
hipokampa (tab. III). Trzeba jednak pamiętać, że pomiędzy fizjologiczną atrofią
tych formacji u osób w podeszłym wieku a patologicznymi zmianami w prze-
biegu AD istnieje wcale niemałe kontinuum (tab. IV) i orzekanie o charakterze
wykrytego zaniku może być niekiedy bardzo trudne bez obserwacji pacjenta
Tabela III :
Proste pomiary płata skroniowego w diagnostyce prawdopodobnej A.D. (wg. Frisoni
G.B., Dementia, 1996, 7/1, 15)
Table III :
Simple measurement of temporal lobe in the diagnosis of probable AD
U 26 chorych z nieznacznymi lub miernie nasilonymi objawami A.D. i u 21 osób zdrowych
oceniano:
In 26 patients with slight or moderately intense AD symptoms and in 21 healthy controles:
1. stopień ogólnego zaniku mózgu (the degree ofgeneral cerebral astrophy and),
2. stopień zaniku struktur hipokampa (the degree of atrophy of hippocampal structures).
Wyniki
Results
:
1. Najwyższą czułość (73%) i swoistość (95%) w różnicowaniu miał pomiar szerokości rogu
skroniowego. (The highest sensitivity (73%) and specificity (95%) in differential diagnosis
had the measurement of temporal horn width.)
2. Dołączenie pomiarów szerokości szczeliny naczyniówki i wysokości hipokampa podniosły
czułość badania do 85%. (Additional measurement of the width of choroidal plexus fissure
and hippocampal height increased examination sensitivity to 85%.)
Kartka nr: 69 Strona nr: 69

8 marca 1999 20:43
a6.tex
70
Jerzy Kulczycki
Nr 1
Tabela IV :
Atrofia formacji hipokampa w fizjologicznym starzeniu i w A.D.
(wg. De-Leon MJ. i wsp., Neurobiol. Aging, 1997, 18/1, 1)
Table IV :
Atrophy of hippocampus formation in physiological aging and in AD.
(after De leon M.J. et al. Neurobiol. Aging 1997, 18/1, 1)
Badano zanik formacji hipokampa w grupach
Hippocampus complex atrophy was studied in groups of
:
I. Osób zdrowych w podeszłym wieku (Healthy old age persons) (n. 130)
II. Osób z nieznacznymi zaburzeniami pamięci (Persons with minor memory impairment) (n. 72)
III. Osób z lekko nasilonymi objawami A.D. (Patients with mild AD symptoms) (n. 73)
IV. Osób ze średnimi lub ciężkimi objawami A.D. (Patients with moderately intense or serious
AD symptoms) (n. 130)
Wyniki:
Results:
W grupie I wykryto atrofię hipokampa u 29% osób (w wieku 60–75 lat – 15%, w wieku 76–
90 lat – 48%) (In group I hippocampus atrophy was found in 29% of persons (aged 60–75
years – in 15%, aged 76–90 years in 48%)
W grupach II, III i IV – atrofia hipokampa od 78% do 96% (bez wyraźnej zależności od wieku)
(In groups II, III and IV hippocampus atrophy was present in 78%–96% (withoutevident re-
lation to age))
Dalsza obserwacja 15 osób z zanikiem hipokampa z grupy I wykazała – u wszystkich – roz-
wój AD (Further follow-up of 15 persons with hppocampus atrophy in group I demonstrated
AD development in all these cases)
i powtarzania badania MR [2]. Należy więc jeszcze raz przypomnieć zdanie
wypowiedziane na wstępie: Istota rozpoznawania AD leży zawsze po stronie
badania klinicznego.
Piśmiennictwo
[1] Convit A., De Leon M., Tarshish C. i wsp.: Hippocampal volume losses in mini-
mally impaired elderly. The Lancet, 1995, 345, 266.
[2] DeLeon M.J. i wsp.: Frequency of hippocampal formation atrophy in normal aging
and Alzheimer’s disease. Neurobiol. Aging, 1997, 18/1, 1.
[3] Erkinjuntti T., Lee D.H., Gao F. i wsp.: Temporal Lobe Atrophy on Magnetic Re-
sonance Imaging in the Diagnosis of Early Alzheimer’s Disease. Arch. Neurol.,
1993, 50, 305.
[4] Frisoni G.B. i wsp.: Usefulness of simple measures of temporal lobe atrophy in
probable Alzheimer’s disease. Dementia, 1996, 7/1, 15.
[5] Gołębiowski M., Łuczywek E., Pfeffer A., Barcikowska M.: Analiza objętościowa
struktur hipokampa w badaniu MR pacjentów z otępieniem typu Alzheimera. Pol.
Przegl. Radiol., 1997, 62, 3, 190.
[6] Harris G.J., Lewis R.F., Satlin A. i wsp.: Dynamic susceptibility Contrast MRI of
Regional Blood Volume in Alzheimer’s Disease. Am. J. Psychiatry 1996, 153/5,
721.
Kartka nr: 70 Strona nr: 70

8 marca 1999 20:43
a7.tex
Nr 1
Rozpoznawanie choroby Alzheimera metodą neuroobrazowania
71
[7] Ikeda M., Tanabe H. Nakagawa Y.: MRI-based quantitative assessment of the hip-
pocampal region in very mild to moderate Alzheimer’s disease. Neuroradiology,
1994, 36, 7.
[8] Kaufer D.I., Miller B.L., Itti B.S. i wsp.: Midline cerebral morphometry distin-
guishes frontotemporal dementia and Alzheimer’s disease. Neurology, 1997, 48,
978.
[9] Powers W.J., Perlmutter J.S., Videen T.O. i wsp.: Blinded clinical evaluation of
positron emission tomography for diagnosis of probable Alzheimer’s disease. Neu-
rology, 1992, 42, 765.
[10] Sandson T.A., O’Connor M., Sperling R.A. i wsp.: Noninvasive perfusion MRI in
Alzheimer’s disease: a preliminary report. Neurology, 1996, 47, 1339.
[11] Scheltens P. i wsp.: Qualitative assessment of cerebral atrophy on MRI: interand
intraobserver reproducibility in dementia and normal aging. Eur. Neurol., 1997,
37/2, 95.
[12] Victoroff J., Mack W.J., Grafton S.T. i wsp.: A method to improve interrater relia-
bility of visual inspection of brain MRI scans in dementia. Neurology, 1994, 44,
2267.
[13] Yamauchi H., Fukuyama H., Harada K. i wsp.: Callosal Atrophy Parallels Decre-
ased Cortical Oxigen Metabolism and Neuropsychological Impairment in Alzhe-
imer’s Disease. Arch. Neurol., 1993, 50, 1070.
Kartka nr: 71 Strona nr: 71

8 marca 1999 20:43
a7.tex
72
Kartka nr: 72 Strona nr: 72

8 marca 1999 20:43
a7.tex
NEUR. NEUROCHIR. POL. 1999, Suplement 1
73
Mariusz Zarajczyk
Jumex w leczeniu choroby Alzheimera
Lek. med. Mariusz Zarajczyk
Sanofi – Biocom
Jumex in treatment of Alzheimer’s disease
Pierwsze doniesienia o korzystnym działaniu Jumexu w chorobie Alzheimera
pochodzą z końca lat 80-tych od autorów amerykańskich – Tariota i współpra-
cowników. Autorzy ci po podaniu Jumexu pacjentom z chorobą Alzheimera
zauważyli u nich poprawę pamięci, funkcji poznawczych, codziennego funkcjo-
nowania, natomiast zmniejszenie niepokoju i napięcia. To dobroczynne działanie
zanikało po przerwaniu terapii Jumexem.
Jaki jest mechanizm działania Jumexu – dotychczasowe badania wykazują
jego podwójne działanie: krótkoterminowe – objawowe i długoterminowe – neu-
roprotekcyjne.
Jumex jest selektywnym, nieodwracalnym inhibitorem monoaminoksydazy
typu B (MAO-B), w dawkach terapeutycznych nie działającym na jelitową MAO-
A, a więc nie powodujący ryzyka powstania przełomów nadciśnieniowych – po-
woduje zmniejszenie rozkładu dopaminy i obniżenie jej neuronalnego wychwytu.
Zwiększając aktywność dopaminergiczną w mózgowiu powoduje poprawę funk-
cji poznawczych, pamięci krótko- i długoterminowej, a także zachowań socjal-
nych. Działanie to łagodzi objawy choroby Alzheimera – podnosi komfort życia
pacjentów.
Ostatnie badania wykazują ponadto, że w chorobie Alzheimera mamy do
czynienia z nadmiernym tworzeniem się wolnych rodników – cząsteczek o nie-
stabilnej strukturze, a więc niezwykle łatwo wchodzące w reakcje chemiczne
ze strukturami wewnątrzkomórkowymi; prowadząc w efekcie do uszkodzenia
i śmierci komórki. Nadmiar wolnych rodników powstaje między innymi podczas
rozpadu dopaminy, odbywającego się przy pomocy MAO-B. Ponieważ wiadomo,
że poziom MAO-B jest podwyższony w chorobie Alzheimera, efektem tego jest
Kartka nr: 73 Strona nr: 73

8 marca 1999 20:43
a7.tex
74
Mariusz Zarajczyk
Nr 1
wzrost ich poziomu – Jumex przez hamowanie MAO-B zmniejsza stres oksy-
dacyjny, a więc produkcję tych endogennych toksyn. Wobec powyższego Jumex
miałby działanie długoterminowe – neuroprotekcyjne, które spowalnia przebieg
choroby.
O ile działanie objawowe Jumexu nie budziło wątpliwości i zostało potwier-
dzone licznymi badaniami, brakowało prób klinicznych na temat jego neuropro-
tekcyjnego działania. Pierwszym większym badaniem była opublikowana dwa
lata temu próba badaczy fińskich – Riekkinena i współpracowników: podwójnie
ślepa, trwająca 3 lata. Stwierdzono, że zaburzenia funkcji poznawczych postępo-
wały wolniej w grupie selegiliny (w skali MMS spadek o 6.2 pkt.) niż w grupie
placebo (spadek o 7.8 pkt.). Według autorów wyniki te świadczą o tym, że
narastanie objawów choroby może być spowolnione przez leczenie selegiliną –
Jumexem. W ubiegłym roku w New England Journal of Medicine opublikowano
wyniki następnej próby potwierdzającej działanie długoterminowe Jumexu. Jest
to największa jak do tej pory próba, podwójnie ślepa, losowa, dotycząca działa-
nia Jumexu i witaminy E w chorobie Alzheimera. Była w całości sponsorowana
przez Narodowy Instytut Zdrowia – obejmowała 341 pacjentów z 23 ośrodków
w Stanach Zjednoczonych. Miała na celu znalezienie odpowiedzi na pytanie:
czy Jumex i witamina E spowalniają przebieg choroby Alzheimera. W próbie tej
chorych przydzielano losowo do jednej z czterech grup, w których stosowano
jedną z poniższych terapii:
1. selegilina (Jumex) – 10 mg dziennie;
2. alfa-tokoferol – 2 000 j.m. dziennie;
3. selegilina + alfa-tokoferol w dawkach jak wyżej;
4. placebo.
Wszystkie grupy nie różniły się między sobą pod względem płci, czasu trwa-
nia choroby (średnio 5 lat) i wieku (średnio 73 lata). Wynikiem końcowym
próby był czas wystąpienia: zgonu chorego, konieczności umieszczenia na stałe
w zakładzie opieki, utraty zdolności wykonywania przynajmniej dwóch z trzech
podstawowych czynności życia codziennego (jedzenie, ubieranie się, używanie
toalety) bądź też znaczne nasilenie się objawów otępiennych.
Po dwóch latach zebrano wyniki i stwierdzono znaczne opóźnienie wystą-
pienia punktów końcowych w stosunku do placebo zarówno w grupie Jumexu
(opóźnienie o 215 dni) jak i witaminy E (230 dni) – a więc różnica o średnio 7
miesięcy. Ponadto wykazano, że Jumex wydłuża czas samodzielności pacjentów,
opóźnia narastanie demencji i opóźnia potrzebę opieki. Jeżeli chodzi o wybór te-
rapii autorzy pracy sugerują, że skoro obydwa leki spowalniają przebieg choroby,
o wyborze terapii powinna decydować wygoda i koszty leczenia. Witamina E nie
Kartka nr: 74 Strona nr: 74

8 marca 1999 20:43
a7.tex
Nr 1
Jumex w leczeniu choroby alzheimera
75
jest dostępna na polskim rynku w dawce podawanej przez autorów pracy; stosu-
jąc dostępne preparaty witaminowe pacjenci musieliby przyjmować kilkadziesiąt
tabletek dziennie – kilkakrotnie w ciągu dnia. Stosowanie tak dużych dawek wi-
taminy E może spowodować powikłania krwotoczne – szczególnie w naszym
kraju, gdzie tak wielu ludzi w starszym wieku cierpi na chorobę wrzodową. Do-
datkowo terapia tak wielką dawką tokoferolu nie jest tania. W przypadku Jumexu
wieloletnie doświadczenie wykazuje, że Jumex jest lekiem bardzo dobrze tole-
rowanym i bezpiecznym. We wszystkich dotychczasowych badaniach, także i w
próbie amerykańskiej, nie zaobserwowano statystycznie istotnych różnic między
grupą Jumexu a placebo w kategorii zdarzeń szkodliwych. W żadnym też przy-
padku nie było konieczności przerwania leczenia. Ponadto Jumex ma bardzo
łatwe i dogodne dla pacjentów dawkowanie. Podaje się go w jednej dawce: dwie
tabletki rano – co jest szczególnie korzystne w przypadku pacjentów z zaburze-
niami pamięci, ułatwia też pracę ich opiekunom.
Reasumując: Jumex, przy bardzo dobrej tolerancji, wygodnym dawkowaniu
i niskich kosztach terapii ma podwójne działanie: objawowe – poprawia pamięć,
funkcje poznawcze i samodzielność pacjentów, oraz działanie długoterminowe –
neuroprotekcyjne, powodujące zwolnienie postępu choroby Alzheimera.
Kartka nr: 75 Strona nr: 75
Wyszukiwarka
Podobne podstrony:
aspekty neurologiczne chorob otepiennych
choroby otepienne- konspekt wykladu 0, Lekarski, Neurologia
Choroby otępienne
Choroby otępienne
15 Zaburzenia neurologiczne w chorobach wewnetrznych
Merrit (FLAGGERMUS), POWIKŁANIA NEUROLOGICZNE CHORÓB UKŁADOWYCH, POWIKŁANIA NEUROLOGICZNE CHORÓB UKŁ
choroby otepienne
Choroby otępienne, uczelnia - Licencjat, sem 3, geriatria
15 Zaburzenia neurologiczne w chorobach wewętrznych 1 lightid 16253 ppt
Neurologiczne choroby zawodowe Nieznany
Choroby otepienne
6 Neurologia Choroby nerwowo mięśniowe
Choroba otępienna
choroby otepienne 5
więcej podobnych podstron