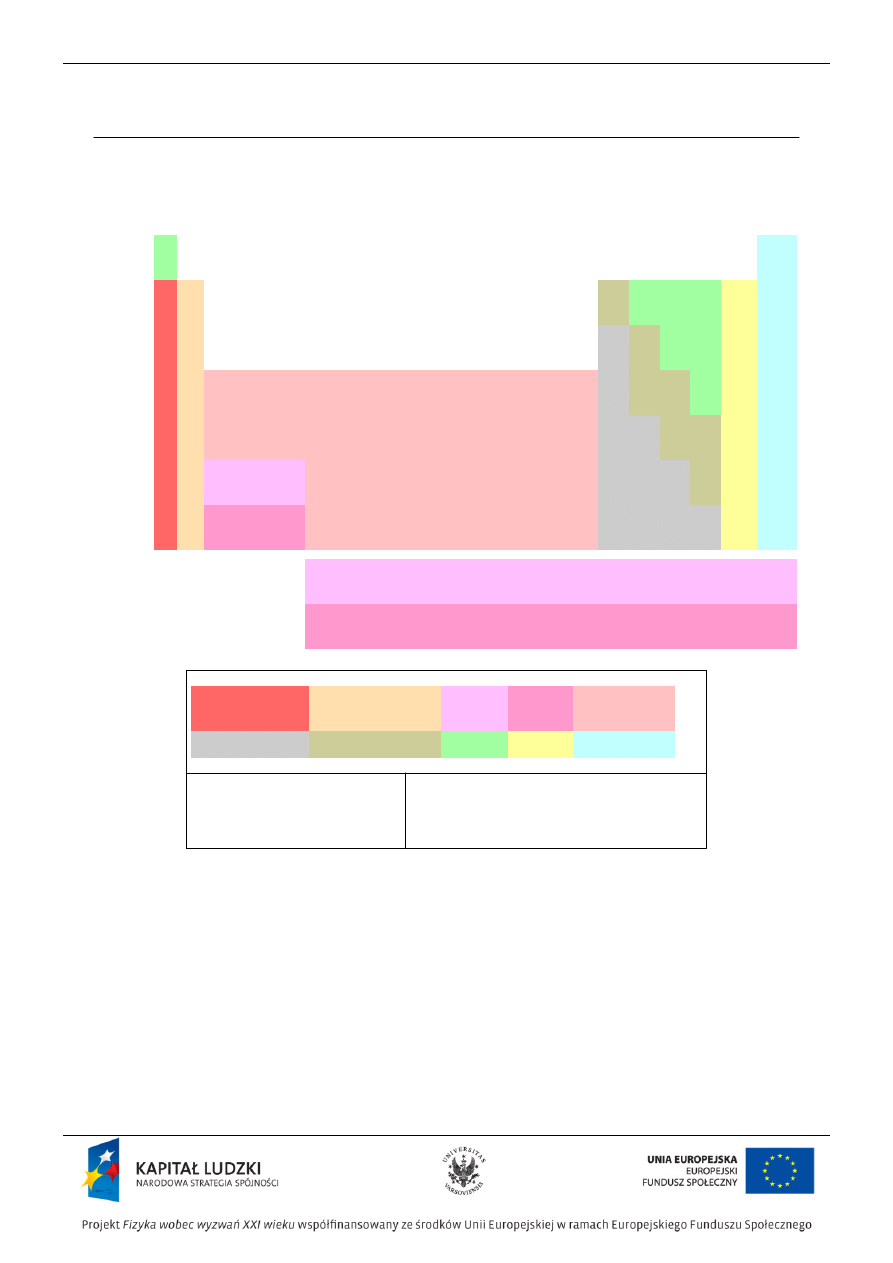
CHEM:PrawidŇāowoŇõci w ukŇāadzie okresowym
1
CHEM:PrawidŇāowoŇõci w ukŇāadzie okresowym
Grupa →
‚ÜstOkres
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
*
72
73
74
75
76
77
78
79
80
81
82
83
84
85
86
87
88
**
104
105
106
107
108
109
110
111
112
113
114
115
116
117
118
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
89
90
91
92
93
94
95
96
97
98
99
100
101
102
103
CiaŇāo staŇāe
Ciecz
Gaz
Nieznany
Naturalny Z rozpadów Syntetyczny Nie odkryty
Tablica Mendelejewa
‚ÄĘ Periodyczna klasyfikacja pierwiastk√≥w (Dymitr Mendelejew, Julius Lothar Meyer) pojawiŇāa sińô okoŇāo roku 1869,
ponad 40 lat przed odkryciami, kt√≥re doprowadziŇāy do okreŇõlenia struktury atom√≥w (1913-1916).
‚ÄĘ PrawidŇāowoŇõńá bńôdńÖca podstawńÖ periodycznej klasyfikacji (nazywana prawem okresowoŇõci) zostaŇāa ustalona na
podstawie obserwacji makroskopowych zwińÖzanych z wŇāaŇõciwoŇõciami chemicznymi i fizycznymi pierwiastk√≥w
uporzńÖdkowanych wedŇāug rosnńÖcych mas atomowych.
‚ÄĘ Na podstawie obserwacji Mendelejew opracowaŇā ukŇāad okresowy liczńÖcy 63 znane w√≥wczas pierwiastki:
‚ÄĘ kaŇľdy okres rozpoczynaŇā sińô jednowartoŇõciowym, aktywnym metalem, a koŇĄczyŇā chemicznie biernym atomem
helowca,
CHEM:PrawidŇāowoŇõci w ukŇāadzie okresowym
2
‚ÄĘ wewnńÖtrz okresu wŇāaŇõciwoŇõci pierwiastk√≥w zmieniaŇāy sińô od typowych, bardzo aktywnych metali, poprzez
maŇāo aktywne metale i niemetale aŇľ do bardzo aktywnych niemetali pierwiastki tworzńÖce grupy wykazywaŇāy
podobne wŇāaŇõciwoŇõci chemiczne,
‚ÄĘ a ich zmiennoŇõńá byŇāa uwarunkowana zmianńÖ masy atomowej (reaktywnoŇõńá metali wzrastaŇāa ze wzrostem masy
atomowej, a reaktywnoŇõńá niemetali malaŇāa).
Struktura obecnego ukŇāadu okresowego
PodziaŇā na okresy i grupy:
‚ÄĘ okresy to szeregi poziome oznaczone cyframi 1-7,
‚ÄĘ grupy to kolumny oznaczone liczbami arabskimi 1-18 (dawniej rzymskimi, uzupeŇānionymi literńÖ A dla grup
gŇā√≥wnych, a literńÖ B dla grup pobocznych).
Dwa szeregi pierwiastk√≥w umieszczonych pod tablicńÖ, lantanowce i aktynowce, naleŇľńÖ odpowiednio do sz√≥stego i
si√≥dmego okresu, tworzńÖc dwu pierwiastkowe grupy, dla kt√≥rych nie wprowadzono dodatkowej numeracji.
Dodatkowy podziaŇā na bloki konfiguracyjne s, p, d, f:
‚ÄĘ blok s ‚ÄĒ pierwiastki grupy 1 i 2 oraz hel,
‚ÄĘ blok p ‚ÄĒ pierwiastki grup 13-18,
‚ÄĘ blok d ‚ÄĒ pierwiastki grup pobocznych (3-12),
‚ÄĘ blok f ‚ÄĒ lantanowce i aktynowce.
PrawidŇāowoŇõci w okresach
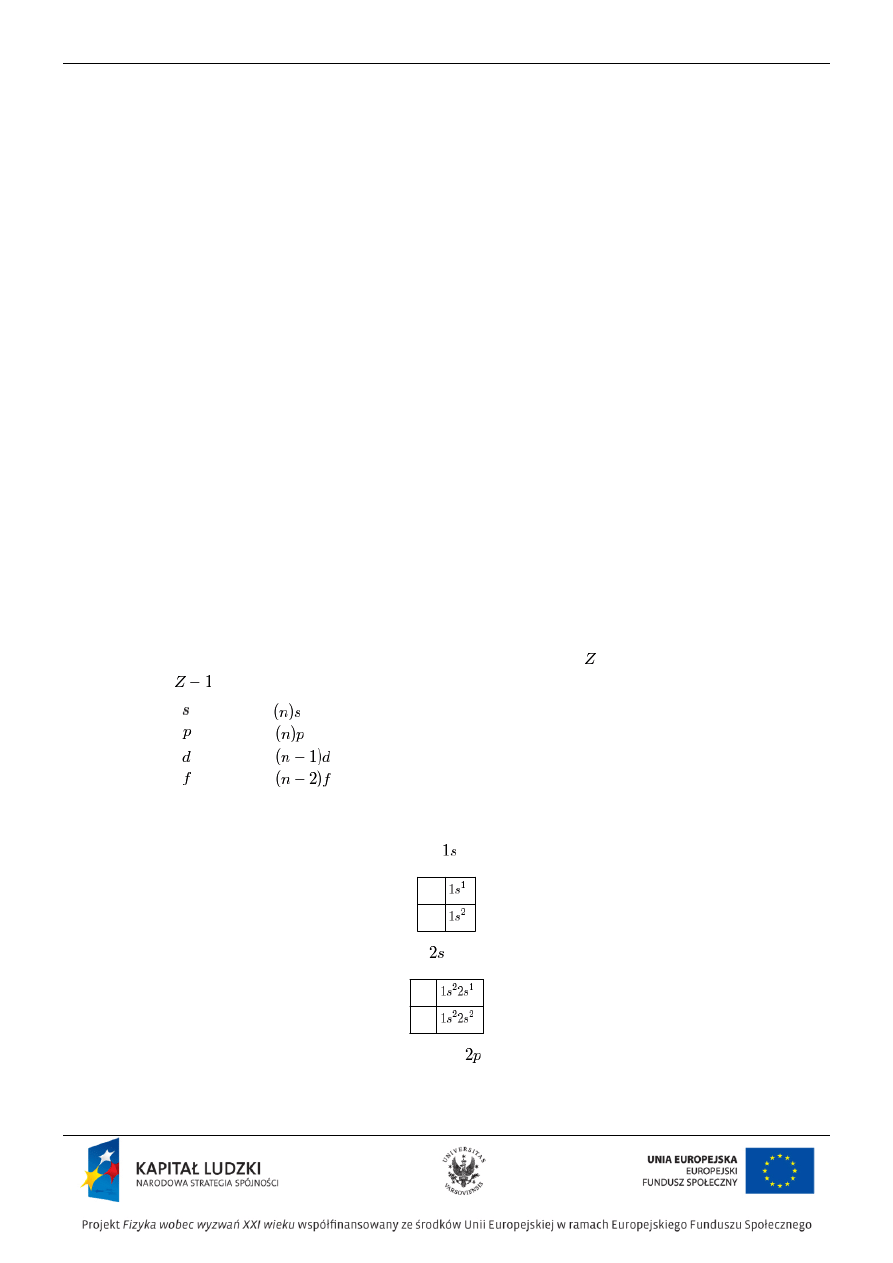
‚ÄĘ Okres jest uporzńÖdkowanym wedŇāug wzrastajńÖcych liczb atomowych szeregiem pierwiastk√≥w, kt√≥rych atomy
zawierajńÖ jednakowńÖ liczbńô powŇāok elektronowych.
‚ÄĘ Numer okresu, w kt√≥rym znajduje sińô dany pierwiastek, okreŇõla liczbńô powŇāok elektronowych zajńôtych przez
elektrony. Elektron odr√≥ŇľniajńÖcy atom danego pierwiastka o liczbie atomowej ¬† od atomu pierwiastka o liczbie
atomowej
  zajmuje:
‚ÄĘ w bloku ¬† podpowŇāokńô
 ,
‚ÄĘ w bloku ¬† podpowŇāokńô
 ,
‚ÄĘ w bloku ¬† podpowŇāokńô
 ,
‚ÄĘ w bloku ¬† podpowŇāokńô
  .
PrzykŇāady
W atomach wodoru i helu elektrony zajmujńÖ podpowŇāokńô ¬†:
1
H
 
2
He
 
W atomach litu i berylu elektrony zajmujńÖ podpowŇāokńô ¬†:
3
Li
 
4
Be
 
W atomach od boru do neonu elektrony zajmujńÖ podpowŇāokńô
 :

CHEM:PrawidŇāowoŇõci w ukŇāadzie okresowym
3
5
B
 
6
C
 
7
N
 
8
O
 
9
F
 
10
Ne
 
PrawidŇāowoŇõci w grupach
‚ÄĘ Grupa jest uporzńÖdkowanym wedŇāug wzrastajńÖcych liczb atomowych szeregiem pierwiastk√≥w, kt√≥rych atomy
zawierajńÖ jednakowńÖ liczbńô elektron√≥w walencyjnych.
‚ÄĘ Numer grupy okreŇõla liczbńô elektron√≥w walencyjnych: w atomach pierwiastk√≥w grup gŇā√≥wnych (1-2, 13-18)
liczba elektronów walencyjnych jest równa cyfrze na miejscu jednostek w numerze grupy.
‚ÄĘ W atomach pierwiastk√≥w grup pobocznych (3-12) liczba elektron√≥w walencyjnych jest r√≥wna numerowi grupy.
Elektrony walencyjne
‚ÄĘ Elektrony walencyjne sńÖ to elektrony biorńÖce udziaŇā w procesie tworzenia czńÖsteczek zwińÖzk√≥w chemicznych.
‚ÄĘ W atomach pierwiastk√≥w bloku s elektronami walencyjnymi sńÖ elektrony ostatniej powŇāoki ‚ÄĒ typ konfiguracji
ns.
‚ÄĘ W atomach pierwiastk√≥w bloku p elektronami walencyjnymi sńÖ r√≥wnieŇľ elektrony z ostatniej powŇāoki (3-8
elektron√≥w, z czego 2 naleŇľńÖ do podpowŇāoki s, a reszta do podpowŇāoki p) ‚ÄĒ typ konfiguracji ns, np.
‚ÄĘ W atomach pierwiastk√≥w bloku d elektronami walencyjnymi sńÖ elektrony z podpowŇāoki s ostatniej powŇāoki oraz
elektrony z podpowŇāoki d powŇāoki przedostatniej ‚ÄĒ typ konfiguracji
 , ns.
‚ÄĘ W atomach pierwiastk√≥w bloku f elektronami walencyjnymi sńÖ elektrony z ostatniej powŇāoki s, podpowŇāoki d
powŇāoki przedostatniej oraz podpowŇāoki f powŇāoki trzeciej od zewnńÖtrz ‚Äď typ konfiguracji
 ,
 ,
 .
Energie jonizacji
‚ÄĘ Pierwsza energia jonizacji odpowiada usunińôciu jednego elektronu z obojńôtnego atomu i zmienia sińô kierunkowo
w kaŇľdym okresie lub grupie ukŇāadu okresowego
M ‚Üí M
+
+ e¬Į.
‚ÄĘ Wysokie wartoŇõci sńÖ charakterystyczne dla helowc√≥w, poniewaŇľ ich zamknińôte powŇāoki elektronowe sńÖ bardzo
trwaŇāe (maksymalna wartoŇõńá wynosi 24,59 eV, dla atomu helu).
‚ÄĘ Minimalne wartoŇõci (3 - 5 eV) sńÖ charakterystyczne dla litowc√≥w. Elektrony walencyjne litowc√≥w sńÖ skutecznie
ekranowane od jńÖdra, dlatego teŇľ ich oderwanie od atomu jest stosunkowo Ňāatwe.
‚ÄĘ Energie jonizacji wzrastajńÖ w okresach przy przejŇõciu od litowc√≥w do helowc√≥w ze wzglńôdu na wzrost Ňāadunku
jńÖdra i zmniejszanie promieni atomowych.
‚ÄĘ W grupach gŇā√≥wnych wartoŇõci energii jonizacji malejńÖ w miarńÖ wzrostu liczby atomowej.
‚ÄĘ Energia jonizacji maleje przy przejŇõciu od konfiguracji ¬† do konfiguracji
¬†, a nastńôpnie przy przejŇõciu od
  do
 .
‚ÄĘ WyŇľsze potencjaŇāy jonizacji odpowiadajńÖ oderwaniu kolejnego elektronu. PrzyjmujńÖ one wińôksze wartoŇõci w
stosunku do wartoŇõci pierwszej energii jonizacji, poniewaŇľ dalsze elektrony sńÖ odrywane od jon√≥w dodatnich.

CHEM:PrawidŇāowoŇõci w ukŇāadzie okresowym
4
‚ÄĘ PrzykŇāad ‚ÄĒ wartoŇõci kolejnych energii jonizacji dla litu:
‚ÄĘ E
1
= 5,39 eV
‚ÄĘ E
2
= 75,64 eV
‚ÄĘ E
3
= 122,45 eV
ElektroujemnoŇõńá
‚ÄĘ ElektroujemnoŇõńá jest miarńÖ tendencji atom√≥w w czńÖsteczce do przycińÖgania elektron√≥w.
‚ÄĘ Pojńôcie elektroujemnoŇõci zostaŇāo wprowadzone przez Linusa Paulinga (1932 r), kt√≥ry na podstawie moment√≥w
dipolowych i energii potrzebnych do rozerwania wińÖzaŇĄ, uszeregowaŇā pierwiastki tworzńÖc tzw. skalńô
elektroujemnoŇõci.
‚ÄĘ NajwińôkszńÖ elektroujemnoŇõńá przypisuje sińô fluorowi (4.0).
‚ÄĘ W miarńô wzrostu Ňāadunku jńÖdra elektroujemnoŇõńá roŇõnie (pierwiastki pierwszej i drugiej grupy majńÖ maŇāe wartoŇõci
elektroujemnoŇõci, 0,7-1,5, natomiast tlenowce i fluorowce charakteryzujńÖ sińô wartoŇõciami elektroujemnoŇõci, w
granicach 2-4).
‚ÄĘ W obrńôbie grupy elektroujemnoŇõńá maleje ze wzrostem rozmiar√≥w atom√≥w.

ŇĻr√≥dŇāa i autorzy artykuŇāu
5
ŇĻr√≥dŇāa i autorzy artykuŇāu
CHEM:PrawidŇāowoŇõci w ukŇāadzie okresowym ¬†ŇĻr√≥dŇāo: https://brain.fuw.edu.pl/edu-wiki/index.php5?oldid=14493 ¬†Autorzy: Asia
Licencja
Attribution-Share Alike 3.0 PL
http:/
Document Outline
Wyszukiwarka
Podobne podstrony:
uszeregowanie pierwiastk√≥w w ukŇāadzie okresowym przez Dmitrija I
uszeregowanie pierwiastk√≥w w ukŇāadzie okresowym przez Dmitrija I
Izotermiczna?sorpcja okresowa w ukŇāadzie ciaŇāo staŇāe ciecz (2)
Izotermiczna adsorpcja okresowa w ukŇāadzie ciaŇāo staŇāe - ciecz, inŇľynieria chemiczna lab, sprawka, 2
Izomeryczna adsorpcja okresowa w ukŇāadzie ciaŇāo staŇāe - ciecz 2, Dokumenty(1)
IZOTERMICZNA ADSORPCJA OKRESOWA W UKŇĀADZIE CIAŇĀO STAŇĀE - CIECZ 3, Dokumenty(1)
DOKUMENTACJA OBROTU MAGAZYNOWEGO prawidŇā
Budowa UkŇāadu Okresowego Pierwiastk√≥w
jak prawidlowo dobrac meble[1]
Najbardziej charakterystyczne odchylenia od stanu prawidŇāowego w badaniu
Przedwczesne odklejanie sińô ŇāoŇľyska prawidŇāowo usadowionego
Przedwczesne odklejanie sińô ŇāoŇľyska prawidŇāowo usadowionego
WEM 5 78 Prawidlowosci dot procesu emocjonalnego II
wińôcej podobnych podstron