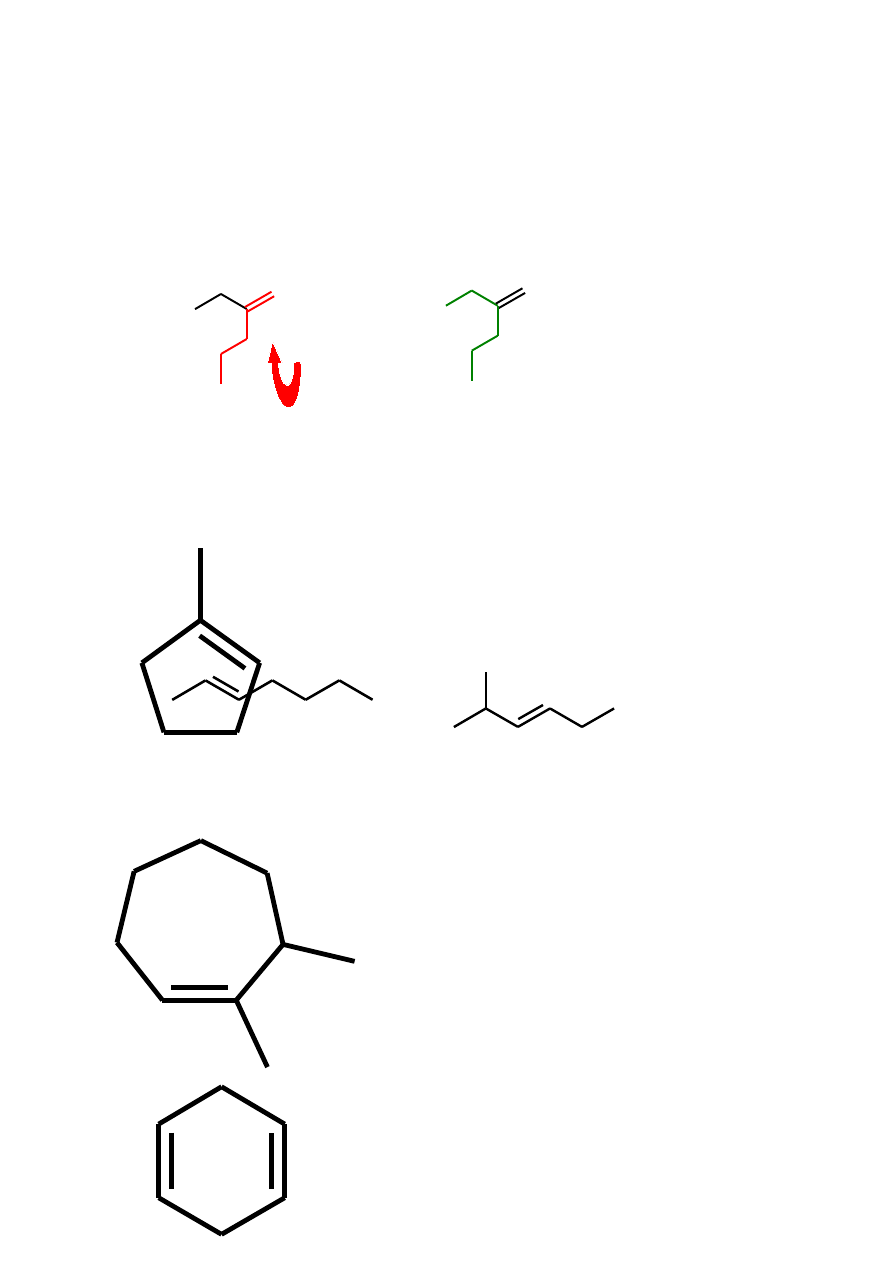
Alkeny
nomenklatura
1. Najdłuższy łańcuch węglowy zawierający wiązanie podwójne
końcówka -
en
penten
heksen
√√√√√√
Alkeny
nomenklatura
2. Numerujemy od końca bliższego wiązanie podwójnego
jeśli odległość od obu końców jest równa to od bliższego podstawnika
1
2 3
1
2 3
3. Nazwa jako jedno słowo, podstawni zgodnie z pozycją w łańcuchu
w kolejności alfabetycznej, końcówka
–en (dien, trien itd)
2-hepten
2-metylo-3-heksen
hept
hept
-
-
2
2
-
-
en 2
en 2
-
-
metyloheks
metyloheks
-
-
3
3
-
-
en
en
1
2
3
1
2
3
2
1
3
4
7
2
1
3
4
7
1-metylo
cyklopenten
1,7-dimetylocyklohepten
1
2
3
4
5
1
2
3
4
5
1,4-cykloheksadien
cykloheksa-1,4-dien

CH
2
Grupa metylenowa
C
H
CH
2
Grupa winylowa
C
H
CH
2
C
H
2
Grupa allilowa
Zahamowana rotacja wokół wiązania podwójnego
σ
π
Moc wiązania w etylenie +
611 kJ/mol (146 kcal/mol)
Moc wiązania w etanie σ
376 kJ/mol (90 kcal/mol)
Wiązanie π
235 kJ/mol (56 kcal/mol)
Rotacja wokół wiązania π jest równoznaczna z jego rozerwaniem
Reakcje addycji do wiązań podwójnych C=C
+
H
2
O
C C
H
H
H
H
+
H
2
O
C C
H
H
H
H
+
HX
C C
H
H
H
H
+
HX
C C
H
H
H
H
+
X
2
C C
H
H
H
H
+
X
2
C C
H
H
H
H
C C H
H
H
H
H
OH
C C H
H
H
X
H
X
C C H
H
H
H
H
X
H
+
H
H
H
Cl
H
H
H
Cl
cykloheksen
karbokation
chlorocykloheksan
H
H
H
Cl
+
H
H
H
Cl
+
H eletrofil
(lubiący elektrony)
Cl
-
nukleofil
(lubiący jądra)
Addycja
Addycja
elektrofilowa
elektrofilowa
H
C
H
3
H
H
OH
CH
3
H
H
H
H
H
CH
3
H
OH
H
H
H
2
O, H
+
REGUŁA MARKOWNIKOWA
Atom elektrododatni reagenta HX
przyłącza się do atomu węgla
posiadającego więcej atomów wodoru
Trwałość
Trwałość
karbokationów
karbokationów
<
<
<
<
W zras tająca stabilność
W zras tająca stabilność
C
H
H
H
+
C
H
H
H
+
C
H
R
H
<
<
+
C
H
R
H
<
<
+
C
H
R
R
+
C
H
R
R
+
C
R
R
R
+
C
R
R
R
+
C
C
. .
. .
H
Stabilizacja karbokationu przez hiperkoniugację
CH
3
H
H
Cl
CH
3
H
H
Cl
+
+
CH
3
H
H
Cl
+
+
+
+
CH
3
H
H
Cl
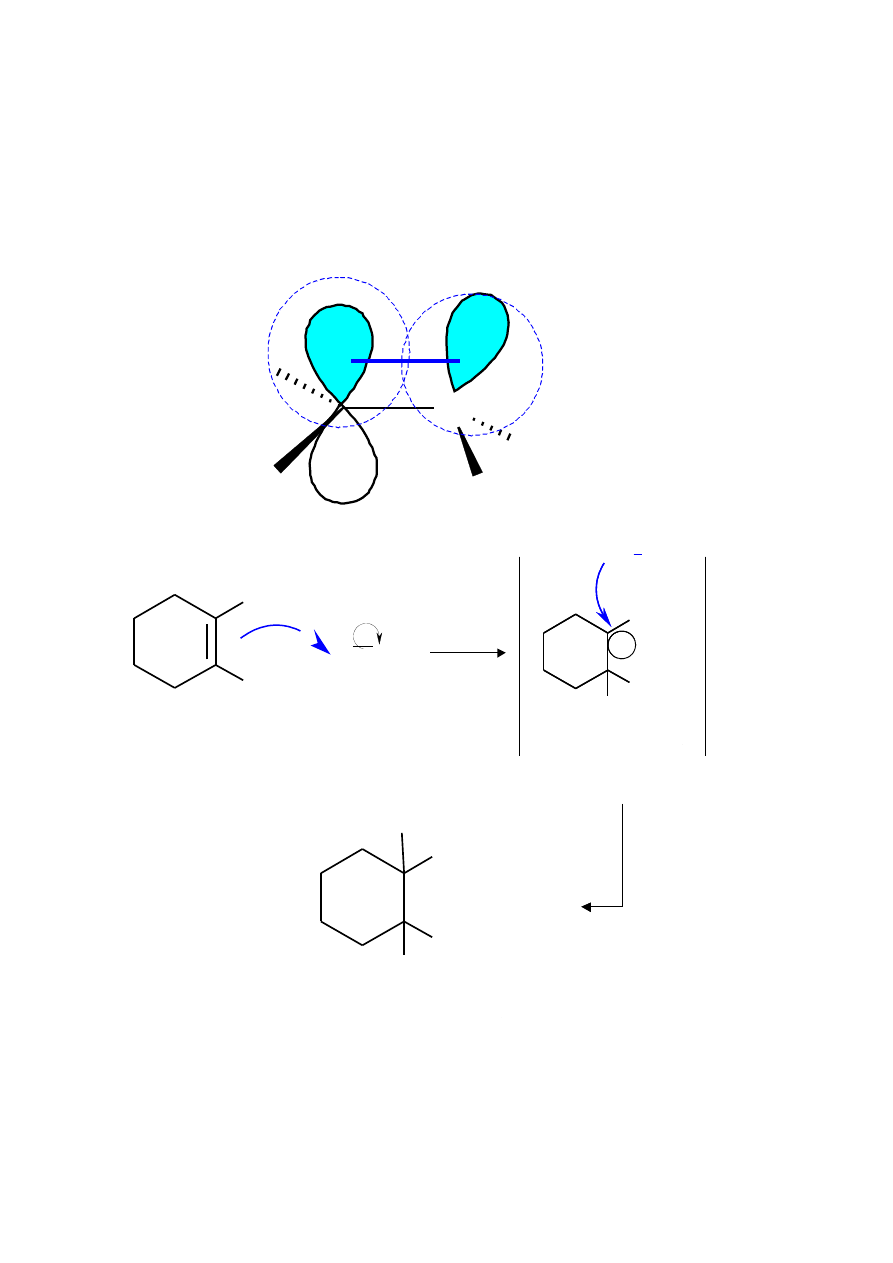
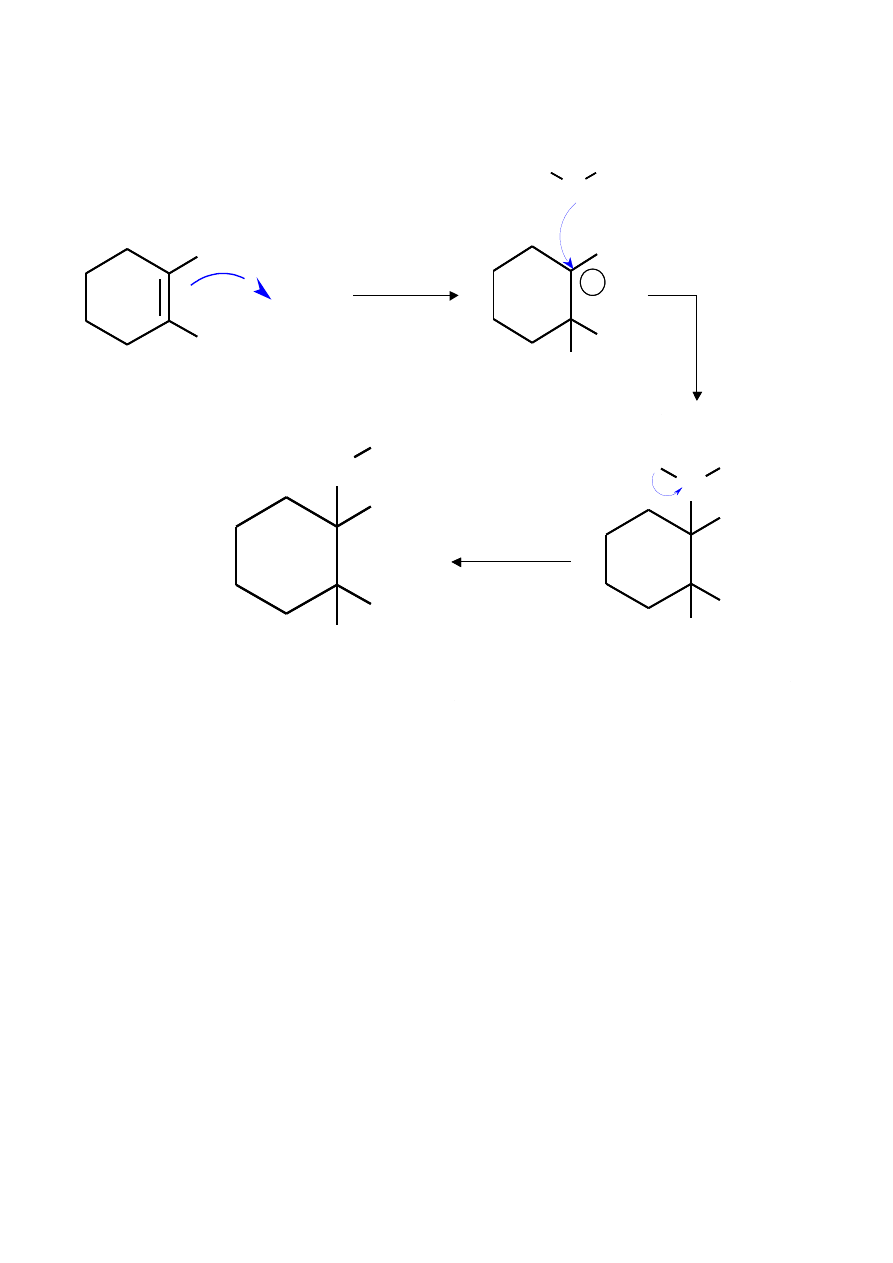
1-metylocykloheksen
karbokation trzeciorzędowy
1-chloro-1-metylocykloheksan
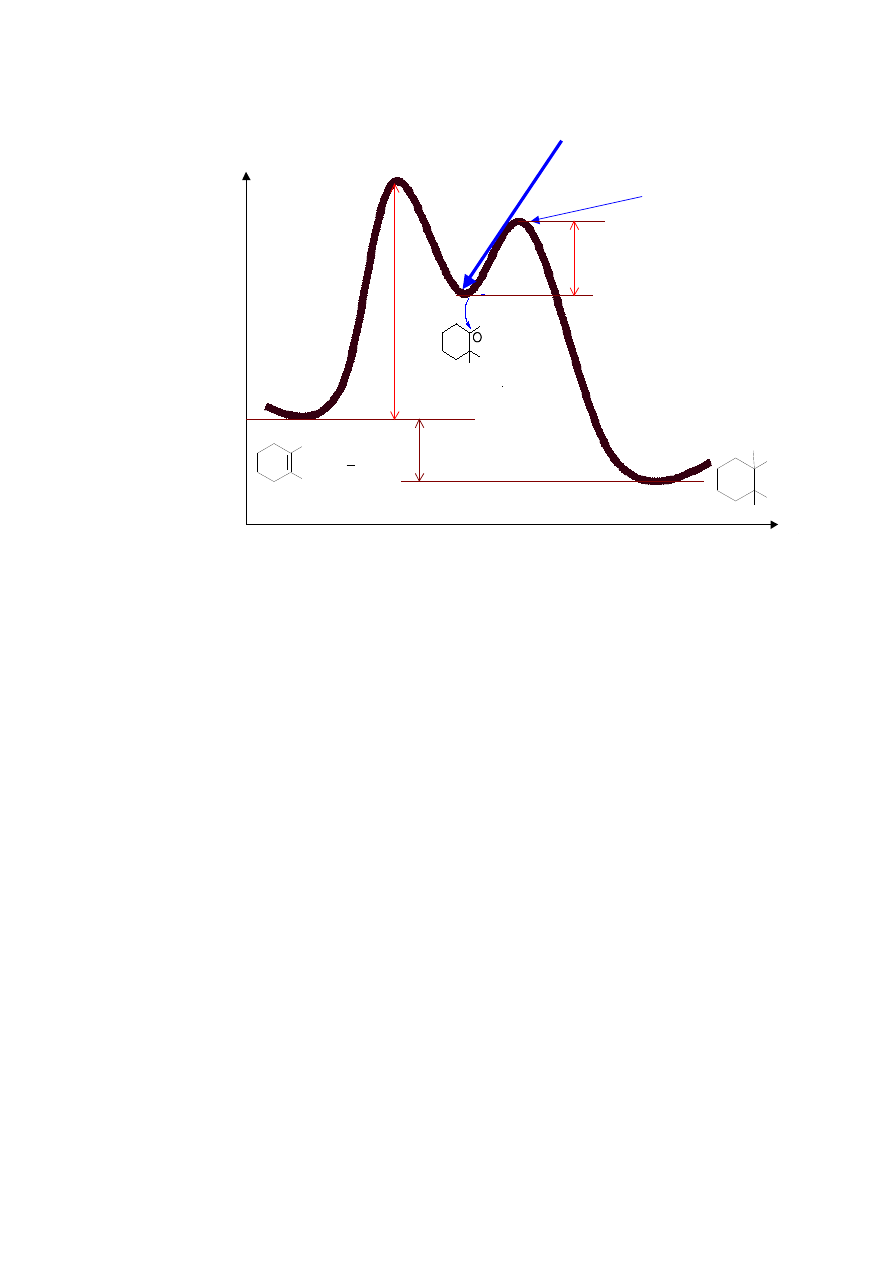
Współrzędne reakcji
E
ne
rg
ia
Stan przejściowy
karbokation
produkt pośredni
Stan przejściowy
etap 1 r.
endotermiczna
etap 2 r.
egzotermiczna
E
E
a
a
H
H
H
Cl
H
H
H
Cl
+
+
H
H
H
Cl
+
+
E
E
a
a
H
H
H
Cl
Δ
Δ
H
H
o
o
H
H
H
+
+
+
H
H
H
+
+
+
H
H
H
O
H
H
. .
. .
+
H
H
H
O
H
H
. .
. .
+
-
H
+
-
H
+
H
H
H
+
+
H
H
H
+
+
O
H
H
. .
. .
. .
. .
O
H
H
. .
. .
O
H
H
. .
. .
. .
. .
H
H
H
O
H
. .
. .
. .
. .
H
H
H
O
H
. .
. .
. .
. .
Mechanizm
Mechanizm
elektrofilowej
elektrofilowej
addycji wody do wiązania C=C
addycji wody do wiązania C=C
H
H
Br
Br
H
H
Br
+
Br
Br
H
H
Br
trans
-1,2-dibromocyklopentan
Addycja fluorowców do wiązania C=C
Addycja fluorowców do wiązania C=C
Addycja
Addycja
„
„
anti
anti
”
”
+ BH
3
B
OH
THF
Hydroborowanie alkenów
Hydroborowanie alkenów
cykloheksen
cykloheksen
boran
boran
tricykloheksyloboran
tricykloheksyloboran
H
2
O
2
OH
-
H
2
O
H
2
O
2
OH
-
H
2
O
cykloheksanol
H
C
H
3
H
H
B
H
H
H
B
H
H
H
H
C
H
3
H
H
B
H
H
H
C
H
3
H
H
H
H
C
H
3
H
H
H
OH
δ
+
δ
+
δ
-
B
H
H
H
czynniki elektronowe i steryczne decydują o regioizomerii
reakcji hydroborowania alkenów

Reakcje addycji do sprzężonych dienów
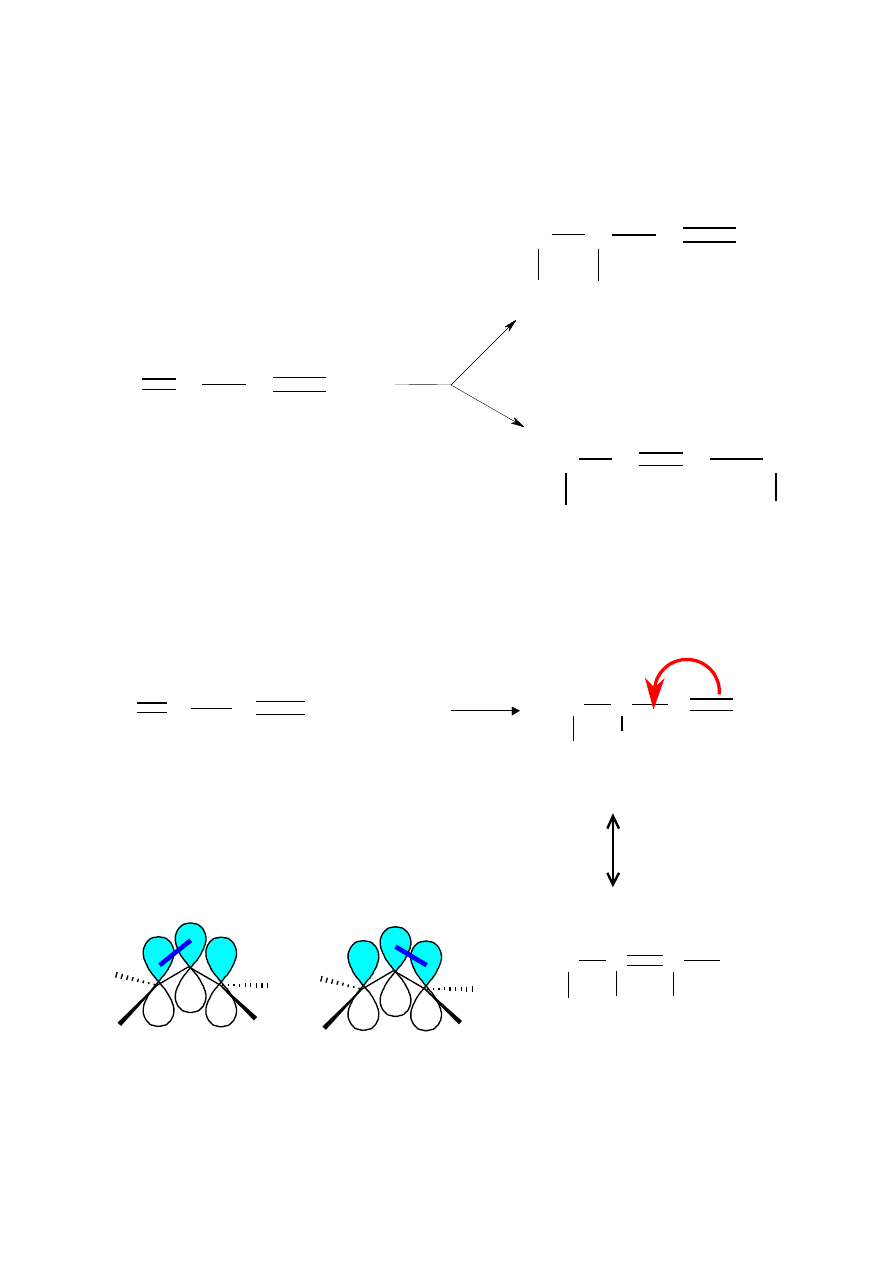
Reakcje addycji do sprzężonych dienów
C
H
2
C
H
C
H
CH
2
buta-1,3-dien
C
H
2
C
H
C
H
CH
2
buta-1,3-dien
C
H
2
C
H
C
H
CH
2
H
Br
3-bromobut-1-en
C
H
2
C
H
C
H
CH
2
H
Br
3-bromobut-1-en
C
H
2
C
H
C
H
C
H
2
H
Br
1-bromobut-2-en
C
H
2
C
H
C
H
C
H
2
H
Br
1-bromobut-2-en
HBr
HBr
Addycja 1,2
Addycja 1,4
C
H
2
C
H
C
H
CH
2
buta-1,3-dien
+
H
+
+
H
+
C
H
2
C
+
C
H
CH
2
H
H
+
+
C
H
2
C
C
H
H
CH
2
+
H
+
+
+
+
Karbokation allilowy stabilizowany przez rezonans
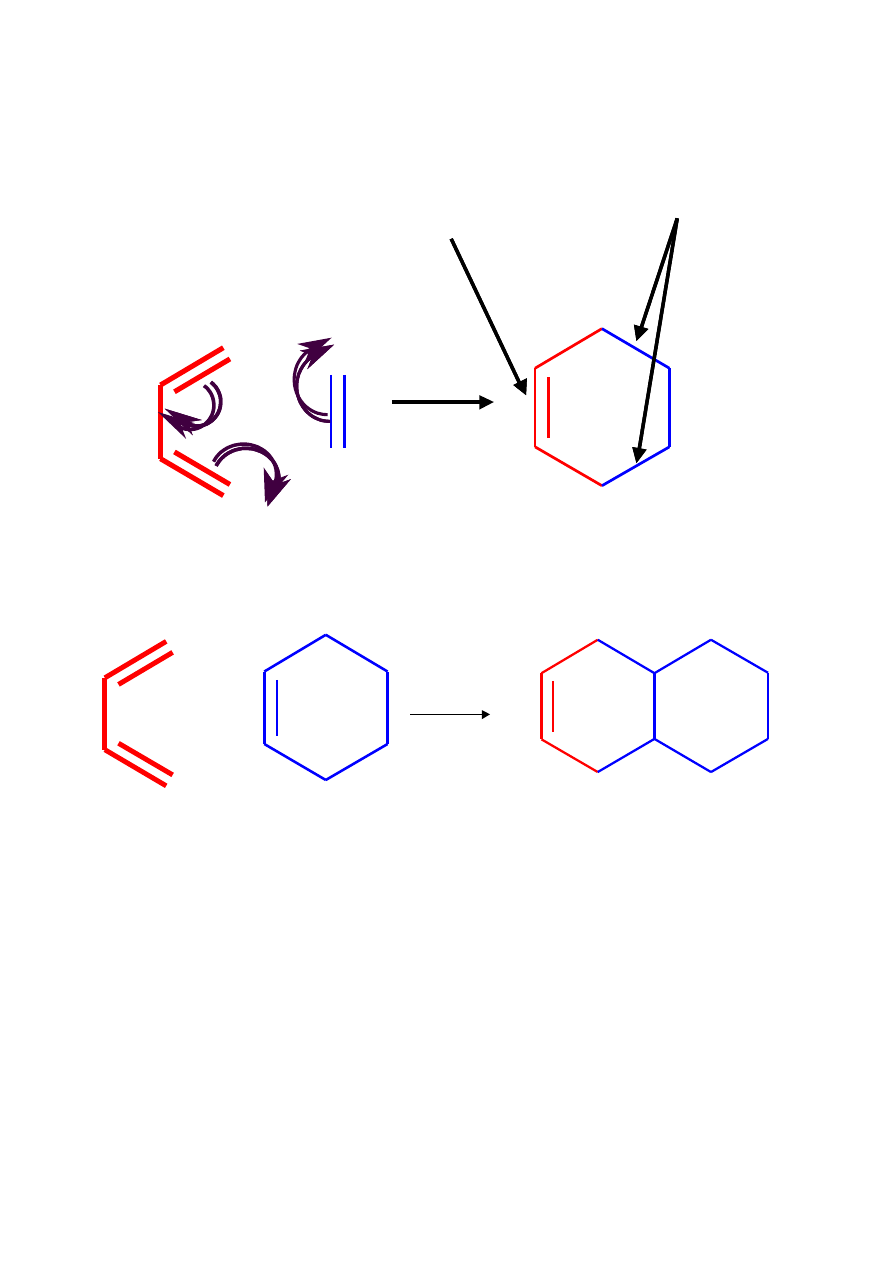
Reakcje cykloaddycji – Reakcja Dielsa-Aldera
nowe wiązanie
π
nowe wiązanie
π
nowe wiązania
σ
nowe wiązania
σ
DIEN DIENOFIL
DIEN DIENOFIL
+
DIEN DIENOFIL
DIEN DIENOFIL
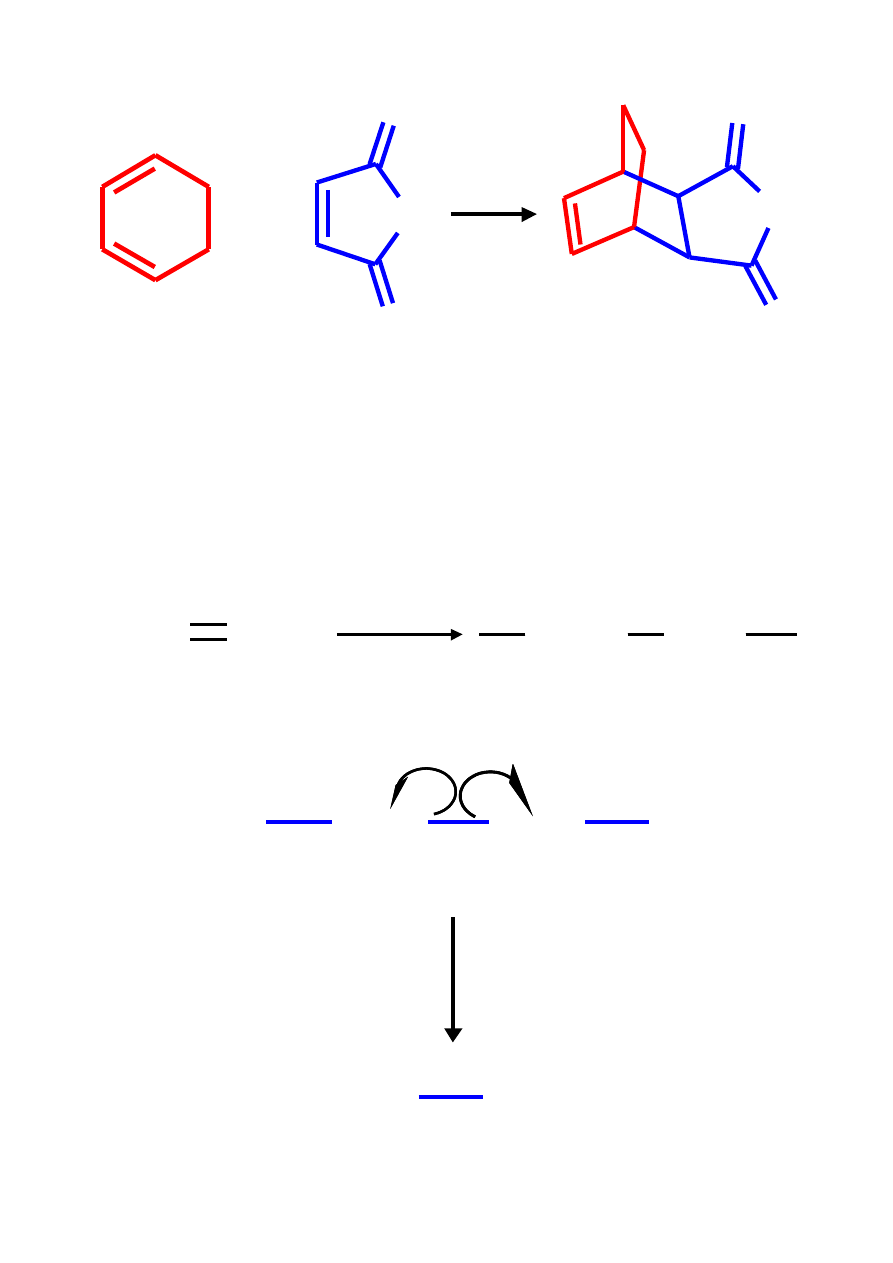
O
O
O
O
O
O
+
Addycja wolnorodnikowa
Reakcje polimeryzacji
C
H
2
CH
2
ROOR
1000 atm.
100
o
C
(n-kilkanaście tysięcy)
polietylen
polietylen
(
(
)
n
C
H
2
CH
2
(
(
)
n
C
H
2
CH
2
C
H
2
CH
2
R
O
O
R
R
O
2
2
.
R
O
2
2
.
H
H
H
Ph
R
O
.
R
O
.
POLIMERYZACJA WOLNORODNIKOWA
POLIMERYZACJA WOLNORODNIKOWA
H
H
H
Ph
RO
.
Ph
H
H
H
Ph
RO
. H
H
H
Ph
RO
.
Ph
H
H
Ph
RO
Ph
.
.
Ph
H
H
Ph
RO
Ph
.
.
Ph
H
H
Ph
RO
Ph
Ph
.
Ph
H
H
Ph
RO
Ph
Ph
.
Ph
polistyren
Reakcje utleniania
Reakcje utleniania
alkenów
alkenów
+ KMnO
4
+ H
2
O
C C
OH OH
alken nadmanganian glikol
potasu
O
3
O
3
O
O
O
O
O
O
molozonit ozonit
O O
O
Reakcje utleniania
Reakcje utleniania
alkenów
alkenów
ozonoliza
ozonoliza
Zn
H
3
O
+
Zn
H
3
O
+
C
O
O
C
+
C
O
O
C
+
Reakcje utleniania alkenów
Reakcje utleniania alkenów
R
O
O
OH
+
O
alken nadkwas epoksyd
Ozonoliza alkenów - przykłady
C
H
2
O
O
O
3
Zn, H
+
O
O
3
Zn, H
+
2
etanal
formaldehyd propanal
Reakcje redukcji alkenów
Reakcje redukcji alkenów
H H
H
H
+
katalizator
katalizator
alken
alkan
Katalizator
Katalizator Pd/C; PtO
Pd/C; PtO
2
2
uwodornienie syn
CH
3
H
H
CH
3
H
2
,
PtO
2
kwas octowy
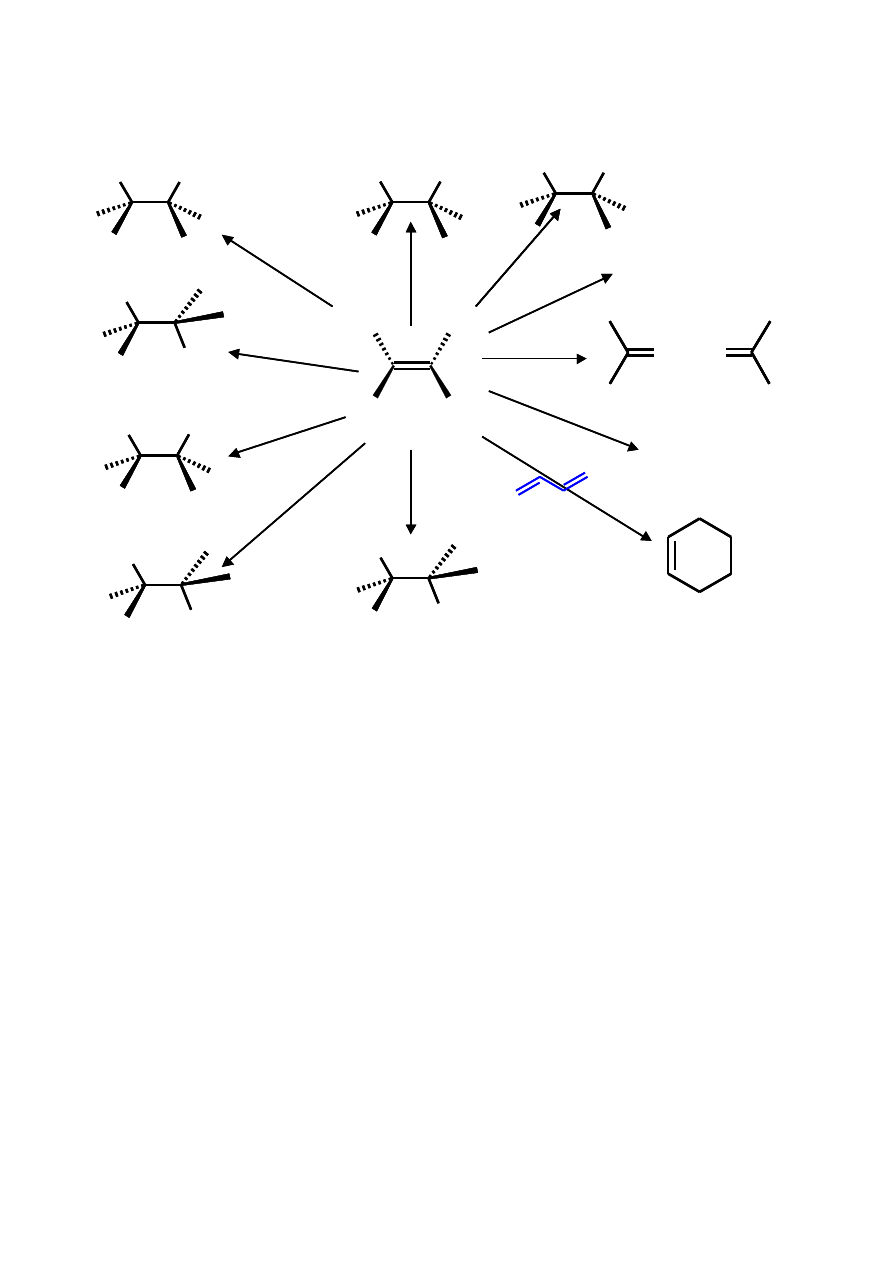
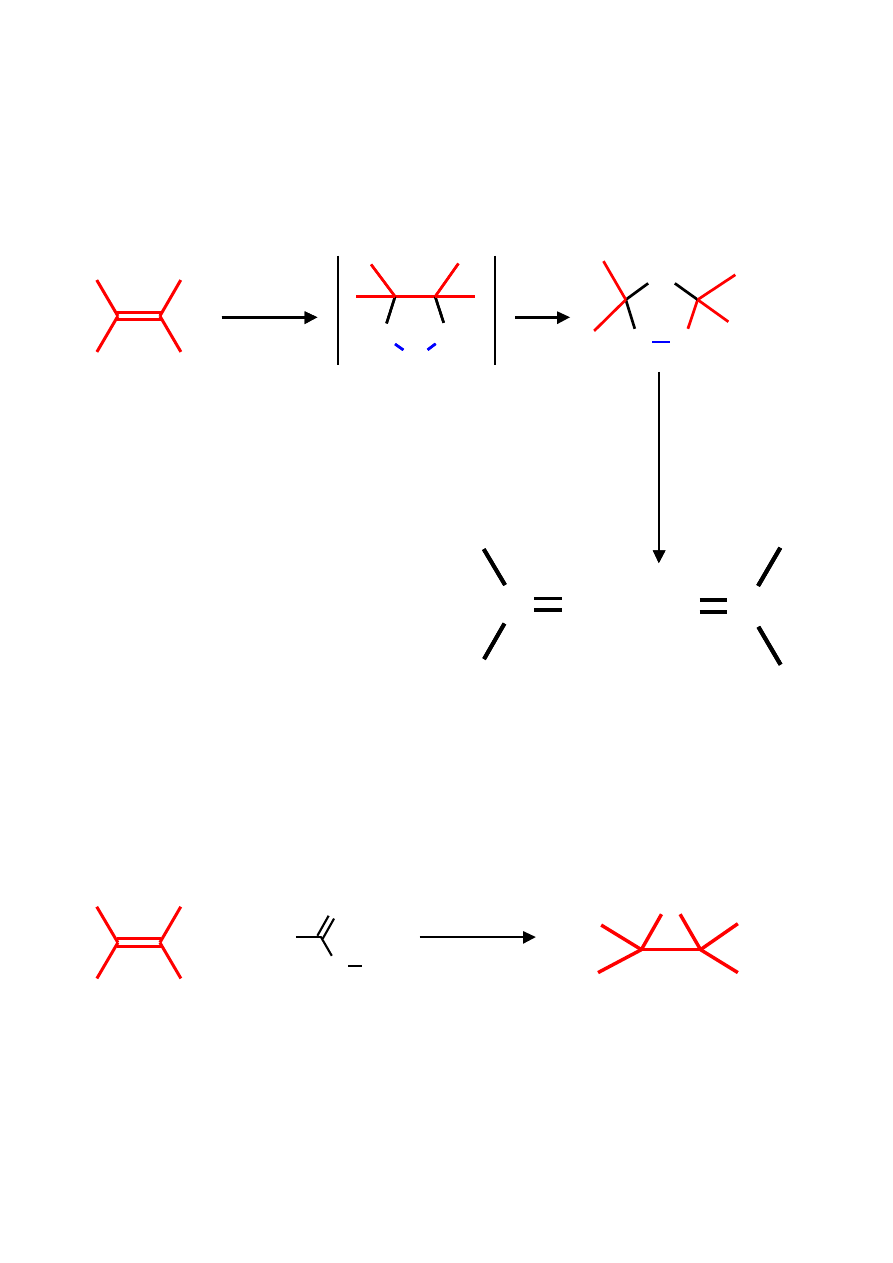
Zastosowanie alkenów w syntezie
H
H
H
2
H
H
H
2
H
X
HX
H
X
HX
X
X
X
2
X
X
X
2
H
OSO
3
H
H
2
SO
4
H
OSO
3
H
H
2
SO
4
X
OH
H
2
O, H
+
X
OH
H
2
O, H
+
X
OH
BH
3
X
OH
BH
3
polimery
rodnik
polimery
rodnik
O
O
O
3
O
O
O
O
O
3
O
H
OH
KMnO
4
O
H
OH
KMnO
4
KMnO
4
HX
Addycja 1,2 i 1,4
HX
Addycja 1,2 i 1,4
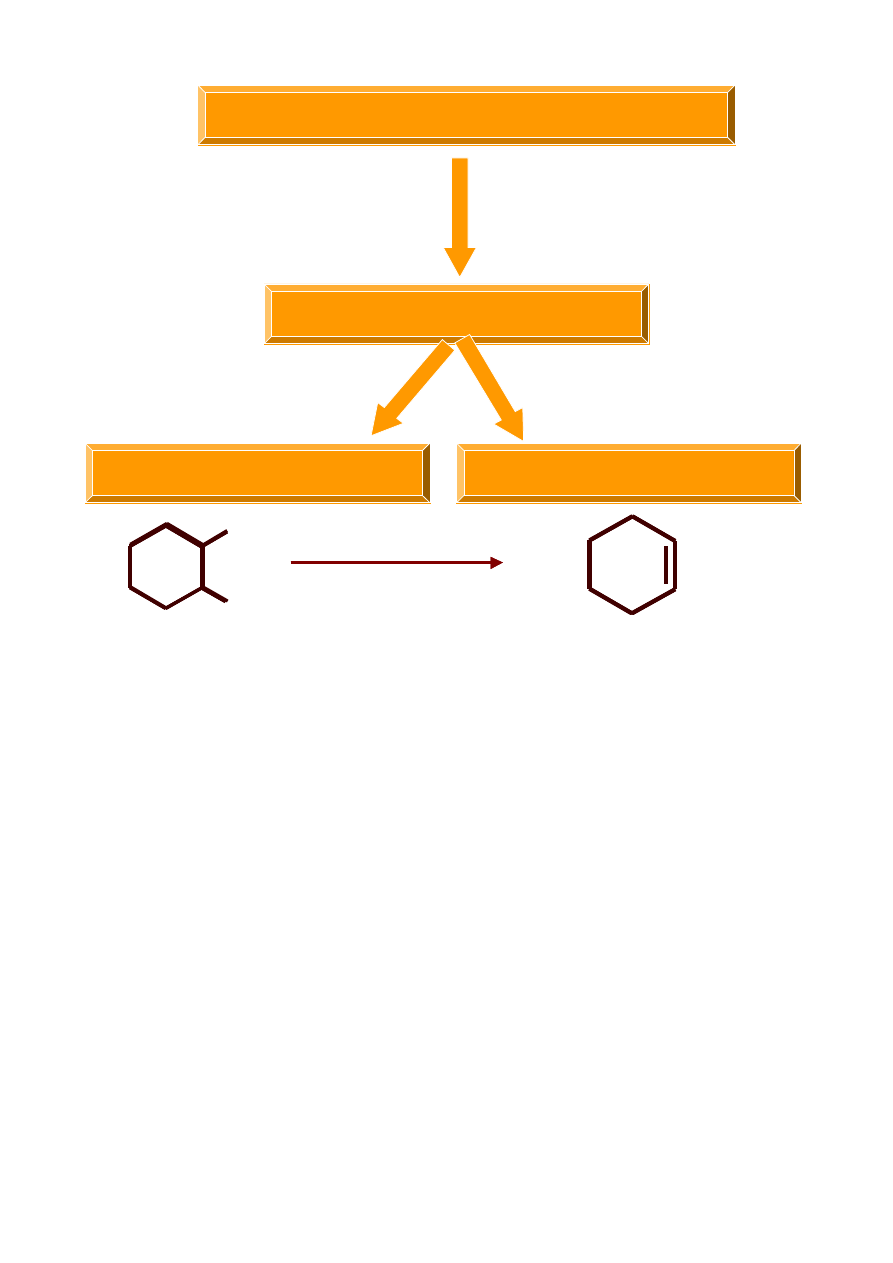
Reakcje otrzymywania alkenów
Reakcje eliminacji
dehydrohalogenacja
dehydratacja
H
Br
KOH
EtOH
H
Br
KOH
EtOH
H
OH
H
2
SO
4
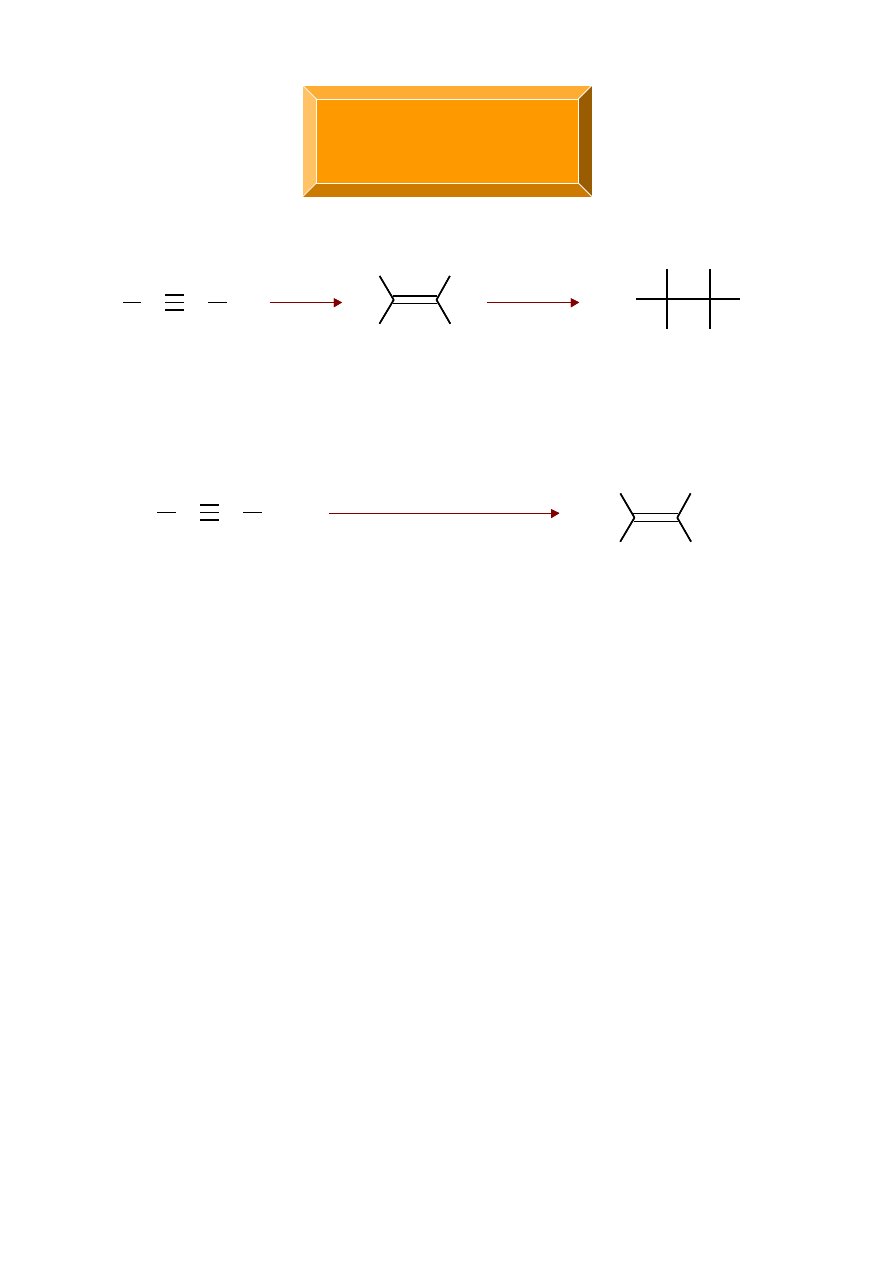
A l k i n y
Reakcje
C C
H
H
H
Br
H
Br
Br
Br
Br
Br
H
H
et
yn
trans-1,2-dibromoeten 1,1,2,2-tetrabromoetan
C C
H
H
H
Br
H
Br
Br
Br
Br
Br
H
H
et
yn
trans-1,2-dibromoeten 1,1,2,2-tetrabromoetan
C C
C
H
3
CH
3
H
CH
3
C
H
3
H
but-2-
yn
cis-but-2-en
H
2
Pd katalizator Lindlara
C C
C
H
3
CH
3
H
CH
3
C
H
3
H
but-2-
yn
cis-but-2-en
H
2
Pd katalizator Lindlara
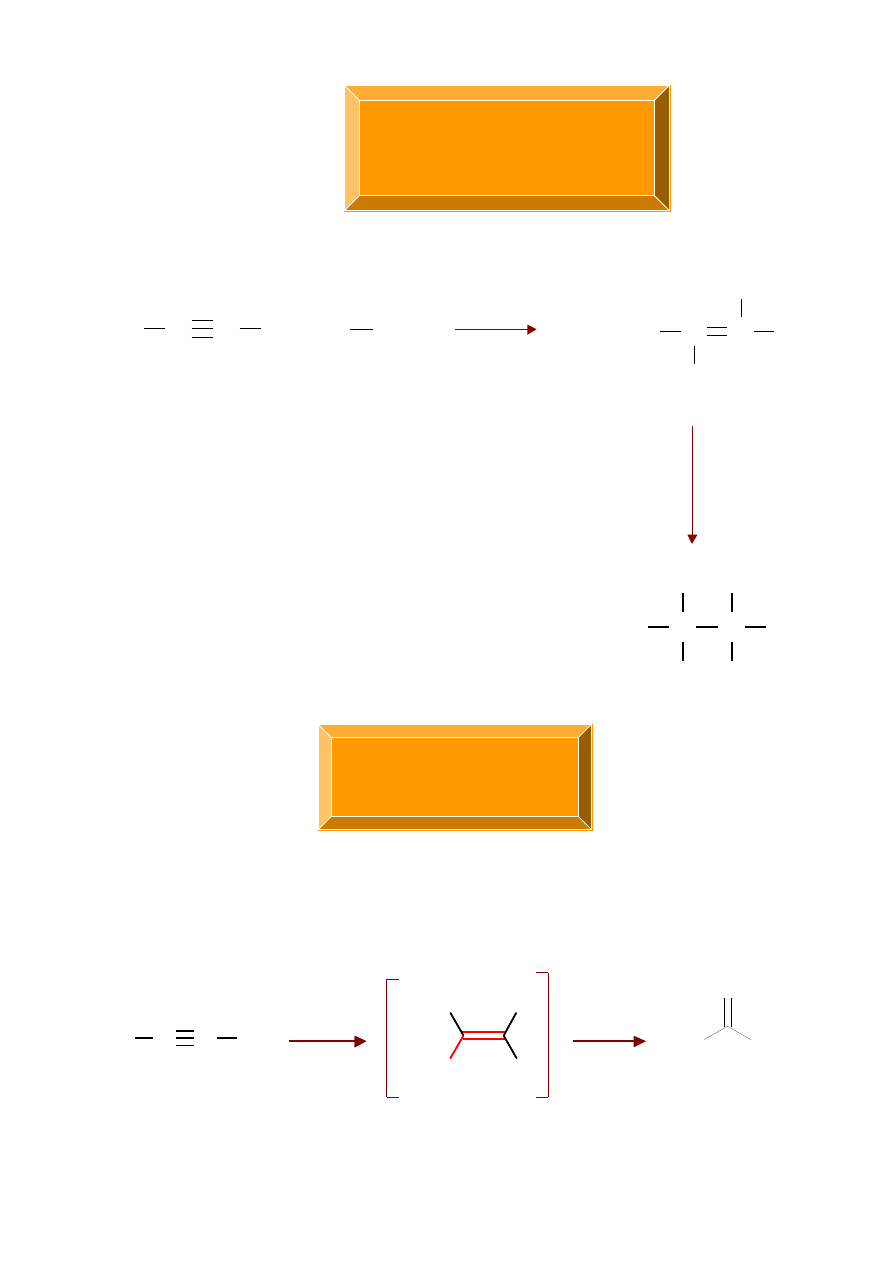
C C
C
H
3
H
A l k i n y
Reakcje
H
Br
+
C C
C
H
3
H
Br
H
HBr
C C
C
H
3
H
Br
Br
H
H
A l k i n y
Reakcje
C C
C
H
3
H
O
CH
3
C
H
3
H
2
O, H
+
HgSO
4
H
2
O, H
+
HgSO
4
H
H
C
H
3
O
H
H
H
C
H
3
O
H
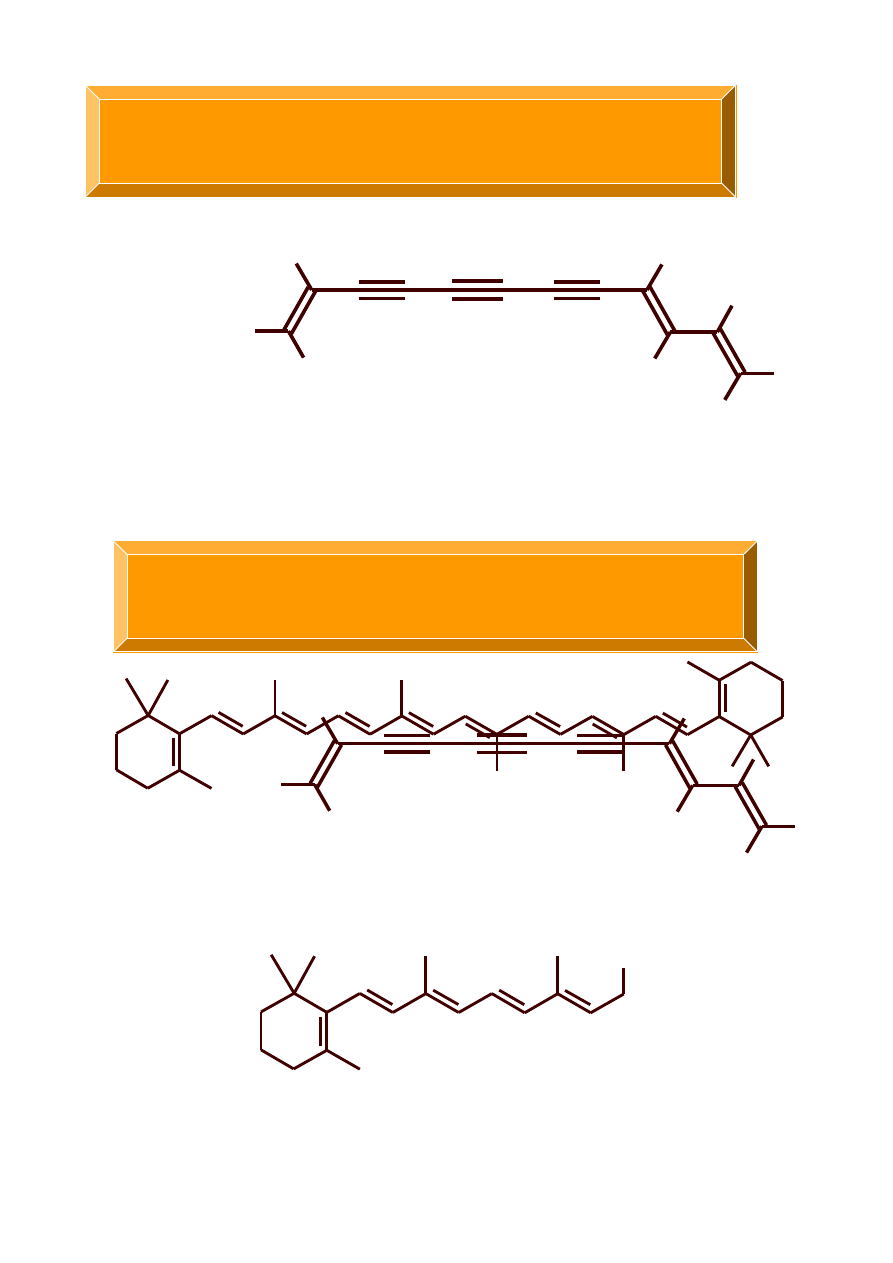
ALKENY I ALKINY W PRZYRODZIE
ALKENY I ALKINY W PRZYRODZIE
C
H
3
H
H
H
H
H
H
H
Carthanus tinctorius L
OH
β
-karoten
witamina A
witamina A
ALKENY I ALKINY W PRZYRODZIE
ALKENY I ALKINY W PRZYRODZIE
C
H
3
H
H
H
H
H
H
H
Carthanus tinctorius L
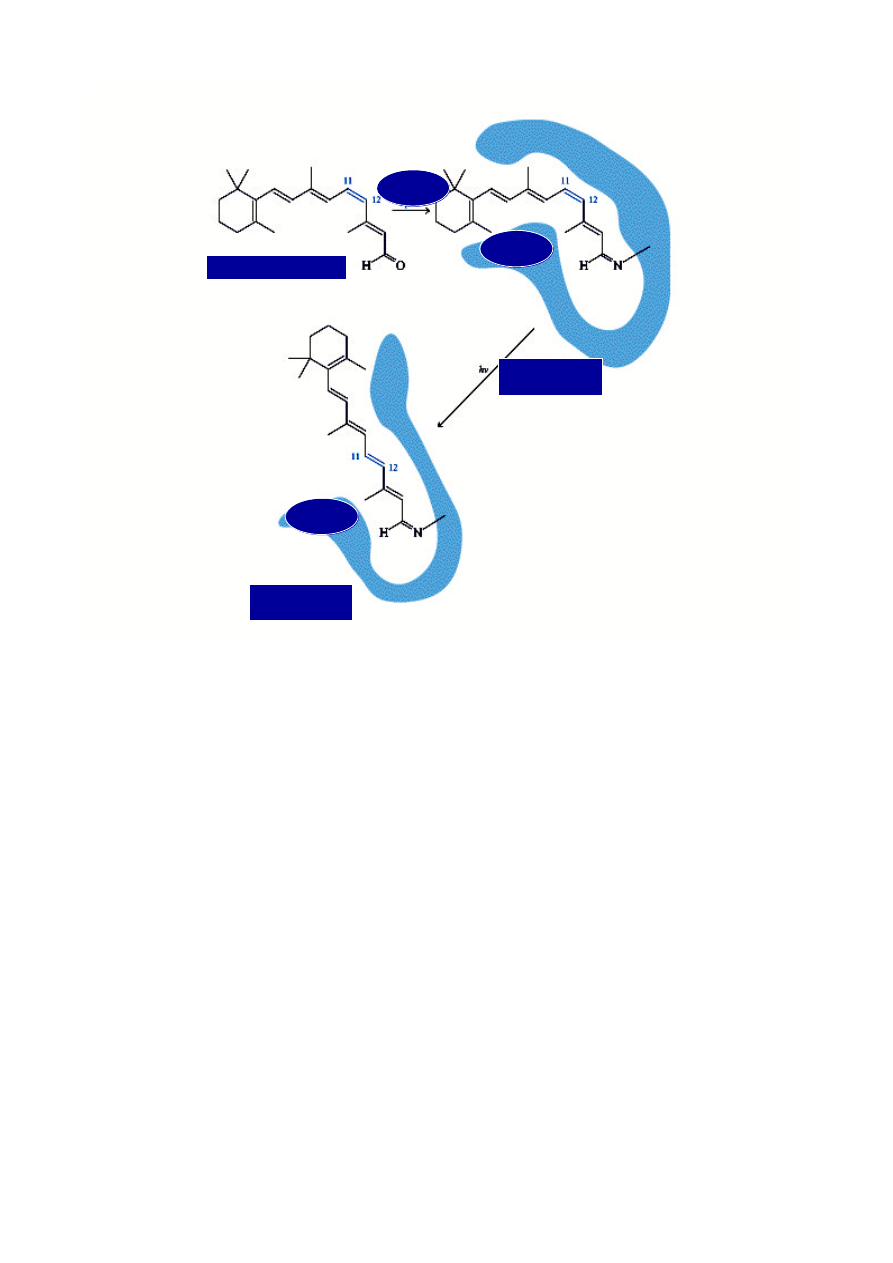
rodopsyna
opsyna
opsyna
opsyna
rodopsyna
11-cis-retinal
opsyna
Wyszukiwarka
Podobne podstrony:
Alkeny i alkiny id 58008 Nieznany (2)
alkany alkeny alkiny id 57988 Nieznany
Alkeny i alkiny id 58008 Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
więcej podobnych podstron