
Nowoczesny atomizm
Nowoczesny atomizm
od
od
Daltona
Daltona
do
do
Bohra
Bohra
dr hab. Andrzej M. Łukasik
dr hab. Andrzej M. Łukasik
Instytut Filozofii UMCS
Instytut Filozofii UMCS
http://
http://
bacon.umcs.lublin.pl
bacon.umcs.lublin.pl
/~
/~
lukasik
lukasik
lukasik@bacon.umcs.lublin.pl
lukasik@bacon.umcs.lublin.pl

Rozwój chemii w XVIII wieku
Rozwój chemii w XVIII wieku
[…] wynikiem badań chemików pokolenia Lavoisiera
było
wprowadzenie sześciu istotnych zmian do chemii, jaka
ukształtowała się w XVII wieku:
uznano powietrze za substancję reaktywną chemicznie;
przestano traktować powietrze jako pierwiastek i wprowadzono
pojęcie stanu gazowego;
zastosowano wagę do wyznaczania masy gazów;
wykazano doświadczalnie przyrost ciężaru substancji spalanych
w powietrzu;
sformułowano praktyczną, roboczą definicję pierwiastka;
przyjęto skorygowaną teorię składu chemicznego oraz bardziej
jednoznaczną i mniej zawiłą terminologię i nomenklaturę
związków chemicznych (William H. Brock,
Historia chemii
)

Prawo zachowania masy
Prawo zachowania masy
masa substratów przed reakcją równa jest masie
substancji po reakcji
Antoine
L. Lavoisier
-
1777
Michaił
W. Łomonosow -
1756

Prawo stosunków stałych
Prawo stosunków stałych
Joseph Louis Proust (1754–1826) składniki wszystkich
związków chemicznych występują zawsze w ściśle określonych
stosunkach ilościowych, niezależnie od warunków, w jakich te
związki zostały wytworzone
pierwiastków nie można łączyć w związki chemiczne w
dowolnych proporcjach

Podstawy nowoczesnej atomistyki
Podstawy nowoczesnej atomistyki
John
John
Dalton
Dalton
–
–
twórca nowoczesnej atomistyki
twórca nowoczesnej atomistyki
Pojęcie atomu staje się kategorią chemiczną i uzyskuje treść
Pojęcie atomu staje się kategorią chemiczną i uzyskuje treść
związaną z badaniami eksperymentalnymi
związaną z badaniami eksperymentalnymi
–
–
empiryczne określenie
empiryczne określenie
względnych ciężarów atomowych
względnych ciężarów atomowych
Prawo stosunków wielokrotnych (1805)
Prawo stosunków wielokrotnych (1805)
New System
New System
of
of
Chemical
Chemical
Philosophy
Philosophy
(1808)
(1808)

Prawo stosunków wielokrotnych
Prawo stosunków wielokrotnych
jeżeli dwa pierwiastki tworzą ze sobą różne związki chemiczne, to
pierwiastki te łączą się w różnych stosunkach wagowych, a stosunki te
wyrażają się niewielkimi liczbami całkowitymi
przykład - tlenek i dwutlenek węgla
Skład chemiczny wyrażony w stosunkach wagowych:
CO —
42,9 części wagowych C i 57,1 części wagowych O,
CO
2
—
42,9 części wagowych C i 114,2 części wagowych O
w dwutlenku węgla na tę samą ilość węgla przypada dwa razy więcej
tlenu niż w tlenku węgla. Stosunki wagowe pomiędzy łączącymi się
pierwiastkami wyrażają się liczbami całkowitymi i okazują się również
czynnikiem decydującym o własnościach związków chemicznych

New System of Chemical Philosophy
(1808)
Wszystkie ciała składają się z atomów powiązanych ze sobą
siłami przyciągania.
Wszystkie atomy ciał homogenicznych mają dokładnie taki sam
ciężar, wielkość i pozostałe własności.
Różne pierwiastki składają się z różnych atomów, w
szczególności atomy poszczególnych pierwiastków różnią się od
siebie ciężarem. Pierwiastki, podobnie jak atomy, z których są
zbudowane, są niezmienne i nie mogą się wzajemnie w siebie
przemieniać.
Atomy są niepodzielne chemicznie, a reakcje chemiczne mogą
jedynie doprowadzić do zmiany połączeń atomów.
Tworzenie się związków chemicznych z pierwiastków zachodzi
dzięki tworzeniu się “złożonych atomów” (
compound atoms
),
zawierających określoną liczbę atomów każdego pierwiastka.

„[chemicy] zawdzięczają Daltonowi
nie nowe prawa
eksperymentalne, lecz nowy sposób uprawiania chemii (on
sam nazwał go “nowym systemem filozofii chemicznej”).
Przyniósł on tak szybkie i oczywiste wyniki, że zaledwie paru
starszych chemików we Francji i Anglii ośmieliło się mu
oponować. W rezultacie chemicy przenieśli się do nowego
świata, w którym reakcje przebiegały zupełnie inaczej niż
poprzednio” (
Thomas
Thomas
Kuhn
Kuhn
,
,
Struktura rewolucji naukowych)
Struktura rewolucji naukowych)
1868–1871 Julius
Lothar
Meyer, Dmitryj
Iwanowicz
Mendelejew

Atomizm w fizyce
Atomizm w fizyce
Kinetyczno
Kinetyczno
-
-
molekularna teoria materii, II połowa XIX wieku
molekularna teoria materii, II połowa XIX wieku
James
James
Clerk
Clerk
Maxwell Ludwig
Maxwell Ludwig
Boltzmann
Boltzmann

Redukcja termodynamiki fenomenologicznej do
Redukcja termodynamiki fenomenologicznej do
fizyki statystycznej
fizyki statystycznej
James Clerk Maxwell (1831–1879), Rudolf Julius Emmanuel
Clausius (1822–1888), Ludwig Eduard Boltzmann (1844–1906)
Ciepło jest procesem, który polega na przekazywaniu energii
kinetycznej od jednego ciała do drugiego w rezultacie
wzajemnych zderzeń między cząsteczkami.
Zastosowanie praw mechaniki Newtona do bardzo dużej liczby
atomów lub cząsteczek i wytłumaczenie zachowania gazu
statystycznie, poprzez uśrednienie zachowania pojedynczych
cząsteczek
Matematyczny opis procesów gazowych - mechanika
statystyczna (rachunek prawdopodobieństwa)

Boltzmann
Boltzmann
–
–
mikroskopowa interpretacja II
mikroskopowa interpretacja II
zasady
zasady
termodymaniki
termodymaniki
II zasada termodynamiki:
II zasada termodynamiki:
dS
dS
/dt>0
/dt>0
S =
S =
k
k
b
b
lnP
lnP
Wzrost entropii w układach izolowanych oznacza ewolucję od
Wzrost entropii w układach izolowanych oznacza ewolucję od
stanów bardziej uporządkowanych do mniej uporządkowanych
stanów bardziej uporządkowanych do mniej uporządkowanych
(od stanów mniej prawdopodobnych do bardziej
(od stanów mniej prawdopodobnych do bardziej
prawdopodobnych)
prawdopodobnych)
Proces, w którym entropia rożnie jest bardziej prawdopodobny
Proces, w którym entropia rożnie jest bardziej prawdopodobny
niż proces, w którym entropia maleje
niż proces, w którym entropia maleje

Ruchy
Ruchy
Browna
Browna
Robert
Robert
Brown
Brown
(1827)
(1827)
–
–
chaotyczne drgania cząsteczek pyłków
chaotyczne drgania cząsteczek pyłków
roślin zawieszonych w cieczy, które można obserwować przez
roślin zawieszonych w cieczy, które można obserwować przez
mikroskop
mikroskop

Teorię ruchów Browna na podstawie
hipotezy atomistycznej podali niezależnie
od siebie Einstein w 1905 roku i Marian
Smoluchowski (1872–1917) w roku 1906.
Wyniki teoretyczne uzyskały
potwierdzenie eksperymentalne w
pracach Jeana Baptiste’a Perrina (1870–
1942) w latach 1908–1911.
Sformułowanie teorii ruchów Browna
miało przełomowe znaczenie w sporze o
realność atomów

1666
1666
–
–
Isaac
Isaac
Newton:
Newton:
rozszczepienie światła
rozszczepienie światła
(przepuszczając światło
(przepuszczając światło
słoneczne przez mały otwór
słoneczne przez mały otwór
w zasłonie okiennej, a
w zasłonie okiennej, a
następnie przez pryzmat,
następnie przez pryzmat,
zaobserwował barwne
zaobserwował barwne
widmo słoneczne)
widmo słoneczne)
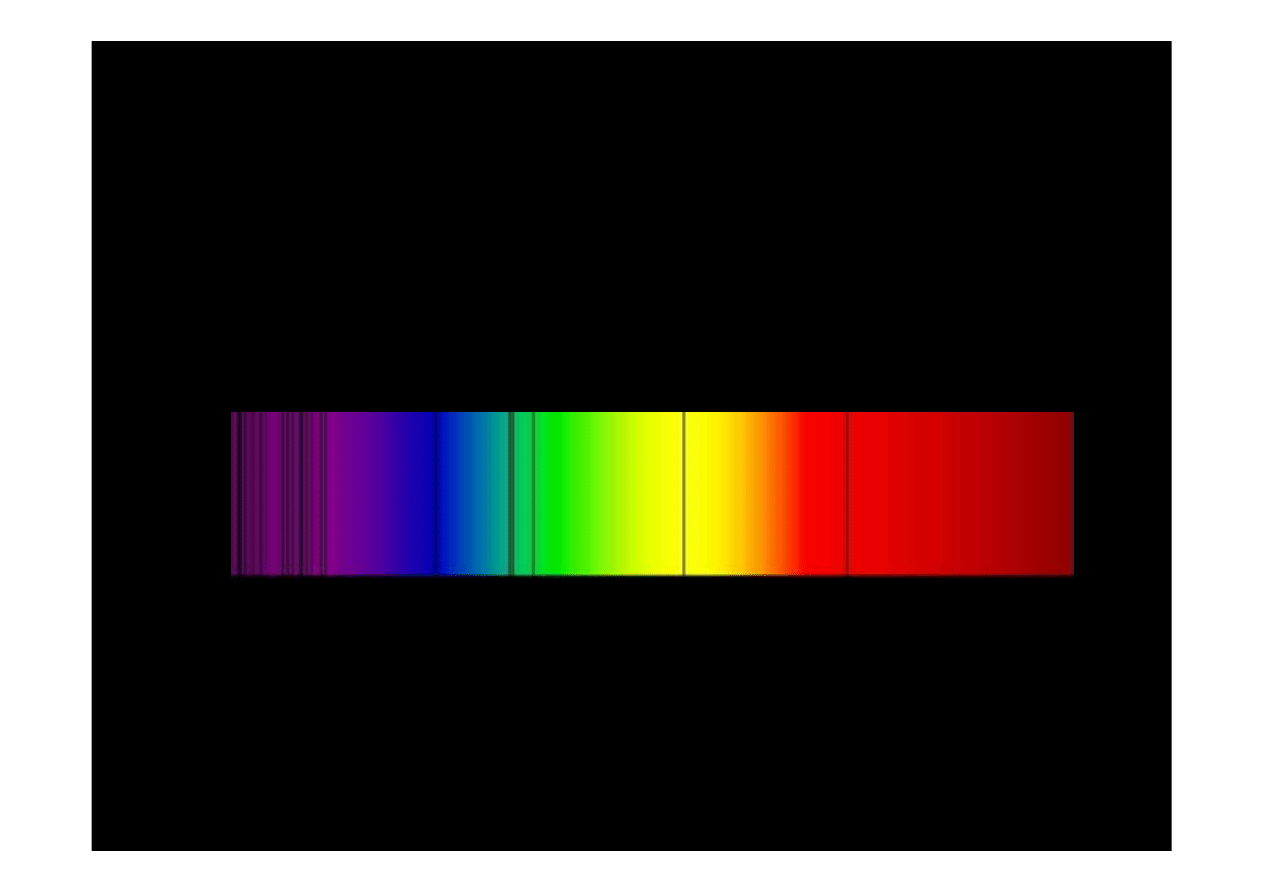
Dyskretne linie widmowe
Dyskretne linie widmowe
1802
1802
-
-
William Hyde
William Hyde
Wollaston
Wollaston
(1766
(1766
–
–
1828): obserwacje
1828): obserwacje
ciemnych linii w widmie słonecznym
ciemnych linii w widmie słonecznym

1814
1814
-
-
Joseph
Joseph
von
von
Fraunhofer
Fraunhofer
(1787
(1787
–
–
1826): spektrometr, w
1826): spektrometr, w
widmie słonecznym kilkaset ciemnych prążków występujących
widmie słonecznym kilkaset ciemnych prążków występujących
w obszarach różnych barw
w obszarach różnych barw
1834
1834
-
-
William Henry
William Henry
Fox
Fox
Talbot
Talbot
(1800
(1800
–
–
1877)
1877)
-
-
rozróżnianie
rozróżnianie
substancji chemicznych na podstawie ich widm
substancji chemicznych na podstawie ich widm
1859
1859
-
-
Gustav
Gustav
Robert
Robert
Kirchhoff
Kirchhoff
(1824
(1824
–
–
1887) i Robert Bunsen
1887) i Robert Bunsen
(1811
(1811
–
–
1899): wyjaśnienie pochodzenia ciemnych linii w
1899): wyjaśnienie pochodzenia ciemnych linii w
widmie słonecznym jako rezultat absorpcji światła o
widmie słonecznym jako rezultat absorpcji światła o
określonej barwie przez różne pierwiastki.
określonej barwie przez różne pierwiastki.

Prawa spektroskopii
Prawa spektroskopii
Kirchhoffa
Kirchhoffa
1. Każdemu pierwiastkowi odpowiada charakterystyczne widmo.
1. Każdemu pierwiastkowi odpowiada charakterystyczne widmo.
2. Każdy pierwiastek zdolny jest absorbować promieniowanie,
2. Każdy pierwiastek zdolny jest absorbować promieniowanie,
które może emitować.
które może emitować.
Początek nowej nauki
Początek nowej nauki
—
—
astrofizyki
astrofizyki
Badanie widma światła (promieniowania
Badanie widma światła (promieniowania
elektromagnetycznego) stanowi współcześnie jedną z
elektromagnetycznego) stanowi współcześnie jedną z
podstawowych metod astronomii obserwacyjnej
podstawowych metod astronomii obserwacyjnej
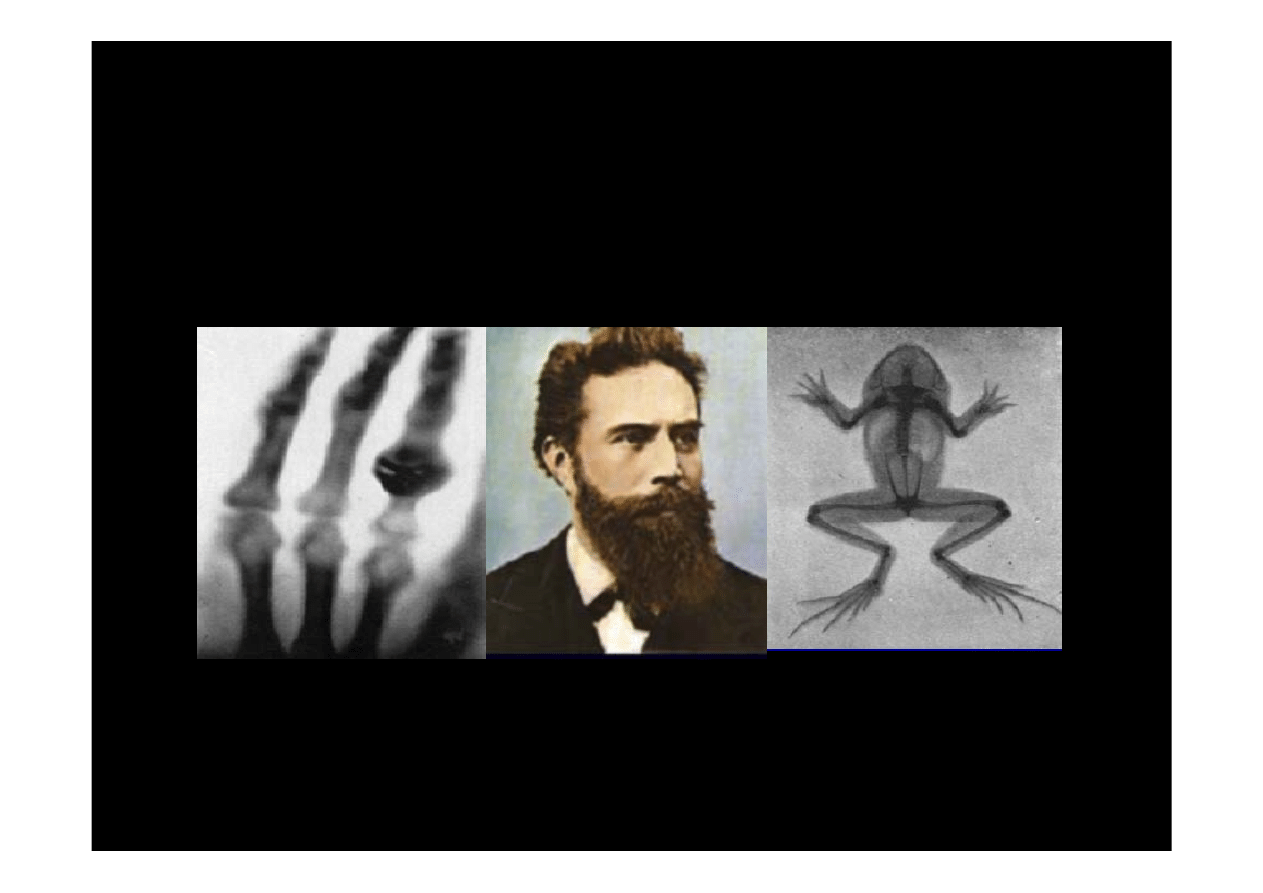
Wilhelm Konrad
Wilhelm Konrad Röntgen
(1845
(1845
-
-
1923)
1923)
1895
1895
-
-
odkrycie promieni X
odkrycie promieni X

Odkrycie promieniotwórczości
Odkrycie promieniotwórczości
Antoine
Antoine
Henri
Henri
Becquelel
Becquelel
–
–
1896
1896
promieniotwórczość uranu
promieniotwórczość uranu
Pierre
Pierre
Curie i Maria Skłodowska
Curie i Maria Skłodowska
-
-
Curie radioaktywność toru orz
Curie radioaktywność toru orz
odkrycie nowych pierwiastków:
odkrycie nowych pierwiastków:
polon i rad (1898)
polon i rad (1898)
Ernest
Ernest
Rutherford
Rutherford
(1899)
(1899)
–
–
składowe „alfa” i „beta” w
składowe „alfa” i „beta” w
promieniowaniu radu
promieniowaniu radu
Poul
Poul
Willard
Willard
–
–
promienie
promienie
„gamma”
„gamma”

Odkrycie elektronu
Odkrycie elektronu
Joseph
Joseph
John
John
Thomson
Thomson
, 1897
, 1897
Badania nad promieniami
Badania nad promieniami
katodowymi
katodowymi
Pomiar stosunku masy
Pomiar stosunku masy
elektronu do ładunku
elektronu do ładunku
m/e = 1,759 x 10
m/e = 1,759 x 10
11
11
C/kg
C/kg
1909 Robert
1909 Robert
Andrew
Andrew
Millikan
Millikan
:
:
e = 1,6 x 10
e = 1,6 x 10
-
-
19
19
C
C
m = 9,1 x 10
m = 9,1 x 10
-
-
31
31
kg
kg
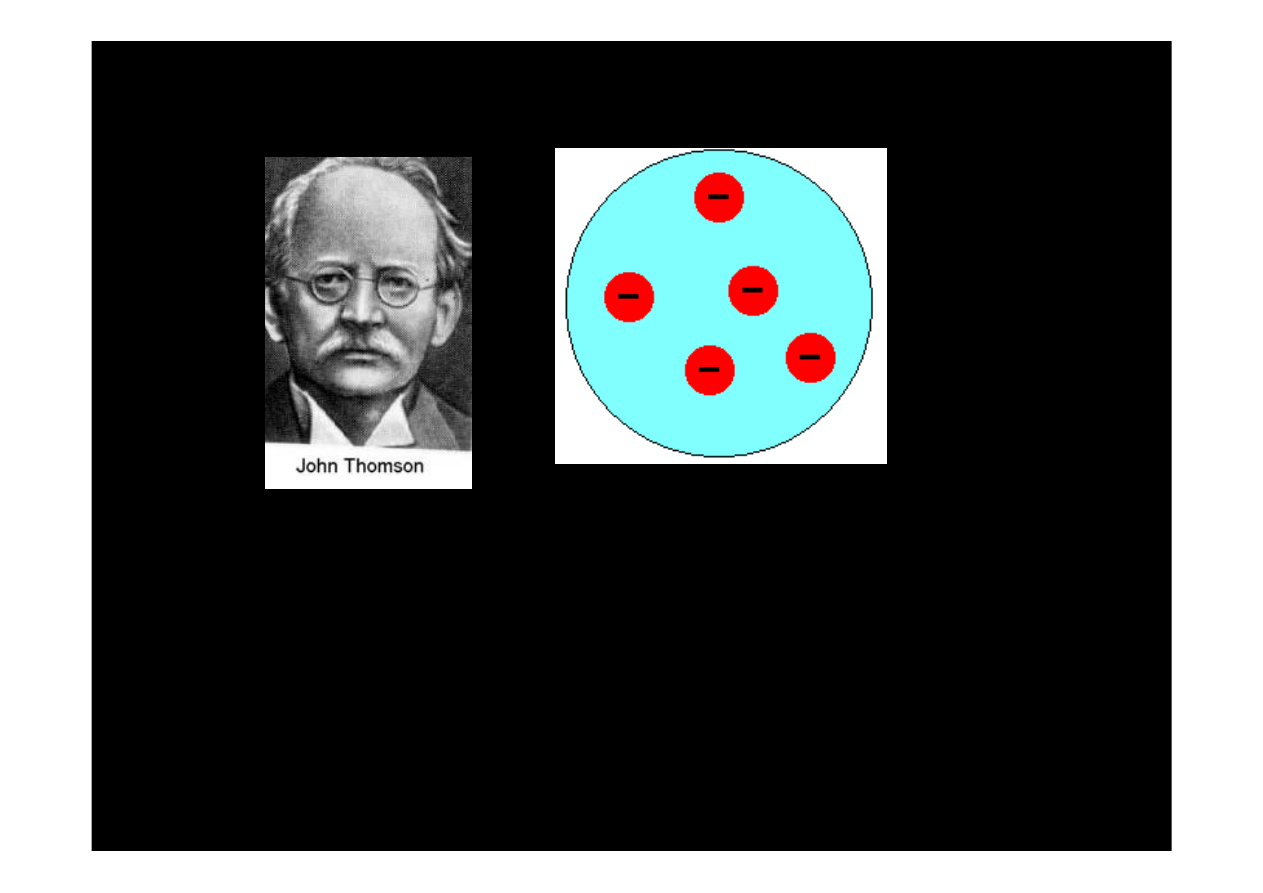
Model atomu Thomsona (1902) — “ciasto z rodzynkami”. W
dodatnio naładowanej kulistej kropli materii o rozmiarach
rzędu 10
–10
m tkwią ujemnie naładowane elektrony. Atom
jako całość jest elektrycznie obojętny
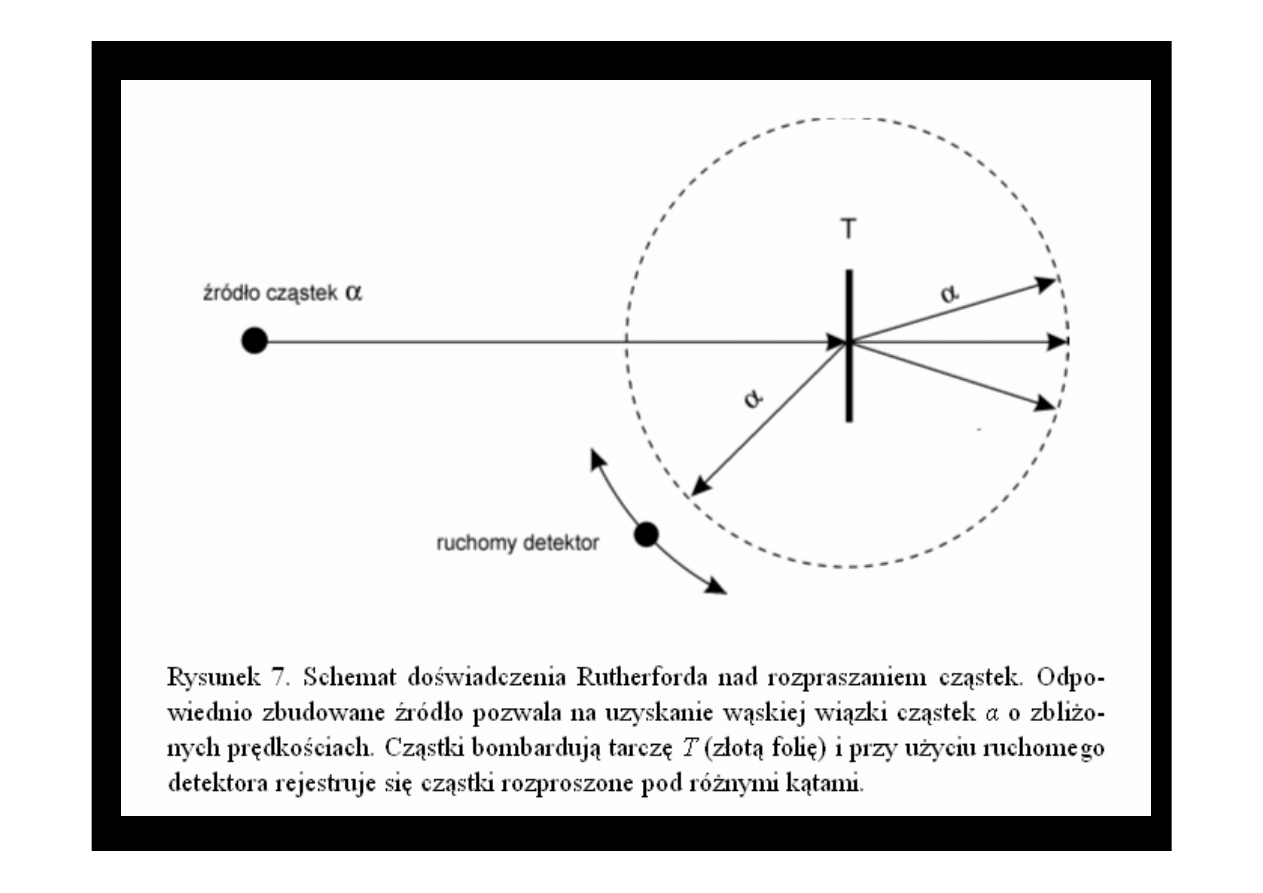

To z pewnością najbardziej niewiarygodna rzecz, która
To z pewnością najbardziej niewiarygodna rzecz, która
wydarzyła mi się w życiu
wydarzyła mi się w życiu
—
—
napisał
napisał
Rutherford
Rutherford
. Było to tak
. Było to tak
samo niewiarygodne, jakby 15
samo niewiarygodne, jakby 15
-
-
calowy pocisk, który
calowy pocisk, który
wystrzeliliście
wystrzeliliście
w
w
kierunku
kierunku
kawałka bibułki, wrócił i trafił w was
kawałka bibułki, wrócił i trafił w was
(
(
Rutherford
Rutherford
)
)
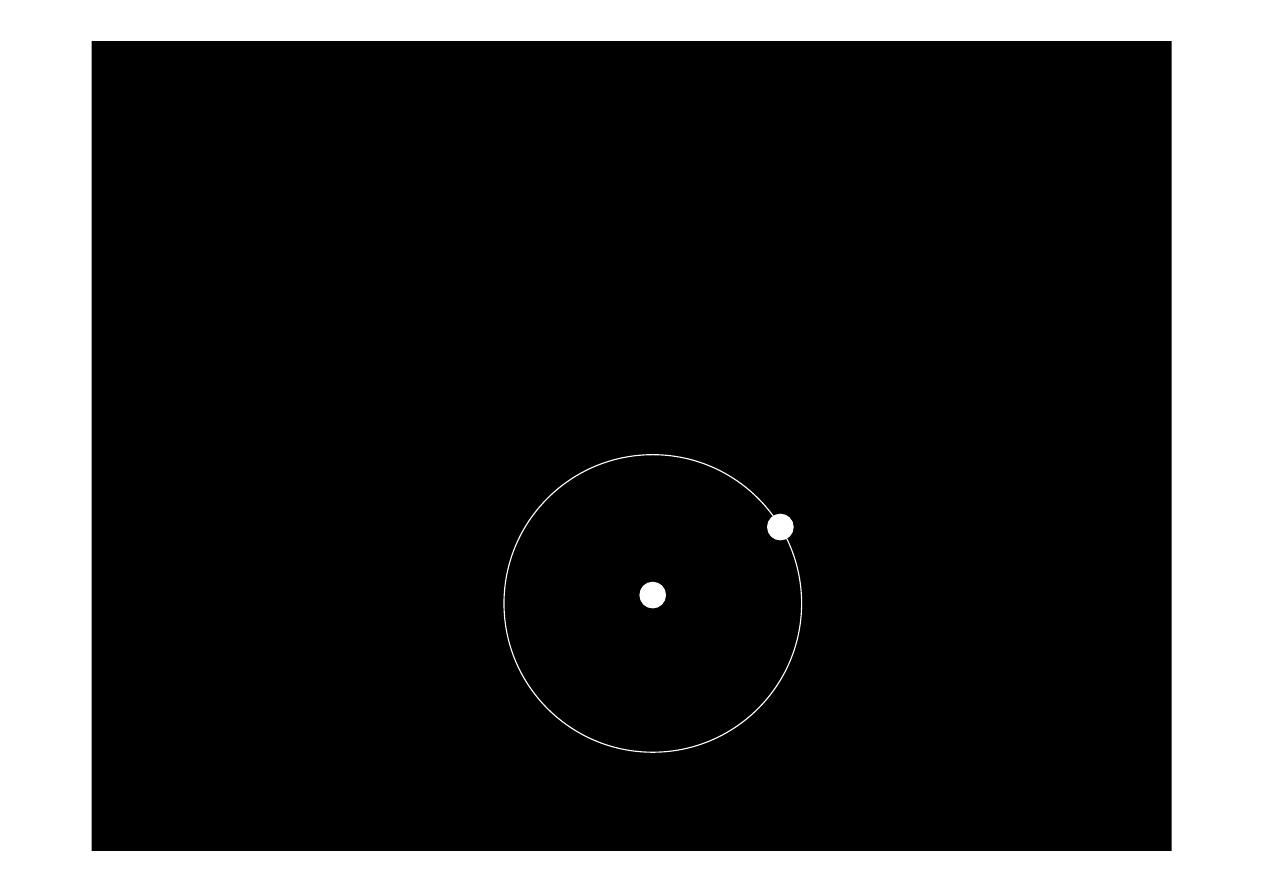
Planetarny model atomu
Planetarny model atomu
Rutherforda
Rutherforda
(1911)
(1911)
Rozmiary atomu
Rozmiary atomu
–
–
10
10
–
–
10
10
m
m
Rozmiary jądra atomowego: 10
Rozmiary jądra atomowego: 10
-
-
15
15
m
m
Max
Max
Planck
Planck
(1858
(1858
-
-
1947)
1947)
prawo promieniowania
prawo promieniowania
ciała doskonale czarnego (
ciała doskonale czarnego (
bbr
bbr
)
)
14 grudnia 1900
14 grudnia 1900
–
–
narodziny teorii kwantów
narodziny teorii kwantów
h
h
–
–
elementarny kwant działania
elementarny kwant działania
λ
λ
π
λ
λ
λ
d
e
hc
d
T
u
kT
hc
1
1
8
)
,
(
5
−
=
ν
h
E =

h
h
energia jest emitowana i absorbowana nie w sposób ciągły, ale w
sposób dyskretny, czyli kwantami, proporcjonalnie do stałej
Plancka
h
i częstości
ν

Albert Einstein (1879
Albert Einstein (1879
-
-
1955)
1955)
teoria zjawiska fotoelektrycznego (1905)
teoria zjawiska fotoelektrycznego (1905)
światło jest strumieniem cząstek (fotonów), których energia
jest proporcjonalna do częstości fali świetlnej:
E = h
ν,
pęd fotonów
p
związany jest z długością fali świetlnej
λ
wzorem:
p = h/ λ = h
ν
/c
c
= 3 x 10
8
m/s – prędkość światła w próżni
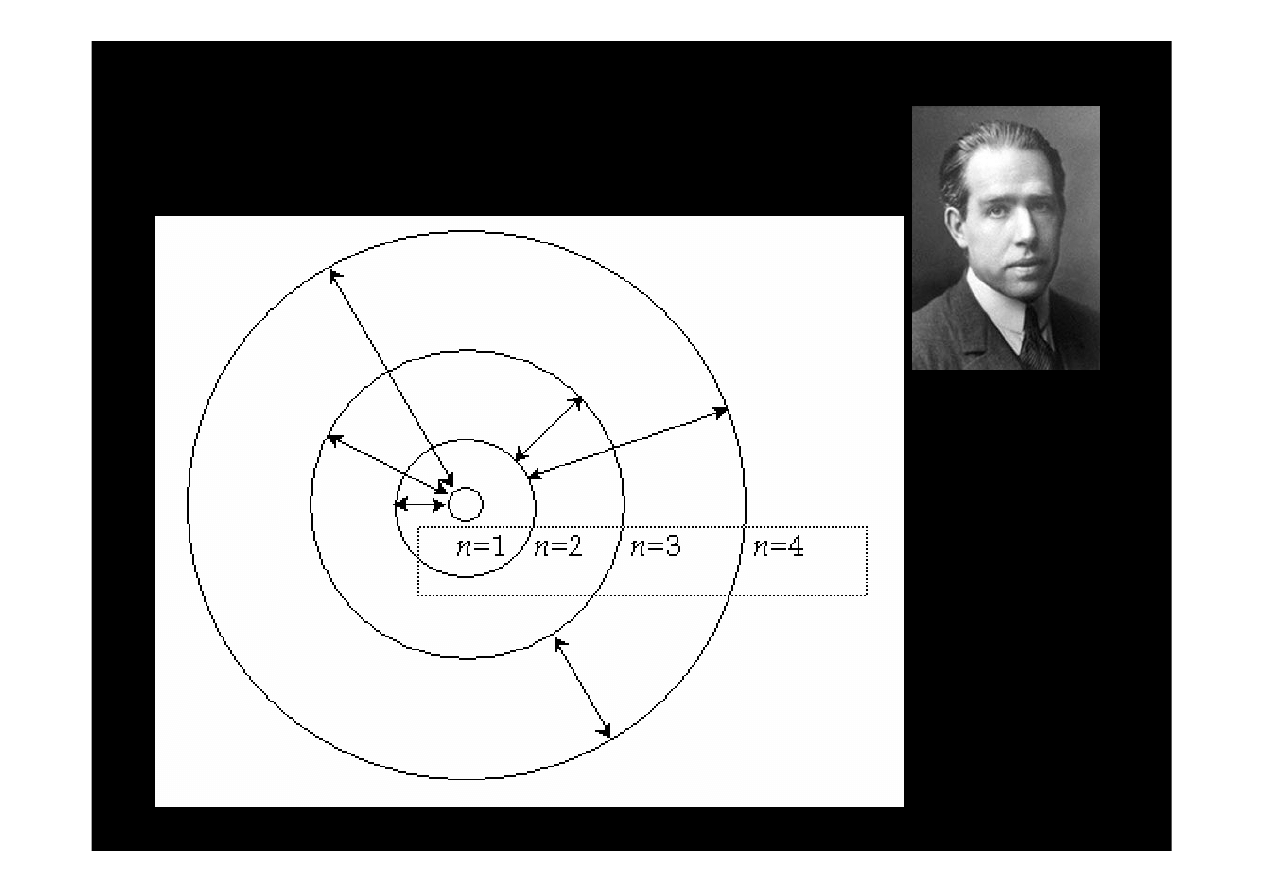
Niels
Niels
Bohr
Bohr
(1855
(1855
-
-
1962)
1962)
model atomu wodoru (1913)
model atomu wodoru (1913)

Postulaty kwantowe
Postulaty kwantowe
Bohra
Bohra
1.
Ze wszystkich możliwych klasycznych orbit kołowych tylko takie są
dozwolone, na których wartość momentu pędu elektronu (
mvr
) jest
całkowitą wielokrotnością stałej Plancka
h
podzielonej przez 2
π
:
mvr = nh/
2
π
.
orbity są skwantowane
-
ich promienie mogą przybierać jedynie
ściśle określone, dyskretne wartości.
2.
Elektron na dozwolonej, czyli stacjonarnej orbicie nie promieniuje
energii.
3.
Elektron emituje lub absorbuje energię tylko podczas przejścia z
jednej orbity stacjonarnej na drugą; energia wypromieniowanego
lub pochłoniętego kwantu promieniowania elektromagnetycznego
równa jest wartości bezwzględnej różnicy energii stanu końcowego
E
n
i początkowego
E
m

Louis
Victor
de Broglie
(1892–1987)
hipoteza f
al materii
al materii
(1924)
Recherches sur la théorie des Quanta
p
h
λ
=
Document Outline
- Nowoczesny atomizm od Daltona do Bohra
- Rozwój chemii w XVIII wieku
- Prawo zachowania masy
- Prawo stosunków stałych
- Podstawy nowoczesnej atomistyki
- Prawo stosunków wielokrotnych
- New System of Chemical Philosophy (1808)
- Slide Number 8
- 1868–1871 Julius Lothar Meyer, Dmitryj Iwanowicz Mendelejew
- Atomizm w fizyce Kinetyczno-molekularna teoria materii, II połowa XIX wieku
- Redukcja termodynamiki fenomenologicznej do fizyki statystycznej
- Boltzmann – mikroskopowa interpretacja II zasady termodymaniki
- Ruchy Browna Robert Brown (1827) – chaotyczne drgania cząsteczek pyłków roślin zawieszonych w cieczy, które można obserwować przez mikroskop
- Slide Number 14
- Dyskretne linie widmowe
- Slide Number 17
- Prawa spektroskopii Kirchhoffa
- Wilhelm Konrad Röntgen (1845-1923) 1895 - odkrycie promieni X
- Odkrycie promieniotwórczości
- Odkrycie elektronu Joseph John Thomson, 1897
- Slide Number 24
- Planetarny model atomu Rutherforda (1911)
- Max Planck (1858-1947) prawo promieniowania ciała doskonale czarnego (bbr) 14 grudnia 1900 – narodziny teorii kwantów h – elementarny kwant działania
-
- Albert Einstein (1879-1955) teoria zjawiska fotoelektrycznego (1905)
- Niels Bohr (1855-1962) model atomu wodoru (1913)
- Postulaty kwantowe Bohra
- Louis Victor de Broglie (1892–1987) hipoteza fal materii (1924) Recherches sur la théorie des Quanta
Wyszukiwarka
Podobne podstrony:
od relatywizmu do prawdy
od 33 do 46
od 24 do 32
Ewolucja techniki sekcyjnej – od Virchowa do Virtopsy®
Od zera do milionera
OD BABILONII DO HISZPANII
Od złotówki do stówki
Moje dziecko rysuje Rozwój twórczości plastycznej dziecka od urodzenia do końca 6 roku życia
Zagadnienia z botaniki pytania od 30 do 38, Botanika
Dziecko poznaje smaki - żywienie niemowląt, Dziecko, Żywienie niemowląt, żywienie dzieci (od noworod
Od zera do gier kodera6
03 Od krzaczka do krzaczka
Od marzen do realizacji fragment id 330850
od zera do ecedeela cz 2 (2)
Dajczak W Od retoryki do argumentacji prawniczej
Optymalizacja dostaw od producent%F3w do hurtowni
więcej podobnych podstron