prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
73
AZOTOWCE - grupa 15. (V A)
Ogólna charakterystyka pierwiastków
Symbol Nazwa
Walenc.
Konfig.
Elektr.
Elektro-
ujemność
(Allreda-
Rochowa)
Właściwości
N
azot
(gaz)
2s
2
p
3
3,07
niemetal
P
fosfor
(c. stałe)
3s
2
p
3
2,06
niemetal
As
arsen
(c. stałe)
4s
2
p
3
2,20
półmetal
Sb
antymon
(c. stałe)
5s
2
p
3
1,82
półmetal
Bi
bizmut
(c. stałe)
6s
2
p
3
1,67
metal
stopnie utlenienia
(-3) N, P np. NH
3
NH
4
+
PH
3
(+1) N
2
O
(+3) N P As Sb Bi (N
2
O
3
)
(+5) N P As Sb Bi (N
2
O
5
)
Ponadto N: -2 -1 +2 +4
N
2
H
4
NH
2
OH NO NO
2
N
3
-
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
74
Występowanie i otrzymywanie azotowców
N P As Sb Bi
0,002 % 0.11 % 10
-4
% 10
-5
% 10
-5
%
33 13 miejsce
w skorupie ziemskiej
saletra chilijska NaNO
3
saletra indyjska KNO
3
Azot – główny składnik atmosfery (N
2
78,1 %)
Otrzymywanie azotu:
1)
ogrzewanie azotanu(III) amonu
-3 +3 0
NH
4
NO
2
= N
2
+ 2H
2
O
2)
rozkład termiczny azydku sodu: (N
3
-
)
NaN
3
= Na + 3/2 N
2
(bardzo czysty azot)
3)
frakcjonowana destylacja skroplonego
powietrza
T
wrz
azotu 77 K
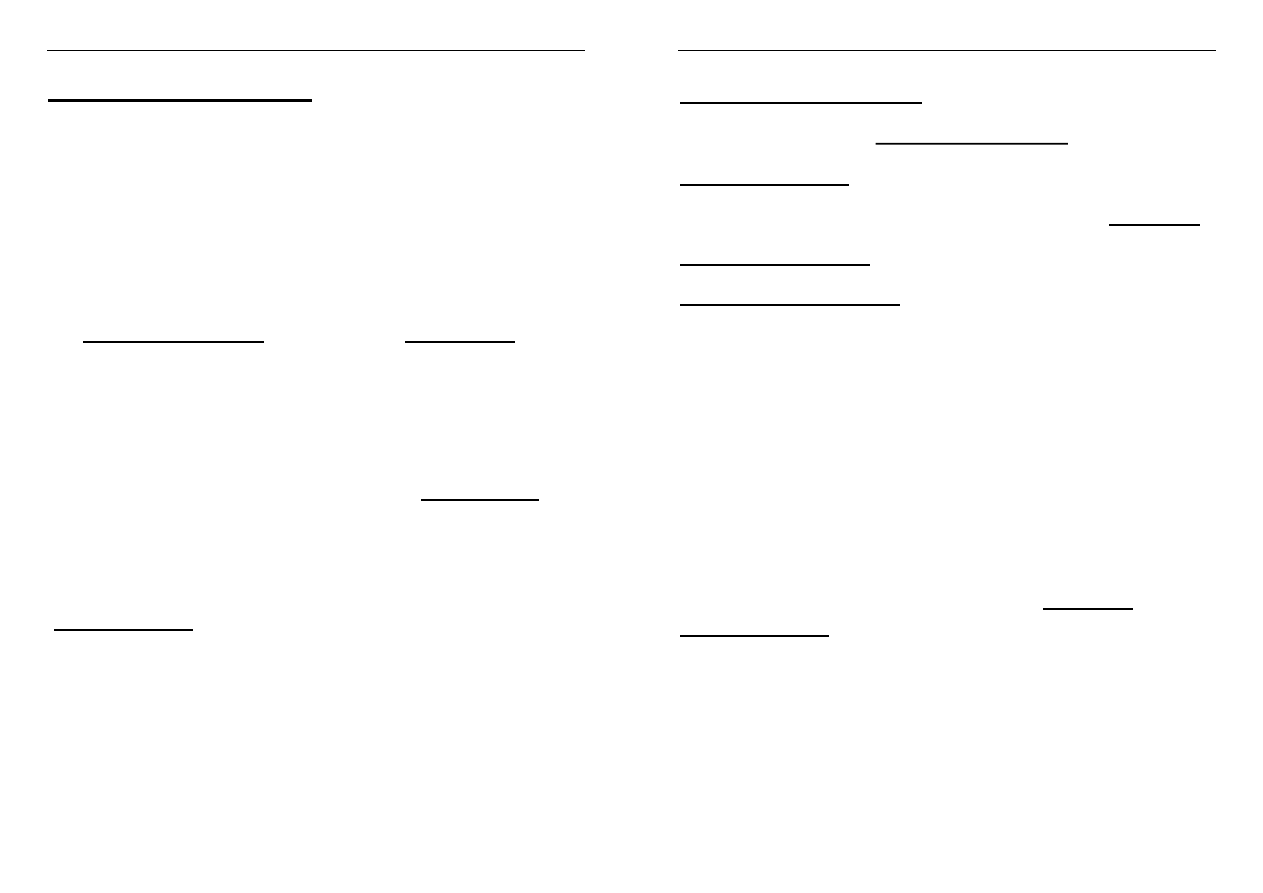
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
75
Obieg azotu w przyrodzie:
Azot krąży ustawicznie między atmosferą, biosferą
i litosferą.
N jest podstawowym składnikiem białek
(zbudowanych z aminokwasów)
a) N
2
z atmosfery przyswajany jest przez
bakterie azotowe i zielone algi
(żyjące na roślinach strączkowych) (grzyby, paprocie)
N
2
Î NH
3
b) bakterie: NH
3
Î NO
2
-
Î NO
3
-
nitryfikacja
c) NO
3
-
przyswajany przez rośliny Î aminokwasy
roślinne
(część NO
3
-
przerabiana przez bakterie
denitryfikujące na N
2
- zawracany do atmosfery)
d) aminokwasy roślinne Î aminokwasy zwierzęce
e) procesy gnilne: białka Î NH
3
f)
bakterie: NH
3
Î N
2
(do atmosfery)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
76
Występowanie fosforu
- w
przyrodzie istnieje w postaci fosforanów:
Apatyt fluorowy 3Ca
3
(PO
4
)
2
· CaF
2
(składnik skały osadowej – fosforytu)
Apatyt węglanowy 3Ca
3
(PO
4
)
2
· CaCO
3
· H
2
O
Apatyt hydroksylowy 3Ca
3
(PO
4
)
2
· Ca(OH)
2
(oba są składnikami kości i zębów)
W organizmach:
Fosfolipidy (składniki błon komórkowych),
ATP – przenośnik energii, kwasy nukleinowe (DNA
i RNA), substancja nerwowa i mózgowa.
Główne zagrożenie dla środowiska - migracja
polifosforanów, np. ortotrifosforanu sodu
dodawanego do proszków do prania w celu
zmiękczania wody –
następuje wzrost biomasy glonów, które zużywają tlen
powodując zanik życia w jeziorach i zatokach.
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
77
Alotropia azotowców
Odmiany alotropowe P, As, Sb
Pierw.
Odmiany niemetaliczne
metaliczne
P
biały czerwony fioletowy
P
4
polim. P
4
polim. P
4
d= 1,8 bezpostaciowy d=2,3
czarny
d=2,7
[g/cm
3
]
połysk metaliczny
przewodzi prąd
As
żółty czarny
As
4
szary
Sb
żółty czarny
Sb
4
srebrzystobiały
Bi
różowo-biały
najtrwalsze odmiany
struktury warstwowe
Alotropia fosforu:
Fosfor biały - biała masa miękka jak wosk
(w postaci cząsteczek P
4
)
zbudowany z tetraedrów
pary fosforu też
złożone z cząsteczek P
4
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
78
450 K lub prom. UV
biały czerwony (bezpostaciowy)
(polimeryzacja P
4
)
800 K
biały fioletowy (odmiana krystaliczna)
490K
biały czarny (najtrwalszy)
12000 atm ma budowę warstwową
Fosfor biały rozdrobniony
zapala się samorzutnie w temp. pokojowej
P
4
+ 5O
2
= P
4
O
10
ΔΗ = - 3096 kJ/mol
Fosfor biały „świeci” w ciemności –
chemiluminescencja
(skutek powierzchniowego utleniania fosforu)
fosfor biały jest bardzo toksyczny !
Fosfor czerwony - nietrujący
(do wyrobu masy do pocierania zapałek)
masa na pudełku: P
czerw.
, MnO
2
, SiO
2
„główka” zapałki: Sb
2
S
3
, KClO
3
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
79
Związki azotowców z wodorem i ich pochodne
Związki typu XH
3
- triwodorki (gazy)
NH
3
– amoniak (azan)
PH
3
- fosforowodór (fosfan)
AsH
3
- arsenowodór
SbH
3
- antymonowodór
BiH
3
- bizmutowodór
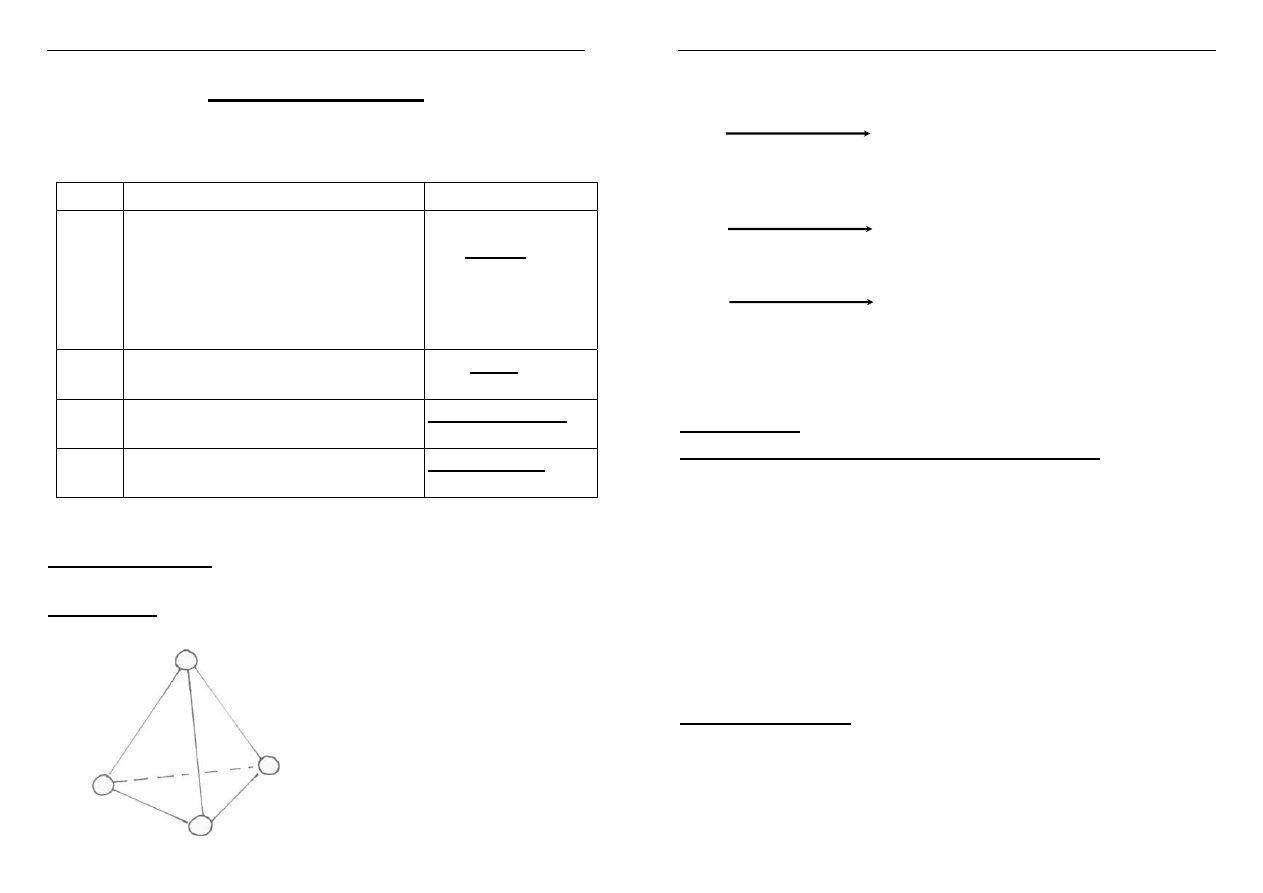
Kształt piramidy
trygonalnej
Atom azotowca
ma hybrydyzację
sp
3
Struktura przestrzenna NH
3
wolna para elektronowa
może przyłączyć proton
→ NH
4
+
jon amonowy
(własności zasadowe NH
3
)
Cząsteczka polarna (moment dipolowy NH
3
4,9 · 10
-30
C · m)
Tworzy kierunkowe wiązania wodorowe
asocjacja cząsteczek
N― H · · · N NH
3
w stanie ciekłym
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
80
Synteza amoniaku - metoda Habera i Boscha
N
2
+ 3H
2
2NH
3
ΔH = -92 kJ/mol
w przemyśle: p = 30-35 MPa
T = 770-820 K
katalizator Fe (Fe
3
O
4
→Fe)
Amoniak w normalnych warunkach jest gazem.
Rozpuszcza się bardzo dobrze w wodzie.
(handlowy stężony roztwór amoniaku = 25 % NH
3
,
d = 0.91 g/cm
3
)
Amoniak jest słabą zasadą:
NH
3
· H
2
O NH
4
+
+ OH
-
K
b
= 1.8 · 10
-5
w roztworze 0,1 M
α = 1 %
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
81
spalanie w tlenie NH
3
→ azot
4 NH
3
+ 3 O
2
= 2 N
2
+ 6 H
2
O
Metoda Ostwalda syntezy NO
W obecności katalizatora Pt → tlenek azotu
4 NH
3
+ 5 O
2
= 4 NO + 6 H
2
O temp. 1100 K
katal. Pt
Pochodne amoniaku: N (st. utl. –3)
1) amidek (NaNH
2
amidek sodu)
2) imidek (Li
2
NH, CaNH)
3) azotek Mg
3
N
2
azotek magnezu
4) aminy RNH
2
, R
2
NH, R
3
N
(R= podstawnik organiczny)
Kwas azotowodorowy (azydek wodoru) HN
3
(ciecz trująca) umiarkowanie mocny kwas
sole: azydki litowców i berylowców mają budowę jonową
jon N
3
-
: NaN
3
Ba(N
3
)
2
Azydek sodu - w poduszkach powietrznych w samochodach
Azydki srebra, ołowiu i rtęci wybuchają wskutek uderzenia –
w technice materiałów wybuchowych
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
82
Tlenki i tlenowe kwasy azotu
Wzór
Stopień
utlenienia
azotu
Nazwa
Kwas
odpowiadający
tlenkowi
N
2
O
+1
Tlenek diazotu
H
2
N
2
O
2
Kwas azotowy(I)
NO
+2
Tlenek azotu
N
2
O
3
+3
Tritlenek diazotu
HNO
2
Kwas azotowy(III)
NO
2
N
2
O
4
+4
Ditlenek azotu
Tetratlenek diazotu
+3 +5
HNO
2
+ HNO
3
N
2
O
5
+5
Pentatlenek diazotu
HNO
3
Kwas azotowy(V)
Tlenek diazotu N
2
O (bezbarwny gaz)
Budowa liniowa N
113 pm
N
119 pm
O
centralny atom N – hybrydyzacja typu sp
„gaz rozweselający” –
środek znieczulający w zabiegach
dentystycznych i chirurgicznych
(nie reaguje z wodą)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
83
Tlenek azotu NO (bezbarwny gaz)
1)
N
2
+ O
2
2 NO
ΔΗ > 0 (endo)
synteza w łuku elektr.
2) Obecnie:
metoda Ostwalda – spalanie amoniaku
(kataliz. Pt)
3) laborat.
3 Cu + 8 HNO
3
= 3 Cu(NO
3
)
2
+ 2 NO + 4 H
2
O
-------------------------------------------------------------------
NO: 5 + 6 = 11 elektronów walencyjnych
(O
2
= 12 elektronów walencyjnych)
NO:
KK(
σ2s)
2
(
σ*2s)
2
(
σ2p
x
)
2
(
π2p
y
)
2
(
π2p
z
)
2
(
π*2p
y
)
1
trwały moment magnetyczny
rząd wiązania: (8-3)/2 = 2,5
Tritlenek diazotu N
2
O
3
niebieska ciecz
poniżej 260 K
O O
N
186 pm
N
114 pm
O
120 pm
płaska struktura
wiązanie N-N tyko
σ
NO + NO
2
= N
2
O
3
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
84
kwas azotowy(III) HNO
2
N
2
O
3
+ H
2
O = 2 HNO
2
słaby kwas
(nietrwały)
Trwałe sole :
azotany(III)
--------------------------------------------------------------
Ditlenek azotu (NO
2
) - brunatny
Tetratlenek diazotu (N
2
O
4
) - bezbarwny
synteza NO
2
NO + ½ O
2
= NO
2
NO
2
: 5 + 2 · 6 = 17 elektronów walencyjnych
(o 1 mniej niż O
3
)
Jeden niesparowany elektron na orbitalu niewiążąym
(
π
0
del
)
1
→
NO
2
jest paramagnetyczny
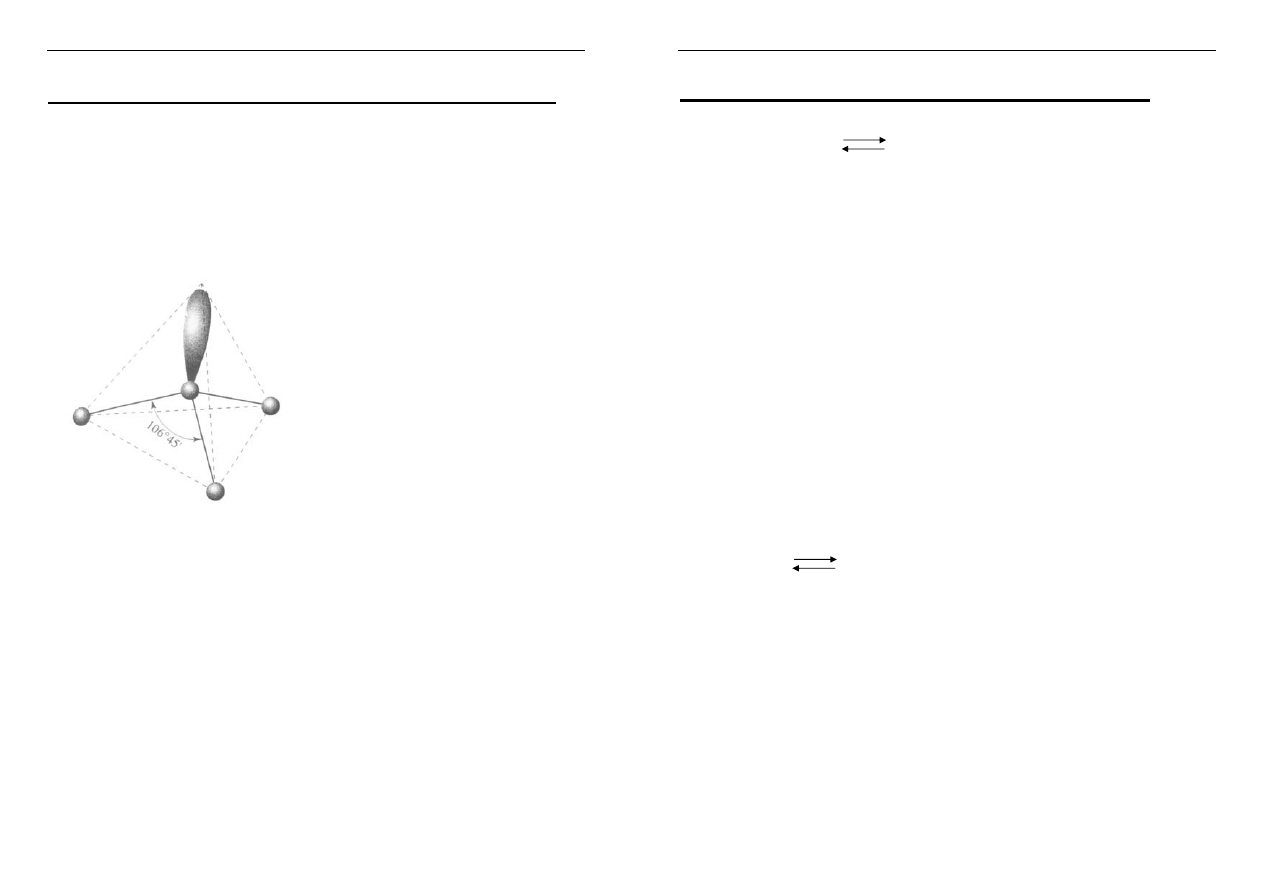
Reakcja równowagowa dimeryzacji NO
2
:
2 NO
2
N
2
O
4
ΔH = - 62 kJ/mol
brunatny bezbarwny
(90 % w 90 % w
temp. 100
0
C) temp. 0
0
C (w lodzie)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
85
NO
2
budowa trójkątna N
O O
N
2
O
4
płaska struktura
O O
N
175 pm
N
118 pm
O O
Cząsteczka diamagnetyczna (34 elektrony walencyjne)
Reakcja dysproporcjonowania :
+4 +3 +5
N
2
O
4
+ H
2
O = HNO
2
+ HNO
3
jonowo:
N
2
O
4
+ H
2
O = HNO
2
+ H
+
+ NO
3
-
Pentatlenek diazotu N
2
O
5
ciało stałe
bezbarwne
gwałtownie reaguje z wodą
N
2
O
5
+ H
2
O = 2HNO
3
120 pm
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
86
Kwas azotowy(V) HNO
3
mocny kwas
Otrzymywanie:
1) synteza amoniaku metodą Habera i Boscha
2) spalanie amoniaku do NO metodą Ostwalda
3) utlenianie NO do NO
2
4) pochłanianie mieszaniny NO
2
i N
2
O
4
w H
2
O
N
2
O
4
+ H
2
O = HNO
2
+ HNO
3
nietrwały
3 HNO
2
= HNO
3
+ 2 NO + H
2
O
NO ponownie utleniany do NO
2
W trakcie destylacji HNO
3
uzyskuje się azeotrop:
68% HNO
3
, d = 1,41 g/cm
3
(handl. „stężony HNO
3
”)
HNO
3
jest mocnym kwasem
i bardzo silnym utleniaczem
(roztwarza metale szlachetne: Cu, Hg, Ag)
„woda królewska” HNO
3
: HCl = 1 : 3
(do roztwarzania Au i Pt )
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
87
sole: azotany(V)
Jon NO
3
-
jest izoelektronowy z cząsteczką SO
3
(24 elektrony walencyjne)
Taki sam zestaw orbitali cząsteczkowych
NO
3
-
ma strukturę płaską
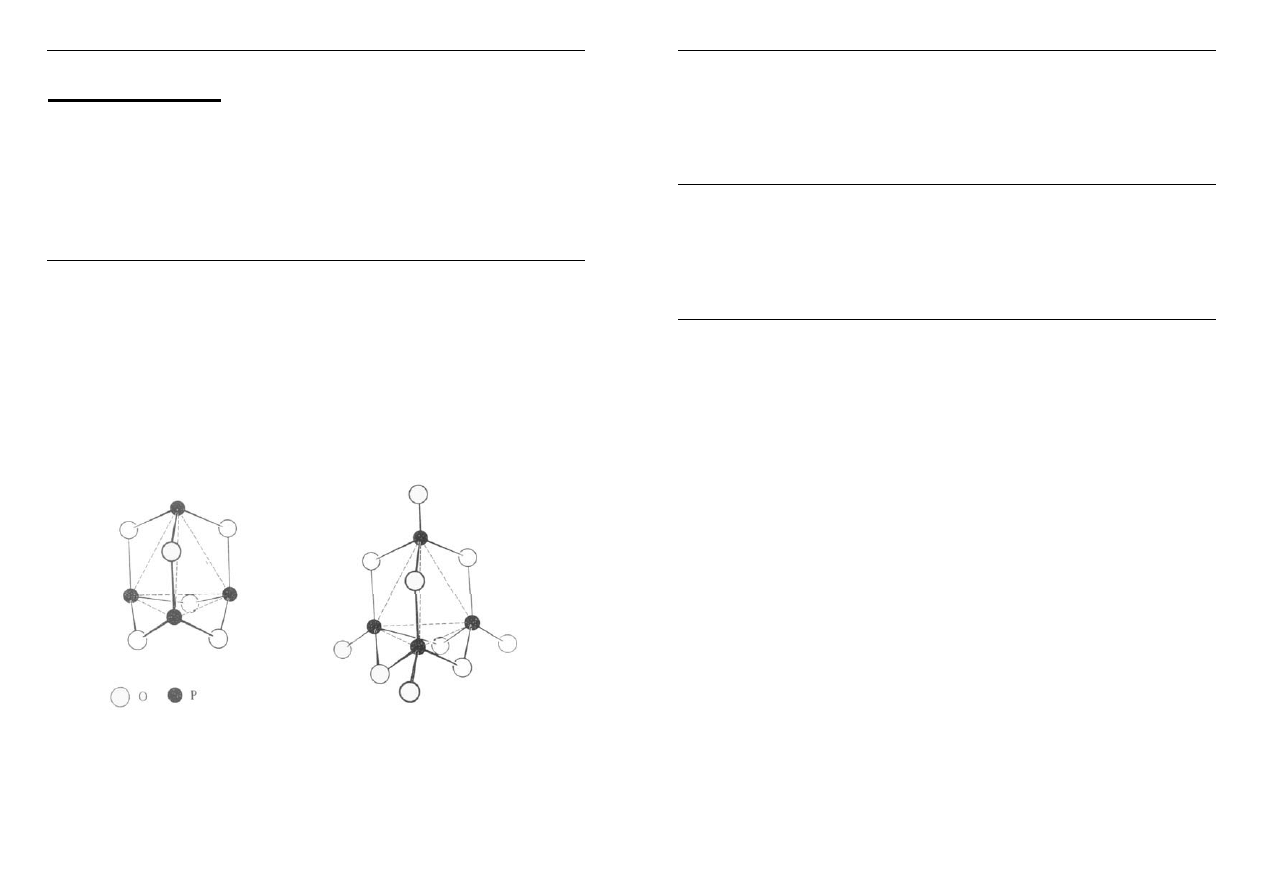
Tlenki i kwasy tlenowe fosforu
+3 +5
P
4
O
6
P
4
O
10
heksatlenek tetrafosforu dekatlenek tetrafosforu
(pentatlenek difosforu, P
2
O
5
)
wolna para elektronowa
na atomie P i 3 wiązania 4 wiązania
kowalencyjne z atomami O kowalencyjne z atomami O
jednostka PO
3
jednostka PO
4
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
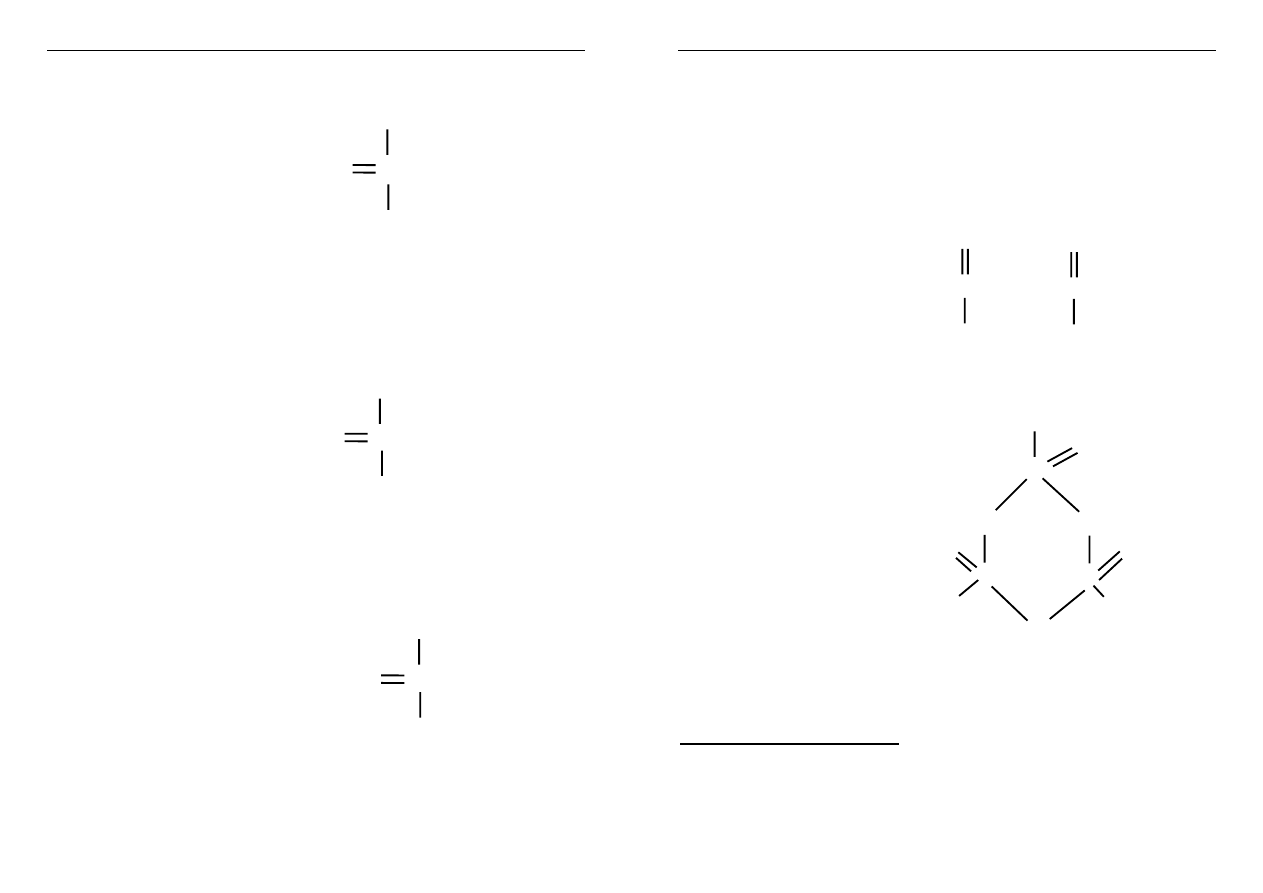
88
P
4
O
6
silnie trujący
P
4
O
6
+ 6 H
2
O = 4 H
3
PO
3
kwas fosforowy(III)
P
4
O
10
bardzo higroskopijny
P
4
O
10
+ 6 H
2
O = 4 H
3
PO
4
kwas fosforowy(V)
Tlenowe kwasy fosforu
P w kwasach wykazuje zawsze liczbę koordynacji 4
P tworzy dwie serie oksokwasów:
a) stopień utlenienia +5 (P otoczony przez 4 atomy
tlenu) – słabe właściwości utleniające
b) +3 lub +1 – właściwości redukujące
(
U
U
w
w
a
a
g
g
a
a
!
! Błędne stopnie utlenienia P w kwasach
fosforowych – podręcznik Bielańskiego „Podstawy Chemii
Nieorganicznej” wyd.5 2002 str. 675)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
89
H
3
PO
2
(+1) H
Kwas fosforowy(I)
Kwas fosfinowy O P ― OH
dihydrydodioksofosforowy
H
(jednoprotonowy)
H
3
PO
3
(+3) OH
Kwas fosforowy(III)
Kwas fosfonowy O P ― OH
H
(dwuprotonowy)
H
3
PO
4
(+5) OH
Kwas ortofosforowy O P ― OH
tetraoksofosforowy
OH
(trójprotonowy)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
90
H
4
P
2
O
7
(+5)
Kwas ortodifosforowy
(czteroprotonowy)
otrzymuje się przez odwadnianie H
3
PO
4
(470-570 K)
O O
HO ― P ― O ― P ― OH
OH OH
(HPO
3
)
n
OH
kwas metapolifosforowy O
P
O O
n = 3 O O
metatrifosforowy
P P
HO OH
O
Otrzymuje się przez odwadnianie H
3
PO
4
w temp. 590 K
Kwasy metafosforowe mają pierścieniową budowę
cząsteczki
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
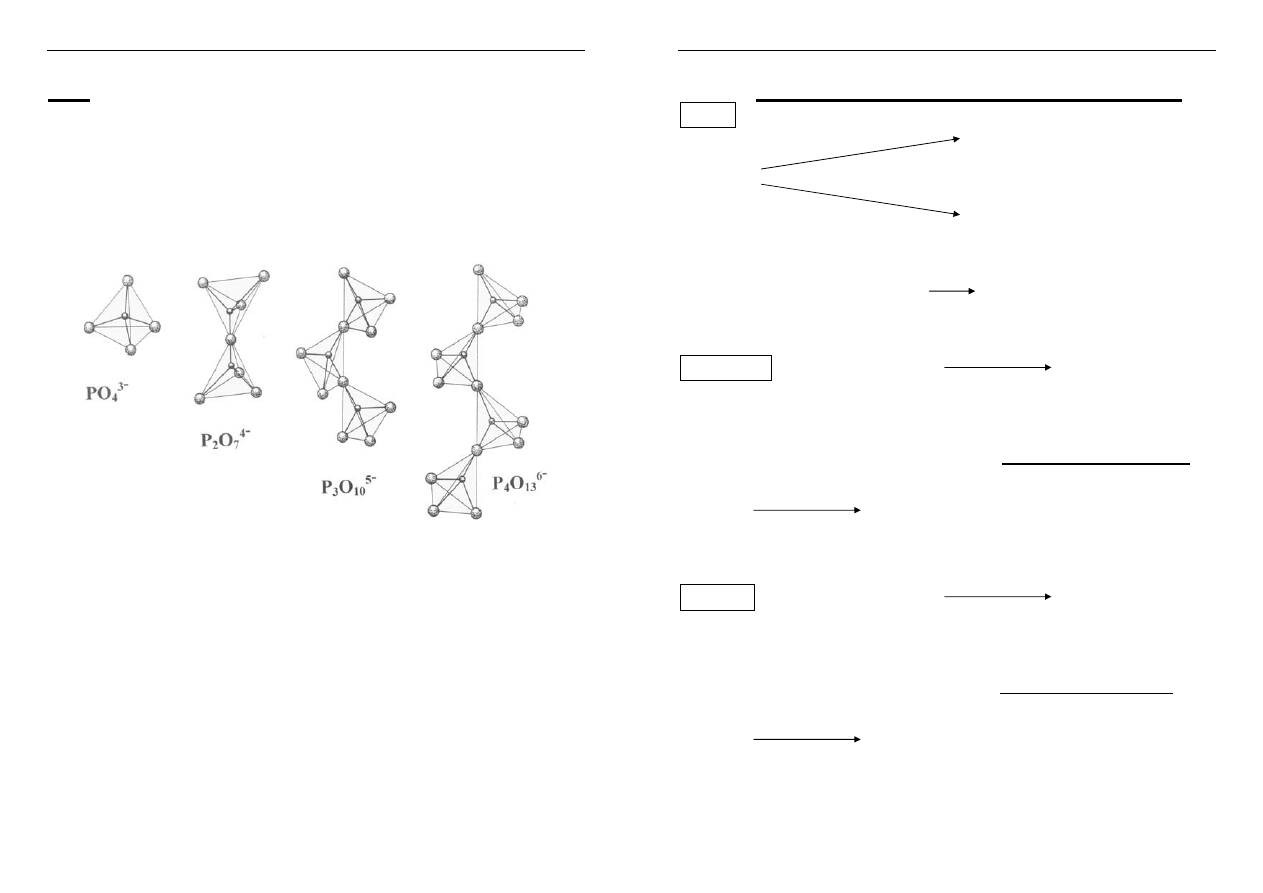
91
orto- skondensowane kwasy fosforowe o budowie
łańcuchowej
czworościany (PO
4
3-
)
n
połączone w łańcuchy
(jeden wierzchołek O jest wspólny)
Aniony polifosforanowe
(Bielański, str. 679)
Kwas ortofosforowy tworzy sole - ortofosforany
pierwszorzędowe NaH
2
PO
4
diwodorofosforan sodu
drugorzędowe Na
2
HPO
4
trzeciorzędowe Na
3
PO
4
ortofosforan sodu
Kwas metafosforowy – metafosforany
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
92
Związki pozostałych azotowców z tlenem:
arsen
+3
As
3+
As
4
O
6
arszenik
(silna trucizna)
[AsO
3
]
3-
arsenian(III)
charakter amfoteryczny (H
3
AsO
3
)
+5
As
4
O
10
charakter kwasowy
[AsO
4
]
3-
arsenian(V)
(H
3
AsO
4
)
-------------------------------------------------------------------------------------------------------------------------------------------
+3
antymon
Sb
4
O
6
Sb
3+
charakter zasadowy
Hydroliza Sb
3+
Sb
3+
+ H
2
O = 2H
+
+ SbO
+
(
kation antymonylowy)
+5
Sb
2
O
5
HSb(OH)
6
charakter kwasowy kwas heksahydroksoantymonowy(V)
-----------------------------------------------------------------------------------------------------------------------------------------------------
+3
bizmut
Bi
2
O
3
Bi
3+
charakter zasadowy
Hydroliza Bi
3+
Bi
3+
+ H
2
O = 2H
+
+ BiO
+
(
kation bizmutylowy)
+5
Bi
2
O
5
[BiO
3
]
-
bizmutynian(V)
charakter kwasowy kwas nieznany
Wyszukiwarka
Podobne podstrony:
azotowe id 74708 Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
więcej podobnych podstron