CHEMIA- ALKOHOLE, FENOLE
Alkohole
- pochodne węglowodorów
R- OH
R- grupa węglowa, OH- grupa funkcyjna-> hydroksylowa
Alkohole
Ze względu na ilość OH
o
Mono hydroksylowe > metanol CH
3
OH , etanol C
2
H
5
OH, propanol C
3
H
7
OH
o
Poli hydroksylowe > C
2
H
4
(OH)
2
– glikol etylenowy/ etano-1,2-diol | C
3
H
5
(OH)
3
propano-
1,2,3-triol
Ze względu na budowę
o
Alifatyczne- łańcuchowe > nasycone CH
3
-CH
2
OH etanol , nienasycone CH
2
=CH-CH etenol
o
Aromatyczne > C
6
H
6
-CH
2
OH – alkohol benzylowy/ fenylometanol
o
Cykliczne cykloheksanol
Ze względu na rzędowość ( z iloma C łączy się C powiązane z OH )
o
I rzędowe
o
II rzędowe
o
III rzędowe
Nazewnictwo: 1. Szukamy najdłuższego łańcucha węglowego, tak aby OH miało najmniejszy lokant.
2. Nazwę układamy zaczynając od pozostałych podstawników > węglowodór > lokant OH, ilość – ol
Właściwości fizyczne
Alkoholu etylowego C
2
H
5
OH
Alkoholu metylowego CH
3
OH
o
Lotny
o
Bezbarwna ciecz
o
Specyficzny zapach
o
Odczyn obojętny
o
Piekący w smaku
o
Rozpuszcza się w H
2
O ze zmniejszeniem objętości (
kontrakcja- mieszanie się z wodą ze zmniejszeniem
objętości, wywołanym skracaniem się łączeń)
o
Wrze w 75C/80C
o
Lotny
o
Bezbarwna ciesz
o
Specyficzny zapach
o
Odczyn obojętny
o
Silnie toksyczny
o
Mała dawka wywołuje ślepotę
o
Duża dawka (100 ml) > zgon
o
Wrze w 63C
Właściwości chemiczne:
o
Ulegają spalaniu całkowitemu
o
Tworzą alkoholany z metalami aktywnymi(1,2gr)
o
Z kwasami tworzą estry
CH
3
COOH +C
2
H
5
OH --- (H
2
SO
4
) ---> CH
3
COOC
2
H
5
+ H
2
0
o
Ulegają dehydratacji = eliminacji > ze związku nasyconego powstaje nienasycony
CH
3
-CH
2
-OH --- Al
2
O
3
i 80C ---> H
2
O +CH
2
=CH
2
o
Reaguje z HBr i HCl > substytucja
CH
2
-OH +HCl - CH
3
Cl + H
2
O
Zastosowanie alkoholu etylowego:
o
Medycyna- dokarzanie, leki
o
Przemysł spożywczy
o
Kosmetyka
OTRZYMYWANIE ALKHOLI :
Metody specyficzne
>>
Fermentacja alkoholowa > etanol
C
6
H
12
O
6
–enzymy -----> 2 C
2
H
5
OH+ 2CO
2
>>
metanol z gazu syntezowego
CO + 2H
2
–kat ---> CH
3
OH
>>
utlenianie alkanów
2 CH
4
+ O
2
–kat----> 2 CH
3
OH
Metody ogólne
>>
addycja H
2
O do alken - jest to substytucja monochlorowco pochodnych alkanów
CH
3
=CH-CH
3
+HOH ----> CH
3
-CHOH-CH
3
propan-2-ol

POLIHYDROKSYLOWE
C
2
H
4
(OH)
2
etan-1,2-diol / glikol etylenowy
C
3
H
5
(OH)
3
propan-1,2,3-triol/ glicerol/gliceryna
Właściwości glikolu etylowego:
o
Oleista ciesz
o
Przeźroczysty
o
Dobrze miesza się z wodą
o
Duża lepkość
o
Silnie toksyczny
o
Ma niską temp. topnienia (-16C)
Stosuje się go w płynach do chłodnic samochodowych
Właściwości glicerolu :
o
Nie toksyczny
o
Bezbarnwa ciecz
o
Słodki
o
Miesza się z wodą
o
Bezwonny
o
Lepka ciesz
Otrzymywanie glikolu etylowego:
o
Stopniowo
CH
2
= CH
2
+Cl
2
---> CH
2
Cl – CH
2
Cl 1,2 dichloroetan
CH
2
Cl – CH
2
Cl + 2NaOH ---H
2
O----> 2NaCl + C
2
H
4
(OH)
2
o
Utlenianie etylenu
CH
2
=CH
2
+ ½ O
2
---kat---> C
2
H
4
O tlenek etylenu
C
2
H
4
O + H
2
O ---kat----> C
2
H
4
(OH)
2
Właściwości chemiczne polihydroksylowców:
o
Ulegają spalaniu całkowitemu
o
Łączą się z metalami aktywnymi
C
3
H
5
(OH)
3
+3K ------> C
3
H
5
(OK)
3
+3H
2
glicerolan potasu
Badanie obecności kilku grup hydroksylowych przy sąsiednich atomach węgla/ identyfikacja
alkoholu mono i poli hydroksylowego.
1. W dwóch próbówkach znajdują się nie zidentyfikowane substancje.
2. Do obydwó dodajemy wcześniej sporządzony wodorotlenek miedzi (niebieski osad) [ CuSO
4
+NaOH ->
Cu(OH)
2
+ Na
2
SO
4
]
3. W próbówce z alkoholem polihydroksylowym -> glicerolem niebieski osad znika i powstaje szafirowy
roztwór
W próbówce z etanolem nie zauważamy zmian.
FENOLE
Ar-OH
C
6
H
5
OH Benzenol/fenol/ hydroksylobenzen
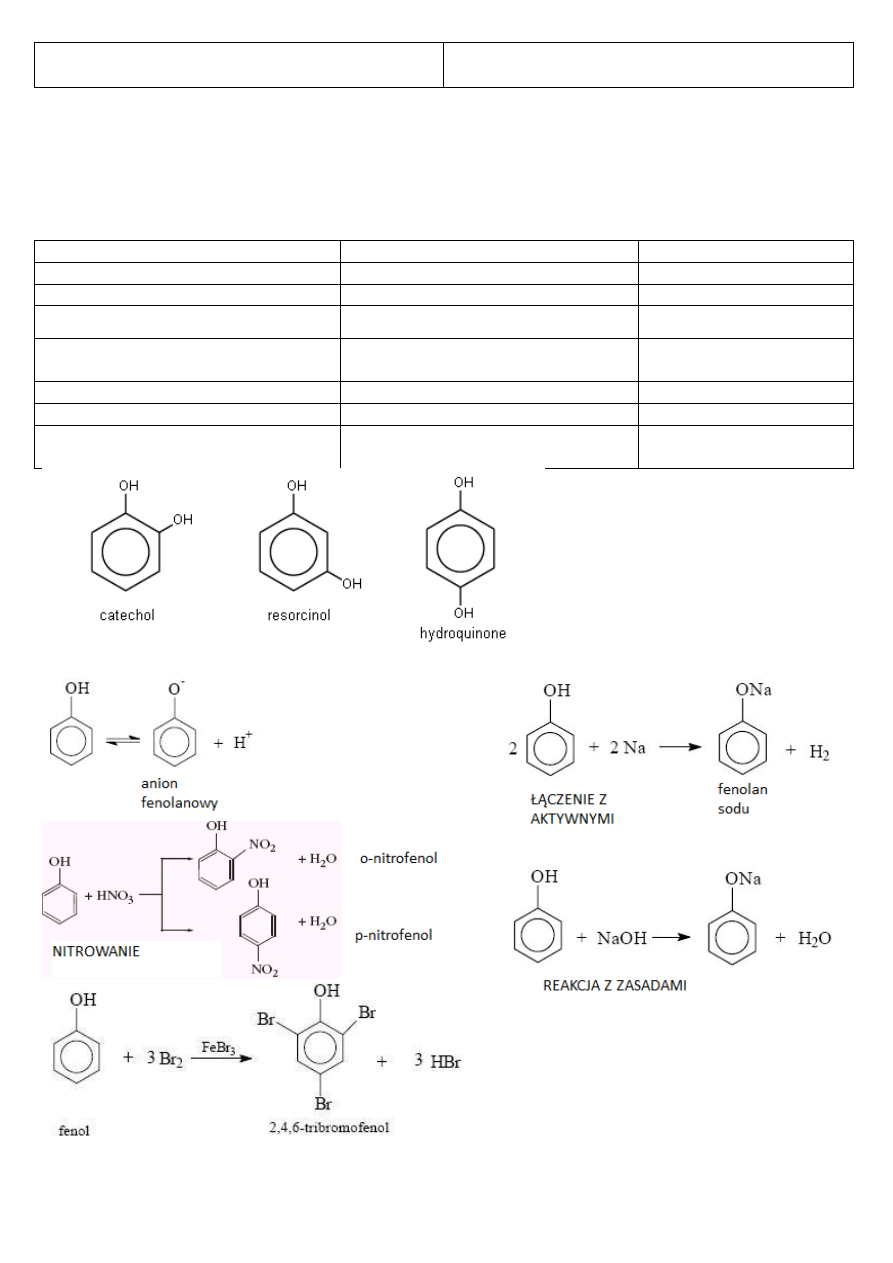
Pirokatechina= 1,2 dnihydrobenzen/ benzeno-1,2-diol
hydrichinom = 1,4 dihydroksybenzen/ benzeno-1,4-diol
rezorcyna= benzeno-1,3- diol/ 1,3hydroksybenzen
Wł. Fizyczne
Wł. Chemiczne
Ciało stałe
Łatwo się utlenia ciemnieje
Ma intensywny specyficzny zapach
Słabo rozpuszcza się w zimnej wodzie
W H
2
O ok 70C dobrze się rozpuszcza
Odczyn lekko kwasowy
Pod wpływem wody ulega dysocjacji
C
6
H
5
OH H
2
O C
6
H
5
O
-
+ H
+
Reaguje z zasadami
Łączy się z metalami aktywnymi
Działa parząco, powoduje silne oparzenia
Ulega nitrowaniu
Odbarwia wodę bromową
Zastosowanie:
Do dezyfekcji pomieszczeń
Metylofenole stosuje się w medycynie
do otrzymywania środków wybuchowych
do otrzymywania tworzyw sztucznych
Fenole w zanieszczyszczonej wodzie identyfikuje się za pomocą FeCl
3
, powstaje związek kompleksowy w
niebiesko-fioletowym kolorze
Alkohol
Fenol
cecha
R-(OH)
n
Ar-OH
Wz ogólny
Hydroksylowa
Hydroksylowa
Gr. Funckyjna
-
C
6
H
5
Ona +H
2
O
Reakcja z zasadami
CH
3
OH +Na CH
3
Ona +H
2
C
6
H
5
OH +K C
6
H
5
OK + H
2
Reakcja z metalami
aktywnymi
Obojętny
Sł. Kwasowy
Odczyn
C
2
H
5
OH + HBr C
2
H
5
Br +H
2
O
-
Reakcja z HBr
C
2
H
5
OH + HNO
3
C
2
H
5
ONO
2
+H
2
0
azotan V etylu
C
6
H
5
OH+HNO
3
C
6
H
5
OHNO
2
+H
2
0
Nitrowanie
Wyszukiwarka
Podobne podstrony:
Chemia - alkohole i fenole, Liceum Matura, Chemia, Chemia(1)
Chemia alkohole, fenole, aldehydy, ketony
test alkohole i fenole chem, chemia gimnazjum
alkohole i fenole, Chemia- liceum
Alkohole i fenole, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
alkohole fenole cwiczenia, Nauka, CHEMIA, Szkoła, Chemia Organiczna
Alkohole i fenole 3 id 58102 Nieznany
instrukcja węglowodory, alkohole i fenole
alkohole i fenole 2 id 58101 Nieznany (2)
Chemia Alkohole wielowodorotlenowe
Alkohole i fenole - test, Napisz brakujące nazwy następujących związków:
Alkohole i fenole - test, Napisz brakujące nazwy następujących związków:
Chemia organiczna Fenole
Alkohole i Fenole
Alkohole i fenole
Chemia alkoholu, Chemia Fizyka Matma
więcej podobnych podstron