1
CHEMIA FIZYCZNA
Wydział Farmaceutyczny
II rok
WYKŁAD:
5
ZAKRES STOSOWALNO
ZAKRES STOSOWALNO
Ś
Ś
CI
CI
prawa
prawa
Raoulta
Raoulta
i prawa
i prawa
Henry
Henry
’
’
ego
ego
30,0
60,0
90,0
p
[kPa]
0
E
p
0
A
p
Etanol
Aceton
x
E
= 1
x
A
= 0
x
E
= 0
x
A
= 1
T = 50°C
Linie przerywane – prawo Raoulta
Linie kropkowane – prawo Henry’ego
ROZPUSZCZALNOŚĆ WZAJEMNA DWÓCH CIECZY
W danych warunkach temperatury i ciśnienia, dwa
składniki ciekłe mogą:
••••
rozpuszczać się bez ograniczeń
(np.
C
2
H
5
OH-H
2
O
)
••••
wykazywać ograniczoną rozpuszczalność
(
H
2
O-fenol
)
••••
być zupełnie wzajemnie nierozpuszczalne
(
H
2
O-Hg
)
Przyczyną
ograniczonej
mieszalności
cieczy
jest
dodatnia wartość entalpii swobodnej mieszania
∆∆∆∆
G
M
.
Entalpia swobodna mieszania związana jest z entalpią i
entropią mieszania wzorem:
∆∆∆∆
G
M
=
∆∆∆∆
H
M
-T
∆∆∆∆
S
M
Ponieważ zwykle
∆∆∆∆
S
M
>0
o znaku
∆∆∆∆
G
M
decyduje entalpia
mieszania
∆∆∆∆
H
M
. Ciecze, których mieszanie związane jest
z pobieraniem ciepła z otoczenia
∆∆∆∆
H
M
>0
mogą zatem
wykazywać ograniczoną mieszalność.
0 20 40 60 80 100
% fenolu w wodzie
T
[K]
388,9
JEDNA FAZA CIEKŁA
DWIE FAZY CIEKŁE
GKTR
Górna
krytyczna
temperatura
rozpuszczalności
a b c d e
f
Krzywa
równowagi
binoida
PUNKT HOMOGENIZACJI
0 20 40 60 80 100
% fenolu w wodzie
T
[K]
388,9
JEDNA FAZA CIEKŁA
DWIE FAZY
CIEKŁE
GKTR
Górna
krytyczna
temperatura
rozpuszczalności
a b
c d
C
α
αα
α
C
ββββ
skład
fazy
α
αα
α
skład
fazy
ββββ
T
1
SKŁAD FAZ:
wodnej
α
αα
α
i
fenolowej
ββββ
w punktach:
a
,
b
,
c
i
d
na izotermie
T
1
wynosi zawsze,
odpowiednio:
C
α
αα
α
i
C
ββββ
PUNKT HOMOGENIZACJI
0 20 40 60 80 100
% fenolu w wodzie
T
[K]
JEDNA FAZA CIEKŁA
DWIE FAZY
CIEKŁE
GKTR
x
C
α
αα
α
C
ββββ
skład
fazy
α
αα
α
skład
fazy
ββββ
T
1
C
x
PUNKT HOMOGENIZACJI
2
Określenie
proporcji
masowych
faz
najprościej
otrzymamy dokonując bilansu masy jednego ze
składników roztworu.
Jeżeli przez
m
α
αα
α
i
m
ββββ
oznaczymy masy faz, w których
stężenie fenolu wynosi odpowiednio
C
α
αα
α
i
C
ββββ
, to w
temperaturze
T
1
i dla całkowitego stężenia fenolu
C
x
otrzymamy:
stąd
Po uporządkowaniu wyrazów
i przekształceniu otrzymamy wzór tzw.
reguły dźwigni
:
((((
))))
β
α
β
β
α
α
m
m
C
C
m
C
m
x
++++
====
++++
x
x
C
m
C
m
C
m
C
m
β
α
β
β
α
α
++++
====
++++
((((
))))
((((
))))
x
x
C
C
m
C
C
m
−−−−
====
−−−−
β
β
α
α
α
β
β
α
C
C
C
C
m
m
x
x
−−−−
−−−−
====
T
[K]
JEDNA FAZA CIEKŁA
DWIE FAZY
CIEKŁE
GKTR
x
α
αα
α
x
ββββ
skład
fazy
α
αα
α
skład
fazy
ββββ
T
1
x
r
PUNKT HOMOGENIZACJI
0 x
B
→
→
→
→
1
A
B
Dolna
krytyczna
temperatura
rozpuszczalności
DKTR
0 x
B
→
→
→
→
1
A
B
T
[K]
JEDNA FAZA CIEKŁA
DWIE FAZY CIEKŁE
x
α
αα
α
x
ββββ
skład
fazy
α
αα
α
skład
fazy
ββββ
T
1
x
r
PUNKT
HOMOGENIZACJI
T
[K]
JEDNA FAZA CIEKŁA
GKTR
x
α
αα
α
x
ββββ
T
1
x
r
0 x
B
→
→
→
→
1
A
B
skład
fazy
α
αα
α
skład
fazy
ββββ
DWIE FAZY
CIEKŁE
DKTR
Prawo podziału Nernsta
Jeżeli do dwóch nie mieszających się cieczy dodamy
substancję, która rozpuszcza się w każdej z nich, to
wówczas nastąpi podział tej substancji między obie
ciecze.
W stanie równowagi potencjał chemiczny substancji w
fazach (1) i (2) będzie równy
Po przekształceniu otrzymamy
oraz
Prawa strona równania zależy tylko od temperatury
2
2
1
1
x
RT
x
RT
ln
ln
++++
====
++++
⊕
⊕
⊕
⊕
⊕
⊕
⊕
⊕
µ
µ
RT
x
x
⊕
⊕
⊕
⊕
⊕
⊕
⊕
⊕
−−−−
====
1
2
2
1
µ
µ
ln
−−−−
====
⊕
⊕
⊕
⊕
⊕
⊕
⊕
⊕
RT
x
x
1
2
2
1
µ
µ
exp
(((( ))))
T
k
x
x
====
2
1
Jeżeli założymy, że stężenie substancji rozpuszczonej
jest w obydwu fazach niewielkie, tj.
x
1
<<1
i
x
2
<<1
to
wówczas ułamki molowe można zastąpić stężeniami
molowymi
c
1
i
c
2
substancji w fazie (
1
) i (
2
) otrzymując
wzór opisujący
prawo podziału Nernsta
:
Stężenie we wzorze odnoszą się do tej samej postaci
cząsteczkowej substancji.
Jeżeli w fazie (
1
) substancja rozpuszczona ulega
dysocjacji (gdzie:
α
αα
α
– stopień dysocjacji), a w fazie (
2
)
asocjuje
n
cząsteczek substancji, to wówczas należy
przekształcić wzór do postaci:
(((( ))))
T
k
c
c
N
====
2
1
((((
))))
K
c
c
n
====
−−−−
2
1
1
α
3
Prawo podziału znajduje praktyczne zastosowanie w
zagadnieniach
ekstrakcji
.
Załóżmy, że fazą
α
αα
α
jest ciecz o objętości
V
α
αα
α
, w której
znajduje się masa
m
0
substancji. Jeżeli zawartą w fazie
a substancję poddamy ekstrakcji działając objętością
V
ββββ
cieczy
ββββ
, nie mieszającej się z cieczą
α
αα
α
, i jeśli po
ustaleniu się stanu równowagi w fazie
α
αα
α
pozostanie
masa
m
1
substancji ekstrahowanej, to z prawa podziału
wynika, że
a stąd
Jeżeli proces ten powtórzymy
n-krotnie
to masa
substancji
m
n
jaka pozostanie w cieczy a wyniesie:
((((
))))
K
V
m
m
V
m
====
−−−−
β
α
/
/
1
0
1
β
α
α
V
KV
KV
m
m
++++
====
0
1
n
n
V
KV
KV
m
m
++++
====
β
α
α
0
DESTYLACJA Z PARĄ WODNĄ
CIECZE NIE MIESZAJĄCE SIĘ WZAJEMNIE
Wzajemnie nierozpuszczalne ciecze stanowią graniczny
przypadek ograniczonej rozpuszczalności. Całkowite
ciśnienie nad układem dwóch nie mieszających się
cieczy
A
i
B
jest równe sumie prężności par czystych
składników:
0
0
B
A
p
p
p
+
=
Oznacza to, że ciśnienie nad układem cieczy nie
mieszających się wzajemnie jest większe od prężności
pary nasyconej każdego ze składników.
W konsekwencji temperatura wrzenia takiego układu
jest niższa od temperatury wrzenia każdego ze
składników.
Rozpatrzmy destylację dwóch nie mieszających się cieczy
(
p=1 bar
):
wody
(
T
w
=100°C
) i
benzenu
(
T
w
=80,3°C
)
A x
→
→
→
→
B
(benzen) (woda)
H
2
O
p
A x
→
→
→
→
B
(benzen) (woda)
H
2
O
T
w
0
B
p
0
0
B
A
p
p
+
0
A
p
T=300 K
p=1 bar (10
5
Pa)
T
w,wody
T
w,benzenu
T
w,mieszaniny
RÓWNOWAGA CIECZ-PARA
W UKŁADZIE DWUSKŁADNIKOWYM
Prężność pary nad roztworem doskonałym opisuje
prawo Raoulta
Prężność pary (ciśnienie) nad roztworem zależą od
ciśnień parcjalnych składników, a zatem od składu
roztworu.
W przypadku roztworu doskonałego para zawiera
więcej składnika, którego prężność pary nasyconej
czystego składnika jest wyższa (temperatura wrzenia
niższa).
Taki składnik nazywany jest
bardziej lotnym
.
0
i
i
i
p
x
p
=
5,0
10,0
15,0
p
[kPa]
0
E
p
0
M
p
Etanol
Metanol
x
E
= 1
x
M
= 0
x
E
= 0
x
M
= 1
0
E
E
E
p
x
p
====
0
M
M
M
p
x
p
====
p =
p
E
+ p
M
T = const
Pr
Pr
ęż
ęż
no
no
ść
ść
pary nad roztworem metanolu i etanolu
pary nad roztworem metanolu i etanolu
(roztw
(roztw
ó
ó
r doskona
r doskona
ł
ł
y) w sta
y) w sta
ł
ł
ej temperaturze
ej temperaturze
A
p
[kPa]
0
A
p
0
B
p
T = const
B
Zeotrop dodatni
4
A
p
[kPa]
0
A
p
0
B
p
T = const
B
Zeotrop ujemny
A
p
[kPa]
0
A
p
0
B
p
T = const
B
Azeotrop dodatni
A
p
[kPa]
0
A
p
0
B
p
T = const
B
Azeotrop ujemny
A
p
0
A
p
0
B
p
T = const
B
p
x
skład
cieczy
skład
pary
x
c
x
p
Sk
Sk
ł
ł
ad pary i cieczy roztworu dwusk
ad pary i cieczy roztworu dwusk
ł
ł
adnikowego
adnikowego
w sta
w sta
ł
ł
ej temperaturze
ej temperaturze
REGU
REGU
Ł
Ł
A D
A D
Ź
Ź
WIGNI
WIGNI
c
p
p
c
x
x
x
x
m
m
−−−−
−−−−
====
0
0
A
p
T = const
B
p
0
skład
cieczy
skład
pary
x
c
x
p
x
0
Sk
Sk
ł
ł
ad pary i cieczy roztworu dwusk
ad pary i cieczy roztworu dwusk
ł
ł
adnikowego
adnikowego
w sta
w sta
ł
ł
ej temperaturze
ej temperaturze
A
p
0
A
p
0
B
p
T = const
B
obszar
cieczy
obszar
pary
x
c
x
p
ciecz
+ para
x
0
punkt
rosy
sk
ła
d
cie
cz
y
sk
ła
d
pa
ry
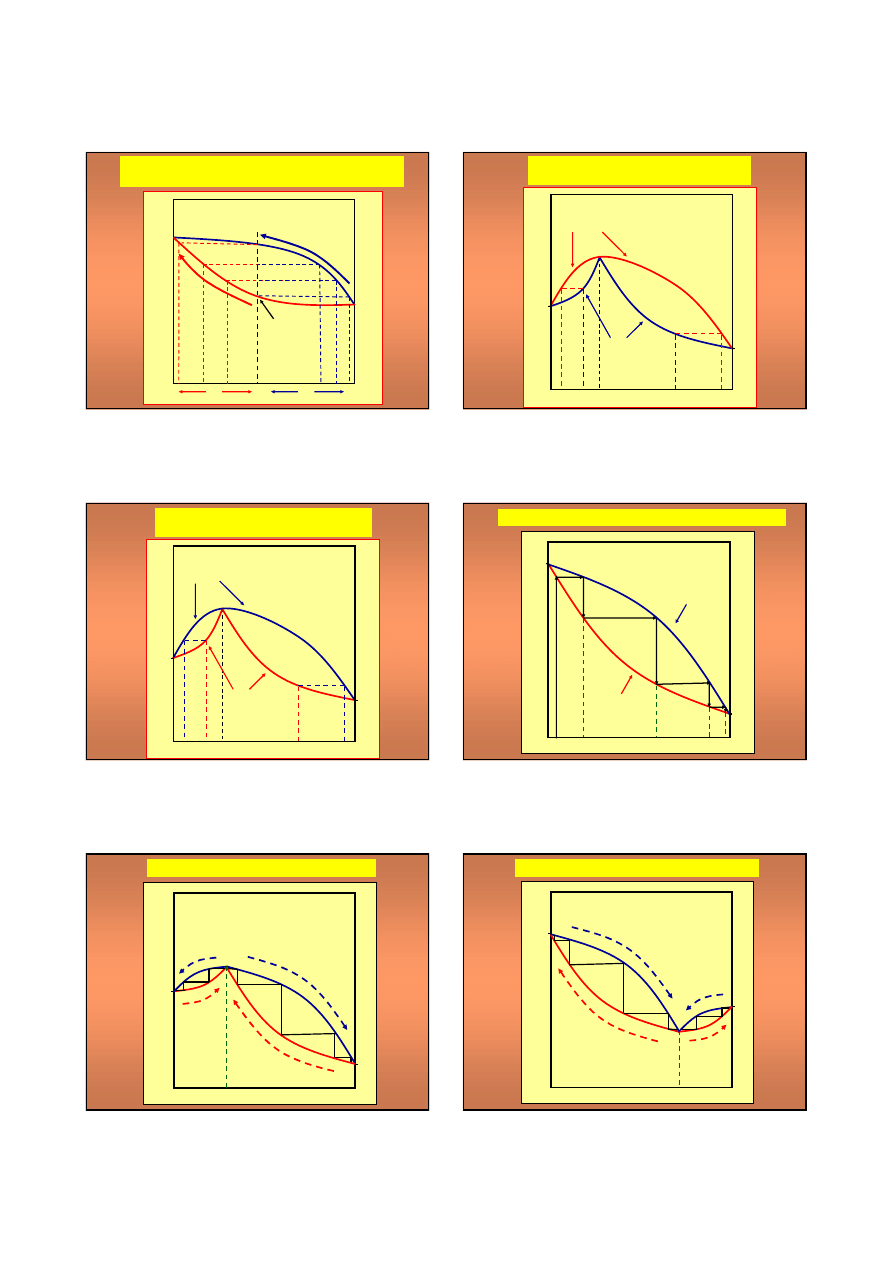
5
Sk
Sk
ł
ł
ad pary i cieczy roztworu dwusk
ad pary i cieczy roztworu dwusk
ł
ł
adnikowego
adnikowego
pod sta
pod sta
ł
ł
ym ci
ym ci
ś
ś
nieniem
nieniem
A
T
p = const
B
obszar
cieczy
obszar
pary
x
c
x
p
ciecz
+ para
x
0
punkt
wrzenia
skła
d cie
czy
sk
ład
pa
ry
T
A
T
B
Sk
Sk
ł
ł
ad pary i cieczy
ad pary i cieczy
azeotropu dodatniego
azeotropu dodatniego
w sta
w sta
ł
ł
ej temperaturze
ej temperaturze
A
p
0
A
p
0
B
p
T = const
B
skład
cieczy
skład
pary
x
a
cie
cz +
pa
ra
ci
ec
z
+
p
ar
a
x
1p
x
1c
x
2p
x
2c
Sk
Sk
ł
ł
ad pary i cieczy
ad pary i cieczy
azeotropu ujemnego
azeotropu ujemnego
pod sta
pod sta
ł
ł
ym ci
ym ci
ś
ś
nieniem
nieniem
A
T
p = const
B
skład
cieczy
skład
pary
x
a
cie
cz +
pa
ra
ci
ec
z
+
p
ar
a
x
1c
x
1p
x
2c
x
2p
T
A
T
B
DESTYLACJA FRAKCJYJNA (FRAKCJONOWANA)
DESTYLACJA FRAKCJYJNA (FRAKCJONOWANA)
A
T
p = const
B
skład
cieczy
skład
pary
x
2
x
3
x
4
x
1
x
0
T
A
T
B
DESTYLACJA AZEOTROPU UJEMNEGO
DESTYLACJA AZEOTROPU UJEMNEGO
A
T
p = const
B
x
a
T
A
T
B
skład
cieczy
skład
pary
DESTYLACJA AZEOTROPU DODATNIEGO
DESTYLACJA AZEOTROPU DODATNIEGO
A
T
p = const
B
x
a
T
A
T
B
skład
cieczy
skład
pary
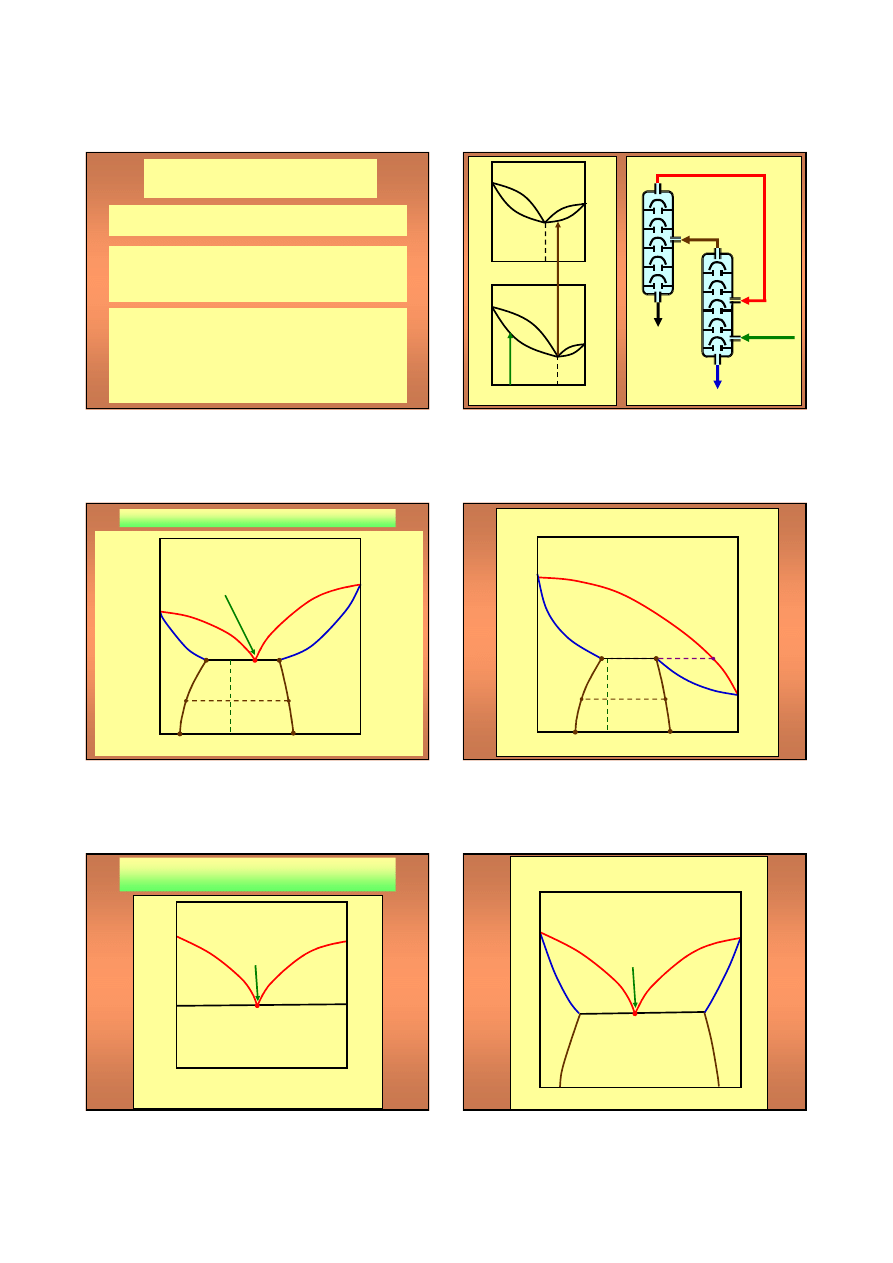
6
ROZDZIELANIE
ROZDZIELANIE
MIESZANIN AZEOTROPOWYCH
MIESZANIN AZEOTROPOWYCH
WIĄZANIE JEDNEGO ZE SKŁADNIKÓW
metodami chemicznymi lub fizycznymi
DESTYLACJA W DWÓCH KOLUMNACH
PRACUJĄCYCH POD RÓśNYMI CIŚNIENIAMI
wykorzystanie faktu, że skład azeotropu i jego temperatura
wrzenia zależą od ciśnienia
DODANIE TRZECIEGO SKŁADNIKA TWORZĄCEGO
Z POZOSTAŁYMI AZEOTROP DODATNI
np. do układu
etanol-woda
dodaje się pewną ilość
benzenu
.
W trakcie destylacji, najpierw oddestylowuje azeotrop
trójskładnikowy, aż do całkowitego wyczerpania wody.
Pozostały benzen usuwa się z etanolu (etanol-benzen nie
tworzą azeotropu) w trakcie zwykłej destylacji frakcyjnej.
A
B
Z
1
Z
2
A + B
A
T
p = p
1
B
Z
1
T
A
T
B
A
T
p = p
2
B
Z
2
T
A
T
B
HETEROAZEOTROPIA i HETEROZEOTROPIA
A
T
p = const
B
heteroazeotrop
1 faza
ciekła
α
αα
α
1
α
αα
α
2
α
αα
α
3
ββββ
3
1 faza
ciekła
x
1
ββββ
1
ββββ
2
2 fazy
ciekłe
1 faza = para
γγγγ
3
para
+
ciecz
para
+
ciecz
A
T
p = const
B
1 faza
ciekła
α
αα
α
1
α
αα
α
2
α
αα
α
3
ββββ
3
1 faza
ciekła
x
1
ββββ
1
ββββ
2
2 fazy
ciekłe
1 faza = para
γγγγ
3
para
+
ciecz
HETEROZEOTROPIA
HETEROZEOTROPIA
RÓWNOWAGA CIECZ – CIAŁO STAŁE
W UKŁADZIE DWUSKŁADNIKOWYM
A
T
p = const
B
punkt
eutektyczny
2 fazy stałe
1 faza ciekła
ciecz
+
ciało stałe
ciecz
+
ciało stałe
uk
uk
ł
ł
ad dwusk
ad dwusk
ł
ł
adnikowy wykazuj
adnikowy wykazuj
ą
ą
cy
cy
brak rozpuszczalno
brak rozpuszczalno
ś
ś
ci w stanie sta
ci w stanie sta
ł
ł
ym
ym
A
T
p = const
B
punkt
eutektyczny
2 fazy stałe
1 faza ciekła
ciecz
+
ciało
stałe
ciecz
+
ciało stałe
ro
z
tw
ó
r
s
ta
ły
ro
z
tw
ó
r
s
ta
ły
uk
uk
ł
ł
ad dwusk
ad dwusk
ł
ł
adnikowy wykazuj
adnikowy wykazuj
ą
ą
cy
cy
ograniczon
ograniczon
ą
ą
rozpuszczalno
rozpuszczalno
ść
ść
w stanie sta
w stanie sta
ł
ł
ym
ym
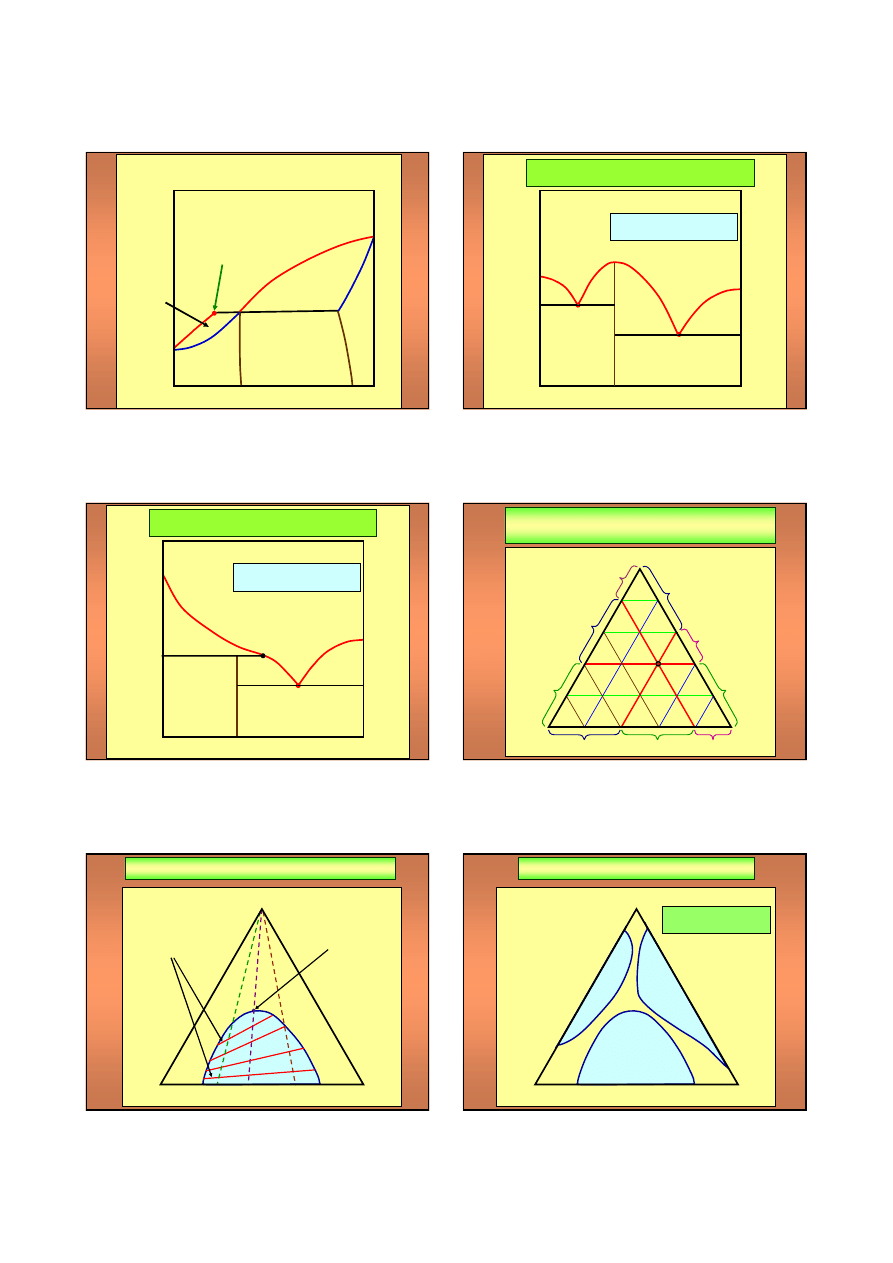
7
A
T
p = const
B
punkt
perytektyczny
2 fazy stałe
1 faza ciekła
ciecz
+
ciało
stałe
ciecz
+
ciało stałe
ro
z
tw
ó
r
s
ta
ły
roztwór
stały
uk
uk
ł
ł
ad dwusk
ad dwusk
ł
ł
adnikowy wykazuj
adnikowy wykazuj
ą
ą
cy
cy
ograniczon
ograniczon
ą
ą
rozpuszczalno
rozpuszczalno
ść
ść
w stanie sta
w stanie sta
ł
ł
ym
ym
uk
uk
ł
ł
ad dwusk
ad dwusk
ł
ł
adnikowy tworz
adnikowy tworz
ą
ą
cy zwi
cy zwi
ą
ą
zek A
zek A
2
2
B
B
i nie tworz
i nie tworz
ą
ą
cy roztwor
cy roztwor
ó
ó
w w stanie sta
w w stanie sta
ł
ł
ym
ym
A
T
p = const
B
E - eutektyki
2 fazy stałe:
A
+
A
2
B
1 faza ciekła
c
+
cst –
ciecz
+
ciało stałe
c
+
cst
A
2
B
2 fazy stałe:
A
2
B
+
A
E
E
c
+
cst
c
+
cst
c
+
cst
uk
uk
ł
ł
ad dwusk
ad dwusk
ł
ł
adnikowy tworz
adnikowy tworz
ą
ą
cy zwi
cy zwi
ą
ą
zek A
zek A
2
2
B
B
topi
topi
ą
ą
cy si
cy si
ę
ę
niekongruentnie
niekongruentnie
A
T
p = const
B
E – punkt perytektyczny
2 fazy stałe:
A
+
A
2
B
1 faza ciekła
c
+
cst –
ciecz
+
ciało stałe
c
+
cst
A
2
B
2 fazy stałe:
A
2
B
+
A
P
c
+
cst
c
+
cst
A
B
C
%
A
%
A
%
A
%
B
%
C
%
B
%
B
%
C
%
C
Rozpuszczalno
Rozpuszczalno
ść
ść
wzajemna trzech cieczy
wzajemna trzech cieczy
Tr
Tr
ó
ó
jk
jk
ą
ą
t
t
Gibbsa
Gibbsa
A
B
C
α
αα
α
ββββ
γγγγ
punkt
homogenizacji
cięciwy
równowagi
konody
Ograniczona rozpuszczalno
Ograniczona rozpuszczalno
ść
ść
A
A
-
-
B
B
A
B
C
I
II
II
II
I – obszar 1-fazowy
II – obszar 2-fazowy
Typy diagram
Typy diagram
ó
ó
w fazowych
w fazowych
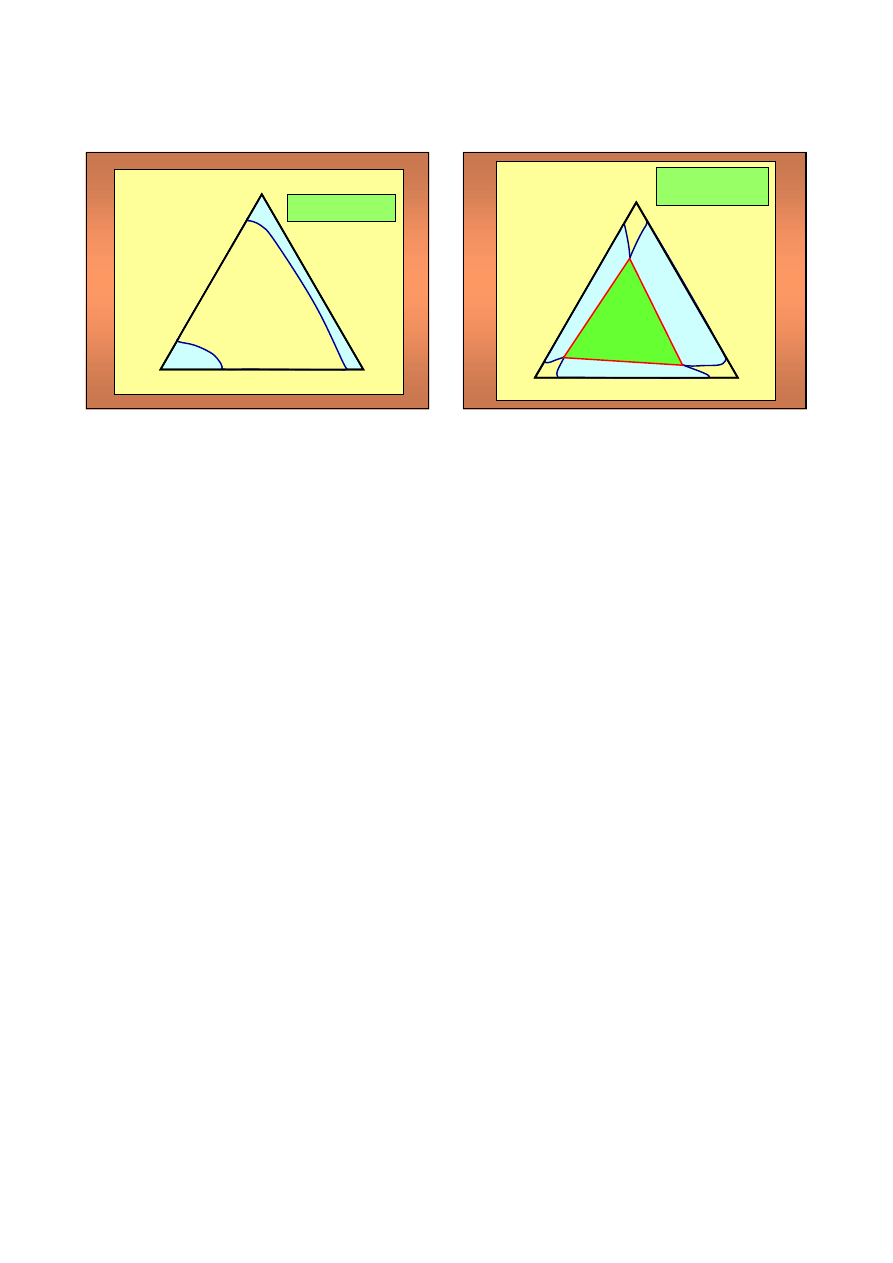
8
I – obszar 1-fazowy
II – obszar 2-fazowy
A
B
C
II
II
I
A
B
C
I
I – obszar 1-fazowy
II – obszar 2-fazowy
III – obszar 3-fazowy
II
II
II
III
I
I
I
Wyszukiwarka
Podobne podstrony:
Fazy 051
1 4 Fazy ZK
p13 051
EnkelNorskGramatik 051
BiolWyklad 051
MTZ W5 fazy ppt
mat bud 051 (Kopiowanie) (Kopiowanie)
Podstawy lesnictwaj 3 fazy
cykl i jego fazy 2., Ściągi Ekonomia
Fazy rozwoju grupy, od 2015, Projekt, budowanie zespołu
Typy i Fazy Instalacji Systemu Windows, Informatyka, Instalacja Systemu
Fazy i etapy?dania marketingowego
Fazy wytwarzania ciasta
P30 051
04 2005 051 055
Datasheet ML15 051
p10 051
3 pomiar czestotliwosci fazy c Nieznany
więcej podobnych podstron