
wykład 3
BIOCHEMIA
16.X.2000
D & F
_ TEMAT: ONKOGENY I PRIONY
I.Onkogeny
Jak wspomniałem ostatnio są to geny leczone jako bagaż z wirusami onkogennymi (wirusami
RNA), które to geny nie są potrzebne dla cyklu życiowego wirusa. Są prawdopodobnie
przywleczone z jakieś komórki zainfekowanej wcześniej przez wirusy onkogenne no i mogą być
wrazem z wirusem wbudowywane w genom gospodarza. zainteresowanie nimi jest tym
spowodowane, iż u zwierząt doświadczalnych infekcja takimi onkogennymi wirusami prowadzi
do ostrej transformacji stąd są zwane wirusami ostrotransformującymi i powstają nowotwory -
głównie są to mięsaki ale także białaczki i chłonniaki. Jak też wcześniej wspominałem w naszych
komórkach występują odpowiedniki funkcjonalne wirusowych onkogenów, które noszą nazwę
protoonkogennów i które są w przeciwieństwie do tych genów zarządzających metabolizmem
komórkowym czyli HOUSEKEEPING GENS odpowiadają za istotny dla komórki głównie w
kwesti związanej z transmisją sygnału a więc kodują albo czynniki wzrostu albo kodują
receptory dla tych czynników wzrostu. Następnie transformują sygnał dokonując transdukcji
sygnału z receptora na efektory wewnątrzkomórkowe , czyli systemu białek GTP-azowych
(białka z rodziny G i bialka systemu ras). Dalej kodują czynniki transkrypcyjne, ktore
odpowiadają za przebieg ekspresji genu, mogą kodować enzymy z grupy kinaz, głównie te które
są sprzężone z receptorami, no i wreszcie kodują zarówno cykliny jak i kinazy cyklinozależne,
które to niezbędne są do przebiegu cyklu komórkowego.
Takie protoonkogeny, w sytuacji gdy ulegną przemianie aktywującej stają się onkogenami i od
ich mutacji, powstania nieprawidłowego allelu onkogennego, może zależeć transformacja
nowotworo-wa komórki.
I te zmiany w komórce mogą obejmować powstanie wadliwego ( ciągłego ) sygnału, mogą
działać na receptor ( ciągłe uaktywnienie ) , albo wewnątrzkomórkowa część odpowiedzi ( białka
G, ras, ewentualnie czynniki transkrypcyjne. To wyjaśnia dlaczego mutacje w obrębie
onkogenów mogą powodować transformacje nowotworowe komórki.
Onkogen ras, który koduje grupę białek o aktywności GTP-azowej, czyli czerpiące natchnienie z
hydrolizy GTP. W przeciwieństwie do białek G , w przypadku transmisji sygnału z receptorów
hormonalnych, białka systemu ras są białkami monomerycznymi, a nie o budowie trimeru. Co się
dzieje zanim białko systemu ras zostanie zakotwiczone w błonie, powiem w dalszej części
wykładu, ponieważ to wiąże się z modyfikacjami posttranslacyjnymi białek. Białko ras
zakotwiczone w błonie - to już jest pewnym elementem jego aktywacji, dla systemu transmisji
sygnału jeszcze jest białkiem nie aktywnym. W momencie pobudzenia receptora przez cząsteczkę
sygnałową , to może być np. czynnik wzrostu, dochodzi do aktywacji sprzężonej z receptorem
kinazy tyrozynoswoistej - jest to enzym, który fosforyluje reszty tyrozyny, które dość obficie
występują w tym receptorze. Aktywacja wyż/wym. kinazy z jednej strony wywołuje zmiany w
receptorze, autofosforylacja z reguły prowadzi do jego inaktywacji, co jest formą obrony komórki
przed nadmiarem informacji i to zjawisko nosi nazwę w biologii i biochemii - down regulation,
regulacji w dół. Ale fosforylacja przy okazji aktywacji kinazy tyrozynoswoistej dotyczy również
białka G.I powstaje aktywne białko RAS, które wymieniło posiadane GDP na GTP, no i
następnie aktywne białko RAS z przyłączoną aktywnością z GDP, doprowadza do aktywacji
kaskady enzymów fosforylujących - nosi to nazwę kaskady kinaz. Kaskada kinaz będzie się
wielokrotnie powtarzała w przekaźnictwie hormonalnym i przekaźnictwie w zakresie czynników
wzrostu. No i kolejne kinazy w wyniku fosforylacji uzyskują aktywność, doprowadzają do
fosforylacji białek enzymatycznych jak i nie enzymatycznych. Z tego wynika wniosek, że
aktywacja białka RAS może doprowadzić zarówno do ekspresji genów, zmian ekspresji genów
(jedne geny mogą ulegać ekspr., innych aktywność ekspresyjna jest hamowana i wreszcie
dochodzi w wyniku zmian posttranslacyjnych do aktywacji białek, część białek w wyniku
fosforylacji aktywność zyskuje, część tą aktywność traci. Tak się dzieje w warunkach
prawidłowych. A co się dzieje jeśli dojdzie do mutacji w genie RAS. Bez względu na sygnał
płynący z komórki, czyli białko RAS, staje się białkiem, w sensie funkcjonalnym białkiem
autonomicznym. Bez względu na to czy czynnik podpowiada komórce, żeby się aktywowała-
procesy związane z białkiem RAS , aktywacja tego następuje w sposób permanentny. Z czasem
doprowadza to do dysregulacji metabolizmu komórki i proliferacji i może doprowadzić do
transformacji nowotworowej. Podobnie dzieje się w przypadku białek, które kodują czynniki
wzrostu lub receptory dla czynników wzrostu ( mutacja w obrębie takiego białka powoduje, że
receptor cały czas jest aktywny, czyli jakby był pobudzany zewnątrzkomórkowo ) . Ten przykład
wyjaśnia nam wystarczająco czemu te zmiany są ważne z punktu widzania transformacji
nowotworowej. W skutek aktywacji onkogenu może dochodzić zarówno do zmian ilościowych
jak również zmian jakościowych w komórce. Zmiany ilościowe dotyczą głównie zmian w
zakresie podawanych czynników wzrostu, ewentualnie kodowanych receptorów. To może być
zarówno wzrost ilościowy kodowanych cząstek jak też ich zmniejszenie. Natomiast zmiany
jakościowe, prowadzą jak w przypadku wspomnianego już zmutowanego białka RAS, do tego, iż
bez stymulacji z zewnątrz odpowiada ono na domniemany bodziec. Warto w tym miejscu
zapamiętać, że mutacje zachodzące w obrębie genów należących do grupy protoonkogenów,
przez co stają się one onkogenami, dotyczą jednego allelu. Gdy taka mutacja ma charakter
dominujący, w przeciwieństwie do antyonkogenów, o których będzie mowa dalej, gdzie
potrzebny jest efekt występujący w obrębie obydwu genów ( alleli ) . Nie należy z tego rozumieć,
że wystarczy jedna mutacja, czyli jeden defekt w obrębie któregoś z protoonkogenów, aby
nastąpiła transformacja nowotworowa komórki, to jest powstanie pewnej predyspozycji, na którą
nakładają się pewne uwarunkowania genetyczne jak i uwarunkowania środowiskowe. W jaki
sposób geny z grupy protoonkogenów mogą ulegać aktywacji. No pierwszym ze sposobów jest
np. amplifikacja, ona jest wykazana w przypadku dwóch takich protoonkogenów biorący udział
w powstawaniu raka sutka, ale znacznie lepiej jest ona poznana w przypadku nowotworu
występującego u zwierząt, mianowicie mięsaka Roussa, kodowanego przez gen SRC. W
przypadku zgromadzenia się więcej niż jednej kopii tego genu występuje tzw. efekt dawki genu,
który w konsekwencji może doprowadzić do transformacji nowotworowej komórek.
Następna grupa aktywacji onkogenów to mutacje punktowe. To jest wykazane w przypadku
takiego onkogenu HRAS, należącego do grupy białek GTP-azowych i tego typu mutację
wykrywa się u chorych na raka jelita grubego, płuc, sutka, pęcherza. Nie należy rozumieć, że jest
to jeden typ mutacji we wszystkich typach nowotworów. Cała trudność badania aktywowanych
onkogenów, wiąże się z tym, że u poszczególnych chorych, poza nowotworami uwarunkowanymi
genetycznie, dziedzicznymi nowotworami, mutacje mogą dotyczyć różnych miejsc, czego nie
należy rozumieć, że jest to w jednym konkretnym miejscu mutacja.
Dalej może nastąpić translokacja części chromosomu z wytworzeniem nowego genu, o
właściwościach onkogennych. Najlepiej jest to poznane w przypadku chromosomu Philadelphia (
Ph ). Jest to chromosom powstały w wyniku translokacji miejsc 9®22. Następuje urwanie
kawałka chromosomu 9 i w tym fragmencie znajduje się gen ABL, i przeniesienie tego fragmentu
genu 9 na 22. Powstanie tego typu aberracji chromosomowej występuje u 85-95 % pacjentów z
przewlekłą białaczką szpikową, więc poszukiwanie chromosomu Ph jest podstawową metodą
diagnostyczną z zakresu biologii molekularnej u chory na naszą białaczkę. Dalej w wyniku zmian
w zakresie chromosomów np. translokacji - może dojść do przesunięcia chromosomu w miejsce
tzw. aktywnej chromatyny, co prowadzi do ekspresji pewnych genów wcześniej nieaktywnych.
Najlepiej jest to poznane w przypadku chłonnika Burkitta - nowotworu układu chłonnego,
występującego u dzieci w Afryce równikowej. W tym przypadku translokacja pewnej części
chromosomu prowadzi do odblokowania syntezy immunoglobulin. Przypominam państwu, że
wśród czynników etiologicznych powstania chłonnika Burkitta dopatruje się udziału DNA-

wirusa Epsteina-Barra.
II. Antyonkogeny, czyli geny supresorowe.
Teraz przechodzimy do kolejnej grupy gennów związanych z transformacją nowotworową -
mianowicie antyonkogenów zwanych także genami supresorowymi. Przyrównuje się geny z
grupy protoonkogenów do pedału gazu w samochodzie, a geny z grupy supresorowej i
protoonkogen-ów do hamulca. Jeden może być hamulcem nożnym, drugi dla odmiany hamulcem
ręcznym. Co to są za geny ? Część z nich są to geny które pełnią w komórce funkcje molekuł
adhezyjnych, czyli cząstek biorących udział w oddziaływaniach międzykomórkowych, tu
szczególnie jest taki gen, który nazywa się APC, i którego mutacje są istotne dla rozwoju
rodzinnego raka jelita grubego,
rozwijającego się na podłożu rodzinnej polipowatości. Drugi z takich genów to gen VHL, który
który bierze udział w powstawaniu zespoł von Hippel-Lindau. To są nowotwory
wielonarządowe rozwijające się też genetycznie ( rak nerki, mięsaki ) . No i wreszcie mamy
grupę genów, które kodują białka, będące negatywnymi regulatorami cyklu komórkowego, czyli
takimi które nie dopuszczają, aby zaszedł cykl komórkowy w sytuacjach, gdy materiał
genetyczny nie jest do tego gotowy. Może nie być gotowy, gdyż nie został w pełni naprawiony.
W przeciwieństwie do onkogenów mutacje mają charakter recesywny. W związku z czym
ujawnia się wyłącznie w przypadku, gdy jest to forma homozygotyczna. Żeby do tego doszło
muszą nastąpić dwie mutacje albo gen prawidłowy musi ulec uszkodzeniu np. abberacji
chromosomowej. Istotnym elementem jest tutaj powstanie sytuacji zwanej - utratą
heterozygotyczności - W przypadku pierwszej mutacji mamy heterozygotę, choroba się nie
ujawnia, jeśli dojdzie do utraty heterozygotyczności, czyli albo w drugim genie nastąpi mutacja
albo prawidłowy gen zostanie stracony, wówczas ujawnia się cech.
Jak dochodzi do LOH ( Lost od heterosigosity ):
utrata chromosomu
‚ reduplikacja
ƒ segregacja 2 alleli
„ delecja alleli dzikiego
… mutacja punktowa
Jak to może się zdarzyć, że ujawnia się utrata heterozygotyczności. Może naprzykład nastąpić
utrata chromosomu podczas podziału komórki. Do komórki trafia wtedy tylko i wyłącznie jeden
zmutowany gen, wtedy mamy taką sytuację, że tylko on może się ujawnić.
Druga sytuacja nazywa się duplikacją - do jednej z komórek obok chromosomu prawidłowego,
czyli zawierającego allel dziki, trafiają dwa chromosomy zawierające allel zmutowany. Dwóch
na jednego - dwóch wygrywa.
Kolejna sytuacja - segregacja dwóch alleli zmutowanych do jednej komórki, to mogło nastąpić w
wyniku podziału komórkowego,
Delecja allelu dzikiego - to mogło nastąpić w wyniku aberracji chromosomowych np. doszło do
utraty chromosomu z komórki i zgubienia allelu.
No i wreszcie w obrębie allelu dzikiego, czyli prawidłowego mogło dojść do mutacji punktowej,
w efekcie czego dochodzi do głosu tylko i wyłącznie allel zmutowany.
Wszystkie te sytuacje doprowadzają do utraty heterozygotyczności. Najwięcej danych jest na
temat powstawania nowotworów powodowanych mutacjami w obrębie antyonkogenów -
pochodzą one z prac Knudsona, który w 1971 roku sformułował teorię dwóch zdarzeń.
Podstawa do tych badań, które są szeroko cytowane, są badania na temat rzadkiego nowotworu
gałki ocznej występującego u dzieci, a mianowicie siatkówczaka ( łac. Retinoblastoma ) . Reti-
noblastoma może wystąpić albo jako choroba sporadyczna albo jako choroba dziedziczna. Jeśli
występuje jako choroba dziedziczna z reguły jest obustronna, w obu gałkach ocznych rozwija się
nowotwór, i to bardzo szybko po urodzeniu. Natomiast jeśli jest to forma sporadyczna - to
występuje u starszych dzieci i tylko w jednej gałce ocznej. Knudson i jego współpr. badali mate-
riał genetyczny chorych zarówno z usuniętego guza gałki ocznej jak i z krwii obwodowej, czyli
takiego materiału jaki występuje w każdej komórce organizmu. No i co ciekawego zauważyli ?
Jeśli tu był guz, a tu mamy materiał DNA pobrany z krwii, w guzie żeby nastąpiła choroba, jak
łatwo zgadnąć, muszą być dwa allele zmutowane. Natomiast w krwii obwodowej nie znajdujemy
w przypadku postaci sporadycznej, żadnej nieprawidłowości. Jeśli mamy postać dziedziczną to w
guzie mamy dwa allele zmutowane, natomiast w krwi obwodowej znajdujemy jeden allel zmuto-
wany. No i narodziła się teoria dwóch zdarzeń.
Tutaj mamy sytuację prawidłową - dwa allele są dzikie, pojawia się pierwsza mutacja i w wyniku
tej mutacji dochodzi do uszkodzenia allelu dzikiego, powstaje allel zmutowany, choroba się nie
Retinoblastoma, czyli obraz siatkówczaka w badanich .
Komórki guza
Komórki somatyczne
DZIEDZICZNA :
Uszkodzenia : obustronne
Wiek: zaraz po urodzeniu
SPORADYCZNA :
Uszkodzenia : jednostronne
Wiek : starsze dzieci
Z
Z
Z
P
Z
Z
P
P
Z - oznacza zmutowany gen
P - oznacza prawidłowy gen
Teoria : DWÓCH ZDARZEŃ
P
P
P
Z
Z
Z
Mutacja 1
Mutacja 2
Choroba
P - prawidłowy gen
Z - zmutowany gen
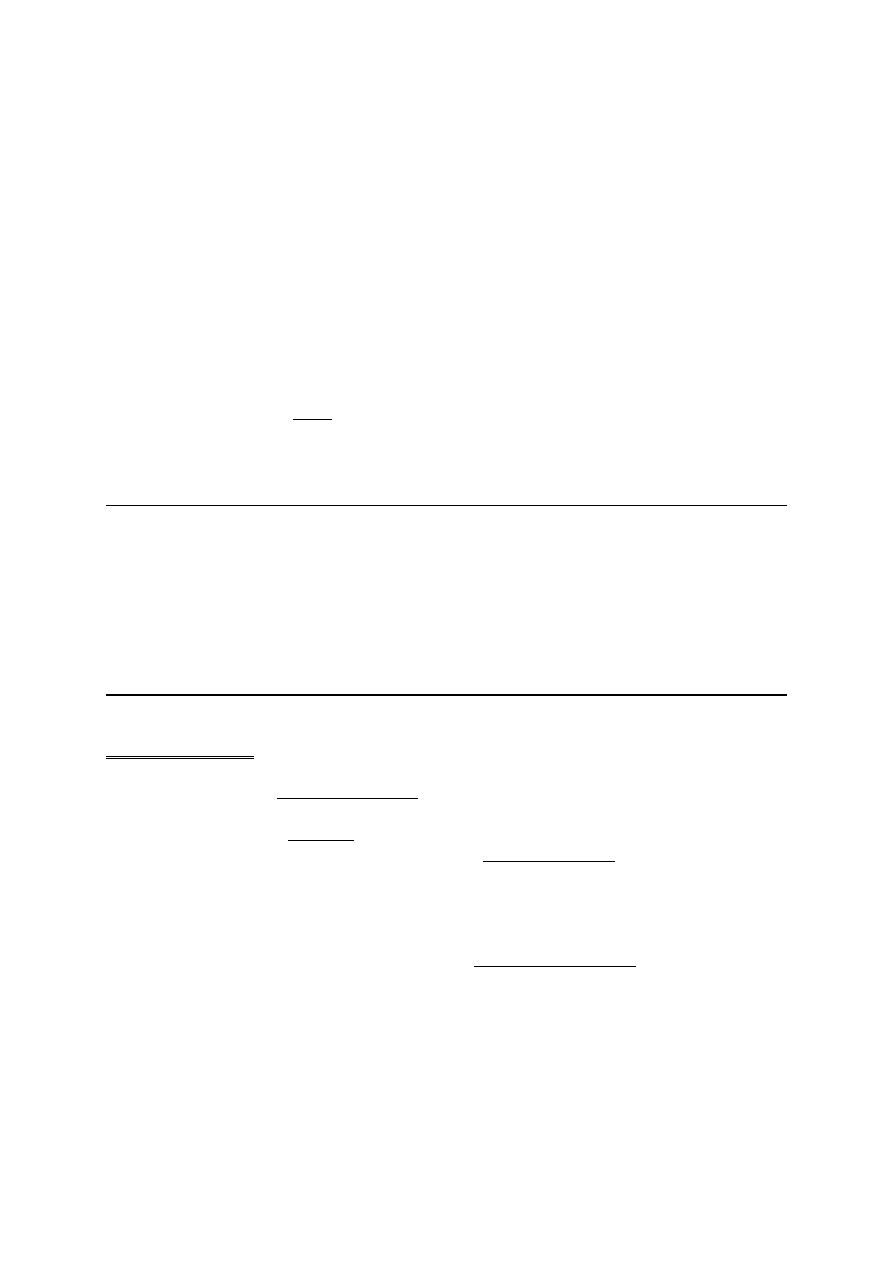
5
rozwija. Jeśli mamy postać sporadyczną - to zdarzyło się na jakimś etapie życia po urodzeniu.
Natomiast w komórkach całego ciała, czytaj DNA krwi obwodowej, sytuacja jest taka : mutacja
wystąpiła wyłącznie w obrębie gałki ocznej. Zdarza się mutacja druga dochodzi do uszkodzenia
allelu drugiego, następuje więc utrata heterozygotyczności i powstaje sytuacja gdzie ujawnia się
choroba. Jeśli mamy postać sporadyczną również dzieje się to w ten sposób w życiu
pozapłodowym. W ten oto sposób rozwija się nowotwór gałki ocznej. Jeśli mamy postać
dziedziczną, to pierwsza mutacja została odziedziczona, jej ślad mamy w krwi obwodowej, ona
również w momencie urodzenia była już w obrębie siatkówki. Natomiast w wyniku działania
jakiegoś czynnika mutagennego, doszło do rozwoju choroby w wyniku powstania homozygoty,
natomiast w obrębie pozostałych komórek somatycznych, wyłącznie występuje ta jedna mutacja,
która została odziedziczona. W konsekwencji doprowadza to do powstania nowotworu
złośliwego.
Wśród nowotworów, w których bierze udział zmutowany antyonkogen na pierwszym miejscu jest
siatkówczak, za to odpowiedzialne są mutacje w obrębie antyonkogenu RB4, drugim najczęściej
badanym onkogenem jest TP53, kodujący białko TP 53, praktycznie mutacje, różne mutacje, w
obrębie tego antyonkogenu stwierdza się w bardzo różnych nowotworach u człowieka. Natomiast
Najważniejsze antyokogeny i choroby spowodowane mutacjami w ich obrębie :
Siatkówczak
RB1
Zespół
Li-Fraumeni
TP53
Rodzinna polipowatość jelita grubego
APC
Zespół von Hippel - Lindau
VHL
Guz
Willmsa
WT1
Rak sutka i jajnika
BRCA1
Rak
sutka
BRCA2
uwarunkowane genetycznie zaburzenie w obrębie tego antyonkogenu powodują powstanie tzw.
zespołu Li-Fraumeni - z licznymi wielonarządowymi nowotworami ( nowotworami synchronicz-
nymi - równocześnie u tego pacjenta rozwijają się nowotwory w różnych narządach ). Dalej
mutacje w obrębie tego antyonkogenu APC kodującego, jak już wspominałem, molekuły adhe-
zyjne, powodują powstanie rodzinnej polipowatości jelita grubego. Dalej taka molekuła jest
kodowana również przez gen VHL ( to jest od zespołu von Hippel - Lindau ) a mutacje prowadzą
tu do raka nerki , OUN-u jak : glejaki, mięsaki. Dalej antyonkogen WT1, jego mutacje powodują
powstanie nowotworu nerki a u dzieci guza Willmsa. No i bardzo intensywne badania na dwójką
antyonkogenów ze względu na ich rolę w powstawaniu rodzinnego raka sutka, raka jajnika. Tu
prace są również zaawansowane w zakresie poradnictwa genetycznego, aplikacji tych badań w
codziennej praktyce. Niemniej trudno tu o jakieś ostateczne wnioski. Są ośrodki w Ameryce,
które w przypadku wykrycia mutacji w obrębie tego antyonkogenu BRAC1 - usunięcie u zdrowej
kobiety obu piersi i obu jajników. Czyli strasznie okaleczająca operacja. No i dwa słowa o dwóch
antyonkogenach.
rAntyonkogen RB1 :
ükoduje białko P110
ü przypomina gen, którego mutacje prowadzą do powstania siatkówczaka
ü występuje na 13 chromosomie i ma 27 eksonów
ü funkcja białka które koduje, czyli PRB - to interakcja z czynnikami transkrypcyjnymi ( jego
możliwość interakcji zależy od tego w jaki sposób jest on ufosforylowany, a stopień fosforylacji

6
zależy od cyklu komórkowego i zależny jest od współpracującego z tym białkiem kinaz.
ü No i to białko może stać się niefunkcjonalne wtedy, kiedy nastąpi mutacja genu albo w obrębie
komórki znajdą się czynniki, które prawidłowo wytworzone białko wiążą i uniemożliwiają jego
prawidłowe łączenie się z czynnikami transkrypcyjnymi. I tu najbardziej upatruje się rolę dwóch
wirusów :
¶ antygen T z wirusa SV40 ( jest to onkogenny wirus transformujący ) tzw. czynnik wywołujący
wakuolizację
¶ wirus ludzkiego brodawczaka (human papilloma wirus ) - jest znacznie ciekawsze od-
działywanie białka wirusowego z białkiem komórkowym, oddziaływanie to jest czynnikiem
etiologicznym dysplazji i raka szyjki macicy.
rAntyonkogen TP53
No i w grupie tych białek supresorowych, produktu genów supresorowych - białko P53, ale
może być również okerślone jako białko TP53,
ü występuje na 17 chromosomie
ü zbudowane z 11 eksonów
ü swoją aktywność wywiera w ten sposób, że wiąże się z materiałem DNA i w przypadku gdy
występuje tam uszkodzenie, uniemożliwia komórce wejście w cykl komórkowy, uniemożliwia
po-wielenie materiału w fasie S cyklu komórkowego.
ü nazywany poetycko "strażnikiem genomu " - swoją działalność wiążącą może rozwinąć tylko
wtedy, kiedy występuje w formie homotetrameru, czyli 4 podjednostki są identyczne. Jak to się
dalej dzieje to za chwilę pokażę. Natomiast ten homotetramer nie powstaje w kilku sytuacjach:
a ) jeśli nastąpi mutacja genu, to wtedy 4 podjednostki bądą identyczne, ale nie takie jak
powinny być
b ) nastąpi połączenie ze zmutowanym białkiem
c ) albo w komórce pojawiają się jakieś białka, które uniemożliwiają to połączenie
I w przyczynach znowu mamy :
¶ antygen T z wirusz SV40
¶ białko F6 z wirusa brodawczaka ludzkiego
Jeśli wszystko przebiega jak należy, mamy jakieś uszkodzone białko P53 po aktywacji wiąże się
z tym właśnie regionem, następuje ekspresja genu P-21, powstaje odpowiedni mRNA, w wyniku
translacji powstaje białko inhibitorowe dla kinaz cyklinozależnych ( CDK ) - taki kompleks staje
się nieaktywny i komórka nie wchodzi w fazę S. Ważna jest interakcja, że białko P53 wchodzi w
interakcję z DNA uniemożliwiając wejście w prawidłowy cykl komórkowy. Wszystko jest pozos-
tawione do czsu naprawy uszkodzenia.
III.Geny mutatorowe
No i wreszczie trzecia grupa genów, o których wspominałem, że biorą udział w transformacji
nowotworowej komórki to geny tzw. toru mutatorowego, czyli geny mutatorowe . Są to geny
zaangażowane w naprawę materiału genetycznego, w jego stabilizację. Tu badania są stosunkowo
najmniej zaawansowane, ale szczególnie dwie jednostki chorobowe są szczególnie eksplorowane:
1.Rak jelita grubego
2.zespół tzw. Ataxia teleangiectasia- to jest wrodzony zespól polegający na zaburzeniu sfery
pozapiramidowej OUN-u, stąd zmiany na tle ataksji - niezborność ruchowa. Zmiany na tle tele-
angiektazji, czyli rozszerzonych naczyń skórnych jak i naczyń narządów wewnętrznych oraz
naczyn w obrębie ośrodkowego układu nerwowego.

7
rMODYFIKACJE POSTTRANSLACYJNE
Modyfikacje posttranslacyjne są jednym z etapów biosyntezy białka. Poprzednio pokazywałem w
jaki sposób powstaje translacja, w jaki sposób jest ona regulowana. Na tym etapie translacji
białko nie jest aktywne, musi ulec obróbce posttranslacyjnej w wyniku której staje się w pełni
funkcjonalnym białkiem. Modyfi. post. można podzielić ze względu na lokalizację, w której
zachodzi dana modyfikacja na : wewnątrzkomórkowe i zewnątrzkomórkowe. No i ze względu na
mechanizm, który za chwilę poznamy, na modyfikacje enzymatyczne i nieenzymatyczne.
1. Hydroksylacja - ( jedna z form utleniania ) najważniejsze znaczenie z punktu widzenia białek,
którymi się zajmujemy jest modyfikacja posttranslacyjna dwóch aminokwasów (proliny i lizyny).
Powstaje odpowiednio hydroksylizyna i hydroksyprolina. Są to aminokwasy białkowe, które nie
mają swojego aminoacylo-tRNA i nie są włączane do białka na etapie translacji. One powstają w
wyniku modyfikacji posttranslacyjnej. Jeśli oznaczylibyśmy te aminokwasy w moczu albo
surowicy co jest możliwe, to mamy stąd wniosek, że nie tylko zaszła prawidłowa translacja, ale
również wewnątrzkomórki nastąpiła hydroksylacja. Hydroksylacja ta jest zależna od witaminy C
i jonów Fe
2+
oraz kwasu
α
- ketoglutarowego. Po co ta modyfikacja zachodzi ? Dla kolagenu
hydroksyla-cja proliny jest kluczowa dla przyjęcia odpowiedniej konformacji przestrzennej,
natomiast hydroksylacja lizyny jest niezbędna do tego, aby kolagen w przyszłości mógł ulegać
glikozylacji. Może to być np. wiązanie się z innymi komponentami tk. łącznej, czyli
glikozaminoglikanami.
2. Glikozylacja - jest to przyłączanie do białka cząstki lub cząstek cukru, najczęściej jest to
glukoza lub galaktoza. Jest to proces enzymatyczny, katalizowany przez odpowiednio : gluko-
lub galaktozylotransferazy.
3. Glikacja - kolejny proces, który z nazwy jest podobny do poprzedniego, ale jest zupełnie
inny. Glikacja zwana inaczej nieenzymatyczną glikozylacją, zachodzi przedewszystkim w
przestrzeni pozakomórkowej. Dotyczy zarówno białek osocza, jak i białek tkankowych i ma
kolosalne znaczenie dla rozwoju powikłań w przypadku niewyrównanej cukrzycy, czyli takiej
która przebiega z podwyższonym poziomem glukozy. Wówczas białka ulegają nieenzymatycznej
glikozylacji. Początkowo powstają produkty pośrednie, przejściowe, które mają charakter
odwracalny - tzw. związki Amadorii , a następnie ulegają one przekształceniu w związki, które
w skrócie noszą nazwę AGE. Nazwa jest dobra ponieważ z wiekiem związki te się kumulują, stąd
nazwa zaawansowane produkty końcowej glikacji. Tego typu związki AGE mają swoje receptory
występujące m.in. na makrofagach, w efekcie czego dochodzi do aktywacji makrofagów, to jest
wzrost wydzielania enzymów proteolitycznych, co może mieć znaczenie w dalszym powikłań
miażdżycowych. Ocena białek modyfikowanych przez glikację, znalazła również zastosowanie
praktyczne. W tym celu oznacza się tzw. glikowaną hemoglobinę, którą oznacza się HbA i która
jest markerem wyrównania cukrzycy za ostatni kwartał. Dlatego za ostatni kwartał, bo krwinka
żyje ok. 120 dni, a owa hemoglobina w krwince, która uległa zmodyfikowaniu nie zostanie zsyn-
tetyzowana, bo takiej możliwości nie posiada. Czyli jest to jak naciągnięty termometr lekarski.
Nawet jak temp. spadnie, czytaj spadnie stężenie glukozy, bo pacjent przed wizytą zaczął się
racjonalnie odżywiać, zaczął brać leki, które miał przepisane i przychodzi na wizytę, pokazując
jaką ma piękną glikemię, ale badanie powie prawdę, bo jeśli poziomy glikozylowanej
hemoglobiny są wysokie, to znaczy, że przez te trzy miesiące......Hulaj dusza bez kontusza,
natomiast tuż przed wizytą wielka pokora.
4.Deaminacja oksydacyjna - dotyczy Î-aminowych grup lizyny. Lizyna jest aminokwasem
dwuzasadowym, posiada grupę alfa i epsilon . Grupa alfa nie może ulegać modyfikacji, bo
tworzy wiązanie peptydowe, natomiast grupa epsilon ulega tej modyfikacji. Za tą modyfikację
odpowiedzialna jest oksydaza lizylowa- jest to enzym miedziozależny. W wyniku tej modyfikacji
powstaje aldehydowa pochodna lizyny, która jak sama nazwa wskazuje nazywa się allizyna. Jest

8
to etap wstępny do powstania wiązań poprzecznych ( cross-linking ), które mają kluczowe
znaczenie dla stabilizacji zarówno kolagenu jak i elastyny. Jeśli ten enzym wykazuje brak aktyw-
ności lub jego aktywność jest wtórnie zakłócona w skutek niedoboru miedzi, taki stan nosi nazwę
LATERYZMU. Powstają wówczas białka tkanki łącznej pozbawione podstawowej cechy,
mianowicie - odporności mechanicznej, wskutek nie powstania wiązań krzyżowych ( wiązanie
krzyżowe = wiązanie poprzeczne )
5. Karboksylacja - więcej w dalszej części wykładu
6. Tworzenie mostków disulfidowych - kluczowe znaczenie dla przyjmowania konformacji
przez liczne hormony i enzymy. Jest to również pewnego rodzaju modyfikacja prowadząca do
inaktywa- cji białek - zrywanie tych mostków disulfidowych powodując redukcję.
7. Ograniczona proteoliza - to kolejna modyfikacja, która w końcówce wykładu będzie do
znudzenia wałkowana. Ograniczona proteoliza jest to hydroliza białka, jest ona ograniczona do
pewnych miejsc w białku, czyli jest wysoce specyficzna. W efekcie tego od białka zostaje odjęty
kawałek, czyli jakiś peptyd drobnocząsteczkowy i w wyniku tego powstałe białko zyskuje
aktywność. Kluczowe znaczenie ma to w przypadku enzymów proteolitycznych ( układ
pokarmo-wy, jak i układ krzepnięcia krwi ). Drugim takim miejscem gdzie ograniczona
proteoliza ma ogromne znaczenie, oprócz aktywacji enzymów jest aktywacja prohormonów do
aktywnych hormonów.
8.9. Fosforylacja i defosforylacja - modyfikacje mające kluczowe znaczenie dla aktywacji i
deaktywacji enzymów. Też się nad nimi zatrzymamy w dalszej części wykładu.
10.Ubikwitynacja - czyli przyłączenie do białka innego drobnocząstecznowego białka, a
mianowicie ubikwityny, więcej powiem za chwilę.
11. Acetylacja - w warunkach fizjologicznych, acetylacja odgrywa rolę w metabolizmie białek
histonowych. Natomiast znacznie ważniejsza funkcja z punktu widzenia lekarskiego jest acety-
lacja wywołana pewnymi środkami farmaceutycznymi. Klasyczny przykład do którego będziemy
wielokrotnie wracać - to jest acetylacja centrum katalitycznego cyklooksygenazy przez kwas
acetylosalicylowy, czyli aspirynę. wówczas białko enzymatyczne ulega zahamowaniu w wyniku
tejże modyfikacji.
12. Metylacja - w tej modyfikacji biorą udział metylotransferazy a w procesie odwrotnym biorą
udział demetylazy.
13. Modyfikacje lipidowe - Przy tych modyfikacjach w dalszej części się zatrzymam, bo to w tej
chwili taki current topic w biochemii klinicznej.
No kilka słów już powiedziałem o hydroksylacji proliny i lizyny, glikozylacji hydroksylizyny dla
łączenia się z pozostałymi strukturami tkanki łącznej. Tu ważna jest również ograniczona
proteoliza, czyli nie tylko enzymy, nie tylko hormony, ale przy trójhelikalnej budowie kolagenu
mamy na końcu N i na końcu C - globularne zakończenia. To wygląda tak jak wkładka do
kontaktu, aby dziecka tam drutanie wsadziło. A ponieważ...........one przedostają się do układu
........... . Ponieważ to wszystko jest spinane koniec do końca, żeby nam się nie rozleciało, tworzą
się tutaj wiązania poprzeczne - cross-linking. No i wreszcie włókno kolagenowe zostaje
wydzielone za komórkę, gdzie w przestrzeni pozakomórkowej musi dysocjować z pozostałymi
składnikami tkanki łącznej, bo te włókna nie są poprostu tak porozrzucane, tylko są elemntami
macierzy międzykomórkowej tkanki łącznej. kolejna rzecz o której warto coś wiedzieć to pewne
nietypowe kolageny zwane w skrócie FACIT ( Fibrill Associated Collagens with Interputed
Triple Helices ) , czyli jak sama nazwa mówi - są to kolageny, których struktura trójhelikalna jest
poprzerywana. Ja cały czas używam nazwy kolageny !!! i też taką oczekuję a nie - kolagen. Jest
to bardzo duża heterogenna grupa zbudowana z kilku rodzajów różnych białek, funkcja części z
nich nie jest nawet dokładnie poznana, a są identyfikowane tylko metodami immunologicznymi
przeciw temu kolagenowi, znajdowane jako odmienne od tych które do tej pory zostały

9
znalezione. To co każdy musi wiedzieć to kolagen typu I ( gdzie ? funkcja ? ) typu IV związany z
błonami podstawnymi i z tym kolagenem a zwłaszcza z odpowiedzią immunologiczną przeciw
temu kolagenowi, wiąże się grupa patologii autoimmunologicznych, zwłaszcza kłębkowe
zapalenie nerk. I wreszcie taki ciekawy kolagen typu VII, który umożliwia zakotwiczenie
naskórka w warstwach skóry właściwej. Jeśli występuje defekt genetyczny w zakresie tego
kolagenu, to wówczas naskórek nie jest niczym przymocowany i najmniejszy uraz doprowadza
do złuszczania z tworzeniem się ran i pęcherzy. Ta jednostka nosi nazwę Epidermalisis bullosa.
To są kolageny tych typów, które są tutaj wspomniane:
ü IX, XII, XIV, XV, XVI, XIX - to są tzw. kolageny włókienkowe, ponieważ one towarzyszą
innym włóknom kolagenowym, tym które stanowią główną strukturę tkanki łącznej . Co one
mają takiego ciekawego? No mają wszystko czego taki dojrzały kolagen mieć nie powinien:
ü posiadają wciąż końce globularne
ü główna masa to jest potrójny heliks w głównych kolagenach, ale w tych kolagenach stanowi
ok.10- 15 % całej masy, czyli jest w mniejszości
ü dalej występuje tzw. struktura A, która spotykana jest w czynniku von Willebranda
ü występuje struktura III-rzędowa charakterystyczna dla innego białka tk. łącznej - fibronektyny.
ü no i wreszcie możemy znajdować w tym kolagenie włókienkowym, czyli typu FACIT, również
czynniki przypominające czynniki wzrostu. Czyli z tego wynika, że te kolageny mogą działać
również jako czynniki wzrostu, czyli brać udział w systemie organizacji organizmu.
Kolageny włókienkowe postrzegane są jako tzw. IV układ sygnalizacyjny, czyli integrująca
rola tkanki łącznej oprócz układu immunologicznego, nerwowego i układu hormonalnego.
r Elastyna
Elastyna jest białkiem występującym w różnych miejscach, a najobficiej w skórze dużych naczyń
krwionośnych, zwanych naczyniami typu sprężystego, a także w płucach. Jak sama nazwa
wskazuje elastyna nadaje tym tkankom właściwości sprężyste. Jest to białko o bardzo długim
okresie półtrwania, bardzo odporne na działanie enzymów proteolitycznych. Enzymy, które
degra-dują elastynę nazywane są elastazami. Biosynteza zachodzi w różnych komórkach:
fibroblastach, oseoblastach i nasza elastyna powstaje w kilku etapach :
î gen elastyny ulega transkrypcji i powstaje pierwotny transkrypt, gdzie mamy zarówno
sekwencje intronowe jak i eksonowe
î w wyniku splicingu powstaje mRNA,
î następnie czytanie mRNA na rybosomach
î jeszcze na etapie powstającego peptydu na rybosomach następuje hydroksylacja lizyny,
hydroksylacja proliny, ale głównie proliny
î powstaje tropoelastyna, która jest wydzielana poza komórkę
î następuje koacerwacja, czyli łączenie się poszczególnych molekuł tropoelastyny
î dochodzi następnie do deaminacji oksydacyjnej lizyny - powstają allizyny, które są niezbędne
do usieciowania elastyny
î i wreszcie poprzez asocjację z glikoproteinami występującymi w tkance łącznej tworzą się
włókna sprężyste.
Unikalną właściwością elastyny jest występowanie dwóch aminokwesów - wiązań krzyżowych :
desmozyny i izodesmozyny. Poza elastyną tego typu aminokwas wiązań poprzecznych
występuje jedynie w skorupce jaja, a ponieważ nikt nie jada skorupek jaja, dlatego tyle
desmozyny ile jest w organizmie, powstaje w wyniku degradacji elastyny. Nie z biosyntezy, a z
degradacji elastyny. Desmozyna powstaje w sposób nieenzymatyczny przez połączenie : trzech
allizyn i jednej lizyny nie zmienionej. Niektóre laboratoria proponują jej oznaczanie, jest
oznacznie jest dość kłopotliwe bo wymaga albo metody immunoenzymatycznej, albo metody
radioimmunologicznej, albo metody HPCL, dla oceny degradacji elastyny. Pierwsze miejsce

10
degradacji elastyny w skórze, na skutek nadmiernego opalania, to dochodzi do aktywacji
enzymów proteolitycznych i po jakimś czasie ma barwe brązową, ale nie jest elastyczna. Drugie
miejsce duże naczynia, czyli aorta - tam następuje degradacja elastyny jako część procesu
miażdżycowego. Trzecie miejsce - płuca , tam następuje degradacja elastyny w tworzeniu
rozedmy płuc. Elastyna zbudowana jest wg. modelu Greya- mamy w elastynie naprzemmienie
ułożone odcinki helikalne , zwane naoliwioną sprężyną W tych odcinkach zawarte są
aminokwasy hydrofobowe. Jeśli rozciąga się ta sprężyna to aminokwasy hydrofobowe wchodzą
w kontakt ze środowiskiem wodnym , co termodynamicznie jest niekorzystne i dąży ta
cząsteczka do przyjęcia struktury pierwszorzędowej, od tych odcinków helikalnych naoliwionej
sprężyny zależy zdolność elastyny do przyjmowania pierwotnej konformacji , czyli sprężystość.
Natomiast odcinki w których występuje desmozyna, te miejsca są bowiem odporne na
rozciąganie , czyli warunkuje właściwości mechaniczne, to , że elastyna rozciągnięta nie zrywa
się. Wreszcie mamy taki genetycznie uwarunkowany zespół zaburzeń w biosyntezie elastyny co
się nazywa cutis laxa ( po naciągnięciu powstaje fałd , który nie wraca do poprzedniego kształtu
)
5.Karboksylacja- to jest modyfikacja polegająca na karboksylacji reszt γ-karboksylowych, które
występują w kwasie glutaminowym. Jest to aminokwas dwu karboksylowy i grupa α bierze
udział w tworzeniu wiązania peptydowego , grupa γ, która ulega takiej modyfikacji, po co ?
powstały zmodyfikowany aminokwas :kwas γ-karboksyglutaminowy uzyskuje zdolność wiązania
jonów wapnia , występuje więc ta modyfikacja w białkach , w których wiązanie białka ma
znaczenie kluczowe - są to czynniki krzepnięcia z grupy protrombiny II,VII,IX,X dalej 2
inhibitory krzepnięcia , których funkcje szczegółowo omówie, przy okazji witaminy K ,
mianowicie białko C i białko S , oraz szereg białek ulegających ekspresji -zarówno w kościach
jak i poza kośćmi. Wtedy kiedy ulegają ekspresji poza kośćmi wiąże się to zazwyczaj z jakąś
patologią. Są to mianowicie takie białka jak : osteokalcyna, osteoblastyna, osteopontyna. Proces
posttranslacyjnej γ-karboksylacji jest procesem zależnym od witaminy K, czyli żeby prawidłowo
powstał kwas γ-karboksyglutaminowy : po pierwsze kwas glutaminowy , czyli musi nastąpić
translacja , muszą być enzymy , musi być witamina K. Jeżeli któregoś z tych składników brakuje
nie powstają białka aktywne funkcjonalnie.
8,9 fosforylacja ; defosforylacja -jest to modyfikacja przez enzymy : enzymy fosforylujące są
nazywne kinazami , enzymy defosforylujące nazywają się fosfatazami.Aminokwasami, ktore w
białkach ulegają takim modyfikacją najczęściej jest : seryna , treonina i tyrozyna. Stąd kinazy
noszą nazwę kinaz tyrozynoswoistych i kinaz seryno-treoninowych. W wyniku działania kinazy
dochodzi do wprowadzenia odpowiedniej struktury w centrum katalityczne enzymu i taki enzym
albo zyskuje swoją aktywność , albo ją traci. Przeciwstawny proces prowadzony jest przez
fosfatazy. Te nawzajem występujące formy aktywne i nieaktywne lub vice versa , która to
możliwość występuje dzięki dwum enzymom: kinazie i fosfatazie nosi nazwę interkonwersji
enzymu .Jest to jeden ze sposobów wpływu na aktywność enzymu i jak to się mówi wpływ na
aktywność katalityczną enzymu, które ma znaczenie dla kluczowych procesów w organizmie
ludzkim. Najlepszym przykładem do wykazania tych funkcji jest pokazanie dwóch białek.
Jednym z nich jst syntetaza glikogenu -jest to enzym, ktory prowadzi syntezę glikogenu , drugi
enzym o działaniu przeciwstawnym jest to fosforylaza glikogenu ,czyli enzym prowadzący do
degradacji glikogenu. Jeśli dochodzi do uruchomienia procesu , o którym będzie mowa w
przyszłości ,w następstwie którego dochodzi do aktywacji odpowiednich kinaz. Jeśli dojdzie do
fosforylacji syntetazy glikogenowej enzym ten staje się nieaktywny, czyli synteza glikogenu staje
, ale równocześnie ta sama fosforylacja w przypadku fosforylazy glikogenu , czyli enzymu
degradującego glikogen - prowadzi do aktywacji tego enzymu, czyli równocześnie dochodzi do
wzmożonej degradacji glikogenu i vice versa .Jeśli zadziałała fosfataza to synteza glikogenu w
formie defosforylowanej jest enzymem aktywnym, natomiast fosforylaza glikogenu w formie

11
zdefosforylwanej jest enzymem nieaktywnym. Dlatego w danym momencie tylko jeden z
procesów zachodzi : albo synteza glkogenu albo jego degradacja. A wszystko to jest regulowane
przez hormony, które działają na odpowiedni receptor, uruchamiając coś o czym już dzisiaj
wspominałem, czyli kaskadę kinaz.
No i kinaza tyrozynoswoista - jest enzymem sprzężonym z receptorem ( najczęściej są to recep-
tory dla czynników wzrostu ). Jeśli do tego receptora przytuli się ligand, w naszym przypadku
jest nim czynnik wzrostu - dochodzi do aktywacji kinazy tyrozynoswoistej - enzym ten ma swój
substrat w postaci reszt tyrozyny części wewnątrzkomórkowej receptora, ale również na szeregu
innych białek, które gdzieś tam po drodze mogą się znajdować. W wyniku fosforylacji receptor
traci swoją aktywność, czyli jest ''stop'' w przekaźnictwie sygnału, a jednocześnie fosforylacja
innych białek doprowadza do przeniesienia sygnału z czynnika wzrostu działającego na receptor,
na odpowiednie substraty - białka enzymatyczne i nieenzymatyczne.
10. Ubikwitynacja
Kolejna modyfikacja to ubikwitynacja, która jest prowadzona za pośrednictwem odpowiednich
enzymów, transferujących ubikwitynę, drobnocząsteczkowe białko o bardzo zachowawczej
budowie, budowie konserwatywnej, która występuje u organizmów nie spokrewnionych ze sobą
praktycznie w takiej samej formie. Przyłączenie tego białka najczęściej postrzegane jest jako
naznaczenie, aby białko to uległo degradacji. Tak się dzieje zarówno w przypadku błędnych
białek, które muszą zostać zdegradowane, jak i takich białek, których los w komórce dobiegł
końca.Ale funkcji tych jest znacznie więcej :
ü naznaczanie białek do degradacji
ü regulacja ekspresji genów
ü naprawa DNA
ü udział w transformacji nowotworowej komórki
ü regulacja cyklu komórkowego
ü regulacja aktywności chromatyny
ü synteza rybosomów i peroksysomów
Ta cząsteczka białkowa może być zmodyfikowana jedną cząstką ubikwityny - nosi to nazwę
monoubikwitynacji, a może zachdzić modyfikacja przez kilka cząstek ubikwityny, co nosi nazwę
poliubikwitynacji. Do takiego łańcucha białkowego może być przyłączonych kilka cząstek w
różnych miejscach lub cząstki są podłączane do siebie na wzajem. I tu mamy jakieś nasze białko,
które ma być zniszczone. Reakcja następuje między grupą karboksylową glicyny występującej w
ubikwitynie a grupą ε-aminową w lizynie. W rezultacie tego działania powstaje wiązanie
izopepty-dowe, czyli już poznaliśmy drugą funkcję grupy ε-aminowej: jedna to było poddanie się
modyfikacji posttranslacyjnej typu deaminacji oksydatywnej i powstawała allizyna, tu mamy
kolejną - powstanie wiązania izopeptydowego z cząstką ubikwityny celem modyfikacji o typie
ubikwitynacji.
13. Modyfikacje lipidowe
No i ostatnia grupa modyfikacji o charakterze posttranslacyjnym - są to modyfikacje lipidowe.
Jest to przyłączanie do białek pewnych składników lipidowych. Są to najczęściej kwasy
tłuszczowe np. palmitylacja, zachodząca zarówno w białkach biorących udział w transdukcji
sygnału, jak i w białkach enzymatycznych i nieenzymatycznych. Drugą taką modyfikacją jest
mirystylacja ( ? ) , ale nas najbardziej będzie interesowała modyfikacja o typie prenylacji.
Jaka by to nie była modyfikacja, w wyniku modyfikacji lipidowej białko zyskuje możliwość
większego niż dotąd w tłuszczach. A ponieważ błony są tłuste białko za czyna nabierać
większego powinowactwa do błony i w błonie może się zakotwiczyć.
r NA CZYM POLEGA PRENYLACJA :
Związki do prenylacji biorą się ze szlaku mewolonowego , zwanego inaczej szlakiem biosyntezy

12
cholesterolu. Najpierw mamy acetylo~CoA, z trzech cząsteczek acetylo~CoA powstaje β-
hydroksy, β-metyloglutarylo~CoA ( HMG~CoA ), i tu mamy taki kluczowy enzym
regulatorowy : reduktazę HMG-CoA powstaje mewolonian i z niego powstaje pierwszy
związek izoprenoidowy - mianowicie : pirofosforanizopentenylu ( jest to związek
pięciowęglowy, ale on jeszcze w prenylacji udziału nie bierze ). Przez połączenie dwóch
izopentenylopirofosforan-ów powstaje geranylopirofosforan ( związek dziesięciowęglowy )
przez przyłączenie kolejnej cząstki izopentenylopirofosforanu powstaje farnezylopirofosforan.
Kolejne przyłączenie daje geranylogeraniol ( 20C ) . Czyli mamy : geranylofosforan,
farnezylofosforan, geranylogeraniol, czyli odpowiednio związki 10, 15, 20 - węglowe.
Takiej modyfikacji o typie prenylacji ulegają białka zaangażowane w transfer sygnału w
komórce. W różnych sytuacjach, tak z punktu widzenia nowotworu, jak i innych chorób
nienowotworo-wych, np. miażdżycy tętnic - zależy nam, żeby te białka sygnałowe nie
powstawały. Ta prenylacja jest o tyle istotna, że dysponujemy potężnym narzędziem jakim jest
inhibitor reduktazy HMG-CoA, hamujący w tym miejscu powstawanie związków
izoprenoidowych, które noszą nazwę statyn. I możemy i u ludzi i u zwierząt i w komórkach
hodowlanych szeregu niekorzystnych zjawisk zapobiec. Jak to się wszystko odbywa ?:
Mamy nasze białko RAS, które już dzisiaj widzieliśmy, które w wyniku działania kinazy
tyrozyno-swoistej, staje się białkiem aktywnym. Ale zanim to białko stanie się substratem dla
kinzy tyrozynoswoistej, po wyprodukowaniu musi trafić do błony, a to białko jest białkiem nie
mającym powinowactwa do błony zanim nie ulegnie prenylacji. Po zprenylowaniu ulegnie
zakotwiczeniu w błonie i może działać. Takich białek zaangażowanych w transfer sygnału jest
znacznie więcej. Oprócz tego białka RAS, również białko...... i białko Rho. Stosując inhibitory
reduktazy HMG-CoA, doprowadzamy do tego, że to białko nadal powstaje możemy je wykryć w
cytozolu, ale przez brak naszej prenylacji nie może być ono zakotwiczone w błonie. Tak jakby
efektu tego białka nie było. I to ma ogromne znaczenie jest to jedna z bardziej intensywnie
poznawanych modyfikacji posttranslacyjnych.
r Immunoglobuliny
Immunoglobuliny pełnią funkcję przeciwciał. Każda cząstka immunoglobuliny zbudowana jest z
czterech łańcuchów: dwóch łańcuchów lekkich i dwóch łańcuchów ciężkich. Zatem w cząsteczce
immunoglobuliny nasze łańcuchy ciężkie i lekkie są tego samego rodzaju. Jak zapewne wiecie te,
które są ciężkie mogą być pięciu rodzajów i to decyduje o rodzaju immunoglobuliny. A lekkie
mogą być dwóch rodzajów. Mamy tu dwa rodzaje wiązania : pierwsze to jest Antigen binding,
czyli to wiążące antygen i miejsce drugie, czyli ulegające krystalizacji, lub tworzące komplement
jak kto woli - po prostu Fc . Immunoglobulina G występuje w formie monomeru, IgA
występuje w formie dimeru, a częsteczka IgM w formie pentameru. I takie nasze polimery
pospinane są łańcuchem J. Chcę zwrócić państwa uwagę, że w części N-końcowej cząstki
immunoglobuliny występują miejsca tzw. rejony zmienne. W obrębie tych rejonów zmiennych
występują tzw. rejony super-zmienne, czyli hiper-zmienne . Część C-końcowa cząsteczki tworzy
tzw. fragment stały. Jak z nazwy wynika te fragmenty zmienne są zmienne, a stałe są stałe. Od
dawien dawna zastanawiano się jak to się dzieje, że mamy taką różnorodność immunoglobulin,
które potrafią sobie radzić z antygenem i radzą sobie z antygenem.
r Teorie na temat zmienności immunoglobulin :
. Teoria instrukcyjna - wyobrażano sobie, że antygen stanowi instrukcję do tworzenia immuno-
globulin. A wydawało się to dość trywialne, że w sposób swoisty antygen ta cząsteczka immuno-

13
globuliny oplata. Oczywiście nikt tak dzisiaj nie uważa.
‚. Teoria zarodkowa - która mówiła, że dla każdego antygenu, z którym organizm może się
spotkać istnieje materiał genetyczny warunkujący budowę odpowiedniej immunoglobuliny. Ale
analiza ilości antygenów wykazała, że to DNA nie zmieściłoby się w naszym jądrze.
ƒ. Teoria somatyczna - obecnie obowiązująca , mówi o tym, że każdy z regionów w części
zmiennej, w łańcuchu ciężkim mamy trzy takie regiony V, D, J - kodowane są przez różne allele,
czyli takie małe fragmenty kodujące część super-zmienną. Tak wygląda przeciwciało limfoblasta,
a z histologii, jak pewnie wiecie, przeciwciała produkuje zaindukowany limfocyt B, czyli
plazmocyt. I na etapie przekształcania limfoblasta w limfocyt B, czyt. plazmocyt następuje
edycja DNA, czyli mamy dodatkowy element powstawania tej zmienności, czyli tak jakbyśmy
pisali na maszynie, dla odpowiednich fragmentów V, D, J - wybierane są odpowidnie fragmenty
- słowa, a korzystamy z ograniczonej liczby liter. I taki edytowany DNA trafia do limfocyta,
następnie wypętlony stanowi podstawę do syntezy przeciwciał. I jest oczywiście traktowany jak
zwykły materiał genetyczny ( ulegający obróbce posttranslacyjnej ) . Czyli mamy tutaj przykłd
składania na etapie różnicowania komórki - DNA limfocyta B jest bardziej ubogi pod względem
zawartej tam informacji niż limfoblasta. Podobny mechanizm występuje w przypadku niektórych
recep-torów występujących w limfocytach T . Jest to edycja na poziomie nie RNA a DNA.
Warto tu również zaznaczyć, że pierwotna odpowiedź immunologiczna jest związana z immuno-
globulinami M przeciwko konkretnemu antygenowi. A po jakimś czasie organizm zaczyna
wytwarzać immunoglobuliny G o tej samej swoistości. Czyli następuje przełączenie na etapie
immunoglobuliny łańcycha µ ( mi ) w łańcych γ ( gamma ), czyli między łańcuchami występują-
cymi normalnie w IgM a IgG. To zjawisko nosi nazwę switching, czyli zmiana syntezy
immunoglobuliny , ale powstanie immunoglobuliny o tej samej swoistości.
r Priony
Zainteresowanie prionami datuje się od połowy lat 70-tych. Kiedy to amerykański badacz
czeskiego pochodzenia, przebywając na wakacjach - Papua, Nowa Gwinea, spotkał się tam z
plemieniem, którego smakołykiem były mózgi przodków. Okazało się, że u tych osób -
rytualnych kanibali - rozwija się rzadkie schorzenie ośrodkowego układu nerwowego cechujące
się :
è niezbornością ruchu
è otępieniem
è śmiercią wśród konwulsyjnego śmiech co nazwano - śmiejącą się śmiercią ( obecnie : kuru ).
W dalszych latach badano mózgi tychże zmarłych i okazało się, że w poszczególnych neuronach,
cechujących się dużym stopniem zwyrodnienia - występują złogi amyloidu. Dalsze badania nie
przyniosły oczekiwanych rozstrzygnięć, aż na przełomie lat 80-90 - zidentyfikowano naturę
czynnika infekcyjnego, który powodował w przypadku zjedzenia mózgu - wystąpienie podobnej
choroby u konsumenta nie spowodowanej oczywiście działaniem złych duchów. Tym
czynnikiem okazały się być PRIONY , które obaliły podstawowy dogmat w biologii: czyli
przekaźnictwo poprzez kwasy nukleinowe. To są zakaźne cząstki białkowe, a nie kwasu
nukleinowego, jak to w przypadku dotąd poznanych cząstek występuje.
U każdego z nas występuje taki gen PRNP, który to koduje białko PRPc ( c jak cellular,
komórkowy ). Dokładnie funkcja tego białka jest nie poznana. Gdyby zmutować taki gen PRNP,
to taka komórka najprawdopodobniej dalej normalnie funkcjonuje. Jak to się dzieje, że z białka
prawidłowego, czyli takiego jakie występuje u każdego z nas, powstaje białko nieprawidłowe,
które ma skrót sc - scrapie ( PRPsc ). Scrapie to jest jedna z chorób prionowych występująca u
kóz. No może nastąpić mutacja genu w wyniku czego zamiast PRPc powstaje PRPsc. Ale
również białko prawidłowe PRPc albo spontanicznie może przekształcić się w białko
prawidłowe, albo ktoś mu o tym powie. To że dzieje się to spontanicznie najprawdopodobniej

14
zachodzi super-rzadko, a najczęściej to się dzieje tak, że temu białku ktoś mówi, żeby stało się
nieprawidłowe. Prawidłowe białko PRPc ma strukturę helikalną . I takie białko jest białkiem
prawidłowo rozpuszczanym w wodzie oraz białkiem podatnym na działanie enzymów
proteolitycznych, czyli białkiem prawidłowo degradowalnym. Natomiast gdyby przyjrzeć się
strukturze białka nieprawidłowego: to traci ono swoją strukturę helikalną i zaczyna swoim
wyglądem przypominać strukturę znanej β-harmonijki. W przypadku takiej modyfikacji, białko
to staje się białkiem nierozpuszczalnym, zaczyna się w komórkach, głównie ośrodkowego układu
nerwowego, wytrącać - powodując zwyrodnienie tych komórek i wakuolizację, czyli ogólnie
zwyrodnienia w ośrodkowym układzie nerwowym, czemu sprzyja odkładanie białka prionowego
niewrażliwego na degradację enzymami proteolitycznymi. Oprócz tego jest to białko, które
bardzo trudno uszkodzić czynnikami fizycznymi, praktycznie jest wrażliwe na skojarzenie
wysokiej temperatury z wysokim ciśnieniem, co się nazywa autoflabowaniem ( ? ), również jest
odporne na typowe środki dezynfekcyjne i można je zniszczyć praktycznie albo przy pomocy
NaOH, nadchloranu sodowego, czyli jest to struktura wyjątkowo odporna.
Unikalną właściwością białka prionowego jest to, że zarażając białko prawidłowe zmusza je do
zmiany konformacji. To zjawisko nosi nazwę - samoodwzorowania ( Autopaterning ).
Warunkiem, żeby czynnik infekcyjny, jakim jest prion, mógł się rozprzestrzenić jest to, że musi
istnieć gen PRP i musi istnieć produkowane przez niego prawidłowe białko o strukturze
helikalnej. Jeśli cząstka prionowa trafi do komórki, zaczyna oddziaływać na białko prawidłowe, i
to jest dokładnie nie poznane, ale zmusza to białko do zmiany konformacji. Struktur alfa-
helikalna zaczyna się rozciągać, i z czasem zaczyna przypominać typową beta-harmonijkę. Czyli
na matrycy białka prionowego, nieprawidłowego, białko prawidłowe zaczyna zmieniać
konformację i zarażać inne komórki. Taki jest sposób transmisji infekcji prionowej.
Zainteresowanie chorobami prionowymi jest spowodowane tym, że one mimo iż rzadkie, są coraz
częstsze.
ûChroby ludzkie :
¶ Chroba Kuru , ale ona u nas nie występuje.
¶Choroba Creuzfelda-Jakoba ( CJD - Creuzfeldt-Jakob disease ) - tą, która występuje znacznie
częściej jest choroba występująca w sposób sporadyczny, czyli bez jakiegoś uzasadnionego
działania cząstki infekcyjnej. Występuje raz na 1000.000 w populacji - jako postać sporadyczna,
bo mogą być postacie transmitowane genetycznie.
¶Zespół GSS, czyli Zespół Gerstmanna-Strausslera-Scheinkera, którego objawy są bardzo
podobne do Kuru : też się cechuje ataksją, zaburzeniami czucia, osłabieniem i postępującą
demencją, czyli otępieniem.
¶Zespół rodzinnej śmiertelnej bezsenności ( FFI - Fatal familial insomnia )- którego objawem
osiowym są problemy z zasypianiem .
ûNatomiast u zwierząt :
¶ Scrapie - najlepiej poznana
¶ Zwyrodnienie gąbczaste mózgu wołu, czyli Choroba wściekłych krów ( BSE- Bovin
spongiform encephalopathy ) No i ta choroba, której się wszyscy konsumenci boją.
ûW jaki sposób następuje transmisja chorób prionowych ?
¶sporadyczna - no musiała nastąpić jakaś mutacja, albo mutacja ''białka'' - rozumiana jako zmiana
jego konformacji, mniej więcej tak jak wygrana na loteri w TOTO-lotku, pod wzglądem
mechanizmów, ale nie pod względem reguł : raz na 1000.000 w populacji
¶rodzinna forma- czyli uwarunkowana transmisją nieprawidłowego genu PRNP,
¶nabyte formy - najlepiej poznana to jest postać związana z transmisją poprzez wyizolowane z
przysadki mózgowej - hormony. W latach 60-70, szeroko stosowano do leczenia karbowatości

15
przysadkowej - hormon wzrostu izolowany z przysadek. I u tych osób po latach, to są tzw.
infekcje spowalniające ( kiedy często po 20-stu latach ujawnia się choroba), rozwinęła się
choroba Creuzfelda-Jakoba. Inne możliwości to przeniesienie od osoby chorej podczas
implantacji rogówki, po operacjach neurochirurgicznych, czy wreszcie choroby odzwierzęce,
które wciąż pozostają pod znakiem zapytania. Czyli prawdopodobnie jest możliwa transmisja
prionów między gatunkami. ( Wcina się hamburgera, a zachorowuje się na CJD )
Wyszukiwarka
Podobne podstrony:
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
D20031152Lj id 130579 Nieznany
mechanika 3 id 290735 Nieznany
więcej podobnych podstron