
Immunologia
– prelekcja 22.10.2007
Odporność wrodzona charakteryzuje się tym że jest:
Antygenowo niezależna
Antygenowo nieswoista
Natychmiastowa
Nie pozostawia po sobie pamięci immunologicznej
Bariery anatomiczne i czynnościowe zapobiegające wtargnięciu patogenów:
Mechaniczne: ścisłe połączenia nabłonków, odruch kaszlu i kichania, wydzielanie i
przesuwanie śluzu przez rzęski błon śluzowych
Chemiczne: obecność kwasów tłuszczowych na powierzchni skóry, lizozym, kwaśne
środowisko w żołądku
Mikrobiologiczne: fizjologiczna flora bakteryjna
Inne: białka wytwarzane przez komórki śródbłonka (defensyny)
Składowe układu odpornościowego -> patrz schemat w II prelekcji.
Interesuje nas odporność nieswoista, komórkowa, czyli układ makrofagów oraz neutrofile.
Pierwsze charakteryzują się tym, że aktywowane przez limfocyty CD4Th1 wydzielać mogą cytokiny
takie jak IFN gamma, IL-2
Odporność przeciwzakaźna naturalna nieswoista:
Tworzą ją mechanizmy obecne zanim dojdzie do zakażenia konkretnym patogenem
Zaczynają działać dużo wcześniej od mechanizmów odporności swoistej, jednocześnie ściśle z
nią współpracując
W wielu przypadkach są wystarczające do ograniczenia lub eliminacji zakażenia
Nie są znane choroby autoimmunizacyjne wywołane przez mechanizmy odporności
nieswoistej, w przeciwieństwie do stanów autoagresji wywołanych przez nieprawidłowe
działanie limfocytów B i T.
Jest ukierunkowana na cząsteczki charakterystyczne dla patogenów które są niezbędne w ich
cyklu życiowym. Dzięki takiemu ukierunkowaniu patogen nie może wymknąć się działaniu
odporności nieswoistej, jak to się niekiedy dzieje w przebiegu odporności swoistej, nabytej.
Wzorce molekularne związane z patogenami – PAMP (ang. pathogen-associated molecular patterns):
Składowe ściany komórki bakteryjnej: lipopolisacharydy, peptydoglikan, kwasy tejchojowe
Mannozany w ścianie grzybów drożdżopodobnych
Formylowane peptydy bakterii
Bakteryjny DNA zawierający niemetylowane sekwencje CpG
Dwuniciowe RNA wirusów
Receptory dla cząsteczek PAMP to receptory rozpoznające wzorce – PRR (ang. pattern regognition
receptors):
Receptory wydzielane
Receptory powierzchniowe uczestniczące w fagocytozie
Receptory aktywujące komórki

Receptory PRR wydzielane – są to najczęściej opsoniny, które po przyłączeniu się do
powierzchni patogenu (bakterii, wirusa, grzyba) ułatwiają fagocytozę, np. kolektyna wiążąca
mannozę MBP.
Receptory PRR powierzchniowe uczestniczące w fagocytozie – znajdują się na powierzchni
komórek zdolnych do prezentacji antygenów (APC) i bezpośrednio wiążą charakterystyczne
struktury drobnoustrojów. Po pochłonięciu i wewnątrzkomórkowej degradacji pojedyncze peptydy
prezentowane są w połączeniu z cząsteczkami MHC klasy II. Do tej grupy receptorów zaliczamy
m. in. receptor dla mannozy oraz receptory zmiatacze (scavenger receptors) np. MARCO.
Receptory PRR aktywujące komórki – są najpowszechniejsze. Znajdują się nie tylko na
powierzchni komórek układu odpornościowego, lecz występują także na komórkach
nabłonkowych, np. w jamie ustnej, gardle, przewodzie pokarmowym, układzie oddechowym,
układzie moczopłciowym, skórze, a także na powierzchni śródbłonka naczyń i fibroblastach.
Dzięki tej rozproszonej lokalizacji, szczególnie we wrotach zakażenia, komórki nie zaliczane do
układu odpornościowego z reguły jako pierwsze rozpoznają drobnoustroje i alarmują o
potencjalnym zagrożeniu. Niektóre komórki nabłonkowe mogą samodzielnie wyeliminować
drobnoustroje – w wyniku aktywacji przez PRR wytwarzają antybiotyki peptydowe (np. beta-
defensyny) wykazujące silne właściwości bakteriobójcze.
Receptory PRR Toll-podobne (TLR, ang. Toll-like receptors)
Dotychczas zidentyfikowano dziesięć receptorów TLR.
TLR2 jest receptorem dla peptydoglikanu
TLR3 rozpoznaje dwuniciowy RNA
TLR4 wiąże LPS
TLR5 wiąże flagellinę
TLR9 jest receptorem dla niemetylowanych oligonukleotydów CpG
Udział receptorów TLR w indukcji odpowiedzi immunologicznej
TLR4 znajduje się m. in. na powierzchni komórek nabłonkowych jelit i dróg oddechowych
oraz komórek śródbłonka. Uczestniczy w rozpoznawaniu już we wrotach zakażenia. Aktywowane w
ten sposób komórki rozpoczynają wydzielanie chemokin i innych cytokin oraz defensyn, które
uczestniczą w przyciągnięciu do miejsca inwazji komórek układu odpornościowego i niszczeniu
mikroorganizmów. Przyciągnięte i wstępnie aktywowane leukocyty mogą teraz rozpocząć działanie.
Na powierzchni tych komórek również znajdują się receptory TLR. Makrofagi aktywowane przez
TLR4 wytwarzają cytokiny prozapalne, takie jak: IL-1, IL-6, IL-8, IL-12, TNF, mają zwiększone
zdolności do fagocytozy, wytwarzania reaktywnych form tlenu, wydzielania NO i prezentacji
antygenu limfocytom T.
Komórki uczestniczące w odporności wrodzonej:
Komórki żerne: neutrofile, makrofagi niszczące bakterie namnażające się
wewnątrzkomórkowo, takie jak prątek gruźlicy Mycobacterium tuberculosis
Naturalne komórki cytotoksyczne niszczące komórki zakażone wirusami i zmienione
nowotworowo
Komórki tuczne i bazofile produkujące substancje wzmacniające odpowiedź nieswoistą takie
jak histamina
Komórki dendrytyczne pracujące na połączeniu odpowiedzi swoistej i nieswoistej
(prezentacja antygenu)
Inne komórki: eozynofile, płytki krwi, erytrocyty (te ostatnie wiążą kompleksy
immunologiczne i transportują je do komórek Browicza-Kupfera wątroby)
Neutrofile
Biorą udział w fagocytozie, zabijaniu
wewnątrzkomórkowym, zapaleniu i
uszkodzeniu tkanek.
Charakterystyczna budowa jądra, w
cytoplazmie liczne ziarnistości
(rysunek)
Marker powierzchniowy CD67
Makrofagi
Biorą udział w fagocytozie i zabijaniu
wewnątrzkomórkowym.
Marker powierzchniowy CD14
Przylegają do powierzchni szklanych i
z tworzywa
Uczynniane przez cytokiny
Zabijają głównie drobnoustroje
wewnątrzkomórkowe
Zabijają komórki nowotworowe i
zakażone komórki własne
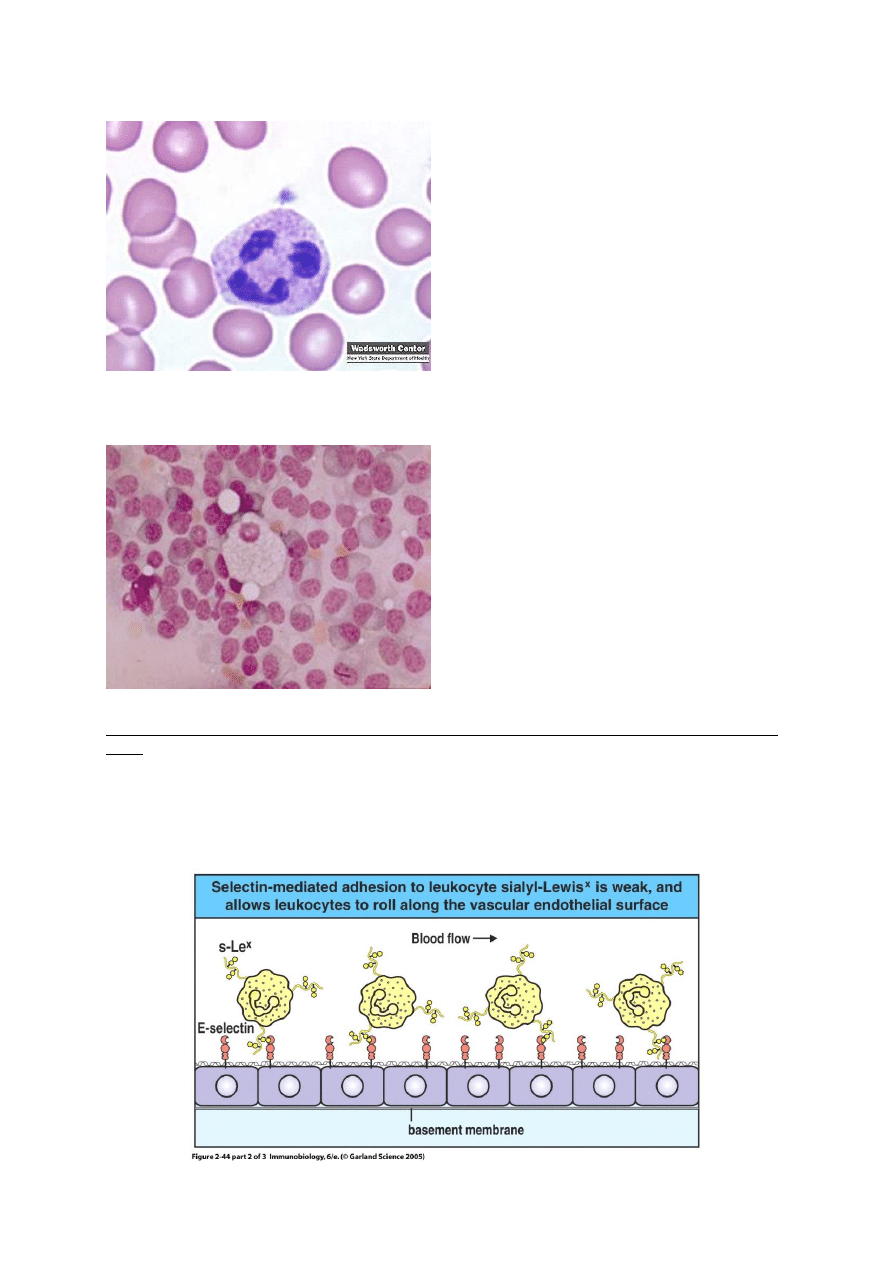
Jak leukocyty przechodzą przez ścianę naczynia, czyli o ekstrawazacji, diapedezie i chemotaksji słów
kilka.
Zanim leukocyt przejdzie przez ścianę naczynia, toczy się po niej przez pewien czas. Siłą
„trzymającą” leukocyt przy powierzchni śródbłonka jest odwracalne wiązanie obecnego w jego błonie
glikanu sLex (sialyl Lewis x) przez eksponowaną przez śródbłonek selektynę E (rysunek 1) oraz *w
mniejszym stopniu) ligandu glikoproteinowego dla selektyny P PSGL-1 przez selektynę P.
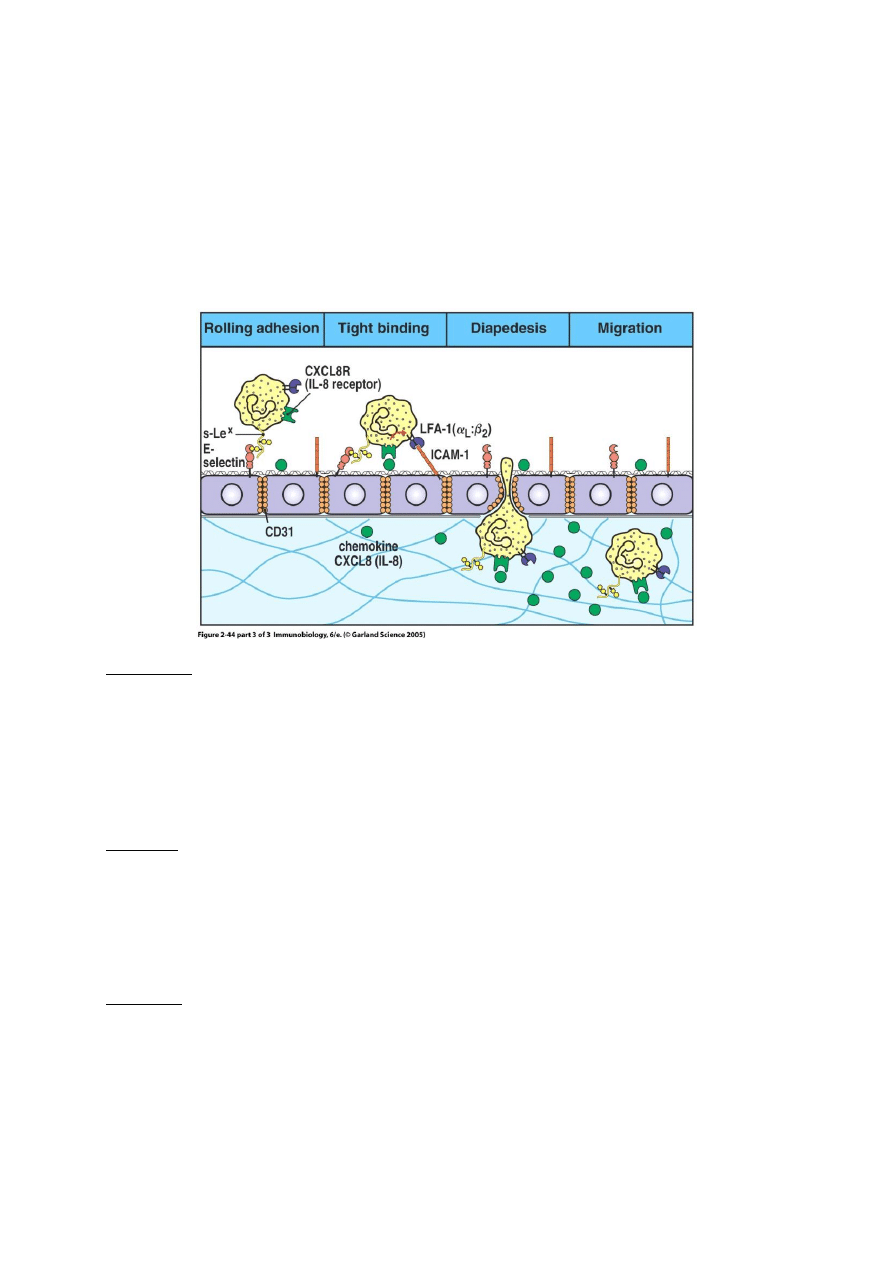
Toczenie się leukocyta po powierzchni śródbłonka przypomina nieco zachowanie się piłki
tenisowej po powierzchni z rzepami – pojedynczy haczyk rzepu nie wywiera zauważalnego działania
na piłkę, która uderza w powierzchnię i odbija się. Jednak połączone działanie adhezyjne wielu
„haczyków” (selektyn) sprawia że „piłka” (leukocyt) toczy się po powierzchni i zwalnia. Całkowite
zwolnienie ruchu leukocyta spowodowane jest związaniem obecnych w błonie leukocyta integryn
LFA-1 i CR3 przez eksponowaną przez śródbłonek cząsteczkę ICAM-1. To pozwala leukocytowi
przejść przez ścianę naczynia – wydziela on proteazy nadtrawiające błonę podstawną śródbłonka.
Widoczna również na rys.2 chemokina czyli IL-8 (wytwarzana m. in. przez makrofagi) pełni funkcję
sygnału przewodniego, wskazującego leukocytowi drogę do miejsca w którym ma on spełnić swoją
biologiczną rolę.
Chemotaksja
Czynniki chemotaktyczne przyciągają komórki żerne do miejsca infekcji. Do czynników tych należą:
Anafilatoksyny C3a i C5a uwalniane w trakcie aktywacji kaskady dopełniacza
Defensyny wytwarzane przez komórki nabłonkowe i neutrofile
IL-1, TNF, IL-8
Leukotrien LTB4 i czynnik aktywujący płytki PAF, uwalniane przez różne komórki, w tym
również neutrofile.
Aktywacja
W trakcie aktywacji leukocyty nabywają wzmożonych właściwości cytotoksycznych. Istnieją dwie
grupy czynników aktywujących makrofagi:
Pochodzenia bakteryjnego
Cytokiny - pojawiające się znacznie później czynniki uwalniane głównie przez pobudzone
komórki tuczne i limfocyty T
Fagocytoza
Komórka żerna poprzez odpowiednie receptory może rozpoznać albo bezpośrednio określone
struktury patogenu, albo pewne czynniki opłaszczające patogen i ułatwiające fagocytozę. Proces
ułatwienia fagocytozy nazywamy opsonizacją, zaś czynniki opłaszczające ułatwiające i wzmagające
fagocytozę („przyprawy” dla fagocytów) to opsoniny. Receptory uczestniczące w fagocytozie to:
Receptory dla fragmentu Fc przeciwciał
Receptory dla składników dopełniacza -> patrz prelekcja III
Receptor dla fibronektyny -> patrz prelekcja III

Dla białka C-reaktywnego
Dla białka wiążącego LPS – receptor LBP
Dla kolektyn, np. białka wiążącego mannozę
Receptory dla fragmentu Fc przeciwciał
Ich funkcją może być nie tylko indukowanie fagocytozy, ale także aktywacja komórki np. do
cytotoksyczności komórkowej zależnej od przeciwciał - ADCC, ang antibody dependent cellular
cytotoxicity. Najefektywniejszymi opsoninami są IgG.
Receptory dla składników dopełniacza
CR1 (dla C3b)
CR2 (dla C4b)
Chociaż wiążą one komórkę opłaszczoną odpowiednim składnikiem dopełniacza, to w
przeciwieństwie do FcγR nie indukują na ogół procesu fagocytozy. Aby zaszła fagocytoza poprzez
CR, komórka musi otrzymać odpowiedni sygnał aktywujący, np. poprzez interferon gamma.
Receptory makrofagów dla struktur bakteryjnych to:
Receptor mannozowy
Receptor dla LPS (CD14)
CD11b/CD18
Receptor glukanowy
Receptory typu scavenger
Bakterie wiążąc się z w/w receptorami inicjują wytwarzanie cytokin i lipidowych mediatorów
zapalenia (prostaglandyny, tromboksany).
Makrofagi trawią wewnątrzkomórkowo pochłonięte bakterie.
Szlaki niszczenia wewnątrzkomórkowego
Zabijanie wewnątrzkomórkowe dzielimy na zależne od tlenu i niezależne od tlenu. To pierwsze
może być zależne od mieloperoksydazy bądź niezależne od mieloperoksydazy. Do reakcji zależnych
od tlenu niezależnych od mieloperoksydazy zaliczamy:
Glukoza + NADP
+
- G-6-P dehydrogenaza ->
Pentoza-P + NADPH
NADPH + O
2
- Cytochrom
b558
->
NADP+ + O
2
2O
2
* + 2H
+
- Dysmutaza nadtlenkowa -> H
2
O
2
+
1
O
2
Natomiast do reakcji zależnych zarówno od tlenu jak i od mieloperoksydazy:
H
2
O
2
+ Cl
-
- mieloperoksydaza -> HOCl
-
+ OH-
OCl
-
+ H
2
O
- mieloperoksydaza ->
1
O
2
+ Cl
-
+ H
2
O
2O
2
+ 2H
+
- dysmutaza nadtlenkowa -> H
2
O
2
+
1
O
2
Mechanizmy niezależne od tlenu to na przykład:
Białka kationowe – katepsyny uszkadzające błony drobnoustrojów
Lizozym hydrolizujący mukopeptydy w ścianie komórkowej
Naturalne komórki cytotoksyczne NK
Są to duże ziarniste limfocyty LGL (ang. large
granular lymphocytes). Występują w różnych tkankach
organizmu, jednak najwięcej jest ich w krwiobiegu – 5-15%
ogólnej liczby limfocytów. Zasadniczą funkcją komórek NK
jest zabijanie własnych komórek zakażonych wirusem oraz
niektórych komórek nowotworowych. NK są identyfikowane
przez obecność CD56 i CD16, a także brak CD3. Są

uaktywniane przez IL-2 i IFN gamma do postaci komórek LAK.
Sposób rozpoznawania komórek docelowych przez NK
Komórki NK mogą wywierać efekt cytotoksyczny bezpośrednio bądź za pośrednictwem
przeciwciał w procesie ADCC.
Receptory z nadrodziny cząstek immunoglobulinopodobnych np. KIR (killer cell
inhibitor/immunoglobulin-like receptors)
Receptory lektynowe z grupy CD94/NKG2
W obrębie każdej grupy istnieją formy hamujące i stymulujące aktywność komórek NK
FcγRIII – receptor dla fragmentu Fc IgG.
Cząsteczki regulujące zabijanie
Należą do nich m. in. cząsteczki MHC klasy I. Jest to bardzo ważny mechanizm
umożliwiający komórce NK rozpoznanie komórki własnej i zignorowanie jej, gdy jest zdrowa, bądź
zabicie, gdy jest zakażona drobnoustrojami. Ignorowanie własnej komórki nie zakażonej polega na
tym że kiedy komórka NK połączy się z własną nie zakażoną komórką, wówczas receptory KIR
wysyłają jej sygnał negatywny, zapobiegający zabiciu zdrowej komórki własnego organizmu.
Podobne działanie mają receptory lektynowe z grupy CD94/NKG2. Wysyłanie sygnału o śmierci
polega na zmniejszeniu na zakażonych niektórymi wirusami komórkach, dzięki czemu komórki NK
otrzymują – poprzez odpowiednie receptory – sygnał aktywujący do zabijania zakażonych komórek.
Mechanizm zabijania - apoptoza zakażonej komórki
Efekt cytotoksyczny komórki NK wywierają na dwóch drogach:
Cytotoksyczność zależna od ziaren cytolitycznych – komórka NK uwalnia perforynę, proteazy
serynowe (granzymy), granulizyny.
Cytotoksyczność zależna od receptorów dla cząstek nadrodziny TNF z udziałem
powierzchniowej cząsteczki FasL. Jest ona ligandem dla cząsteczki Fas występującej na
powierzchni komórki zakażonej wirusami oraz TRAIL.
Cytotoksyczność zależna od ziaren cytolitycznych przebiega w następujących etapach:
Rozpoznanie i wiązanie komórki docelowej
Aktywacja komórki efektorowej prowadząca do polaryzacji ziaren w kierunku komóki
docelowej
Degranulacja i uwolnienie czynników cytotoksycznych, indukcja apoptozy
Oddzielenie komórek, recyrkulacja komórek efektorowych
Perforyna jest to białko podobne do składnika C9 dopełniacza. Po wbudowaniu się w błonę
komórkową polimeryzuje tworząc kanały, umożliwiające wniknięcie kationów Ca+, granzymów
(enzymów proteolitycznych, fragmentyny), granulolizyny do wnętrza komórki docelowej.
Cytotoksyczność zależna od receptorów dla cząstek nadrodziny TNF
Oparta jest na interakcji ligandów wytwarzanych przez komórki efektorowe: FasL/Apo-IL
(CD95L), TRAIL ze swoistymi receptorami obecnymi na komórkach docelowych zawierających w
części cytoplazmatycznej tzw. „domenę śmierci”. Konsekwencją tej interakcji jest przekazanie
sygnału do komórki docelowej indukującego mechanizmy komórkowe prowadzące do aktywacji
kaspaz i apoptozy. Aktywowane komórki NK pod wpływem IL-2, IL-12 są znacznie efektywniejsze,
jeśli chodzi o efekt cytotoksyczny, w porównaniu do NK spoczynkowych. Jest to następstwem m. in.
wzmożonego wydzielania przez nie chemokin, cytokin. Niektóre cytokiny mogą wywierać
bezpośredni efekt cytotoksyczny (np. TNF), inne działają pośrednio, aktywując np. makrofagi (IFN
gamma).

Cytotoksyczność komórkowa zależna od przeciwciał – ADCC
Przeciwciała opłaszczają komórkę docelową warunkując swoistość reakcji, natomiast komóki
efektorowe, wiążąc fragment Fc tych przeciwciał, warunkują efekt cytotoksyczny. Do komórek
efektorowych zaliczamy NK, makrofagi, monocyty, niektóre limfocyty T, neutrofile, eozynofile, a
także trombocyty. Kiedyś komórki uczestniczące w ADCC nazywano komórkami K (killer).
Makrofagi, monocyty i neutrofile wywierają efekt ADCC wobec erytrocytów, a także w pewnym
stopniu wobec komórek nowotworowych, komórki NK niszczą komórki nowotworowe oraz zakażone
wirusem, zaś eozynofile, podobnie jak trombocyty (także monocyty) uczestniczą w ADCC
ukierunkowanej na pasożyty (np. larwy Schistosoma). Niektóre cytokiny wzmagają efekt ADCC (np.
zwiększając ekspresję FcR): IFN gamma aktywuje makrofagi i neutrofile, IL-2 aktywuje komórki NK.
W reakcjach ADCC uczestniczą IgG oraz IgE, a przede wszystkim IgG1 i IgG3, co związane jest z ich
dużym powinowactwem do odpowiednich receptorów FcγR (FcγR I – monocyty, makrofagi,
FcγRIIIA/CD16 – komórki NK). IgE uczestniczą w odpowiedzi przeciw pasożytom w ADCC z
udziałem komórek mających receptor FcεRII, takich jak eozynofile, trombocyty i makrofagi. Efektem
jest wyzwolenie mechanizmów cytotoksycznych i ewentualnie wydzielanie cytokin.
Komórki tuczne i bazofile
Komórki tuczne występują w tkance łącznej w różnych miejscach organizmu, szczególnie pod
nabłonkiem dróg oddechowych, moczopłciowych i przewodu pokarmowego. Bazofile występują w
niewielkiej ilości w krwiobiegu (<0,2% wszystkich granulocytów). Zarówno bazofile jak i kom.
tuczne charakteryzują się zbliżoną morfologią, zawierają w cytoplazmie ważne dla ich funkcji
ziarnistości. Uwalnianie ziarnistości z kom. tucznych i bazofilów zachodzi pod wpływem wiązania
C3a i C5a (anafilatoksyn), krzyżowego wiązania ich powierzchniowych receptorów FcεR przez IgE i
alergeny. Wydzielana jest histamina, zwiększająca przepuszczalność naczyń krwionośnych, cytokiny
TNF-α i IL-8 przyciągające neutrofile i eozynofile, a także PAF przyciągający bazofile.
Komórki dendrytyczne
Działają na styku odporności nabytej i wrodzonej, rozpoznają antygeny bakteryjne przez
nieswoiste receptory. Ich rola polega na przetwarzaniu i prezentacji antygenów peptydowych
limfocytom T.
Eozynofile
Są obecne w niewielkiej ilości w krwiobiegu (2-5% leukocytów krwi). Wykazują bardzo słabą
aktywność fagocytarną i odpowiedzialne są głównie za zewnątrzkomórkowe zabijanie dużych
pasożytów, które nie mogą być sfagocytowane. Zwykle przyłączają się do pasożytów opłaszczonych
przeciwciałami za pomocą receptorów Fc i degranulują na powierzchnię pasożyta. Ziarnistości
zawierają peroksydazę i toksynę zabijającą pasożyta. Uwalniana histaminaza ma właściwości
przeciwzapalne.
Płytki krwi
Odgrywają główną rolę w procesie krzepnięcia krwi, jednak aktywowane wydzielają
mediatory aktywujące dopełniacz, co prowadzi do gromadzenia leukocytów w miejscu uszkodzenia
tkanki spowodowanego urazem lub infekcją
Erytrocyty
Są wyposażone w powierzchniowe receptory dla dopełniacza, wiążące małe krążące kompleksy
immunologiczne związane z dopełniaczem, po czym transportują te kompleksy do wątroby, gdzie są
one fagocytowane przez kom. Kupfera. Tak więc odpornościowa funkcja erytrocytów polega na
usuwaniu z krążenia kompleksów immunologicznych powstających podczas przewlekłych infekcji.
PS. x-dandi ma u Was kolejne piwo :)
Wyszukiwarka
Podobne podstrony:
03 Immunologia prelekcja 10 15 2007id 4167 (2)
05 Immunologia prelekcja 10 29 2007id 5532 (2)
01 Immunologia prelekcja 10 01 2007id 2618 (2)
02 Immunologia prelekcja 10 08 2007id 3412 (2)
03 Immunologia prelekcja 10 15 2007id 4167 (2)
10 Immunologia prelekcja 12 02 2007id 10554 (2)
08 Immunologia prelekcja 11 19 2007id 7260 (2)
Immunologia - prelekcja 10.08.2007(1), 1.Lekarski, II rok, Immunologia, Prelekcje
09 Immunologia prelekcja 11 26 2007id 7759 (2)
06 Immunologia prelekcja 11 05 2007id 6134 (2)
Immunologia - prelekcja01 1.10.2007, IMMUNOLOGIA
13 Immunologia prelekcja 12 17 2007id 14455 (2)
07 Immunologia prelekcja 11 12 2007id 6717 (2)
Immunologia - prelekcja11 10.12.2007, IMMUNOLOGIA
Immunologia - prelekcja 10.15.2007, nauki BIOLOGiczne, medycyna, IMMUNOLOGIA
Immunologia - prelekcja 10.29.2007, immunologia
więcej podobnych podstron