
Immunologia - prelekcja 15.10.2007
Odporność nieswoista humoralna
Odpowiedź nieswoista cechuje się tym że:
Jest szybka, natychmiastowa
Receptory rozpoznające drobnoustroje są niezmienne w ciągu życia osobnika, kolejnych
pokoleń (dziedziczne)
Jest selektywna (celem ataku nie są własne struktury)
Nie pozostawia po sobie trwałej pamięci immunologicznej
Rozwija się niezależnie od odpowiedzi swoistej
Nieswoiste mechanizmy obronne to przede wszystkim:
Skóra (rogowacjejący nabłonek, pot, łój)
Drogi oddechowe (kaszel, kichanie, wydzieliny śluzowo-surowicze)
Przewód pokarmowy (kwas solny, perystaltyka, złuszczanie się nabłonka, fizjologiczna flora
bakteryjna produkująca kolicyny – substancje o charakterze bakteriobójczym zabijające
bakterie zwłaszcza szczepów pokrewnych E. coli)
Krew, wydzieliny (laktoferyna, transferyna, interferony, lizozym)
Układ dopełniacza, białka ostrej fazy, lizozym, komórki żerne i NK
PAMP (ang. pathogen-associated molecular patterns, molekularne wzorce budowy patogenów) to
najbardziej charakterystyczne struktury drobnoustrojów, selektywnie rozpoznawane w odpowiedzi
nieswoistej. Zaliczamy do nich między innymi lipopolisacharydy, peptydoglikan, polisacharydy
bakterii (składniki ściany), zymosan, mannany, dwuniciowy RNA. Receptory dla PAMP dzielą się
na wolne (opsoniny) i związane z powierzchnią komórek – te ostatnie mogą uczestniczyć w procesie
fagocytozy oraz aktywacji komórek, np. nabłonkowych.
Cząsteczki uczestniczące w mechanizmach odporności wrodzonej to:
Białka ostrej fazy
Kolektyny
Peptydy antybakteryjne
Lizozym
Cytokiny i interferony -> patrz kolejne prelekcje
Białka ostrej fazy (APP, ang. acute phase proteins) stanowią stały fizjologiczny składnik surowicy, w
razie konieczności uczestniczący w odpowiedzi immunologicznej. Syntetyzowanie są głównie w
wątrobie, zwykle na skutek stymulacji bakteryjnej. W warunkach fizjologicznych ich stężenie w
surowicy jest małe lub śladowe, a pod wpływem stymulacji gwałtownie wzrasta w ciągu paru godzin
(choć może też maleć w wypadku negatywnych białek ostrej fazy, np. transferyny). Mogą być również
wytwarzane w odpowiedzi na cytokiny IL-1, IL-5, TNF, IFN-gamma produkowane przez aktywowane
makrofagi i komórki NK. Główne funkcje APP to:
Wzmaganie aktywacji dopełniacza
Funkcja opsonin – głównie CRP, kolektyny, białko wiążące mannozę MBP oraz składniki
dopełniacza.
Wzmaganie zabijania drobnoustrojów
Hamowanie wzrostu bakterii przez białka wiążące jony metali (odbieranie bakteriom
potrzebnych mikroelementów) – transferyna, laktoferyna, ceruloplazmina, haptoglobina.
Ograniczanie uszkodzenia tkanek spowodowanego przez bakterie, urazy, nowotwory,
reumatoidalne zapalenie stawów – fibrynogen wspomaga krzepnięcie krwi, inhibitory proteaz
neutralizują enzymy lizosomalne uwalniane w czasie fagocytozy

Fibronektyna wiąże się z włóknikiem, zdenaturowanym, „pociętym” kolagenem, a także
bezpośrednio z niektórymi bakteriami (np. gronkowcem złocistym), indukując przez swe receptory na
komórkach żernych fagocytozę. Za pośrednictwem tego receptora makrofagi mogą fagocytować
fragmenty uszkodzonych tkanek i ciała obce, na których odłożył się włóknik.
Białko CRP wiąże się z fosfocholiną bakterii, aktywuje dopełniacz (łączy się z C1q) oraz pełni
funkcję opsoniny. Jego nazwa pochodzi od zdolności do wiązania się z wielocukrem C
pneumokoków. Ilościowe oznaczanie tego białka u pacjentów z chorobami zapalnymi
wykorzystywane jest do monitorowania bieżącej aktywności zapalnej w przebiegu choroby. Wysoki
poziom CRP oznacza ostry przebieg choroby.
Surowiczy amyloid A (SAA) aktywuje dopełniacz (łączy się z C1q) oraz pełni rolę opsoniny.
Białko wiążące mannozę MPB łączy się z mannozą na powierzchni bakterii, a następnie z
receptorami dla MPB (opsonizacja) oraz aktywuje dopełniacz.
Białko wiążące LPS łączy się ze ścianą komórek bakteryjnych.
Kolektyny to grupa rozpuszczalnych białek zdolnych do wiązania oligosacharydów na powierzchni
niektórych drobnoustrojów. Strukturalnie przypominają one składnik C1q dopełniacza. Receptory dla
kolektyn na makrofagach ułatwiają usunięcie i zniszczenie bakterii do których przyłączyły się
kolektyny. Do kolektyn należą białko wiążące mannozę, konglutyniny, białka A i D surfaktantu
płucnego.
Peptydy antybakteryjne wytwarzane są przez wiele różnych komórek, w tym komórki nabłonkowe i
żerne. Odgrywają one ważną rolę w usuwaniu infekcji bakteryjnych w reakcjach odporności
wrodzonej. Działanie antybakteryjne wykazują one na drodze różnych mechanizmów. Należą do nich
m. in. cekropiny, magaininy i defensyny. Dwie pierwsze grupy powodują lizę, inne zaś interferują z
transportem jonów. Peptydy przeciwbakteryjne wykazują aktywność zarówno przeciw bakteriom
Gram-ujemnym jak i Gram-dodatnim. Jest to jeden z najstarszych ewolucyjnie mechanizmów
obronnych. Ostatnimi czasy peptydy przeciwbakteryjne wzbudzają zainteresowanie medycyny jako
leki – podjęte próby kliniczne z zastosowaniem peptydów kationitowych dały zadowalające wyniki m.
in. w leczeniu owrzodzeń w przebiegu cukrzycy, profilaktyce zapalenia śluzówki jamy ustnej po
chemioterapii, infekcji u dzieci z mukowiscydozą i wielu innych schorzeń.
Lizozym (muraminidaza) należy do białek kationowych. Odkryty został na początku lat 20. XX w.
przez Fleminga. Obecny jest w ziarnistościach komórek żernych, a także w osoczu krwi, łzach, ślinie
oraz wydzielinach śluzowo-surowiczych dróg oddechowych. Jego biochemiczne działanie polega na
hydrolizie wiązania beta-1,4-glikozydowego między kwasem N-acetylomuraminowym i N-
acetyloglukozaminą, które stabilizuje ścianę komórek bakteryjnych. Działa na wszystkie bakterie
Gram-dodatnie z wyjątkiem Staphylococcus aureus.
Lizozym oznaczamy za pomocą następującej próby mikrobiologicznej: do żelu agarozowego
dodajemy bakterii Micrococcus lisodeicticus, po czym nakrapiamy badaną wydzielinę z lizozymem.
Rozbijanie ścian bakteryjnych daje przejaśnienia, których średnicę oceniamy, by ilościowo oznaczyć
poziom lizozymu w badanej wydzielinie. Jest to bardzo trudna metoda ze względu na niewielką
widoczność przejaśnień.
Wykonanie praktyczne:
Do 50 ml 2% r-ru agarozy wprowadzić zawiesinę bakterii Micrococcus lisodeicticus. Agarozę z
zawiesiną szczepu rozlać (po 25 ml) do jałowych płytek Petriego. Po zastygnięciu agarozy wyciąć
4mm dołki, dodać po 50 ul badanych surowic i r-rów wzorcowych o znanym stężeniu lizozymu
(kolejne rozcieńczenia lizozymu kurzego). Inkubować 24h w temp. 37 st. C w cieplarce w komorze
wilgotnej. Po inkubacji widoczne strefy przejaśnienia wokół dołków.
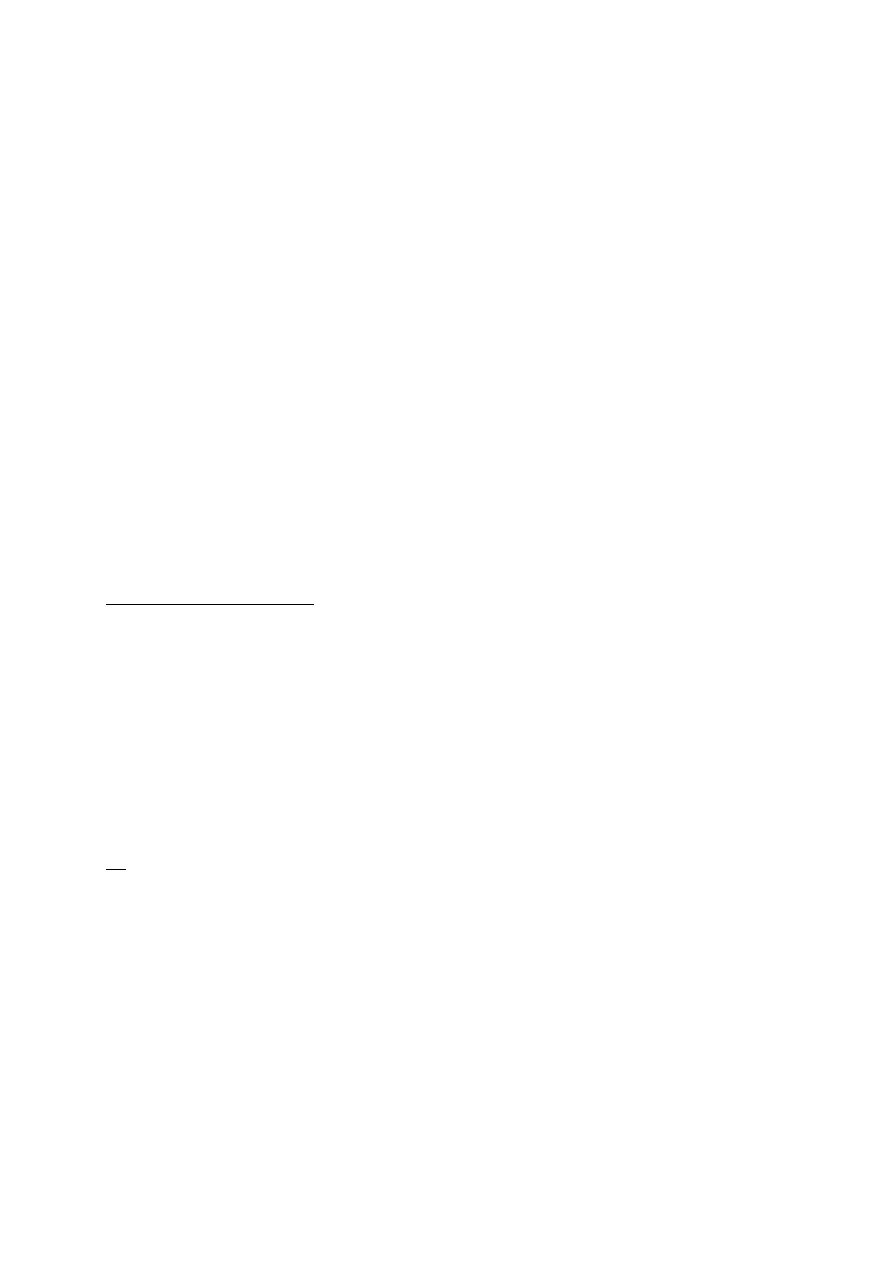
Układ dopełniacza
System dopełniacza (C, complement) zbliżony do obecnie występującego u ssaków, zidentyfikowano
także u ryb, płazów, gadów oraz ptaków. Drogi aktywacji alternatywnej drogi dopełniacza
ukształtowały się prawdopodobnie ok. 600 mln lat temu – stąd wniosek że układ ten jest bardzo stary
ewolucyjnie. Terminu „dopełniacz” użył po raz pierwszy Ehrlich w opisie aktywności surowicy, która
może „dopełnić” zdolność swoistego przeciwciała do wywołania lizy bakterii.
Podstawowe funkcje dopełniacza to:
Obrona przeciwzakaźna (opsonizacja, liza)
Aktywacja fagocytów
Degranulacja kom. tucznych i bazofilów prowadząca do lokalnego wydzielania stymulatorów
odczynu zapalnego
Współpraca odpowiedzi nieswoistej ze swoistą
Usuwanie zbędnych produktów - kompleksów immunologicznych, komórek apoptotycznych
Opsonizacja to zjawisko ułatwiania fagocytozy (zwłaszcza drobnoustrojów) w obecności surowicy,
szczególnie odpornościowej. Czynnikami ułatwiającymi opsonizację – opsoninami – są składniki
surowicy: przeciwciała IgG i IgM, kolektyny, białko CRP oraz fragmenty dopełniacza.
Na układ dopełniacza składają się białka, enzymy, układy pozytywnej i negatywnej regulacji oraz
receptory. Należy do niego ok. 40 białek występujących w surowicy i płynach ustrojowych w postaci
nieaktywnej, podlegających kaskadowej aktywacji, oraz białka regulatorowe. Miejscem ich syntezy są
głównie hepatocyty, a także monocyty/markofagi i fibroblasty. Najwyższe stężenie w surowicy osiąga
składowa C3 (1200 ul/ml).
Kaskada aktywacji dopełniacza
Aktywacja dopełniacza polega na serii zarówno enzymatycznych jak i nieeznymatycznych reakcji o
charakterze kaskadowym. Każda z trzech dróg aktywacji prowadzi do utworzenia dwóch enzymów o
charakterze proteaz: konwertzy C3 i konwertazy C5. Mają one zdolność wzmacniania kaskady
aktywacji. Końcowe etapy wszystkich dróg aktywacji są dla nich wspólne, a ich celem jest utworzenie
kompleksu atakującego błonę MAC (ang. membrane attacking complex).
Kolejność cyfr oznaczających kolejne białka dopełniacza (C – complement) nie jest związana z
kolejnością ich udziału w kaskadzie aktywacji dopełniacza, chociaż w znacznym stopniu się z nią
pokrywa. Dotyczy to jedynie odkrytej jako pierwsza, klasycznej drogi aktywacji dopełniacza. Białka
biorące udział w pozostałych drogach nie są oznaczane cyframi. W drodze alternatywnej biorą udział
czynniki B, D, H, I oraz P (properdyna), natomiast w drodze lektynowej – białko wiążące mannozę
MBP i inne kolektyny, a także proteazy MASP-1 i MASP-2, u człowieka także fikoliny L i H.
C3
Jest głównym białkiem kaskady aktywacji dopełniacza, na nie bowiem działają konwertazy utworzone
w wyniku działania wszystkich trzech dróg dopełniacza. Zbudowane jest z dwóch łańcuchów
polipeptydowych, fizjologiczne stężenie C3 w surowicy wynosi 1200 ug/ml. Sytnetyzowane jest w
wątrobie, monocytach, makrofagach, a także płucach, skórze, astrocytach oraz tkance tłuszczowej.
Nieaktywowane przez konwertazę białko C3 bierze udział w opsonizacji, natomiast jego składowe:
C3a wraz z C5a i C4a bierze udział w chemotaksji i aktywacji leukocytów
C3b bierze udział we wzmaganiu odpowiedzi humoralnej oraz rozwoju pamięci
immunologicznej - wraz z C4b, związanym kompleksem Ag:Ab odpowieddnio przez
receptory CR2 na limf. B oraz CR2 i CR3 na komórkach dendrytycznych grudek
Fragmenty C3 wraz z C1q i fragmentami C4 biorą udział w usuwaniu kompleksów
immunologicznych oraz komórek apoptotycznych.
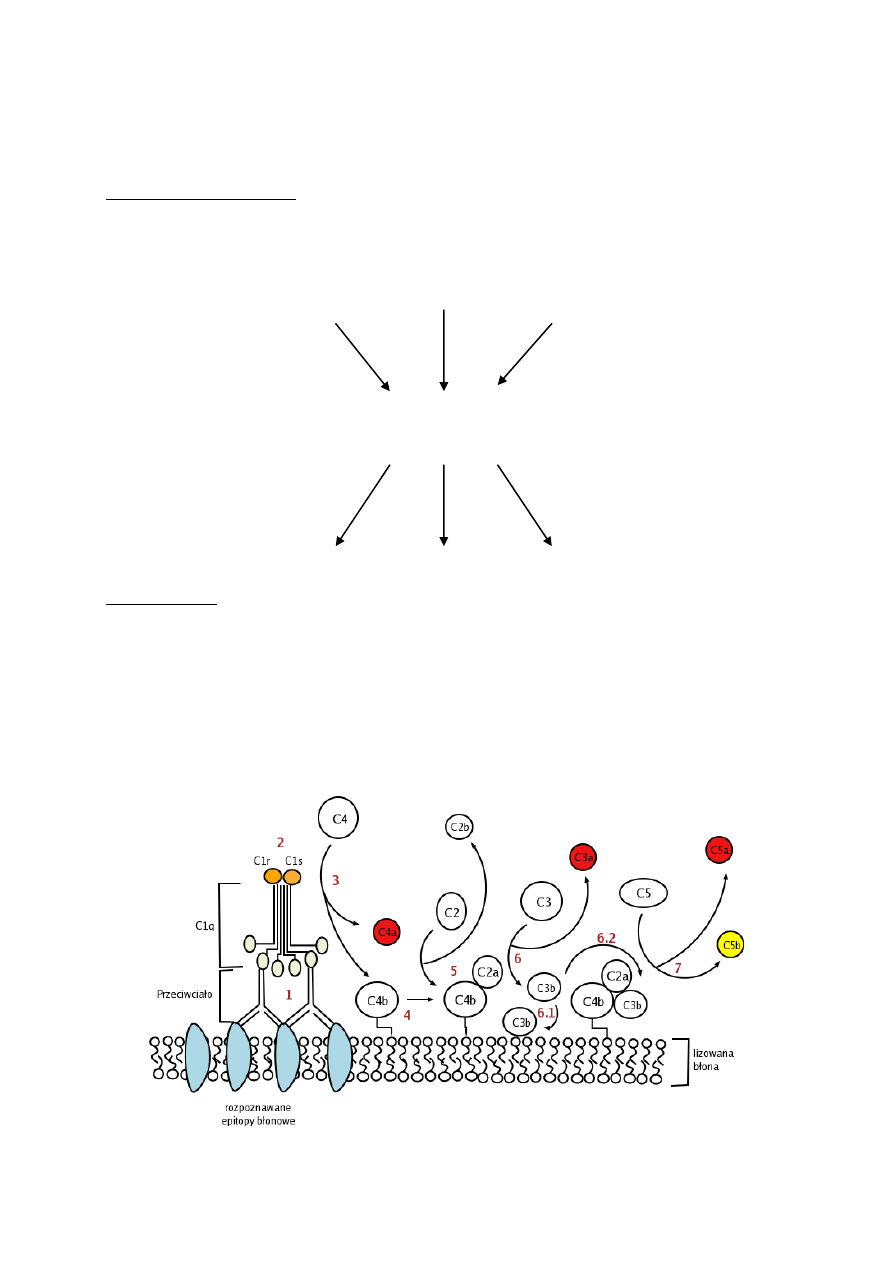
Drogi aktywacji dopełniacza
Klasyczna
Kompleksy immunologiczne
(IgM, IgG)
Elementy strukturalne na
powierzchni drobnoustrojów
Lektynowa
Elementy strukturalne na
powierzchni drobnoustrojów
zawierające mannozę
Alternatywna
Elementy strukturalne na
powierzchni drobnoustrojów
AKTYWACJA
Odczyn zapalny
Opsonizacja
Liza
Droga klasyczna
Charakteryzuje ją zależność od przeciwciał związanych z antygenem w kompleksy immunologiczne.
Dlatego właśnie układ zyskał nazwę dopełniacza – dopełnia bowiem funkcję przeciwciał, które same
w sobie nie są zdolne do zniszczenia komórki drobnoustroju lub pasożyta. Zdolność do aktywacji tej
drogi dopełniacza mają immunoglobuliny IgG (z wyjątkiem G4) oraz IgM.
Składnik C1 fizjologicznie składa się z dwóch odwracalnie połączonych ze sobą podjednostek C1q
oraz tetrameru C1r2s2.
Przebieg drogi klasycznej aktywacji dopełniacza jest następujący:
1. Przeciwciała przyłączają się do epitopów, co powoduje ich zmiany konformacyjne, a
następnie do powstałych kompleksów immunologicznych przyłącza się cząsteczka C1q,
kształtem podobna do wiązki sześciu tulipanów. Wiązanie C1q z jednym kompleksem
immunologicznym jest słabe, ale związanie dwóch lub więcej sąsiadujących ze sobą
kompleksów przez odpowiednią liczbę „główek tulipanów” znacznie zwiększa siłę wiązania,
dzięki czemu może zajść dalsza aktywacja dopełniacza.
2. W C1q zachodzi zmiana konformacyjna, która powoduje zmianę konformacyjną w obrębie
C1r, eksponując miejsce enzymatyczne o właściwościach proteazy serynowej. Następnie
poprzez ograniczoną proteolizę zachodzi trwała już aktywacja kolejnej proteazy serynowej
C1s.
3. Aktywowana C1s rozkłada białka C4 i C2. Najpierw rozkładany jest C4, z którego powstają
fragmenty C4a i C4b. Pierwszy z nich, uwolniony do środowiska, pełni funkcję
anafilatoksyny – patrz niżej.
4. C4b łączy się z błoną komórkową poprzez zawarte w niej białka i cukry. Po przyłączeniu C4b
do błony następuje
5. przyłączenie C2 do C4b, po czym C2 zostaje rozłożony do C2a i C2b przez C1s. Powstały
kompleks C4bC2a jest to konwertaza C3 drogi klasycznej, najistotniejsza dla prawidłowego
działania układu dopełniacza
6. Konwertaza C3 rozkłada C3 do C3a (kolejna anafilatoksyna) i C3b, a ten z kolei może
przyłączyć się do błony komórkowej patogenu (6.1), lub do konwertazy C3, tworząc
kompleks C4b2a3b, czyli konwertazę C5 drogi klasycznej.
7. Konwertaza C4 rozkłada białko C5 do anafilatoksyny C5a i fragmentu C5b, który bierze
udział we wspólnej końcowej drodze aktywacji dopełniacza – tworzeniu kompleksu MAC.
Opisane wyżej konwertazy znacznie wzmacniają efekt aktywacji – jedna konwertaza C3 produkuje
setki tysięcy cząsteczek C3b, z których każda może utworzyć konwertazę C5. Każda z tych konwertaz
C5 może wyprodukować sporo cząsteczek C5b, każda z nich zaś może utworzyć jeden kompleks
MAC. W warunkach fizjologicznych jednak znaczna część cząsteczek C3b nie bierze udziału ani w
reakcjach aktywacji dopełniacza, ani w opsonizacji patogenów, ponieważ ze względu na swoją
wysoką reaktywność łączą się one z białkami w płynie tkankowym lub z wodą. Wytworzenie
nadmiaru C3b jest więc niezbędne do aktywacji układu dopełniacza w ogóle, niemniej amplifikacyjna
funkcja konwertaz jest bardzo istotna. Podobną rolę, jako „producent” C4b odgrywa składnik C1s.
Droga alternatywna (poperdynowa)
Droga ta rozpoczyna się spontanicznie i atakuje każdą dostępną błonę biologicznym, jest jednak
unieszkodliwiana na komórkach własnego organizmu.
1. W osoczu krwi występuje białko C3(H
2
O) podobne do składnika C3b drogi klasycznej. Wiąże
ono czynnik B, który w obecności jonów Mg+ i czynnika D zostaje rozbity na fragmenty Ba i
Bb.
2. Fragment Ba wydostaje się do środowiska reakcji, natomiast fragment Bb wiąże się z
C3(H
2
O). Powstały kompleks ma aktywność enzymatyczną, jest to (rozpuszczalna)
konwertaza C3 drogi alternatywnej.
3. Konwertaza ta rozkłada C3 tworząc fragmenty C3a i C3b – analogicznie do drogi klasycznej.
Pierwszy fragment jest anafilatoksyną, drugi zaś łączy się z błoną komórkową.
4. Związany z błoną C3b przyłącza czynnik B, który – analogicznie do powyższej reakcji –
rozbijany jest do Ba i Bb. Po raz kolejny utworzona zostaje konwertaza C3 drogi
alternatywnej, tym razem związana z błoną komórkową i dodatkowo stabilizowana
czynnikiem P, czyli properdyną (stad druga nazwa drogi – properdynowa).
5. Konwertaza C3 rozkłada C3 do C3a i C3b. Ten ostatni – podobnie jak powyżej – przyłącza się
do błony komórkowej i łączy się z czynnikiem B, dając początek kolejnej konwertazie C3
(dodatnie sprzężenie zwrotne), lub przyłącza się do już istniejącej konwertazy C3, tworząc
kompleks C3bBb3b czyli konwertazę C5 drogi alternatywnej.
6. Analogicznie do drogi klasycznej konwertaza C5 rozkłada C5 do anafilatoksyny C5a i
fragmentu C5b, który tworzy MAC.
Powiązanie dróg klasycznej i alternatywnej zachodzi dzięki czynnikowi C3b, bowiem
wytworzony w drodze klasycznej C3b może po związaniu się z błoną tworzyć konwertazę C3
drogi alternatywnej.
Droga lektynowa
Jest podobna do drogi klasycznej, różnią się one jedynie pierwszymi etapami. W drodze lektynowej
antygen nie musi być rozpoznany przez przeciwciała (niezależna od niedoborów humoralnych) – są
one zastąpione przez białka nieswoiście wiążące cukry, czyli kolektyny. Białka te posiadają domeny
lektynowe oraz długie ogonki o strukturze podobnej do kolagenu.
Kolektyna zapoczątkowująca drogę lektynową to białko wiążące mannozę MBL, występujące w
osoczu. Budową przypomina ono czynnik C1q, posiada bowiem sześć główek umieszczonych na
kolagenopodobnym trzonie:
Ogonek ten może wiązać proteazy serynowe MASP-1 oraz MASP-2. Gdy MBL zwiąże się z
powierzchnią antygenu, w ogonku zachodzi zmiana konformacyjna, co powoduje aktywację MASP-1.
Ta z kolei dokonuje proteolitycznego cięcia, a zarazem aktywacji MASP-2. Eznym ten ma zdolność
rozkładania C2 i C4. Dalsze etapy reakcji są identyczne jak w drodze klasycznej. Kompleks
kolektyna-MASP-1-MASP-2 zastępuje więc przeciwciało, jak i C1q, C1r i C1s drogi klasycznej.
Ze względu na swoje właściwości i wczesne pojawienie się w filogenezie MBL określana jest
„paraprzeciwciałem”.
Droga alternatywna oraz lektynowa umożliwiają organizmowi natychmiastową reakcję obronną zaraz
po wniknięciu do niego patogenu, droga klasyczna wymaga bowiem utworzenia swoistych
przeciwciał, co następuje dopiero po pewnym czasie od infekcji.
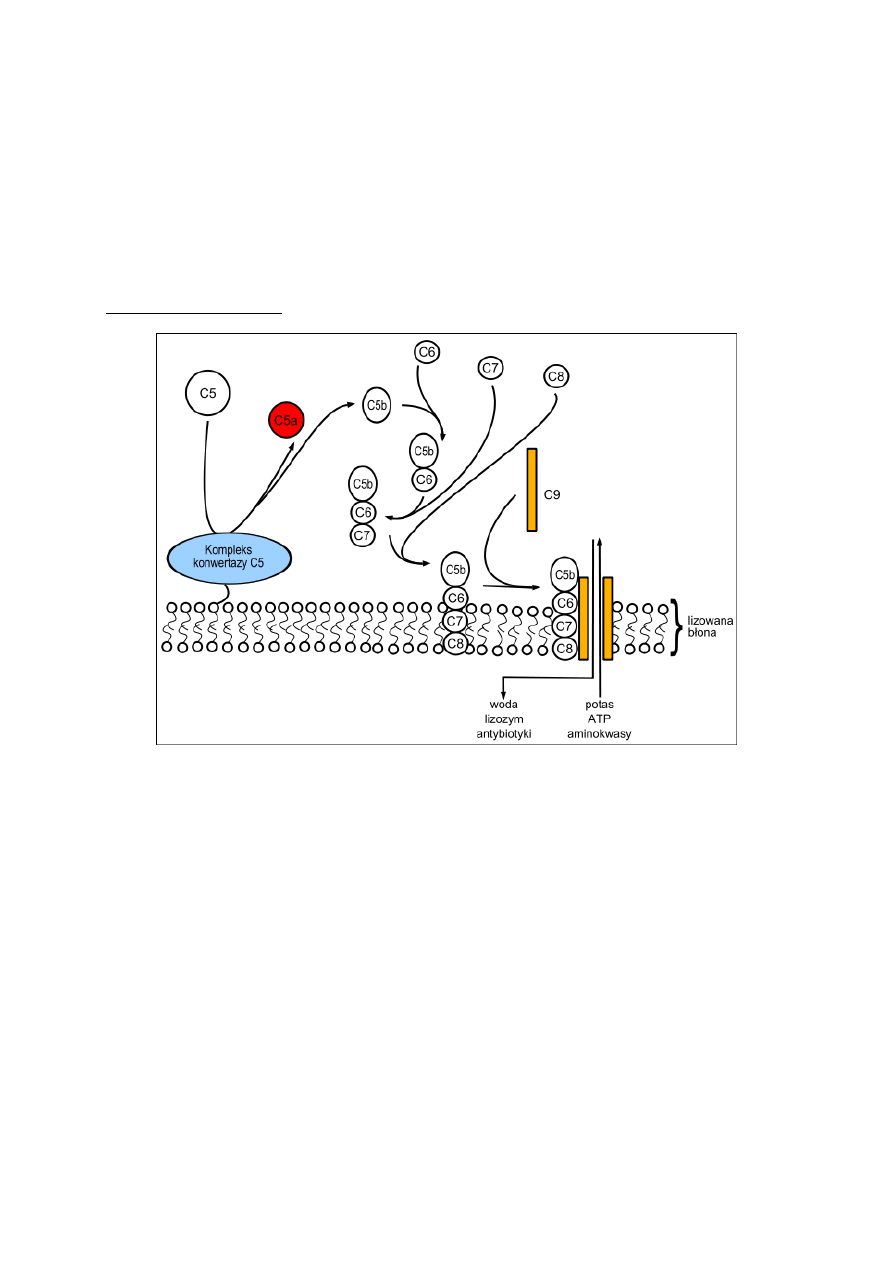
Kompleks atakujący błonę
Powstaje on w wyniku reakcji nieenzymatycznych, Po wytworzeniu fragmentu C5b – na dowolnej
drodze – dochodzi do jego połączenia się z C6. Następnie do powstałego kompleksu dołączane są C7 i
C8. Powstaje kompleks C5b-8, który ma zdolność włączania się w błonę komórkową (co powoduje
reorientację lipidów błony i jej deformację) i przyłączania cząstek C9. Przyłączenie 2-14 takich
cząstek tworzy w błonie komórkowej nie regulowany kanał jonowy, którego średnica zależy od liczby
przyłączonych C9. Przez kanał ten z komórki wypływają jony K+, ATP, makromolekuły, wpływa
natomiast woda, jony Na+ i inne, a także lizozym oraz antybiotyki. Do zabicia jednej komórki E. coli
potrzebne jest od kilkudziesięciu do kilkuset kompleksów MAC.
Wrażliwe na działanie MAC są bakterie Gram-ujemne, niektóre wirusy, pierwotniaki i mykoplazmy.
Bakterie Gram-dodatnie bronią się przed dopełniaczem grubą warstwą peptydoglikanu.Dopełniacz
może także niszczyć erytrocyty i komórki jądrzaste, np. zakażone wirusem.
Działanie MAC nie jest prawdopodobnie najistotniejszym efektorem działania układu dopełniacza. O
wiele skuteczniejszym sposobem eliminacji komórek patogenów oraz zmienionych patologicznie
komórek organizmu jest immunofagocytoza, w której udział biorą m. in. związane z błoną komórkową
jako opsoniny składniki dopełniacza. Mimo to osoby z defektem genetycznym dotyczącym któregoś
ze składników dopełniacza cechują się znacznie niższą odpornością na zakażenia niektórymi
bakteriami, np. Neisseria meningitidis i Neisseria gonorrheae.
Końcowe składniki aktywacji dopełniacza, odkładające się w błonie komórkowej w ilościach
podprogowych i nie powodując zabicia komórki, mogą stymulować proliferację komórek.

Mechanizmy chroniące bakterie przed litycznym działaniem dopełniacza stanowią:
Ochronna rola komórkowych struktur powierzchniowych (lipopolisacharydów, białek
powierzchniowych, otoczek)
Proteolityczna degradacja białek dopełniacza
Proteolityczna degradacja immunoglobulin
Funkcje składowych układu dopełniacza:
Obrona przeciwzakaźna
o Opsonizacja (C3b i C4b)
o
Zabijanie komórek bakteryjnych oraz zakażonych komórek gospodarza (C5b-9)
Składniki C3a i C5a wykazują właściwości chemotaktyczne wobec monocytów i neutrofili
(rekrutacja komórek zapalnych do strefy zapalenia i ich aktywacja)
Silne induktory stanu zapalnego to:
Składniki dopełniacza C3a, C4a, C5a zwane anafilatoksynami
Powodują dgranulację kom. tucznych i bazofilów i uwalnianie mediatorów anafilaksji
Stymulują syntezę metabolitów kw. arachidonowego
Powodują zwiększenie przepływu krwi, przepuszczalności naczyń włosowatych co ułatwia
przechodzenie przez śródbłonek naczyń krwionośnych mediatorów istotnych z punktu
widzenia trwającej reakcji zapalnej
Usuwanie kompleksów immunologicznych z krążenia umożliwia wygasanie odczynu zapalnego po
usunięciu patogenu ze środowiska wewnętrznego ustroju. Kompleksy opsonizowane przez C3b mogą
być usuwane z krążenia poprzez wiązanie do receptorów C1 krwinek czerwonych, które następnie
transportowane z krwią do wątroby zostają usunięte przez fagocyty. U większości chorych z
pierwotnymi niedoborami C1 i C4, rzadziej C2 występują choroby kompleksów immunologicznych
Układ dopełniacza umożliwia współpracę odp. swoistej z odp. nieswoistą:
Wzmaganie odpowiedzi humoralnej – C3b i C4b połączone z kompleksem Ag-Ab są wiązane
przez receptory CR2 na limfocytach B
Rozwój pamięci immunologicznej – C3b i C4b połączone z kompleksem Ag:Ab są wiązane
przez receptor CR3 na komórkach dendrytycznych.
Fragmenty białek układu dopełniacza wytworzone w czasie aktywacji wiążą się ze swoistymi
receptorami na powierzchni komórek ukł. odpornościowego. Najlepiej poznano receptory dla białek
opsoninowych CR3: CR1-CR4
CR1 – receptor dla C3b jest receptorem opsoninowym na granulocytach, monocytach makrofagach,
uczestniczy w fagocytozie. Obecny na erytrocytach lub płytkach krwi może służyć do wiązania
opsonizowanych kompleksów immunologicznych lub bakterii i transportowania ich do komórek
jednojądrzastych lokalnego układu wątroby.
Układ dopełniacza może stanowić potencjalne zagrożenie dla organizmu gospodarza, gdyż w
przypadku jego niekontrolowanej aktywacji może dojść do uszkodzenia tkanek. Ma to miejsce m. in.
w chorobie Alzheimera, astmie oskrzelowej, kłębuszkowym zapaleniu nerek, myasthenia gravis,
łuszczycy, reumatoidalnym zapaleniu stawów, udarze mózgu, a także we wstrząsie.
Aktywacja dopełniacza przez endotoksyny bakteryjne
Ednotoksyny (lipopolisacharydy) bakterii Gram (-) wyeksponowane na powierzchni mają zdolność
aktywacji kaskady dopełniacza. Lipid A i oligosacharyd rdzeniowy aktywują dopełniacz na drodze

klasycznej ale niezależnej od przeciwciał. Część polisacharydowa aktywuje dopełniacz na drodze
alternatywnej.
W stanie wstrząsu septycznego masywna wewnątrzkomórkowa aktywacja dopełniacza przez
endotoksynę bakteryjną i powstanie dużych ilości anafilatoksyn C3a i C5a odgrywa bardzo istotną
rolę. Aktywacja i degranulacja granulocytów, bazofilów i mastocytów prowadzi do aktywacji kaskady
układu krzepnięcia – powstawanie mikrozakrzepów w naczyniach prowadzi do uszkodzenia tkanki
płucnej przez enzymy proteolityczne i wolne rodniki tlenowe.
Białka regulacyjne układu dopełniacza
Czynniki regulujące obecne na błonach komórkowych – CR1, DAF, MCP, HRF
Czynniki osoczowe – inhibitor C1, czynnik I, białko wiążace C4, czynnik H, inaktywatory
anafilatoksyn, witronektyna, klasteryna, properdyna
CR1, MCP, białko wiążące C4 i czynnik H są kofaktorami czynnika I rozkładającego C3b i
C4b – tym samym inaktywują konwertazy C3 i C5
Inhibitor C1 wiąże aktywny C1r i C1s blokując dalszą aktywację
Czynnik I jest proteazą osocza rozkładającą C3b i C4b zarówno wolne jak i związane w
konwertazach
Czynnik H wiąże C3b i wspomaga czynnik I w hamowaniu konwertazy C3 drogi
alternatywnej.
Białko wiążące C4 przyspiesza zarówno spontaniczny jak i wywołany przez czynnik I rozpad
konwertazy C3 drogi klasycznej
Immunokonglutyniny są to autoprzeciwciała przeciwko związanym składnikom dopełniacza,
głównie C3. Pojawiają się w następstwie zakażeń oraz w stanach zapalnych i mają zdolność
aglutynacji pokrytych dopełniaczem cząsteczek i mikroorganizmów.
Czynniki obecne na komórkach są odpowiedzialne za wyłapywanie dopełniacza, zwłaszcza
fragmentów powstających na skutek działania drogi alternatywnej. Umożliwia to obronę własnego
organizmu przed aktywowanym spontanicznie dopełniaczem. Działanie drogi alternatywnej wynika z
faktu iż drobnoustroje nie posiadają czynników hamujących dopełniacz. Czynniki występujące na
komórkach to:
Receptor dla dopełniacza C1R inaktywuje konwertazy poprzez rozkład C3b i C4b
MCP - błonowy kofaktor białkowy wiąże C3b i C4b, jest obecny właściwie na wszystkich
komórkach jądrzastych organizmu.
DAF – czynnik przyspieszający rozkład, ang. degradation accelerating factor przyspiesza
spontaniczny rozpad konwertaz C3 i C5 drogi klasycznej i alternatywnej aktywacji
dopełniacza, drastycznie skracając czas ich trwania.
HRF - czynnik restrykcji homologicznej wiąże C8 i C9, hamując tworzenie MAC.
Niektóre wirusy wykorzystują cząsteczki regulacyjne układu dopełniacza jako swoiste receptory
umożliwiające im wniknięcie do komórki gospodarza. Np. wirus odry wykorzystuje MCP,
echowirusy i wirusy Coxackie – DAF, a wirus Eppstein-Barr CR2.
Niektóre organizmy rozwinęły mechanizmy obrony przed dopełniaczem:
Wirus krowianki syntetyzuje białko homologiczne do białka wiążącego C4
Proteazy wydzielane przez kropidlaki, pierwotniaki i bakterie rozkładają składniki
dopełniacza.
Jad kobry zawiera czynnik CVF tworzący kompleksy CVF-Bb i CVF-BBC3b, które mają
właściwości konwertazy C3 drogi alternatywnej. Nie podlega ona inaktywującemu wpływowi
czynnika I i H i wywołuje niehamowaną aktywację dopełniacza.
Niedobory składników dopełniacza

Pacjenci z niedoborami składników dopełniacza mają zwiększoną wrażliwość na zakażenia bakteryjne
oraz zwiększone ryzyko wystąpienia chorób autoimmunizacyjnych powodowanych przez kompleksy
immunologiczne. Nawracające zakażenia bakteryjne występują w większości niedoborów:
Paciorkowcowe (niedobór C3, czynnika H i I)
Dwoinką zapalenia opon mózgowo-rdzeniowych Neisseria meningitidis (niedobór C5 do C9,
czynnika D, properdyny)
Choroby autoimmunizacyjne na tle kompleksów Ag:Ab, np. toczeń, kłębkowe zapalenie nerek
(niedobór C1q, C1r, C1s, C2, C4)
Obrzęk naczynioruchowy Quinckego – polega na niedoborze inhibitora C1, który oprócz czynnika C1
hamuje także plazminę, kalikreinę i aktywny czynnik XII i XIa. Dochodzi do powstania obrzęków, w
przypadku zajęcia krtani zagrażających życiu.
Metody oznaczania dopełniacza
Poszczególne składowe możemy mierzyć zarówno oddzielnie, oznaczając ich poziom, jak i oceniając
ich funkcję. Prawidłowy poziom składowych dopełniacza nie przesądza o ich funkcjonalnej
aktywności. Całkowity poziom poszczególnych składowych dopełniacza jest mierzony za pomocą
ELISA, RIA oraz precypitacji z wykorzystaniem swoistych przeciwciał. W testach czynnościowych
wykorzystuje się krwinki opłaszczone przeciwciałem i dopełniaczem z wyłączeniem tej aktywności,
której pomiar jest przedmiotem badań.
Ocena całkowitej aktywności (C1-C9)
Ustalenie stężenia surowicy, przy którym dojdzie do 50% lizy wystandaryzowanej zawiesiny
erytrocytów opłaszczonych swoistym przeciwciałem.
Radialna hemoliza (żel zawiera kompleksy erytrocyt-przeciwciało antyerytrocytarne, a z
dołków dyfunduje badana surowica.
Immunodyfuzja radialna znalazła zastosowanie w oznaczaniu składowych C3b i C4 dopełniacza.
Wykonanie praktyczne:
Zestaw zawiera płytki wypełnione żelem zawierającym p/ciała o swoistości anty C3, oraz trzy
standardy o różnym stężeniu C3 (Ref. I, Ref. II, Ref. III). Do dołków w żelu wprowadzamy po 2,5 ul
standardów oraz badanych surowic. Inkubujemy płytki w komorze wilgotnej.
Odczyn wiązania dopełniacza, OWD
Jest to jeden z klasycznych odczynów, wbrew nazwie nie służy jednak do oznaczania składników
dopełniacza. Metoda ta służy wykrywaniu kompleksów immunologicznych w badanej surowicy (z
reguły wykrywamy w ten sposób przeciwciało), a polega na konkurencji dwóch układów:
wskaźnikowego oraz badanego o dopełniacz. Układ wskaźnikowy stanowią erytrocyty baranie
opłaszczone swoistym przeciwciałem, tzw. amboceptorem – jest to surowica królika immunizowanego
erytrocytami barana. Układ badany zaś to poszukiwane przez nas przeciwciało i swoisty wobec niego
antygen (lub odwrotnie). Badanie przeprowadzamy w kilku etapach:
1. Najpierw dodając do badanej na obecność przeciwciała antygenu (lub odwrotnie).
2. Następnie dodajemy ściśle wymiareczkowaną ilość dopełniacza, odpowiednią do ilości
użytego w 1 etapie antygenu bądź przeciwciała.
3. Na samym końcu dodajemy erytrocyty opłaszczone amboceptorem.
Po kilku minutach inkubacji sprawdzamy czy pojawiła się liza tych erytrocytów – jeśli nie, wynik
badania jest pozytywny. Dzieje się tak ponieważ jedynie kompleks immunologiczny złożony z
antygenu i swoistego przeciwciała jest w stanie aktywować dopełniacz. Jeśli w pierwszym etapie
doprowadziliśmy do utworzenia takich kompleksów, „zabiorą” one cały dodany dopełniacz
erytrocytom baranim z amboceptorem. Tak związany dopełniacz, zajęty kompleksem
immunologicznym nie wywoła w badanej próbie hemolizy.

Bardzo ważne w odczynie wiązania dopełniacza są trzy próby kontrolne, które zawsze musimy
wykonać:
1. Kontrola właściwości antykomplementarnych surowicy, składająca się z badanej surowicy,
erytrocytów barana z amboceptorem oraz dopełniacza. W prawidłowych warunkach w
surowicy nie występują elementy wiążące dopełniacz, a więc może on zadziałać na krwinki i
w kontroli występuje hemoliza.
2. Kontrola właściwości antykomplementarnych antygenu, złożona z roztworu 0,9% NaCl,
antygenu, erytrocytów barana z amboceptorem oraz dopełniacza. W prawidłowych warunkach
antygen może wiązać dopełniacz jedynie w połączeniu ze swoistym przeciwciałem, przez co
dopełniacz jest „wolny” i działa na krwinki, w kontroli występuje hemoliza.
3. Kontrola sprawności układu wskaźnikowego, złożona z erytrocytów barana z amboceptorem
oraz dopełniacza. W prawidłowych warunkach, kiedy cały układ „działa”, po związaniu się
dopełniacza z opłaszczonymi amboceptorem krwinkami w kontroli następuje hemoliza.
OWD można także wykonać jako oznaczenie ilościowe, podając miano przeciwciał w surowicy krwi.
Metoda ta znalazła zastosowanie w diagnostyce ostrego cuchnącego nieżytu nosa. Badanie
wykonujemy przygotowując kolejne rozcieńczenia badanej surowicy od 1:10 (1:20) do 1:80 i trzy
powyższe kontrole. Brak hemolizy w roztworach między 1:10 i 1:20 wskazuje na toczący się proces
chorobowy.
Wykonanie praktyczne – odczyn lizy serologicznej:
Do próbówek odmierzyć po 0,25 ml:
1. krwinek owcy, amboceptora, dopełniacza
2. krwinek owcy, amboceptora, r-ru NaCl
3. krwinek owcy r-ru NaCl, dopełniacza
Inkubować w temp. 37 st. C przez 5 minut
Odczytać wynik badania - liza powinna wystąpić tylko w próbie 1, gdzie obecne są wszystkie
składniki układu (analogicznie do w/w kontroli sprawności układu wskaźnikowego).
PS. Wszyscy czytający powyższą prelekcję stawiają piwo x-dandi’emu, bez którego ta produkcja na pewno by nie
powstała.
Wyszukiwarka
Podobne podstrony:
05 Immunologia prelekcja 10 29 2007id 5532 (2)
01 Immunologia prelekcja 10 01 2007id 2618 (2)
02 Immunologia prelekcja 10 08 2007id 3412 (2)
04 Immunologia prelekcja 10 22 2007id 4837 (2)
Immunologia - prelekcja 10.15.2007, nauki BIOLOGiczne, medycyna, IMMUNOLOGIA
10 Immunologia prelekcja 12 02 2007id 10554 (2)
08 Immunologia prelekcja 11 19 2007id 7260 (2)
Immunologia - prelekcja 10.08.2007(1), 1.Lekarski, II rok, Immunologia, Prelekcje
09 Immunologia prelekcja 11 26 2007id 7759 (2)
06 Immunologia prelekcja 11 05 2007id 6134 (2)
Immunologia - prelekcja01 1.10.2007, IMMUNOLOGIA
13 Immunologia prelekcja 12 17 2007id 14455 (2)
07 Immunologia prelekcja 11 12 2007id 6717 (2)
Immunologia - prelekcja11 10.12.2007, IMMUNOLOGIA
Immunologia - prelekcja 10.29.2007, immunologia
więcej podobnych podstron