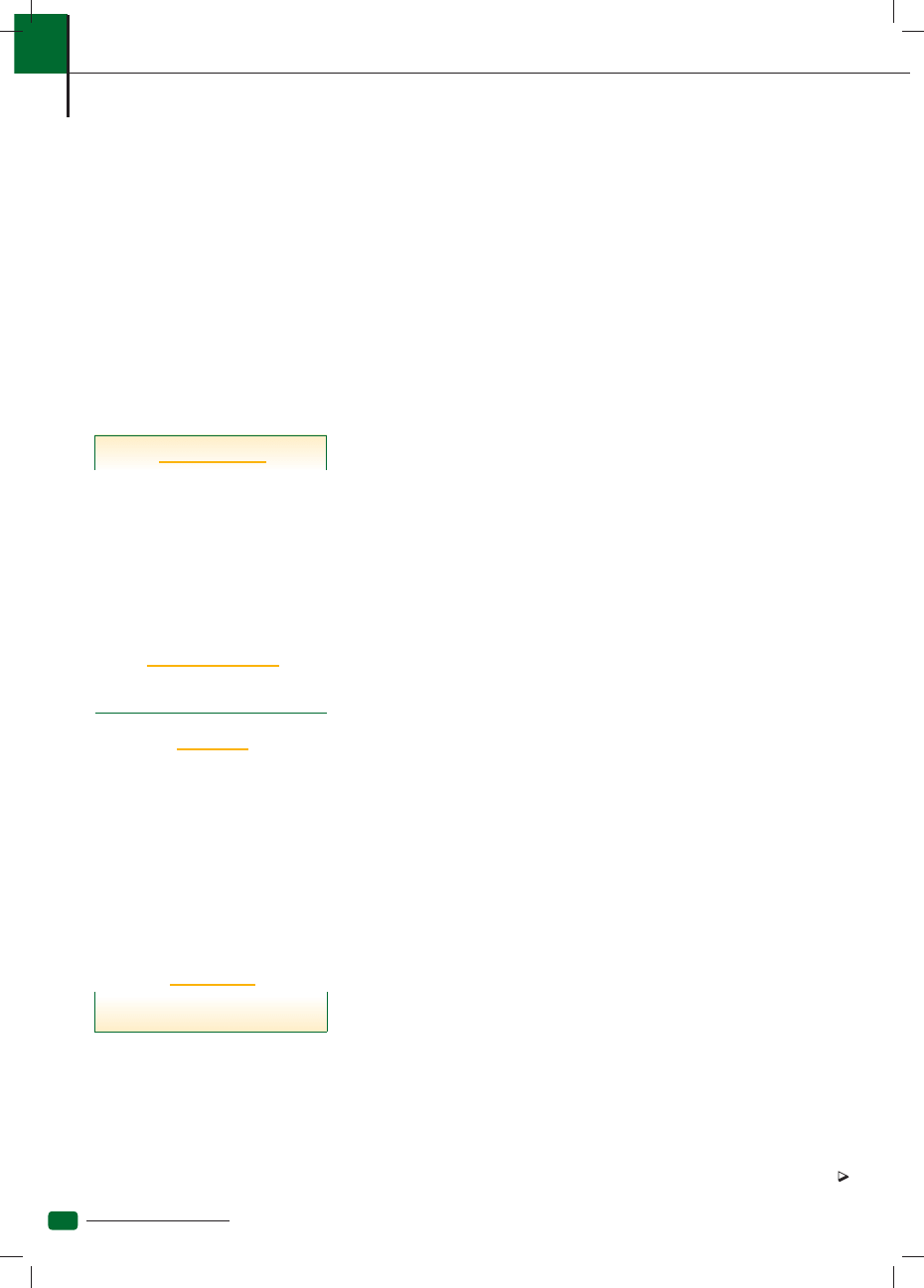
DIAGNOSTYKA LABORATORYJNA
WETERYNARIA W PRAKTYCE
46
www.weterynaria.elamed.pl
LISTOPAD-GRUDZIEŃ • 11-12/2009
U zwierząt z podejrzeniem niedokrwisto-
ści z niedoboru żelaza oznaczano poziom
żelaza i stopień wiązania żelaza (TIBC).
Zwierzęta podzielono na 7 grup w zależ-
ności od rodzaju występującej u nich nie-
dokrwistości.
P
ACJENCI
Z
NIEDOKRWISTOŚCIĄ
HEMOLITYCZNĄ
Pacjent 1
Kotka, 3 miesiące; stwierdzono następują-
ce objawy: biegunka, wymioty, duszność,
bladość błon śluzowych (po 2 dniach po-
jawiło się ich zażółcenie). Wystąpiła rów-
nież silna niedokrwistość (ryc. 1) oraz au-
toaglutynacja szkiełkowa. W rozmazie krwi
znaleziono na otoczkach erytrocytów drob-
noustroje Mycoplasma haemofelis, w erytro-
cytach występowały bardzo liczne ciałka
Howella-Jolly’ego, charakterystyczne dla
niedokrwistości hemolitycznych (także
autoimmunohemolityczych), świadczące
o odnowie erytrocytów (ryc. 2, 3) (10, 14, 20,
23). Znaleziono również erytroblasty oraz
makrofagi, fagocytujące erytrocyty. Wyko-
nano test Coombsa, który wykazał pod-
wyższone miano przeciwciał IgG zimnych
(miano 1:160) i ciepłych (miano1:320). Poli-
czono liczbę retikulocytów, niedokrwistość
wywołana przez mykoplazmę miała charak-
ter niedokrwistości hemolitycznej oraz au-
toimmunohemolitycznej, regeneratywnej,
z towarzyszącą jej leukocytozą. Wyniki te-
stów przeprowadzonych w kierunku zaka-
żenia wirusem FeLV i FIV były ujemne.
Podobne objawy opisane zostały przez
autorkę we wcześniejszej pracy (19), a tak-
że przez Carneya i Englanda (6) oraz Pen-
nisi’ego i współ. (21).
P
ACJENCI
Z
NIEDOKRWISTOŚCIĄ
HEMOLITYCZNĄ
Z
CIAŁKAMI
H
EINZA
Pacjent 2
Kot, samiec, rasy europejskiej, wiek około
7 miesięcy, wykazujący objawy zapalenia
Szczenięta i kocięta wykazują po urodzeniu
niedokrwistość fi zjologiczną utrzymującą
się do 5. miesiąca życia (20, 26, 31). Często
jednak występują u nich także niedokrwi-
stości wywoływane różnymi czynnikami.
Towarzyszą im charakterystyczne zmiany
w obrazie czerwonokrwinkowym, ale tak-
że białokrwinkowym, ułatwiające ich roz-
poznanie.
Celem powyższego opracowania jest
omówienie diagnostyki oraz analiza przy-
czyn i postaci niedokrwistości u pacjentów
poniżej 1. roku życia.
Badania wykonano w latach 2004-
-2007 u 21 zwierząt w wieku od 7 tygodni
do 1. roku, które wykazywały objawy niedo-
krwistości przekraczającej wartości fi zjolo-
giczne. Oznaczono morfologię przy pomo-
cy analizatora hematologicznego ABC VET.
Obliczano także manualnie liczbę retikulo-
cytów oraz ich odsetek w celu określenia
stopnia nasilenia erytropoezy. Stopień nasi-
lenia niedokrwistości oceniano na podsta-
wie wartości liczby hematokrytowej. Roz-
mazy krwi barwiono metodą Diff-Quick
(Hemastain) oraz błękitem metylowo-kre-
zylowym, wybarwiającym ziarnistości re-
tikulocytów i ciałka Heinza (2, 8, 14, 26,
29, 35). U jednego z pacjentów, podejrzane-
go o zapalenie wielomięśniowe, wykonano
oznaczenie aktywności kinazy kreatyno-
wej (7). Przy podejrzeniu niedokrwistości
autoimmunohemolitycznej wykonywano
test Coombsa (4, 9, 16, 18, 34). U kotów po-
dejrzanych o zakażenie wirusem białaczki
kociej lub niedoboru immunologicznego
wykonywano szybkie testy immunologicz-
ne w celu potwierdzenia infekcji (32).
U psów z krwotocznym zapaleniem prze-
wodu pokarmowego wykonano badanie te-
stem w kierunku zakażenia wirusem parvo.
Podobnie postępowano z kotami podejrza-
nymi o panleukopenię.
Przy podejrzeniu o inwazję pasożytów
jelitowych wykonywano badanie parazy-
tologiczne kału.
dr n. wet. Janina Łukaszewska
Przychodnia weterynaryjna we Wrocławiu
Abstract
Research has been carried out on a total
of 21 patients under the age of 1 year,
where symptoms of anaemia have been
noted. Morphologic tests were then car-
ried out in order to manually ascertain
the number of reticulocytes, while one
patient was administered a measure-
ment of keratin kinesis. Levels of iron
were also ascertained, along with qu-
ick scans for infectious diseases. The
Coombs test and parasitological faeces
examination were also carried out.
Key words
analysis, diagnostics, kittens, anaemia,
young dogs
Streszczenie
Badania wykonano u 21 pacjentów
w wieku poniżej 1. roku, u których stwier-
dzono objawy niedokrwistości. Wykony-
wano morfologię, obliczano manualnie
liczbę retikulocytów, u jednego pacjenta
wykonano pomiar kinazy kreatynowej.
Wykonywano także oznaczenie poziomu
żelaza, szybke testy w kierunku chorób
zakaźnych, test Coombsa i badania pa-
razytologiczne kału.
Słowa kluczowe
analiza, diagnostyka, kocięta, niedo-
krwistości, szczenięta
Niedokrwistości
u szczeniąt i kociąt – cz. II
Diagnostyka i analiza – opisy przypadków
naliza – opisy przypadków
ANAEMIA AMONG YOUNG DOGS AND CATS
DIAGNOSTICS AND ANALYSIS OF CAUSES, PART II

DIAGNOSTYKA LABORATORYJNA
WETERYNARIA W PRAKTYCE
47
www.weterynaria.elamed.pl
LISTOPAD-GRUDZIEŃ • 11-12/2009
1. Wyniki morfologii kota zakażonego Mycoplasma haemofelis z niedokrwistością regeneratywną
2. Mycoplasma haemofelis na błonie komórkowej erytrocytów
3. Mycoplasma haemofelis – rzadki widok – łańcuszek
4. Liczne okrągłe ciałka Heinza (strzałki) we krwi kota (rozmaz tradycyjny). Zbudowane są z methemo-
globiny, która jest jaśniejsza niż hemoglobina, stąd mogą być tutaj widoczne.
5. Duże ciałka Heinza (A ) u kota po zjedzeniu cebuli – świeża krew
6. Liczne, duże ciałka Heinza (rozmaz barwiony w kierunku retikulocytów)
7. Rozmaz krwi jamniczki z anemią hemolityczną regeneratywną po zjedzeniu cebuli. Jedna strzałka
– ciałka Howella-Jolly’ego, dwie strzałki – jaśniejsze kropki to ciałka Heinza, A– ekscentrocyt,
B – keratocyty, C – krwinki tarczowate, D – retikulocyty
8. Wyniki morfologii psa z niedokrwistością z niedoboru żelaza. Charakterystyczne objawy to obniżone
MCV, MCH i MCHC.
9. Rozmaz krwi psa z niedokrwistością z niedoboru żelaza. Widoczny: erytroblast kwasochłonny (A ),
mikrocyt (B), niedobarwliwy mikrocyt (C), retikulocyt (D)
10. Wyniki morfologii psa z ostrym krwawieniem– jeszcze brak regeneracji
11. Wyniki z ryc. 4 – tu liczba retikulocytów wzrosła do 4%, na histogramie pojawia się przesunięcie
wykresu w prawo. Wzrost liczby płytek krwi, anizocytoza płytek z dużymi, młodymi trombocytami
1
3
8
10
11
4
6
7
5
9
2
fot. ar
chiwum autora

DIAGNOSTYKA LABORATORYJNA
WETERYNARIA W PRAKTYCE
48
www.weterynaria.elamed.pl
LISTOPAD-GRUDZIEŃ • 11-12/2009
płuc. Stwierdzono u niego regeneratyw-
ną niedokrwistość średniego stopnia oraz
leukocytozę z neutrofi lią, z przesunięciem
w lewo. W rozmazie krwi barwionym me-
todą Diff-Quick zauważono na erytrocytach
liczne drobne ciałka Heinza, które wystąpiły
również w rozmazie krwi barwionym błęki-
tem metylowo-krezylowym (ryc. 4).
Występowały również ciałka Howella-
-Jolly’ego w liczbie przekraczającej dopusz-
czalne wartości dla kotów oraz nieliczne
ekscentrocyty. Powstały one wskutek two-
rzenia się methemoglobiny oraz utlenienia
błony komórkowej erytrocyów.
Właścicielka podała w wywiadzie, iż kar-
mi kota szynką i kiełbasą. Rozpoznano
przewlekłą niedokrwistość hemolitycz-
ną z ciałkami Heinza wywołaną azotyna-
mi, służącymi do peklowania i zawartymi
w tych pokarmach (5, 8, 17, 36).
Autorka stwierdziła już podobny przypa-
dek zatrucia dorosłego kota azotynami, któ-
re mają właściwości utleniające. Przebiegało
ono wówczas równocześnie z methemoglo-
binemią, powodującą wiśniowe zabarwienie
błon śluzowych (17).
Ze względu na średnie nasilenie nie-
dokrwistości nie podjęto leczenia w tym
kierunku, zalecono jedynie zmianę diety,
po 4 tygodniach nie zaobserwowano już cia-
łek Heinza, a wskaźniki czerwonokrwinko-
we same powróciły do normy.
Pacjent 3
Kot, samiec, rasy syjamskiej, wiek około
3 miesięcy. Objawy kliniczne – silna dusz-
ność, wyniki badań morfologicznych nie
odbiegały od normy. W trakcie liczenia ery-
trocytów w komorze Thoma zaobserwowa-
no prawie na każdym z nich bardzo duże
ciałka Heinza. Szczególnie widoczne były
w rozmazie krwi barwionym metodą tra-
dycyjną oraz po zabarwieniu rozmazu krwi
w kierunku retikulocytów (ryc. 5, 6). Wła-
ściciel podał, iż poprzedniego dnia nakarmił
zwierzę dużą ilością pokarmu zawierającego
cebulę. Duszność wynikła prawdopodobnie
z powstania dużej ilości methemoglobiny,
zawartej w licznych i dużych ciałkach He-
inza (związek ten nie przenosi tlenu). Po-
wstała ona pod wpływem dwusiarczków
zawartych w cebuli.
W literaturze opisany został przypadek
silnej niedokrwistości i w konsekwencji
śmierci 2 kotów, nakarmionych odżyw-
ką dziecięcą, zawierającą czosnek, rów-
nież bogaty w związki utleniające (5, 8) oraz
kota, któremu podano ½ tabletki paraceta-
molu (17).
Niedokrwistość wywołana powstaniem
ciałek Heinza pojawia się najwcześniej
po kilku dniach po ich powstaniu, dlatego
wyniki morfologii pacjenta nie odbiegały
jeszcze od normy. Po 5 dniach wystąpiło już
znaczne obniżenie liczby RBC.
Pacjenci 4 , 5, 6, 7, 8
Jamniki miniaturowe, cały miot w wieku
4 tygodni. Matka szczeniąt została nakar-
miona pokarmem zawierającym cebulę
i wykazywała objawy niedokrwistości he-
molitycznej regeneratywnej z ciałkami He-
inza i licznymi ekscentrocytami. Zauważono
je w barwionym tradycyjnie rozmazie krwi
matki i szczeniąt, jednak u tych ostatnich
w znacznie mniejszej liczbie.
Na podstawie obecności ciałek Hein-
za i ekscentrocytów postawiono diagno-
zę: niedokrwistość hemolityczna z ciałka-
mi Heinza u matki oraz u szczeniąt (5, 8).
U tych ostatnich powstała wskutek przedo-
stania się czynników utleniających, zawar-
tych w cebuli (dwusiarczki) do mleka matki.
Prawdopodobnie dodatkowo występowała
u nich niedokrwistość z niedoboru żelaza,
co sugerowała duża liczba krwinek tarczo-
watych, ale także keratocytów oraz schisto-
cyty (ryc. 7), (10, 22, 23, 31).
Harvey (10), Raskin (22) oraz Weiser
(31) w obrazie erytrocytów przy niedo-
krwistości z niedoboru żelaza stwierdza-
li również oprócz anulocytów i mikrocy-
tów, poikilocytozę w postaci schistocytów,
keratocytów, krwinek tarczowatych oraz
owalocytów.
Znaczna retikulocytoza powstała praw-
dopodobnie u szczeniąt wskutek nie tylko
niedokrwistości hemolitycznej, ale także
wywołanej tzw. wczesną hemolizą erytro-
cytów.
P
ACJENCI
Z
OBJAWAMI
NIEDOKRWISTOŚCI
Z
POWODU
NIEDOBORU
ŻELAZA
Pacjent 9, 10
Pies, wiek 2 miesiące, rottweiler (pa-
cjent 9) oraz suka, wiek 3 miesiące, rasy
bokser (pacjent 10), zakupione na placu
targowym.
Właściciele zgłosili się z psami do szcze-
pienia, w czasie badania stwierdzono u nich
kacheksję oraz bladość błon śluzowych.
Wyniki badań morfologicznych obu psów
wykazały znaczną niedokrwistość mikrocy-
tarną, niedobarwliwą (spadek MHC) oraz
obniżone stężenie żelaza. W rozmazie krwi
znaleziono mikrocyty, anulocyty oraz sto-
matocyty, a także liczne fragmentocyty – ke-
ratocyty i schistocyty. W kale występowały
jaja glist. Była to niedokrwistość z niedobo-
ru żelaza (ryc. 8, 9 ).
Harvey (11), Uerlinger i współ. (28) oraz
Weiser (31) stwierdzili, iż wymienione
krwinki czerwone są erytrocytami (szcze-
gólnie keratocyty) tworzącymi się przy nie-
dokrwistościach z niedoboru żelaza, a bar-
dzo nasilonej anemii może towarzyszyć
poikilocytoza, wskutek obecności retiku-
locytów. Mikrocyty z kolei powstają wsku-
tek mitozy ze zbyt niskim poziomem hemo-
globiny (11, 20).
Pacjent 11
Dziewięciomiesięczna suka rasy dober-
man. W badaniu klinicznym stwierdzono
znacznego stopnia wychudzenie, w wywia-
dzie podano, iż pies wykazuje słaby apetyt
i od dłuższego czasu oddaje stolec o dość
luźnej konsystencji ze śladami krwi. Wcze-
śniej była wielokrotnie odrobaczana.
W obrazie USG stwierdzono powiększo-
ną śledzionę oraz obrzęk błony śluzowej je-
lit cienkich. W badaniach morfologicznych
stwierdzono umiarkowaną niedokrwistość
mikrocytarną, niedobarwliwą, występowała
anizocytoza i eozynofi lia, w rozmazie zna-
leziono liczne keratocyty. Wykonano bada-
nie kału, w którym znaleziono jaja Ancylo-
stoma caninum.
U psów tej grupy niedokrwistości ozna-
czano poziom żelaza we krwi, który był
znacznie obniżony (< 60 μg/dl), przy zwięk-
szonym stopniu wchłaniania.
Wszystkie te niedokrwistości miały cha-
rakter mniej lub bardziej regeneratywny,
chociaż mogą być one także nieregenera-
tywne.
U zwierząt zastosowano odrobaczenie
preparatem uwzględniającym tego pasożyta
w swoim spektrum działania oraz podawa-
nie preparatu zawierającego żelazo. Po 4 ty-
godniach powtórne badanie kału nie wyka-
zało obecności jaj pasożytów. U pacjenta
ustąpiły biegunki.
Potwierdzeniem diagnozy była poprawa
wskaźników czerwonokrwinkowych dłu-
goterminową terapią (30-60 dni) prepara-
tami zawierającymi żelazo.
P
ACJENCI
Z
NIEDOKRWISTOŚCIĄ
SPOWODOWANĄ
NAGŁYM
UBYTKIEM
KRWI
(
KRWOTOCZNE
ZAPALENIE
PRZEWODU
POKARMOWEGO
)
Pacjent 12, 13
Kot, samiec, w wieku 4 miesięcy (pacjent 12)
i rottweiler, samiec, w tym samym wieku
(pacjent 13). Objawy kliniczne to biegun-
ka ze znaczną ilością krwi, duża ilość krwi
znajdowała się również w wymiocinach.
Ze względu na silną leukopenię, u kota po-
stawiono podejrzenie panleukopenii, co po-
twierdził test, podjęto więc leczenie w tym
kierunku.
U psa przyczyną choroby było spożycie
dużej ilości zbrylającego piasku dla kotów.
U obu zwierząt wystąpiła leukocytoza
oraz ostra niedokrwistość średniego stop-
nia, wywołana krwawieniem z przewodu
pokarmowego, regeneratywna (ryc.10, 11).
Nie zauważono też specjalnych zmian w ob-
razie erytrocytów. Anemia ustąpiła samoist-
nie w ciągu 1 tygodnia po wyleczeniu cho-
roby podstawowej. Podobne objawy opisuje
Aird (1) i inni autorzy (14, 23).
Niedokrwistości spowodowane strata-
mi krwi (również przy zakażeniu szczeniąt

DIAGNOSTYKA LABORATORYJNA
WETERYNARIA W PRAKTYCE
50
www.weterynaria.elamed.pl
LISTOPAD-GRUDZIEŃ • 11-12/2009
wirusem parvo) przez przewód pokarmo-
wy wskutek jego krwotocznego stanu za-
palnego były słabo nasilone, normocytar-
ne i normobarwliwe. Zgodnie z danymi
literatury (1, 11, 28) ze stratą procentowo
niewielkiej ilości krwi organizm radzi so-
bie bez problemu, zwierzęta nr 12 i 13 nie
wymagały więc specjalnego postępowania
terapeutycznego w tym kierunku.
Zakażenie parvovirusem powoduje jed-
nak dodatkowo hypo- lub aplazję szpiku
kostnego. Jest ona w tych przypadkach od-
wracalna, a więc niedokrwistość nią wy-
wołana również ustępuje po wyleczeniu
choroby podstawowej. U kotów i psów
zakażenie takie powoduje raczej hipopla-
zję układu granulocytarnego, stąd pojawia
się leukopenia (neutropenia), a szpik czę-
sto powraca do stanu prawidłowego, za-
nim rozwinie się niedokrwistość wskutek
jego aplazji (20).
P
ACJENCI
Z
NIEDOKRWISTOŚCIAMI
AUTOIMMUNOHEMOLITYCZNYMI
(
AIHA
)
(ryc. 12, 13, 14, 15, 16, 17)
Pacjent 14
Pies, samiec, rasy chow-chow, 6 miesięcy,
wykazywał następujące objawy kliniczne:
wymioty, biegunka, utrzymująca się go-
rączka, nasilająca się niedokrwistość, bili-
rubinemia, bilirubinuria.
Wynik testu Coombsa był dodatni,
w rozmazie krwi znaleziono sferocyty, po-
jedyncze schistocyty i liczne retikulocyty
oraz limfocyty odczynowe. Stwierdzono
słabą autoaglutynację krwinek czerwonych
(+1), rozpoznano niedokrwistość autoim-
munohemolityczną, prawdopodobną przy-
czyną był stres (transport).
Pacjent 15
Pies, bokser, w wieku 3 miesięcy. Niedo-
krwistość pojawiła się u niego dwa tygo-
dnie po szczepieniu szczepionką skoja-
rzoną. W badaniu klinicznym stwierdzono
silną bolesność mięśni, szczególnie w oko-
licy głowy i szyi, gorączkę (40,1°C), wystą-
piła podwyższona aktywność kinazy kre-
atynowej. Anemia oraz autoaglutynacja
erytrocytów nasiliły się znacznie w ciągu
dwóch dni. Wykryto także podwyższone
miano przeciwciał klasy IgG oraz składni-
ka dopełniacza C3. Postawiono podejrze-
nie zapalenia wielomięśniowego, co suge-
rowały: silna bolesność mięśni, trudności
w otwieraniu pyska, podwyższona aktyw-
ność CK oraz eozynofi lia. Podobne do po-
wyższych objawy zapalenia wielomięśnio-
wego i niedokrwistości opisał Chanoit
i wsp (7).
Rozpoznano niedokrwistość autoim-
munohemolityczną, której przyczyną było
prawdopodobnie szczepienie i zapalenie
wielomięśniowe.
Pacjent 16
Owczarek niemiecki, siedmiomiesięcz-
na suka. Od miesiąca wykazywała obja-
wy bólowe znacznego stopnia, trudności
w poruszaniu się, okresowo występowała
podwyższona temperatura. Leczona była
dotychczas przeciwzapalnymi dawkami
glikokortykosteroidów i antybiotykami.
W dniu wizyty pies nie mógł chodzić, tem-
peratura ciała wynosiła 41,1°C; występo-
wały obrzęki w okolicy stawów nadgarst-
kowych i skokowych kończyn. W obrazie
RTG stawów nie stwierdzono zmian, bada-
nie USG wykazało powiększoną śledzionę,
prawdopodobnie wskutek nasilonej erytro-
poezy pozaszpikowej (ryc. 18), (10).
W płynie stawowym o podwyższonym
stężeniu białka całkowitego, występowały
liczne neutrofi le oraz makrofagi fagocytują-
ce neutrofi le (przewlekły stan zapalny), nie
stwierdzono natomiast obecności bakterii.
We krwi stwierdzono liczne sferocyty,
niedokrwistość miała charakter regenera-
tywny. Test Coombsa wykazał obecność
przeciwciał IgG w mianie 1:320.
Taki obraz chorobowy przemawiał za za-
paleniem wielostawowym tła immunolo-
gicznego z towarzyszącą niedokrwistością
autoimmunohemolityczną (4, 18, 24, 27).
Pacjent 17
Pies, labrador w wieku 11 miesięcy. Stwier-
dzono niedokrwistość typu autoimmu-
nohemolitycznego (AIHA), z podobnymi
zmianami we krwi, jak powyżej, prawdo-
podobnie po ukąszeniu przez owada (ob-
serwacja właściciela).
We krwi wystąpiła autoaglutynacja, sfe-
rocytoza, pojawiła się również żółtaczka.
Właściciel nie wyraził zgody na wykonanie
testu Coombsa. Pies został wyleczony wy-
sokimi dawkami glikokortkosteroidów.
W literaturze również spotyka się donie-
sienia o przypadkach wystąpienia chorób
autoimmunologicznych, takich jak: zapa-
lenie wielostawowe, zapalenie wielomię-
śniowe, niedokrwistość autoimmunohe-
molityczna, a nawet toczeń rumieniowaty
układowy, pojawiających się u tak młodych
psów, ale głównie po szczepieniach (9). Psy
15 oraz 16 były szczepione minimum 2 ty-
godnie przed wystąpieniem objawów cho-
robowych, pozostałe przynajmniej 3 mie-
siące wcześniej.
Może to sugerować, iż u tego pacjenta
czynnikiem sprzyjającym powstaniu AIHA
był inny bodziec wyzwalający chorobę, czy-
li stres po ukąszeniu.
P
ACJENCI
Z
NIEDOKRWISTOŚCIĄ
SPOWODOWANĄ
ZAKAŻENIEM
WIRUSEM
BIAŁACZKI
KOCIEJ
Pacjent 18
Kotka, samica, w wieku około 6 miesięcy,
rasy środkowoeuropejskiej, z silną niedo-
krwistością nieregeneratywną i autoaglu-
tynacją erytrocytów.
Wynik testu w kierunku białaczki za-
kaźnej kotów był dodatni. W rozmazie
krwi znaleziono limfocyty odczynowe.
Oprócz tego występowały liczne erytrobla-
sty z podzielonym jądrem, proerytroblasty,
mikrocyty (megalocyty), zasadochłonne
nakrapiania erytrocytów, liczne ciałka Ho-
wella-Jollye’go – jako wyraz dyserytropo-
ezy oraz anizocytoza i dysplazja płytek krwi
i licznymi, dużymi płytkami – będące wyni-
kiem zaburzenia trombopoezy. Takie zmia-
ny w krwi obwodowej mogą pojawiać się
w tej chorobie także ze względu na częste
rozwijanie się dysplazji szpiku kostnego
(ryc. 19 i 20). Obecność licznych proery-
troblastów sugerowała również rozwinię-
cie się erytroleukemii (12, 13, 25).
Pacjent 19
Kot, samiec, dziesięciomiesięczny, wycho-
dzący. Wynik testu w kierunku zakażenia
wirusem białaczki kociej był dodatni. Zmia-
ny w obrazie krwi były podobne do po-
przedniego przypadku, jednak słabo nasi-
lone i dotyczące również granulocytów.
W licznych pracach dotyczących zespo-
łów mielodysplastycznych zaburzenia he-
mopoezy są obserwowowane u kotów także
w krwi obwodowej. Są to zmiany wynikają-
ce z zaburzenia erytropoezy, trombopoezy,
ale również granulopoezy: hypo- lub hy-
persegmentacji neutrofi li, neutropenia, ol-
brzymie granulocyty, szczególnie pałeczko-
wate (12, 13, 25).
Według badań Shimodo i współ. (25)
36% kotów zakażonych wirusem białaczki
kociej wykazywało również objawy zespo-
łu mielodysplastycznego.
Pacjent 20
Kot, u którego pomimo zakażenia wirusem
białaczki kociej wystąpiła niedokrwistość
hemolityczna regeneratywna, spowodo-
wana obecnością mykoplazm na otocz-
kach erytrocytów.
U tego kota wirus nie spowodował ob-
jawów uszkodzenia szpiku kostnego, stąd
możliwe było pojawienie się niedokrwisto-
ści o charakterze regeneracyjnym.
P
ACJENCI
Z
NIEDOKRWISTOŚCIĄ
SPOWODOWANĄ
CHOROBAMI
PRZEWLEKŁYMI
Pacjent 21
7-miesięczny sznaucer miniaturowy, u któ-
rego stwierdzono niedokrwistość średnie-
go stopnia, nieregeneratywną, ze znaczną
anizocytozą. Spowodowana ona była zabu-
rzeniem wytwarzania erytrocytów wskutek
wystąpienia zespołu przedbiałaczkowego
oraz białaczki z komórek niezróżnicowa-
nych. Oprócz blastów niezróżnicowanych,
we krwi obwodowej występowały podobne,
DIAGNOSTYKA LABORATORYJNA
WETERYNARIA W PRAKTYCE
51
www.weterynaria.elamed.pl
LISTOPAD-GRUDZIEŃ • 11-12/2009
12
13
15
14
22
21
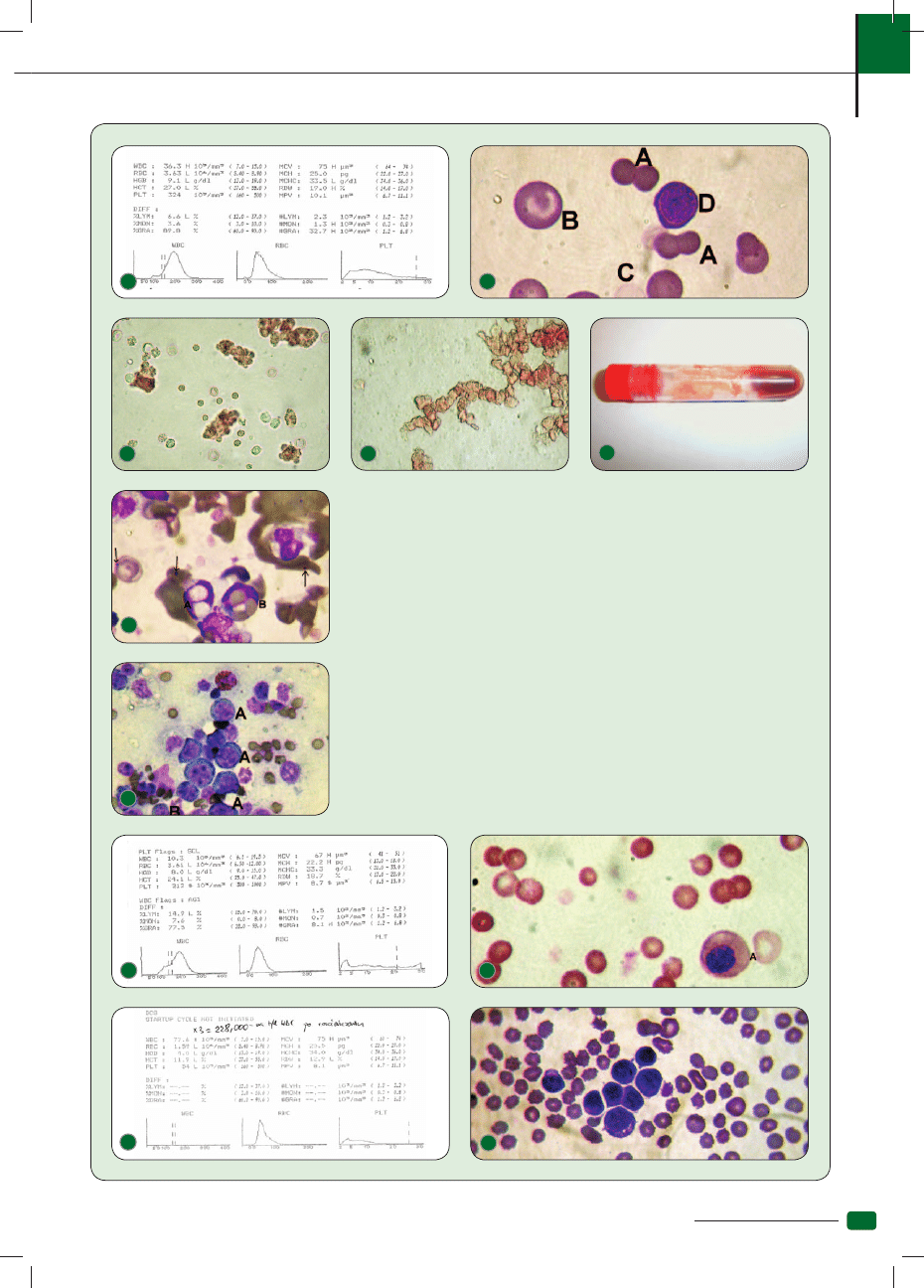
12. Niedokrwistość autohemolityczna regeneratywna – wzrost MCV, spadek MCHC. Pik po lewej stronie
histogramu RBC oznacza liczne sferocyty, przesunięcie wykresu w prawo – retikulocyty
13. Obraz krwi pacjenta z ryc. 12. A – sferocyty, B – retikulocyty, C – erytrocyt, D – erytroblast
zasadochłonny
14. Autoaglutynacja w świeżej krwi obwodowej, po rozcieńczeniu krwi w stosunku 1:0,9% NaCl – wi-
doczne pakiety (zlepy) erytrocytów
15. Rulonizacja w krwi świeżej bez rozcieńczenia może mylić aglutynację. Wywołana jest wysokim
stężeniem globulin lub fi brynogenu. Rozcieńczenie krwi likwiduje ją
16. Autoaglutynacja może pojawić się już w próbówce z EDTA, ale tak może wyglądać również bardzo
nasilona rulonizacja
17. Erytrofagocytoza w krwi obwodowej. A – sfagocytowane erytrocyty, B – widoczne erytrocyty.
Strzałki – ciałka Howella-Jolly’ego (niedokrwistość regeneratwna)
18. Hemopoeza pozaszpikowa w śledzionie – liczne proerytoblasty (A) i erytroblasty (B)
19. Wyniki morfologii kota zakażonego wirusem białaczki kociej, z objawami dysplazji szpiku kostnego.
Charakterystyczna makrocytoza (wysokie MCV)
20. Rozmaz krwi pacjenta z ryc. 19. A – megaloblast kwasochłonny, z którego powstanie makrocyt
– megalocyt
21. Morfologia psa z ostrą białaczką z blastów niezróżnicowanych. Obecne we krwi obwodowej liczne
cechy dysplazji szpiku kostnego nasuwają podejrzenie transformacji wcześniejszego zespołu
przedbiałaczkowego
22. Obraz krwi obwodowej pacjenta z ryc. 21. Liczne niezróżnicowane blasty
16
18
20
19
17
fot. ar
chiwum autora

DIAGNOSTYKA LABORATORYJNA
WETERYNARIA W PRAKTYCE
52
www.weterynaria.elamed.pl
LISTOPAD-GRUDZIEŃ • 11-12/2009
jak opisano u ww. kotów, objawy dysplazji
szpiku kostnego (ryc. 21 i 22).
P
ODSUMOWANIE
U wszystkich badanych zwierząt w rozma-
zach krwi występowały charakterystyczne
dla danego rodzaju niedokrwistości formy
czerwonych ciałek krwi, znacznie ułatwia-
jące ustalenie jej przyczyny. Były to: kera-
tocyty, sferocyty, anulocyty, ekscentrocyty,
schistocyty, owalocyty, krwinki ołówko-
wate, retikulocyty, erytroblasty. Pojawiły
się również wtręty: ciałka Heinza, ciałka
Howella-Jolly’ego – efekt nasilonej ery-
tropoezy, niekiedy zasadochłonne nakra-
piania oraz pasożyty erytrocytów. Podob-
ne zmiany we krwi, charakterystyczne dla
różnych postaci niedokrwistości opisu-
ją w swoich pracach inni autorzy (5, 8, 10,
11, 13, 23-33, 36). Niedokrwistości wywo-
łane zaburzeniami żołądkowo-jelitowymi
wykazywały niewielkie nasilenie, nie po-
wodowały zmian w obrazie erytrocytów,
miały charakter normocytarny i normo-
barwliwy i ustępowały one po wyleczeniu
choroby podstawowej.
Na podstawie uzyskanych wyników
stwierdzono, iż najczęściej diagnozowa-
ną przyczyną niedokrwistości u młodych
zwierząt było ich nieprawidłowe żywienie
i zarobaczenie. Wystąpiły one wskutek nie-
dokarmiania szczeniąt – niedokrwistość
z niedoboru żelaza, karmienia odpadkami
ze stołu – niedokrwistości z ciałkami He-
inza, lub obydwie te przyczyny występowa-
ły jednocześnie (w sumie dziesięć przypad-
ków).
Piśmiennictwo do części 1. i 2.
1. Aird B.: Acute loss anemia. In Schalm’s Veterinary
hematology. Ed. Feldman B., Zinkl J., Nemi
C. Lippincot Williams & Wilkins. 2000. 151-
-153.
2. Allison R., Meinkoth J.: Hematology without the
numbers: „In-clinic blood fi lm evaluation. Ve-
terinary Clinics of North America”, 2007; 37.
3. Baker R., Valli V.: Dysmyelopoesis in the cat:
A hematological disorder resembling refractory
anemia with excess blasts in man. „Can. J. Vet.
Res.” 1986, 59, 3-6.
4. Bücheler J., Cotter S.: Canine immune-mediated
hemolytic anemia. Kirk’s Current of Veterinary
Therapy XII, 1995, 152-157.
5. Caldin M., Carli E., Furtanello T., Solango-
-Gallego L., Tasca S., Lubas G.: A retrospective
study of 60 cases of eccentrocytes in the dog. „Vet.
Clin. Pathol.” 2005, 43, 224-225.
6. Carney H.., England J.: Feline hemobartonello-
sis. „Vet. Clin. North Am. Small Anim. Pract.”
1993, 23, 79 -90.
7. Chanoit G., Lefebvre H., Orcel K., Laroute V.,
Toutain P.L., Braun J.: Use of plasma creatine
kinase pharmacokinetics to estimate the amount
of excercise-induced muscle damage in beagle.
„Am. Vet. J. Res.„ 62, 1375.
8. Christopher M., White J., Eaton J.: Erythrocyte
pathology and mechanisms of Heinz body – me-
diated hemolysis in cats. „Vet. Pathol.”, 1990, 27,
299-310.
9. Duvall D., Giger U.: Vaccine associated immuno-
mediated hemolytic anemia in the dog. „J. Vet Int.
Med.”, 1966, 10, 290-295.
10. Giger U.: Regenerative anemias caused by blood
loss or hemolysis. Texbook of Veterinary Internal
Medicine. Ed. Ettinger S.J., Feldman E.C.,
W.B. Saunders comp, 2000, 1784-1804.
11. Harvey J.W.: Microcytic anemias. In Schal-
m’s Veterinary Hematology. Ed. Feldman B.,
Zinkl J., Nemi C. Lippincot Williams &
Wilkins, 2000. 190-204.
12. Hisasue M., Nishigaki K., Katae H., Yuri K.,
Mizuno T., Fujino Y., Setoguchi A., Hasegawa
A., Watari T., Masuda K., Ohno K., Tsujimoto
H.: Clonality analysis of various hematopoetic
disorders in cats naturally infected with feline
leukemia virus. „J. Vet. Med. Sci”. 2000, 62,
1059-1065.
13. Hihasue M., Okayama H., Okayama T., Susu-
ki T., Mizuno T., Naganobu K., Hasegawa A.,
Watari T., Matsuki N., Masuda K., Ohno K.,
Tsujimoto H.: Hematologic abnormalites and
outcome of 16 cats with myelodysplastic syndro-
mes. „J. Vet. Int. Med”. 2001, 15, 471-477.
14. Jain N.C.: Essentials of veterinary hematology.
Lea & Febiger, Philadelphia, 1993.
15. Jonas L., Thrall M., Weiser M.: Nonregenera-
tive form of immune-mediated hemolytic anemia
in dogs. „J. Am. Anim. Hosp. Assoc”. 1987, 23,
204-210.
16. Klag A., Giger U., Shofer F.: Idiopathic immu-
no-mediated hemolytic anemia in dogs: 42 cases
[1986-1990]. „J. Am. Vet. Med. Assoc”. 1993,
202, 783-788.
17. Łukaszewska J., Popiel J.: Methemoglobinemie
i anemie hemolityczne z ciałkami Heinza u kotów.
„Mag. Wet.” 2005.
18. Łukaszewska J., Popiel J., Stefaniak T.,
Atamaniuk W.: Niedokrwistości autoimmuno-
hemolityczne u psów – analiza 48 przypadków.
Praca w druku.
19. Łukaszewska J., Popiel J., Zawadzki W.:
Mycoplasma haemofelis – czynnik anemii kotów.
„Medycyna Wet.”, 2004, 60, 1347-1351.
20. Meyer D., Harvey J.: Veterinary Laboratory
Medicine. 2nd ed., W.B. Saunders comp
Philadelphia, 1998.
21. Pennisi M.G.: Hemobartonelloza kotów (zakaź-
na niedokrwistość kotów): obecny stan wiedzy.
„Medycyna Wet.”,1991, 47, 485-487.
22. Raskin R., Meyer D.: Atlas of canine and feline
cytology. W.B. Saunders comp. Philedelphia
1997.
23. Rebar A., McWilliams P., Feldman B., Met-
zger F., Pallock R., Roche J.: A quide to he-
matology of dogs and cats. „Teton NewMedia”,
Jackson, Wyoming, 2002.
24. Reimer M., Troy G., Warnick L.: Immune-me-
diated hemolytic anemia: 70 cases [1988-1996].
„J. Am. Anim. Hosp. Assoc.”, 1996, 35, 384-
-391.
25. Shimoda T., Shiranga N., Mashita T., Hase-
gawa A.: A hematological study on thirteen cats
with myelodysplastic syndrome. „J. Vet. Med.
Sci.”, 2000, 62, 59-64.
26. Stockham S., Scott M.: Fundamentals of Ve-
terinary Clinical Pathology. Sc ed. Blackwell,
2008.
27. Thompson J.: Immunologic diseases. Texbook
of Veterinary Internal Medicine. Diseases of the
Dogs and Cats. Ettinger S.J., Feldman E.C.,
W.B. Saunders comp., 1995, 1879-1881.
28. Uehlinger P., Glaus T., Stockli R., Flucki-
ger M., Leuch F.: What is your diagnosis? Iron
defi ciency anemia due to intestinal blood loss.
„Schweiz Arch. Tierheilgk.”. 1997,139, 449-
-453.
29. Weiss D. J.: Secondary myelofobrosis in three
dogs. „J. Am. Vet. Med. Assoc.” 1985, 187,
423-425.
30. Weiss J.D.: Evaluation of dysmyelopoesis in cats:
34 cases (1966-2005). „J. Am. Vet. Med. As-
soc”. 2006, 228, 893-897.
31. Weiser G., O’Grady M.: Erythrocyte volume
dystribution analysis and hematologic changes
in dogs wih iron defi ciency anemia. „Vet. Pathol.”,
1983, 20, 230-241.
32. Weiser M., Kociba G.: Erythrocyte macrocytosis
in feline leukemia virus associated anemia. „Vet.
Pathol.”, 1983, 20, 687-697.
33. Weiser M.: Erythrocyte responses and disorders.
Texbook of Veterinary Internal Medicine Ettinger
S.J., Feldman E.C., W.B. Saunders comp.,
1986, 1885-1981.
34. Wilkerson M., Davies E., Shuman W., Harkin
H., Cox J., Rush B.: Isotype – specifi c antibodies
in horses and dogs with immune-mediated hemo-
lytic anemia. „J. Vet. Intern. Med.”, 2000, 14,
190-196.
35. Willard M., Tvendten H.: Small Animal Dia-
gnostic Laboratory Methods. Ed. Saunders,
2004.
36. Winnicka A., Łukaszewska J., Popiel J.: Niedo-
krwistość hemolityczna z ciałkami Heinza u psów
i kotów. Materiały z XII Kongresu PTNW.
Warszawa 2004, 300.
dr n. wet. Janina Łukaszewska
Lecznica dla zwierząt
50-053 Wrocław
ul. Paczkowska 26
r e k l a m a
Document Outline
- WWP_11-12_2009 46
- WWP_11-12_2009 47
- WWP_11-12_2009 48
- WWP_11-12_2009 50
- WWP_11-12_2009 51
- WWP_11-12_2009 52
Wyszukiwarka
Podobne podstrony:
neonatologia szczeniąt i kociąt cz I
neonatologia szczeniąt i kociąt cz II
Czynniki ryzyka choroby niedokrwiennej serca cz
Niedokrwistosci cz I
krytyczne niedokrwienie konczyn cz.2, 1.Lekarski, III rok, Chirurgia, Choroby wewnętrzne
Niedokrwistosci-cz.I
indicativus futuri primi activi tryb oznajmujący cz przyszłego niedokonanego str czynnej
krytyczne niedokrwienie konczyn cz.1, 1.Lekarski, III rok, Chirurgia, Choroby wewnętrzne
Czynniki ryzyka choroby niedokrwiennej serca cz
J R R Tolkien Niedokończone opowieści cz 2
więcej podobnych podstron