
1
Politechnika Wrocławska
Wydział Chemiczny
Kierunek: Technologia chemiczna
Technologia chemiczna – surowce i procesy
przemysłu nieorganicznego
– laboratorium –
Ćwiczenie 7
OTRZYMYWANIE PRDUKTÓW KRYSTALICZNYCH W REAKTORZE
O DZIAŁANIU CIĄGŁYM.
mgr inż. Robert Liszka
Zakład Procesów i Reaktorów Chemicznych
Instytut Technologii Nieorganicznej i Nawozów Mineralnych
WROCŁAW 2010

2
1. Oznaczenia
A
T
– sumaryczna powierzchnia kryształów, m
2
B
– szybkość zarodkowania, m
–3
s
–1
c
– stężenie, mol dm
–3
Δc
– średnie przesycenie roztworu, kg m
–3
Δc
max
– przesycenie graniczne roztworu, %
CV
– współczynnik niejednorodności kryształów, %
D
– średnica krystalizatora, m
d
dt
– średnica rury cyrkulacyjnej, m
d
s
– średnica wału mieszadła, m
d
m
– średnica mieszadła, m
G
– liniowa szybkość wzrostu kryształów, m s
–1
H
– wysokość krystalizatora, m
h
dt
– wysokość rury cyrkulacyjnej, m
h
p
– odległość mieszadła od dna krystalizatora, m
K
sp
– iloczyn rozpuszczalności
k
a
– powierzchniowy współczynnik kształtu kryształów
k
v
– objętościowy współczynnik kształtu kryształów
k
N
– stała szybkości zarodkowania, s
–1
L
– charakterystyczny rozmiar kryształu, m
L
16
– rozmiar sita przez które przechodzi 16% populacji kryształów, m
L
50
– środkowy rozmiar kryształów (dla podziarna równego 50% mas.), m
L
84
– rozmiar sita przez które przechodzi 84% populacji kryształów, m
L
m
– średni rozmiar kryształów, m
L
i
– średni rozmiar kryształów i–tej frakcji, m
L
i
– zakres rozmiarów kryształów i–tej frakcji, m
l
i
– długość, m
m
i
– masa i–tej frakcji kryształów, kg
M
T
– zawartość kryształów w zawiesinie (gęstość zawiesiny), kg m
–3
N
– liczba obrotów mieszadła, s
–1
N
Nv
– liczba zarodków w jednostce objętości
N
T
– sumaryczna liczba kryształów
n
0
– gęstość populacji zarodków (kryształów o rozmiarze zerowym), m
–1
m
–3
n(L)
– gęstość populacji (liczba kryształów w danym zakresie rozmiarów kryształów w jednostce
objętości zawiesiny), m
–1
m
–3
n
– rząd szybkości zarodkowania
n
i
– gęstość populacji i–tej frakcji kryształów, m
–1
m
–3
P
– stopień przesycenia
pK
sp
– ujemny logarytm iloczynu rozpuszczalności
pH
– ujemny logarytm stężenia jonów wodorowych
T
– temperatura, K
x
i
– udział masowy poszczególnych frakcji w produkcie
V
i
– objętość i–tej frakcji kryształów, m
3
V
t
– objętość całkowita krystalizatora, m
3
V
w
– objętość robocza krystalizatora, m
3
ρ
c
– gęstość roztworu, kg m
–3
ρ
s
– gęstość fazy stałej, kg m
–3
q
v
– strumień objętościowy, m
3
s
–1
– czas przebywania: V
w
/q
v
, s
CSD
– Crystal Size Distribution (Rozkład Rozmiarów Kryształów)
DT
– Draft Tube
MSMPR
– Mixed Suspension Mixed Product Removal crystallizer
SIG
– Size Independent Growth
3
2. Wprowadzenie
Stale rosnący przyrost populacji ludzkiej niesie za sobą konieczność sukcesywnego zwiększania ilości
produkowanej żywności. Niezwykle istotne stało się więc nawożenie gleb, które jest najważniejszym
czynnikiem oddziaływującym na ich produktywność.
Wciąż malejąca zasobność rud fosforanowych wymusiła na wielu jednostkach badawczych podjęcie
badań nad pozyskiwaniem alternatywnych źródeł fosforu. Wysoce efektywnym źródłem fosforu, magnezu i
azotu okazał się struwit
MgNH
4
PO
4
∙6H
2
O
.
Struwit jest minerałem rzadko występującym w przyrodzie, jego największym naturalnym źródłem jest
rozkładający się materiał organiczny. Występuje on w osadach z biologicznego oczyszczania ścieków, odpadach
rolnych oraz w osadach powstałych w procesach beztlenowej fermentacji ciekłych odpadów z hodowli zwierząt.
Do najważniejszych metod odzyskiwania fosforu ze ścieków przemysłowych, pochodzenia
zwierzęcego, bytowo – gospodarczych należą technologie biologicznego usuwania fosforu oraz chemiczne
usuwanie fosforanów. Nowość technologiczną stanowią metody chemicznej eliminacji związków fosforu ze
ścieków, poszerzone o etap odzysku form użytecznych tzw. recykling fosforu.
Kontrolowane strącanie i krystalizacja trudno rozpuszczalnych soli fosforanowych jest złożonym
zagadnieniem, tak zarówno teoretycznym, jak i praktycznym zależnym od czynników związanych ze
środowiskiem, w którym te procesy przebiegają oraz parametrami tych procesów.
Główny problem w
poprawnym zaprojektowaniu i eksploatacji instalacji przemysłowej do recyklingu fosforu stanowi niestabilny
skład chemiczny ścieków, jak również obserwowane często zmiany w czasie wartości stężeń poszczególnych
składników.
Zanieczyszczenia, występujące w różnym składzie, stężeniach i proporcjach mają decydujący
wpływ obok zasadniczego składnika ścieków – jonów fosforanowych. Część zanieczyszczeń czasami w
nieoczekiwany sposób (zależny m.in. od ich stężenia, postaci fizycznej, obecności i stężeń innych
współobecnych składników w układzie) katalizuje bądź inhibituje przebieg reakcji chemicznej strącania,
procesów zarodkowania i wzrostu kryształów, wpływając znacząco na ostateczny kształt i aglomerację
kryształów oraz chemiczną czystość produktu. Wyniki badań wpływu różnych zanieczyszczeń na kinetykę
zarodkowania i wzrostu kryształów struwitu z roztworów rozcieńczonych w procesie ciągłego usuwania jonów
fosforanowych ze ścieków przemysłowych mogą stanowić znaczące źródło danych poznawczych o tym ważnym
i aktualnym problemie światowym jakim jest recykling fosforu. Pomimo znacznego wkładu pracy i
uruchamiania instalacji pilotażowych, recykling fosforu ścieków nie został jeszcze szeroko zaadoptowany.
Temperatura, pH, geometria wnętrza, mieszanie/cyrkulacja, czas przebywania, miejsce wprowadzenia reagentów
oddziaływują na przebieg i rezultaty procesów odzyskiwania fosforanów. Miejsca wprowadzenia reagentów
muszą być tak dobrane, aby mieszanina wprowadzonych razem jonów była szybko i skutecznie mieszana z
cyrkulującą w krystalizatorze zawiesiną.
Przeprowadzenie wszystkich tych procesów w sposób kontrolowany, w optymalnych warunkach
strącania i krystalizacji trudno rozpuszczalnych fosforanów oraz w odpowiednio dobranym i zaprojektowanym
krystalizatorze ciągłego działania, umożliwia otrzymywanie produktów o wysokim stopniu czystości chemicznej
i rozmiarach kryształów pozwalających na ich skuteczne oddzielenie od roztworu macierzystego.
Bardzo dobre właściwości nawozowe struwitu umożliwiają aplikowanie go do gleby w ilościach
znacznie przekraczających nawozy konwencjonalne bez obawy przedozowania. Uwalnianie składników
pokarmowych wzmaga się poprzez mechanizm biologicznej nitryfikacji z jednoczesnym uwalnianiem
składników w kontrolowanych porcjach w wyznaczonych przedziałach czasowych.
W tabeli 2.1 zestawiono porównanie wyników badań właściwości nawozowych struwitu i innych
nawozów typu NP, na glebach piaszczysto–gliniastych o odczynie kwaśnym (pH = 5,2). Wynika z niej, że
struwit jest lepszym jakościowo lub równie dobrym źródłem fosforu od testowanych handlowych nawozów.
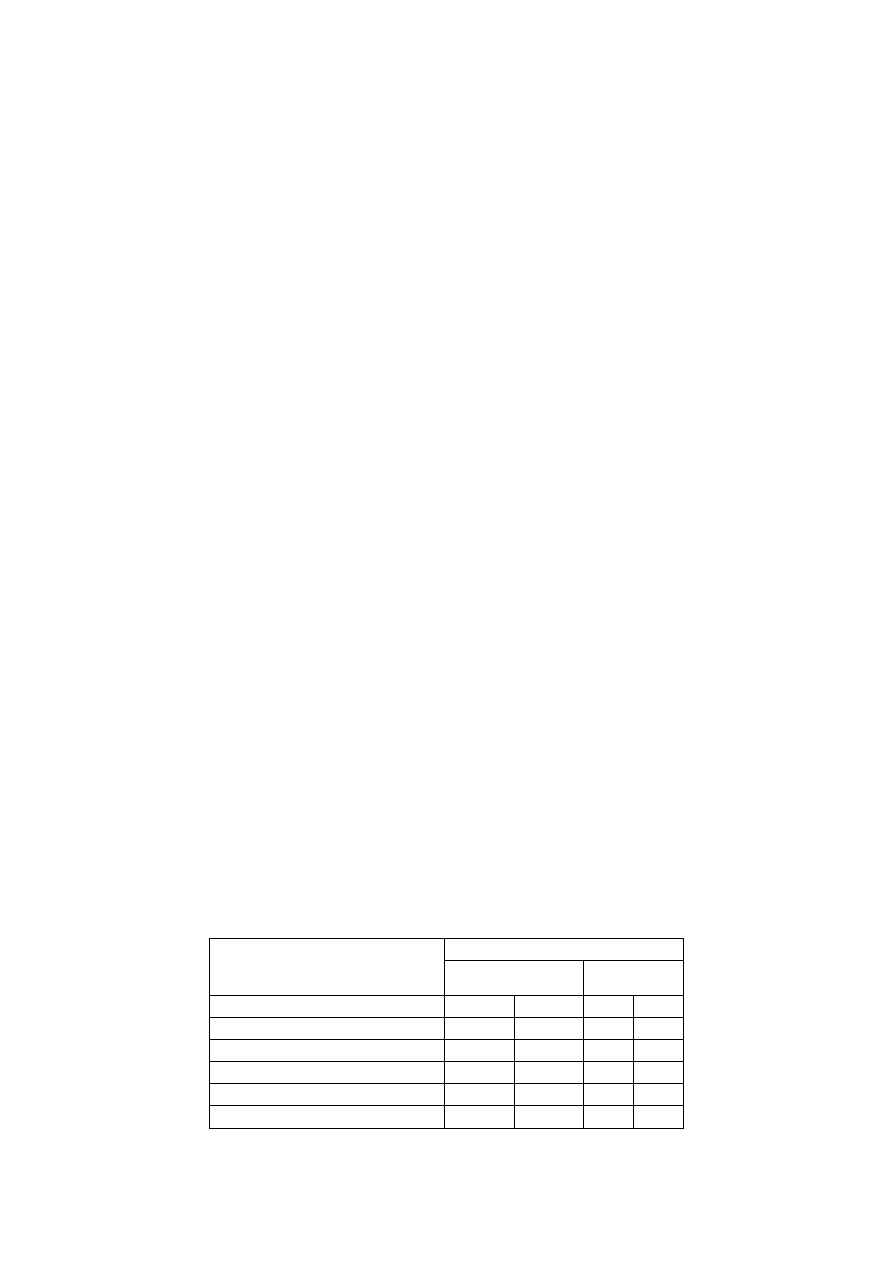
Tabela 2.1 Porównanie wyników badań właściwości nawozowych struwitu i innych nawozów typu NP.
Dawka fosforu mg P/kg gleby
Sucha masa
roślinna [g/doniczkę]
Pobór P
[mg/g plonów]
Rodzaj nawozu
6
12
6
12
Struwit
0,475
0,705
0,209 0,404
Polifosforan amonu
0,665
0,683
0,167 0,393
Ortofosforan dwuamonu
0,590
0,645
0,218 0,376
Superfosfat pojedynczy
0,605
0,616
0,197 0,338
Próbka kontrolna (zerowy dodatek P)
0,406
–
0,289
–

4
3. Proces krystalizacji masowej z roztworu
Krystalizacja masowa z roztworu jest szczególnym przypadkiem krystalizacji. Ma ona szeroki wachlarz
zastosowań: do wydzielania, oczyszczania i formowania substancji organicznych i nieorganicznych, w przemyśle
chemicznym, metalurgicznym, włókienniczym, farmaceutycznym i spożywczym, górniczym, a także w
oczyszczaniu ścieków i regeneracji odpadów.
Definiowana jest jako proces wydzielania substancji rozpuszczonej z przesyconej ma cierzystej
fazy ciekłej w postaci populacji kryształów, tworzących fazę rozproszoną w roztworze wyjściowym. Proces
ten zachodzi w całej masie (objętości) roztworu. Krystalizacja masowa z roztworu jest procesem bardziej
selektywnym oraz mniej energochłonnym niż destylacja lub ekstrakcja.
Wydzielony produkt procesu krystalizacji masowej (kryształy) charakteryzuje się:
właściwościami fizycznymi i chemicznymi,
zanieczyszczeniami,
rozkładem rozmiarów,
pokrojem kryształów.
Proces krystalizacji to kolejno następujące po sobie etapy:
wytworzenie przesycenia,
zarodkowanie,
wzrost zarodka,
wzrost kryształów.
Dobór parametrów procesu i urządzenia do jego realizacji jest jednym z trudniejszych zadań
projektowania nowoczesnych instalacji do krystalizacji masowej. Znaczna liczba rozwiązań konstrukcyjnych
wymaga takiego rozwiązania, aby przy minimalnych nakładach i najkorzystniejszych wskaźnikach
eksploatacyjnych osiągnąć maksymalną zdolność produkcyjną oraz pożądaną jakość produktu.
3.1. Istota procesu krystalizacji z reakcją chemiczną
Proces tworzenia się fazy stałej z fazy ciekłej w wyniku przesycenia roztworu wywołanego reakcją
chemiczną to krystalizacja z reakcją chemiczną. W wyniku reakcji stężenie rozpuszczonego w roztworze
produktu staje się większe od stężenia odpowiadającego w danych warunkach stężeniu równowagowemu.
Niezwykle ważny wpływ na krystalizację z reakcją chemiczną mają warunki hydrodynamiczne
panujące w krystalizatorze. Należą do nich homogenizacja przesycenia, transport kryształów wewnątrz
aparatu oraz utrzymanie sedymentujących kryształów w zawiesinie, co wymusza stosowanie przepływu.
Bardzo ważnym czynnikiem jest mieszanie, ponieważ musi zapewnić dostarczenie reagentów do strefy
reakcji chemicznej następnie odprowadzić zawiesinę zarodków od strefy wzrostu kryształów. Decyduje ono
również o rozkładzie czasów przebywania i lokalnych szybkościach reakcji chemicznej. Z intensywnością
mieszania rosną szybkości zarodkowania pierwotnego, wtórnego oraz wzrostu kryształów. W przypadku
reakcji bardzo szybkich, przebiegających momentalnie, gdzie obserwuje się duże nierównomierności
lokalnych przesyceń wybór punktów zasilania roztworami wejściowymi jest również znaczącym
czynnikiem.
Na przebieg procesu oraz jakość wytwarzanego produktu duży wpływ mają zanieczyszczenia
wprowadzane razem z reagentami. Ograniczają one bądź potęgują formowanie się zarodków i wzrost
kryształów poprzez aktywizowanie lub blokadę centrów krystalizacji. Mogą również przyczyniać się do
zmiany rozpuszczalności oraz inicjowania reakcji ubocznych.
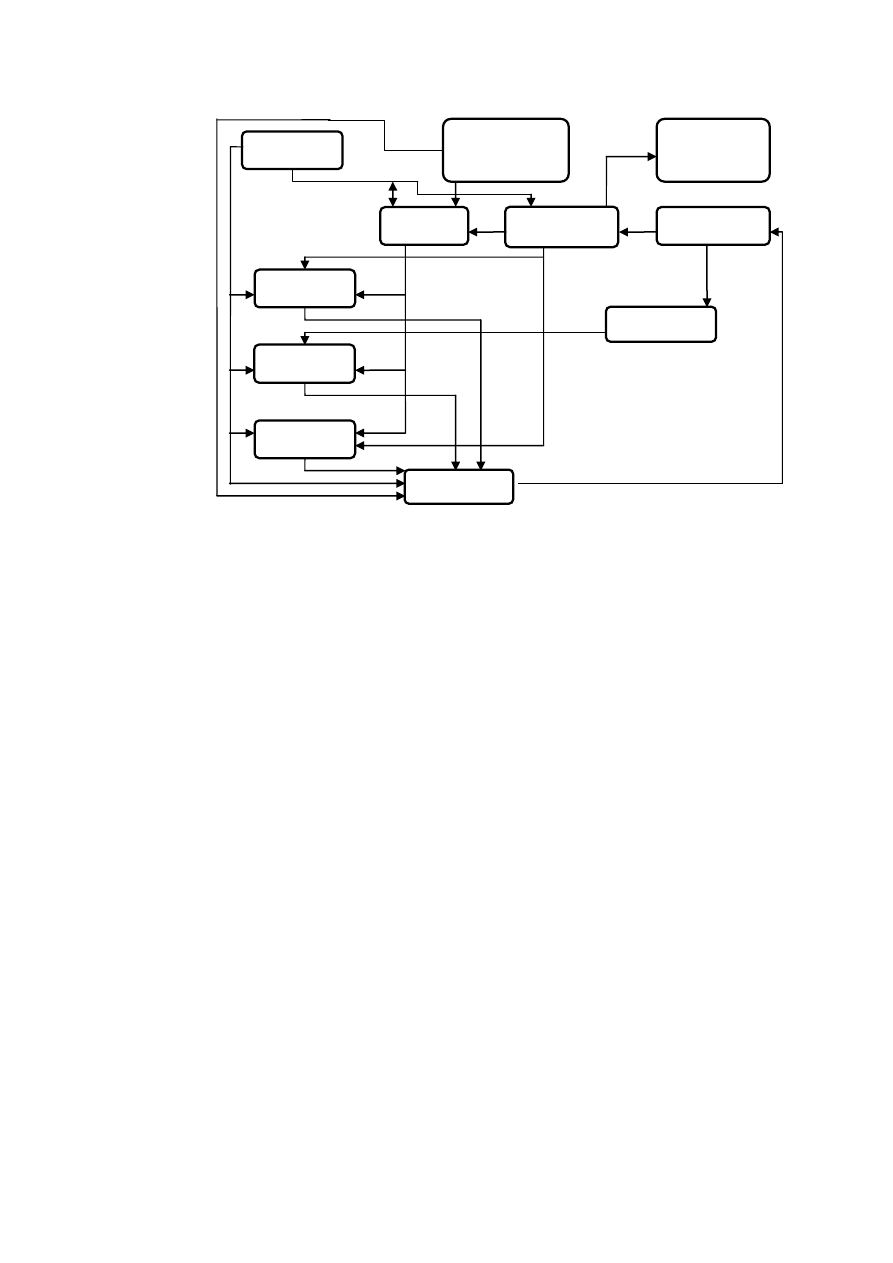
Złożoność procesu krystalizacji z reakcją chemiczną przedstawia schemat:
5
Rys. 3.1. Schemat wzajemnego powiązania wielkości wejściowych i wyjściowych w procesie krystalizacji z
reakcją chemiczną.
Z rys. 3.1 jednoznacznie wynika, że proces krystalizacji z reakcją chemiczną nie jest pojedynczym
procesem jednostkowym, lecz kompleksem takich procesów. Są one sprzężone ze sobą i najczęściej przebiegają
łącznie w czasie i w przestrzeni.
3.2. Przesycenie
Czynnikiem sprawczym (siłą napędową) procesu krystalizacji jest przesycenie. Jest ono etapem
wstępnym procesu krystalizacji i warunkuje je termodynamiczna niestabilność roztworu macierzystego. Za
pomocą przesycenia można regulować szybkość powstawania zarodków i szybkość wzrostu kryształów, a tym
samym kontrolować wydajność krystalizatora i rozmiar liniowy kryształów.
Na dobór sposobu wytwarzania przesycenia mają wpływ:
cechy i wymogi procesu technologicznego,
czynniki energetyczne lub chłodnicze,
rodzaj dostępnych surowców,
przeznaczenie produktu,
względy eksploatacyjne i ekonomiczne,
rozpuszczalność i zależność substancji od temperatury – czynnik decydujący.
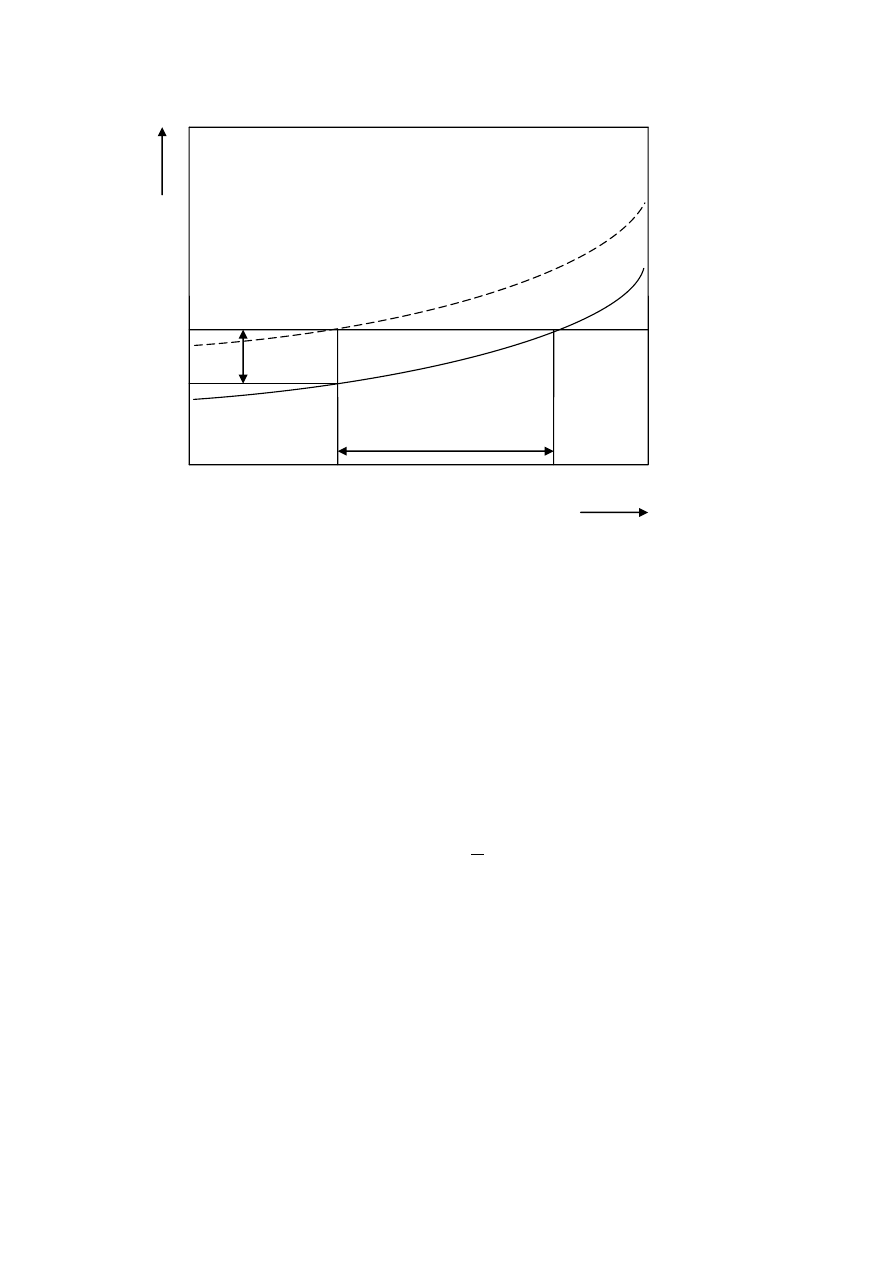
Rysunek 3.2 przedstawia sposoby przesycenia roztworu przy pomiarach zarodkowania oraz
obszary stężeniowe roztworu.
Hydrodynamika
Rozpuszczalność
Temperatura
Stężenie początkowe
Wydajność procesu
krystalizacji
Przesycenie
Gęstość zawiesiny
kryształów
Rozkład rozmiarów
kryształów
Powierzchnia
kryształów
Bilans populacji
kryształów
Aglomeracja,
ścieranie
Wzrost
kryształów
Zarodkowanie
6
Rys. 3.2. Obszary stężeniowe roztworu i sposób wyznaczania przesycenia.
Granice obszarów: A – obszar labilny, B – obszar stabilny, C – obszar metastabilny.
Z rysunku 3.2 wynika, że pierwszy zarodek powstaje na granicy obszaru metastabilnego (C) i
obszaru labilnego (A) (przesyconego). W obszarze labilnym zarodkowanie następuje samorzutnie
(spontanicznie), z kolei w obszarze metastabilnym, kryształy mogą wzrastać w sprzyjających warunkach,
spontaniczne zarodkowanie jest niemożliwe.
Faza stała może wydzielić się z roztworu tylko w roztworach przesyconych, czyli w takich, w
których stężenie substancji rozpuszczonej jest znacznie większe w stosunku do równowagowego.
Przesycenie
c można wyrazić za pomocą wzoru:
T
n
c
c
c
(3.1)
w którym rzeczywiste stężenie składnika w roztworze oznaczono c, a jego stężenie nasycenia w tych
samych warunkach temperaturowych c
n
. Przesycenie
c mierzy się najczęściej w gramach bezwodnej
substancji rozpuszczonej na 100g rozpuszczalnika. Stosunek stężenia rzeczywistego do stężenia nasycenia
nazywany jest stopniem przesycenia P:
T
n
c
c
P
(3.2)
Roztwory przesycone są roztworami niestabilnymi, w przeciwieństwie do roztworów
nienasyconych i nasyconych, które w ustalonych warunkach są nieograniczenie trwałe. Przy wzroście
przesycenia w pewnym momencie ma miejsce przejście układu ze stanu nierównowagi w stan równowagi,
charakteryzujące się spontanicznym wypadaniem zarodków krystalicznych. Takie przesycenie, w którym
zachodzi spontaniczna krystalizacja, nazywane jest przesyceniem granicznym
c
max
.
Przesycenie w aparatach do krystalizacji (krystalizatorach) wytwarza się na kilka sposobów,
najważniejsze z nich to:
chłodzenie roztworu,
odparowanie rozpuszczalnika,
wysalanie,
reakcję chemiczną (strącanie),
kombinacja powyższych procesów.
c
c
n
Roztwór nienasycony
c<1
T
T
n
Krzywa przesycenia granicznego
(spontaniczna nukleacja)
B
(
c
max
)T
C
stę
że
ni
e
Roztwór nasycony
temperatura
T
max
Roztwór przesycony
c>1
A
7
Proces chłodzenia i ogrzewania zachodzi wskutek wymiany ciepła, procesy odparowania, reakcji
chemicznej i wysalania – wskutek wymiany masy.
Gdy rozpuszczalność substancji w temperaturze końcowej procesu jest mała lub umiarkowana i silnie
rośnie z temperaturą wówczas wykorzystuje się proces chłodzenia. Do zalet tego procesu należą prostota
operacji, niskie koszty eksploatacyjne, niskie koszty czynników chłodniczych, możliwość chłodzenia do niskich
temperatur.
Ze względu na sposób realizacji chłodzenia, proces ten dzieli się na chłodzenie pośrednie (przeponowe)
przez przegrodę separującą chłodziwo od roztworu, chłodzenie bezpośrednie (bezprzeponowe) adiabatyczne
próżniowe oraz kontaktowe przy zastosowaniu niemieszającej się cieczy lub gazu.
Konieczne staje się odparowanie części rozpuszczalnika gdy rozpuszczalność substancji słabo zmienia
się z temperaturą. Wymaga to doprowadzenia ciepła do układu.
Wysalanie stosuje się, gdy rozpuszczalność substancji jest znaczna nawet w niskiej temperaturze, a
odparowanie nie jest wskazane. Proces wysalania polega na zmniejszeniu rozpuszczalności substancji
krystalizowanej w rozpuszczalniku pierwotnym przez dodanie innego rozpuszczalnika.
Przesycenie roztworu z wykorzystaniem reakcji chemicznej polega na tym, że substancja krystalizująca
powstaje w wyniku reakcji chemicznej, po zmieszaniu roztworów reagentów i wytrąca się jako najmniej
rozpuszczalna. Reagentem mieszanym z roztworem może być gaz bądź ciecz.
3.3. Zarodkowanie
Proces powstawania najmniejszych kryształów substancji rozpuszczonej jakie są stabilne
termodynamicznie w kontakcie z przesyconym roztworem macierzystym to zarodkowanie (nukleacja).
Najmniejsze kryształy to zarodki, składają się z kilkunastu do kilku tysięcy cząsteczek. Najmniejszy rozmiar
zarodka, który znajduje się w równowadze z roztworem o danym stopniu przesycenia to rozmiar krytyczny.
Kryształy o rozmiarze mniejszym rozpuszczają się w roztworze, a o rozmiarze większym rosną dalej.
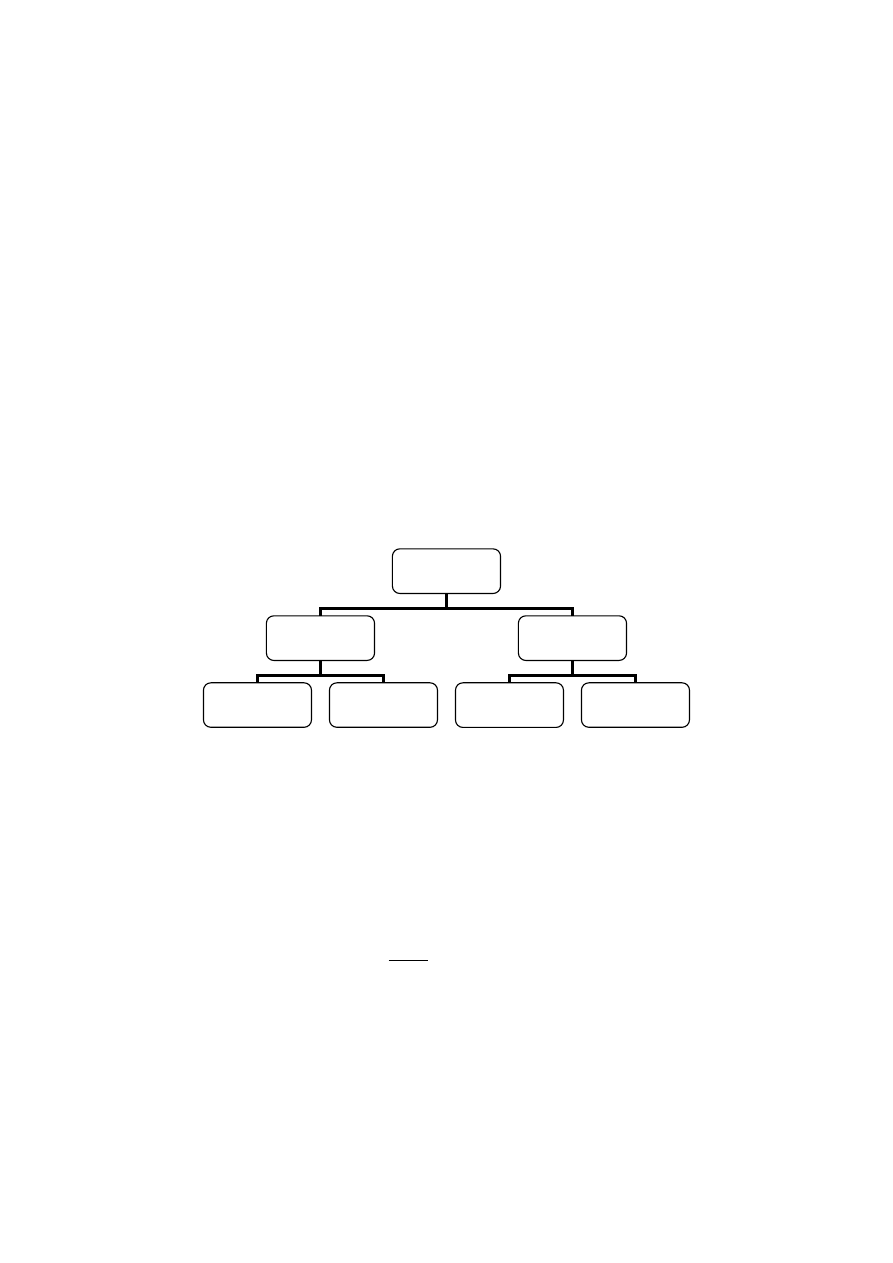
Rys. 3.3. Rodzaje i podział zarodkowania (nukleacji).
Zarodkowanie pierwotne wynika z natury roztworu i dzieli się na zarodkowanie homogeniczne i
heterogeniczne. Zarodkowanie zachodzące wskutek fluktuacji dużego przesycenia średniego to zarodkowanie
homogeniczne. Zarodkowanie heterogeniczne zachodzi przy obecności cząstek obcych np. pyłu.
Nukleacja wtórna zachodzi tylko w obecności kryształów substancji krystalizującej, zależy od jakości i
ilości fazy stałej oraz od ruchu zawiesiny w krystalizatorze, a także od ścierania i łamania się kryształów.
Zarodkowanie wtórne można podzielić na tzw. normalne i kontaktowe.
Proces powstawania zarodków opisuje równanie:
n
c
k
N
N
Nv
dτ
d
(3.3)
Rząd zarodkowania (n) zależy od rodzaju substancji krystalizującej, a jego wartość zawiera się
najczęściej w granicach od 2 do 9.
Szybkości zarodkowania (k
N
) zależy od:
typu i wielkości krystalizatora,
występowania oddziaływań mechanicznych (ultradźwięków, wstrząsów),
obecności i stężenia zanieczyszczeń,
temperatury krystalizacji,
Zarodkowanie
Pierwotne
Wtórne
Normalne
Kontaktowe
Homogeniczne
Heterogeniczne

8
stężenia substancji krystalizującej.
3.4. Wzrost kryształów
W wyniku przemiany fazowej i przejścia ze stanu ciekłego w stały, układ staje się wielofazowy.
Poszczególne cząstki stałe takiego układu nazywają się kryształami. Szczególną cechą kryształów jest to, że ich
kształt jest specyficzny dla każdej substancji. Kryształy dzieli się na mono– i polikrystaliczne.
Parametry określające wzrost kryształów to:
przesycenie,
rodzaj rozpuszczalnika,
temperatura,
rozpuszczone zanieczyszczenia,
warunki hydrodynamiczne.
Proces wzrostu ma wpływ na właściwości produktu:
rozmiar kryształów,
pokrój kryształów,
czystość i wytrzymałość mechaniczną.
Etapy procesu wzrostu kryształów:
1) dyfuzja substancji krystalizowanej z głównej masy roztworu do powierzchni kryształu,
2) absorpcja substancji na powierzchni,
3) migracja cząsteczek substancji po powierzchni i włączanie się ich do sieci krystalicznej.
3.5. Wpływ procesów towarzyszących na krystalizację
Procesy, które nieodłącznie towarzyszą krystalizacji to: rozkład przesycenia, rozdrabnianie i ścieranie
kryształów oraz aglomeracja kryształów.
Rozkład przesycenia
Bez względu na sposób generacji przesycenia, w krystalizatorze przemysłowym występują strefy
zwiększonego przesycenia przy powierzchni chłodzącej, przy powierzchni wrzenia roztworu oraz w miejscu
dopływu trzeciego składnika przy wysalaniu (lub reagentów przy precypitacji). Gdy czas cyrkulacji zawiesiny
jest dłuższy od czasu potrzebnego do znacznego obniżenia przesycenia maksymalnego przez zarodkowanie i
wzrost kryształów, od czasu półtrwania dla przesycenia wówczas rozkład przestrzenny przesycenia jest znaczny.
W procesie precypitacji szczególnie ważne jest mieszanie w fazie ciekłej, gdzie przesycenie źle rozpuszczonej
substancji krystalizującej wytwarza się zwykle przez mieszanie kilku reagentów. Prowadzi to do bardzo dużych
przesyceń lokalnych, w szczególności w procesach okresowych uzależnionych od intensywności
mikromieszania.
Rozdrabnianie i ścieranie kryształów
W wyniku zderzeń cząstek stałych w zawiesinie, jak również w trakcie zderzeń z urządzeniami
mieszającymi oraz elementami konstrukcyjnymi krystalizatora następuje proces rozdrabniania i ścierania
kryształów.
Aglomeracja kryształów
Proces aglomeracji kryształów polega na zetknięciu dwóch osobników i ich zrośnięciu. W procesie
krystalizacji może być zarówno pożądana jak i szkodliwa. Znaczne przesycenie i lepkość oraz mała
intensywność mieszania sprzyjają aglomeracji. Dodatek niektórych środków powierzchniowo czynnych obniża
ją. Aglomeracja jest niejako procesem odwrotnym do rozdrabniania.
4. Krystalizatory
Aby zapewnić wymaganą zdolność produkcyjną oraz jakość produktu przed rozpoczęciem krystalizacji
należy wybrać odpowiednią metodę prowadzenia procesu oraz urządzenie. Krystalizator jest to aparat bądź
zespół urządzeń, w których istnieją warunki do powstawania i wzrostu kryształów.
9
Dokonując wyboru metody krystalizacji oraz rodzaju krystalizatora należy zwrócić uwagę na:
wymagania produkcyjne (zdolność produkcyjna, rozmiar, kształt kryształów, czystość produktu),
właściwości fizykochemiczne roztworu i substancji krystalizowanej (rozpuszczalność, szybkość
sedymentacji, przyczepność do ścian krystalizatora tworzących się kryształów),
lokalne warunki realizacji inwestycji oraz prowadzonego procesu (lokalizacja aparatury, źródła energii,
dostępność surowców),
koszty inwestycji.
Problemy występujące przy projektowaniu krystalizatora to m.in.:
separacja kryształów,
transport czynników,
wymiana ciepła i masy,
sterowanie pokrojem i strukturą makroskopową kryształów,
sterowanie rozkładem rozmiarów kryształów.
Współczesne konstrukcje, uwzględniające dokonane osiągnięcia rozwojowe stwarzają warunki do
regulacji zarodkowania, wzrostu kryształów, ich klasyfikację jednak nie pozwalają one stworzyć krystalizatora
uniwersalnego. Szeroki zakres parametrów przebiegu krystalizacji oraz różnorodność właściwości układów
fizykochemicznych, zmuszają do indywidualnego doboru elementów konstrukcyjnych i warunków pracy
krystalizatora.
4.1. Systematyka krystalizatorów
Najbardziej ogólny podział krystalizatorów to podział ze względu na charakter pracy:
krystalizatory pracujące okresowo,
krystalizatory pracujące ciągle.
Podział ten zależy od zdolności produkcyjnej i od rodzaju substancji krystalizowanej. Jeśli reagent jest
tani, to zaleca się krystalizację ciągłą, natomiast jeśli jest drogi – okresową. Dla dużych zdolności
produkcyjnych konieczna jest ciągła praca krystalizatora.
Inna systematyka dzieli krystalizatory na:
zbiorniki stacjonarne bez elementów ruchomych wymuszających stan zawieszenia kryształów,
aparaty wyposażone w urządzenia umożliwiające utrzymanie kryształów w zawieszeniu w roztworze
macierzystym.
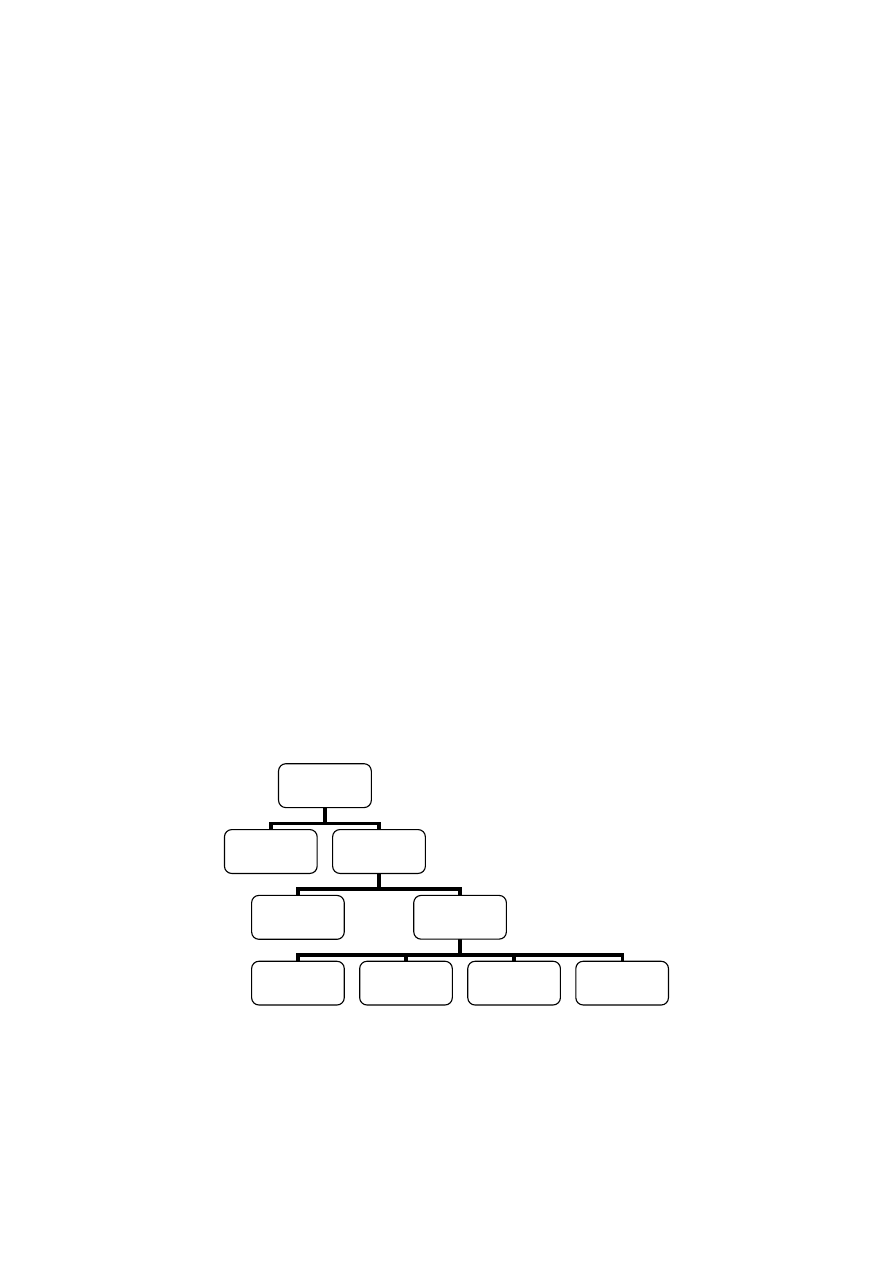
Pod względem hydrodynamicznym wyróżnia się:
Rys. 4.1. Podział krystalizatorów ze względu na hydrodynamiczne warunki prowadzenia procesu.
Obieg wymuszony umożliwia szerszą elastyczność ruchową i stwarza lepsze warunki do kontroli procesu.
Są one szeroko stosowane do masowej krystalizacji z roztworów, dużej liczby organicznych i nieorganicznych
produktów chemicznych. Równomierna cyrkulacja zawiesiny lub roztworu w krystalizatorze z wymuszonym
obiegiem prowadzi do likwidacji lokalnych przesyceń, stabilizacji temperatury i utrzymania wszystkich
kryształów w zawieszeniu, co dodatnio wpływa na ich wzrost, a równocześnie umożliwia ścisłą kontrolę
Krystalizatory
Bez cyrkulacji
Z cyrkulacją
Z obiegiem
naturalnym
Z obiegiem
wymuszonym
Z obiegiem
roztworu
Z obiegiem
zawiesiny
Zewnętrznym
Wewnętrznym
10
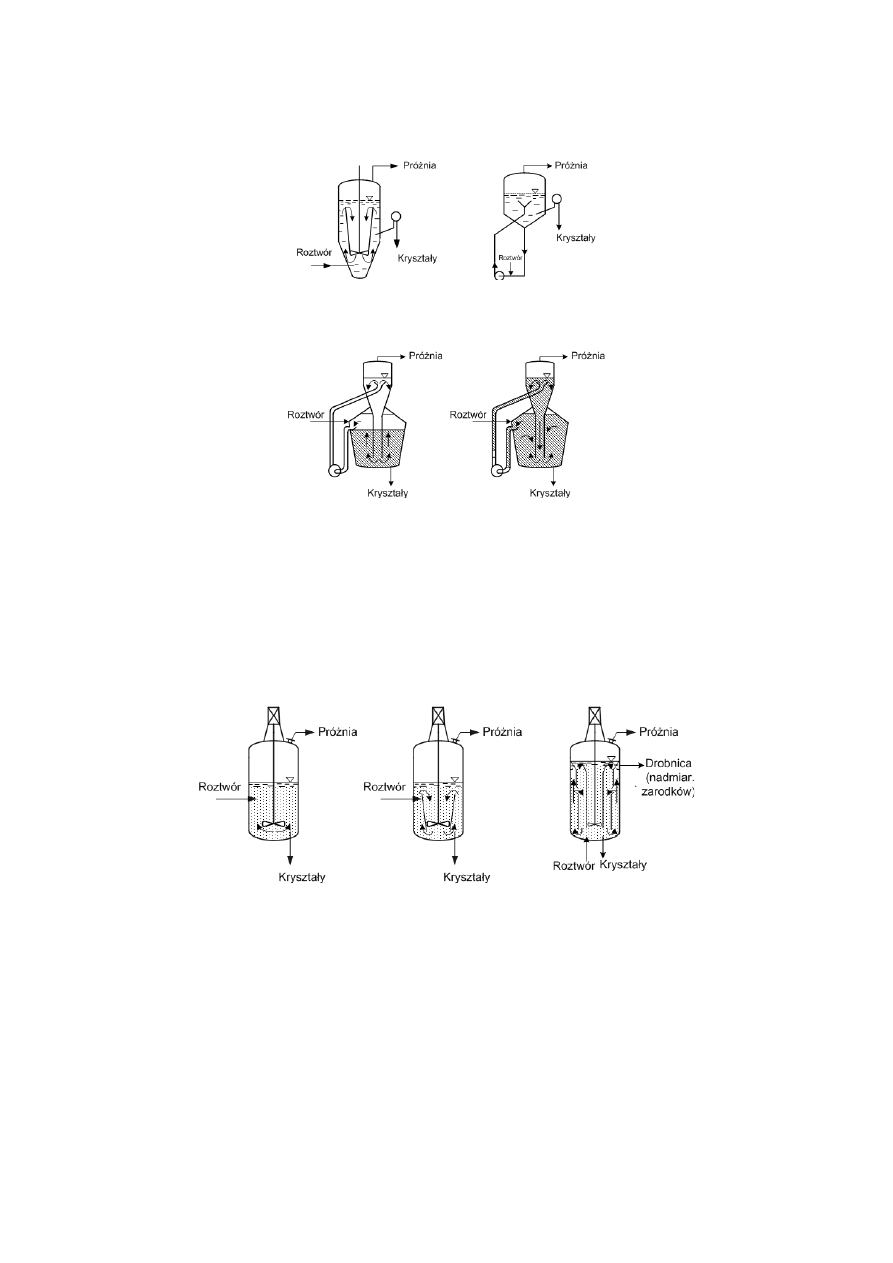
parametrów i prowadzenie krystalizacji w optymalnych kinetycznych i hydrodynamicznych warunkach. Dzięki
temu otrzymuje się jednorodny produkt o pożądanym rozmiarze. Przykłady takich krystalizatorów przedstawiają
rysunki 4.2. i 4.3.
Rys. 4.2. Schemat krystalizatora:
a) z cyrkulacją wewnętrzną, b) bez cyrkulacji, oraz z obiegiem: a) wewnętrznym, b) zewnętrznym.
Rys. 4.3. Schemat krystalizatora w wymuszonym obiegiem:
a) roztworu, b) zawiesiny.
Ze względu na skład granulometryczny otrzymywanych kryształów można wyróżnić:
krystalizatory dające produkt polidyspersyjny,
krystalizatory dające produkt wysoce jednorodny.
Dobór krystalizatora zależy od możliwości kontroli zarodkowania i wzrostu kryształów oraz ich
klasyfikacji w aparacie. Zasadnicze różnice w budowie krystalizatorów bez kontroli i z kontrolą zarodkowania i
wzrostu kryształów oraz ich klasyfikację w aparacie przedstawia rysunek 4.4.
Rys. 4.4. Podział krystalizatorów wg kryterium kontroli wzrostu i klasyfikacji ziaren:
a) bez możliwości kontroli, b) z kontrolą przesycenia, c) z kontrolą przesycenia
i klasyfikacją ziaren.
Pod względem sposobu wytwarzania przesycenia wyróżniamy:
krystalizatory z chłodzeniem przeponowym,
krystalizatory wyparne,
krystalizatory z adiabatycznym odparowaniem części rozpuszczalnika pod zmniejszonym ciśnieniem,
krystalizatory z chłodzeniem bezprzeponowym,
krystalizatory do procesów wysalania,
krystalizatory z reakcją chemiczną.
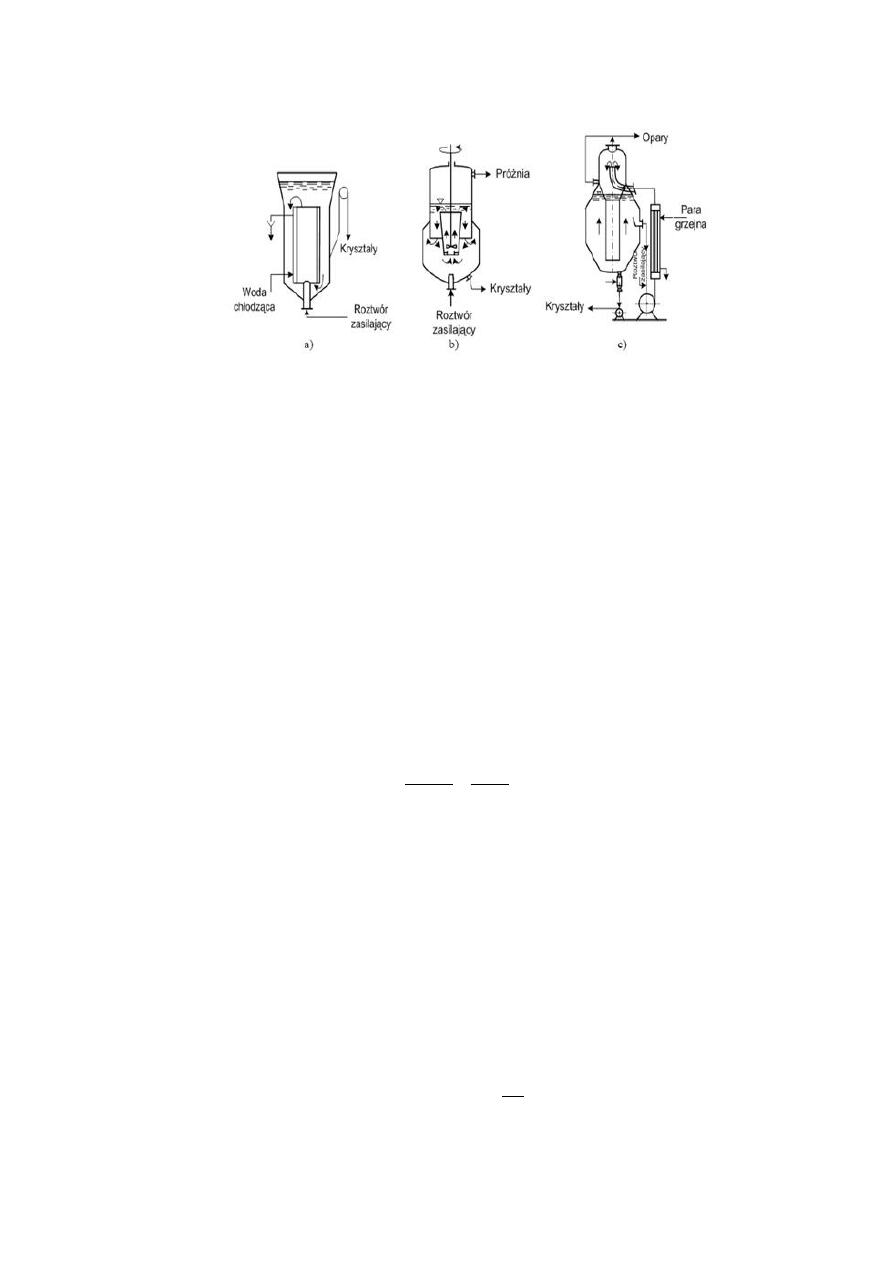
11
Rys. 4.5. Podział krystalizatorów wg sposobu osiągania przesycenia:
a) chłodzenie przeponowe, b) chłodzenie próżniowe, c) odparowanie.
5. Kinetyka krystalizacji ciągłej w krystalizatorze MSMPR
Opisując ilościowo proces krystalizacji masowej w krystalizatorze należy wziąć pod uwagę prawo
zachowania liczby kryształów. Wyraża ono ilościowo bilans liczbowy kryształów, inaczej nazywane jest
bilansem populacji. Prawo to stanowi, że liczba kryształów zasilających i powstających w krystalizatorze w
stanie ustalonym pracy ciągłej (lub okresowej) jest równa liczbie kryształów opuszczających aparat razem z
zawiesiną produktu.
Z bilansu liczbowego procesu krystalizacji można uzyskać zależność między liczbą kryształów, a ich
rozmiarem (CSD – Crystal Size Distribution) wynikające z kinetyki i hydrodynamiki procesu, konstrukcji
krystalizatora, parametrów decyzyjnych oraz innych procesów towarzyszących. Stanowi również istotną miarę
jakości produktu krystalicznego.
5.1. Szybkość wzrostu kryształów niezależna od ich rozmiarów (SIG)
Do opisu kinetyki badań zaproponowano najprostszy i najbardziej wyidealizowany model krystalizatora
MSMPR (Mixed Suspension Mixed Product Removal crystallizer). Jest to aparat o działaniu ciągłym z idealnie
wymieszaną zawiesiną i odbiorem niesklasyfikowanego, reprezentatywnego produktu.
Bilans populacji kryształów można przedstawić w postaci równania różniczkowego:
0
τ
)
(
)
(
L
n
L
L
n
G
d
d
(5.1)
Dla uproszczenia bilansu populacji zakłada się, że:
zarodki powstające w krystalizatorze mają rozmiar zerowy,
nie występuje dyspersja wzrostu kryształów,
roztwór zasilający nie zawiera kryształów,
kryształy są podobne geometrycznie,
liczba kryształów jest duża, dlatego rozkład ich rozmiarów można uważać za funkcję ciągłą,
szybkość wzrostu kryształów nie zależy od ich rozmiarów (G(L) = const. dla danego przesycenia –
SIG) – zasada McCabe’a,
nie zachodzą procesy aglomeracji, agregacji, ścierania i rozdrabniania kryształów.
Z równania (5.1) można otrzymać następujące zależności:
1. Rozkład gęstości populacji cząstek n(L):
)
τ
exp(
)
(
0
G
L
n
L
n
(5.2)
lub

12
)
τ
exp(
)
(
G
L
G
B
L
n
(5.3)
gdzie: B – szybkość zarodkowania
n
0
– gęstość populacji zarodków powiązane ze sobą:
B = n
0
G
(5.4)
Czas przebywania zawiesiny w krystalizatorze oblicza się ze wzoru:
v
w
q
V
(5.5)
2. Szybkość wzrostu kryształów G:
Równanie (5.2) po zlogarytmowaniu można zapisać następująco:
G
L
n
L
n
0
ln
)
(
ln
(5.6)
gdzie: n – gęstość populacji kryształów, 1/m
3
m; n
0
– gęstość populacji zarodków, 1/m
3
m; L – charakterystyczny
rozmiar kryształów, m; G – liniowa szybkość wzrostu kryształów, m/s;
– średni czas przebywania, s.
Graficznie równanie to przedstawia linię prostą w półlogarytmicznym układzie współrzędnych lnn(L) = f(L).
Punkt przecięcia tej prostej z osią y pozwala wyznaczyć wartość n
0
. A dzięki tangensowi kąta nachylenia
możemy wyznaczyć szybkość wzrostu G:
G
tg
1
(5.7)
3. Sumaryczną liczbę kryształów N
T
:
N
T
= n
0
Gτ = Bτ
(5.8)
4. Sumaryczną powierzchnię właściwą kryształów A
T
:
3
0
a
T
)
τ
(
2
G
n
k
A
(5.9)
5. Sumaryczną masę kryształów w 1 m
3
zawiesiny:
M
T
= 6 k
v
ρ
s
n
0
(Gτ)
4
= 6 k
v
ρ
s
Bτ (Gτ)
3
(5.10)
6. Wielkości charakteryzujące rozkład rozmiarów kryształów:
L
m
= 4Gτ
(5.11)
L
50
= 3,672 Gτ
(5.12)
Średni rozmiar kryształów L
m
oblicza się również ze wzoru:
i
i
i
m
L
x
L
(5.13)
gdzie: x
i
– udział masowy poszczególnych frakcji w produkcie, L
i
– średni rozmiar otworów dwóch
kolejnych sit (L
i
= 0,5(l
i
+l
i+1
)).

13
Niejednorodność populacji kryształów ocenia się przez obliczenie tzw. współczynnika zmienności CV (CV –
Coefficient of Variation) zdefiniowanego przez zależność:
%
100
2
CV
50
84
16
L
L
L
(5.14)
gdzie: L
16
i L
84
– rozmiary otworów sita, na których pozostaje odpowiednio 16% mas. i 84% mas. kryształów
populacji, L
50
– tzw. środkowy rozmiar otworów sita, przez który przesypuje się 50% mas. analizowanego
materiału.
Najprostszy model kinetyki procesu ciągłej krystalizacji w krystalizatorze z idealnym mieszaniem zawiesiny
określa równanie (5.6)
Parametry tego równania wyznacza się z masowego (lub objętościowego) rozkładu rozmiarów kryształów
produktu, obliczając gęstość populacji kryształów:
i
i
v
L
L
k
M
x
V
L
L
k
V
V
L
L
k
m
n
3
T
i
w
i
3
i
v
i
w
i
3
i
v
i
i
ρ
ρ
(5.15)
gdzie: n
i
– gęstość populacji frakcji i kryształów, 1/m
3
m; m
i
– masa kryształów frakcji i, kg; k
v
–
objętościowy współczynnik kształtu kryształów;
– gęstość kryształów, kg/m
3
; L
i
– średni rozmiar
kryształów frakcji i, m;
L
i
– zakres rozmiarów kryształów frakcji i, m; V
w
– objętość robocza krystalizatora,
m
3
; V
i
– objętość kryształów frakcji i, m
3
; M
T
– zawartość kryształów w zawiesinie (gęstość zawiesiny), kg
m
–3
, x
i
– udział masowy poszczególnych frakcji w produkcie.
Obliczone wartości przedstawia się w układzie półlogarytmicznym: lnn(L), L. Dla L = 0 odczytuje się gęstość
populacji zarodków n
0
, a z nachylenia prostej – liniową szybkość wzrostu G, jeżeli znany jest średni czas
przebywania
(Patrz: Przykład – Wykres n(L)).
6. Struwit
6.1. Właściwości fizyczne i chemiczne
Sześciowodny fosforan magnezu i amonu MgNH4PO4·6H2O – struwit – jest substancją krystaliczną
zawierającą 65,20% O, 12,62% P, 9,9% Mg, 6,57% H i 5,71% N. Tworzy ortorombowe piramidalne kryształy.
Wewnętrzna struktura kryształu składa się z regularnych tetraedrów PO
4
3–
zniekształconych oktaedrami
Mg(H
2
O)
6
2+
i grupami NH
4
+
powiązanymi za pomocą wiązań wodorowych. W zależności od warunków forma
kryształu struwitu może być różna – izomeryczna, trapezowa, graniasto–pryzmatyczna lub rurowa.
Zawartość domieszek, a także przesycenie roztworu wpływa na formę kryształu. Znaczny stopień
przesycenia (pH > 8, wysokie stężenie jonów magnezu i amonu) sprzyja formowaniu się dwuwymiarowych i
trójwymiarowych kryształów bliźniaczych. Z kolei w warunkach dużego przesycenia przy pH ≈ 7 formują się
kryształy rurowe.
Powstawanie kryształów o średniej wielkości jest determinowane przede wszystkim szybkością
zarodkowania pierwotnego, zwłaszcza w krystalizatorach ciągłego działania. Jeżeli poziom przesycenia jest
wysoki, to również zarodkowanie pierwotne jest szybkie, co powoduje przyspieszone formowanie się dużej
ilości kryształów o wielkości 0,05
m w ciągu zaledwie 5 sekund. Jednak niemożliwy jest późniejszy wzrost
kryształów w wyniku spadku stężenia odpowiednich jonów w roztworze. Wraz ze zwiększeniem obciążenia
reaktora średnia wielkość kryształów maleje, w wyniku ścierania, uszkodzenia bądź zniszczenia kryształów.
Czas przebywania w reaktorze odgrywa bardzo ważna rolę również w powstawaniu kryształów o średniej
wielkości.
Kryształy struwitu mogą być żółte, brązowe, jasno brunatne, a po dehydracji białe. Rzadko są bezbarwne.
Charakteryzują się wyraźną łupliwością. Twardość osiąga wartość 1,5 – 2 w skali Mohsa, gęstość 1710 kg/m
3
.

14
6.2. Kinetyka strącania struwitu
Fosforan magnezu i amonu strąca się samorzutnie według reakcji:
HPO
4
2–
+ Mg
2+
+ NH
4
+
+ 6H
2
O = MgNH
4
PO
4
∙ 6H
2
O↓ + H
+
Na proces strącania struwitu wpływa:
siła jonowa oraz temperatura,
pH,
przesycenie roztworu (czas przebywania w krystalizatorze ciągłego działania),
stężenie jonów magnezowych, amonowych i fosforanowych(V).
Wytrącanie struwitu następuje wówczas, gdy iloczyn stężeń jonów magnezu, amonu i fosforanowych(V)
będzie większy od wartości stałej K
sp
:
[Mg
2+
][NH
4
+
][PO
4
3–
] = K
sp
Wartości pK
sp
mieszczą się w zakresie 9.4 – 13.26. Tak znaczny zakres wartości związany jest z
domieszkami zawartymi w składnikach, które mogą tworzyć związki kompleksowe z jonami magnezu, amonu i
fosforanowymi, znacznie zwiększając rozpuszczalność struwitu.
Rozpuszczalność struwitu zależy od pH środowiska. Regulacja pH zapobiega reakcjom ubocznym –
wytrącanie wodorotlenku magnezu, hydroksyfosforanu magnezu, wodorofosforanu magnezu. Wytrącają się one
wcześniej niż krystalizujący struwit ze względu na amorficzny charakter. Regulację pH można kontrolować za
pomocą roztworów: wodorotlenku wapnia Ca(OH)
2
, wodorotlenku sodu NaOH lub wodorotlenku magnezu
Mg(OH)
2
. Wraz ze wzrostem pH rozpuszczalność struwitu maleje, natomiast potencjał jego wytrącania rośnie
(rys. 6.1).
Rys. 6.1. Wpływ pH na formowanie się struwitu.
Mniejszy wpływ na strącanie struwitu niż pH i stężenie składnika mineralnego ma temperatura. W
zakresie 0 – 20 ºC rozpuszczalność struwitu wzrasta osiągając swoje maksimum, powyżej 20 ºC zaczyna spadać.
6.3. Metody wytwarzania struwitu
Do metod usuwania fosforu i odzyskiwania fosforanów ze ścieków w skali doświadczalnej, pilotażowej i
przemysłowej należą:
CSIR (fosforany wapnia lub fosforany magnezu i/lub potasu, Republika Południowej Afryki),
PHOSNIX UNITAKA (struwit, Shimane, Sakai – Japonia, Brisbane – Australia),
OFMSW/BNR (struwit, Treviso – Włochy),
DHV CRYSTALACTOR (fosforany wapnia, Darmstadt, Gaggenau – Niemcy, Chelmsford – UK,
Westerbork i inne),
KURITA WATER INDUSTRIES (fosforany wapnia, skala doświadczalna),
SYDNEY WATER POARD PROCESS (fosforany wapnia, Warriewood – Australia).

15
Proces krystalizacji ze złożem fluidalnym CSIR został opracowany w skali laboratoryjnej. Polega na
usuwaniu fosforu z różnych roztworów, w postaci granulowanego hydroksyapatytu Ca
5
(PO
4
)
3
OH lub struwitu
MgNH
4
PO
4
∙6H
2
O, przy minimalnej ilości szlamów odpadowych. Struwit odzyskuje się w reaktorze z roztworów
przesyconych przy pH>8, w obecności łupków i koksiku jako zarodków krystalizacji. Do korygowania pH
stosuje się wodorotlenek sodu NaOH.
Proces Phosnix Unitaka jest to trójstopniowy proces odzyskiwania fosforu w postaci struwitu ze ścieków
wzbogaconych uprzednio w fosfor (30–905 mg P/dm
3
) na drodze biologicznej. Proces prowadzony jest w
zasilanym powietrzem reaktorze fluidalnym. Czas przebywania w reaktorze (1–2h) pozwala na usunięcie 94%
fosforu.
Proces OFMSW i BNR jest procesem trzystopniowym, który łączą anaerobową fermentację organicznej
frakcji stałych odpadów komunalnych (Organic Fraction of Municipal Sewage Waste – OFMSW) oraz proces
biologicznego usuwania ze ścieków pierwiastków pokarmowych (Biological Nutrients Removal – BNR) z
krystalizacją fosforanów. W rezultacie uzyskuje się nawóz w postaci struwitu.
7. Krystalizacja z reakcją chemiczną strącania struwitu w krystalizatorze o działaniu
ciągłym typu DT z mieszadłem śmigłowym
7.1. Założenia do ćwiczenia
Strącanie i krystalizacja struwitu przebiega według reakcji:
HPO
4
2–
+ Mg
2+
+ NH
4
+
= MgNH
4
PO
4
∙6H
2
O↓ + H
+
Surowce:
roztwór jonów fosforanowych
roztwór jonów magnezu
roztwór jonów amonu
oraz
roztwór alkalizujący – roztwór NaOH o stężeniu 20% mas. (lub o stężeniu < 20% mas. NaOH)
Przygotowanie roztworu wejściowego do krystalizatora o działaniu ciągłym typu DT:
Skład roztworu:
Roztwór A: [PO
4
3–
] = 1,00% mas.; [Mg
2+
] = 0,256% mas.; [NH
4
+
] = 0,190% mas.
Roztwór B: [PO
4
3–
] = 0,20% mas.; [Mg
2+
] = 0,0512% mas.; [NH
4
+
] = 0,0380% mas.
W roztworach A i B stosunek molowy reagentów PO
4
3–
: Mg
2+
: NH
4
+
= 1 : 1 : 1, a zatem jest to stosunek
stechiometryczny (patrz reakcja chemiczna strącania struwitu).
Przygotowanie roztworu:
Odważyć:
Roztwór A:
Roztwór B:
60,57 g NH
4
H
2
PO
4
12,11 g NH
4
H
2
PO
4
107,06 g MgCl
2
∙6H
2
O
21,41 g MgCl
2
∙6H
2
O
4832,37 g H
2
O
4966,48 g H
2
O
–––––––––––––––
–––––––––––––––
Razem: 5000 g
Razem: 5000 g
Roztwór alkalizujący (roztwór NaOH) – do dyspozycji wykonawców ćwiczenia
16
Parametry pracy krystalizatora DT:
– roztwór wejściowy o zadanym składzie (stężeniu reagentów): Roztwór A lub Roztwór B;
– temperatura T = 298 K;
– pH = 9, 10 lub 11;
– średni czas przebywania zawiesiny w krystalizatorze DT
= 900, 1800 lub 3600 s.
Czas pracy krystalizatora DT:
5
– od momentu ustabilizowania się zadanych parametrów procesu: przepływy, czas przebywania, pH,
temperatura.
7.2. Stanowisko badawcze
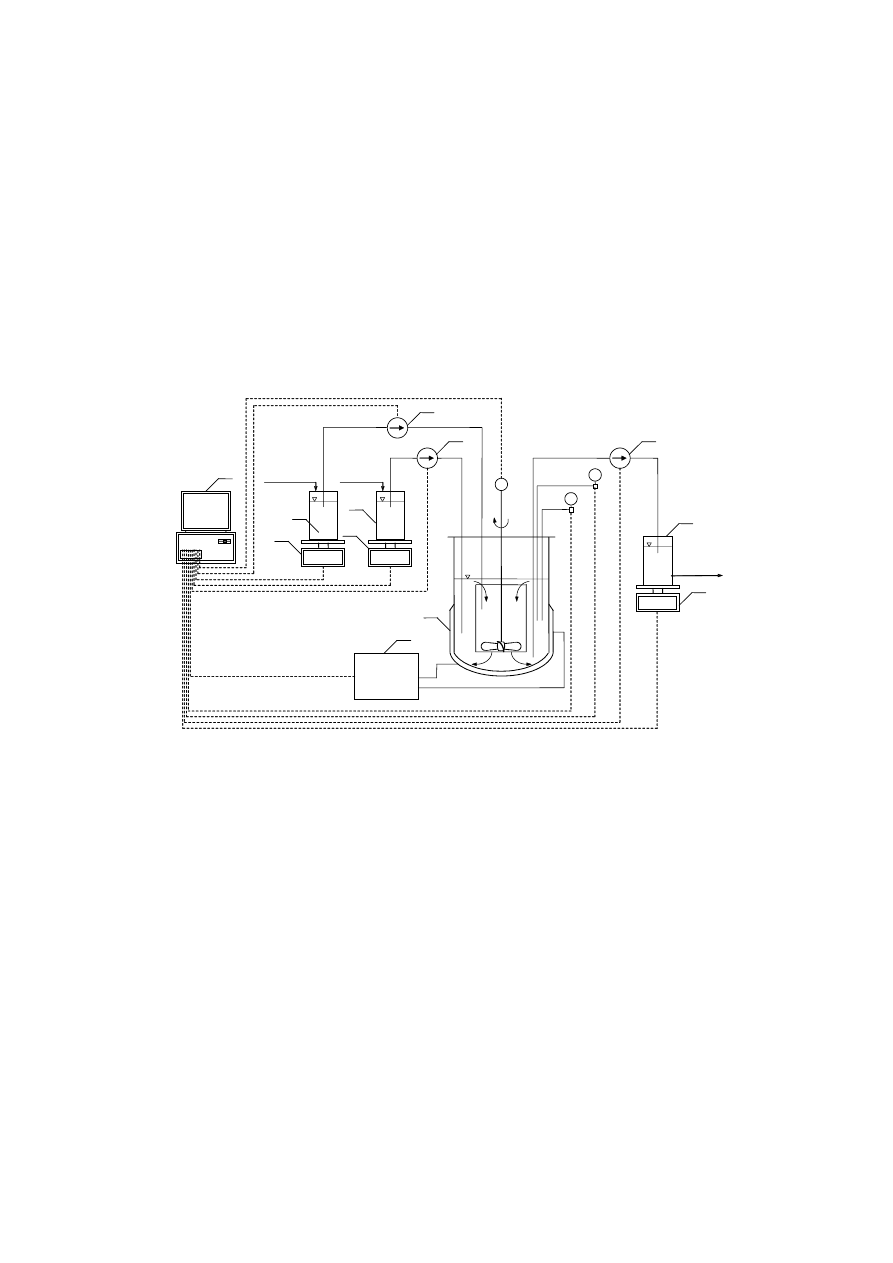
Schemat stanowiska do badań strącania i krystalizacji struwitu przedstawiono na rysunku 7.1.
Rys. 7.1. Schemat stanowiska badawczego z krystalizatorem o działaniu ciągłym z mieszadłem
śmigłowym do strącania i krystalizacji struwitu: 1 – krystalizator typu DT z wewnętrzną cyrkulacją
zawiesiny, 2 – termostat, 3 – komputer, 4 – zbiornik roztworu zasilającego: roztwór wodny MgCl
2
,
NH
4
H
2
PO
4
i Na
2
SO
4
lub NaNO
3
5 – pompa dozująca surowiec, 6 – zbiornik roztworu alkalizującego:
roztwór wodny NaOH, 7 – pompa dozująca roztwór NaOH, 8 – pompa odbioru zawiesiny kryształów
produktu z krystalizatora, 9 – zbiornik magazynowy zawiesiny kryształów produktu, 10, 11, 12 –
waga, M – kontrola obrotów mieszadła, pH – kontrola odczynu, T – kontrola temperatury.
Sterowanie, kontrola i rejestracja danych pomiarowych odbywają się za pomocą komputera.
Stanowisko pomiarowe zestawiono z urządzeń firmy IKA Labortechnik: reaktor LR–A1000, mieszadło
śmigłowe trójłopatkowe R1382 z napędem EUROSTAR POWER control–visc P4 z przekładnią, termostat LT5
control, pompy perystaltyczne PA–MI digital oraz miernik temperatury IKATRON DTM 11 z czujnikiem
temperatury PT100.4/5. Dla celów idealnej precyzyjnej kontroli pracy układu pomiarowego pracującego w
stanie ustalonym wykorzystano oprogramowanie IKA labworldsoft. Odczyn środowiska reakcji chemicznej i
krystalizacji mierzono za pomocą elektrody pH–metrycznej EPP–3 i wielofunkcyjnego urządzenia pomiarowego
ELMETRON CX–741.
Objętość robocza krystalizatora z mieszadłem śmigłowym wynosi V
w
= 0,6 dm
3
. Jest to szklany
zbiornik cylindryczny (V
t
= 1 dm
3
, D = 120 mm, H = 123 mm), w dolnej części zaopatrzony w zewnętrzny
płaszcz grzejny/chłodzący wykonany ze stali nierdzewnej i zapewniający stałość temperatury procesu. W
centralnej osi aparatu umieszczono cylindryczną rurę cyrkulacyjną (Draft Tube: d
dt
= 57 mm, h
dt
= 53 mm),
wewnątrz której usytuowano trójłopatkowe mieszadło śmigłowe (d
m
= 55 mm, d
s
= 8 mm). Liczba obrotów
mieszadła powinna być we wszystkich pomiarach stała i wynosić N = 240 obr./min. (lub mniej), zapewniając
M
T
produkt
roztwór
NaOH
pH
MgCl
2
+NH
4
H
2
PO
4
3
11
6
5
7
1
2
9
8
10
4
12

17
stabilną i dostatecznie intensywną cyrkulację wewnątrz krystalizatora. Odległość mieszadła od wyoblonego dna
krystalizatora wynosi h
p
= 7 mm.
7.3. Sposób wykonywania pomiarów
Proces strącania i krystalizacji sześciowodnego fosforanu magnezu i amonu przeprowadza się w
krystalizatorze ciągłego działania z wewnętrzną cyrkulacją zawiesiny o pojemności roboczej 0,6 dm
3
. Do
krystalizatora 1 (rys. 7.1) ze zbiornika 4 wprowadza się surowiec – roztwór wodny chlorku magnezu MgCl
2
,
diwodorofosforanu amonu NH
4
H
2
PO
4
oraz wody destylowanej o ściśle określonych analitycznie stężeniach
składników (patrz pkt. 7.1) za pomocą pompy 5 do wnętrza rury cyrkulacyjnej (obroty mieszadła 240 obr./min.;
ruch zawiesiny – ku dołowi), pompą 7 między korpus krystalizatora i rurę (ruch zawiesiny – ku górze) dozuje się
wodny roztwór wodorotlenku sodu NaOH (o stężeniu 20% mas.) w proporcjach zapewniających założoną,
kontrolowaną wartość pH środowiska strącania fosforanów. Pompą nr 8 odbiera się zawiesinę z dna
krystalizatora do zbiornika 9. Temperaturę w krystalizatorze kontroluje się za pomocą czujnika PT 100. Kontroli
poddany jest również strumień zawiesiny, strumień roztworu zasilającego krystalizator, poziom zawiesiny w
aparacie (objętość robocza), praca i obroty mieszadła.
Pomiary prowadzi się w temperaturze T = 298 K zakładając pH równe 9, 10, 11 dla kolejnych serii
badań i średni czas przebywania zawiesiny w krystalizatorze
= 900, 1800, 3600 s. Po ustaleniu się w
krystalizatorze zadanych parametrów, proces prowadzi się jeszcze przez 5
(osiągnięcie – w przybliżeniu – stanu
stacjonarnego). Po upływie tego czasu określa się metodami analitycznymi stężenie fazy stałej w zawiesinie
kryształów produktu (M
T
), rozkład rozmiarów kryształów struwitu (laserowy analizator cząstek stałych
COULTER LS–230), skład chemiczny roztworu macierzystego i fazy stałej (plazmowy spektrometr emisyjny
ICP–AES CPU7000 PHILIPS, spektrometr IR PU 9712 PHILIPS), oraz kształt kryształów (elektronowy
mikroskop skaningowy JOEL JSM 5800LV).
7.4. Wynik ćwiczenia
Wynik procesu krystalizacji strąceniowej:
Po upływie czasu = 5
:
zatrzymać dostarczanie surowca i roztworu neutralizującego oraz odbiór zawiesiny produktu;
zawartość krystalizatora DT (zawiesinę kryształów) przelać do zlewki, zważyć, rozdzielić zawiesinę na
filtrze próżniowym, zważyć fazę stałą i fazę ciekłą;
po wysuszeniu fazy stałej: analiza rozkładu rozmiarów kryształów (laserowy analizator cząstek stałych
COULTER LS–230), skład chemiczny fazy stałej (spektrometr IR), analiza kryształów (elektronowy
mikroskop skaningowy JEOL);
roztwór macierzysty: analiza chemiczna składu roztworu.
Obliczenie średniego rozmiaru kryształów produktu:
Obliczyć średni rozmiar kryształów produktu ze wzoru:
i
i
i
m
L
x
L
Obliczenia kinetyczne:
Z rozkładu rozmiarów kryształów (CSD) obliczyć gęstość populacji kryształów n(L):
i
i
v
L
L
k
M
x
V
L
L
k
m
n
3
T
i
w
i
3
i
v
i
i
ρ
ρ
x
i
– udział masowy frakcji kryształów;
k
v
– współczynnik objętości kryształów (przyjąć k
v
= 1);
– gęstość kryształów (gęstość struwitu
= 1710 kg/m
3
);
L
i
– średni rozmiar frakcji kryształów, m;
L
i
– zakres rozmiarów frakcji kryształów, m;
M
T
– zawartość kryształów w zawiesinie, kg/m
3
:

18
dla [PO
4
3–
] = 1,00% mas. M
T
= 24,6 kg/m
3
dla [PO
4
3–
] = 0,20% mas. M
T
= 4,8 kg/m
3
.
Narysować przebieg graficzny zależności n(L), obliczyć gęstość populacji zarodków (n
0
), liniową szybkość
wzrostu kryształów (G) i szybkość zarodkowania (B) z modelu kinetyki dla krystalizatora MSMPR, w którym
zakłada się, że G(L) = const – model SIG (Size Independent Growth kinetic model).
Porównanie wyników:
Ocenić wpływ pH i średniego czasu przebywania zawiesiny w krystalizatorze na:
– średni rozmiar kryształów produktu (L
m
)
– parametry kinetyczne procesu: n
0
, G i B
Sprawozdanie z ćwiczenia
Dla danych wejściowych:
– roztwór zasilający (Roztwór A lub Roztwór B)
– T = 298 K
– pH (9, 10 lub 11)
–
(900, 1800 lub 3600 s)
podać wartości:
– L
m
, n
0
, G, B
– porównać wpływ pH lub wpływ
na parametry wynikowe procesu: L
m
, n
0
, G, B
19
8. Przykładowe dane:
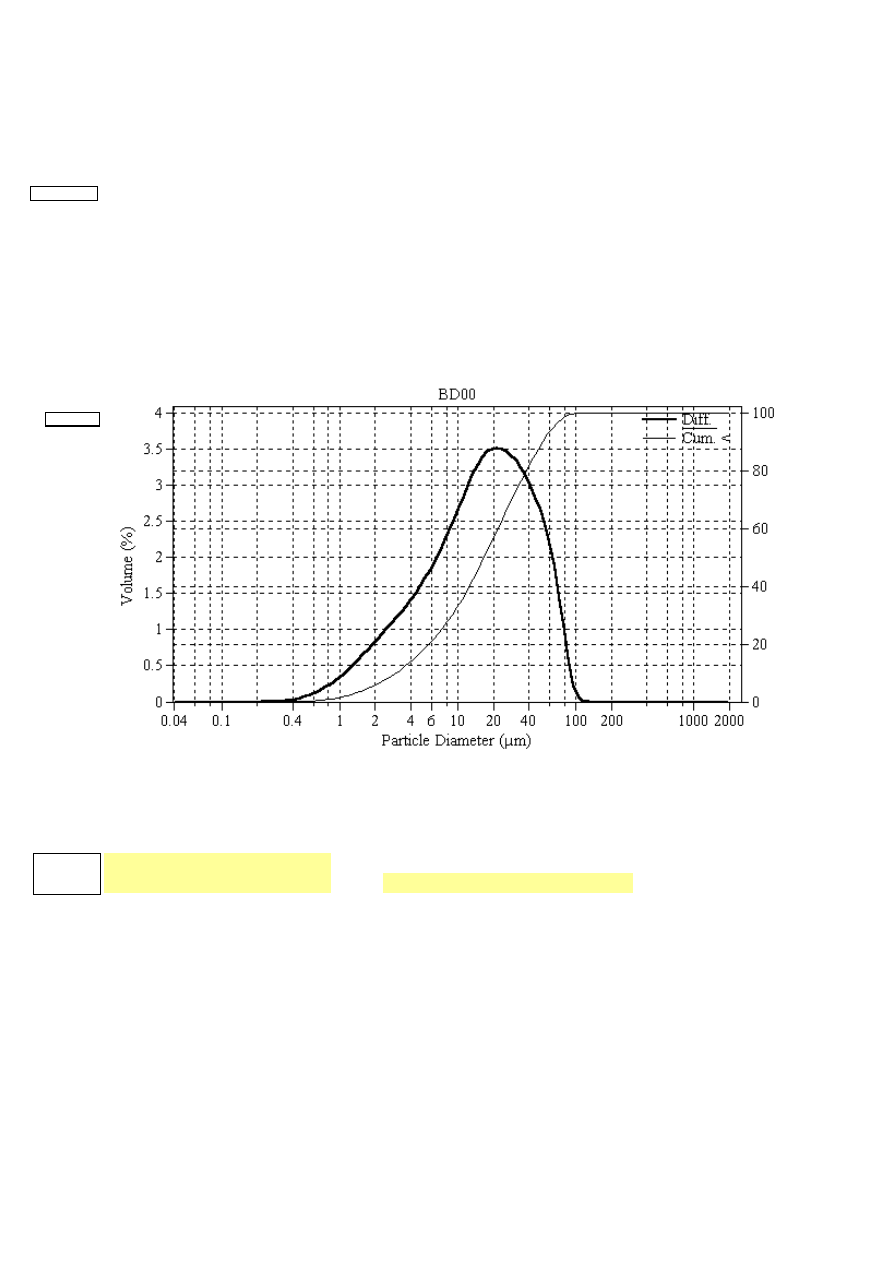
8.1. Rozkład rozmiarów kryształów z laserowego analizatora cząstek stałych COULTER LS–230
File name:
bd00.$av
Group ID:
BD00
Sample ID:
BD00
Operator:
M.Szpilka
Comments:
Optical model: Fraunhofer PIDS included
LS 230
Small Volume Module
Volume Statistics (Arythmetic)
bd00.$av
Calculations from 0.040
m to 2000
m
Volume
100.0 %
Mean:
22.67
m
S.D.:
19.78
m
Median:
16.70
m
C.V.:
87.2 %
D(3.2):
7.188
m
Skewness: 1.221 Right skewed
Mode:
21.69
m
Kurtosis:
1.051 Leptokurtic
% <
3
25
50
75
97
Size
m
1.371
7.245
16.70
32.76
71.05
Nazwa próbki
Wykres
L
m
L
50
i CV

20
bd00.$av
Particle
Volume
Diameter
% <
m
1.000
1.52
2.000
5.77
3.000
10.1
4.000
14.0
5.000
17.6
6.000
21.0
7.000
24.2
8.000
27.3
9.000
30.3
10.00
33.2
11.00
36.0
12.00
38.7
13.00
41.3
14.00
43.7
15.00
46.1
16.00
48.5
17.00
50.7
18.00
52.8
19.00
54.8
20.00
56.7
21.00
58.6
22.00
60.3
23.00
62.0
24.00
63.6
25.00
65.1
30.00
71.8
35.00
77.3
40.00
81.8
45.00
85.5
50.00
88.6
55.00
91.3
60.00
93.5
65.00
95.3
70.00
96.8
75.00
97.8
80.00
98.6
85.00
99.2
90.00
99.5
95.00
99.8
100.0
99.9
125.0
100.0
Te dane są wykorzystywane do obliczeń wartości rozmiarów kryształów L i gęstości
populacji n
0
.
Rozmiary sit
i zawartość
procentowa
ziaren struwitu
na
poszczególnych
sitach
21
a)
b)
c)
8.2. Przykład wyników pomiarów
Wykres n(L):
0
20
40
60
80
100
120
140
160
10
10
10
11
10
12
10
13
10
14
10
15
10
16
10
17
10
18
10
19
10
20
10
21
10
22
[PO
4
3–
]
RM
= 1.0 mass %, T = 298 K,
= 3600 s
pH = 9 n = 1.235
10
17
exp(–9.494
10
4
L)
pH = 10 n = 3.870
10
17
exp(–1.355
10
5
L)
pH = 11 n = 8.039
10
17
exp(–2.043
10
5
L)
P
op
ula
ti
on
d
en
sit
y / (
m
–1
m
–3
)
Crystal size L /
m
Population density distributions of struvite crystals produced in a
crystallizer
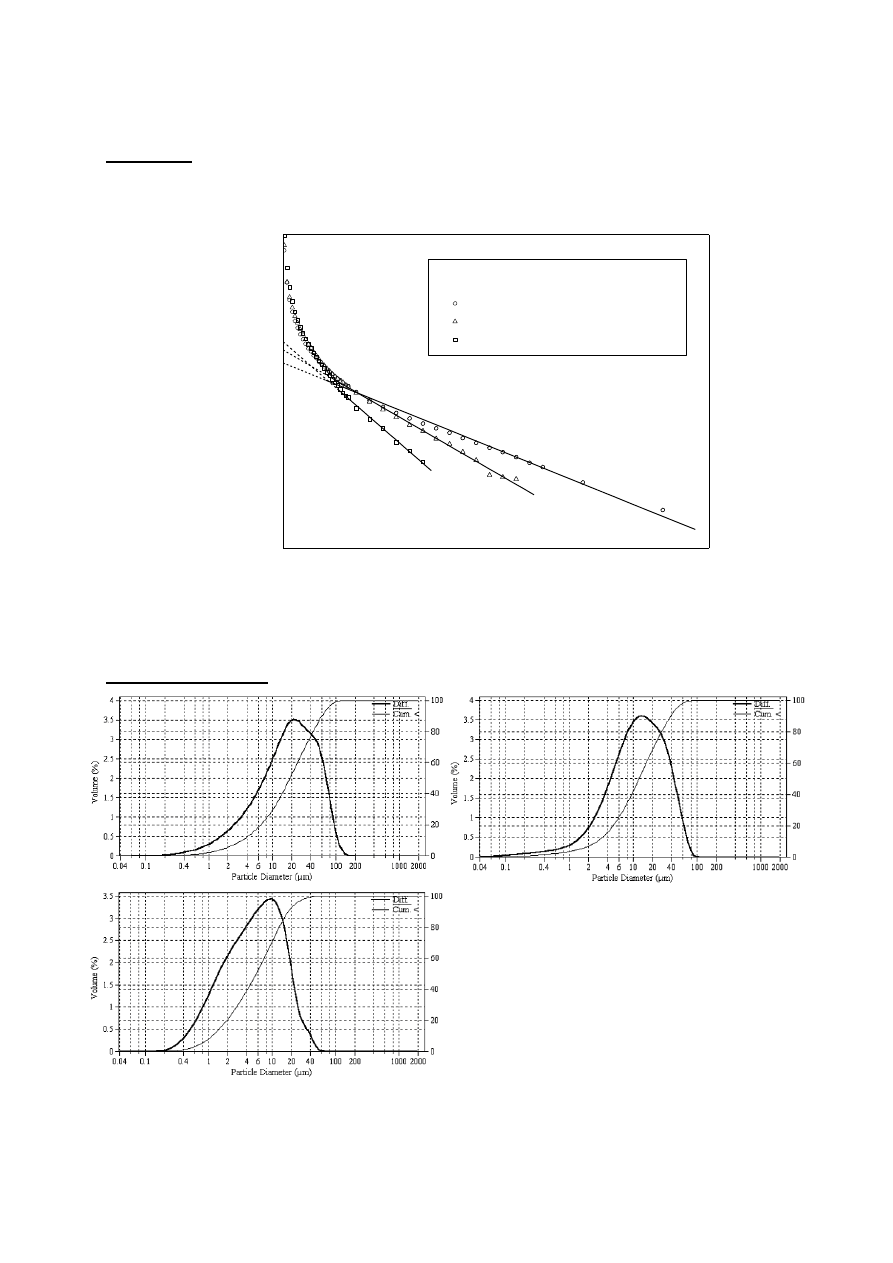
Wykresy z COULTERA:
Influence of pH value on the differential (left
scale) and cumulative (right scale) crystal size
distributions of struvite produced for
= 3600 s:
a) pH = 9 (L
m
= 25.9
m, L
50
= 18.8
m, CV =
89.5%), b) pH = 10 (L
m
= 17.0
m, L
50
= 12.3
m,
CV = 87.9%), c) pH = 11 (L
m
= 8.0
m, L
50
= 5.6
m, CV = 95.9%)

22
20
m
b
20
m
a
c
20
m
Zdjęcia z mikroskopu skaningowego:
Scanning electron microscope images of struvite
crystals produced for
= 3600 s: a) pH = 9,
magnification 1500x, b) pH = 10, magnification
2500x, c) pH = 11, magnification 3000x
Wyszukiwarka
Podobne podstrony:
laboratorium artykul 2010 01 28 Nieznany
NOM WIMiR harmonogram laboratorium PNM 2010 11
LATO 2010 id 263802 Nieznany
EiM egzamin, 1 Pytania egzamin lato 2010
ZARZADZANIE Lato 2010, Plan IV semestr
Test1 lato 2010
prtl pl oferowanie lato 2010
Badania laboratoryjne - P.Barker 2010, Lekarski, Diagnostyka laboratoryjna
egzamin zerowy lato 2010
egzamin poprawkowy lato 2010
egzamin zasadniczy lato 2010
laboratorium artykul 2010 01 28 Nieznany
lato 2010
więcej podobnych podstron