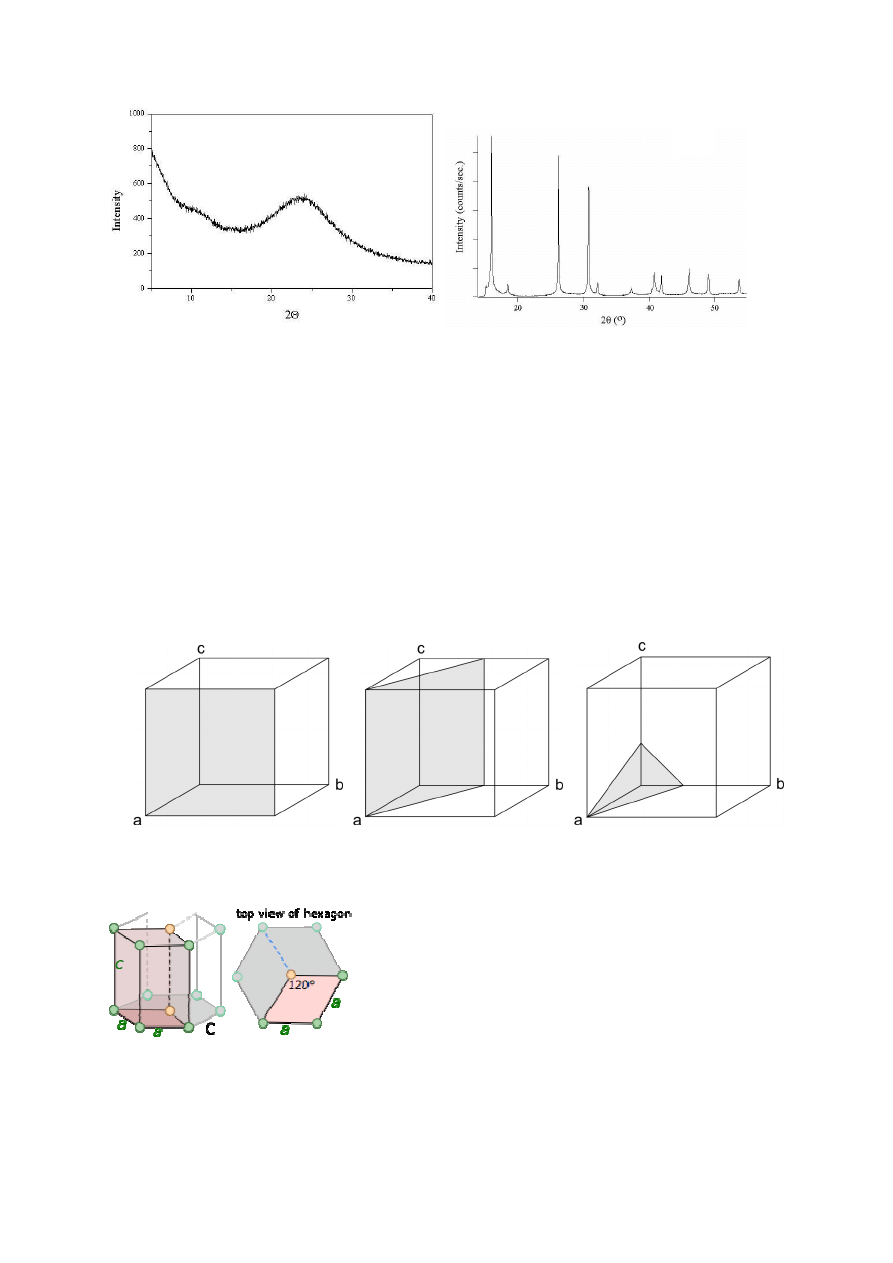
1.
Na podanych rysunkach zamieszczono dyfraktogramy ciał stałych. Co można powiedzieć o
strukturze krystalicznej tych materiałów? Odpowiedź uzasadnij. (1)
Kryształ - ciało stałe dające dyskretny obraz dyfrakcyjny. Zatem materiał, którego dyfraktogram
jest oznaczony jako B ma strukturę krystaliczną, a materiał o którego dyfraktogram jest oznaczony
jako A nie ma struktury krystalicznej.
2.
Które z podanych ciał stałych nie są przewodnikami elektrycznymi? Mg(s), C(grafit), I
2
(s), H
2
O(s)
(1)
I
2
(s), H
2
O(s)
3.
Podaj co najmniej trzy charakterystyczne właściwości kryształów kowalencyjnych. (1
)
twarde, wysoka temperatura topnienia, słabe przewodnictwo cieplne i elektryczne
4.
Jakie są indeksy (hkl) płaszczyzn krystalograficznych na załączonych rysunkach? (1)
5.
Narysuj kształt komórki elementarnej heksagonalnego układu krystalograficznego, zaznaczając
symbolicznie charakterystyczne kąty i długości. (1)
a=b≠c, α=β=90, γ≠120
Należy pamiętać, że komórka elementarna to równoległościan (tylko sześć ścian).
6.
Narysuj ułożenie atomów w układzie regularnym w komórce ściennie centrowanej oraz podaj
ilość atomów w takiej komórce wraz z uzasadnieniem. (1)
A
B
A
B
C
100
120
133
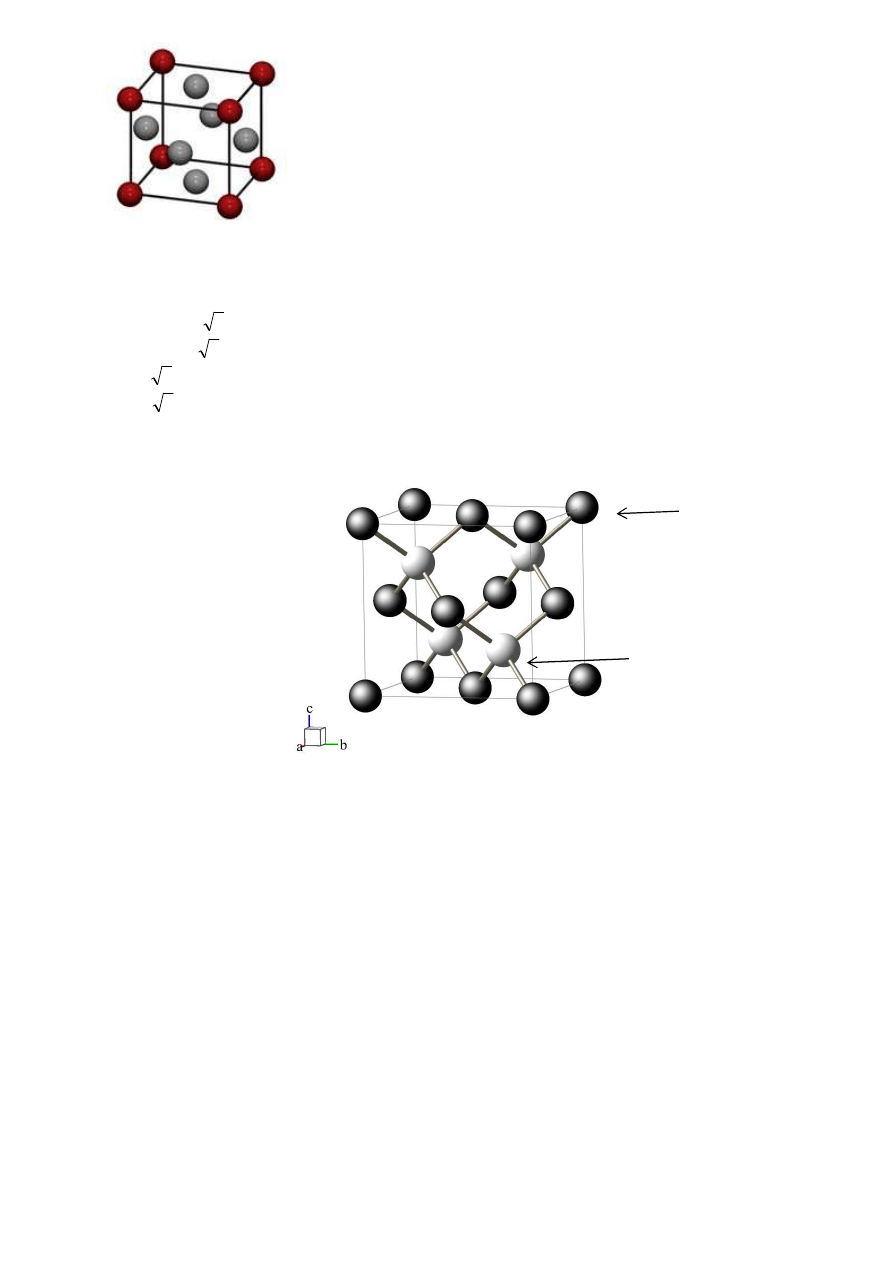
4 atomy w komórce = 8x1/8 + 6x1/2
7.
Podaj, na podstawie obliczeń, krytyczny stosunek promienia kationu (r
k
) do promienia anionu (r
a
)
dla koordynacji sześciennej. (2)
2(r
k
+ r
a
) = 2r
a
3
2r
k
+ 2r
a
- 2r
a
3
= 0
r
k
= r
a
(
3
– 1)
r
k
/r
a
=
3
– 1 = 0.732
8.
Na podstawie poniższego rysunku uzasadnij, że stechiometria sfalerytu (ZnS) jest zgodna z jego
strukturą krystaliczną. (1)
Stechiometrię związku można określić na podstawie ilości atomów w komórce elementarnej.
Należy zwrócić uwagę na położenie atomów (naroża – 1/8 atomu, ściany – 1/2 atomu, krawędzie
1/4 atomu, wnętrze równoległościanu 1 cały atom): Zn – 8x1/8 + 6x1/2 = 4 atomy ; S – 4 całe = 4
atomy: Zn
4
S
4
-> ZnS
Alternatywnie, można stwierdzić, że jony Zn
2+
na rysunku tworzą komórką ściennie centrowaną.
Baza w postaci Zn – S w połączeniu z siecią regularną z komórką FCC, przedstawioną na rysunku,
umożliwia odtworzenia struktury krystalicznej z zachowaniem proporcji 1:1 cynku i siarki.
9.
W której z poniższych struktur liczba koordynacyjna kationów i anionów w strukturze gęstego
upakowania jest taka sama? (1)
a.
Jony Cl
–
tworzą strukturę typu FCC i jony Na
+
zajmują wszystkie luki oktaedryczne w
komórce elementarnej.
b.
Jony Ca
2+
tworzą strukturę typu FCC i jony F
–
zajmują wszystkie osiem luk
tetraedrycznych w komórce elementarnej.
c.
Jony O
2–
tworzą strukturę typu FCC i jony Na
+
zajmują wszystkie osiem luk
tetraedrycznych w komórce elementarnej.
d.
Jony S
2–
tworzą strukturę typu FCC i jony Zn
2+
zajmują co drugą lukę tetraedryczną w
komórce elementarnej.
Zn
2+
S
2-
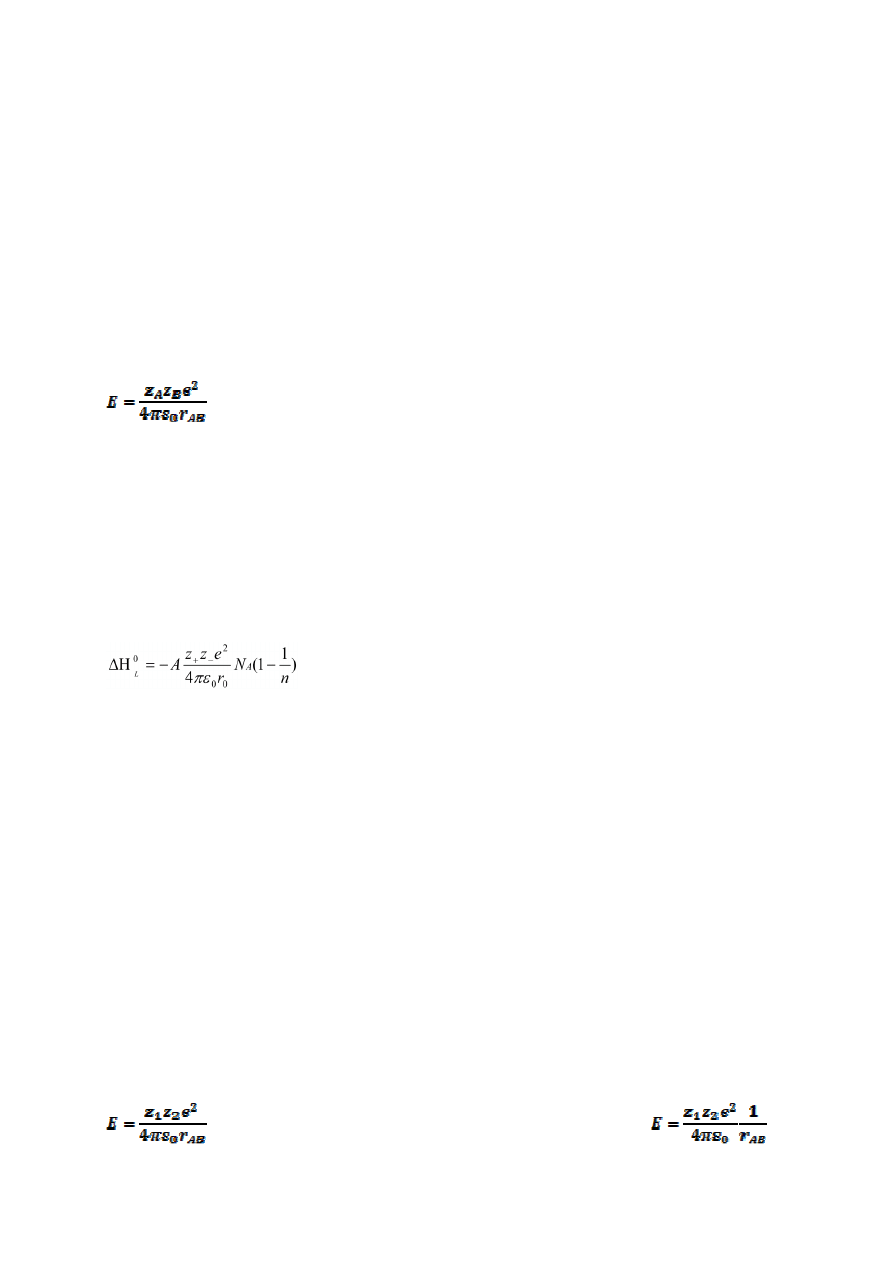
10.
Srebro tworzy sieć typu FCC i na podstawie pomiarów dyfrakcyjnych wykazano, że długość boku
komórki elementarnej wynosi 408,6 pm. Oblicz gęstość srebra (masa atomowa Ag wynosi
107,9 u). (2)
Z – 4 atomy na komórkę elementarną
a – długość boku komórki elementarnej [pm]
M
Ag
– masa atomowa Ag [u == g/mol]
Gęstość = Z * M
Ag
/a
3
N
A
Gęstość = 10.5 g/cm
3
11.
Który w podanych związków charakteryzuje się największą energią sieciową? Odpowiedź
uzasadnij uwzględniając oddziaływania elektrostatyczne pomiędzy jonami. LiF, NaF, CaF
2
, AlF
3
(1)
AlF
3
– największa energia przyciągania Coulombowskiego, największy ładunek z (iloczyn wynosi 3).
O wiele większy wpływ ładunku jonu na energię oddziaływania niż odległość pomiędzy jonami.
12.
Wapno, CaO, krystalizuje strukturze soli kamiennej. Oszacuj energię sieciową dla CaO. Wykładnik
Borna wynosi 8. (2)
Ca – 100 pm (dla LK = 6)
O – 140 pm (dla LK = 6)
A – 1,74756 dla soli kamiennej (NaCl);
n = 8
E = -3527 kJ/mol
13.
Oszacuj wartość energii sieciowej dla MgCl
2
na podstawie Cyklu Borna-Habera. (2)
ΔH
f
= ΔH
(sub)
+ IE
(1)
+ IE
(2)
+ ΔH
(dys)
- 2EA + U
(latt)
U
(latt)
= ΔH
f
- ΔH
(sub)
- IE
(1)
- IE
(2)
- ΔH
(dys)
+ 2EA
= -614.6 - 148 - 738 - 1450 - 243 + 2(349) kJ molˉ¹
= -2495.6 kJ molˉ¹
U
(latt)
= -2495.6 kJ molˉ¹
1. Musimy uwzględnić obydwie energie jonizacji magnezu.
2. Zgodnie z definicją podaną na kartce z danymi tablicowymi
powinowactwo elektronowe jest to energia
potrzebna do usunięcia elektronu z pojedynczo naładowanego anionu: X
–
= X + e. Bardziej ogólnie można
zapisać, że powinowactwo elektronowe = E
koniec
– E
początek
, w przypadku kiedy dodatkowy elektron jest
przyłączony do atomu lub cząsteczki. Oznacza to, że do obliczeń z cyklu Borna-Habera należy wziąć ujemną
wartość powinowactwa elektronowego. Wartość tą bierzemy dwukrotnie – dla każdego atomu chloru.
14.
Podaj wartość stałej Madelunga dla pary jonów A
+
B
-
. (1)
; ilość najbliższych sąsiadów w odległości 1r
AB
wynosi 1, zatem
, a
stała wynosi 1. Również w strukturach 3D każda para jonów liczona jest tylko raz.

15.
Podaj i uzasadnij obliczeniami wartość stałej Madelunga dla atomów zaznaczonych strzałką na
poniższym rysunku, uwzględniając wszystkie narysowane atomy. Różne kolory oznaczają jony o
różnym znaku, narysowany wielościan to sześcian. Czy na podstawie obliczonej wartości stałej
Madelunga można coś powiedzieć o względnej reaktywności ty jonów (uzasadnij)? Jeśli tak, to
co? (2+1)
Rozwiązanie podobnie jak w grupie 2.
Wyszukiwarka
Podobne podstrony:
logika grupa1 id 272081 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
D20031152Lj id 130579 Nieznany
więcej podobnych podstron