
1
3. Identyfikacja kationów
Identyfikację kationów
1
na podstawie reakcji chemicznych przebiegających w roztworach wodnych
przeprowadza się metodą analizy systematycznej. Analiza systematyczna polega na kolejnym oddzielaniu
lub stwierdzeniu nieobecności całych grup jonów za pomocą odpowiednich reagentów, zwanych
odczynnikami grupowymi. W ten sposób dzieli się jony na grupy analityczne, w których nietrudno jest
wykryć poszczególne jony, przeprowadzając tzw. reakcje charakterystyczne (reakcje wybiórcze).
3.1. Reakcje charakterystyczne jonów
Reakcją charakterystyczną jonu jest reakcja, której produkty posiadają niepowtarzalną, przypisaną
tylko dla jednego rodzaju jonu, cechę. Najbardziej typowe reakcje charakterystyczne to:
1. Reakcje, w wyniku, których wytrąca się osad o określonym kolorze.
Na przykład z grupy trzech kationów: Cu
2+
, Hg
2+
i As
3+
jedynie As
3+
w reakcji z jonami S
2-
tworzy
żółty osad As
2
S
3
. Reakcją charakterystyczną jest, więc reakcja:
2 As
3+
+ 3 S
2-
=
As
2
S
3
2. Reakcje, w wyniku, których wytrąca się osad, rozpuszczalny w nadmiarze dodawanego odczyn-
nika.
Na przykład z grupy trzech kationów: Cu
2+
, Hg
2+
i As
3+
jedynie z jonami Hg
2+
w wyniku reakcji z I
-
powstaje czerwony osad HgI
2
, który w nadmiarze dodawanych jonów I
-
rozpuszcza się, tworząc kompleks
jonowy - [HgI
4
]
2-
. Reakcją charakterystyczną jest więc reakcja, przebiegająca w dwóch etapach:
Hg
2+
+ 2 I
–
=
HgI
2
HgI
2
+ 2 I
–
= [HgI
4
]
2–
3. Reakcje, w wyniku których wytrąca się osad, rozpuszczalny po dodaniu innego odczynnika.
Na przykład z grupy trzech kationów: Ag
+
, Hg
2
2+
i Pb
2+
, które w reakcji z jonami Cl
–
wytrącają białe
osady, jedynie osad AgCl rozpuszcza się po dodaniu roztworu NH
4
OH, gdyż srebro(I) przechodzi w
kompleks jonowy - [Ag(NH
3
)
2
]
+
. Reakcją charakterystyczną jest, więc reakcja, przebiegająca w dwóch
etapach:
Ag
+
+ Cl
-
=
AgCl
AgCl + 2 NH
4
OH = [Ag(NH
3
)
2
]
+
+ Cl
–
+ 2 H
2
O
4. Reakcje w wyniku, których wytrąca się osad, zmieniający barwę po dodaniu innego odczynnika.
1
Uzupełnieniem treści tego rozdziału jest kolorowa wkładka do skoroszytu pt.: "Schemat systematycznej analizy kationów" wg
R. Freseniusa, wydana prze AUE.

2
Na przykład z grupy trzech kationów: Ag
+
, Hg
2
2+
i Pb
2+
, które w reakcji z jonami Cl
–
wytrącają białe
osady, jedynie osad Hg
2
Cl
2
po dodaniu roztworu NH
4
OH zmienia barwę na czarną, gdyż zachodzi reakcja
dysproporcjonowania rtęci(I) w wyniku, której powstaje czarna mieszanina (Hg i HgNH
2
Cl). Reakcją
charakterystyczną jest, więc reakcja przebiegająca w dwóch etapach:
Hg
2
2+
+ 2 Cl
-
=
Hg
2
Cl
2
Hg
2
Cl
2
+ 2 NH
4
OH = Hg + HgNH
2
Cl + NH
4
+
+ Cl
–
+ 2 H
2
O
5. Reakcje w wyniku, których wytrąca się osad, zmieniający barwę po podgrzaniu.
Na przykład jony Cu
2+
po dodaniu roztworu NaOH wytrącają niebieski osad Cu(OH)
2
, który po
podgrzaniu przechodzi w czarny osad CuO. Reakcją charakterystyczną jest więc reakcja, przebiegająca w
dwóch etapach:
Cu
2+
+ 2 OH
–
=
Cu(OH)
2
Cu(OH)
2
CuO + H
2
O
6. Reakcje w wyniku, których powstają gazowe produkty o charakterystycznym zapachu.
Na przykład jony NH
4
+
po dodaniu roztworu NaOH przechodzą w produkt gazowy (NH
3
)
o łatwo rozpoznawalnym zapachu. Reakcją charakterystyczną jest, więc reakcja:
NH
4
+
+ OH
–
= NH
3
+ H
2
O
7. Reakcje, w których analizowany jon odbarwia dodawany odczynnik.
Na przykład jony As
3+
w środowisku zasadowym przechodzą w formę anionową AsO
3
3-
, która
odbarwia rubinowoczerwony roztwór I
2
w KI. Reakcją charakterystyczną jest więc reakcja, przebiegająca w
dwóch etapach:
As
3+
+ 6 OH
–
= AsO
3
3-
+ 3 H
2
O
AsO
3
3–
+ I
2
+ 2 OH
–
= AsO
4
3–
+ 2 I
–
+ H
2
O
3.2.
Podział kationów na grupy analityczne
Jakie jest kryterium podziału kationów na grupy analityczne?
Według R. Freseniusa wszystkie kationy można podzielić na 5 grup analitycznych. Kryterium tego
podziału jest wynik reakcji z wybranymi odczynnikami, zwanymi odczynnikami grupowymi. Odczynniki
grupowe, po dodaniu do badanego roztworu tworzą trudno rozpuszczalne w wodzie związki. Odczynniki
grupowe zostały tak dobrane, aby w przypadku prowadzenia analizy w sposób systematyczny możliwe było
rozdzielenie
kationów
należących
do
różnych
grup
analitycznych.
W tabeli 21 przedstawione zostały wybrane kationy należące do poszczególnych grup analitycznych
i wykorzystywane do rozdzielenia tych grup odczynniki grupowe.
Systematyczny tok analizy powinien przebiegać tak, że w pierwszej kolejności należy sprawdzić czy
badany roztwór zawiera kationy I grupy analitycznej, a następnie - w przypadku negatywnego wyniku próby
na obecność kationów I grupy - kolejno należy sprawdzać czy są kationy grupy II, III i IV. Taka kolejność
sprawdzania obecności kationów poszczególnych grup analitycznych podyktowana jest faktem, że
odczynnik grupowy grupy II reaguje z kationami grupy I, a odczynnik grupowy grupy III reaguje z

3
kationami grupy II, itd. Niemożliwe jest, więc wybiórcze, niesystematyczne identyfikowanie, której grupy
analitycznej kationy zawiera badany roztwór.
Tabela 21. Podział kationów na grupy analityczne wg R. Freseniusa
Nr grupy
Kationy
Odczynnik grupowy
I
Ag
+
, Hg
2
2+
, Pb
2+
HCl
aq
II
Cu
2+
, Hg
2+
, As
3+
H
2
S
aq
, H
+ *
III
Fe
2+
, Fe
3+
, Co
2+
, Mn
2+
, Zn
2+
, Al
3+
S
2–
, bufor amonowy (mieszanina
roztworów: NH
4
OH, NH
4
Cl) **
IV
Ca
2+
, Ba
2+
CO
3
2–
, bufor amonowy
(mieszanina roztworów:
NH
4
OH, NH
4
Cl)
V
K
+
, NH
4
+
, Mg
2+
-
*
- Ponieważ H
2
S jest substancją silnie trującą, to dla zachowania bezpieczeństwa, przeprowadza się reakcję w wyniku, której
siarkowodór jest generowany bezpośrednio w układzie reakcyjnym. W tym celu do próbówki zawierającej 1 cm
3
badanego
roztworu dodaje się: 1 cm
3
roztworu HCl o stężeniu 1 mol/dm
3
, 1 cm
3
amidu kwasu tiooctowego (AKT) i mieszaninę podgrzewa
się w łaźni wodnej do temperatury około 60
o
C.
**
- Jony S
2–
powstają w wyniku reakcji hydrolizy zasadowej AKT w środowisku buforu amonowego.
Na podstawie wyników reakcji z odczynnikami grupowymi można określić numer grupy, do której
należy kation znajdujący się w badanym roztworze. Następnym krokiem jest przeprowadzenie reakcji
charakterystycznych dla kationów określonej grupy analitycznej. Dla pewności należy przeprowadzić kilka
reakcji charakterystycznych dla każdego identyfikowanego jonu.
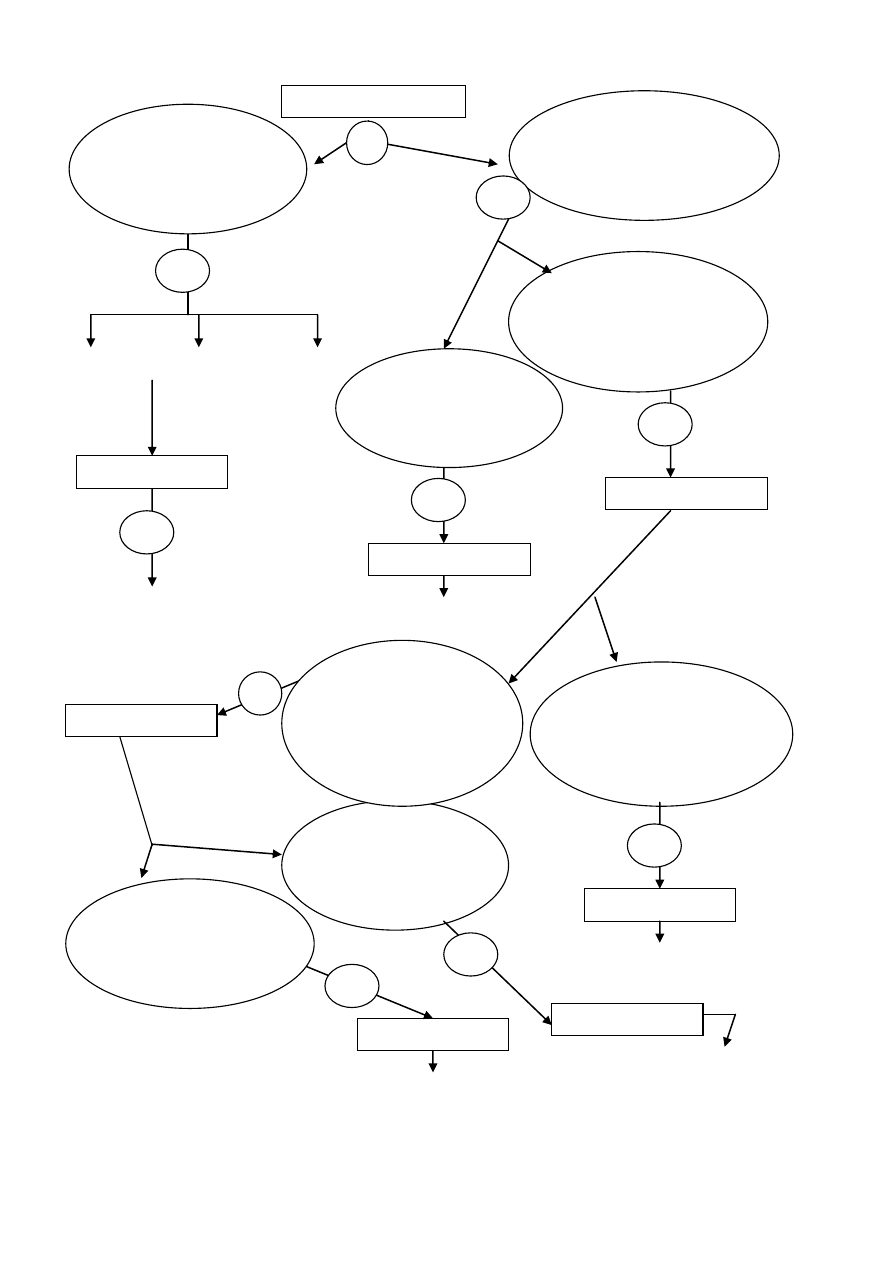
Ogólny schemat przeprowadzenia systematycznej analizy kationów został przedstawiony
na rysunku 1.
Celem ćwiczeń laboratoryjnych dotyczących identyfikacji jonów w badanym roztworze jest
zapoznanie studenta z:
- Pracą w laboratorium chemicznym, ze szczególnym zwróceniem uwagi na właściwy dobór wa-
runków, w jakich określone reakcje przebiegają,
- Wnikliwą obserwacją efektów przeprowadzanych reakcji,
- Umiejętnością poprawnego zapisu równań reakcji chemicznych, ze szczególnym zwróceniem
uwagi na to, aby w równaniu reakcji występowały tylko te elementy materii (atomy, jony,
cząsteczki), które rzeczywiście reagują.
Każdy student w części praktycznej ćwiczeń otrzymuje w próbówce wodny roztwór substancji
chemicznej (najczęściej jest to roztwór soli), nazywany roztworem badanym. Dla uproszczenia procedury
analitycznej roztwory badane zawierają tylko jeden rodzaj kationów. Zadaniem studenta jest
przeprowadzenie identyfikacji i przedstawienie w sprawozdaniu z wykonanej analizy, jaki kation znajdował
się w badanym roztworze.
Sprawozdanie z przeprowadzonej identyfikacji kationów w badanych roztworach należy sporządzić
na przedstawionych dalej formularzach.
4
Rysunek 1. Schemat systematycznej analizy kationów
+ HCl
aq
+ AKT, ogrzewanie
+ NH
4
OH
[Ag(NH
3
)
2
]
+
, (HgNH
2
Cl), PbCl
2
czarny osad biały osad
Reakcje charakterystyczne Reakcje charakterystyczne + AKT
kationów I grupy analitycznej kationów II grupy analitycznej + bufor amonowy,
podgrzewanie
+ (NH
4
)
2
CO
3
+ bufor amonowy
Reakcje charakterystyczne
kationów III grupy analitycznej
Reakcje charakterystyczne
Reakcje charakterystyczne kationów IV grupy analitycznej
kationów V grupy analitycznej
Badany roztwór
Wytrąca się osad:
AgCl, Hg
2
Cl
2
, PbCl
2
Obecność kationów
I grupy analitycznej
Wytrąca się osad:
CuS, HgS, As
2
S
3
Obecność kationów
II grupy analitycznej
Wytrąca się osad:
FeS, Fe
2
S
3
, CoS,
MnS, ZnS, Al(OH)
3
Obecność kationów
III grupy analitycznej
Wytrąca się o
sad:
CaCO
3
, BaCO
3
Obecność kationów
IV grupy analitycznej
Badany roztwór
Badany roztwór
Badany roztwór
Badany roztwór
Badany roztwór
Badany roztwór
Badany roztwór
Brak osadu
badany roztwór
nie zawiera kationów
II grupy analitycznej
II grupy analitycznej
Brak osadu
badany roztwór
nie zawiera kationów
I grupy analitycznej
Brak osadu
badany roztwór
nie zawiera kationów
III grupy
analitycznej
III
grupy
analitycznej
Brak osadu
badany roztwór
nie zawiera kationów
IV grupy analitycznej
1
1a
a
1b
2
3
2a
3a
4
4a
5

5
3.3. Reakcje kationów I grupy analitycznej z odczynnikiem grupowym
Dlaczego reakcje kationów I grupy analitycznej z roztworem HCl pozwalają oddzielić te kationy od
kationów innych grup analitycznych?
Tylko kationy I grupy analitycznej: Ag
+
, Hg
2
2+
, Pb
2+
w reakcji z jonami Cl
–
tworzą trudno roz-
puszczalne w wodzie sole:
Ag
+
+ Cl
–
=
AgCl
Pb
2+
+ 2 Cl
–
=
PbCl
2
Hg
2
2+
+ 2 Cl
–
=
Hg
2
Cl
2
.
Reakcje przeprowadza się dodając do próbówki z niewielką ilością (1 cm
3
) badanego roztworu 1 cm
3
roztworu kwasu solnego o stężeniu 1 mol·dm
-3
. Wytrącanie się białego osadu świadczy o obecności w
badanym roztworze któregoś z kationów I grupy analitycznej. Identyfikacji, który z kationów I grupy
analitycznej jest w badanym roztworze dokonuje się przeprowadzając reakcje charakterystyczne kationów I
grupy analitycznej.
3.4. Reakcje charakterystyczne kationów I grupy analitycznej
Jakie odczynniki chemiczne wykorzystywane są do przeprowadzania reakcji charakterystycznych
kationów I grupy analitycznej?
Reakcje charakterystyczne kationów I grupy analitycznej przeprowadza się wykorzystując nastę-
pujące odczynniki chemiczne: NH
4
OH, NaOH, K
2
Cr
2
O
7
, KI.
Do pierwszej reakcji charakterystycznej wykorzystuje się osad powstały w wyniku dodania do
badanego roztworu odczynnika grupowego. Po odlaniu roztworu znad wytrąconego osadu (operację taką
nazywa się dekantacją), dodaje się niewielką ilość (1 - 2 cm
3
) roztworu NH
4
OH o stężeniu
1 mol·dm
-3
. W przypadku, gdy wytrącony osad to: AgCl lub Hg
2
Cl
2
zachodzi jedna z reakcji:
AgCl + 2 NH
4
OH = [Ag(NH
3
)
2
]
+
+ Cl
–
+ 2 H
2
O
Hg
2
Cl
2
+ 2 NH
4
OH =
HgNH
2
Cl +
Hg + NH
4
+
+ Cl
–
+ 2 H
2
O.
W wyniku pierwszej reakcji następuje rozpuszczenie białego osadu AgCl. Powstaje jonowa forma
srebra, jon kompleksowy - [Ag(NH
3
)
2
]
+
. W reakcji drugiej, która jest reakcją dysproporcjonowania, biały
osad Hg
2
Cl
2
przechodzi w chlorek amino rtęci(II) i rtęć(I) metaliczną. W konsekwencji biały osad
całkowicie czernieje. Jeśli zaś biały osad to: PbCl
2
- nie obserwuje się żadnych zmian.
Reakcje z roztworem NH
4
OH, prowadzone z osadami chlorków kationów I grupy analitycznej
uznaje się za pierwszą reakcję charakterystyczną tych kationów. Już ta pierwsza reakcja pozwala jed-
noznacznie określić, który z kationów I grupy znajduje się w badanym roztworze. Dla potwierdzenia jednak
tych pierwszych wniosków należy wykonać inne reakcje charakterystyczne. Równania tych reakcji zostały
przedstawione w tabeli 22.

6
Tabela 22. Wybrane reakcje charakterystyczne kationów I grupy analitycznej
NaOH
(nadmiar odczynnika)
K
2
Cr
2
O
7
KI
Ag
+
Ag
+
+ 2OH
-
= Ag
2
O + H
2
O
Brunatny osad
Ag
+
+ Cr
2
O
7
2-
= Ag
2
Cr
2
O
7
Czerwonobrunatny osad
Ag
+
+ I
-
= AgI
Żółty osad
Hg
2
2+
Hg
2
2+
+ 2OH
-
= Hg
2
O + H
2
O
Czarny osad
Hg
2
2+
+ CrO
4
2-
= Hg
2
CrO
4
*
Brunatny osad
Hg
2
2+
+ 2I
-
= Hg
2
I
2
Żółtozielony osad
Pb
2+
Pb
2+
+ 2OH
-
= Pb(OH)
2
Biały osad
Pb(OH)
2
+ 2OH
-
= Pb(OH)
4
2-
Pb
2+
+ CrO
4
2-
= PbCrO
4
*
Żółty
osad
Pb
2+
+ 2I
-
= PbI
2
Żółty osad
* - Reakcję przeprowadza się po dodaniu roztworu octanu sodu (CH
3
COONa), w którym w wyniku reakcji
hydrolizy: CH
3
COO
–
+ H
2
O = CH
3
COOH + OH
–
środowisko alkalizuje się i jony Cr
2
O
7
2–
przechodzą w
jony CrO
4
2–
w wyniku reakcji: Cr
2
O
7
2–
+ 2OH
–
= 2CrO
4
2–
+ H
2
O. Reakcja z jonami CrO
4
2–
przebiega łatwiej
niż z jonami Cr
2
O
7
2–
, gdyż chromiany są trudniej rozpuszczalnymi w wodzie solami niż dichromiany.
3.5. Reakcje kationów II grupy analitycznej z odczynnikiem grupowym
Dlaczego reakcje kationów II grupy analitycznej z AKT przebiegające w środowisku kwaśnym
pozwalają oddzielić te kationy od kationów III, IV i V grupy analitycznej?
Spośród kationów II grupy analitycznej opisana została identyfikacja tylko kationów: Hg
2+
, Cu
2+
i As
3+
. Kationy te maja silne właściwości kwasowe i reagują z odczynnikiem grupowym (H
2
S) zgodnie z
podanymi równaniami reakcji:
Hg
2+
+ H
2
S =
HgS + 2 H
+
Cu
2+
+ H
2
S =
CuS + 2 H
+
2 As
3+
+ 3 H
2
S =
As
2
S
3
+ 6 H
+
Żaden z kationów pozostałych grup analitycznych (III, IV i V) nie reaguje z H
2
S. Ponieważ H
2
S jest
substancją silnie trującą, to dla zachowania bezpieczeństwa, przeprowadza się reakcję, w wyniku której
siarkowodór jest generowany bezpośrednio w układzie reakcyjnym. W tym celu do próbówki zawierającej 1
cm
3
badanego
roztworu
dodaje
się:
1
cm
3
roztworu
HCl
o
stężeniu
1 mol/dm
3
, 1 cm
3
amidu kwasu tiooctowego (AKT) i mieszaninę podgrzewa się w łaźni wodnej do
temperatury około 60
o
C. W tej temperaturze, w środowisku kwaśnym AKT ulega hydrolizie, a otrzymany
w wyniku tej reakcji siarkowodór reaguje z kationami II grupy analitycznej. Reakcję hydrolizy AKT w
środowisku kwaśnym przedstawia równanie reakcji:
- gdzie Δ oznacza ogrzewanie roztworu, w którym przebiega reakcja.
Wytrącanie się czarnego osadu CuS lub HgS świadczy o obecności w badanym roztworze, któregoś
z tych kationów. W przypadku, gdy badany roztwór zawiera kationy As
3+
wytrąca się żółty osad As
2
S
3
.
Identyfikacji, który z kationów: Cu
2+
czy Hg
2+
oraz potwierdzenia obecności kationu As
3+
dokonuje się,
przeprowadzając odpowiednie reakcje charakterystyczne kationów II grupy analitycznej.
H C
3
C
S
NH2
H C
3
C
O
OH
+ 2 H O + H
2
+
NH + H S
4
+
2
+
7
3.6. Reakcje charakterystyczne kationów II grupy analitycznej
Jakie odczynniki chemiczne wykorzystywane są do przeprowadzania reakcji charakterystycznych
kationów II grupy analitycznej?
Reakcje charakterystyczne kationów II grupy analitycznej przeprowadza się wykorzystując na-
stępujące odczynniki chemiczne: NaOH, KI, AgNO
3
.
Wszystkie reakcje charakterystyczne przeprowadza się w próbówkach, do których należy wlać nowe
porcje badanego roztworu o objętości około 1 cm
3
, a następnie dodać taką samą objętość roztworu z
odczynnikiem reakcji charakterystycznej. Równania reakcji charakterystycznych kationów II grupy
analitycznej zostały przedstawione w tabeli 23.
Tabela 23. Wybrane reakcje charakterystyczne kationów II grupy analitycznej
NaOH
KI
(nadmiar odczynnika)
AgNO
3
Hg
2+
Hg
2+
+ 2OH
-
= HgO + H
2
O
Żółty osad
Hg
2+
+ 2I
-
= HgI
2
Czerwony osad
HgI
2
+ 2I
-
= [HgI
4
]
2-
-
Cu
2+
Cu
2+
+ 2OH
-
= Cu(OH)
2
*
Niebieski osad
Cu
2+
+ 2I
-
= CuI
2
Żółty osad
-
As
3+
As
3+
+ 6OH
-
= AsO
3
3-
+ 3H
2
O
-
As
3+
+ 6OH
-
= AsO
3
3-
+ 3H
2
O
AsO
3
3-
+ 3Ag
+
= Ag
3
AsO
3
Żółty osad
* - w wyniku podgrzewania niebieski osad Cu(OH)
2
przechodzi w czarny osad CuO.
Schemat systematycznej analizy kationów I i II grupy analitycznej został przedstawiony na rysunku 2.
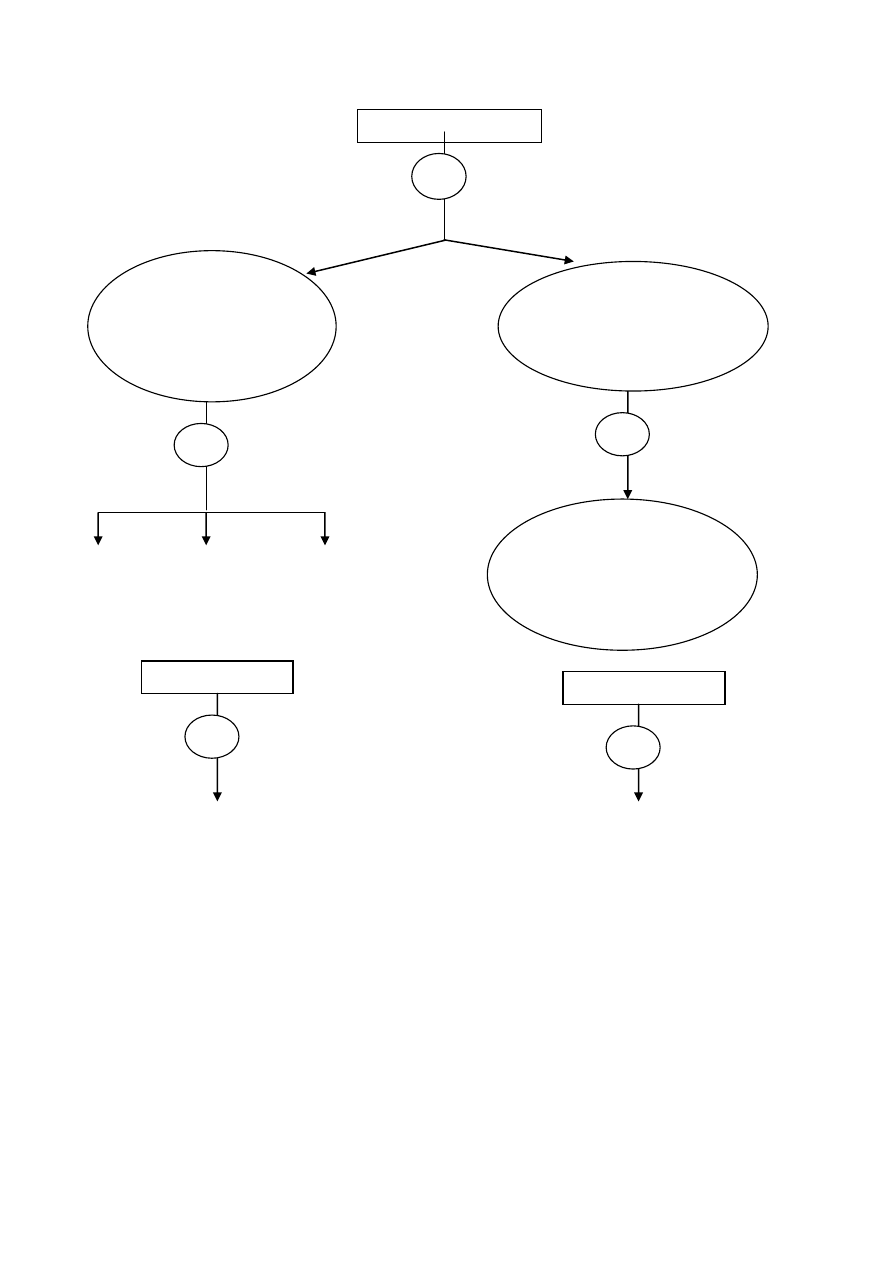
8
Rysunek 2. Schemat systematycznej analizy I i II grupy kationów
+ HCl
aq
+ NH
4
OH + AKT, ogrzewanie
Ag(NH
3
)
2
+
, (HgNH
2
Cl), PbCl
2
czarny osad biały osad
Reakcje charakterystyczne Reakcje charakterystyczne
kationów I grupy analitycznej kationów II grupy analitycznej
Sprawozdanie z przeprowadzonej identyfikacji kationów I i II grupy analitycznej w badanych
roztworach należy sporządzić na przedstawionych dalej formularzach.
Badany roztwór
Wytrąca się osad:
AgCl, Hg
2
Cl
2
, PbCl
2
biały biały biały
Obecność kationów
I grupy analitycznej
Wytrąca się osad:
CuS, HgS, As
2
S
3
czarny czarny żółty
Obecność kationów
II grupy analitycznej
Badany roztwór
Badany roztwór
Brak osadu
badany roztwór
nie zawiera kationów
I grupy analitycznej
1
1a
a
1b
2
2a
9
Sprawozdanie z wykonanego zadania kontrolnego
Identyfikacja kationów znajdujących się w badanym roztworze - próbówka Nr 1
1. Badany roztwór + roztwór HCl o stężeniu 1 mol/dm
3
Obserwacja:..........................................................................................................................
Wniosek:...............................................................................................................................
2. Otrzymany roztwór w pkt. 1 + AKT + ogrzewanie:
Obserwacja:..........................................................................................................................
Wniosek:...............................................................................................................................
3. Reakcje charakterystyczne:
Spośród najczęściej stosowanych do przeprowadzenia reakcji charakterystycznych kationów I
i II grupy analitycznej odczynników: NaOH, NH
4
OH, K
2
Cr
2
O
4
, KI, AgNO
3
należy wybrać
właściwe dla identyfikowanego kationu, przeprowadzić reakcje, wpisać do tabelki obserwacje,
wnioski i odpowiednie równania reakcji.
Odczynnik
Obserwacja
Wniosek
Równanie reakcji:
Odczynnik
Obserwacja
Wniosek
Równanie reakcji:
Odczynnik
Obserwacja
Wniosek
Równanie reakcji:
W badanym roztworze znajduje się kation: ..............................................................................
10
Sprawozdanie z wykonanego zadania kontrolnego
Identyfikacja kationów znajdujących się w badanym roztworze - próbówka Nr 2
1. Badany roztwór + roztwór HCl o stężeniu 1 mol/dm
3
Obserwacja:.........................................................................................................................
Wniosek:...............................................................................................................................
2. Otrzymany roztwór w pkt. 1 + AKT + ogrzewanie:
Obserwacja:..........................................................................................................................
Wniosek:...............................................................................................................................
3. Reakcje charakterystyczne:
Spośród najczęściej stosowanych do przeprowadzenia reakcji charakterystycznych kationów I
i II grupy analitycznej odczynników: NaOH, NH
4
OH, K
2
Cr
2
O
4
, KI, AgNO
3
należy wybrać
właściwe dla identyfikowanego kationu, przeprowadzić reakcje, wpisać do tabelki obserwacje,
wnioski i odpowiednie równania reakcji.
Odczynnik
Obserwacja
Wniosek
Równanie reakcji:
Odczynnik
Obserwacja
Wniosek
Równanie reakcji:
Odczynnik
Obserwacja
Wniosek
Równanie reakcji:
W badanym roztworze znajduje się kation: ...............................................................................
11
3.7. Reakcje kationów III grupy analitycznej z odczynnikiem grupowym
Dlaczego reakcje kationów III grupy analitycznej z AKT przebiegające w środowisku buforu
amonowego pozwalają oddzielić te kationy od kationów IV i V grupy analitycznej?
Spośród kationów III grupy analitycznej opisana została identyfikacja kationów: Fe
2+
, Fe
3+
, Co
2+
,
Mn
2+
, Zn
2+
i Al
3+
. Kationy te mają słabe właściwości kwasowe i reagują z mocnymi zasadami: S
2–
i OH
–
,
tworząc trudno rozpuszczalne w wodzie związki.
W celu sprawdzenia, czy w badanym roztworze znajdują się kationy III grupy analitycznej stosuje
się mieszaninę roztworu amidu kwasu tiooctowego (AKT) i roztwór buforu amonowego. W roztworze
buforu amonowego i po podgrzaniu AKT hydrolizuje. Reakcję hydrolizy AKT w środowisku zasadowym
opisuje równanie reakcji:
+ 3 OH
-
+ NH
4
OH + S
2-
W wyniku tej reakcji powstają jony siarczkowe. Mieszanina reakcyjna zawiera więc aniony: S
2-
i
OH
-
. Do przeprowadzenia reakcji hydrolizy AKT w środowisku zasadowym stosuje się bufor amonowy,
gdyż jedynie w tych warunkach nie wytrącają się wodorotlenki kationów grupy IV i wodorotlenek magnezu
(grupa V).
Przygotowanie roztworu buforu amonowego
Do czystej probówki należy wlać 1 cm
3
roztworu NH
4
OH o stężeniu mol·dm
-3
i 3 cm
3
roztworu
NH
4
Cl o stężeniu mol·dm
-3
i roztwory wymieszać.
W celu sprawdzenia, czy w badanym roztworze znajdują się kationy grupy III należy do czystej
próbówki wlać 1 cm
3
roztworu badanego, 1 cm
3
roztworu buforu amonowego i 1 cm
3
roztworu AKT, a
następnie mieszaninę podgrzać w łaźni wodnej do temperatury około 60
o
C. W przypadku obecności w
badanym roztworze kationów III grupy analitycznej powstają następujące związki:
Spośród kationów III grupy analitycznej jedynie kationy glinu tworzą trudniej rozpuszczalne w wodzie
wodorotlenki niż siarczki. I dlatego jedynie one tworzą wodorotlenek. Pozostałe kationy wytracają w tych
warunkach osady odpowiednich siarczków.
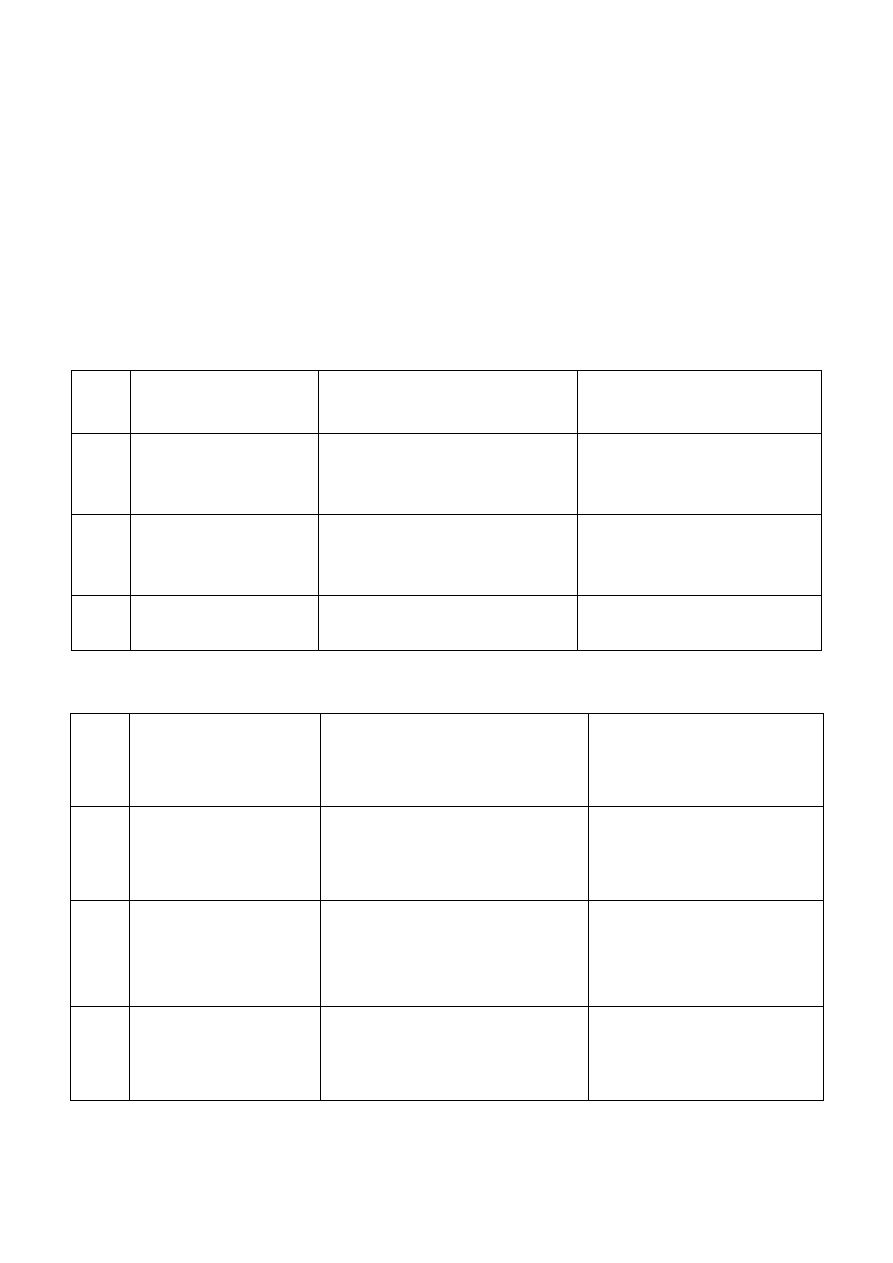
Na podstawie efektów reakcji kationów III grupy analitycznej z AKT w środowisku buforu
amonowego można te kationy podzielić na dwie podgrupy:
- podgrupa A - kationy: Fe
2+
, Fe
3+
i Co
2+
- tworzą czarne osady siarczków,
- podgrupa B - kationy: Mn
2+
, Zn
2+
i Al
3+
- tworzą białe lub kremowe osady.
Fakt ten znacznie ułatwia identyfikację. Wystarczy bowiem, w zależności od efektów reakcji z AKT,
przeprowadzić reakcje charakterystyczne kationów podgrupy A lub podgrupy B.
H C
3
C
S
NH2
H C
3
C
O
O
Podgrupa A
Podgrupa B
FeS
cz. o.
2
Fe S
cz. o.
3
CoS
cz. o.
b. o.
ZnS
MnS
ciel. o.
2
Fe +
Zn2+
2
Mn +
2
Co +
Al +
3
-
2
S , OH -
Fe 3+
b. o.
Al(OH)
3
12
3.8. Reakcje charakterystyczne kationów III grupy analitycznej
Jakie odczynniki chemiczne wykorzystywane są do przeprowadzania reakcji charakterystycznych
kationów III grupy analitycznej?
Reakcje charakterystyczne kationów grupy III przeprowadza się wykorzystując następujące
odczynniki chemiczne:
- dla kationów podgrupy A: NaOH, K
3
[Fe(CN)
6
], K
4
[Fe(CN)
6
]
- dla kationów podgrupy B: NaOH, NH
4
OH, K
4
[Fe(CN)
6
]
Wszystkie reakcje charakterystyczne przeprowadza się w próbówkach, do których wlewa się 1 cm
3
badanego roztworu i 1 cm
3
roztworu z odczynnikiem reakcji charakterystycznej. Równania reakcji
charakterystycznych kationów III grupy analitycznej, podgrupy A zostały przedstawione w tabeli 24,
a kationów podgrupy B w tabeli 25.
Tabela 24. Wybrane reakcje charakterystyczne kationów III grupy analitycznej, podgrupy A
NaOH
K
3
[Fe(CN)
6
]
K
4
[Fe(CN)
6
]
Fe
2+
Fe
2+
+ 2OH
-
= Fe(OH)
2
brązowo zielony osad
3Fe
2+
+ 2Fe(CN)
6
3-
= Fe
3
[Fe(CN)
6
]
2
niebieski osad
(błękit Turynbulla)
-
Fe
3+
Fe
3+
+ 3OH
-
= Fe(OH)
3
czerwono brunatny osad
-
4Fe
2+
+ 3Fe(CN)
6
4-
= Fe
4
[Fe(CN)
6
]
3
niebieski osad
(błękit pruski)
Co
2+
Co
2+
+ 2OH
-
= Co(OH)
2
różowy osasd
-
2Co
2+
+ Fe(CN)
6
4-
= Co
2
[Fe(CN)
6
]
zielony osad
Tabela 25. Wybrane reakcje charakterystyczne kationów III grupy analitycznej, podgrupy B
NaOH
(nadmiar odczynnika)
NH
4
(OH)
(nadmiar odczynnika)
K
4
[Fe(CN)
6
]
Mn
2+
Mn
2+
+ 2OH
-
= Mn(OH)
2
różowy osad
Mn
2+
+ 2NH
4
OH = Mn(OH)
2
+ 2NH
4
+
różowy osad
Mn
2+
+ Fe(CN)
6
4-
= Mn
2
[Fe(CN)
6
]
2
biały osad
Zn
2+
Zn
2+
+ 2OH
-
= Zn(OH)
2
biały osad
Zn(OH)
2
+ 2OH
-
= Zn(OH)
4
2-
Zn
2+
+ 2NH
4
OH = = Zn(OH)
2
+ 2NH
4
+
biały osad
Zn(OH)
2
+ 6NH
4
OH = [Zn(NH
3
)
6
]
2+
+
2OH
-
+ 6H
2
O
2Zn
2+
+ Fe(CN)
6
4-
= Zn
2
[Fe(CN)
6
]
białokremowy osad
Al
3+
Al
3+
+ 3OH
-
= Al(OH)
3
biały osad
Al.(OH)
3
+ OH
-
= [Al(OH)
4
]
-
Al
3+
+ 3NH
4
OH = Al(OH)
3
+ 3NH
4
+
biały osad
-
13
3.9. Reakcje kationów IV grupy analitycznej z odczynnikiem grupowym
Dlaczego reakcja kationów IV grupy analitycznej z wodnym roztworem (NH
4
)
2
CO
3
przebiegająca w
środowisku buforu amonowego pozwala oddzielić te kationy od kationów V grupy analitycznej?
Spośród kationów IV grupy analityczne opisana została identyfikacja kationów: Ca
2+
i Ba
2+
.
Tylko kationy IV grupy analitycznej w reakcji z węglanem amonu - (NH
4
)
2
CO
3
, przebiegającej w
roztworze buforu amonowego, tworzą trudno rozpuszczalne w wodzie węglany. Zachodzące wtedy reakcje
przedstawiają równania:
Ca
2+
+ CO
3
2-
= CaCO
3
Ba
2+
+ CO
3
2-
= BaCO
3
Węglan amonu jest solą słabego kwasu i słabej zasady. W roztworze wodnym tej soli zachodzi
reakcja hydrolizy. Ponieważ stała dysocjacji kwasu węglowego (K
a
= 4,5∙10
-7
) jest mniejsza od stałej
dysocjacji wodorotlenku amonu (K
b
= 1,8∙10
-5
), to wodny roztwór tej soli ma odczyn zasadowy.
W takim roztworze jony Mg
2+
wytracają się w postaci osadu - Mg(OH)
2
. Jony Mg
2+
natomiast nie wytracają
osadu Mg(OH)
2
w środowisku buforu amonowego. Aby zapobiec więc wytrącaniu się wraz z kationami
grupy IV wodorotlenku magnezu, jako odczynnika grupowego kationów grupy IV używa się mieszaniny
roztworu węglanu amonu i roztworu buforu amonowego.
W celu sprawdzenia, czy w badanym roztworze znajdują się kationy grupy IV, należy do czystej
próbówki wlać 1 cm
3
badanego roztworu, 1cm
3
roztworu buforowego (opis przygotowania roztworu
buforowego podany jest w części dotyczącej identyfikacji kationów grupy III) i 1 cm
3
roztworu (NH
4
)
2
CO
3
.
Wytracający się biały osad świadczy o obecności w badanym roztworze któregoś z kationów grupy IV.
W celu sprawdzenia, który z kationów grupy IV znajduje się w badanym roztworze należy prze-
prowadzić reakcje charakterystyczne kationów IV grupy analitycznej.
3.10. Reakcje charakterystyczne kationów IV grupy analitycznej
Jakie odczynniki chemiczne wykorzystywane są do przeprowadzania reakcji charakterystycznych
kationów IV grupy analitycznej?
Reakcje charakterystyczne kationów IV grupy analitycznej przeprowadza się wykorzystując
następujące odczynniki chemiczne: NaOH, K
2
Cr
2
O
7
, H
2
SO
4
.
Wszystkie reakcje charakterystyczne kationów IV grupy analitycznej przeprowadza się
w próbówkach, do których wlewa się 1 cm
3
badanego roztworu i 1 cm
3
roztworu z odczynnikiem reakcji
charakterystycznej. Równania reakcji charakterystycznych kationów IV grupy analitycznej zostały
przedstawione w tabeli 26.
Tabela 26. Wybrane reakcje charakterystyczne kationów IV grupy analitycznej
NaOH
K
2
Cr
2
O
7
H
2
SO
4
Ca
2+
Ca
2+
+ 2OH
-
= Ca(OH)
2
biały osad
-
-
Ba
2+
-
Ba
2+
+ CrO
4
2-
= BaCrO
4
*
żółty osad
Ba
2+
+ SO
4
2-
= BaSO
4
biały osad
* - w roztworze K
2
Cr
2
O
7
znajdują się również jony CrO
4
2-
. Ponieważ BaCrO
4
jest trudniej rozpuszczalny niż BaCr
2
O
7
, to wytrąca się BaCrO
4
.

14
3.11. Reakcje charakterystyczne dla kationów V grupy analitycznej
Jakie odczynniki chemiczne wykorzystywane są do przeprowadzania reakcji charakterystycznych
kationów V grupy analitycznej?
W przypadku, gdy badany roztwór nie daje pozytywnych wyników w reakcjach z odczynnikami
grupowymi I, II, III i IV grupy analitycznej, zachodzi podejrzenie, że w roztworze tym mogą się znajdować
kationy grupy V.
Spośród kationów V grupy analitycznej opisana została identyfikacja kationów: K
+
, NH
4
+
i Mg
2+
.
W celu sprawdzenia, który z kationów V grupy analitycznej znajduje się w badanym roztworze
należy przeprowadzić reakcje charakterystyczne kationów V grupy analitycznej.
Reakcje charakterystyczne kationów V grupy analitycznej przeprowadza się wykorzystując na-
stępujące odczynniki chemiczne: NaOH, K
2
[HgI
4
] + NaOH (odczynnik Nesslera) i HClO
4
.
Wszystkie reakcje charakterystyczne kationów V grupy analitycznej przeprowadza się
w próbówkach, do których wlewa się 1 cm
3
badanego roztworu i 1 cm
3
roztworu z odczynnikiem reakcji
charakterystycznej. Równania reakcji charakterystycznych kationów V grupy analitycznej zostały
przedstawione w tabeli 27.
Tabela 27. Wybrane reakcje charakterystyczne kationów V grupy analitycznej
NaOH
Odczynnik Nesslera
K
2
[HgI
4
] + NaOH
HClO
4
Mg
2+
Mg
2+
+ 2OH
-
= Mg(OH)
2
biały osad
-
-
NH
4
+
NH
4
+
+ OH
-
= NH
3
+ H
2
O
NH
4
+
+ 2[HgI
4
]
2-
+ 4OH
-
= (Hg
2
NH
2
O)I +
+ 7 I
-
+ 3 H
2
O
czerwono brunatny osad
-
K
+
-
-
K
+
+ ClO
4
-
= KClO
4
*
biały osad
* p
o dodaniu odczynnika reakcji charakterystycznej należy potrzeć wewnętrzną ściankę próbówki bagietką. Ułatwia
to wytrącanie osadu KClO
4
.
Schemat systematycznej analizy kationów III, IV i V grupy analitycznej został przedstawiony na
rysunku 3.
Każdy student w części praktycznej ćwiczeń otrzymuje w próbówce wodny roztwór substancji
chemicznej (najczęściej jest to roztwór soli), nazywany roztworem badanym. Dla uproszczenia procedury
analitycznej roztwory badane zawierają tylko jeden rodzaj kationów. Zadaniem studenta jest
przeprowadzenie identyfikacji i przedstawienie w sprawozdaniu z wykonanej analizy jaki kation znajdował
się w badanym roztworze.
Sprawozdanie z przeprowadzonej identyfikacji kationów w badanych roztworach należy sporządzić
na przedstawionych dalej formularzach.
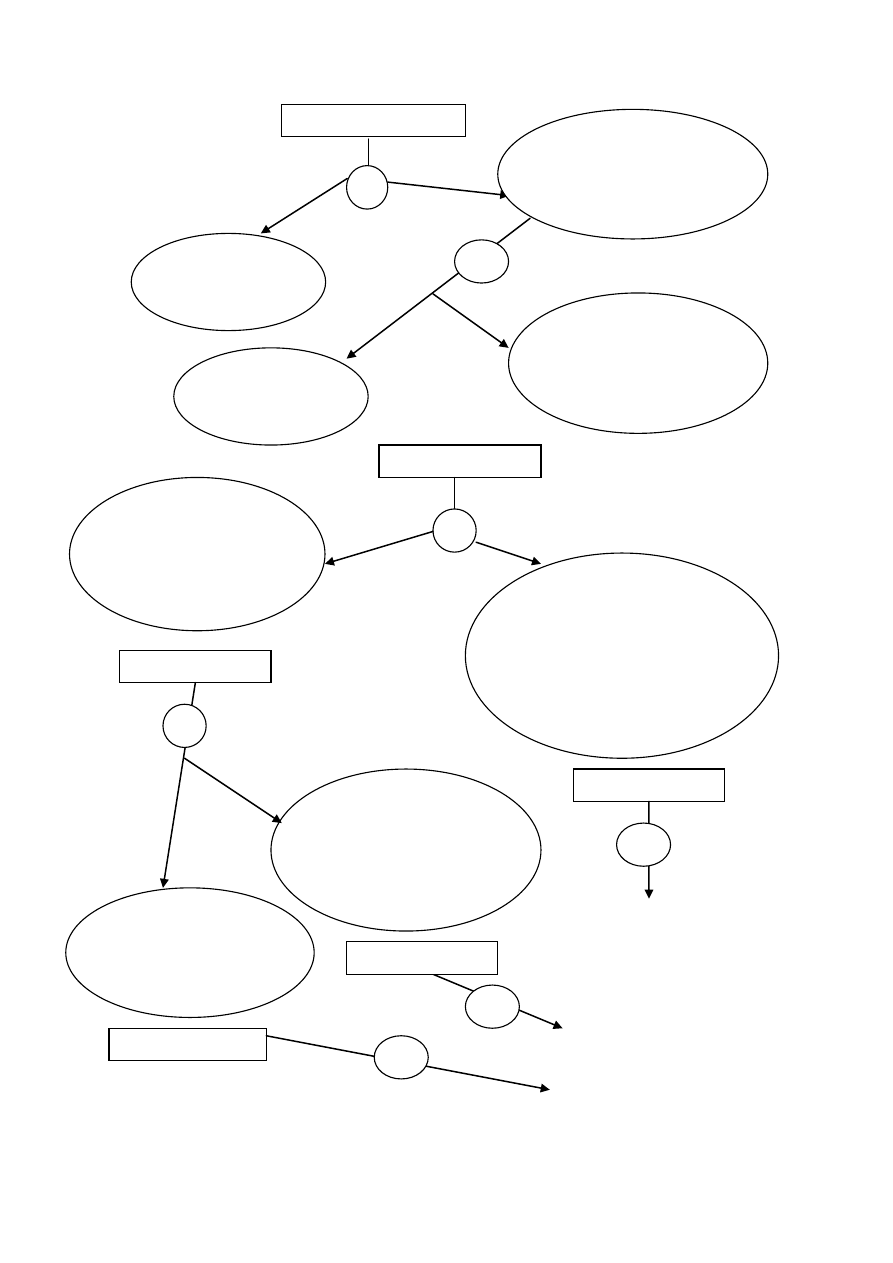
15
Rysunek 3. Schemat systematycznej analizy III, IV i V grupy kationów
+ HCl
aq
+ AKT, ogrzewanie
+ AKT
+ bufor amonowy, podgrzewanie
+ (NH
4
)
2
CO
3
+ bufor amonowy
Reakcje charakterystyczne
kationów III grupy analitycznej
Reakcje charakterystyczne
kationów IV grupy analitycznej
Reakcje charakterystyczne
kationów V grupy analitycznej
Badany roztwór
Wytrąca się osad:
FeS, Fe
2
S
3
, CoS,
czarny czarny czarny
MnS, ZnS, Al(OH)
3
cielisty biały biały
Obecność kationów
III grupy analitycznej
Wytrąca się o
sad:
CaCO
3
, BaCO
3
biały biały
Obecność kationów
IV grupy analitycznej
Badany roztwór
Badany roztwór
Badany roztwór
Badany roztwór
Brak osadu
badany roztwór
nie zawiera kationów
II grupy analitycznej
II grupy analitycznej
Brak osadu
badany roztwór
nie zawiera kationów
I grupy analitycznej
Brak osadu
badany roztwór
nie zawiera kationów
III grupy analitycznej
III grupy analitycznej
Brak osadu
badany roztwór
nie zawiera kationów
IV grupy analitycznej
1
2
4
4a
Wytrąca się osad
Patrz rysunek 2
Wytrąca się osad
Patrz rysunek 2
3
Badany roztwór
3a
5
16
Sprawozdanie z wykonanego zadania kontrolnego
Identyfikacja kationów znajdujących się w badanym roztworze - próbówka Nr 1
1. Badany roztwór + roztwór HCl o stężeniu 1 mol/dm
3
Obserwacja:..................................................................Wniosek:...........................................
2. Otrzymany roztwór w pkt. 1 + AKT + ogrzewanie:
Obserwacja:..................................................................Wniosek:...........................................
3. Badany roztwór + bufor amonowy + AKT + ogrzewanie:
Obserwacja:..................................................................Wniosek:...........................................
4. Badany roztwór + bufor amonowy + (NH
4
)
2
CO
3
:
Obserwacja:..................................................................Wniosek:...........................................
5. Reakcje charakterystyczne:
Spośród najczęściej stosowanych do przeprowadzenia reakcji charakterystycznych od-
czynników: NaOH, NH
4
OH, K
2
Cr
2
O
4
, KI, K
4
Fe(CN)
6
, K
3
Fe(CN)
6
, odczynnik Nesslera,
HClO
4
należy wybrać właściwe dla identyfikowanego kationu, przeprowadzić reakcje, wpisać
do tabelki obserwacje, wnioski i odpowiednie równania reakcji.
Odczynnik
Obserwacja
Wniosek
Równanie reakcji:
Odczynnik
Obserwacja
Wniosek
Równanie reakcji:
Odczynnik
Obserwacja
Wniosek
Równanie reakcji:
W badanym roztworze znajduje się kation: ...............................................................................
17
Sprawozdanie z wykonanego zadania kontrolnego
Identyfikacja kationów znajdujących się w badanym roztworze - próbówka Nr 2
1. Badany roztwór + roztwór HCl o stężeniu 1 mol/dm
3
Obserwacja:..................................................................Wniosek:.........................................
2. Otrzymany roztwór w pkt. 1 + AKT + ogrzewanie:
Obserwacja:..................................................................Wniosek:.........................................
3. Badany roztwór + bufor amonowy + AKT + ogrzewanie:
Obserwacja:..................................................................Wniosek:.........................................
4. Badany roztwór + bufor amonowy + (NH
4
)
2
CO
3
:
Obserwacja:..................................................................Wniosek:.........................................
5. Reakcje charakterystyczne:
Spośród najczęściej stosowanych do przeprowadzenia reakcji charakterystycznych od-
czynników: NaOH, NH
4
OH, K
2
Cr
2
O
4
, KI, K
4
Fe(CN)
6
, K
3
Fe(CN)
6
, odczynnik Nesslera,
HClO
4
należy wybrać właściwe dla identyfikowanego kationu, przeprowadzić reakcje, wpisać
do tabelki obserwacje, wnioski i odpowiednie równania reakcji.
Odczynnik
Obserwacja
Wniosek
Równanie reakcji:
Odczynnik
Obserwacja
Wniosek
Równanie reakcji:
Odczynnik
Obserwacja
Wniosek
Równanie reakcji:
W badanym roztworze znajduje się kation: ...............................................................................

18
Pytania treningowe
1. Czy pojęcia pierwiastek i substancja prosta są synonimami?
2. Co to są substancje złożone i jak je dzielimy?
3. Omów kryterium podziału kationów na grupy analityczne.
4. Napisz równania reakcji kationów I grupy analitycznej z odczynnikiem grupowym.
5. Jak wykorzystuje się właściwości amfoteryczne do identyfikacji kationów I grupy analitycznej?
6. Jak wykorzystuje się reakcje tworzenia jonów kompleksowych do identyfikacji kationów I grupy
analitycznej?
7. Czy wodne roztwory K
2
Cr
2
O
7
i KI mogą być wykorzystane do przeprowadzenia reakcji identyfikują-
cych kationy I grupy analitycznej?
8. Napisz równania reakcji pozwalających jednoznacznie określić, który z roztworów znajduje się
w analizowanym roztworze:
a) Ag
+
, Hg
2
2+
, b) Pb
2+
, Hg
2
2+
, c) Ag
+
, Pb
2+
.
9. Napisz równanie reakcji hydrolizy AKT w środowisku:
a) kwaśnym, b) zasadowym.
10. Jak wykorzystuje się różnicę rozpuszczalności siarczków i wodorotlenków kationów II i III grupy
analitycznej w jakościowej analizie chemicznej?
11. Napisz równania reakcji kationów II grupy analitycznej z odczynnikiem grupowym.
12. Dlaczego reakcje kationów II grupy analitycznej z odczynnikiem grupowym przeprowadza się
w środowisku kwaśnym?
13. Do identyfikacji jednego z kationów II grupy analitycznej wykorzystuje się jego właściwości amfote-
ryczne. Napisz odpowiednie równania reakcji jego formy:
a) kationowej, b) anionowej.
14. Czy wodny roztwór NH
4
OH może być wykorzystany do przeprowadzenia reakcji identyfikującej jeden
z kationów II grupy analitycznej?
15. Jak wykorzystuje się reakcje tworzenia jonów kompleksowych do identyfikacji kationów II grypy
analitycznej?
16. Napisz równania reakcji pozwalających jednoznacznie określić, który z kationów znajduje się
w analizowanym roztworze:
a) Cu
2+
, As
3+
, b) Hg
2+
, Cu
2+
, c) As
3+
, Hg
2+
.
17. Napisz równania reakcji kationów III grupy analitycznej z odczynnikiem grupowym.
18. Co to są bufory? Wyjaśnij na przykładzie buforu amonowego.
19. Dlaczego reakcje kationów III grupy analitycznej z odczynnikiem grupowym przeprowadza się
w środowisku buforu amonowego?
20. Jak wykorzystuje się właściwości amfoteryczne do identyfikacji kationów III grypy analitycznej?
21. Jak wykorzystuje się reakcje tworzenia jonów kompleksowych do identyfikacji kationów III grypy
analitycznej?
22. Napisz równania reakcji pozwalających jednoznacznie określić, który z kationów znajduje się
w analizowanym roztworze:
a) Zn
2+
, Al
3+
, b) Zn
2+
, Mn
2+
, c) Co
2+
, Fe
3+
, d) Fe
2+
, Fe
3+
.
23. Napisz równania reakcji kationów IV grupy analitycznej z odczynnikiem grupowym.
24. Napisz równania reakcji pozwalających jednoznacznie określić, który z kationów znajduje się w
analizowanym roztworze: Ca
2+
, Ba
2+
.
25. Napisz równania reakcji pozwalających jednoznacznie określić, który z kationów znajduje się w
analizowanym roztworze:
a) K
+
, NH
4
+
, b) Mg
2+
, K
+
, c) Mg
2+
, NH
4
+
.
Wyszukiwarka
Podobne podstrony:
analiza kationow 2 id 60685 Nieznany
Ident obiekt h(t) id 209280 Nieznany
Ident anionow id 209278 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
więcej podobnych podstron