Baterie i akumulatory
wkraczaj¹ coraz mielej
we wszelkie dziedziny
naszego ¿ycia. Wszyscy
oczekuj¹ chwili, kiedy
wreszcie pojawi siê
samochód z ekologicznym
napêdem elektrycznym
nie ustêpuj¹cy
wspó³czesnemu
napêdowi spalinowemu.
Zanim ta chwila nast¹pi,
warto zapoznaæ siê ze
stanem rozwoju
chemicznych róde³
pr¹du w chwili obecnej.
Z
asada dzia³ania ogniw galwanicz-
nych polega na wykorzystaniu uwol-
nionych w trakcie reakcji chemicznej
elektronów, które s¹ nonikiem
energii przekazywanej na sposób elektrycz-
ny. Wiêkszoæ reakcji chemicznych polega na
wymianie elektronów miêdzy atomami lub jo-
nami substancji bior¹cych udzia³ w reakcji (re-
agentów). Do takich procesów nale¿¹ reak-
cje utleniania-redukcji (redoks), do których za-
licza siê reakcje spalania. Idealnym rozwi¹-
zaniem jest bezporednie wykorzystanie
elektronów bior¹cych udzia³ w reakcjach re-
doks jako pr¹du elektrycznego. Wówczas
teoretycznie 100% energii uwolnionej pod-
czas reakcji chemicznej mo¿e byæ zamienia-
ne bezporednio np. na pracê mechaniczn¹.
Obecnie, gdy koniecznoci¹ sta³o siê stoso-
wanie maksymalnie wydajnych róde³ ener-
gii, które musz¹ byæ jednoczenie ekolo-
gicznie czyste, chemiczne ród³a pr¹du, tj.
ogniwa maj¹ szanse odegrania wa¿nej roli na
tym polu.
Historia odkryæ chemicznych
róde³ pr¹du
Prawdopodobnie nie znamy jeszcze dok³a-
dnie ca³ej historii chemicznych róde³ pr¹-
du i wszystkich faktów z nimi zwi¹zanych.
W 1936 roku archeolog niemiecki Koenig,
prowadz¹c swoje prace wykopaliskowe pod
Bagdadem, na terenach dawnej Mezopota-
mii (dzisiejszy Irak), znalaz³ dziwne naczy-
nie. By³o to naczynie gliniane, wewn¹trz
którego znajdowa³ siê wydr¹¿ony walec
miedziany, a w nim _ ¿elazny prêt. Ca³e to
naczynie by³o zaczopowane korkiem z ma-
sy bitumicznej. Stwierdzono, ¿e naczynie
pochodzi z III w. przed nasz¹ er¹. Koenig
CHEMICZNE RÓD£A PR¥DU
(1)
wysun¹³ bardzo mia³¹ hipotezê, ¿e prze-
znaczeniem tego naczynia by³o spe³nianie
funkcji staro¿ytnego ogniwa galwanicznego.
Hipoteza ta zosta³a zignorowana w wiecie
naukowym. Wybuch³a wojna i sprawa zna-
leziska posz³a w zapomnienie. W latach
szeædziesi¹tych, ponownie pod Bagda-
dem odkryto prawie identyczne naczynia.
Miedziany walec i prêt ¿elazny mia³y silne
w¿ery, tak jakby pracowa³y jako ogniwo gal-
waniczne. Przypomniano sobie wtedy o hi-
potezie Koeniga. Aby j¹ sprawdziæ wype³nio-
no naczynie jednym z kwasów znanych w
staro¿ytnoci (np. cytrynowy, octowy...)
i stwierdzono, ¿e faktycznie uk³ad dzia³a
jak ogniwo galwaniczne. Mo¿na zapytaæ
po co staro¿ytnym by³o potrzebne ogniwo
galwaniczne? Okaza³o siê, ¿e z³otnicy z
tych okolic w celu pokrywania szlachetnymi
metalami ró¿nych przedmiotów jubilerskich
pos³ugiwali siê jeszcze do niedawna skon-
struowanymi przez siebie ogniwami, które
by³y ca³kiem niepodobne do stosowanych
obecnie. Poparciem hipotezy Koeniga by³y
znalezione w pobli¿u wykopalisk poz³ocone
przedmioty. Dlaczego na ten temat nie ma
nic w ród³ach? Dlaczego ten pomys³ nie
rozprzestrzeni³ siê w ówczesnym wiecie
staro¿ytnym? Tego typu urz¹dzenia by³y
najwiêksz¹ tajemnic¹ pracowni jubilerskiej
i nawet ogniwa stosowane w ró¿nych war-
sztatach z³otniczych Bagdadu znacznie ró¿-
ni³y siê miêdzy sob¹ konstrukcj¹. A wiêc
Koenig mia³ racjê?
Historia wspó³czesnych ogniw galwanicz-
nych zaczê³a siê od prac Luigiego Galvanie-
go, lekarza z Bolonii, który w latach sie-
demdziesi¹tych XVIII stulecia bada³ wp³yw
pr¹du elektrycznego na reakcje miêni spre-
parowanych udek ¿ab. Galvani stwierdzi³, ¿e
pod wp³ywem pr¹du elektrycznego udka
¿abie ulegaj¹ skurczom. Pr¹d elektryczny
otrzymywa³ z maszyny elektrostatycznej.
W czasie dalszych badañ Galvani stwierdzi³,
¿e badane przez niego fragmenty cia³a ¿ab,
mimo ¿e nie by³y pod³¹czone do maszyny
elektrostatycznej, ulegaj¹ skurczom po do-
tkniêciu ich z obu koñców prêtami wyko-
nanymi z ró¿nych metali. Pracê na ten temat
Galvani opublikowa³ w 1791 roku, w piêæ lat
po swoim odkryciu.
Odkryciami Galvaniego zainteresowa³ siê fi-
zyk Alessandro Volta, profesor z Uniwersy-
tetu w Pawii. Pocz¹tkowo on tak¿e by³ prze-
konany o istnieniu nowego rodzaju elek-
trycznoci zwierzêcej. Po pewnym czasie
zrezygnowa³ z udek ¿abich jako domniema-
nego ród³a elektrycznoci i zamiast nich
u¿y³ roztworu elektrolitycznego, w którym za-
nurzone by³y elektrody wykonane z dwóch
ró¿nych metali, np. srebra (lub miedzi) oraz
cynku (lub cyny). Wywnioskowa³ on s³u-
sznie, ¿e przyczyny skurczów ¿abich cia³
szukaæ nale¿y w zamkniêciu obwodu styka-
j¹cych siê ze sob¹ metali przez wilgotn¹
tkankê miêniow¹ ¿ab. Pocz¹tkowo funkcjê
tej tkanki w eksperymentach Volty pe³ni³a
woda morska, czyli wodny roztwór soli ku-
chennej. Nastêpnie badacz pos³ugiwa³ siê
kawa³kami filcu nasyconego kwasem siar-
kowym i po wstawieniu go miêdzy dwie
p³ytki ró¿nych metali, np. miedzi i cynku,
stwierdzi³ za pomoc¹ elektroskopu, ¿e miê-
dzy obiema p³ytkami wytwarza siê napiêcie
elektryczne. A wiêc urz¹dzenie to mo¿e
spe³niaæ funkcjê ród³a pr¹du. Skurcze miê-
ni ¿ab t³umaczy³ Volta pobudzeniem ner-
wów przez pr¹d elektryczny i dowiód³, ¿e
omówiona reakcja fizjologiczna jest jedy-
nie bardzo czu³ym wskanikiem wystêpowa-
nia napiêæ elektrycznych. W przypadku z³o-
¿enia wiêkszej liczby par p³ytek przedziela-
nych nasyconymi kwasem siarkowym ka-
wa³kami filcu (tzw. stos Volty) otrzymywa³
miêdzy p³ytkami koñcowymi tym wiêksze
napiêcie, im wiêcej par p³ytek u¿y³ do do-
wiadczenia. Ponadto Volta stwierdzi³, ¿e
w tym uk³adzie p³ynie pr¹d. Jako detektora
pr¹du elektrycznego Volta u¿ywa³ ¿abich
udek, które spe³nia³y funkcjê stosowanych
dzisiaj galwanometrów. Volta zauwa¿y³, ¿e
napiêcie otrzymane z jego stosu nie zale¿y
od wielkoci powierzchni zetkniêcia, ani te¿
wielkoci p³ytek, lecz wy³¹cznie od tego ja-
kie metale zosta³y po³¹czone ze sob¹
z przewodnikiem. Volcie uda³o siê znane
wtedy metale u³o¿yæ w szereg odpowiada-
j¹cy obecnie szeregowi elektrochemiczne-
mu metali. Ponadto doszed³ do wniosku,
i¿ obserwowane zjawiska mo¿na wykorzy-
staæ do budowy praktycznego urz¹dzenia
zdolnego do wytwarzania pr¹du elektrycz-
nego. Dotychczas do tego celu s³u¿y³a ma-
szyna elektrostatyczna, która wytwarza³a
krótkotrwa³e impulsy. W 1800 roku Volta
zbudowa³ pierwsze ogniwo i wynalazek ten
zg³osi³ listownie do Królewskiego Towarzy-
stwa Naukowego w Londynie. Jako elektrod
u¿ywa³ na przemian kr¹¿ków miedzianych
(lub srebrnych) oraz cynkowych, czyli ogni-
wa ³¹czy³ szeregowo. Przedzielone one by-
³y kawa³kami bibu³y nas¹czonymi roztworem
soli kuchennej. Do p³ytki miedzianej z jednej
strony a cynkowej z drugiej strony by³y przy-
³¹czone przewody.
Po zetkniêciu wolnych koñcówek przewo-
Radioelektronik Audio-HiFi-Video 10/2002
Rys. 1. Ogniwo Daniella
Zn
ZnSO
4
/H
2
SO
4
(aq)
porowata przegroda
CUSO
4
(aq)
Cu
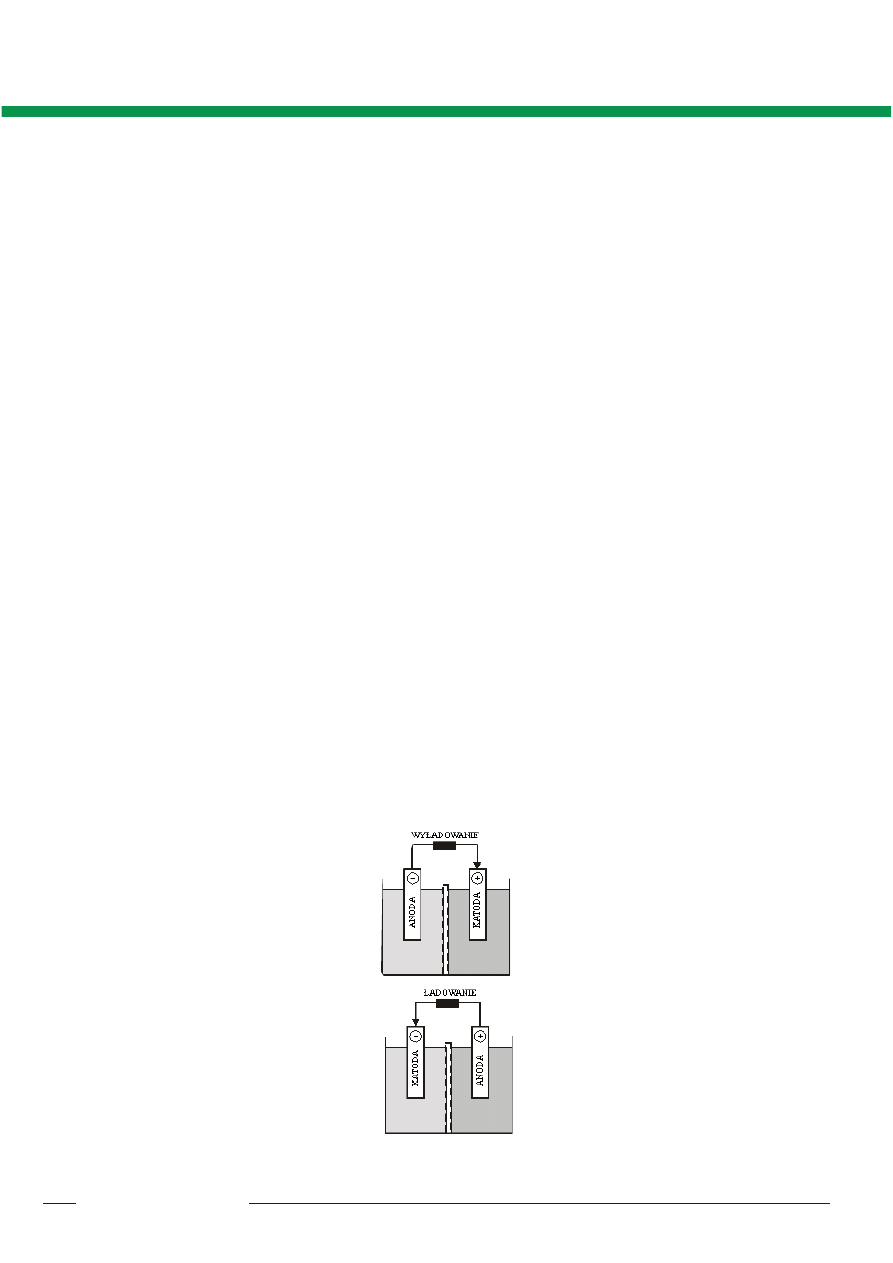
dów przep³ywa³ przez nie pr¹d. Z otrzyma-
nego urz¹dzenia, zwanego stosem Volty,
mo¿na by³o otrzymaæ pr¹d elektryczny o
doæ du¿ym napiêciu.
W ogniwie znajdowa³o siê ok. 30 kr¹¿ków,
a wiêc 15 po³¹czonych szeregowo ogniw
miedziano-cynkowych lub srebrno-cynko-
wych . Mo¿na oszacowaæ, ¿e napiêcie wy-
tworzone w takim ogniwie wynosi kilkana-
cie woltów.
Zapis elektrochemiczny takiego ogniwa
podano poni¿ej:
Zn | NaCl | Ag lub Zn | NaCl | Cu
W tym zapisie Zn, Ag (lub Cu) to elektrody,
a NaCl _ elektrolit.
W ogniwie Volty czêsto stosowanym elektro-
litem by³ wodny roztwór kwasu siarkowego.
Zapis elektrochemiczny takiego ogniwa jest
nastêpuj¹cy:
(_) Zn | H
2
SO
4(aq)
| Cu (+)
W ogniwie tym zachodzi reakcja:
Zn + H
2
SO
4(aq)
⇒
ZnSO
4(aq)
+ H
2
Wielu historyków uwa¿a, ¿e podobne ród³o
pr¹du elektrycznego zosta³o niezale¿nie
skonstruowane w 1797 roku przez Aleksan-
dra von Humboldta, niemieckiego badacza
przyrody.
Warto zaznaczyæ, ¿e Volta uwa¿a³, i¿ ener-
giê elektryczn¹ w ogniwie otrzymuje siê z ni-
czego. Stos Volty sta³ siê rych³o znany na
ca³ym wiecie. Wielu innych badaczy zbu-
dowa³o podobne ogniwa. Poniewa¿ srebro
by³o zbyt kosztowne, jako elektrody w ogni-
wie Volty najczêciej stosowano mied i
cynk. Stos Volty u¿ywano do przeprowa-
dzania dowiadczeñ niezwykle istotnych
dla dalszego rozwoju nauki. Dziêki takiemu
ogniwu m.in. zosta³o zdefiniowane prawo Jo-
ule,a _ Lenza, a Oersted wykona³ swe zna-
mienne w skutkach dowiadczenia. Wkrót-
ce po og³oszeniu prac Volty, w 1803 roku
A. Carlisle, W. Nicholson i H. Davy, badacze
angielscy, zaobserwowali, ¿e pod wp³ywem
dzia³ania pr¹du wytworzonego w ogniwie,
woda ulega rozk³adowi. Oznacza³o to, ¿e
procesy chemiczne mo¿na wymusiæ za po-
moc¹ pr¹du elektrycznego
W 1826 roku Antoine Cesar Becquerel (dzia-
dek Henryka Becquerela _ odkrywcy pro-
mieniotwórczoci), odkry³ zjawisko polaryza-
cji elektrod w pracuj¹cym ogniwie, polega-
j¹ce na wydzielaniu przy elektrodach pro-
duktów reakcji, które szybko obni¿a³y si³ê
elektromotoryczn¹ ogniwa. Becquerel zapro-
ponowa³ u¿ycie tzw. depolaryzatorów, które
zobojêtnia³yby szkodliwe produkty reakcji
elektrodowych.
Prawie 10 lat póniej Anglik Daniell skon-
struowa³ ogniwo zwane dzi ogniwem Da-
niella _ rys.1. Ogniwo Daniella sk³ada siê z
dwóch komór przedzielonych porowat¹ prze-
grod¹ ceramiczn¹. W jednej z nich znajduje
siê roztwór siarczanu miedzi z zanurzon¹ w
nim elektrod¹ miedzian¹, a w drugiej _ roz-
twór siarczanu cynku z elektrod¹ cynkow¹.
Przegroda zapewnia³a niemieszanie siê roz-
tworów i produktów reakcji elektrodowych.
W rozwi¹zaniu tym problemem by³a rezy-
23
stancja przegrody, która powodowa³a pe-
wien spadek napiêcia miêdzy anod¹ a kato-
d¹ podczas pracy ogniwa. W tej chwili to
ogniwo ma tylko wartoæ historyczn¹ i stoso-
wane jest jedynie jako pomoc dydaktyczna.
Si³a elektromotoryczna ogniwa
(SEM)
Si³a elektromotoryczna ogniwa (SEM) jest
równa ró¿nicy potencja³ów miêdzy bieguna-
mi pó³ogniw przy braku przep³ywu pr¹du
elektrycznego (wyprowadzenia elektrycz-
ne do pomiaru musz¹ byæ wykonane z tego
samego materia³u). Pó³ogniwami mog¹ byæ
uk³ady elektrochemiczne, np. metal-roz-
twór. Wszystkie granice faz tworz¹ce ogni-
wo musz¹ siê znajdowaæ w stanie równo-
wag elektrochemicznych. Wartoæ si³y elek-
tromotorycznej oblicza siê, w pierwszym
przybli¿eniu, odejmuj¹c od potencja³u pó³-
ogniwa bardziej dodatniego (oznaczanego
na schemacie jako elektroda_ )potencja³ pó³-
ogniwa mniej dodatniego (oznaczanej na
schemacie jako elektroda (). Na przyk³ad dla
ogniwa z³o¿onego z elektrody miedzianej i
cynkowej, zanurzonych odpowiednio w wod-
nych roztworach siarczanu miedzi i siar-
czanu cynku:
E = E
Cu
_ E
Zn
Dla warunków standardowych SEM powy¿-
szego uk³adu przyjmie wartoæ:
SEM = 0,337 _ (_0,763) = 1,099 V
Si³a elektromotoryczna ogniwa odwracal-
nego bywa zwykle oznaczana symbolem E
lub SEM. Tworzy j¹ nie tylko suma algebra-
iczna dwóch skoków potencja³ów na grani-
cy ka¿dej z elektrod i roztworu (potencja³
elektrody), lecz równie¿ ró¿nice potencja³ów
wystêpuj¹ce wewn¹trz ogniwa, np. na gra-
nicy zetkniêcia roztworów o ró¿nym sk³adzie
jakociowym i ilociowym (potencja³ dyfuzyj-
ny lub cieczowy).
Zapis elektrochemiczny ogniwa galwanicz-
nego Daniella podano poni¿ej:
Radioelektronik Audio-HiFi-Video 10/2002
(_) Zn | ZnSO
4
|| CuSO
4
1Cu (+)
Pojedyncze linie pionowe (|) oznaczaj¹ gra-
nicê faz, np. metal elektrody-roztwór. Linia
Podwójna (||) ( lub pionowa przerywana)
oznacza granicê zetkniêcia siê dwóch ró¿-
nych elektrolitów o ró¿nym sk³adzie. S¹ one
mechanicznie oddzielone, ale jednoczenie
po³¹czone za pomoc¹ separatora lub klucza
elektrolitycznego, umo¿liwiaj¹cego prze-
p³yw jonów. Zgodnie z definicj¹ si³a elektro-
motoryczna jest sum¹ algebraiczn¹ kolej-
nych ró¿nic potencja³ów miêdzyfazowych.
Stosuj¹c powy¿sz¹ konwencjê (sztokholm-
sk¹) nale¿y stwierdziæ, ¿e si³a elektromoto-
ryczna ogniwa bêdzie mia³a wartoæ do-
datni¹, je¿eli na elektrodzie Zn zachodzi
reakcja
Zn
⇔
Zn
2+
+ 2e
Przy czym elektroda ta jest ujemna. Nato-
miast na drugiej _ dodatniej elektrodzie _ za-
chodzi reakcja zgodnie ze schematem:
Cu
2+
+ 2e
⇔
Cu
Samorzutna reakcja roz³adowania ogniwa
przebiega³aby w sposób nastêpuj¹cy:
Zn + Cu
2+
⇒
Zn
2+
+ Cu
Anodê, na której z definicji przebiegaj¹ proce-
sy utleniania, stanowi tu p³yta cynkowa, nato-
miast katod¹ (procesy redukcji) jest blacha
miedziana. Anoda w ogniwie galwanicznym
ma znak ujemny, a katoda znak dodatni.
W przypadku odwrotnej sytuacji, kiedy za
pomoc¹ ród³a pr¹du spróbujemy wymusiæ
przeciwny kierunek przebiegu reakcji ( co
opisuje równanie: Zn
2+
+ Cu
⇒
Zn + Cu
2+
),
si³a elektromotoryczna mia³aby przeciwny
znak E = _1,099 V i proces w ogniwie nie
by³by samorzutny.
Ujemna wartoæ si³y elektromotorycznej
oznacza, ¿e w ogniwie o podanym zapisie
reakcje elektrodowe maj¹ kierunki przeciw-
ne, a elektrody znaki odwrotne. W procesie
elektrolizy anod¹ (o znaku dodatnim) bêdzie
mied, a katod¹ _ cynk. Oba warianty ³ado-
wania i roz³adowania ogniwa Daniella zosta-
³y przedstawione na rys. 2.
Nale¿y zaznaczyæ, ¿e nie zawsze ogniwa
znajduj¹ siê w stanie idealnej równowagi
(np. na elektrodach zachodz¹ powolne pro-
cesy roz³adowania). Równowaga ta zosta-
je zak³ócona tak¿e podczas dokonywania
pomiaru napiêcia miêdzy elektrodami ogni-
wa za pomoc¹ miernika (nawet o wysokiej
rezystancji wejciowej) wskutek przep³ywu
przez uk³ad nieznacznego pr¹du. Trudno
jest równie¿ mówiæ o sile elektromotorycz-
nej podczas pracy ogniwa, w trakcie której
zmienia siê jego napiêcie. W zwi¹zku z
tym zamiast si³y elektromotorycznej czêsto
podawana jest wartoæ OCV _ tzw. napiê-
cia ogniwa przy otwartym obwodzie (open
circuit voltage).
Maksymalna praca, jak¹ mo¿e wykonaæ
ogniwo, zwi¹zana jest z przeniesieniem n ³a-
dunków elektrycznych na wy¿szy o E wol-
tów poziom potencja³u elektrycznego i jest
równa:
W
max
= _ nFE
przy czym: F jest sta³¹ Faradaya.
n
Andrzej A. Czerwiñski
Rys. 2. Roz³adowanie w ogniwie Daniella
i proces elektrolizy
Wyszukiwarka
Podobne podstrony:
Siatkówka- wystawa 2002.10.22, Konspekty, Siatkówka
Siatkówka- wystawa 2002.10.22, KONSPEKTY, ĆWICZENIA
2002 10 12 pra
eis 2002 10 adaptacja akustyczna domowego studia
2002 10 12 prawdopodobie stwo i statystykaid 21648
2002 05 22
ei 01 2002 s 21 22
15 10,22 10 2013 Sapa Internetid 16087
2010 10 22(2), 29, 11 05 szeregi
2002 10 01
Siatkówka wystawa 02 10 22
Siłownia obwodowa (chłopcy) 02 10 22
Koszykówka- rzut pozycyjny jednorącz 2002.10.02, Uczelnia
Ćwiczenie Chemia 2 (18 10 22 10 2010 r )
2002 10 03
2002 10 30
2002 10 07
2002 10 24
więcej podobnych podstron