
Podstawy elektroniki
wykład
kierunek elektrotechnika
rok I, semestr II
kierunek informatyka
rok I, semestr I
wymiar godzin: 30
wykładowca: dr inż. Dorota Wiraszka
d.wiraszka@tu.kielce.pl
Projekt współfinansowany przez
Unię Europejską w ramach
Europejskiego Funduszu Społecznego
Materiały dydaktyczne opracowano do realizacji projektu
”Program Rozwojowy Potencjału Dydaktycznego Politechniki Świętokrzyskiej w Kielcach: kształcenie na miarę sukcesu’’
Umowa UDA-POKL.04.01.01-00-175/08-00

Program wykładu (1)
1. Informacje wstępne - zakres materiału, tryb
zaliczenia, literatura.
2. Budowa atomu, wiązania kowalencyjne.
Struktura elektronowa krzemu i germanu.
Energetyczny model pasmowy
półprzewodnika.
3. Założenia elektronowo-dziurowej teorii
przewodnictwa elektrycznego
półprzewodników.

Program wykładu (2)
4. Półprzewodniki samoistne i domieszkowane.
5. Złącze p-n: mechanizm tworzenia bariery
potencjału, polaryzacja w kierunku
przewodzenia i zaporowym. Charakterystyka
prądowo-napięciowa złącza p-n.
6. Diody warstwowe. Podstawowe parametry
diod prostowniczych i uniwersalnych.
Podstawowe zastosowania - prostowniki.
7. Diody Zenera. Stabilizatory parametryczne.

Program wykładu (3)
8. Diody elektroluminescencyjne i fotodiody.
Diody metal-
półprzewodnik (Schottky’ego).
Diody pojemnościowe. Zastosowania.
9. Tranzystor bipolarny: budowa, zasada
działania, podstawowe zależności.
10. Charakterystyki tranzystora bipolarnego.
Polaryzacja tranzystorów n-p-n i p-n-p.
11. Schemat zastępczy hybrydowy tranzystora
bipolarnego.

Program wykładu (4)
12. Wzmacniacz na tranzystorze bipolarnym.
Analiza małosygnałowa i stałoprądowa.
13. Tranzystor polowy złączowy: budowa,
zasada działania, podstawowe zależności.
15. Charakterystyki tranzystora polowego
złączowego. Warunki polaryzacji.
16. Wzmacniacz na tranzystorze polowym.
Analiza małosygnałowa i stałoprądowa.

Program wykładu (5)
17. Tranzystor polowy MOS normalnie
wyłączony.
18. Tranzystor polowy MOS normalnie
załączony.
19. Wzmacniacz operacyjny: schemat blokowy,
właściwości i parametry. Podstawowe
zastosowania.

Literatura (1)
1. W. Marciniak -
Przyrządy
półprzewodnikowe i układy scalone.
WNT, Warszawa 1994.
2. T. L. Floyd - Electronic Devices. Macmillan
Publishing Company, New York 1998.
3. A. Filipkowski
– Podstawy elektroniki
półprzewodnikowej.
WNT, Warszawa 2003.

Literatura (2)
4. K. Waczyński – Przyrządy
półprzewodnikowe – podstawy działania
diod i tranzystorów. Wyd. Politechniki
Śląskiej, Gliwice 1997.
5. U. Tietze, Ch. Schenk -
Układy
półprzewodnikowe. WNT, Warszawa 2005.
6. P. Horotwitz, W. Hill
– Sztuka elektroniki.
WKiŁ, Warszawa 2003.

Budowa atomu
Atom
- jest to najmniejsza
cząstka pierwiastka
chemicznego, posiadająca
jeszcze własności
chemiczne tego pierwiastka.
Niels Bohr
(1885-1962)

Postulaty Bohra
1. Elektrony
mogą krążyć wokół jądra
jedynie po
ściśle określonych orbitach
stacjonarnych.
2.
Przejście elektronu z niższego poziomu
energetycznego na poziom
wyższy jest
możliwe tylko wtedy, gdy atom pobierze
porcję energii. Natomiast przejście ze
stanu o energii
wyższej do stanu
o energii
niższej wiąże się z oddaniem
energii.
-
-
+
+
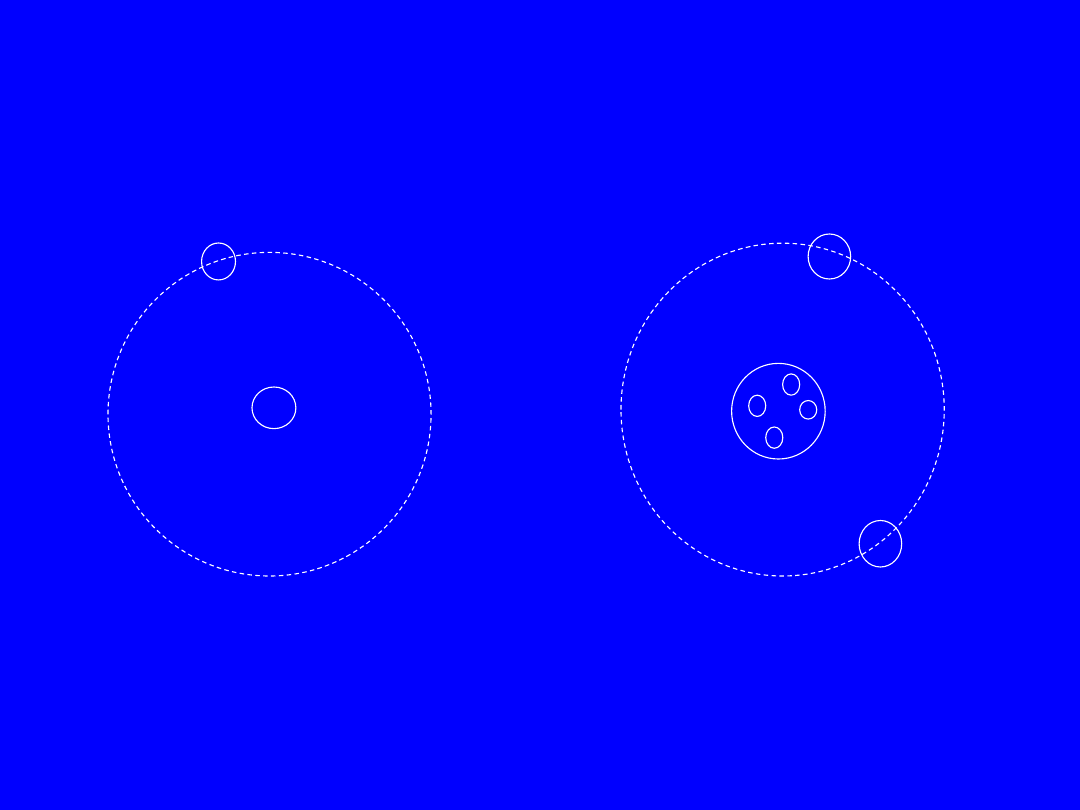
Model atomu wodoru i helu
wodór
+
-
hel

Liczba i masa atomowa
Masa atomowa
– odpowiada liczbie
wszystkich cząstek znajdujących się
w jądrze atomu
Liczba atomowa
– odpowiada liczbie
elektronów w atomie elektrycznie
obojętnym

Układ okresowy pierwiastków

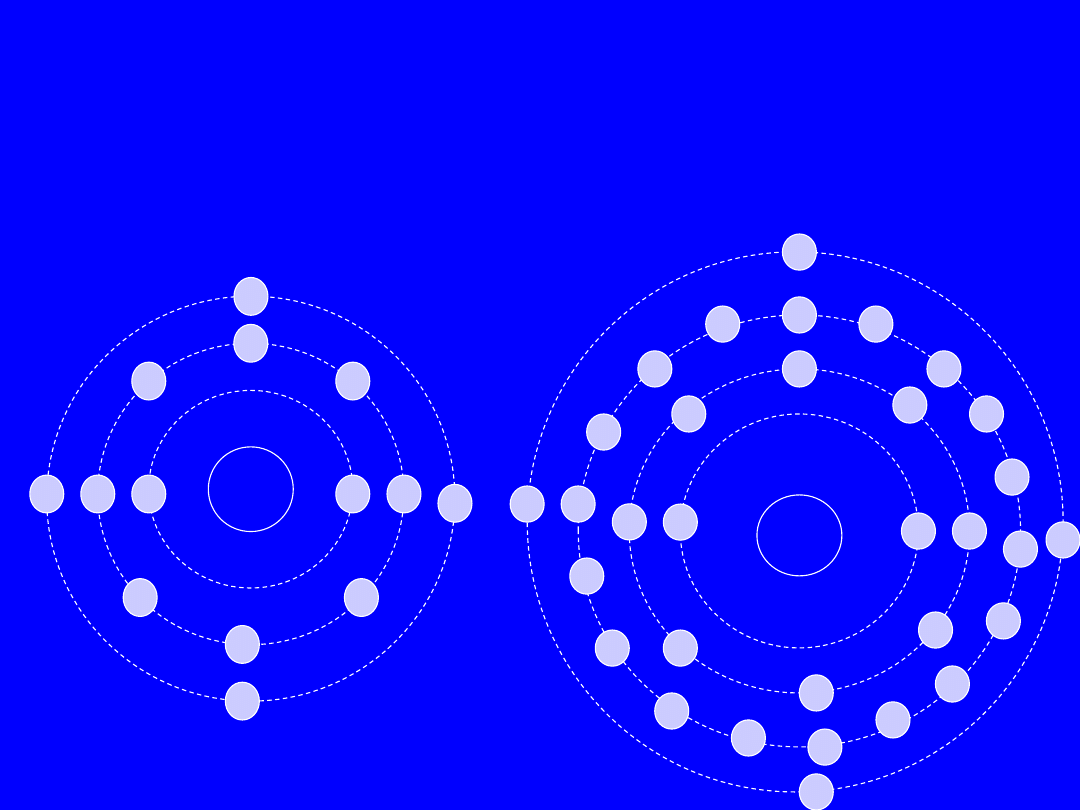
Powłoki i orbity elektronowe
Nr powłoki n 1 2 3 4 5 6 7
Ozn. literowe K L M N O P Q
Maksymalna liczba elektronów
na powłoce n:
2
2
n
K (n = 1):
2 el.
L (n = 2):
8 el.
M (n = 3):
18 el.
...
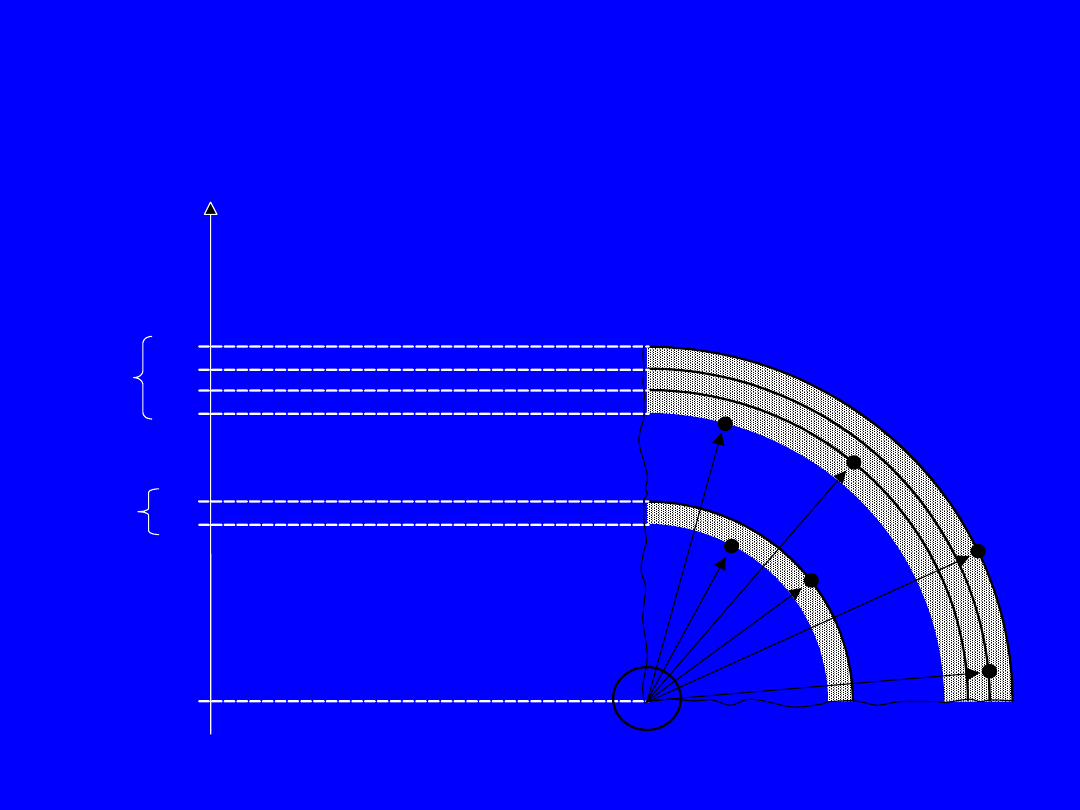
Poziomy energetyczne
pojedynczego atomu
Elektrony
L
K
Jądro
I p
ow
ło
ka
II
p
ow
ło
k
a
W
6
W
5
W
4
W
3
W
2
W
1
W
– energia
r
– promień orbity
r
5
r
6
r
1
r
3
r
2
r
4
Poziom
energetyczny

Elektrony walencyjne
Zapełnianie powłok przez
elektrony następuje od
powłok położonych
najbliżej jądra, tj. powłoki 1,
następnie 2, itd.
Na ostatniej, zewnętrznej
powłoce znajdują się
elektrony słabo związane
z jądrem atomu. Elektrony
te nazywamy
elektronami
walencyjnymi
.
(Mg).

Jonizacja
Kiedy atom absorbuje energię ze źródła ciepła
lub światła, poziomy energetyczne elektronów
podnoszą się. Elektron pobiera energię
i przechodzi na orbitę położoną dalej od jądra.
Jeśli elektron walencyjny zaabsorbuje
dostateczną ilość energii, może zostać całkowicie
oderwany z powłoki zewnętrznej i znaleźć się
poza wpływem atomu. Oderwanie elektronu
walencyjnego pozostawia atom, który był
poprzednio neutralny, z nadmiarem ładunku
dodatniego.
Proces utraty elektronu walencyjnego -
jonizacja

Struktura elektronowa atomu
krzemu i germanu
Wartościowość IV
K: 2
L: 8
M: 4
powłoka
walencyjna
Wartościowość IV
K: 2
L: 8
M: 18
N: 4
powłoka
walencyjna
Struktura elektronowa atomu
krzemu i germanu
+14
+ 32
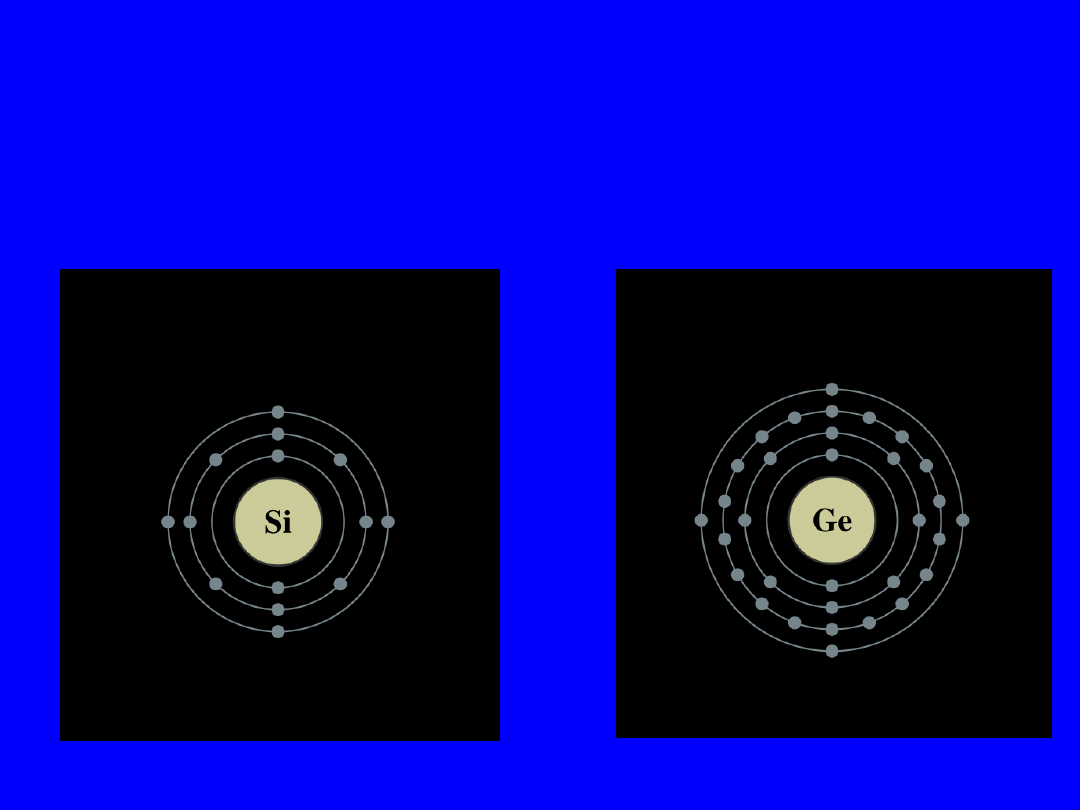
Struktura elektronowa atomu
krzemu i germanu
Źródło grafiki: http://commons.wikimedia.org/wiki/
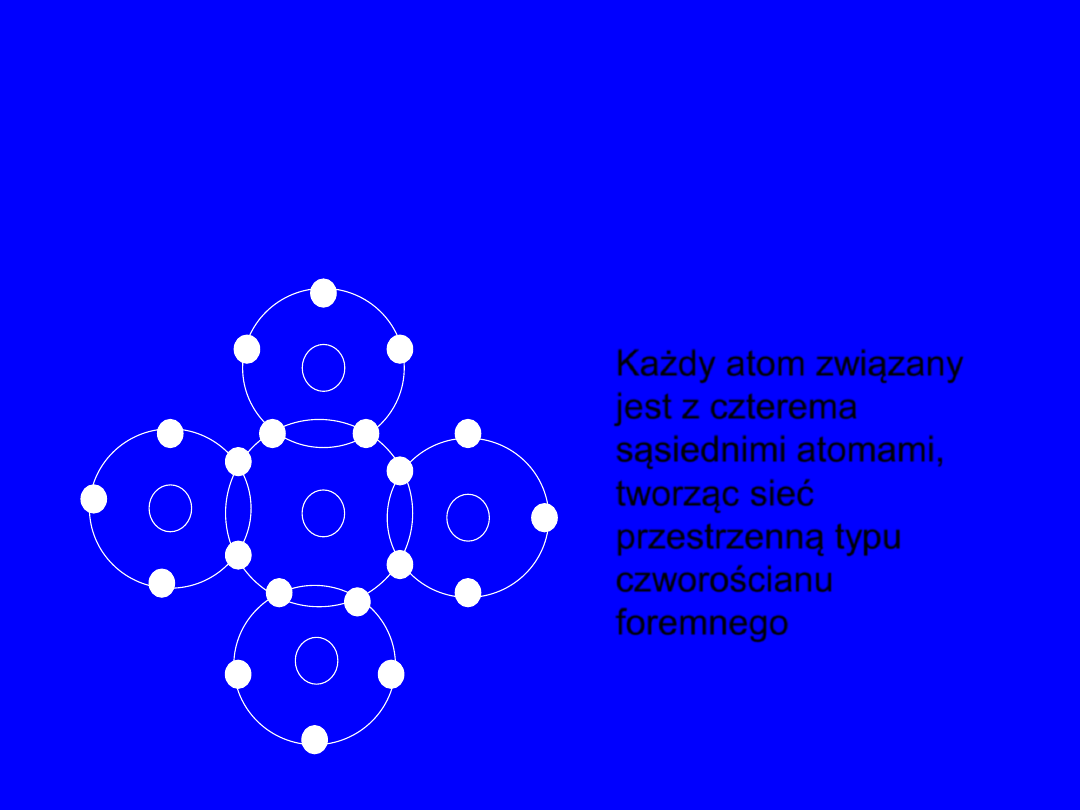
Wiązania kowalencyjne
w krysztale krzemu
Każdy atom związany
jest z czterema
sąsiednimi atomami,
tworząc sieć
przestrzenną typu
czworościanu
foremnego
Si
Si
Si
Si
Si
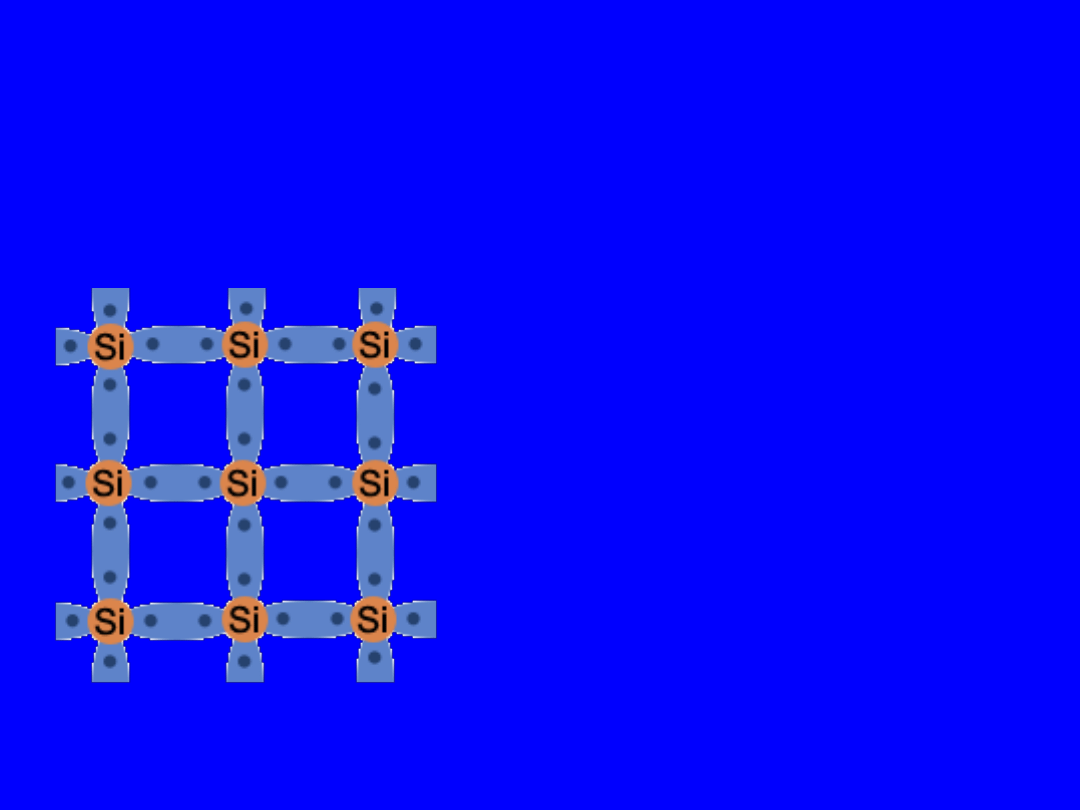
Diagram wiązań
kowalencyjnych
Do wyrwania elektronu
z wiązania kowalencyjnego
potrzebne jest dostarczenie
odpowiedniej energii
w dowolnej postaci.
E = 1,1 eV dla Si
Oderwany elektron staje się
elektronem swobodnym
.
Luka powstała w wiązaniu
kowalencyjnym to hipotetyczny
ładunek dodatni, zwany
dziurą
.

Energetyczny model pasmowy
ciała stałego
• Poszczególnym orbitom elektronów w atomie
przyporządkowane są odpowiednie poziomy (stany)
energetyczne. Energia elektronu jest tym większa, im większy
jest promień jego orbity. W stanie normalnym wszystkie
elektrony zajmują najniższe z możliwych poziomy
energetyczne.
•
Zakaz Pauliego
(1925) - w atomie, a tym bardziej w krysztale
zawierającym wiele atomów, nie mogą występować dwa
elektrony o identycznych stanach energetycznych.
• Każdy poziom energetyczny rozszczepia się na tyle
podpoziomów, ile atomów występuje w rozważanej strukturze.
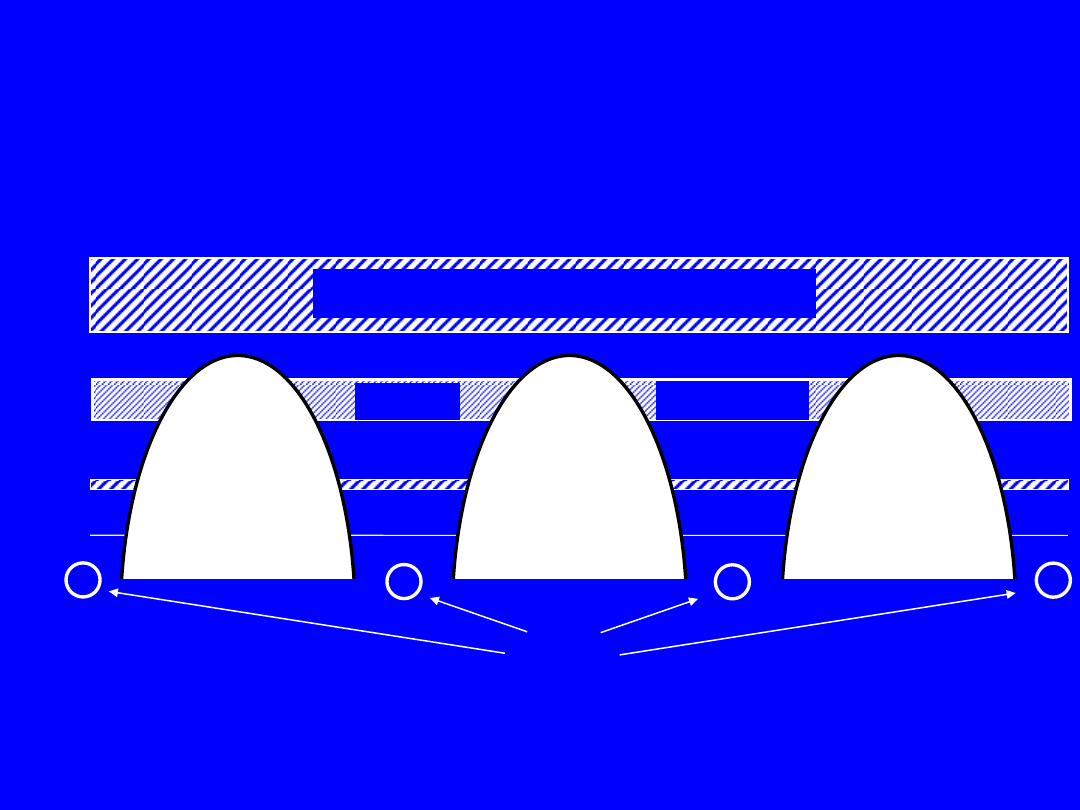
Rozszczepienie poziomów
energetycznych
Pasmo przewodnictwa (elektrony swobodne)
Pasmo
walencyjne
Jądra
atomów

Energetyczny model pasmowy
ciała stałego - stan normalny
Wg
Pasmo
walencyjne
Pasmo
przewodnictwa
Pasmo zabronione
(Energy gap)
W
Wc
Wv
(Conduction band)
(Valence band)

Energetyczny model pasmowy
ciała stałego
• Pasmo przewodnictwa
– odpowiada wartościom
energii, przy których elektrony stają się swobodnymi
i mogą brać udział w procesie przewodzenia prądu
elektrycznego.
• Pasmo zabronione
– obszar między pasmem
walencyjnym a pasmem przewodnictwa o odstępie
Wg (Wg
Ge
=0,68 eV, Wg
Si
=1,08eV), którego
elektrony nie mogą obsadzać.
• Pasmo walencyjne
-
odpowiada wartościom energii
elektronów walencyjnych.
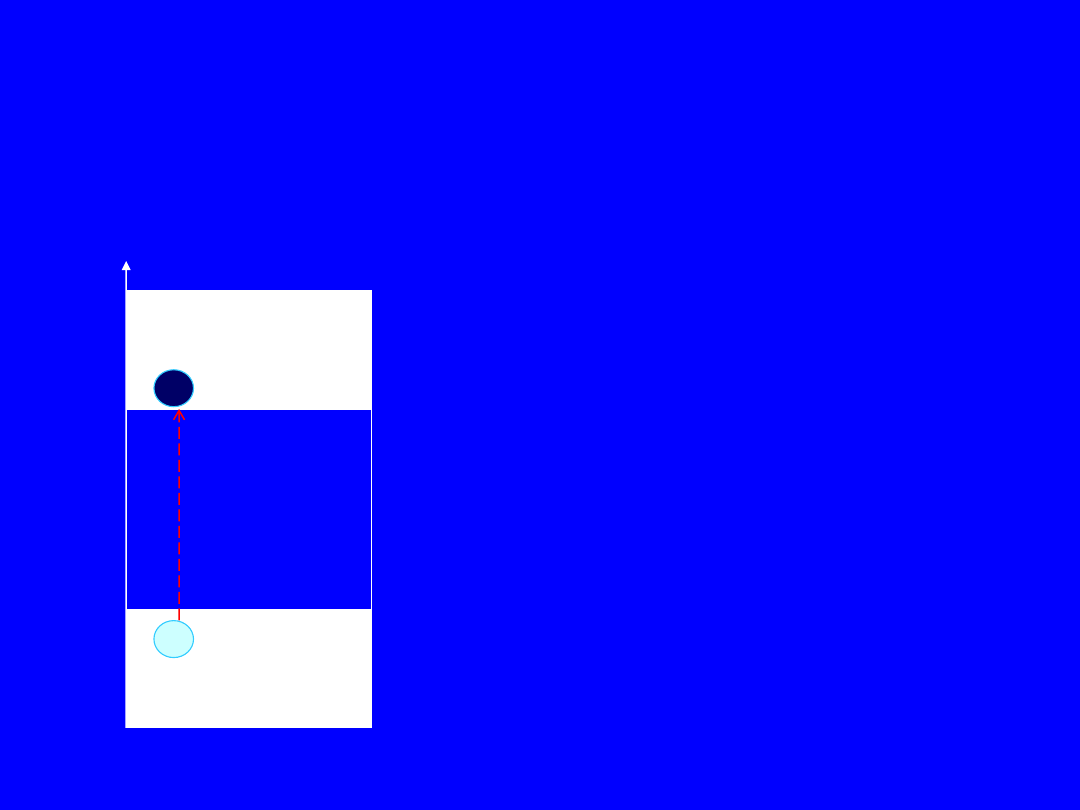
Energetyczny model pasmowy
ciała stałego - stan wzbudzenia
W
elektron
dziura
Wg
Wc
Wv
Generacja par elektron - dziura
Pod wpływem dostarczonej
energii, równej co najmniej
szerokości pasma zabronionego
Wg, część elektronów z pasma
walencyjnego przeskakuje do
pasma przewodnictwa,
pozostawiając w paśmie
walencyjnym wolne miejsca -
dziury.
Proces odwrotny -
rekombinacja
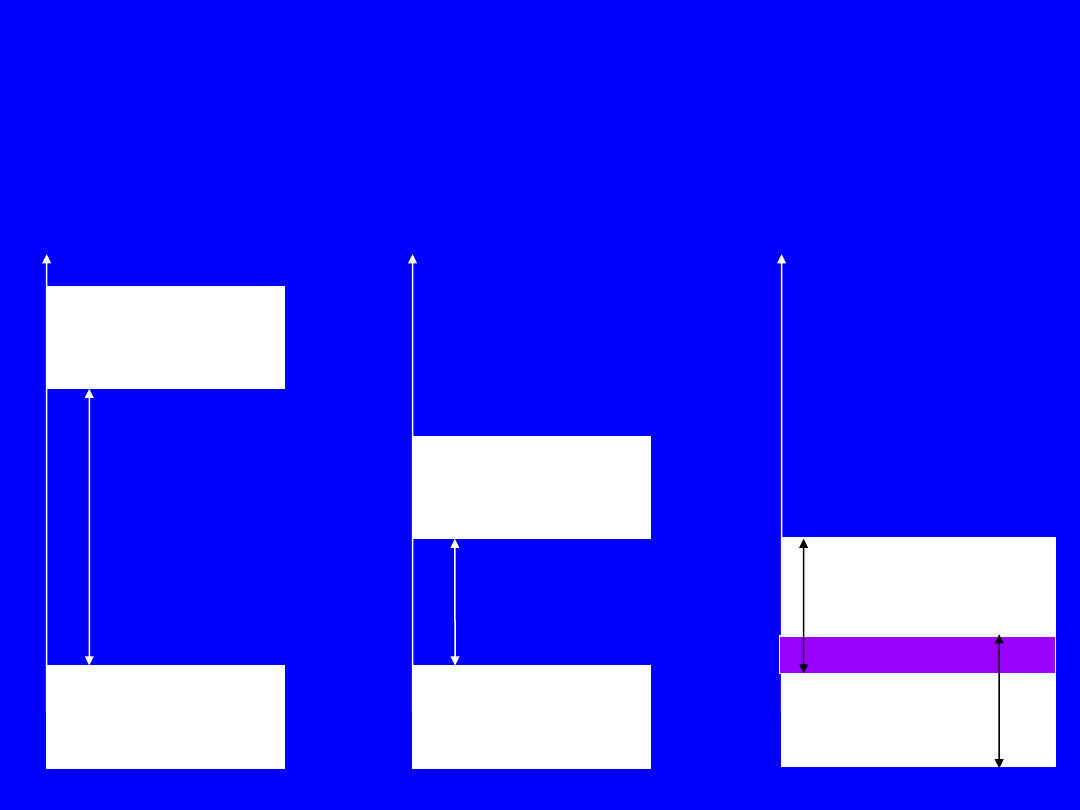
Energetyczne modele
pasmowe
Pasmo
walencyjne
Pasmo
przewodnictwa
Pasmo
zabronione
( Wg > 2 eV )
Pasmo
walencyjne
Pasmo
przewodnictwa
Pasmo
zabronione
( Wg <= 2 eV )
Pasmo
przewodnictwa
Pasmo
walencyjne
W
W
W
izolator
półprzewodnik
przewodnik

Półprzewodniki samoistne
i domieszkowane
• Półprzewodnik samoistny
(intrinsic semiconductor)
– idealnie czysty, nie zawierający żadnych
domieszek ani defektów sieci krystalicznej. Nośniki
swobodne powstają tylko w wyniku generacji par
elektron - dziura.
• Półprzewodnik domieszkowany
(extrinsic
semiconductor )
– półprzewodnik zawierający celowo
wprowadzone atomy innego pierwiastka , tzw.
domieszki.
Wyróżnia się 2 rodzaje domieszek:
- donorowe
- akceptorowe

Domieszki donorowe
Pierwiastki V grupy układu okresowego,
mające po 5 elektronów walencyjnych
Źródło grafiki: http://commons.wikimedia.org/wiki/
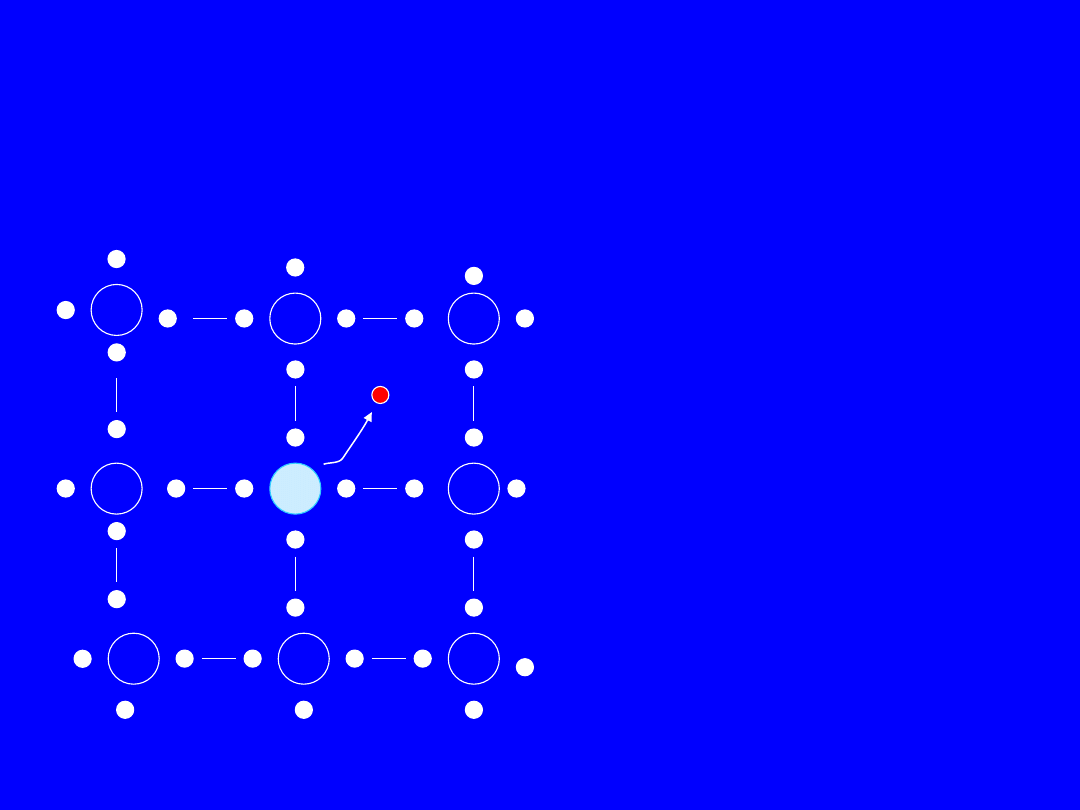
Półprzewodnik typu n - model
wiązań kowalencyjnych
Si
Si
Si
Si
Si
P
Si
Si
Si
Jeden z elektronów
walencyjnych atomu
fosforu nie bierze udziału
w tworzeniu wiązania
kowalencyjnego, dzięki
czemu może łatwo zostać
oderwany od
macierzystego atomu.
Energia jonizacji
Wj = 0,044 eV
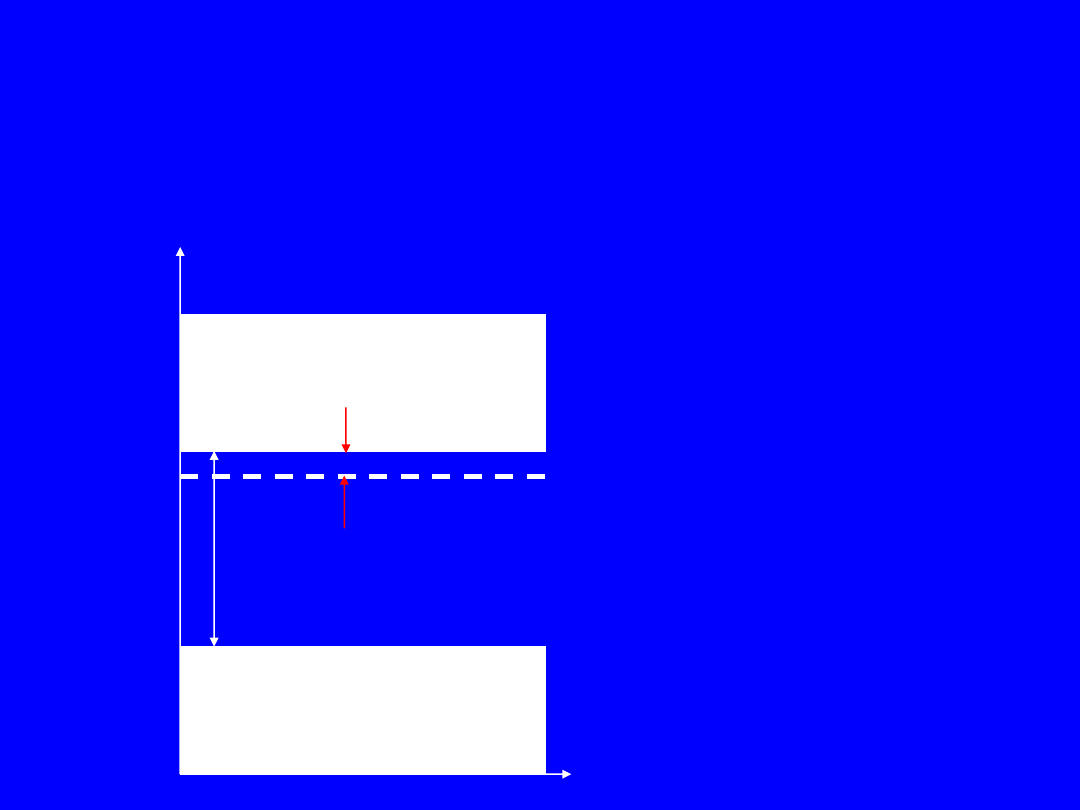
Półprzewodnik typu n -
energetyczny model pasmowy
Pasmo przewodnictwa
Pasmo walencyjne
Wg
poziom donorowy
W
Wc
Wv
Wd
Wj
Wj << Wg

Domieszki akceptorowe
Pierwiastki III grupy układu okresowego,
mające po 3 elektrony walencyjne
Źródło grafiki: http://commons.wikimedia.org/wiki/
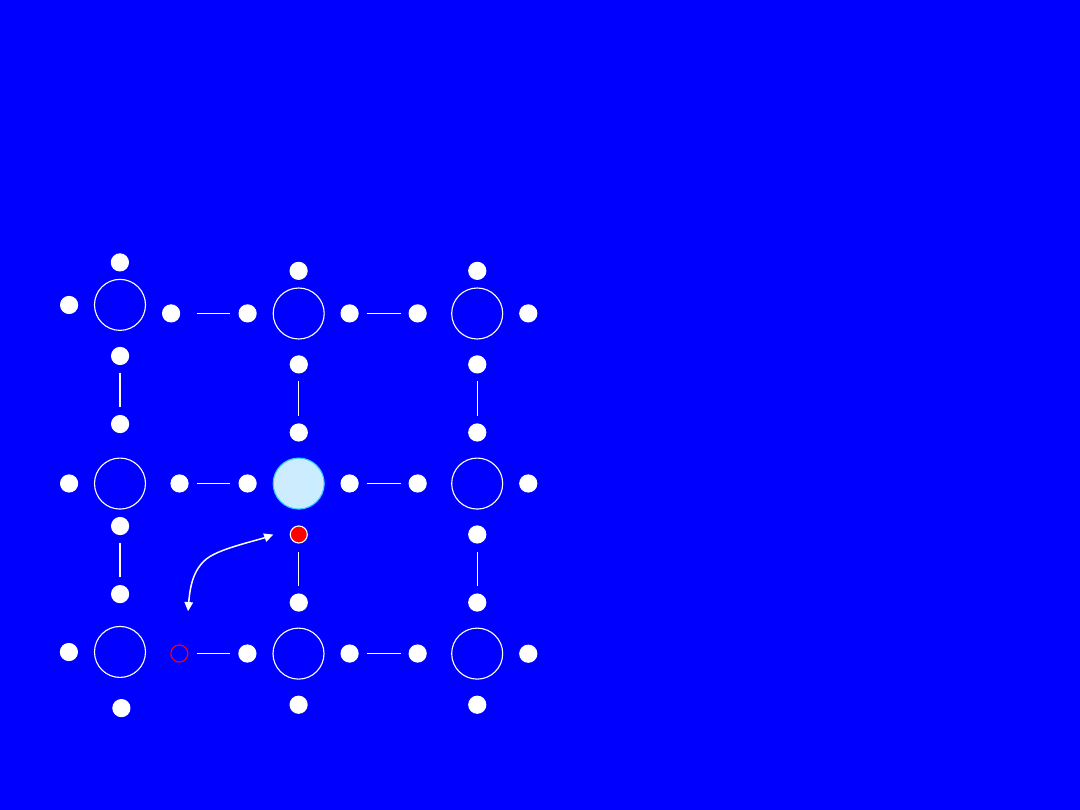
Półprzewodnik typu p - model
wiązań kowalencyjnych
Do utworzenia stabilnych
wiązań kowalencyjnych
atomowi boru brakuje
jednego elektronu. Może
być on łatwo uzupełniony
po oderwaniu
z sąsiadującego wiązania
Si-
Si, pozostawiając
w nim dziurę.
Energia jonizacji
Wj = 0,045 eV
Si
Si
Si
Si
Si
B
Si
Si
Si
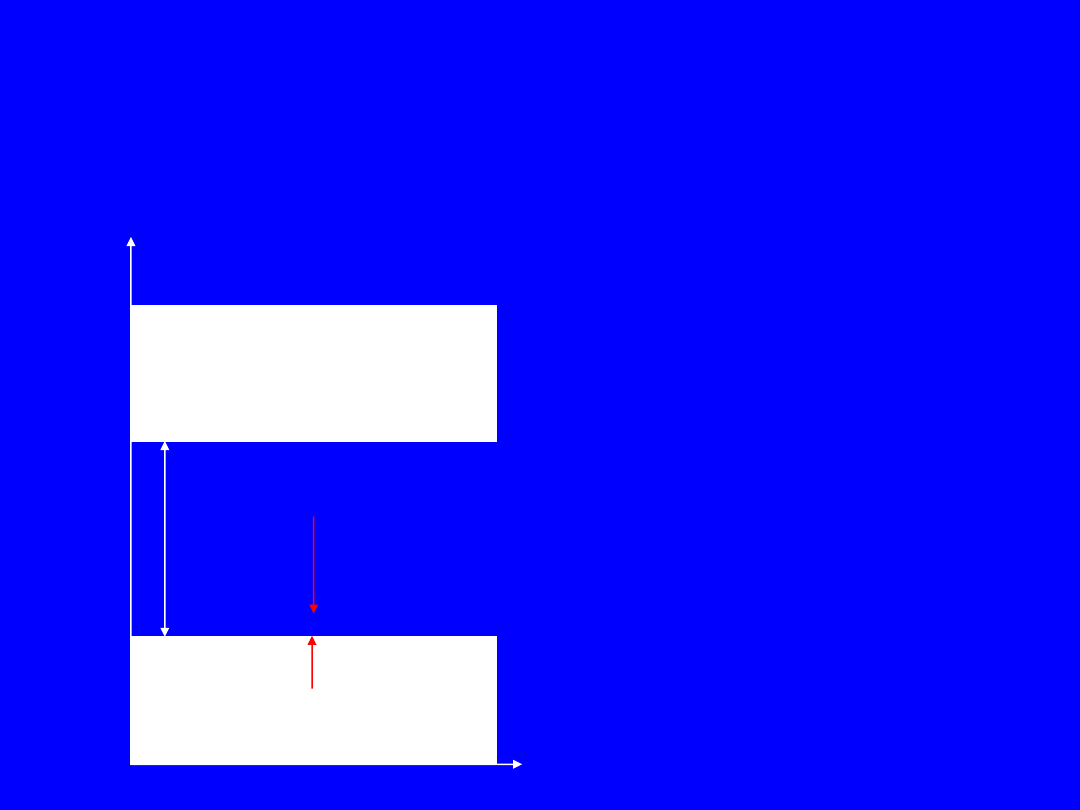
Półprzewodnik typu p -
energetyczny model pasmowy
Pasmo przewodnictwa
Pasmo walencyjne
Wg
++++++++++++++++++
W
Wc
Wv
Wa
poziom akceptorowy
Wj
Wj << Wg

Koncentracja elektronów
i dziur w stanie równowagi
termodynamicznej
c
W
n
dW
W
f
W
N
n
)
(
)
(
Wv
dW
W
fp
W
N
p
)
(
)
(
n -
koncentracja elektronów
p - koncentracja dziur
N(W) -
rozkład koncentracji poziomów energetycznych
w funkcji energii
f
n
(W), f
p
(W) -
funkcja rozkładu prawdopodobieństwa zajęcia
poziomu o energii W odpowiednio przez elektron (n)
lub dziurę (p)

Efektywna koncentracja
stanów energetycznych
)
(
c
n
c
W
f
N
n
)
(
v
p
v
W
f
N
p
N
c
, N
v
-
efektywne koncentracje stanów energetycznych
2
3
,
T
N
N
v
c

Efektywna koncentracja
stanów energetycznych
Efektywna
gęstość stanów
energetycznych
Si
Ge
GaAs
N
c
[m
-3
]
2.8*10
25
1.04*10
25
4.7*10
23
N
v
[m
-3
]
1.04*10
25
6.0*10
24
7.0*10
24

Rozkład Boltzmanna
kT
W
W
f
exp
)
(
k = 1.38 * 10
-23
J/K = 8.62 * 10
-5
eV/K
k -
stała Boltzmanna

Statystyka Fermiego - Diraca
)
(
1
)
(
exp
1
1
)
(
W
f
W
f
kT
W
W
W
f
n
p
F
n
W
F
-
energia (poziom) Fermiego; jest to wartość
energii, dla której prawdopodobieństwo
obsadzenia stanów wynosi 0,5 dla każdej
temperatury T > 0 K.
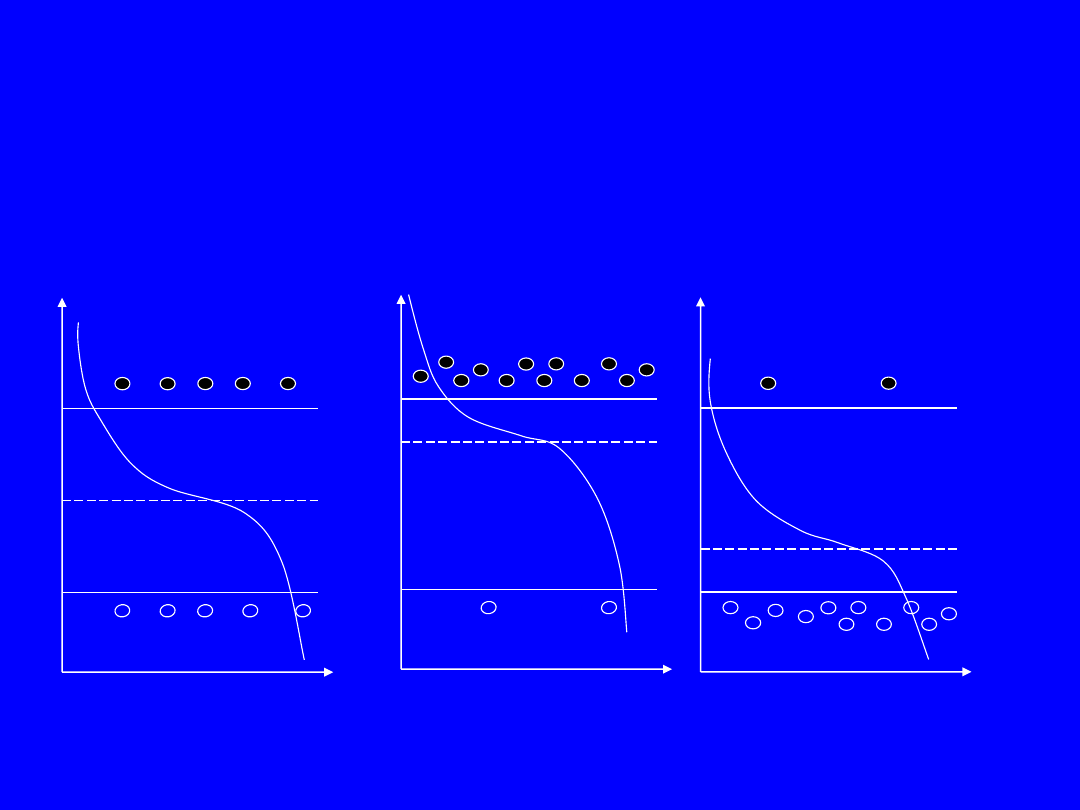
Statystyka Fermiego - Diraca
- wykresy
Wv
W
c
W
F
elektrony
dziury
W
W
W
W
F
W
F
półprz. samoistny
półprz. typu n
półprz. typu p
Wyszukiwarka
Podobne podstrony:
Podstawy elektroniki cz 4
Kurs podstaw elektroniki cz 5
Kurs podstaw elektroniki cz 2
Kurs podstaw elektroniki cz 4
Kurs podstaw elektroniki cz 7
Kurs podstaw elektroniki cz 8
Kurs podstaw elektroniki cz 1
Kurs podstaw elektroniki cz 3
Kurs podstaw elektroniki cz 6
Instrukcja 14 Badanie podstawowych kładów sterowania elektropneumatycznego cz 1
Podstawy elektroniki i miernictwa2
Podstawy elektroniki i energoelektroniki prezentacja ppt
Modul 3 Podstawy elektroniki cyfrowej
Biologiczne podstawy zachowań cz I Psychologia N 2012 2013
podstawy elektrotechniki
lista 4a, Elektrotechnika, PODSTAWY ELEKTROTECHNIKI, ćwiczenia
zadania na egzaminie czerwcowym 2009, Elektrotechnika, PODSTAWY ELEKTROTECHNIKI, pytania
więcej podobnych podstron