
Materiały pomocnicze do ćwiczeń z przedmiotu:
Termodynamika techniczna
Rozdział 1
Gazy jako czynnik termodynamiczny
mgr inż. Agnieszka Sadłowska-Sałęga


Materiały pomocnicze do przedmiotu Termodynamika techniczna. Rozdział 1
mgr inż. Agnieszka Sadłowska-Sałęga
3
1 Gaz jako czynnik termodynamiczny
Gaz doskonały (idealny) jest to abstrakcyjny, matematyczny model gazu, spełniający na-
stępujące warunki:
brak oddziaływań międzycząsteczkowych z wyjątkiem odpychania w momencie zderzeń cząste-
czek;
objętość cząsteczek jest znikoma w stosunku do objętości gazu;
zderzenia cząsteczek są doskonale sprężyste;
cząsteczki znajdują się w ciągłym chaotycznym ruchu.
Gaz doskonały posiada stałe ciepło właściwe (niezależne od temperatury i ciśnienia), nie zmienia
stanu skupienia. Można go traktować jako zbiór cząstek stanowiących punkty materialne. Ściśle
podporządkowuje się następującym prawom gazowym:
1. Boyle’a i Mariotte’a;
2. Gay-Lussaca;
3. Avogadra.
Gaz półdoskonały stosuje się do wyżej wymienionych trzech praw, ale jego ciepło właściwe
nie jest stałe i zależy od temperatury.
Gaz rzeczywisty – pojęcie termodynamiczne oznaczające gaz, który nie zachowuje się ściśle
zgodnie z prawami ustalonymi dla gazu doskonałego. W praktyce są to wszystkie gazy istniejące w
realnym świecie, aczkolwiek przybliżenie gazu doskonałego może w wielu warunkach być do nich
z powodzeniem zastosowane. Przybliżenie to zawodzi jednak w skrajnych warunkach, oraz gdy
istnieje potrzeba dokonania bardzo dokładnych obliczeń w warunkach zbliżonych do normalnych.
Należy zwrócić uwagę na to że gazy rzeczywiste znajdujące się pod niezbyt dużymi ciśnieniami
i w temperaturach znacznie wyższych od temperatur, w których mogłyby być bez zmiany ciśnienia
zmienione w ciecz, a zarazem niższych od tych, w których dysocjacja odgrywałaby dużą rolę, mają
własności bardzo zbliżone od własności gazów półdoskonałych. Stosując wtedy do nich prawa
Boyle'a i Mariotte'a, Gay-Lussaca, Avogadra i wynikające z tych praw wzory popełniamy tylko
małe błędy. Stosowanie zaś omawianych praw gazowych bardzo ułatwia nam obliczenia.
Materiały pomocnicze do przedmiotu Termodynamika techniczna. Rozdział 1
mgr inż. Agnieszka Sadłowska-Sałęga
4
Jako gazy półdoskonałe traktować więc można suche powietrze, azot, tlen, hel, metan i wiele
innych gazów znajdujących się pod ciśnieniem nie przekraczającym 4 MPa w temperaturach panu-
jących u nas zwykle w zimie i w lecie, a tym bardziej temperaturach wyższych. Natomiast nie wol-
no traktować jako gazów półdoskonałych tlenu zawartego w butli pod ciśnieniem 15 MPa (za wy-
sokie ciśnienie), pary wodnej wytworzonej w kotle parowym (w kotłach niskoprężnych temperatura
tej pary jest często równa lub niewiele wyższa od temperatury, w której można zamienić ją na ciecz,
para zaś wyprodukowana w nowoczesnych kotłach wysokoprężnych ma za duże ciśnienie) itd.
[Wilk. 1998].
Jeżeli w rozpatrywanym przez nas zagadnieniu ciepło właściwe gazu zmienia się bardzo mało
lub jeżeli chodzi nam tylko o obliczenia orientacyjne, to często nie tylko stosujemy omawiane tu
prawa gazowe, ale zakładamy jeszcze dodatkowo, że ciepło właściwe danego gazu jest niezmienne
– czyli traktujemy gaz jako doskonały.
1.1 Prawa gazowe
1.1.1 Prawo Boyle'a-Mariotte'a
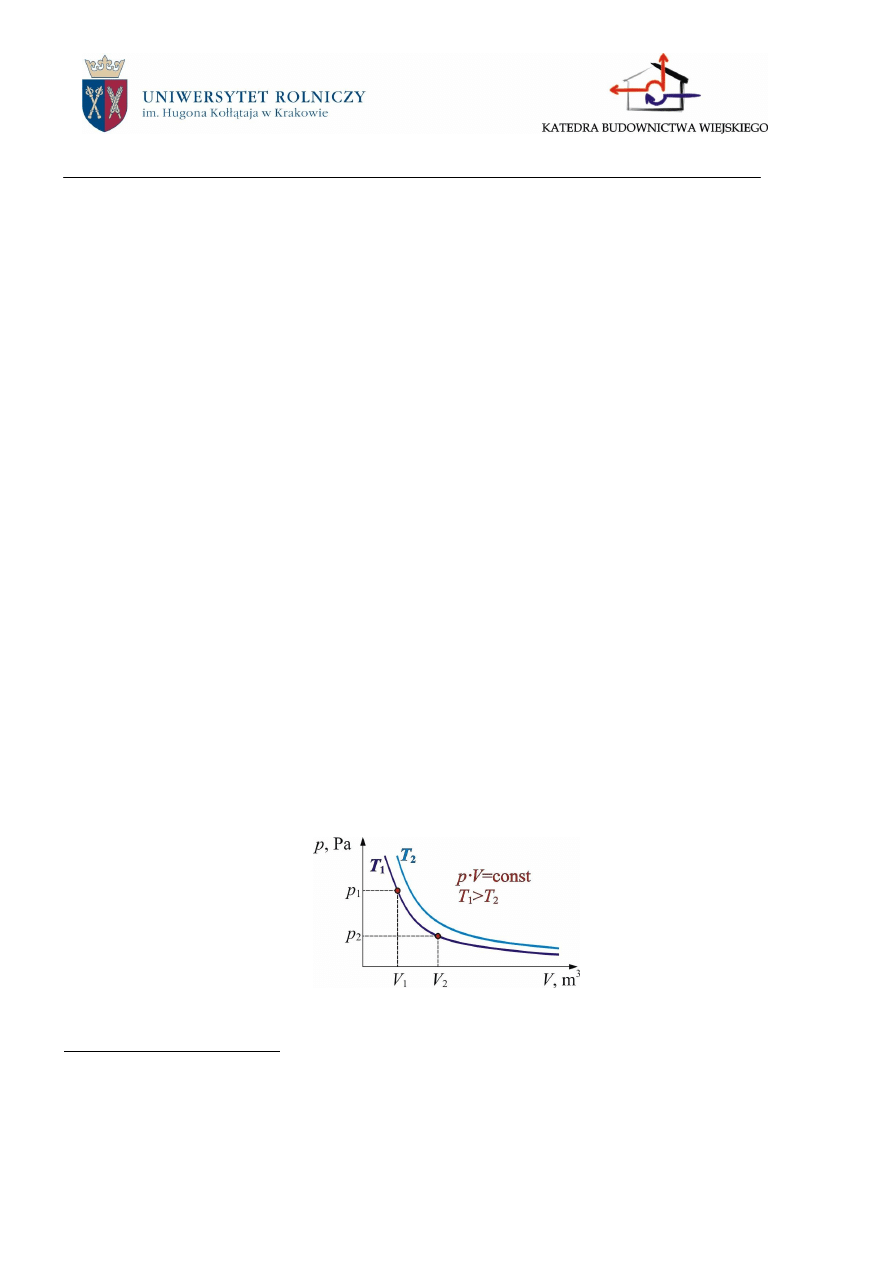
1
Prawo Boyle'a-Mariotte'a dotyczy zachowania gazu doskonałego w przemianie izotermicznej:
Jeżeli temperatura gazu nie zmienia się, to iloczyn jego ciśnienia bezwzględnego i objętości jest
wielkością stałą.
Gdy T = const:
const.
V
p
(1.1)
1
Prawo Boyle'a-Mariotte'a, zwane też (głównie w krajach anglosaskich) prawem Boyle'a, a prawem Mariotte'a we
Francji, zostało podane w1662 r. przez irlandzkiego naukowca Roberta Boyle'a, a niezależnie od niego w 1676 r.
przez Francuza Edme Mariotte'a.
Rys.1.1. Graficzna interpretacja prawa Boyle'a-Mariotte'a
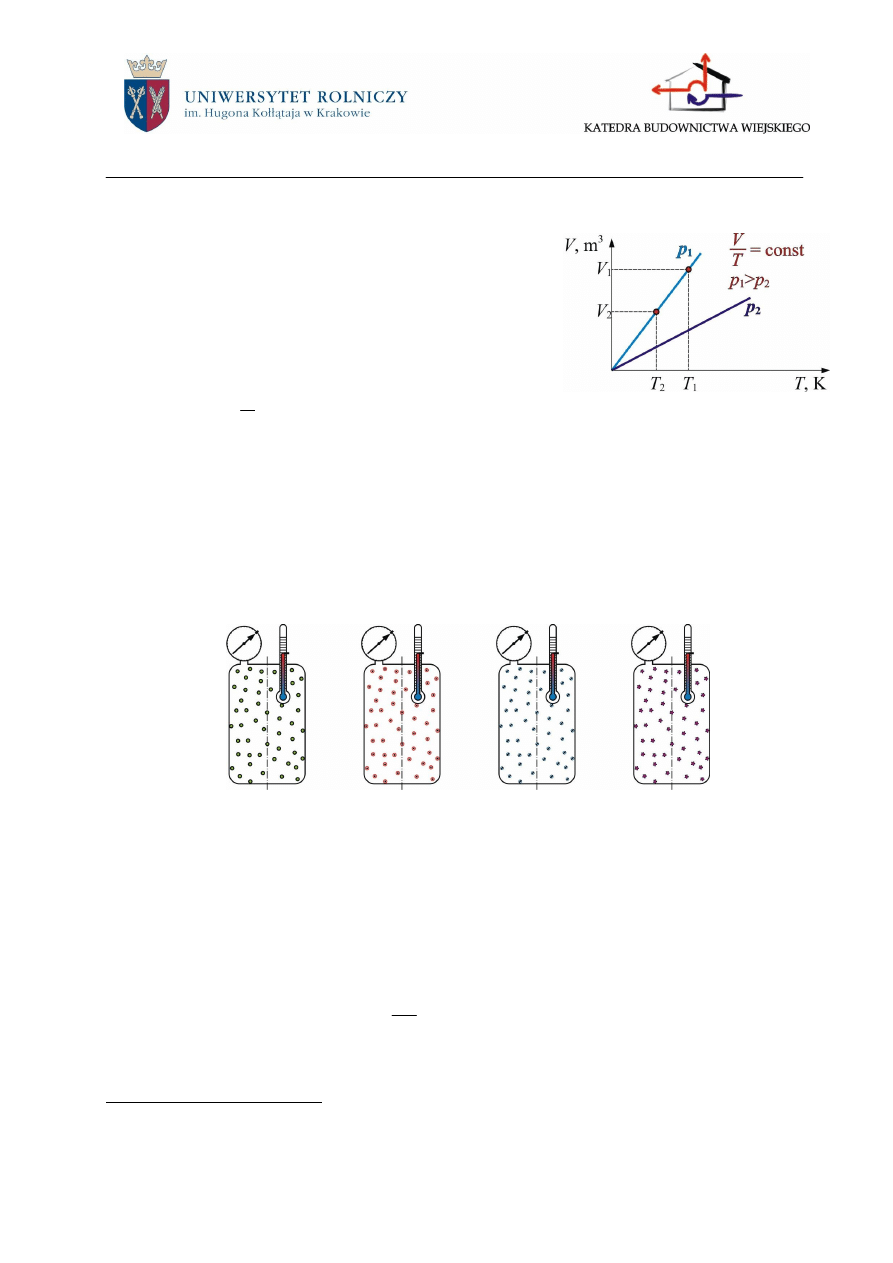
Materiały pomocnicze do przedmiotu Termodynamika techniczna. Rozdział 1
mgr inż. Agnieszka Sadłowska-Sałęga
5
1.1.2 Prawo Gay-Lussaca
2
Prawo Gay-Lussaca opisuje przemianę izobaryczną
gazu doskonałego: Jeżeli ciśnienie gazu jest stałe, to jego
objętość zmienia się wprost proporcjonalnie do temperatury
wyrażonej w kelwinach.
Gdy p = const:
const.
T
V
(1.2)
1.1.3 Prawo Avogadra
Prawo Avogadra (hipoteza Avogadra) jest prawem przybliżonym, którego zakres stosowalno-
ści zależy od podobieństwa porównywanych gazów rzeczywistych do gazu doskonałego.
W tych samych warunkach fizycznych tj. w takiej samej temperaturze i pod takim samym ci-
śnieniem, w równych objętościach różnych gazów znajduje się taka sama liczba cząsteczek.
Rys.1.3. Graficzna interpretacja prawa Avogadra
1.2 Równanie stanu gazu doskonałego i półdoskonałego
1.2.1 Ciepło właściwe
Pojemność cieplna (C) jest to różniczkowa ilość ciepła zaabsorbowanego przez układ (dQ),
niezbędna do zmiany temperatury układu jest proporcjonalna do tej zmiany temperatury (dT).
.
dT
dQ
C
]
K
J
[
1
(1.3)
2
Prawo to odkrył J.A. Charles na podstawie doświadczeń rozpoczętych w 1787 r. a ostatecznie sformułował
Gay-Lussac na podstawie opublikowanych przez siebie danych w 1802 r.
Rys.1.2. Graficzna interpretacja prawa
Gay-Lussaca

Materiały pomocnicze do przedmiotu Termodynamika techniczna. Rozdział 1
mgr inż. Agnieszka Sadłowska-Sałęga
6
Pojemność cieplna przypadająca na jednostkę masy to ciepło właściwe a na 1 mol to molowe ciepło
właściwe.
Kilogramowym ciepłem właściwym (c) nazywamy ilość ciepła potrzebną do ogrzania 1 kg
ciała o 1 stopień. W układzie jednostek SI ma ono wymiar J·kg
-1
·K
-1
.
Molowym ciepłem właściwym (Mc) nazywamy ilość ciepła potrzebną do ogrzania 1 mol cia-
ła o 1 stopień. W układzie jednostek SI ma ono wymiar J·mol
-1
·K
-1
.
Pojemność cieplna C jest związana z ciepłem właściwym oraz molowym ciepłem właściwym
poprzez proste zależności:
];
K
J
[
1
m
c
C
(1.4)
];
K
J
[
1
n
Mc
C
(1.5)
gdzie:
m
–
masa substancji, [kg];
n
–
liczba moli substancji, [mol].
Molowe ciepło właściwe, zwane czasem molową pojemnością cieplną, łączy z ciepłem właściwym
zależność opisana następującym wzorem:
];
K
mol
[J
1
1
c
M
Mc
(1.5)
gdzie:
M
–
masa molowa substancji, [kg·mol
-1
].
Ściśliwość gazów powoduje, że inną ilość ciepła należy dostarczyć ogrzewając gaz o 1 K przy
niezmiennym ciśnieniu, a inną – przy niezmiennej objętości. Z tego powodu, dla gazów, rozróżnić
należy ciepło właściwe przy stałym ciśnieniu (c
p
) i ciepło właściwe przy stałej objętości (c
v
).
Ciepło właściwe gazów doskonałych nie zależy od temperatury.
Analogicznie do ciepła właściwego molowe ciepło właściwe, w przypadku gazów, rozróż-
niamy molowe ciepło właściwe przy stałym ciśnieniu (Mc
p
) oraz molowe ciepło właściwe przy
stałym ciśnieniu (Mc
v
).
Ciepło właściwe przemiany realizowanej przy stałym ciśnieniu jest większe, niż ciepło wła-
ściwe przemiany realizowanej przy stałej objętości. Stosunek obu tych wielkości jest wykładni-
kiem adiabaty (κ):

Materiały pomocnicze do przedmiotu Termodynamika techniczna. Rozdział 1
mgr inż. Agnieszka Sadłowska-Sałęga
7
.
Mc
Mc
c
c
v
p
v
p
(1.6)
W tabeli 1.1. podano wartości molowego ciepła właściwego przy stałym ciśnieniu oraz stałej
objętości dla gazów doskonałych.
Tab.1.1. Molowe ciepło właściwe gazów doskonałych [Wilk]
Gazy
(Mc
p
)
[J·kmol
-1
·K
-1
]
(Mc
v
)
[J·kmol
-1
·K
-1
]
1-atmomowe
20 800
12 500
1,7
2-atmomowe
29 100
20 800
1,40
3- i więcej atmomowe
33 300
24 900
1,33
1.2.2 Stała gazowa
Uniwersalna stała gazowa (RM) – stała fizyczna równa pracy wykonanej przez 1 mol gazu
doskonałego podgrzewanego o 1 kelwin podczas przemiany izobarycznej. Wartość uniwersalnej
stałej gazowej nie zależy od rodzaju gazu, dla każdego gazu jest jednakowa i wynosi:
.
,
,
RM
1
1
K
mol
J
000015
0
314472
8
Dla gazu doskonałego, uniwersalna stała gazowa jest równa różnicy molowego ciepła właściwego
przy stałej objętości oraz przy ciśnieniu:
].
K
mol
[J
1
1
v
p
Mc
Mc
RM
(1.7)
gdzie:
(Mc
p
) –
molowe ciepło właściwe przy stałym ciśnieniu, [J·mol
-1
·K
-1
];
(Mc
v
)
molowe ciepło właściwe przy stałej objętości, [J·mol
-1
·K
-1
].
Indywidualna stała gazowa (R) – stała fizyczna równa pracy wykonanej przez 1 kg gazu
podgrzewanego o 1 kelwin podczas przemiany izobarycznej. Wartość indywidualnej stałej gazowej
jest zależna wyłącznie od masy molowej gazu i można ją wyliczyć z zależności:
].
K
kg
[J
1
1
M
RM
R
(1.8)
gdzie:
M
–
masa molowa substancji, [kg·mol
-1
].
Uwaga!
W literaturze można spotkać również inne oznaczenia ciepła właściwego oraz stałych gazo-
wych:
Materiały pomocnicze do przedmiotu Termodynamika techniczna. Rozdział 1
mgr inż. Agnieszka Sadłowska-Sałęga
8
molowe ciepło właściwe: C
m
, C
m
, C;
uniwersalna stała gazowa R indywidualna stała gazowa r.
W tabeli 1.2 Podano wartości indywidualnej stałej gazowej dla wybranych gazów.
Tab.1.2. Wartości indywidualnej stałej gazowej dla niektórych gazów
c
p
c
v
Rodzaj gazu
Znak chemiczny
R
[J·kg
-1
·K
-1
]
[J·kg
-1
·K
-1
]
Acetylen
C
2
H
2
319,6
1511
1216
Amoniak
NH
3
488,18
2060
1571
Azot
N
2
296,8
1038
742,7
Dwutlenek siarki
SO
2
129,8
586
478,6
Dwutlenek węgla
CO
2
188,8
802
630,1
Etan
C
2
H
6
276,7
1729
1445
Etylen
C
2
H
4
296,6
1612
1290
Hel
He
2078,0
5234
3161
Metan
CH
4
518,7
2160
1637
Powietrze
—
287,0
1006
716
Tlen
O
2
259,8
917
656,5
Tlenek węgla
CÓ
296,9
1047
743,2
Wodór
H
2
4124,2
14225
10111
Znając indywidualną stałą gazową oraz wykładnik adiabaty wartości ciepła właściwego przy
stałym ciśnieniu oraz stałej objętości obliczyć można również z następujących zależności:
;
K
kg
J
1
1
1
R
c
p
(1.9)
;
K
kg
J
1
1
1
1
R
c
v
(1.10)
1.2.3 Równanie Clapeyrona – równanie stanu gazu doskonałego
Na podstawie praw Boyle’a i Mariotte’a i Gay-Lussaca wyprowadzone zostało równanie sta-
nu gazu
3
opisujące związek pomiędzy temperaturą, ciśnieniem i objętością gazu doskonałego, a w
sposób przybliżony opisujący gazy rzeczywiste:
;
T
R
m
V
p
(1.11)
;
T
R
v
p
(1.11a)
3
Równanie stanu gazu sformułowane zostało w 1834 roku przez Benoîta Clapeyrona.

Materiały pomocnicze do przedmiotu Termodynamika techniczna. Rozdział 1
mgr inż. Agnieszka Sadłowska-Sałęga
9
;
T
RM
n
V
p
(1.11b)
gdzie:
m
–
masa gazu, [kg];
n
–
liczba moli gazu , [mol];
p
–
ciśnienie gazu, [Pa];
R
–
indywidualna stała gazowa, [J·kg
-1
·K
-1
];
RM
–
uniwersalna stała gazowa (RM = 8,314 J·mol
-1
·K
-1
), [J·mol
-1
·K
-1
];
T
–
temperatura gazu, [K];
V
–
objętość gazu, [m
3
];
v
–
objętość właściwa gazu, [m
3
·kg
-1
].
Wyszukiwarka
Podobne podstrony:
Choroba przewlekła jako czynnik ryzyka krzywdzenia emocjonalnego dziecka, Dziecko- Metody terapii
praca, Praca jako czynnik odradzający i umoralniający jednostkę i s, Praca jako czynnik odradzający
Aktywność i kreatywność własna jako czynnik rozwoju psychicznego
Zazdrość jako czynnik?terminujący zachowania czlowieka
14 Ruchy jako czynnik zmiany spolecznej
referat swiatopoglad jako czynnik ukierunkowujacy ksztalcenie w swietle pedagogiki kulturyx
infrastruktura techniczna jako czynnik rozwoju gospodarczego
Praca jako czynnik odradzający i umoralniający jednostkę i s
meteorologia, opracowanie meteorologiczne, Termika powietrza jako czynnik ekologiczny w leśnictwie
KOMPETENCJE LOGISTYCZNE FIRM POLSKICH JAKO CZYNNIK
Terror państwowy jako czynnik inżynierii społecznej
Woda jako czynnik profilaktyki zdrowotnej
Promieniowanie UV jako czynnik szkodliwy
Mycie i dezynfekcja jako czynniki eliminujące zagrożenia mikrobiologiczne w przemyśle spożywczym
więcej podobnych podstron