
Podstawy Chemii Nieorganicznej
Ć
wiczenia laboratoryjne
kod kursu:
CHC 0120
SUBSTANCJE TRUDNO ROZPUSZCZALNE
(rozpuszczalno
ść
substancji jonowych w roztworach wodnych)
Opracowanie: Andrzej T. Kowal
1. CZ
ĘŚĆ
TEORETYCZNA
Kryształy zwi
ą
zku chemicznego o strukturze jonowej w zetkni
ę
ciu z wod
ą
oddziaływaj
ą
z
cz
ą
steczkami rozpuszczalnika i nakład energii konieczny do usuni
ę
cia jonów z sieci krystalicznej
oraz rozerwania cz
ęś
ci wi
ą
za
ń
wodorowych mi
ę
dzy cz
ą
steczkami wody jest równowa
ż
ony przez
egzoenergetyczne procesy hydratacji jonów. Rozpuszczaniu substancji o strukturze jonowej towa-
rzyszy wi
ę
c dysocjacja elektrolityczna i hydratacja przechodz
ą
cych do roztworu jonów. Je
ż
eli w
powstałym roztworze pozostaje nadmiar substancji stałej poddawanej rozpuszczaniu, to w miar
ę
wzrostu st
ęż
e
ń
uwodnionych jonów w roztworze ro
ś
nie szybko
ść
procesu odwrotnego do roz-
puszczania, czyli wydzielania jonów z roztworu na powierzchni kryształów. Po pewnym czasie, dla
danej temperatury, ustala si
ę
stan równowagi dynamicznej pomi
ę
dzy procesem rozpuszczania i
procesem wydzielania substancji stałej, a roztwór pozostaj
ą
cy w równowadze z kryształami
zwi
ą
zku (osadem) jest roztworem nasyconym. St
ęż
enie roztworu nasyconego substancji, w
danej temperaturze, jest nazywane rozpuszczalno
ś
ci
ą
substancji w tej temperaturze.
Dla wi
ę
kszo
ś
ci zwi
ą
zków jonowych proces rozpuszczania w wodzie odbywa si
ę
z pochła-
nianiem energii i, zgodnie z reguł
ą
przekory Le Chatelier-Browna, rozpuszczalno
ść
takich zwi
ą
z-
ków ro
ś
nie wraz ze wzrostem temperatury. Rozpuszczalno
ść
substancji jonowych, których roz-
puszczaniu towarzyszy wydzielanie si
ę
ciepła (proces egzotermiczny), maleje wraz ze wzrostem
temperatury. Je
ż
eli w wyniku rozpuszczania zwi
ą
zku jonowego cały osad zostanie przeprowadzo-
ny do roztworu, a st
ęż
enie otrzymanego roztworu jest mniejsze od st
ęż
enia roztworu nasyconego,
to powstanie roztwór nienasycony, z którego mo
ż
na wydzieli
ć
ciało stałe przez zat
ęż
enie roz-
tworu i/lub obni
ż
enie temperatury. Powolne ochładzanie roztworu nienasyconego, w którym bra-
kuje zarodków krystalizacji, mo
ż
e doprowadzi
ć
do otrzymania roztworu przesyconego, w którym
st
ęż
enie substancji rozpuszczonej jest wy
ż
sze od rozpuszczalno
ś
ci zwi
ą
zku w danej temperatu-
rze. Taki stan roztworu jest nietrwały (metastabilny) i wprowadzenie do roztworu zarodków krysta-
lizacji (kryształy substancji stałej, cz
ą
stki szkła z bagietki u
ż
ytej do mieszania roztworu) powoduje
gwałtown
ą
krystalizacj
ę
nadmiaru zwi
ą
zku rozpuszczonego.
Jakkolwiek ró
ż
nice w rozpuszczalno
ś
ci zwi
ą
zków jonowych w wodzie si
ę
gaj
ą
kilkunastu
rz
ę
dów wielko
ś
ci, to nie jest mo
ż
liwe wyznaczenie wyra
ź
nej granicy pomi
ę
dzy zwi
ą
zkami łatwo i
trudno rozpuszczalnymi (porównanie dotyczy tej samej temperatury). Cz
ę
sto przyjmuje si
ę
umow-

2
nie,
ż
e zwi
ą
zki, których rozpuszczalno
ść
w temperaturze pokojowej przekracza 0,10 mol/dm
3
mo
ż
na uzna
ć
za łatwo rozpuszczalne, te za
ś
, których rozpuszczalno
ść
0,10 mol/dm
3
≥
R
≥
0,0010 mol/dm
3
zalicza si
ę
do umiarkowanie rozpuszczalnych, natomiast zwi
ą
zki o rozpuszczal-
no
ś
ci poni
ż
ej 0,0010 mol/dm
3
uwa
ż
a si
ę
za trudno rozpuszczalne. Zdecydowana wi
ę
kszo
ść
chlor-
ków, bromków, jodków i azotanów(V) metali jest dobrze rozpuszczalna w wodzie (poza halogen-
kami srebra(I), miedzi (I), ołowiu(II)). Siarczany(VI) metali rozpuszczaj
ą
si
ę
dobrze w wodzie, za
wyj
ą
tkiem siarczanów(VI) ołowiu(II), wapnia(II), strontu(II) i baru(II). Siarczany(IV) litowców i bery-
lowców zaliczaj
ą
si
ę
do dobrze rozpuszczalnych w odró
ż
nieniu od siarczanów(IV) pozostałych
kationów. W
ś
ród w
ę
glanów(IV) i siarczków jedynie zwi
ą
zki litowców nale
żą
do soli dobrze roz-
puszczalnych w wodzie.
1.1 Iloczyn rozpuszczalno
ś
ci
Równowag
ę
pomi
ę
dzy osadem i jonami powstałymi w wyniku rozpuszczenia i dysocjacji
trudno rozpuszczalnego zwi
ą
zku M
p
X
q
w jego roztworze nasyconym w danej temperaturze opisu-
je si
ę
za pomoc
ą
stałej równowagi, uwzgl
ę
dniaj
ą
c jedynie najprostsze postacie jonów:
M
p
X
q
(stały)
↔
p M
q+
+ q X
p-
q
p
p
q
X
M
q
X
p
M
a
a
a
K
−
+
=
gdzie a
i
jest aktywno
ś
ci
ą
cz
ą
stek i. Poniewa
ż
aktywno
ść
M
p
X
q
jest stała (substancja czysta
stanowi
ą
ca odr
ę
bn
ą
faz
ę
), wi
ę
c równie
ż
iloczyn aktywno
ś
ci w liczniku wyra
ż
enia na stał
ą
równo-
wagi ma warto
ść
stał
ą
. Je
ś
li dodatkowo siła jonowa roztworu (
∑
=
i
i
i
z
c
I
2
2
1
gdzie c
i
i z
i
s
ą
odpo-
wiednio st
ęż
eniem i ładunkiem jonu i) jest stała, to wtedy, ze wzgl
ę
du na stało
ść
współczynników
aktywno
ś
ci, aktywno
ś
ci jonów mo
ż
na zast
ą
pi
ć
st
ęż
eniami otrzymuj
ą
c iloczyn jonowy o postaci:
q
p
p
q
X
M
X
M
Ir
q
p
]
[
]
[
−
+
=
zwany iloczynem rozpuszczalno
ś
ci, który zale
ż
y jedynie od temperatury. St
ęż
enia [M
q+
] i [X
p-
]
s
ą
równowagowymi st
ęż
eniami jonów M
q+
i X
p-
w roztworze nasyconym M
p
X
q
. Warto
ś
ci ilo-
czynów rozpuszczalno
ś
ci podaje si
ę
cz
ę
sto w postaci logarytmicznej, korzystaj
ą
c z zale
ż
no
ś
ci: pIr
= -log
10
Ir. Przez analogi
ę
, wyra
ż
enie, w którym wyst
ę
puj
ą
st
ęż
enia jonów obliczone na pod-
stawie znanych liczno
ś
ci jonów M
q+
i X
p-
oraz obj
ę
to
ś
ci roztworu (a wi
ę
c niezale
ż
ne od
równowagi osad – roztwór):
q
X
p
M
X
M
p
q
q
p
c
c
Ij
−
+
=
nazywa si
ę
iloczynem jonowym M
p
X
q
. St
ęż
enia jonów M
q+
i X
p-
w roztworze nasyconym M
p
X
q
s
ą
okre
ś
lone przez warto
ść
iloczynu rozpuszczalno
ś
ci tej soli i łatwe do powi
ą
zania ze st
ęż
eniem
roztworu nasyconego (rozpuszczalno
ś
ci
ą
):
q
X
p
M
V
n
R
p
q
X
M
q
p
]
[
]
[
−
+
=
=
=
q
p
q
p
q
p
q
p
p
q
X
M
R
q
p
qR
pR
X
M
Ir
q
p
+
−
+
=
=
=
)
(
)
(
]
[
]
[
q
p
q
p
X
M
q
p
Ir
R
q
p
+
=

3
na przykład: PbF
2
↔
Pb
2+
+ 2 F
-
2
]
[
]
[
2
2
−
+
=
=
=
F
Pb
V
n
R
PbF
3
3
2
2
2
4
4
)
2
(
]
][
[
2
2
PbF
PbF
Ir
R
R
R
R
F
Pb
Ir
=
=
=
=
−
+
Zn
3
(AsO
4
)
2
↔
3 Zn
2+
+ 2 AsO
4
3-
2
]
[
3
]
[
3
4
2
)
(
2
4
3
−
+
=
=
=
AsO
Zn
V
n
R
AsO
Zn
5
)
(
5
2
3
2
3
4
3
2
)
(
108
108
)
2
(
)
3
(
]
[
]
[
2
4
3
2
4
3
AsO
Zn
AsO
Zn
Ir
R
R
R
R
AsO
Zn
Ir
=
=
=
=
−
+
Z postaci zale
ż
no
ś
ci mi
ę
dzy iloczynem rozpuszczalno
ś
ci i rozpuszczalno
ś
ci
ą
wynika,
ż
e
rozpuszczalno
ść
jest tym mniejsza, im mniejsza jest warto
ść
iloczynu rozpuszczalno
ś
ci zwi
ą
zku,
przy jednakowym typie wzoru chemicznego porównywanych zwi
ą
zków. Porównanie iloczynu
jonowego substancji trudno rozpuszczalnej z warto
ś
ci
ą
jej iloczynu rozpuszczalno
ś
ci jest
stosowane jako kryterium wytr
ą
cania (rozpuszczania) osadu:
<
>
si
ę
wytraca
nie
osad
:
Ir
si
ę
wytraca
osad
:
Ir
Ij
q
p
q
p
q
p
X
M
X
M
X
M
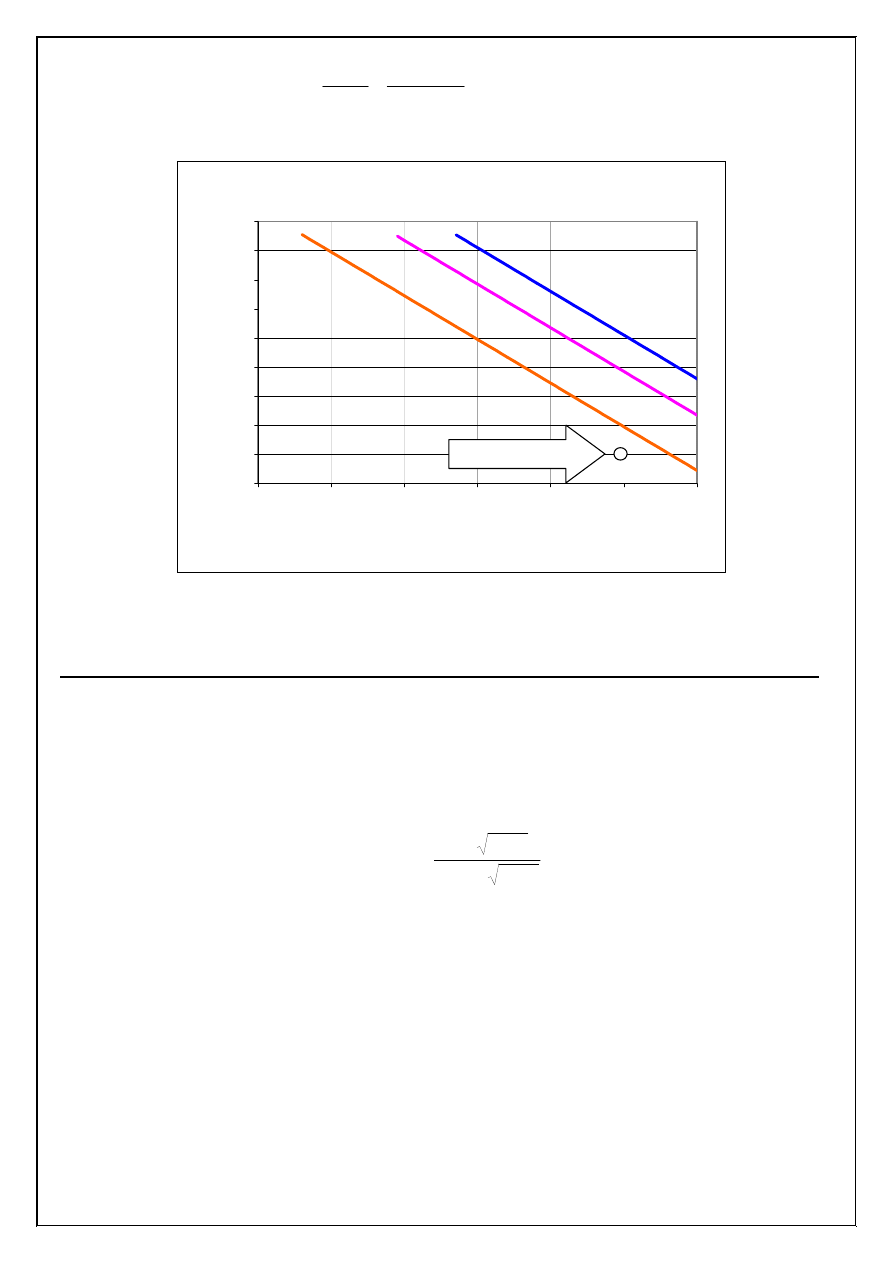
co zostało zilustrowane na wykresie st
ęż
enia jonów Ag
+
w funkcji st
ęż
enia jonów halogenkowych
(I
-
, Br
-
, Cl
-
) w roztworze (Rys. 1). Ka
ż
da z linii równowagi na tym wykresie spełnia równanie
[Ag
+
][X
-
] = Ir
AgX
, a odpowiadaj
ą
ce im hiperbole s
ą
przedstawione jako proste w układzie współ-
rz
ę
dnych log [Ag
+
] – log [X
-
]. Dodawanie kroplami 1,0 M AgNO
3
do roztworu 1,0·10
-3
M wzgl
ę
dem
jonów Cl
-
, Br
-
i I
-
powoduje wzrost st
ęż
enia jonów srebra(I) wzdłu
ż
linii pionowej [X
-
] =1,0·10
-3
M
do punktu „1” (w polu D wykresu), w którym iloczyny jonowe halogenków srebra s
ą
mniejsze od
odpowiednich iloczynów rozpuszczalno
ś
ci (roztwór jest nienasycony wzgl
ę
dem AgI, AgBr i AgCl).
Nast
ę
pnie, gdy st
ęż
enie jonów Ag
+
osi
ą
gnie warto
ść
7,9·10
-14
mol/dm
3
(linia równowagi AgI) roz-
poczyna si
ę
wytr
ą
canie osadu AgI. Dalszy wzrost st
ęż
enia jonów Ag
+
(pole C) powoduje wytr
ą
ca-
nie osadu AgI i spadek st
ęż
enia jonów I
-
wzdłu
ż
linii równowagi AgI. Gdy st
ęż
enie jonów Ag
+
osi
ą
gnie warto
ść
5,0·10
-10
mol/dm
3
to zostanie przekroczony iloczyn rozpuszczalno
ś
ci AgBr i roz-
poczyna si
ę
wytr
ą
canie osadu tej soli, a st
ęż
enie jonów Br
-
zmienia si
ę
wzdłu
ż
linii równowagi
AgBr. W punkcie odpowiadaj
ą
cym przekroczeniu iloczynu rozpuszczalno
ś
ci bromku srebra(I) st
ę
-
ż
enie jonów I
-
mo
ż
na obliczy
ć
z iloczynu rozpuszczalno
ś
ci AgI (punkt przeci
ę
cia linii poziomej
[Ag
+
]=5,0·10
-10
mol/dm
3
z lini
ą
równowagi AgI; [I
-
]=1,6·10
-7
mol/dm
3
). W polu B wykresu roztwór
jest nienasycony wzgl
ę
dem AgCl i dopiero wzrost st
ęż
enia jonów Ag
+
powy
ż
ej 1,6·10
-7
mol/dm
3
spowoduje przekroczenie iloczynu rozpuszczalno
ś
ci tej soli i wytr
ą
canie osadu AgCl. W chwili,
gdy st
ęż
enie jonów Ag
+
wzro
ś
nie do warto
ś
ci 0,10 mol/dm
3
, st
ęż
enia jonów I
-
, Br
-
i Cl
-
mo
ż
na
okre
ś
li
ć
z poło
ż
enia punktów przeci
ę
cia linii równowagi AgI, AgBr i AgCl z prost
ą
[Ag
+
]=0,10
mol/dm
3
.
]
/
[
10
94
,
7
10
,
0
10
94
,
7
]
[
]
[
3
16
17
dm
mol
Ag
Ir
I
AgI
−
−
+
−
⋅
=
⋅
=
=
]
/
[
10
01
,
5
10
,
0
10
01
,
5
]
[
]
[
3
12
13
dm
mol
Ag
Ir
Br
AgBr
−
−
+
−
⋅
=
⋅
=
=
4
]
/
[
10
58
,
1
10
,
0
10
58
,
1
]
[
]
[
3
9
10
dm
mol
Ag
Ir
Cl
AgCl
−
−
+
−
⋅
=
⋅
=
=
Rozpuszczalno
ść
AgX
1.0E-17
1.0E-15
1.0E-13
1.0E-11
1.0E-09
1.0E-07
1.0E-05
1.0E-03
1.0E-01
1.0E+01
1
.0
E
-1
8
1
.0
E
-1
5
1
.0
E
-1
2
1
.0
E
-0
9
1
.0
E
-0
6
1
.0
E
-0
3
1
.0
E
+
0
0
[X
-
]
[A
g
+
]
A
B
C
D
AgCl
AgBr
AgI
Ij
AgX
< Ir
AgX
1
Rysunek 1. Równowagi wytr
ą
cania osadów AgI, AgBr i AgCl (X=Cl
-
, Br
-
, I
-
). St
ęż
enia podano w skali loga-
rytmicznej, a linie równowagi s
ą
prostymi o równaniu [Ag
+
][X
-
] = Ir
AgX
.
2.1 Czynniki wpływaj
ą
ce na rozpuszczalno
ść
osadu trudno rozpuszczalnego zwi
ą
zku jonowego
2.1.1 Siła jonowa roztworu.
Wpływ siły jonowej na rozpuszczalno
ść
osadu wynika z zale
ż
no
ś
ci współczynników aktyw-
no
ś
ci jonów od siły jonowej roztworu [3] (na przykład, dla Ag
2
CrO
4
):
)
(
)
(
Ir
2
4
2
4
4
2
2
Ag
−
−
+
+
=
CrO
CrO
Ag
Ag
CrO
f
c
f
c
0
0
2
/
1
/
log
c
I
B
a
c
I
Az
f
i
i
⋅
+
−
=
gdzie f
i
jest współczynnikiem aktywno
ś
ci jonu i, z
i
- ładunkiem jonu i, A i B – stałymi empirycznymi
(A=0,51), I – sił
ą
jonow
ą
roztworu, a – promieniem jonu i [3]. Dodanie do nasyconego roztworu
chromianu(VI) srebra(I) 1,0 M roztworu azotanu(V) sodu (NaNO
3
nie ma jonów wspólnych z osa-
dem) spowoduje wzrost siły jonowej roztworu, a w konsekwencji zmniejszenie współczynników
aktywno
ś
ci jonów w roztworze. Je
ż
eli warto
ść
iloczynu rozpuszczalno
ś
ci Ag
2
CrO
4
ma pozosta
ć
stała, to musz
ą
wzrosn
ąć
st
ęż
enia jonów Ag
+
i CrO
4
2-
w roztworze nad osadem, a to mo
ż
e nast
ą
-
pi
ć
jedynie poprzez zwi
ę
kszenie rozpuszczalno
ś
ci osadu. Tylko w przypadku osadów koloidalnych
niewielki dodatek elektrolitu nie maj
ą
cego jonów wspólnych z osadem obni
ż
a jego rozpuszczal-
no
ść
w wodzie poprzez obni
ż
enie zdolno
ś
ci osadu do peptyzacji.
2.1.2 Elektrolit zawieraj
ą
cy jony wspólne z osadem.

5
Dodanie elektrolitu dysocjuj
ą
cego na jony wspólne z osadem do roztworu nasyconego
trudno rozpuszczalnego zwi
ą
zku (np. nasycony roztwór AgCl, do którego dodano roztwór AgNO
3
)
powoduje obni
ż
enie rozpuszczalno
ś
ci osadu przy zachowaniu stałej warto
ś
ci iloczynu rozpusz-
czalno
ś
ci:
AgCl(stały)
↔
Ag
+
+ Cl
-
AgNO
3
→
Ag
+
+ NO
3
-
]
)[
]
([
Ir
'
.
AgCl
−
+
+
+
=
Cl
c
Ag
Ag
osadu
rozp
Wzrost st
ęż
enia jonów Ag
+
w roztworze (c’
Ag+
jest st
ęż
eniem jonów Ag
+
z dodanego azota-
nu(V) srebra(I)) powoduje przesuni
ę
cie poło
ż
enia stanu równowagi procesu rozpuszczania i dy-
socjacji AgCl w kierunku wydzielania dodatkowej ilo
ś
ci osadu (reguła przekory) i zmniejszenia
st
ęż
e
ń
jonów Cl
-
i Ag
+
rozp osadu
([Cl
-
] = [Ag
+
]
rozp osadu
). Odpowiada to poruszaniu si
ę
wzdłu
ż
linii rów-
nowagi (AgCl) (Rys. 1) w kierunku malej
ą
cego st
ęż
enia jonów chlorkowych. Efekt ten obserwuje
si
ę
w przypadku umiarkowanych st
ęż
e
ń
dodanego elektrolitu, albowiem wzrost siły jonowej roz-
tworu i towarzysz
ą
ca mu zmiana współczynników aktywno
ś
ci jonów cz
ęś
ciowo kompensuje obni-
ż
enie rozpuszczalno
ś
ci osadu.
2.1.3 Hydroliza jonów powstaj
ą
cych w wyniku rozpuszczania osadu.
Je
ś
li jony znajduj
ą
ce si
ę
w stanie równowagi z osadem w roztworze trudno rozpuszczalne-
go elektrolitu pochodz
ą
od słabego kwasu lub słabej zasady, to ulegaj
ą
hydrolizie, a ich st
ęż
enie
ulega zmniejszeniu. Aby zachowa
ć
stał
ą
warto
ść
iloczynu rozpuszczalno
ś
ci musi rozpu
ś
ci
ć
si
ę
dodatkowa ilo
ść
osadu, co jest to
ż
same ze wzrostem jego rozpuszczalno
ś
ci. Efekt ten jest łatwo
zauwa
ż
alny w przypadku silnie hydrolizuj
ą
cych anionów S
2-
, PO
4
3-
, CO
3
2-
) i kationów (Bi
3+
, Sb
3+
).
Rozwa
ż
aj
ą
c wpływ hydrolizy jonu w
ę
glanowego w roztworze nad osadem w
ę
glanu baru(II) na
rozpuszczalno
ść
osadu mo
ż
na zauwa
ż
y
ć
,
ż
e równowagowe st
ęż
enie jonów CO
3
2-
jest okre
ś
lone
przez warto
ś
ci odpowiednich stałych równowagi:
BaCO
3
(osad)
↔
Ba
2+
+ CO
3
2-
]
][
[
2
3
2
3
−
+
=
CO
Ba
Ir
BaCO
CO
3
2-
+ H
2
O
↔
HCO
3
-
+ OH
-
]
[
]
][
[
2
3
3
2
1
−
−
−
=
=
CO
OH
HCO
K
K
K
a
w
h
HCO
3
-
+ H
2
O
↔
H
2
CO
3
+ OH
-
]
[
]
][
[
3
3
2
1
2
−
−
=
=
HCO
OH
CO
H
K
K
K
a
w
h
oraz
]
[
]
[
]
[
3
2
3
2
3
2
3
CO
H
HCO
CO
c
CO
+
+
=
−
−
−
gdzie: K
a1
i K
a2
s
ą
stałymi dysocjacji kwasu w
ę
glowego,
−
2
3
CO
c
- całkowitym st
ęż
eniem jonów w
ę
-
glanowych, a K
w
iloczynem jonowym wody. Je
ż
eli pH roztworu trudno rozpuszczalnego zwi
ą
zku,
którego anion ulega w roztworze hydrolizie (np. BaCO
3
), jest znane, to rozpuszczalno
ść
mo
ż
na
obliczy
ć
w prosty sposób [1,3].
2.1.4 St
ęż
enie jonów wodorowych w roztworach zawieraj
ą
cych aniony pochodz
ą
ce od sła-
bych kwasów.
6
Rozpuszczalno
ść
trudno rozpuszczalnych zwi
ą
zków, których aniony wywodz
ą
si
ę
od sła-
bych kwasów, zale
ż
y od st
ęż
enia jonów wodorowych w roztworze, poniewa
ż
poło
ż
enie stanu
równowagi reakcji protonowania (lub dysocjacji) tych cz
ą
stek jest zale
ż
ne od st
ęż
enia jonów wo-
dorowych. Zatem poprzez zmian
ę
pH roztworu (dodatek kwasu, zasady lub roztworu buforowego)
mo
ż
na wpływa
ć
na st
ęż
enie jonów decyduj
ą
cych o wytr
ą
caniu osadu. Zale
ż
no
ść
ta jest wyra
ź
nie
widoczna w układzie chromian(VI) – wodorochromian(VI), w którym poło
ż
enie stanu równowagi
reakcji:
CrO
4
2-
+ H
+
↔
HCrO
4
-
2 HCrO
4
-
↔
Cr
2
O
7
2-
+ H
2
O
przesuwa si
ę
wraz ze zmieniaj
ą
cym si
ę
st
ęż
eniem jonów H
+
, wpływaj
ą
c znacz
ą
co na st
ęż
enie
jonów [CrO
4
2-
] i rozpuszczalno
ść
osadów chromianów(VI) wapnia(II), strontu(II) i baru(II) (Tabela
1).
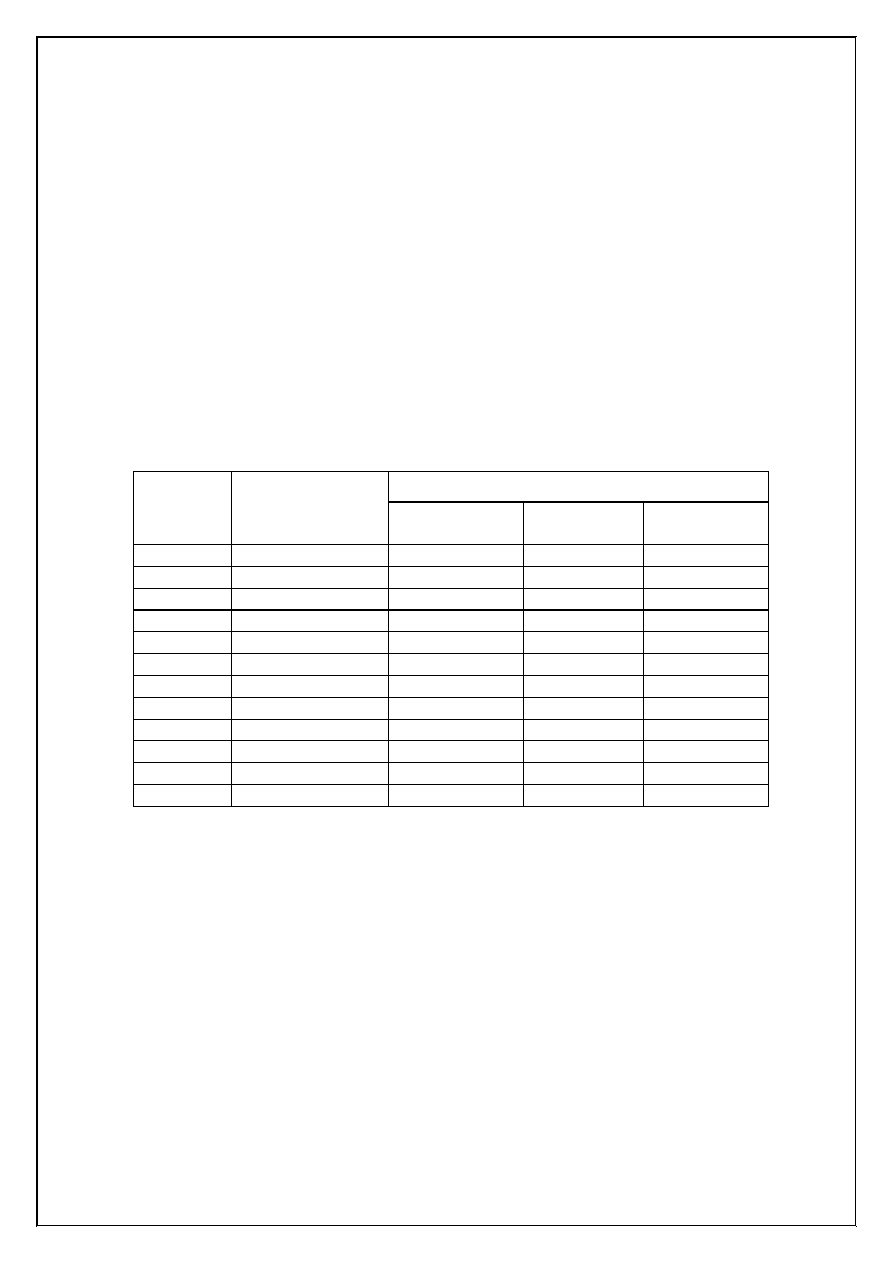
Tabela 1. St
ęż
enie jonów chromianowych(VI) i rozpuszczalno
ść
osadów chromianów(VI) baru(II),
strontu(II) i wapnia(II) w funkcji pH roztworu (
3
/
050
,
0
2
4
dm
mol
c
CrO
=
−
)
.
Rozpuszczalno
ść
osadu [mol/dm
3
]
pH
[CrO
4
2-
]
BaCrO
4
Ir = 1,17·10
-10
SrCrO
4
Ir = 3,63·10
-5
CaCrO
4
Ir = 7,08·10
-4
1,0
1,56·10
-7
6,14·10
-3
2,0
1,58·10
-6
1,93·10
-3
1,07
3,0
1,58·10
-5
6,10·10
-4
3,39·10
-1
1,50
4,0
1,58·10
-4
1,93·10
-4
1,07·10
-1
4,74·10
-1
5,0
1,53·10
-3
6,19·10
-5
3,44·10
-2
1,52·10
-1
6,0
1,20·10
-2
2,21·10
-5
1,23·10
-2
5,43·10
-2
7,0
3,80·10
-2
1,24·10
-5
6,91·10
-3
3,05·10
-2
8,0
4,85·10
-2
1,10·10
-5
6,12·10
-3
2,70·10
-2
9,0
4,98·10
-2
1,09·10
-5
6,04·10
-3
2,66·10
-2
10,0
5,00·10
-2
1,08·10
-5
6,03·10
-3
2,66·10
-2
11,0
5,00·10
-2
1,08·10
-5
6,03·10
-3
2,66·10
-2
12,0
5,00·10
-2
1,08·10
-5
6,03·10
-3
2,66·10
-2
Mo
ż
na zauwa
ż
y
ć
,
ż
e przy pH=4,00 st
ęż
enie równowagowe [CrO
4
2-
] stanowi tylko ok. 0,3%
całkowitego st
ęż
enia tych jonów,
]
[
]
[
2
4
2
4
2
4
−
−
+
=
−
HCrO
CrO
c
CrO
(Tabela 1). Dlatego w roztworze
0,050 M wzgl
ę
dem jonów Ca
2+
, Sr
2+
i Ba
2+
, przy ustalonym pH=4,00 i całkowitym st
ęż
eniu jonów
chromianowych(VI)
3
/
050
,
0
2
4
dm
mol
c
CrO
=
−
wytr
ą
ca si
ę
tylko osad BaCrO
4
. Obliczenie iloczynu
jonowego MCrO
4
(M=Ca
2+
, Sr
2+
, Ba
2+
)
6
4
2
4
2
10
88
,
7
10
58
,
1
050
,
0
]
][
[
4
−
−
−
+
⋅
=
⋅
⋅
=
=
CrO
M
Ij
MCrO
pokazuje,
ż
e jego warto
ść
przekracza iloczyn rozpuszczalno
ś
ci chromianu(VI) baru(II), lecz jest
wyra
ź
nie mniejsza od iloczynów rozpuszczalno
ś
ci SrCrO
4
i CaCrO
4
.
Podobnie, zale
ż
no
ść
st
ęż
enia jonów siarczkowych od pH roztworu jest wykorzystywana do
wytr
ą
cania trudno rozpuszczalnych siarczków metali w sposób pozwalaj
ą
cy na rozdział kationów
metali o ró
ż
ni
ą
cej si
ę
rozpuszczalno
ś
ci siarczków. St
ęż
enia jonów S
2-
, HS
-
i cz
ą
steczek siarkowo-
doru zmieniaj
ą
si
ę
w bardzo szerokim zakresie wraz ze zmieniaj
ą
cym si
ę
st
ęż
eniem jonów wodo-
rowych (Rysunek 2).
7
H
2
S
↔
H
+
+ HS
-
98
,
6
2
1
10
]
[
]
][
[
−
−
+
=
=
S
H
HS
H
K
a
HS
-
↔
H
+
+ S
2-
60
,
12
2
2
10
]
[
]
][
[
−
−
−
+
=
=
HS
S
H
K
a
]
[
]
[
]
[
2
2
2
−
−
+
+
=
S
HS
S
H
c
S
H
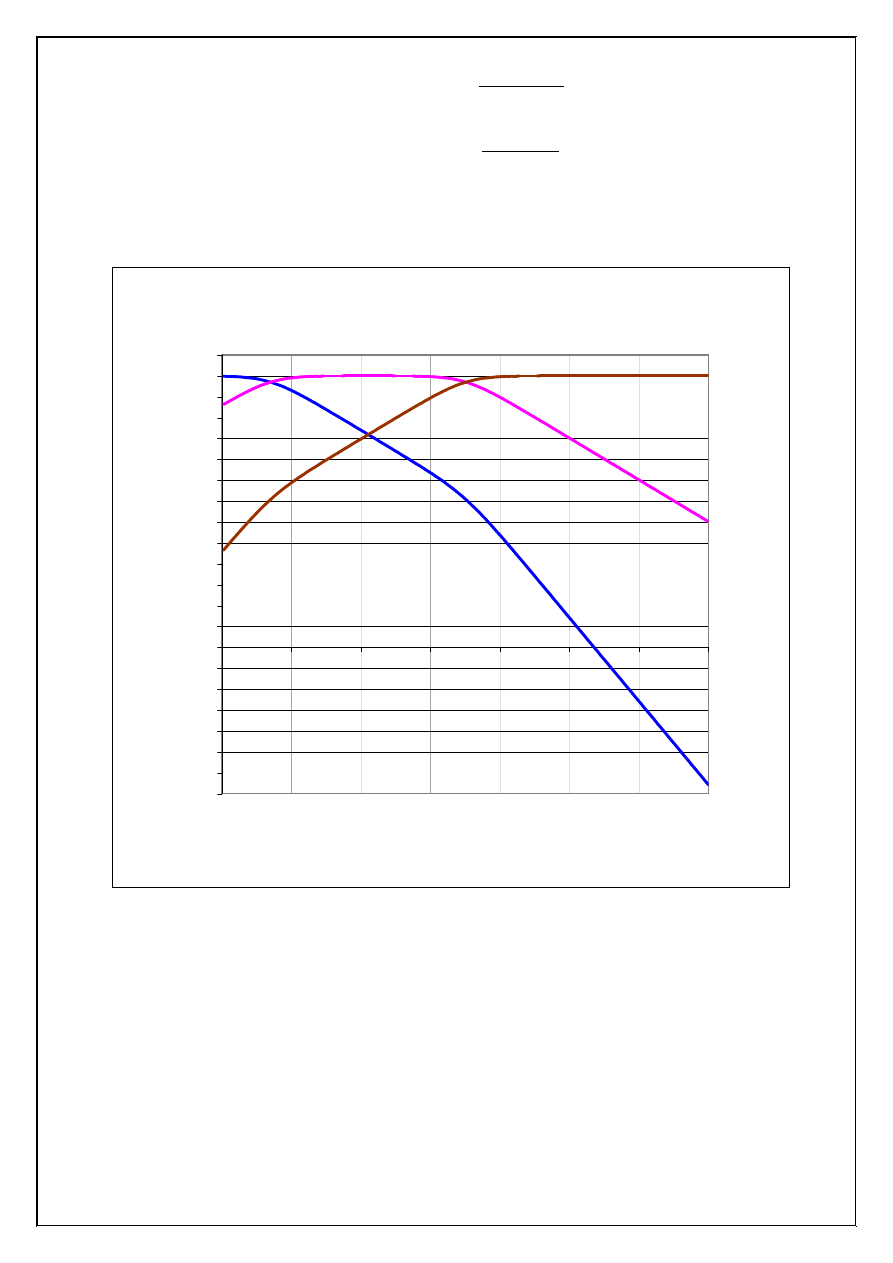
St
ęż
enia: H
2
S, HS
-
, S
2-
w funkcji st
ęż
enia jonów wodorowych
1.0E-21
1.0E-20
1.0E-19
1.0E-18
1.0E-17
1.0E-16
1.0E-15
1.0E-14
1.0E-13
1.0E-12
1.0E-11
1.0E-10
1.0E-09
1.0E-08
1.0E-07
1.0E-06
1.0E-05
1.0E-04
1.0E-03
1.0E-02
1.0E-01
1.0E+00
1.0E-14
1.0E-12
1.0E-10
1.0E-08
1.0E-06
1.0E-04
1.0E-02
1.0E+00
[H
+
]
[X
]
S
2-
H
2
S
HS
-
Rysunek 2. Krzywe równowagi w nasyconym roztworze H
2
S w zale
ż
no
ś
ci od st
ęż
enia jonów wodo-
rowych (X=H
2
S, HS
-
, S
2-
). St
ęż
enie całkowite siarkowodoru,
3
H
mol/dm
10
,
0
c
2
=
S
. St
ęż
enia jonów i cz
ą
-
steczek podano w skali logarytmicznej
.
W nasyconym roztworze siarkowodoru (st
ęż
enie całkowite,
3
H
mol/dm
10
,
0
c
2
=
S
), przy pH <
0,50 st
ęż
enie jonów siarczkowych nie przekracza warto
ś
ci 1,0·10
-20
mol/dm
3
(krzywa S
2-
, Rys. 2),
co wystarcza do wytr
ą
cenia osadu CuS, a st
ęż
enie jonów Cu
2+
w równowadze z osadem siarczku
miedzi(II) jest mniejsze od 1,0·10
-15
mol/dm
3
(krzywa CuS, Rys. 3). W tych warunkach iloczyny
jonowe siarczków niklu(II) i manganu(II) (krzywe NiS i MnS, Rys. 3) s
ą
znacznie mniejsze od od-
powiednich warto
ś
ci iloczynów rozpuszczalno
ś
ci i osady siarczków tych metali nie wytr
ą
caj
ą
si
ę
.
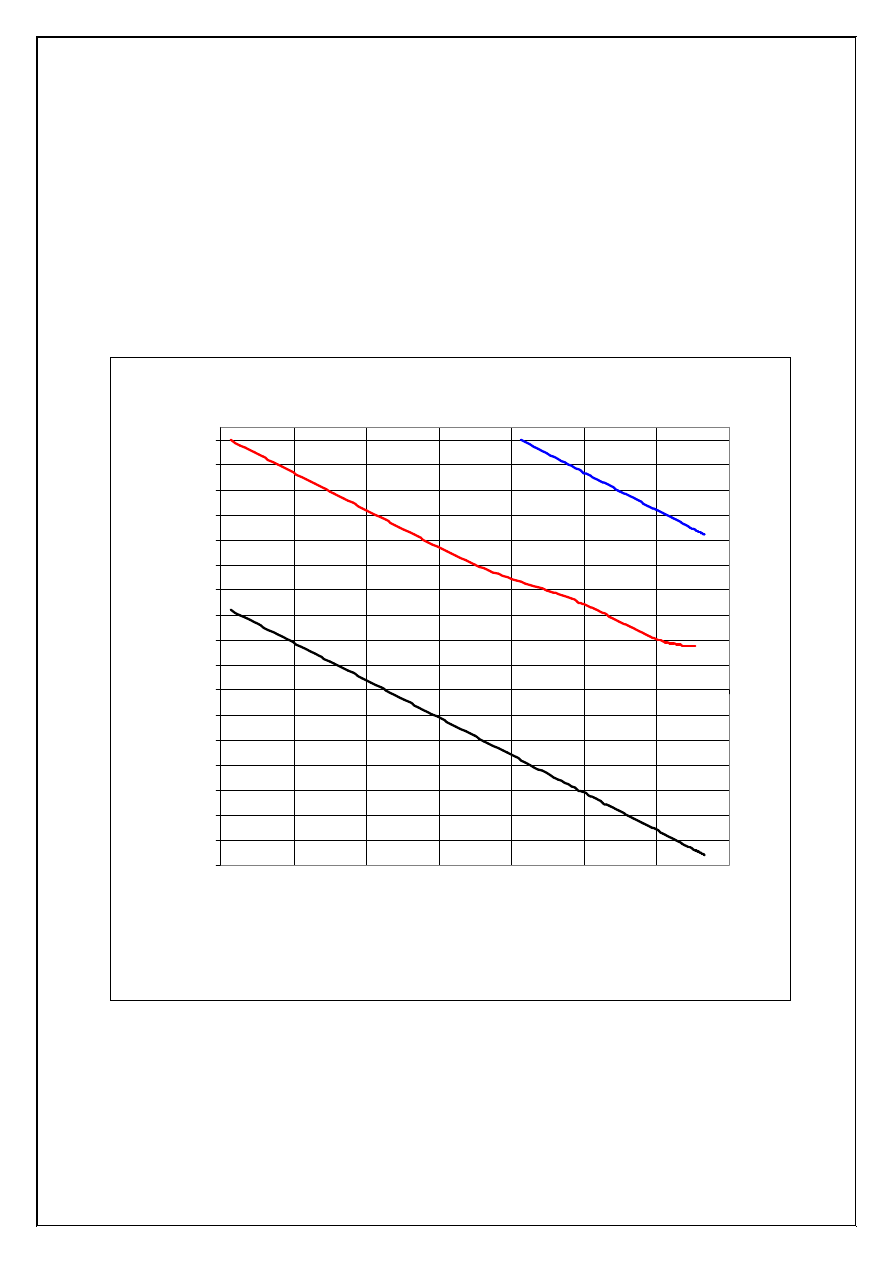
8
W miar
ę
wzrostu pH rosn
ą
st
ęż
enia jonów S
2-
i HS
-
, i przy pH=3,0 ([S
2-
]=1,0·10
-15
) nast
ę
puje cał-
kowite wytr
ą
cenie siarczku niklu(II) (krzywa NiS). Przy pH=6,0 st
ęż
enie jonów siarczkowych,
[S
2-
]=4,0·10
-9
nie wystarcza jeszcze do przekroczenia iloczynu rozpuszczalno
ś
ci siarczku manga-
nu(II) (krzywa MnS), a całkowite wytr
ą
cenie tego siarczku nast
ę
puje dopiero przy pH
≅
9,0 (st
ęż
e-
nie jonów Mn
2+
w roztworze nad osadem jest mniejsze od 1,0·10
-5
mol/dm
3
). Rozdział kationów
Cu
2+
, Ni
2+
i Mn
2+
w roztworze 0,10 M wzgl
ę
dem ka
ż
dego z tych jonów jest wi
ę
c mo
ż
liwy przez
wytr
ą
cenie siarczku miedzi(II) przy pH < 0,50, oddzielenie osadu CuS od roztworu, nast
ę
pnie wy-
tr
ą
cenie siarczku niklu(II) przy pH=3,0, a wtedy roztwór otrzymany po oddzieleniu osadu NiS za-
wiera jedynie jony manganu(II) (ró
ż
nice st
ęż
e
ń
: [Mn
2+
]
>>
[Ni
2+
] >> [Cu
2+
] wynosz
ą
nie mniej ni
ż
6
rz
ę
dów wielko
ś
ci).
Równowagi wytr
ą
cania osadów MnS, NiS i CuS
1.0E-35
1.0E-33
1.0E-31
1.0E-29
1.0E-27
1.0E-25
1.0E-23
1.0E-21
1.0E-19
1.0E-17
1.0E-15
1.0E-13
1.0E-11
1.0E-09
1.0E-07
1.0E-05
1.0E-03
1.0E-01
1.0E-21
1.0E-18
1.0E-15
1.0E-12
1.0E-09
1.0E-06
1.0E-03
1.0E+00
[S
2-
]
[M
2
+
]
MnS
CuS
NiS
Rysunek 3. Krzywe równowagi wytr
ą
cania siarczków CuS, NiS i MnS. St
ęż
enia jonów podano w skali loga-
rytmicznej, a linie równowagi s
ą
prostymi o równaniu [M
2+
][S
2-
] = Ir
MS
.
2.1.5 Tworzenie zwi
ą
zków kompleksowych
Tworzenie zwi
ą
zków kompleksowych przez kationy metalu w roztworze nasyconym trudno
rozpuszczalnego elektrolitu prowadzi cz
ę
sto do zwi
ę
kszenia rozpuszczalno
ś
ci osadu. Efekt taki
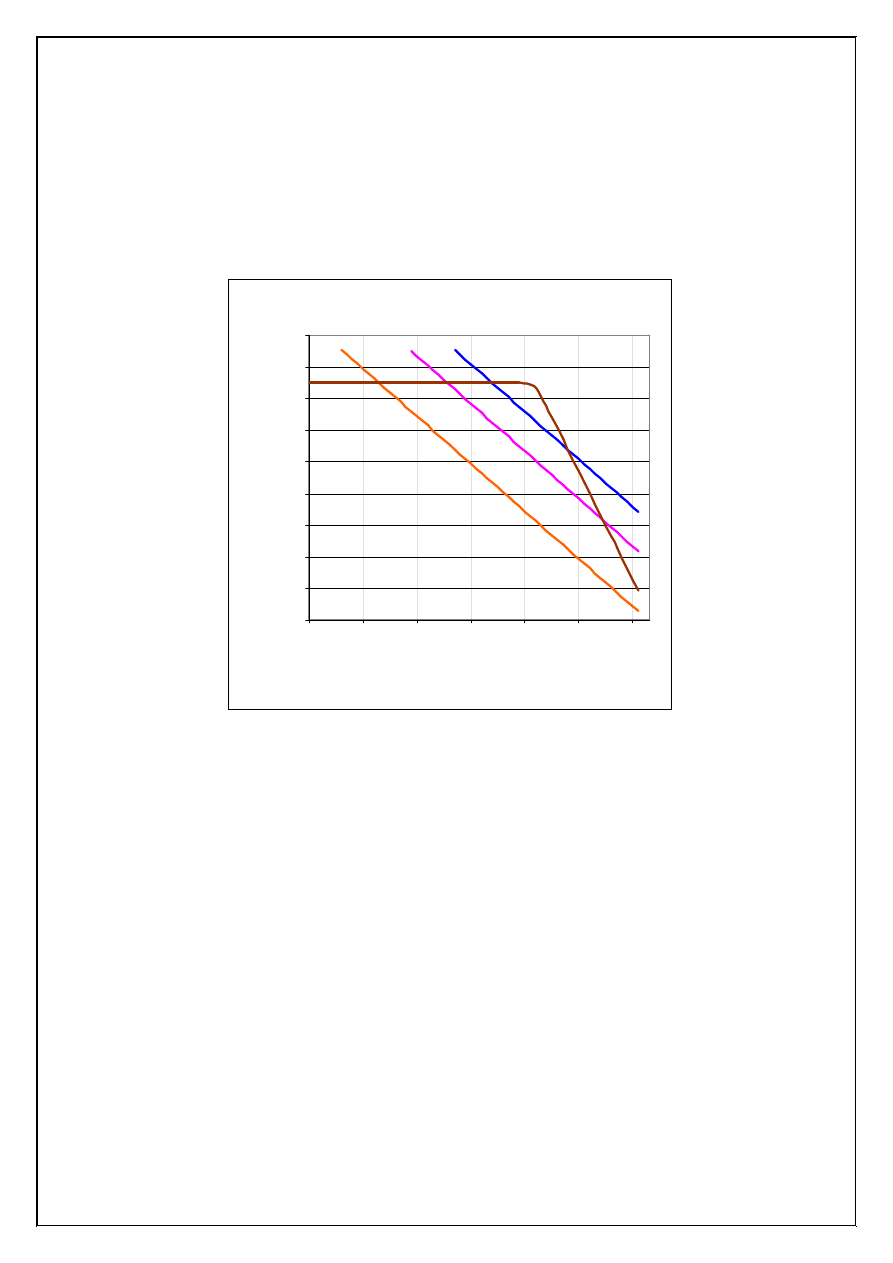
9
jest zale
ż
ny od warto
ś
ci stałych równowagi konkurencyjnych procesów: tworzenia zwi
ą
zków kom-
pleksowych i wytr
ą
cania trudno rozpuszczalnego osadu, a tak
ż
e st
ęż
enia jonów metalu oraz st
ę
-
ż
enia wolnego ligandu w roztworze nad osadem. Kompleksowanie jonów metalu w roztworze na-
syconym trudno rozpuszczalnego zwi
ą
zku bywa wykorzystywane do selektywnego rozpuszczania
osadów (osady AgCl, AgBr i AgI w obecno
ś
ci roztworu amoniaku) lub zapobiegania wytr
ą
caniu
si
ę
osadów (maskowanie jonów, z u
ż
yciem jonów CN
-
, C
2
O
4
2-
lub EDTA jako ligandów). Wpływ
st
ęż
enia amoniaku na rozpuszczalno
ść
osadów AgCl, AgBr i AgI zilustrowano na Rysunku 4.
Rozpuszczalno
ść
AgX w obecno
ś
ci NH
3
1,0E-17
1,0E-15
1,0E-13
1,0E-11
1,0E-09
1,0E-07
1,0E-05
1,0E-03
1,0E-01
1,0E+01
1,0E-18
1,0E-15
1,0E-12
1,0E-09 1,0E-06
1,0E-03 1,0E+00
[X
-
] [NH
3
]
[A
g
+
]
Ag
+
AgCl
AgBr
AgI
Rysunek 4. Wpływ st
ęż
enia NH
3
i jonów halogenkowych (X=Cl, Br, I) na rozpuszczalno
ść
osadów AgCl,
AgBr i AgI (całkowite st
ęż
enie jonów Ag
+
,
3
Ag
mol/dm
010
,
0
c
=
+
). St
ęż
enia jonów i cz
ą
steczek podano w
skali logarytmicznej.
Krzywe oznaczone wzorami halogenków srebra(I) opisuj
ą
równowagi AgX(osad)
↔
Ag
+
+
X
-
(Ir
AgX
=[Ag
+
][X
-
]), podczas gdy krzywa opisana symbolem Ag
+
przedstawia st
ęż
enie jonów sre-
bra(I) w równowadze z amoniakiem i kationami aminasrebra(I) i diaminasrebra(I). Z wykresu na
Rysunku 4 wynika,
ż
e osad AgI jest nierozpuszczalny w roztworze amoniaku (krzywa równowagi
AgI(osad)
↔
Ag
+
+ I
-
przebiega poni
ż
ej krzywej odpowiadaj
ą
cej st
ęż
eniu [Ag
+
] w równowadze z
NH
3
), lecz osady AgBr i AgCl mo
ż
na przeprowadzi
ć
do roztworu, stosuj
ą
c odpowiednio st
ęż
ony
roztwór amoniaku (w obszarach, gdzie krzywe równowagi AgBr(osad)
↔
Ag
+
+ Br
-
i AgCl(osad)
↔
Ag
+
+ Cl
-
przebiegaj
ą
powy
ż
ej linii Ag
+
).
LITERATURA
1. J. Minczewski, Z. Marczenko, „Chemia analityczna. I. Podstawy teoretyczne i analiza jako
ś
ciowa”,
Wydanie 7, PWN, Warszawa, 1998.

10
2. T. Lipiec, Z. Szmal, “Chemia analityczna z podstawami analizy instrumentalnej”, PZWL, 1980 i pó
ź
-
niejsze.
3. A. Jabło
ń
ski, T. Palewski, L. Pawlak, W. Walkowiak, B. Wróbel, B. Ziółek i W.
ś
yrnicki, „Obliczenia
w chemii nieorganicznej”, Oficyna Wydawnicza Politechniki Wrocławskiej, Wrocław 1997, 1998,
2002.
Pytania kontrolne:
1. Jaka minimalna obj
ę
to
ść
wody jest potrzebna do rozpuszczenia w temperaturze pokojowej 0,279 g
(1,0·10
-3
mola) PbCl
2
? (Ir=1,6·10
-5
)
2. Do 50,0 cm
3
0,010 M Ca(NO
3
)
2
dodano 5,0 cm
3
1,0·10
-3
M NaF. Czy wytr
ą
ci si
ę
osad
CaF
2
? (Ir=4,0·10
-11
)
3. Czy z 10 cm
3
roztworu nasyconego wzgl
ę
dem AgCl mo
ż
na wytr
ą
ci
ć
osad AgBr przez dodanie 0,119
mg KBr ? (Ir
AgCl
=1,8·10
-10
Ir
AgBr
=5,2·10
-13
)
4. Jakie powinno by
ć
minimalne st
ęż
enie jonów I
-
aby wytr
ą
ci
ć
osad PbI
2
(Ir=7,1·10
-9
) z nasyconego roz-
tworu PbCl
2
? (Ir=1,6·10
-5
).
5. Który z osadów jest trudniej rozpuszczalny: Ag
3
AsO
4
(Ir=1,0·10
-22
), czy AgCl?
(Ir=1,8·10
-10
)
6. Jak
ą
mas
ę
siarczku bizmutu(III) (Ir=1,0·10
-97
) mo
ż
na rozpu
ś
ci
ć
w 1,0 m
3
wody (pomijaj
ą
c hydroliz
ę
jonów Bi
3+
i S
2-
)?
7. Jak
ą
mas
ę
chlorku sodu nale
ż
y doda
ć
do 100 cm
3
0,10 M Pb(NO
3
)
2
,aby pojawił si
ę
osad chlorku oło-
wiu(II)? (Ir=1,6·10
-5
)
8. Na czym polega ró
ż
nica pomi
ę
dzy roztworem przesyconym i roztworem nasyconym?
9. Czy dodanie rozcie
ń
czonego roztworu HCl (c=0,010 mol/dm
3
) do roztworu pozostaj
ą
cego w równowa-
dze z osadem PbCl
2
spowoduje wzrost czy spadek rozpuszczalno
ś
ci?
10. Jaki wpływ na rozpuszczalno
ść
osadu chromianu(VI) srebra(I) b
ę
dzie miał niewielki dodatek roztworu
HCl (poda
ć
równania reakcji)?
11. Jaki wpływ na rozpuszczalno
ść
osadu chlorku ołowiu(II) b
ę
dzie miał dodatek st
ęż
onego HCl (poda
ć
równania reakcji)?
12. Wyja
ś
ni
ć
za pomoc
ą
równa
ń
reakcji chemicznych wpływ hydrolizy na rozpuszczalno
ść
chromianu(VI)
ołowiu(II).
13. Wyja
ś
ni
ć
za pomoc
ą
równa
ń
reakcji chemicznych wpływ hydrolizy na rozpuszczalno
ść
ortofosfora-
nu(V) srebra(I).
14. Wyja
ś
ni
ć
za pomoc
ą
równa
ń
reakcji chemicznych wpływ obecno
ś
ci buforu octanowego (pH=4,75) na
rozpuszczalno
ść
chromianów(VI) baru(II) i strontu(II).
15. Wyja
ś
ni
ć
za pomoc
ą
równa
ń
reakcji chemicznych wpływ dodatku rozcie
ń
czonego kwasu azotowego(V)
na rozpuszczalno
ść
ortofosforanu(V) srebra(I).
16. Wyja
ś
ni
ć
za pomoc
ą
równa
ń
reakcji chemicznych wpływ dodatku rozcie
ń
czonego kwasu azotowego(V)
na rozpuszczalno
ść
w
ę
glanu srebra(I).
17. Wyja
ś
ni
ć
za pomoc
ą
równa
ń
reakcji chemicznych wpływ dodatku st
ęż
onego roztworu amoniaku,na
rozpuszczalno
ść
chlorku srebra(I).
18. Wyja
ś
ni
ć
za pomoc
ą
równa
ń
reakcji chemicznych wpływ dodatku rozcie
ń
czonego kwasu solnego na
rozpuszczalno
ść
szczawianu wapnia(II).
19. Wyja
ś
ni
ć
za pomoc
ą
równa
ń
reakcji chemicznych wpływ dodatku rozcie
ń
czonego kwasu azotowego(V)
na rozpuszczalno
ść
chromianu(VI) srebra(I).
20.
Do roztworu 0,010 M wzgl
ę
dem jonów Ag
+
i jonów Ba
2+
dodawano po kropli 1,0 M K
2
CrO
4
. Który z
osadów, Ag
2
CrO
4
(Ir=1,3·10
-12
), czy BaCrO
4
(Ir=1,2·10
-10
) zacznie wytr
ą
ca
ć
si
ę
jako pierwszy?

11
WYKONANIE DO
Ś
WIADCZE
Ń
Substancje trudno rozpuszczalne I
Do
ś
wiadczenie 1. Kolejno
ść
wytr
ą
cania osadów
Odczynniki: 0,10 M chlorek sodu (NaCl); 0,10 M azotan srebra (AgNO
3
); 0,25 M chromian
potasu (K
2
CrO
4
)
Do probówki odmierzy
ć
1 cm
3
0,10 M roztworu NaCl, a nast
ę
pnie doda
ć
1 (dokładnie)
kropl
ę
0,25 M roztworu chromianu(VI) potasu. Wymiesza
ć
zawarto
ść
probówki i dodawa
ć
po kro-
pli 0,10 M roztwór AgNO
3
, mieszaj
ą
c roztwór w probówce po dodaniu ka
ż
dej porcji roztworu azo-
tanu(V) srebra(I). Osad chlorku srebra jest biały, za
ś
osad chromianu(VI) srebra – czerwono-
brunatny. Na podstawie zaobserwowanej kolejno
ś
ci wytr
ą
cania osadów okre
ś
li
ć
:
•
dla którego z osadów iloczyn rozpuszczalno
ś
ci został przekroczony jako pierwszy,
•
st
ęż
enie jonów chlorkowych w roztworze po dodaniu stechiometrycznej ilo
ś
ci roztworu
AgNO
3
(AgCl: Ir=1,8·10
-10
; Ag
2
CrO
4
: Ir=1,3·10
-12
).
•
Napisa
ć
reakcje wytr
ą
cania osadów chlorku srebra(I) i chromianu(VI) srebra(I) (zapis jono-
wy).
•
Obliczy
ć
st
ęż
enie jonów chromianowych(VI) konieczne do wytr
ą
cenia osadu chromianu(VI)
srebra(I) w chwili, gdy do roztworu chlorku sodu dodano stechiometryczn
ą
(wzgl
ę
dem po-
cz
ą
tkowej liczno
ś
ci NaCl) liczno
ść
azotanu(V) srebra(I).
Do
ś
wiadczenie 2. Wpływ st
ęż
enia jonów S
2-
na wytr
ą
canie siarczków metali
Odczynniki: 0,10 M siarczan miedzi(II) (CuSO
4
); 0,10 M siarczan manganu(II) (MnSO
4
); 2,0 M
kwas solny (HCl); 6,0 M wodny roztwór amoniaku (NH
3
.H
2
O); 3,0 M chlorek
amonu (NH
4
Cl); 0,50 M roztwór amidu kwasu tiooctowego (CH
3
CSNH
2
, AKT),
uniwersalne papierki wska
ź
nikowe.
Do probówki zawieraj
ą
cej 2 cm
3
wody odmierzy
ć
po 10 kropli 0,10 M roztworów siarcza-
nu(VI) miedzi(II) i siarczanu(VI) manganu(II) a nast
ę
pnie doda
ć
2 krople 2,0 M HCl oraz 10 kropli
0,50 M AKT. Probówk
ę
umie
ś
ci
ć
we wrz
ą
cej ła
ź
ni wodnej (pod wyci
ą
giem !) na 15 minut.
•
Zaobserwowa
ć
barw
ę
i posta
ć
wydzielonego osadu (siarczek miedzi(II) ma barw
ę
czarn
ą
,
podczas gdy siarczek manganu(II) – cielist
ą
).
Roztwór wraz z osadem przenie
ść
do probówki konicznej i odwirowa
ć
(2 minuty, 2000 ob-
r/min). Roztwór znad osadu przenie
ść
do czystej probówki, doda
ć
5 kropli 3,0 M NH
4
Cl i tyle 6,0
M NH
3
.H
2
O, aby roztwór był wyra
ź
nie zasadowy wobec papierka wska
ź
nikowego. Probówk
ę
z
roztworem umie
ś
ci
ć
we wrz
ą
cej ła
ź
ni wodnej (pod wyci
ą
giem!) na 5 minut.
•
Zaobserwowa
ć
barw
ę
i posta
ć
wydzielonego osadu.
•
Okre
ś
li
ć
minimalne pH konieczne do wytr
ą
cenia osadu MnS przy zało
ż
eniu,
ż
e całkowite
st
ęż
enie siarkowodoru w roztworze wynosi 0,10 mol/dm
3
a st
ęż
enia jonów Mn
2+
jest równe

12
0,010
mol/dm
3
.
(Stałe
dysocjacji
H
2
S:
pK
a1
=6,98
pK
a2
=12,60;
Ir
CuS
=6,3·10
-36
Ir
MnS
=2,5·10
-10
).
Reakcja rozkładu amidu kwasu tiooctowego:
CH
3
CSNH
2
+ 2 H
2
O =H
2
S + CH
3
COO
-
+ NH
4
+
Substancje trudno rozpuszczalne II
Do
ś
wiadczenie 3. Przekształcenie trudno rozpuszczalnych soli w sole jeszcze trudniej
rozpuszczalne
Odczynniki: stały wodorow
ę
glan sodu (NaHCO
3
); stały octan sodu (CH
3
COONa); 0,50 M
azotan ołowiu (Pb(NO
3
)
2
); 1,0 M chlorek potasu (KCl); 1,0 M jodek potasu (KI);
6,0 M kwas solny (HCl); 1,0 M chromian potasu (K
2
CrO
4
); 1,0 M wodorotlenek
sodu (NaOH)
a) otrzymywanie chlorku ołowiu(II)
Do zlewki o pojemno
ś
ci około 200 cm
3
wprowadzi
ć
1 cm
3
0,50 M roztworu azotanu oło-
wiu(II) oraz 10 cm
3
wody destylowanej. Do klarownego roztworu doda
ć
przy ci
ą
głym mieszaniu 3
cm
3
1,0 M roztworu chlorku potasu. Po kilku minutach powinien wytr
ą
ci
ć
si
ę
biały osad chlorku
ołowiu(II). Obliczy
ć
st
ęż
enie jonów Pb
2+
w otrzymanym roztworze pomijaj
ą
c hydroliz
ę
jonów oło-
wiu(II) oraz tworzenie zwi
ą
zków kompleksowych (PbCl
2
: Ir = 1,62·10
-5
). Zlewk
ę
z wydzielonym
PbCl
2
ogrzewa
ć
do rozpuszczenia si
ę
osadu i otrzymania bezbarwnego roztworu. Do dwóch
oznaczonych probówek (1) i (2) przenie
ść
po 3 cm
3
otrzymanego roztworu i ochłodzi
ć
. Zanotowa
ć
obserwacje. Roztwór znad wydzielonego w probówce (2) osadu zla
ć
, a do osadu dodawa
ć
kro-
plami 6,0 M HCl. Po roztworzeniu si
ę
osadu roztwór ponownie rozcie
ń
czy
ć
wod
ą
destylowan
ą
.
Napisa
ć
zachodz
ą
ce reakcje.
PbCl
2
jest rozpuszczalny w gor
ą
cej wodzie (33,4 g/dm
3
w temp. 100
o
C; 9,9 g/dm
3
w temp. 20
o
C). PbCl
2
jest tak
ż
e rozpuszczalny w st
ęż
onym HCl, wskutek tworzenia si
ę
jonów kompleksowych:
PbCl
2
+ Cl
-
= PbCl
3
-
PbCl
3
-
+ Cl
-
= PbCl
4
2-
Rozcie
ń
czaj
ą
c roztwór zawieraj
ą
cy jony kompleksowe, powoduje si
ę
ponowne wytr
ą
cenie PbCl
2
.
b) Otrzymywanie jodku ołowiu
Do pozostałej cz
ęś
ci roztworu w zlewce doda
ć
2 cm
3
1,0 M roztworu jodku potasu. Jony I
-
wytr
ą
caj
ą
ż
ółty osad jodku ołowiu(II), trudniej rozpuszczalny ani
ż
eli PbCl
2
. Do wydzielonego osa-
du doda
ć
ok. 100 cm
3
wody destylowanej i podgrzewa
ć
do rozpuszczenia si
ę
osadu. Gor
ą
cy roz-
twór przenie
ść
do trzech probówek. Do probówek (3) i (4) wprowadzi
ć
po 3 cm
3
, a do probówki (5)
- l cm
3
roztworu jodku ołowiu. Do probówki (3) doda
ć
około 0,4 g octanu sodu (dwie małe szpa-
chelki). Zawarto
ść
probówki (4) kilkakrotnie ogrzewa
ć
i ozi
ę
bia
ć
. Roztwór w probówce (5) po
ozi
ę
bieniu zla
ć
znad wydzielonego osadu, a do osadu doda
ć
1,0 M KI w nadmiarze. Zanotowa
ć
obserwacje i opisa
ć
powy
ż
sze procesy za pomoc
ą
reakcji chemicznych.

13
c) Otrzymywanie w
ę
glanu ołowiu
Do zlewki z roztworem jodku ołowiu po ochłodzeniu do temperatury ok. 50-60
o
C doda
ć
0,2
g wodorow
ę
glanu sodu rozpuszczonego w 15 cm
3
wody. Obserwowa
ć
zmiany barwy roztworu i
osadu. Zapisa
ć
równania zachodz
ą
cych reakcji. Zamiesza
ć
zawarto
ść
zlewki i przenie
ść
3 cm
3
otrzymanej zawiesiny do probówki (6).
d) Otrzymywanie chromianu ołowiu
Do zlewki z otrzymanym w
ę
glanem ołowiu doda
ć
energicznie mieszaj
ą
c 2 cm
3
1,0 M roz-
tworu chromianu potasu. Obserwowa
ć
zmian
ę
barwy osadu. 3 cm
3
tej mieszaniny przenie
ść
do
probówki (7). Do zlewki dodawa
ć
(przy ci
ą
głym mieszaniu) kroplami 2 cm
3
1,0 M roztworu wodo-
rotlenku sodu, tak aby mo
ż
na było zauwa
ż
y
ć
stopniow
ą
zmian
ę
barwy. Delikatne ogrzewanie roz-
tworu ułatwia tworzenie hydroksochromianu ołowiu. 3 cm
3
zawiesiny chromianu(VI) diwodorotlen-
ku diołowiu(II) umie
ś
ci
ć
w probówce (8). Zanotowa
ć
obserwacje i zapisa
ć
reakcje.
Obserwacje z do
ś
wiadcze
ń
5a – 5d przedstawi
ć
syntetycznie w postaci tabeli, porównuj
ą
c:
barwy, postaci i obliczone na podstawie iloczynów rozpuszczalno
ś
ci [3] rozpuszczalno
ś
ci bada-
nych zwi
ą
zków ołowiu(II) (PbCl
2
, PbI
2
, PbCO
3
, PbCrO
4
).
Wyszukiwarka
Podobne podstrony:
10 Substancje trudno rozpuszczalne sprawozdanie
12 - substancje trudno rozpuszczalne, sprawozdanie
12 substancje trudno rozpuszczalne sprawozdanieid 13334
11 substancje trudno rozpuszczalne sprawozdanie
1996 10 26 praid 18571 Nieznany
10 Poslugiwanie sie dokumentacj Nieznany
Cwiczenia nr 10 (z 14) id 98678 Nieznany
2008 10 06 praid 26459 Nieznany
10 zaburzenia organiczneid 1121 Nieznany
10 Sprawdzenie Konstrukcji Ze W Nieznany (2)
mat bud cwicz 10 11 id 282450 Nieznany
Cw 5 10 Analiza tolerancji i od Nieznany
10 1 1 83 2318id 10401 Nieznany
10 Sporzadzanie i ekspedycja wy Nieznany (2)
analiza swot (10 stron) id 6157 Nieznany
więcej podobnych podstron