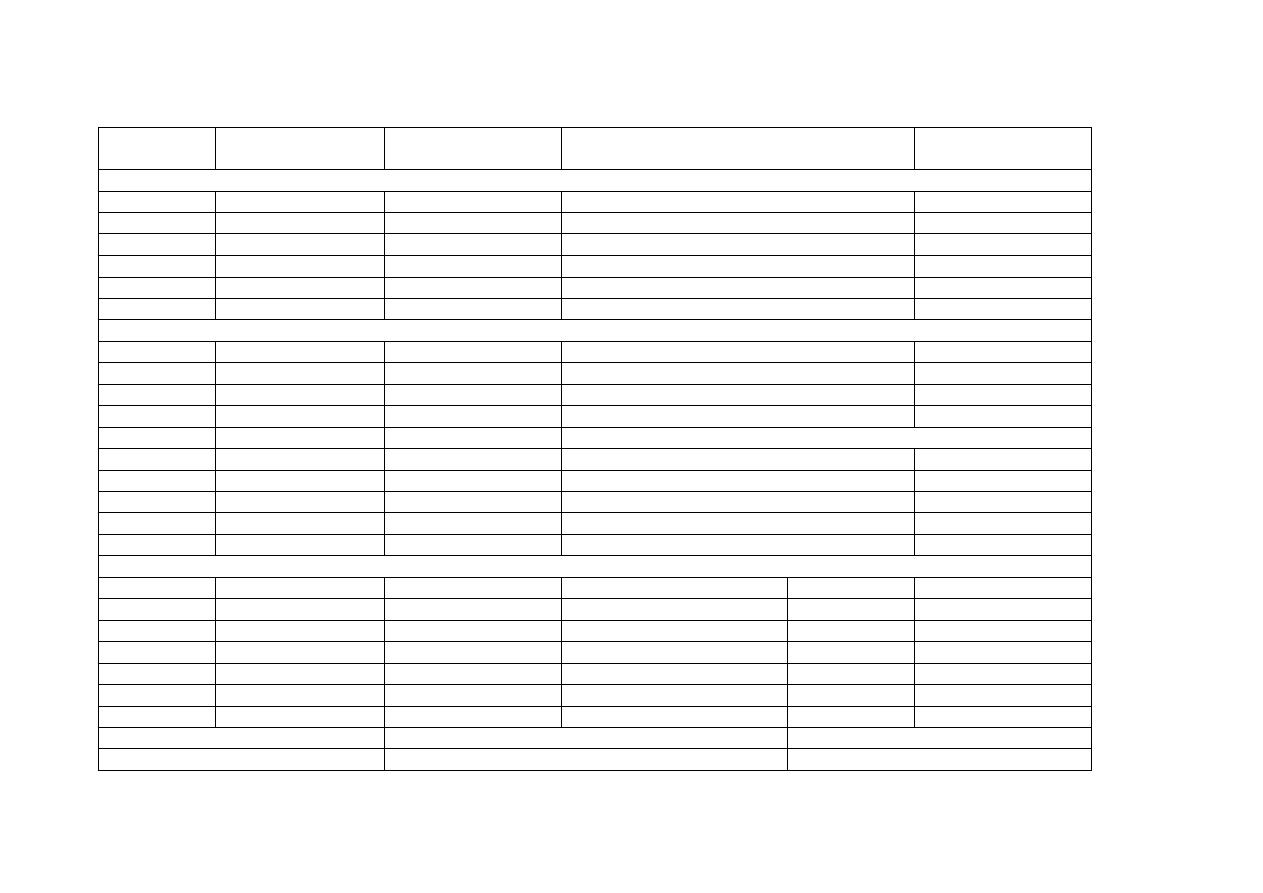
Cz . VIII Kwasy i sole
Bezwodnik
kwasowy
Wzór cząsteczkowy
kwasu
Nazwa systematyczna
kwasu
Otrzymywanie kwasu / reszty kwasowe
(R)
Nazwa systematyczna
soli
Kwasy beztlenowe
HF
(g lub c)
HF
(aq)
Kwas fluorowodorowy
HF + H
2
O → H
3
O
+
+ F
-
/ F
-
fluorek
HCl(g)
HCl
(aq)
Kwas chlorowodorowy
HCl + H
2
O → H
3
O
+
+ Cl
-
/ Cl
-
chlorek
HBr
(g)
HBr
(aq)
Kwas bromowodorowy
HBr+ H
2
O → H
3
O
+
+ Br
-
/ Br
-
bromek
HI
(g)
HI
(aq)
Kwas jodowodorowy
HI + H
2
O → H
3
O
+
+ I
-
/ I
-
jodek
HCN
(g lub c)
HCN
(aq)
Kwas cyjanowodorowy
HCN + H
2
O → H
3
O
+
+CN
-
/ CN
-
cyjanek
H
2
S
(g)
H
2
S
(aq)
Kwas siarkowodorowy
H
2
S+ 2H
2
O → 2H
3
O
+
+ S
2 -
/ S
2 -
siarczek
Kwasy tlenowe
CO
2(g)
H
2
CO
3(c)
Kwas węglowy(IV)
CO
2(g)
+ H
2
O→ H
2
CO
3(c)
/ CO
3
2 -
Węglan(IV)
SO
2(g)
H
2
SO
3(c)
Kwas siarkowy(IV)
SO
2(g)
+ H
2
O→
H
2
SO
3(c)
/ SO
3
2 -
Siarczan(IV)
SO
3(s)
H
2
SO
4(c)
Kwas siarkowy(VI)
SO
3(s)
+ H
2
O→ H
2
SO
4(c)
/ SO
4
2 -
Siarczan(VI)
SO
3(s)
H
2
S
2
O
7(c)
Kwas pirosiarkowy(VI)
SO
3(s)
+ H
2
SO
4
→ H
2
S
2
O
7(c)
/ S
2
O
7
2 -
Pirosiarczan(VI)
NO
2(g)
(N
2
O
4
) HNO
2(c)
+ HNO
3(c)
Kwas azotowy(III) i (V)
2NO
2(g)
+ H
2
O→ HNO
2(c)
+ HNO
3(c)
/ NO
2
–
i NO
3
-
N
2
O
3(g)
HNO
2(c)
Kwas azotowy(III)
N
2
O
3(g)
+ H
2
O→ 2HNO
2(c)
/ NO
2
-
Azotan(III)
N
2
O
5(c)
HNO
3(c)
Kwas azotowy(V)
N
2
O
5(c)
+ H
2
O→ 2HNO
3(c)
/ NO
3
-
Azotan(V)
P
2
O
5(s)
(P
4
O
10
) HPO
3(c)
Kwas metafosforowy(V)
P
2
O
5(s)
+ H
2
O→ 2HPO
3(c)
/ PO
3
-
Metafosforan(V)
P
2
O
5(s)
H
3
PO
4(c)
Kwas ortofosforowy(V)
P
2
O
5(s)
+ 3H
2
O→ 2H
3
PO
4(c)
/ PO
4
3 -
Ortofosforan(V)
P
2
O
5(s)
H
4
P
2
O
7(c)
Kwas pirofosforowy(V)
P
2
O
5(s)
+ 2H
2
O→ H
4
P
2
O
7(c)
/ P
2
O
7
4 -
Pirofosforan(V)
Pozostałe kwasy tlenowe otrzymywane metodami pośrednimi lub których reszty występują tylko w solach
HClO
(c)
Kwas chlorowy(I)
Cl
2
+ H
2
O
→
HCl + HClO
ClO
-
Chloran(I)
HClO
2(c)
Kwas chlorowy(III)
2ClO
2
+ 2H
2
O → HClO
2
+ HClO
3
ClO
2
-
Chloran(III)
HClO
3(c)
Kwas chlorowy(V)
2ClO
2
+ 2H
2
O → HClO
2
+ HClO
3
ClO
3
-
Chloran(V)
HClO
4(c)
Kwas chlorowy(VII)
ClO
4
-
Chloran(VII)
H
2
SiO
3(s)
Kwas metakrzemowy(IV)
SiO
2
2 -
Metakrzemian(IV)
H
4
SiO
4(s)
Kwas ortokrzemowy(IV)
SiO
4
4 -
Ortokrzemian(IV)
HOCN
(c)
Kwas cyjanowy
OCN
-
cyjanian
Dysocjacja jonowa kwasów
Ogólny wzór dysocjacji
H
n
R + nH
2
O ↔ nH
3
O
+
+ R
n -
Przykłady
H
2
SO
4
+ 2H
2
O ↔ 2H
3
O
+
+ SO
4
2 -
H
3
PO
4
+ 3H
2
O ↔ 3H
3
O
+
+ PO
4
3 -

Sole -cd. – Wzór ogólny Me
n
R
m
( jeżeli n = m lub przybierają wartość równą 1 to indeksów n i m nie zapisuje się), gdzie Me – kation metalu,
wyjątek kation amonowy NH
4
+
, R – reszta kwasowa. Dysocjacja jonowa Me
n
R
m
↔ nMe
m+
+ mR
n-
Klasyfikacja soli ze względu na ich budowę – skład chemiczny
Sole obojętne
proste
Ag
2
SO
4
↔ 2Ag
+
+ SO
4
2-
, tylko 1 r-j kationów (Ag
+
) i 1 r-j anionów (SO
4
2-
)
podwójne
KNa SO
4
↔ K
+
+ Na
+
+ SO
4
2-
, 2 r-je kationów (K
+
i Na
+
oraz 1 r-j anionu (SO
4
2-
)
Pb
2
Cl
2
CO
3
↔ Pb
4+
+ 2Cl
-
+ CO
3
2-
, 1 r-j kationu (Pb
4+
) i 2 r-je anionów (Cl
-
i CO
3
2-
)
hydraty
CuSO
4
.
5H
2
O ↔ Cu
2+
+ SO
4
2-
+ 5H
2
O, dysocjując odszczepiają cząsteczki wody
Sole kwaśne
wodorosole
NaHCO
3
↔ Na
+
+ H
+
+ CO
3
2 -
, dysocjując dodatkowo odszczepiają kation(y) H
+
Sole zasadowe
hydroksosole
CaOHNO
3
↔ Ca
2+
+ OH
-
+ NO
3
-
, dysocjując dodatkowo odszczepiają anion(y) OH
-
Metody otrzymywania soli
zasada + kwas = sól + woda, nMe(OH)
m
+ mH
n
R → Me
n
R
m
+ n
.
mH
2
O (n≠m),
jeżeli n = m, to Me(OH)
m
+ H
n
R → MeR+ n
.
H
2
O,
jeżeli n≠m i są liczbami parzystymi ≥2,
to stosuje się zasadę najmniejszej wielokrotności
2Fe(OH)
3
+ 3H
2
SO
4
→ Fe
2
(SO
4
)
3
+ 6H
2
O, (n=2, m=3)
Fe(OH)
3
+ H
3
PO
4
→ FePO
4
+ 3H
2
O, (n=m=3)
Pb(OH)
4
+ H
2
SO
4
→ Pb(SO
4
)
2
(
naj. wielokr.= 4, 4:1=1, 4:2=2
tlenek zasadowy + kwas = sól + woda, Me
(n=2)
O
m
+ mH
n
R →Me
n
R
m
+ 1/2m
.
nH
2
O,
pozostały reguły jak w poprzedniej metodzie
CaO + 2HCl → CaCl
2
+ H
2
O
Al
2
O
3
+ 3H
2
SO
4
→ Al
2
(SO
4
)
3
+ 3H
2
O
aktywny metal + kwas = sól + wodór, nMe + mHnR → Me
n
R
m
+ 1/2n
.
mH
2
,
(metale znajdujące się przed wodorem w szeregu aktywności), pozostałe reguły jw.
Zn + H
2
S → ZnS + H
2
2Al. + 3H
2
SO
4
→ Al
2
(SO
4
)
3
+ 3H
2
tlenek kwasowy (bezwodnik kwasowy) + tlenek zasadowy = sól kwasu tlenowego,
mEO + nMe
(n=2)
O
m
→ Me
n
R
m
(pozostałe reguły jw.)
P
2
O
5
+ 3MgO
→ Mg
3
(PO
4
)
2
SO
3
+ K
2
O → K
2
SO
4
tlenek kwasowy (bezwodnik kwasowy) + zasada = sól kwasu tlenowego + woda,
mEO + nMe(OH)m → MenRm + mH
2
O, pozostałe reguły jw.
P
2
O
5
+ 3Ca(OH)
2
→ Ca
3
(PO
4
)
2
+ 3H
2
O
SO
2
+ 2NaOH → Na
2
SO
4
+ H
2
O
synteza z pierwiastków – metal + aktywny niemetal (fluorowce, siarka) = sól
kwasu beztlenowego ,nMe + mE → Me
n
R
m ,
pozostałe reguły jw.
2Ag + S → Ag
2
S
2Fe + 3Br
2
→ 2FeBr
3
sól I + sól II = sól III + sól IV,
1
Me
n
1
R
m
+
2
Me
n
2
R
m
→
1
Me
n
2
R
n
+
2
Me
n
1
R
n
,
warunki konieczne – sole I i II rozpuszczalne w wodzie, jedna z soli III lub IV musi
być praktycznie nie rozpuszczalna w wodzie
CaCl
2
+ Na
2
SO
4
→ 2Na
+
+2Cl
-
+ CaSO
4
↓
AgNO
3
+ NaCl → Na
+
+ NO
3
-
+ AgCl↓
2KI + Pb(NO
3
)
2
→ 2K
+
+ 2NO
3
-
+ PbI
2
↓
sól kwasu słabego + mocny kwas = sól kwasu mocnego + kwas słaby,
Me
n
1
R
m
+ mH
n
2
R → Me
n
2
R
m
+ mH
n
1
R
CaCO
3
+ 2HCl → Ca
2+
+2Cl
-
+ H
2
CO
3
Na
2
SiO
3
+ 2HBr → 2Na+ + 2Br
-
+ H
2
SiO
3
Właściwości soli
- hydroliza
Kationowa – sole rozpuszcz. w wodzie:
mocnych kwasów i słabych zasad
Anionowa – sole rozpuszcz. w wodzie: mocnych zasad i słabych
kwasów
- rozkład
termiczny
→
tlenek kwasowy + tl. metalu
fotochemiczny
→
metal + niemetal
Wyszukiwarka
Podobne podstrony:
CHEMIA KOSMETYCZNA Chemia nieorganiczna (tlenki, kwasy, sole
19311-tlenki i kwasy sole i wodorotlenki, chemia
chemia kwasy sole ściąga
sprawdzian kwasy-wodorotlenki zestaw 2
kwasy sole tlenki wodorotlenki, Budownictwo semestr 1
kwasy i sole
kwasy i sole przykładowe zadania
Kwasy i sole
sprawdzian kwasy-wodorotlenki zestaw 1
Wodorotlenki, Kwasy i Sole
Kwasy i Sole
chemia- kwasy i sole, Inżynieria środowiska ZUT, Chemia
zadania tlenki kwasy sole
CHEMIA KOSMETYCZNA Chemia nieorganiczna (tlenki, kwasy, sole
kwasy i sole
więcej podobnych podstron