ELEMENTY FIZYKI KWANTOWEJ I JĄDROWEJ
101. Ciało doskonale czarne (rozkład Plancka)
Ciałami doskonale czarnyminazywamy ciała, których powierzchnie absorbują całe
promieniowanie, jakie na nie pada (nie odbijają światła).
W praktyce ciała doskonale czarne realizuje się robiąc pudło z bardzo małym otworkiem i
wnętrze tego pudła pokrywa się sadzą (sadza ma bardzo dobre własności pochłaniania
promieniowania). Wówczas promieniowanie wpadające w ten otworek odbija się
wielokrotnie od powierzchni wewnętrznej pudła, a ponieważ ma ona bardzo mały
współczynnik odbicia, więc po kilkunastu odbiciach promieniowanie zostaje
zaabsorbowane przez pudło. Następnie obserwuje się otwór i mierzy rozkład widmowy
promieniowania, który jest jednakowy dla wszystkich ciał doskonale czarnych.
Całkowitą energię wysyłanego promieniowania w całym zakresie długości fal możemy
obliczyć sumując emisję dla wszystkich długości fal (calkując R
λ
po wszyskich długościach
fal). Wielkość tą nazywamy całkowitą emisją energetyczną promieniowania R:
Emisja energetyczna promieniowania ciała doskonale czarnego zmienia się wraz z
temperaturą według prawa Stefana-Boltzmanna:
gdzie = 5,67,10
-8
W/m
2
K
4
jest stałą Stefana – Boltzmanna.
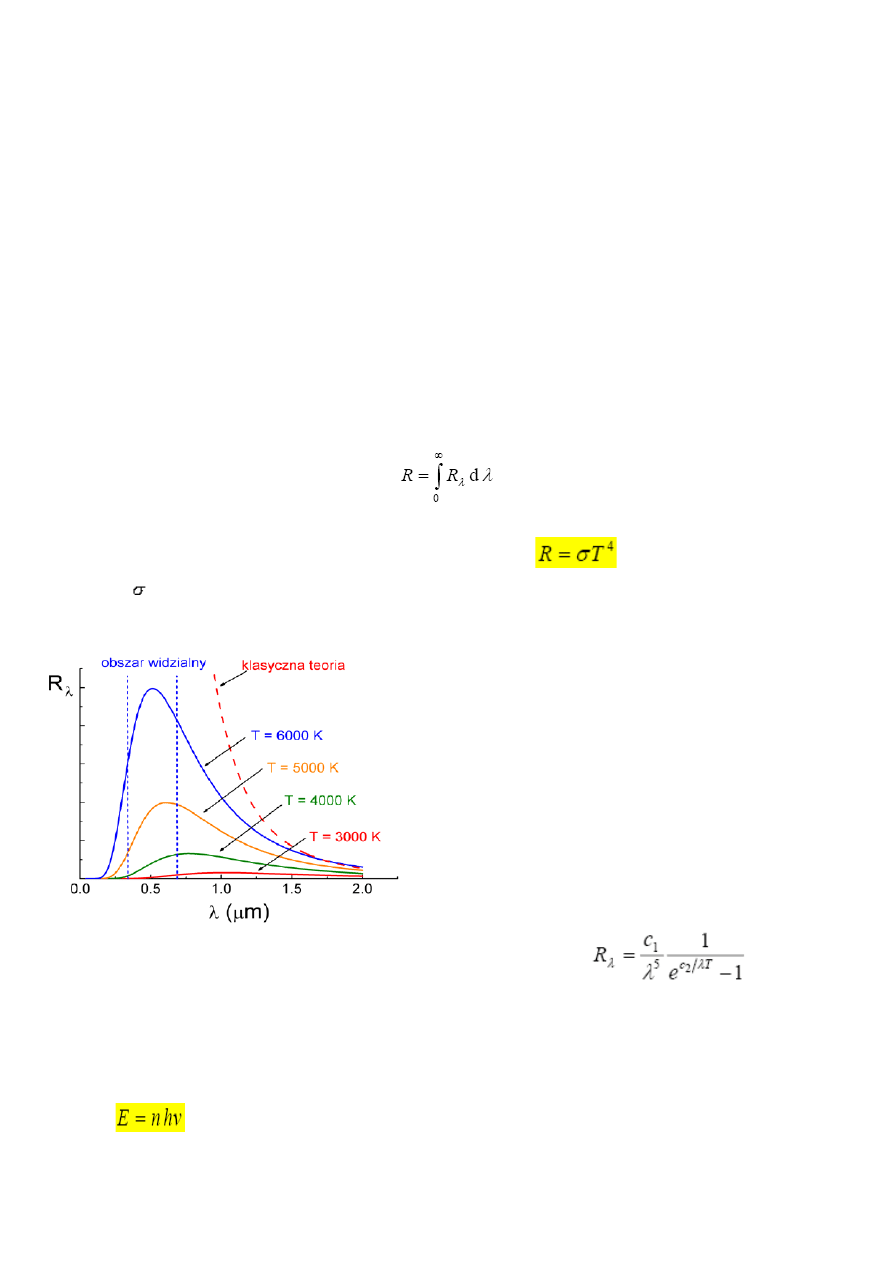
Zdolność emisyjna promieniowania dla ciała doskonale czarnego zmienia się z temperaturą
tak jak na rysunku:
Pokazane krzywe są zależa tylko od temperatury i
są całkowicie niezależne od materiału, kryształu i
wielkości.
Długość fali dla której przypada maksimum emisji
jest zgodnie z prawem Wiena odwrotnie
proporcjonalna do temperatury ciała.
Teoria klasyczna- widmowa zdolność emisyjna
wyliczona w oparciu o obliczoną wartość średniej
energii z prawa ekwipartycji energii. Sprzeczny z
rzeczywistością wynik rozważań klasycznych
nazywany jest „katastrofą w nadfiolecie”.
Teoria Plancka promieniowania we wnęce
Wzór Plancka dający wynik widmowej zdolnosci emisyjnej :
c
1
i c
2
- stałe wyznaczane doświadczalnie
Planck stwierdził, że w przypadku promieniowania ciała doskonale czarnego średnia
energia fal stojących jest funkcją częstotliwości. Założył on, że każdy atom zachowuje się
jak oscylator elektromagnetyczny posiadający charakterystyczną częstotliwość drgań.
Oscylatory te, wg Plancka, nie mogą mieć dowolnej energii, ale tylko ściśle określone
wartości dane wzorem:
h=6,63
.
10
-34
Js (stała Plancka), n- liczba kwantowania.
Oscylator wypromieniowuje energię kwantami (nie w sposób ciągły). Kwanty są emitowane
gdy oscylator przechodzi ze stanu o danej energii do drugiego o mniejszej energii.
Odpowiada to zmianie liczby kwantowej n o jedność, a w konsekwencji wypromieniowana
zostale eneria w ilości:
Oznacza to, że dopóki oscylator pozostaje w jedym ze swoich stanów kwantowych dopóty
ani nie emituje ani nie absorbuje energii. Mówimy, że znajduje się w stanie stacjonarnym.
102. Efekt fotoelektryczny, efekt Comptona, zjawisko kreacji par cząstek
Zjawisko uwalniania przez światło elektronów z powierzchni rozmaitych substancji
nazwane jest zjawiskiem fotoelektrycznym.
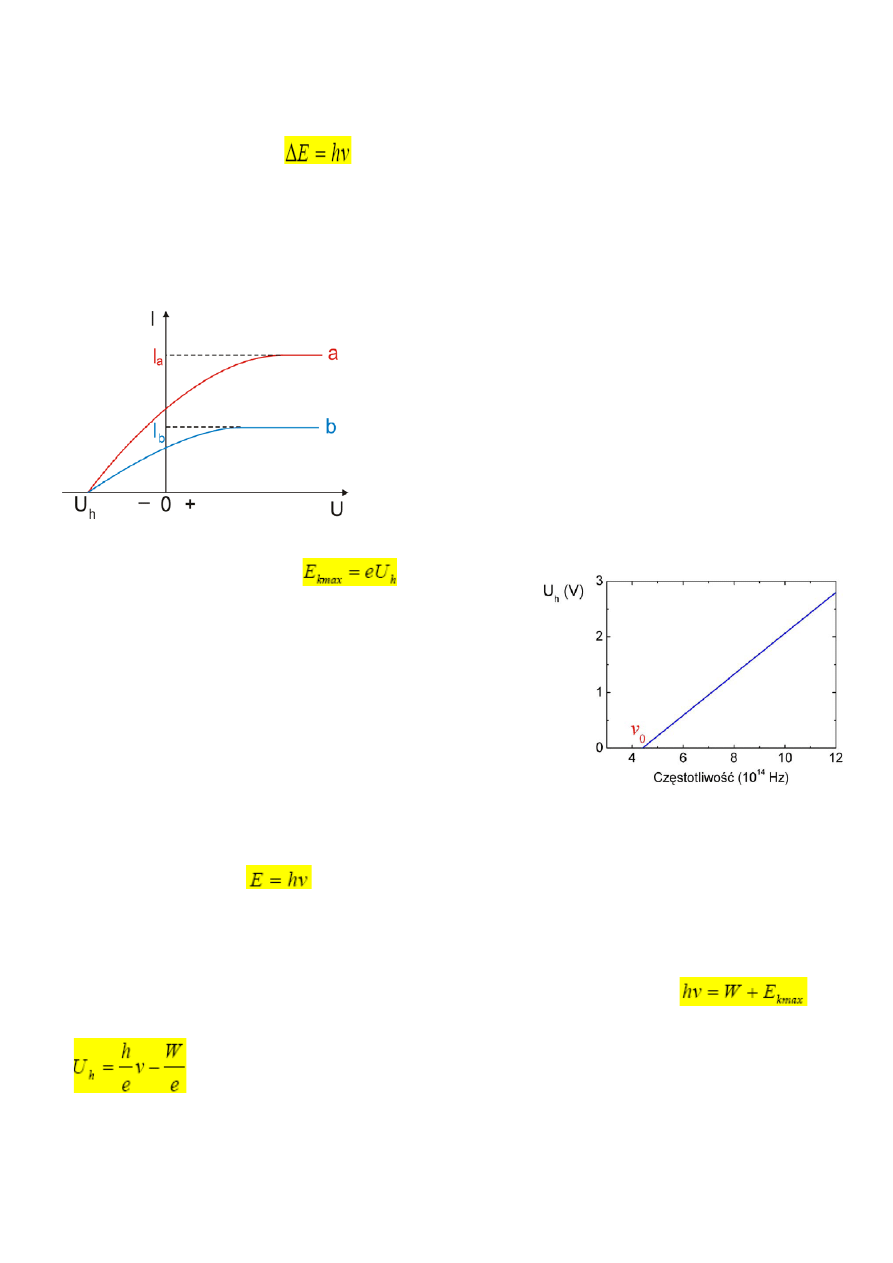
Jeśli wytworzymy pewną różnicę potencjałów pomiędzy
płytką A, z której uwalniane są elektrony, a płytką
zbierającą B, to zaobserwujemy przepływ prądu. Gdy U
jest dostatecznie duże, wtedy prąd fotoelektryczny
osiąga pewną wartość graniczną (prąd nasycenia).
Niektóre z elektronów dochodzą do elektrody B, pomimo
że pole elektryczne działa na ich ruch hamująco.
Jednakże gdy różnica potencjałów U jest dostatecznie
duża, równa wielkości U
h
zwanej napięciem hamującym,
wtedy prąd fotoelektryczny całkowicie zanika. Różnica
potencjałów U
h
pomnożona przez ładunek elektronu jest
miarą energii kinetycznej K
max
najszybszych
uwolnionych elektronów:
Krzywa b odpowiada dwukrotnie mniejszemu natężeniu
światła padającego niż krzywa a. Napięcie hamujące jest
niezależne od natężenia światła, natomiast natężenie
prądów nasycenia I
a
oraz I
b
są wprost proporcjonalne do
natężenia światła.
Zależność napięcia hamowania od częstotliwości światłą
padającego na powierzchnię sodu metalicznego jest
zależnością liniową. Isnieje pewna wartość progowa
częstotliwości v
o
, poniżej której zjawisko fotoelektryczne
nie występuje.
Einstein założył, że energia wiązki świetlnej rozchodzi się w przestrzeni w postaci
skończonych porcji (kwantów) energii zwanych fotonami. Energia pojedynczego fotonu
dana jest wzorem:
Einstein zapostulował, że kwanty światła rozchodzą się w
przestrzeni jak cząstki materii (wg Plancka jako fala elektromagnetyczna), i gdy foton
zderzy się z elektronem w metalu to może zostać przez elektron pochłonięty. Wówczas
energia fotonu zostanie przekazana elektronowi. Do wyrwania elektronu z metalu
potrzebna jest energia W (praca wyjścia). Energia hv fotonu, w części (W)
zostaje zużyta na wyrwanie elektronu z materiału, a ewentualny nadmiar
energii (hv – W) elektron otrzymuje w postaci energii kinetycznej.
Teoria Einsteina przewiduje liniową zależność pomiędzy napięciem
hamowania, a częstotliwoścą. Teoria fotonowa potwierdza fakty związane ze
zjawiskiem fotoelektrycznym, ale jest sprzeczna z teorią falową (dualizm
korpuskularnofalowy)
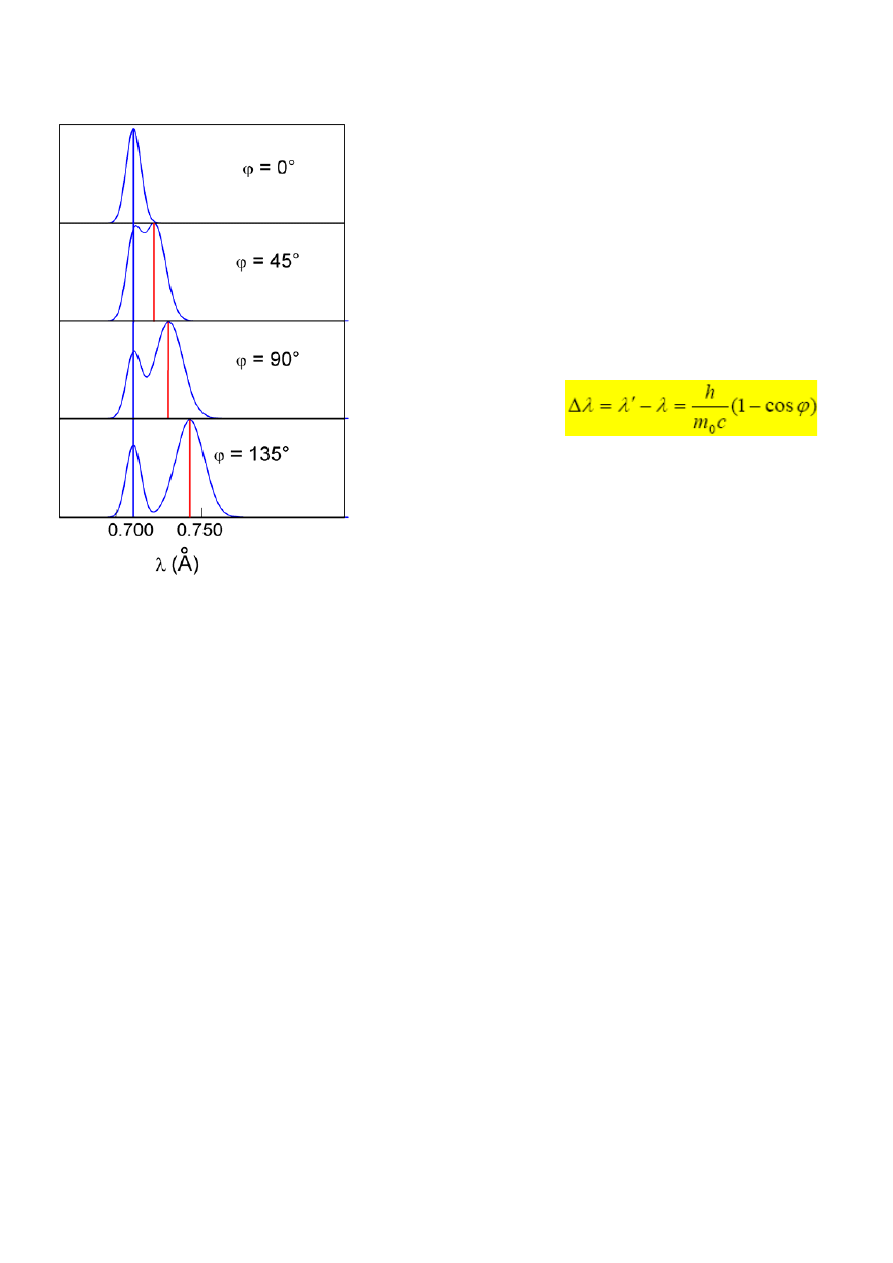
Efekt Comptona to doświadczenie związane z rozpraszaniem fal elektromagnetycznych
na swobodnych elektronach. Compton mieżył natężenie
wiązki rozproszonej pod różnymi kątami φ jako funkcję
długości fali λ. W promieniowaniu rozproszonym
występują dwie długości fal: jedna o długości λ
identycznej jak fala padająca i druga długości λ' większa
o Δλ. Jest to tzw. przesunięcie Comptona ( λ' zmienia
się wraz z kątem). Compton założył, że fotony zderzają
się z elektronami swobodnymi w bloku grafitu. W
wyniku zderzenia zmienia się kierunek poruszania się
fotonu oraz jego energia ( jej część została przekazana
elektronowi). Oznacza to zmianę częstotliwości oraz
długości fali. Stosując zasadę zachowania pędu oraz
zasadę zachowania energii otrzymujemy wyrażenie na
przesunięcie Comptona:
m
o
- masa elektronu
(spoczynkowa)
Przesunięcie Comptona zależy tylko od kąta
rozproszenia. Do obliczania energii kinetycznej
elektronu stosuje się wyrażenie relatywistyczne
ponieważ odrzucone elektrony mogą mieć prędkości
porównywalne z prędkością światła.
Zjawisko kreacji par cząstek- foton o wysokiej energii traci wskutek zderzenia z
jądrem całą swą energię hv i jej kosztem powstaje para cząstek - elektron i pozyton,
mających pewną energię kinetyczną. Pozyton jest cząstką o własnościach identycznych z
własnościami elektronu, z wyjątkiem znaku ładunku elektrycznego (i kierunku momentu
magnetycznego). W procesie tworzenia par energia przekazana jądru ulegającemu
odrzutowi jest zaniedbywalna, ponieważ jądro ma dużą masę. Obie cząstki mają jednakowe
energie spoczynkowe m
0
c
2
. Wyprodukowany pozyton ma nieco większą energię
kinetyczną, ponieważ w wyniku oddziaływania kulombowskiego wytworzonej pary z
dodatnio naładowanym jądrem występuje przyspieszenie pozytonu i hamowanie elektronu
.
Podstawowe prawa, które muszą być spełnione podczas oddziaływania to: prawo
zachowania całkowitej energii relatywistycznej, prawo zachowania pędu oraz prawo
zachowania ładunku. Mówimy, że proces kreacji par przebiega w polu jądra, czyli w polu
oddziaływania z jądrem. Minimalna energia fotonu, zwana inaczej energią progową,
potrzebna do wytworzenia pary cząstek, wynosi 2m
0
c
2
, czyli 1,02MeV, co odpowiada
długości fali 0,012Å. Jeżeli długość fali jest mniejsza, a tym samym energia jest większa od
energii progowej, to wytworzona para cząstek ma oprócz energii spoczynkowej również
pewną energię kinetyczną.
Ze zjawiskiem kreacji par ściśle związany jest proces odwrotny zwany anihilacją par. Polega
on na tym, że gdy spoczywające cząstki - elektron i pozyton - znajdują się blisko siebie,
wtedy łączą się ze sobą i ulegają anihilacji. W rezultacie następuje unicestwienie dwóch
cząstek materialnych, w miejsce których powstaje promieniowanie elektromagnetyczne.
W wyniku występowania zjawiska fotoelektrycznego oraz kreacji par zachodzi całkowita
absorpcja fotonów, natomiast zjawisko Comptona prowadzi do rozpraszania fotonów.
103. Model atomu Bohra (postulaty kwantowania)
Podstawową cechą modelu Bohra jest to, że umożliwia przewidywanie widm
promieniowania wysyłanego przez atomy.
W przeciwieństwie do widma ciągłego emitowanego na przykład przez powierzchnie ciał
ogrzanych do wysokich temperatur, widma promieniowania pierwiastków w postaci gazów
i par pobudzonych do świecenia na przykład za pomocą wyładowania elektrycznego, są
złożone z jasnych, ostrych linii, odpowiadających ściśle określonym długościom fal.
Promieniowanie wysyłane przez swobodne atomy (tzw. widmo emisyjne ) zawiera tylko
pewną liczbę długości fal. Takie widmo nazywamy widmem liniowym , a każdą z takich
składowych długości fal nazywana jest linią widmową.
Obok widm emisyjnych badano również widma absorpcyjne , tym razem obserwując
promieniowanie pochłaniane przez gazy zamiast emitowanego. Doświadczenia pokazują,
że pojedyncze atomy (cząsteczki) zarówno emitują jak i absorbują promieniowanie o ściśle
określonych długościach fali.
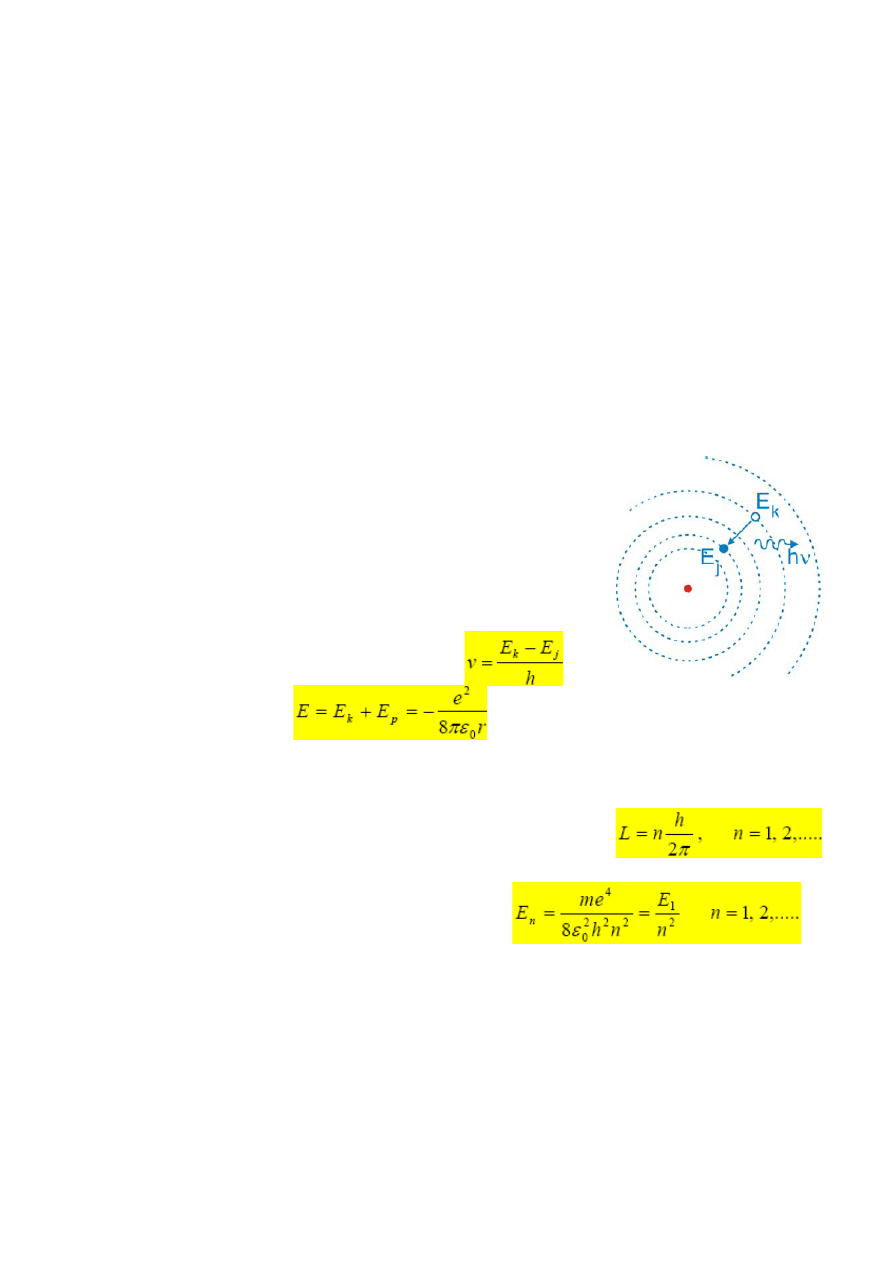
Niels Bohr zaproponował kwantowy model budowy atomu wodoru. Postulaty:
• elektron może poruszać się tylko po pewnych dozwolonych
orbitach.
• podobnie jak oscylatory Plancka, tak samo atom wodoru może
znajdować się tylko w ściśle określonych stacjonarnych stanach
energetycznych, w których, pomimo, że elektron doznaje
przyspieszenia (poruszając się po orbicie) nie wypromieniowuje
energii. Jego całkowita energia pozostaje stała.
• promieniowanie elektromagnetyczne zostaje wysłane tylko
wtedy, gdy elektron poruszający się po swojej orbicie zmienia
swój ruch skokowo, tak że porusza się
następnie po orbicie o niższej energii.
Cęstotliwość emiptowanego promieniowania:
Całkowita enrgia ukłądu:
• elektron w atomie porusza się po orbicie kołowej pod wpływem przyciągania
kulombowskiego pomiędzy elektronem i jądrem i ruch ten podlega prawom mechaniki
klasycznej.
• elektron może poruszać się tylko po takich orbitach, dla których
moment pędu L jest równy całkowitej wielokrotności stałej
Plancka podzielonej przez 2π, (stała n jest liczbą kwantową).
Równanie przedstawia wartości energii dozwolonych
stanów stacjonarnych:
Wprowadzenie kwantowania orbitalnego momentu pędu elektronu prowadzi do
kwantowania jego energii całkowitej.
Serie widmowe wodoru:
Przejścia pomiędzy stanami stacjonarnymi i odpowiadające im linie widmowe tworzą serie
widmowe. Dana seria obejmuje promieniowanie emitowane przy przejściu elektronu z
poziomów wyższych na dany np. seria Balmera obejmuje przejścia ze stanów o n > 2 do
stanu o n = 2.
Tylko przejściom elektronu na drugą orbitę (seria Balmera) towarzyszy emisja
promieniowania z zakresu widzialnego. Seria Lymana obejmuje promieniowanie w
zakresie nadfioletu, a seria Paschena w podczerwieni.
104. Fale de Broglie'a i zasada nieoznaczności Heisenberga
W 1924 r. de Broglie zapostulował, że skoro światło ma dwoistą, falowo-cząstkową, naturę,
to także materia może mieć taką naturę. Posługując się klasyczną teorią
elektromagnetyzmu można pokazać, że światło o energii E ma
pęd p = E/c. Zatem foton (kwant światła) ma pęd równy:
De Broglie nie tylko zasugerował istnienie fal materii ale
również przewidział ich długość. Założył, że długość przewidywanych fal materii jest
określona tym samymzwiązkiem, który stosuje się do światła:
Eksperyment interferencyjny odsłania falowy charakter cząstek.
De Broglie przyjął, że elektron krążący wokół jądra po orbicie kołowej ze
stałą prędkością jest reprezentowany przez pewną falę materii - falę
elektronową. Ta fala, tak jak elektron, przebiega wielokrotnie wzdłuż orbity
kołowej, przy czym w każdym kolejnym okresie przebieg ulega dokładnemu
powtórzeniu, to znaczy fala jest zgodna w fazie z falami z poprzednich
obiegów. W przeciwnym razie powstająca fala wypadkowa miała by
natężenie równe zeru.
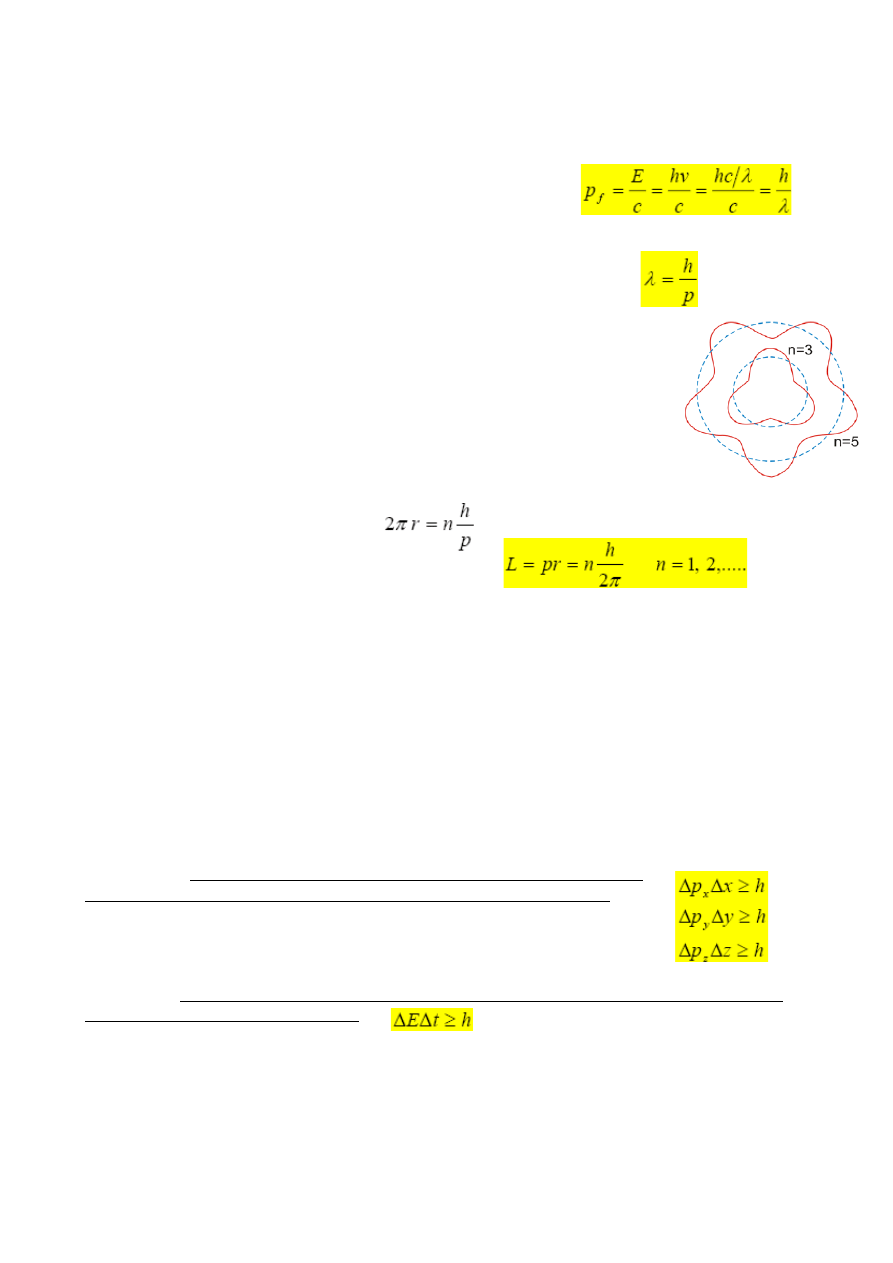
Ten warunek zgodności faz oznacza, że orbita musi na swym obwodzie
mieścić całkowitą liczbę długości fal de Broglie'a 2π r = nλ. Co w połączeniu z postulatem
de Broglie'a prowadzi do wyrażenia:
Stąd moment pendu elektronu:
Postulat de Broglie’a nie odpowiadał na pytanie jaką postać może mieć funkcja opisująca
fale materii - funkcja falowa , jak ją wyznaczyć oraz jaka jest jej interpretacja. Problem ten
został wyjaśniony przez Heisenberga i Schrödingera, którzy zaproponowali nowy sposób
opisu świata mikrocząstek - mechanikę kwantową.
Do pełniejszego opisu własności falowych materii należy posługiwać się funkcją falową ψ.
M. Born zasugerował, że wielkość | ψ |2 w dowolnym punkcie przedstawia miarę
prawdopodobieństwa, że cząstka znajdzie się w pobliżu tego punktu to znaczy w jakimś
obszarze wokół tego punktu np. w przedziale x, x+dx. Ta interpretacja funkcji ψ daje
statystyczny związek pomiędzy falą i związaną z nią cząstką. Nie mówimy gdzie cząstka jest
ale gdzie prawdopodobnie się znajdzie.
Zasada nieoznaczności Heisenberga
Pierwsza część tej zasady dotyczy jednoczesności pomiaru położenia i pędu (wyklucza ją).
Głosi ona, że iloczyn nieokreśloności pedu cząstki i nieokreśloności jej
położenia w danym kierunku jest zawsze większy od stałej Plancka. Im
dokładniej mierzymy pęd, tym bardziej rośnie nieoznaczność polozenia.
Druga część zasady nieoznaczności dotyczy pomiaru energii i czasu potrzebnego na jego
wykonanie. Jeżeli cząska posiada energię E, to dokładność jej wyznaczenia ΔE zależy od
czasu pomiaru Δt zgodnie z relacją:
Im dłużej cząstka jest w stanie o energi E tym dokładniej można wyznaczyć tą energię.
Zasada nieoznaczności stanowi podstawę stwierdzenia, że w fizyce kwantowej musimy
posługiwać się pojęciem prawdopodobieństwa.
105. Równanie Schrodingera
Równanie różniczkowe opisujące zachowanie się układu kwantowego w czasie i
przestrzeni. Rozwiązując je można znaleźć ścisłą postać funkcji falowej dla dowolnego
układu. W szczególności przyjmuje ono postać:
E – energia całkowita cząstki,
U(x) – energia potencjalna zależna od jej położenia,
= h/2π.
Zależność ta przedstawia najprostrzą formę równania Shroedingera, czyli równanie w
jednym wymiarze i niezależne od czasu. Jego rozwiązanie polega na znalezieniu postaci
funkcji falowej ψ i wartości energii cząstki E przy znanej działającej na cząstke sile zadanej
poprzez energię patecijalną U.
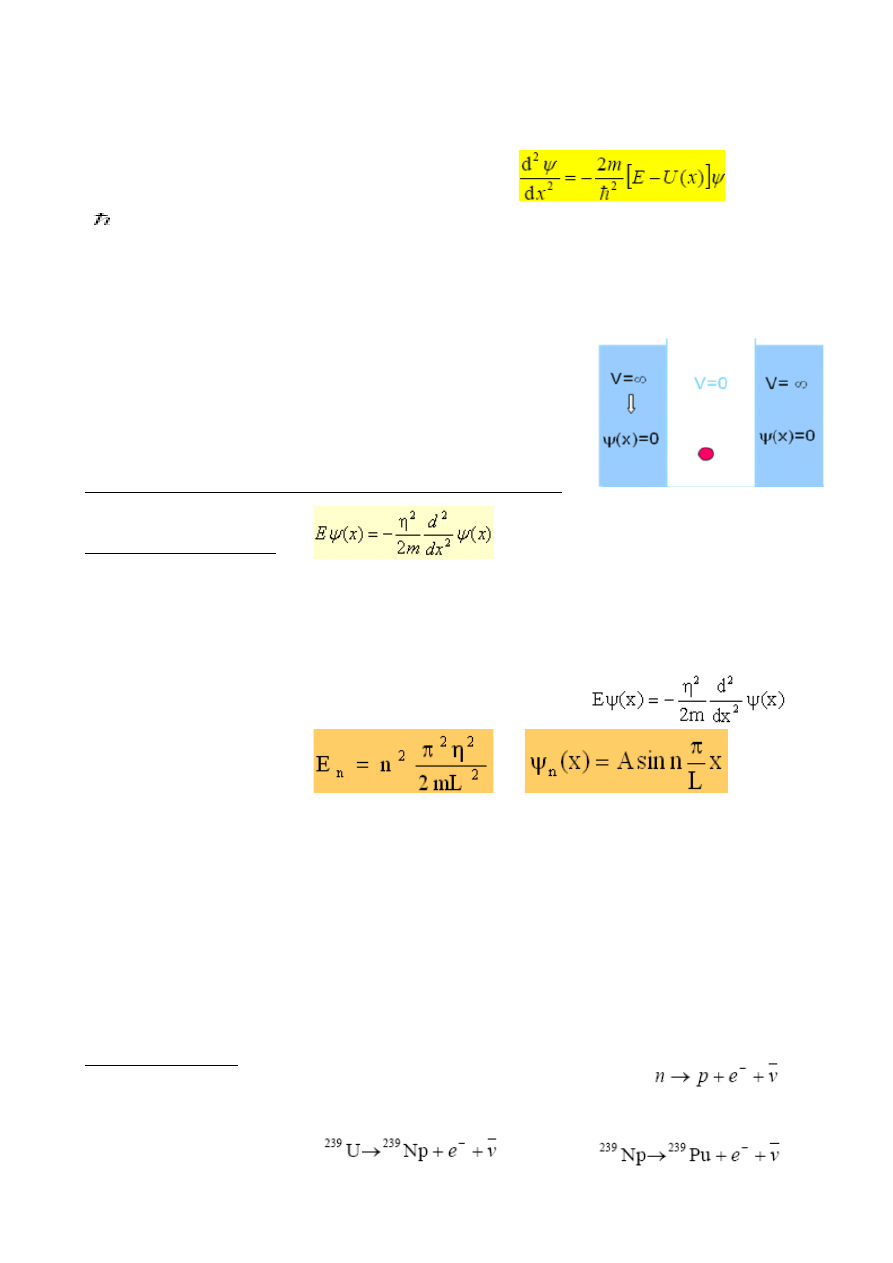
106. Studnia kwantowa (?)
ELEKTRON W NIESKOŃCZONEJ STUDNI POTENCJAŁU
Znaleźć możliwe energie E i odpowiadające im funkcje falowe
y(x) elektronu w nieskończonej studni potencjału.
ROZWIĄZANIE:
x<0 i x>LÞ V(x)=¥
Elektron nie może być w tym obszarze: y(x)=0 dla x<0 i x>L
lub
0<x<L Þ V(x)=0
Elektron jest swobodny.
Jeśli do studni potencjału „wrzuci” się wiele elektronów, to rozłożą się one tak, aby zakaz
Pauliego był spełniony.
Dozwolone energie (wartości własne energii)
Możliwe stany elektronu (funkcje własne)
Ponieważ wiadomo, że elektron nie może być w obszarze
nieskończonego potencjału, czyli y(x) =0 dla x<0 i x>L, to
rozwiązujemy tylko równanie dla elektronu swobodnego:
Odgadnięte rozwiązanie:
107. Promieniowanie alfa, beta, gamma, neutrony – własności
Promieniowanie alfa – promienie alfa (mało przenikliwe) to jądra helu. Rozpad alfa
występuje zazwyczaj w jądrach o Z>= 82. Polega ona na przemianie niestabilnego jądra w
nowe jądro przy emisji jądra
4
He tzw. cząstki alfa. Dla ciężkich jąder energia wiązania
pojedynczego nukleonu maleje ze wzrostem liczby masowej więc zmniejszenie liczby
nukleonó (w wyniku promieniowania alfa) prowadzi do powstania silniej związanego jądra.
Proces zachodzi samorzutnie bo jest kozystny energetycznie. Energia wyzwolona w czasie
rozpadu jest unoszona przez cząstkę alfa w postaci energii kinetycznej.
Promieniowanie beta – promienie beta to elektrony. Istnieje optymalna liczba
protonów i neutronów, które tworza stabilne jądra. Jądra, których ilość protonów Z różni
się od watrości odpowiadającej stabilnym jądrom o tej samej liczbie masowej A, mogą
zmieniać Z w kierunku jąder stabilnych poprzez rozpad beta.
Rozpad beta minus – jeżeli jądro ma większąod optymalnej liczbę
neutronów to w jadrze takim zachodzi przemiana neutronu w proton,
neutron n rozpada się na proton, elektron i antyneutrino. W takim
procesie liczba protonów Z wzrasta o jeden, a liczba nukleonów A pozostaje bez zmian.
Przykład: rozpad uranu
239
U:
Rozpad beta plus – gdy jądro ma nadmiar protonów to zachodzi proces przemiany protonu
w neutron:
proton rozpada się na neutron, pozyton i neutrino. W
tym procesie liczba protonów Z maleje o jeden, a liczba
nukleonów pozostaje bez zmian.
Pierwiastki powstające w rozpadach alfa i beta są na ogół także promieniotwórcze i ulegają
dalszemu rozpadowi.
Promieniowanie gamma – rozpadom alfa i beta towarzyszy zazwyczaj emisja
wysokoenergetycznego promieniowania elektromagnetycznego – promieniowania gamma.
Ta samoczynna emisja fotonów następuje gdyjądra posiadające nadmiar energii, czyli
znajdujące się w stanie wzbudzonym przechodza do niższych stanów energetycznych.
Widmo promieniowania gamma ma charakter liniowy, tak jak charakterystyczne
promieniowanie X i bardzo wysoka energię, tysiące razy większą od energii fotonów
wysyłanych przez atomy.
Jądra w stanie wzbudzonym można również otrzymać za pomocą neutronów o małej
energii. Przykłąd: wiązka powolnych neutronów kierujemy na próbkę uranu 138U => część
neutronów zostaje wychwycona i powstają jądra uranu 239U* w stanie wzbudzonym. Takie
jądra przechodzą do stanu podstawowego emituja kwanty gamma. Przebieg procesu:
Emisji promieniowania gamma nie towarzyszy zmiana liczby masowej ani liczby atomowej.
Neutron – własności – neutron jest jednymz dwóch nukleonów w jądrze, jego masa to
1,674928(1)
.
10
-27
kg. Na wewnetrzna struktórę neutronu składaja się 3 kwarki: udd, dające
w sumie zerowy ładunek elektryczny. Pomimo braku ładunku elektrycznego (czyli braku
bezpośredniego oddziaływania elektromagnetycznegoz otoczeniem), neutron ma moment
magnetyczny równy -9,6491783(18)
.
10
-27
JT
-1
. Neutron jest cząska nietrwałą i rozpada się
ze średnim czasem życia (885,9s) wg schematu:
Neutrony mogą wywoływać szereg reakcji
jądrowych, których prawdopodobieństwo zajścia zalezy silnie od energi neutronó. Reakcje
z neutronami mogą być zarówno egzo-, jak i endotermiczne. W pierwszych ciepło reakcji Q
jest dodatnie, w drugich ujemne. Oznacza to, że w reakcjach pierwszego rodzaju wyzwala
się energia, do zajścia zaś reakcji drugiego typu energia musi być dostarczona przez
neutrony o odpowiedniej energii kinetycznej.
Obliczenie ciepła reakcji opiera się na rachunku mas spoczynkowych cząstek wchodzących
w reakcję. Dla reakcji, którą zapiszemy schematycznie jakos X(x,y)Y, ciepło rwakcji
definiujemy jako:
Dla Q<0 cząstka
bombardująca jądro utraci część swej energii na
energię odrzutu (E
R
) jądra, stąd też w wypadku
reakcji endoenergetycznych minimalna energia
wymagana dla ajścia reakcji, tzw. energia progowa
reakcji musi być sumą ciepła reakcji i energii
odrzutu:
108. Źródła, sposoby ochrony, detekcja
promieniowania
Źródła promieniowania można podzielić na:
zamknięte (gdy materoał promieniotwórczy jest
zamknięty w materii nieprominiującej i nie może się
przedostać do otoczenia) lub otwarte (gdy materiał
promieniotwórczy może przedostać się do
otoczenia).
Inny podział: naturalne źródła promieniowania
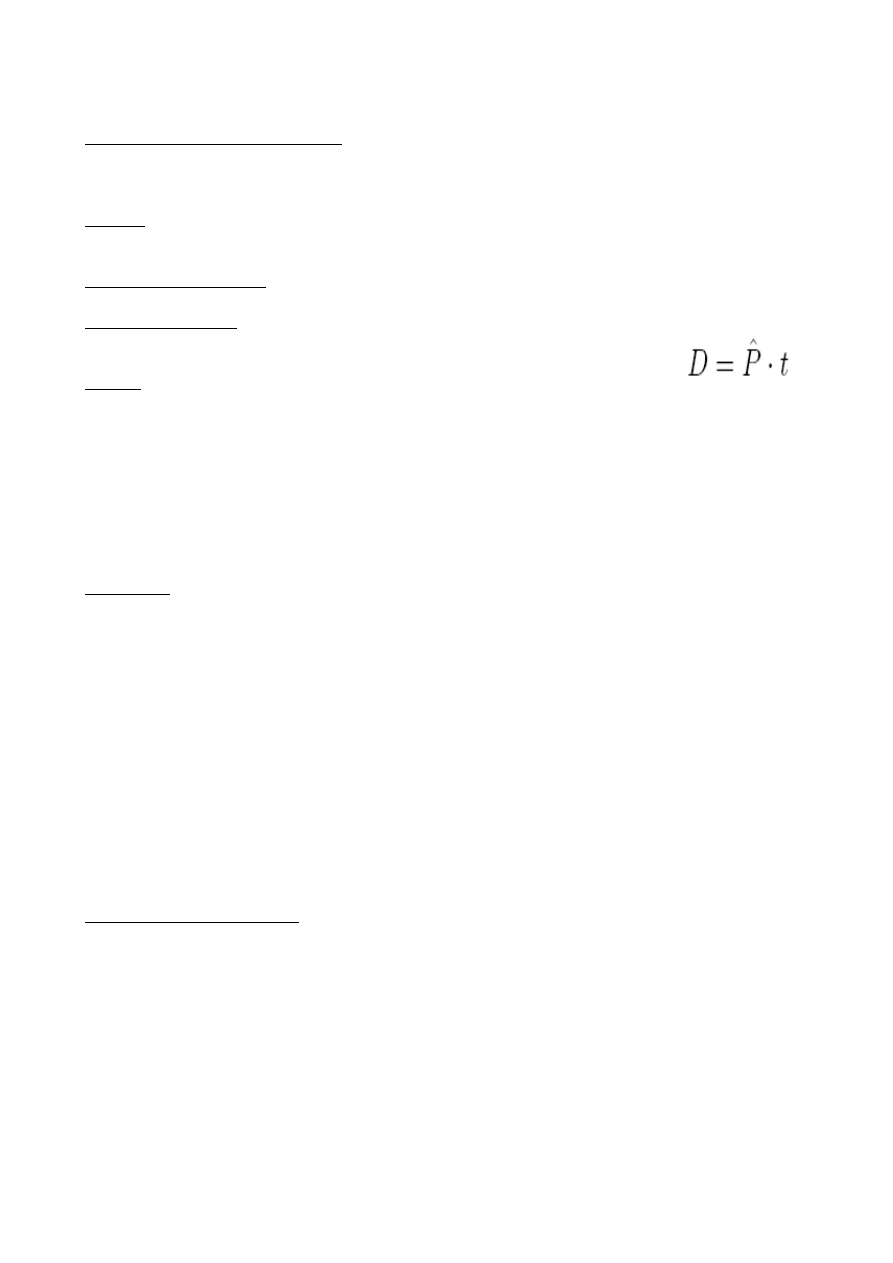
( promieniowanie kosmiczne, promieniowanie emitowane przez pierwiastki zawarte w
skorupie ziemskiej),
sztuczne źródła promieniowania ( aparatura rentgenowska, izotopy promieniotwórcze).
Sposoby ochrony – metody ochrony przed promieniowaniem różnia się w zalezności od
rodzaju promieniowania i żródła. Istnieją jednak podstawowe zasady dotyczące wszystkich
rodzajów źródeł oraz rodzajów promieniowania:
ALARA (As Low As Reasonably Achievable) podstawowa zasada mówiąca, że wszystkie
działania mają na celu ograniczenie kontaktu z materiałami promieniotwórczymi na tyle,
na ile jest to racjonalnie osiągalne.
Zwiększenie odległości – zawsze moc promieniowania maleje wraz z kwadratem odległości
od żródła.
Ograniczenie czasu – jedną z metod ograniczania otrzymanej dawki promieniowania jest
ograniczenie czasu przebywania w pobliżu materiału promieniotwórzcego:
gdzie D- dawka otrzymana, P – moc dawki.
Osłony – każdy rodzaj promieniowania wymaga dobrania odpowiedniej
osłony, tak aby była ona najbardziej efektywna. W przypadku promieniowania alfa
wystarczy kilka kartek papieru, a w przypadku beta stosunkowo cienka płyta aluminiowa.
Promieniowanie gamma jest bardzo przenikliwe, dlatego do jego zatrzymania używa się
osłon ołowiowych, które nadają się również do zatrzymywania promieniowania alfa i beta.
Nie można ich jednak stosować do zatrzymywania neutronów, ponieważ neutron
zderzający się z ciężkim jądrem osłony powoduje powstanie izotopów promieniotwórczych.
Dletego do zatrzymywania promieniowania neutronowego wykożystuje się bloki wodne,
parafine bądź bloki betonowe.maywane są na lekkich jądrach wodoru. W efekcie powstaje
promieniowanie gamma, które trzeba zatrzymać dodatkowymi osłonami.
Szczelność – ważnym elementem ochrony przed promieniowaniem w przypadku
wykorzystania żródeł w medycynie, przemyśle etc. jest zadbanie o ich szczelność.
Promieniowanie alfa oraz beta są mało przenikliwe jednak w przypadku przedostania się
do przewodu pokarmowego bądź dróg oddechowych mogą wywołać bardzo poważne
uszkodzenia.
Detekcja promieniowania – większość detektorów promieniowania jonizującego
opiera się na bardzo prostej zasadzie, promieniowanie jonizujące oddziałując z materiałem,
z którego wykonany jest detektor, powoduje powstanie pary elektron-jon, która ulega
separacji w polu elektrycznym. Następnie ilość ładunków jest zliczana i na jej podstawie
określana zostaje określona moc promieniowania jonizujacego, które spowodowało
jonizację ośrodka. Wady: efektywność kwantowa nie jest nigdy równa 100%. Istnieją
zawsze kwanty, które przechodząc przez ośrodek nie spowodują w nim jonizacji przez co
dla detektora pozostaną niezauważone. Promieniowanie alfa jest na tyle słabo przenikliwe,
że układ detekcyjny zamknięty wewnątrz obudowy nie jest w stanie go zarejestrować.
Dlatego, też stosuje się tzw. detektory okienkowe, w których występuje bezpośredni dostęp
do samego detektora.
Liczniki wypełnione gazem – bardzo powszechny rodzaj detektora. Gaz stanowi ośrodek, w
którym zchodzi detekcja promieniowania. Pole elektryczne przyłożone do elektrod
powoduje rozsunięcie pary elektron-jon. Przyspieszony elektron oraz jon trafiają na
przeciwległe elektrody. Odpowiedni układ mierzy powstały prąd elektryczny lub zlicza
poszczególne impulsy. W przypadku, gdy do elektrod podłączone jest stosunkowo
niewielkie napięcie w ośrodku następuje tylko jonizacja pierwotna. To znaczy
promieniowanie powoduje powstanie pary elektron-jon, jednakenergia kinetyczna
powstałych produktów jest na tyle mała, że nie może spowodować kolejnej jonizacji.
Produkty wędrują w stronę elektrod gdzie są zliczane. W przypadku większych napięć może
dojść do tzw. jonizacji wtórnej, kiedy to elektron powstały w wyniku jonizacji gazu ma
enerie kinetyczną na tyle dużą aby spowodować kolejną jonizację gazu. Gdy proces taki
powtarza się wielokrotnie dochodzi do powielenia elektronów zwanego wzmocnieniem
gazowym bądź też lawiną Townsenda. Do liczników wypełnionych gazem nalezą:
•
licznik Geigera-Mullera (liczba elektronów niezależna od napięcia na elektrodach,
możliwa identyfikacja rodzaju promieniowania, dostarcza jedynie informacji o ilości
czastek, dodatnie jony gromadzące się przy jednej z elektrod powodują spadek
napięcia, ograniczony czas działania z uwagi na degradację gazu, duża czułość,
mozliwość detekcji słabego promieniowania, prosty układ zliczający)
•
licznik proporcjonalny (detekcja dowolnego rodzaju promieniowania oraz jego
energii, wykorzystywanym gazem jest hel,argon lub trójfluorek boru, powstanie
swobodnych elektronów na drodze jonizacji wtórnej, interakcji fotoelektrycznych
oraz bombardowania elektrody przez dodatnio naładowane jony, możliwość
detekcji cząstek o nizkich energiach (<10 eV), ograniczony czas działania –
degradacja gazu)
•
kompra jonizacykna (sygnał wyjściowy proporcjonalny do energii cząstki, detekcja
silnego promieniowania (>10 eV), okienko dla cząstek alfa oraz beta,
wykorzystywanym ośrodkiem jest powietrze, skonstruowana z równoległych płyt
bądź z cylindra i umieszczonej wewnątrz elektrody, mozliwość detekcji neutronów.
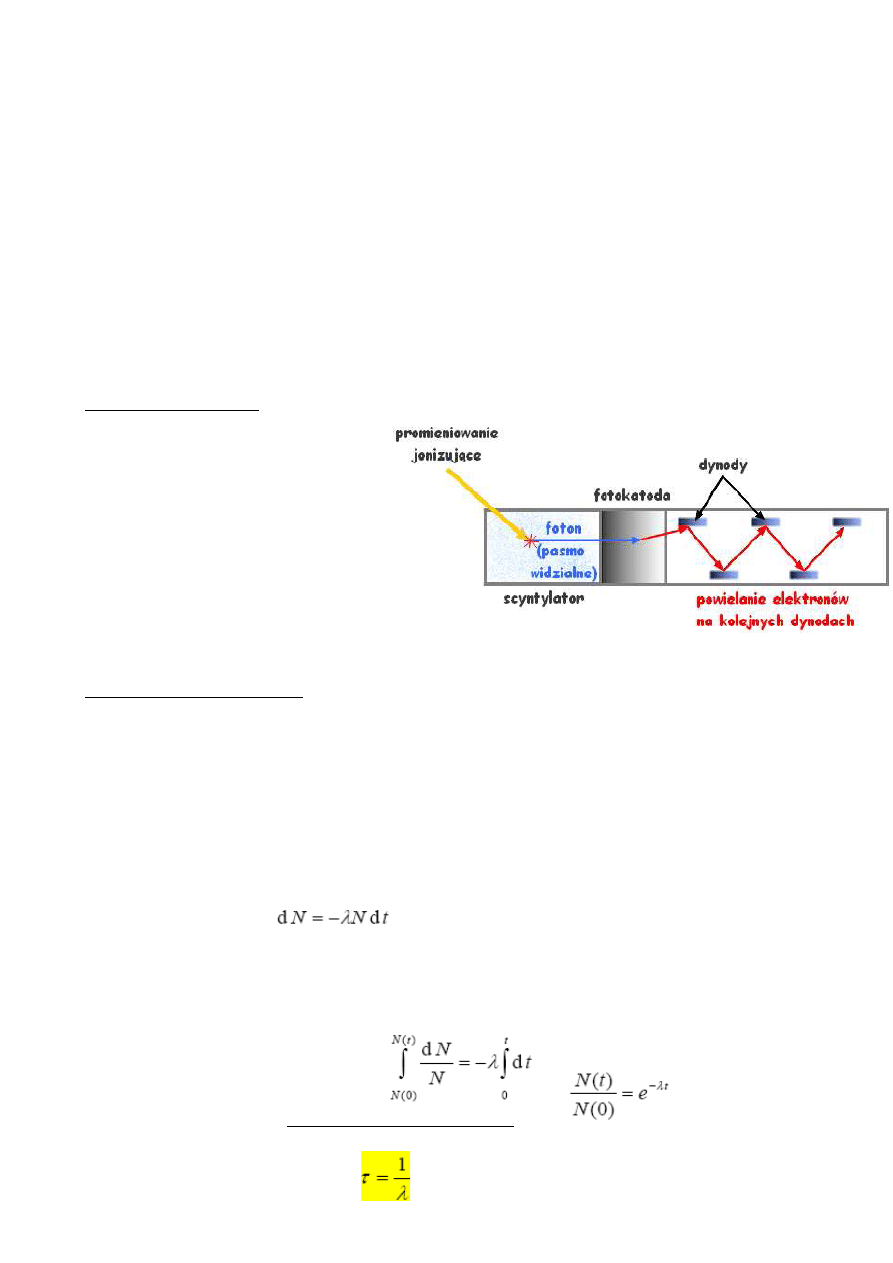
Liczniki scyntylacyjne – ze względu na budowe można je podzielić na trzy części:
scyntylator, w którym padające
promieniowanie jonizujące powoduje
przejście elektronów do stanu
wyższego, a następnie przy przejściu
elektronów do stanu nizszego
następuje emisja fotonu z pasma
światła widzialnego. Następnie foton
trafia na fotokatodę powodując
powstanie elektronów, te zaś
przyspieszane polem elektrycznym
trafiaja na kolejne dynody. Na każdej
z dynod następuje powielenie elekronów. Typowy układ składa się z 15 dynod. Różnica
potencjałów pomiędzy kolejnymi dynodami wynosi 80 – 120 V.
Liczniki półprzewodnikowe – przypominają w swoim działaniu komory jonizacyjne.
Różnica polega na tym, że nie powstają w nich pary elektron-jon, lecz pary elektron-dziura.
Zaletą liczników półprzewodnikowych jest duża dokładność oraz rozdzielczość
energetyczna. Dzięki temu mozliwe jest bardzo dokladne rozróżnienie energii cząsek.
109. Prawo rozpadu, aktywność, osłabienie promieniowania przez osłony,
szeregi promieniotwórcze
Rozpatrujemy układ zawierający w chwili początkowej wiele jąder tego samego rodzaju,
które podlegaja rozpadowi promieniotwórczemu (alfa lub beta). Aby określić liczbę jąder,
któte nie uległy rozpadowi po czasie t. Przez N oznaczamy liczbę jąder w materiale, dN jest
liczbą jąder, które rozpadają się w czasie dt. Spodziewana liczba rozpadów w czasie dt jest
dana wyrażeniem:
gdzie λ jest stałą rozpadu. Określa ona prawdopodobieństwo rozpadu w jednostce czasu,
nie zależy od czynników zewnętrznych. Znak minus wynika z tąd, że dN jest liczbą ujemną
bo liczba jąder N maleje z czasem.
Liczba jąder rozpadających się w jednostce czasu jest proporcjonalna do aktualnej liczby
jąder N. Całkując powyższe równanie
otrzymujemy ostatecznie wykładnicze prawo rozpadu:
Często wytaża się N poprzez średni czas życia jąder τ, który z definicji jest równy
odwrotności stałej rozpadu λ :

Prawo rozpadu można zapisać więc również w postaci:
Do scharakteryzowania szybkości rozpadu uzywa się czasu połowicznego rozpadu T. jest to
czas, po którym liczba jąder danego rodzaju maleje do połowy. Stąd:
I ostatecznie:
Aktywność wyraża się wzorem:
Szeregi promieniotwórcze – ogromną większość pierwiastków wykazujących
naturalną promieniotwórczość można podzielić na 3 grupy, zwane szeregami
promieniotwórczymi. Każdy szereg promieniotwórczy rozpoczyna się od jednego z
występujących na ziemi pierwiastków, a wszystkie trzy szeregi kończą się na trwałych
izotopach ołowiu.
W szeregu uranu, rozpoczynającym się od izotopu uranu
238
92
U, występują izotopy, których
liczby masowe można opisać ogólnym wzorem 4n+2. Szereg ten kończy się na izotopie
ołowiu
206
82
Pb.
Szereg aktynu rozpoczyna się od izotopu uranu
235
92
U, zwanego aktynouranem, i kończy się
na izotopie ołowiu
207
82
Pb. Liczby masowe izotopów tego szeregu opisane są wzorem 4n+3.
Szereg toru rozpoczyna się od izotopu toru
232
90
Th i kończy izotopem ołowiu
208
82
Pb.
Liczby masowe w tym szeregu opisane są wzorem 4n.
110. Rozpad a rozszczepienie, reakcje łańcuchowe, reaktor, bomba A
Energia wiąznia na jeden nukleon wzrasta z liczba masową aż do A>50. Dzieje się tak
dlatego, że dany nukleon jest przyciągany przez coraz większa liczbę sasiednich nukleonów.
Jednak przy dalszym wzroście liczby nukleonów obserwujemy zmniejszanie energii
wiązania nukleonu w jadrze. Siły jądrowe mają bardzo krótki zasięg i jeżeli odległość
między dwoma nukleonami jest więkasza niż 2,5
.
10
-15
m to oddziaływanie pomiędzy nimi
jest słąbsze. Jądra zawierające duza liczbę nukleonów mają większe rozmiary i odległości
pomiędzy poszczególnymi nukleonami mogą być relatywnie duże, a stąd słabsze
przyciąganie pomiędzy nimi. Konsekwencją takich zmian energii wiązania ze wzrostem
liczby nukleonów w jądrze jest występowanie zjawiska rozszczepienia.
Jeżeli ciężkie jądro rozdzielimy na dwie części, to powstałe dwa mniejsze jądra są silniej
wiązane do jądra wyjsciowego, tzn. te dwie części mają masę mniejszą niż masa jądra
wyjściowego. Dzięki temu w reakcji rozszczepienia wydziela się energia. Źródłem energii
bomby atomowej i reaktora jądrowego są procesy rozszczepienia jądrowego.
Spontaniczne rozszczepienie naturalnego jądra jest an ogół mniej prawdopodobne niż
rozpad alfa tego jądra. Można jednak zwiększyć prawdopodobieństwo rozszczepienia
bombardując jądra neutronami o odpowiednio wysokiej energii. Właśnie takie neutrony
powodują reakcję rozszczepienia uranu
235
U i plutonu
239
Pu.
Pierwiastki lekkie zawierają w jądrze zbliżone ilości protonów i neutronów, podczas gdy w
pierwiastkach ciężkich przeważa liczba neutronó. Z związku z tym w reakcji rozszczepienia
powstaje na ogół kilka neutronów. W konsekwencji rozszczepienie jądrowe może stać się
procesem samopodtrzymującym w wyniku tzw. reakcji łańcuchowej. Jeżeli przynajmniej
jeden z powstałych neutronów wywoła kolejne rozszczepienie to proces będzie sam się
podtrzymywał. Ilość materiału powyżej, której spełniony jest powyższy warunek nazywamy
masą krytyczną. Jeżeli liczba rozszczepień na jednostkę czasu jest utrzymana na stałym
poziomie to mamy do czynienia z kontrolowaną reakcją łańcuchową.
Masa materiału rozszczepianego może być tez nadkrytyczna. Wówczas neutrony powstałe
w wyniku jednego rozszczepienia wywołują więcej niż jedną reakcję wtórną. Mamy do
czynienia z lawinową reakcją łańcuchową. Cała masa ndkrytyczna może być rozszczepiona
w bardzo krótkim czasie, t<0,001 s, ze względu na dużą prędkość neutronów (3
.
10
5
m/s).
tak eksploduje bomba atomowa. Najczęściej przygotowuje się kulę o masie nadkrytycznej
ale rozrzedzonej. Następnie otacza się ją klasycznymi ładunkami wybuchowymi, których

detonacja wywołuje wzrost ciśnienia zewnętrznego i gwałtowne zwiększenie gęstości
materiału (zmniejsza się objetość kuli). W konsekwencji osiągnięty zastaje stan
nadkrytyczny.
Urządzenia, w których prowadzone są kontrolowane reakcje łąńcuchowe, nazywamy
reaktorami jadrowymi. Ważnym elementem każdego reaktora są urządzenia
zabezpieczające przed niepożądanym wzrostem szybkości reakcji łańcuchowej i rozwojem
reakcji lawinowej. Najczęściej służą w tym celu pręty kadmowe. Prawdopodobieństwo
wychwytu neutronów przez jądra kadmu jest bardzo duże, totez wsuwając do reaktora
pręty kadmowe mażemy znacznie zmniejszyć liczbę neutronów powodujących
rozszczepienie. Energia cieplna wydzielająca się w reaktorze jest odprowadzana na
zewnątrz przez czynnik chłodzący – gaz lub ciecz przepływającą przez wnętrze reaktora.
111. Wykorzystanie promieniowania: metody izotopowe, znacznikowe,
datowanie
Różne izotopy tego samego pierwiastka mają takie same własności chemiczne. Zatem
zastąpienie w cząsteczce jednego izotopu innym nie zmienia jej funkcji. Natomiast
promieniowanie emitowane przez izotop umożliwia jego wykrycie, zlokalizowanie i
śledzenie ruchu, a nawet pomiar jego stężenia bez ingerencji z zewnątrz. Metoda
znaczników izotopowych pozwala zatem badać funkcjonowanie żywego organizmu,
poczynając od poszczególnych jego komórek po cały narząd. Wielu przełomowych odkryć
naukowych w drugiej połowie dwudziestego wieku dokonano dzięki wykorzystaniu
promieniotwórczości m.in. odkryto funkcjonowanie genotypu, metabolizm komórek,
fotosyntezę, mechanizm wysyłania chemicznych informacji (hormony, neuromediatory)
wewnątrz organizmu. Izotopy radioaktywne wykorzystywane są w medycynie nuklearnej,
zwłaszcza w obrazowaniu medycznym, aby poznać działanie leków, funkcjonowanie
mózgu, wykryć zaburzenia pracy serca, umiejscowić przerzuty nowotworowe itp.
Promieniowanie jonizujące może selektywnie niszczyć zrakowaciałe komórki i doprowadzić
do likwidacji nowotworu. Jest to radioterapia. Było to jedno z pierwszych zastosowań
promieniotwórczości po jej odkryciu.
Metody datowania wykorzystują rozpad izotopów promieniotwórczych w materiałach
lub przedmiotach poddawanych datowaniu. Oczywiście musi być znany okres
połowicznego rozpadu tych izotopów. Do oznaczania wieku przedmiotów nie
przekraczających 50.000 lat używa się najczęściej izotopu węgla-14. Inne metody
datowania, w których wykorzystuje się kombinacje różnych izotopów pozwalają określić
wiek zdarzeń opisujących historię Ziemi, jej klimatu i istot żywych, które ją zamieszkują do
tej pory.
Dwutlenek węgla (CO2) obecny w atmosferze zawiera stabilny węgiel-12 i bardzo niewielki
odsetek promieniotwórczego węgla-14 (którego okres połowicznego rozpadu wynosi 5730
lat), ciągle tworzonego przez promienie kosmiczne. Dwutlenek węgla znajdujący się w
atmosferze jest wchłaniany przez organizmy żywe (w procesach oddychania i fotosyntezy).
Kiedy żywy organizm umiera, znajdujący się w nim węgiel-14 przestaje być odnawiany. W
miarę jak izotop ten ulega rozpadowi jego zawartość w porównaniu z węglem-12 spada. W
ten sposób węgiel-14 pełni rolę swoistego "zegara"; im mniej go pozostaje, tym starsza jest
próbka pobrana do datowania.
Wyszukiwarka
Podobne podstrony:
(Fizyka II jądrowa [tryb zgodności])id 1321
opracowanie2 id 338681 Nieznany
Fizyka Prad elektryczny test id Nieznany
temp krytyczna, TRANSPORT PWR, STUDIA, SEMESTR II, FIZYKA, fizyka-wyklad, zagadnienia opracowane, za
Opracowanie07v2 id 338680 Nieznany
chemia opracowanie id 112613 Nieznany
%9cwiat%b3o+a+fizyka+kwantowa FIE44NASQGDAHUBJ53IEAGGJG3WCSRIMILDMGMI
Fizyka Uzupelniajaca Prad elektryczny I id 177229
Barok Opracowanie id 80259 (2)
ginexy opracowanie id 191652 Nieznany
Najlepsze opracowanie id 313141 Nieznany
Fizyka Laborki (cwiczenieS) opracowanie?
probabilistyczna natura wiata czyli chaos jako nauka fizyka kwantowa magia
32 Światło a fizyka kwantowa
więcej podobnych podstron