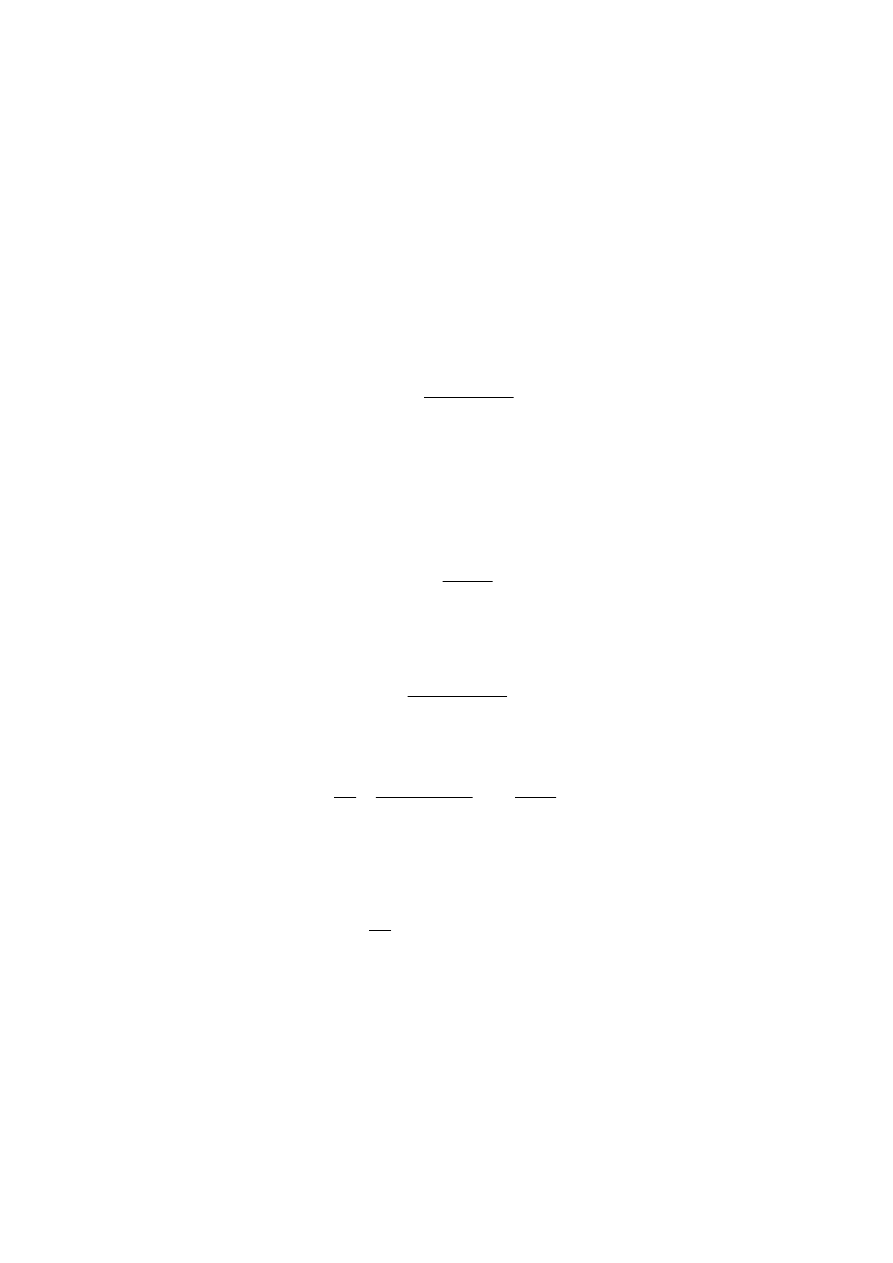
Ć W I C Z E N I E Nr 35
OZNACZANIE STAŁEJ RÓWNOWAGI REAKCJI
−
−
=
+
3
2
I
I
I
Cel ćwiczenia: wyznaczenie stałej równowagi reakcji pomiędzy jodem
cząsteczkowym i jonami jodkowymi w fazie wodnej.
Jod,
źle rozpuszczalny w wodzie, dobrze rozpuszcza się w wodnych
roztworach jodku potasu, dzięki zachodzącej w układzie reakcji:
(1)
−
−
=
+
3
2
I
I
I
Stałą równowagi tej reakcji, wyrażoną wzorem:
w
w
2
w
3
c
]
I[
]
I[
]
I[
K
−
−
⋅
=
(2)
można obliczyć wykorzystując różnice współczynników podziału jodu pomiędzy
rozpuszczalnik organiczny i wodę, K, oraz pomiędzy rozpuszczalnik organiczny i
wodny roztwór jodku potasu K
1
.
W stałej temperaturze i pod stałym ciśnieniem, zgodnie z prawem podziału
Nernsta, stosunek stężeń jodu w obu fazach, rozpuszczalniku organicznym i wodzie
jest stały i równy współczynnikowi podziału K, który wyrażony jest równaniem:
w
2
org
2
]
I[
]
I[
K
=
(3)
W stałej temperaturze i pod stałym ciśnieniem stosunek stężeń jodu w
rozpuszczalniku organicznym i wodnym roztworze jodku potasu jest stały i określony
współczynnikiem podziału K
1
, wyrażonym zależnością:
w
3
w
2
org
2
1
]
I
[
]
I
[
]
I
[
K
−
+
=
(4)
Dzieląc równania (3) i (4) stronami otrzymujemy zależność (5):
w
2
w
3
w
2
w
3
w
2
1
]
I[
]
I[
1
]
I[
]
I[
]
I[
K
K
−
−
+
=
+
=
(5)
Po uwzględnieniu zależności (5) w równaniu (2) otrzymujemy zależność
pomiędzy stałą równowagi reakcji K
c
i współczynnikami podziału jodu pomiędzy fazę
organiczną i wodną, K oraz fazę organiczną i wodny roztwór jodku potasu, K
1
:
w
c
1
]
I[
K
1
K
K
−
⋅
=
−
(6)
Stałą równowagi K
c
dla reakcji (1) można obliczyć oznaczając współczynnik
podziału jodu K pomiędzy rozpuszczalnik organiczny i wodę, a także współczynniki
podziału jodu K
1
pomiędzy rozpuszczalnik organiczny i wodne roztwory jodku potasu
o różnych stężeniach jonów jodkowych [I
-
].
Wykonanie ćwiczenia
1. W suchych kolbkach z korkiem szlifowanym przygotować po 20 ml wodnych
roztworów KI, o stężeniach podanych przez asystenta.
2. Do przygotowanych roztworów dodać po 20 ml roztworu jodu w toluenie (lub
innym rozpuszczalniku organicznym), zatkać korkiem i energicznie wytrząsać.
Pozostawić do rozwarstwienia.
3. Po rozdzieleniu faz suchą pipetką pobrać po około 5 ml roztworu z warstwy
organicznej (górnej) i przelać do kuwety pomiarowej kolorymetru. W drugiej
kuwecie umieścić rozpuszczalnik organiczny (toluen).
4. Zmierzyć absorbancję kolejnych roztworów [wartości (A
2
)
i
]
5. Zmierzyć absorbancję wyjściowego roztworu I
2
w toluenie (lub innym
rozpuszczalniku organicznym) A
1
.
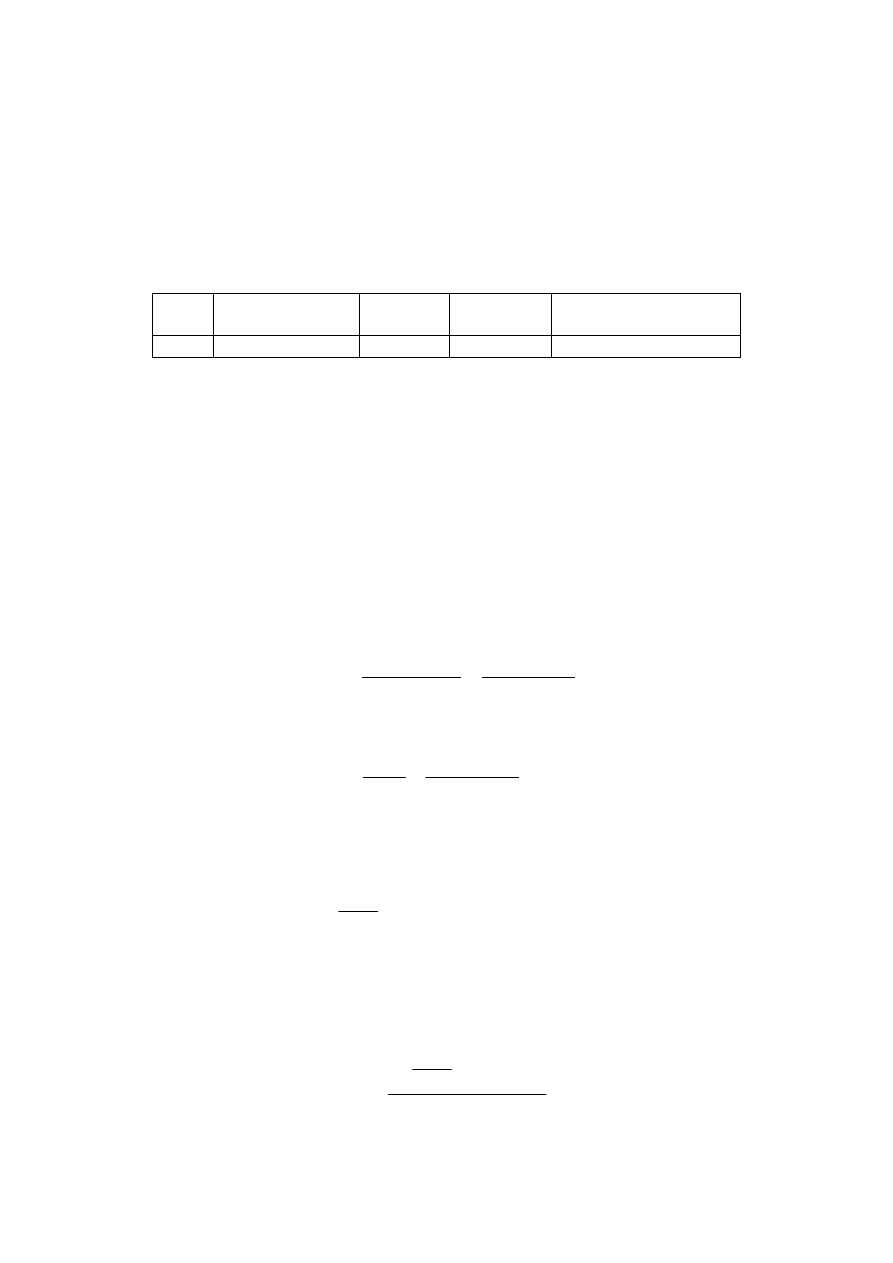
Lp.
[J
-
]
w
Stężenie KI
(A
2
)
i
(K
1
)
i
Opracowanie wyników
Z prawa Lemberta-Beera wynika, że absorbancja roztworu A jest wprost
proporcjonalna do stężenia c substancji absorbującej i długości drogi optycznej l:
A = A
o
⋅ l ⋅ c (7)
A
0
jest molowym współczynnikiem absorpcji.
Długość drogi optycznej jest równa grubości warstwy roztworu czyli grubości kuwety.
Ponieważ do wszystkich oznaczeń wykorzystywana jest ta sama kuweta, zmierzone
w doświadczeniu absorbancje roztworów (A
2
)
i
są proporcjonalne do równowagowego
stężenia jodu w fazie organicznej. Natomiast równowago stężenie jodu w wodnym
roztworze jodku potasu jest proporcjonalne do różnicy absorbancji [A
1
-(A
2
)
i
], gdzie A
1
jest absorbancją wyjściowego roztworu jodu w toluenie.
1. Współczynniki podziału jodu pomiędzy fazę organiczną i wodne roztwory jodku
potasu można obliczyć z zależności (8) otrzymanej po uwzględnieniu równania
(7) w równaniu (4):
]
)
A
(
A
[
)
A
(
]
I[
]
I[
]
I[
K
i
2
1
i
2
w
3
w
2
org
2
1
−
≡
+
=
−
(8)
2. Współczynnik podziału jodu pomiędzy rozpuszczalnik organiczny i wodę, K
można obliczyć z zależności (9):
]
)
A
(
A
[
)
A
(
]
I[
]
I[
K
0
2
1
0
2
w
2
org
2
−
≡
=
(9)
(A
2
)
0
jest absorbancja roztworu I
2
w fazie organicznej w równowadze z
nasyconym wodnym roztworem I
2
.
3. Wartość (A
2
)
0
należy wyznaczyć przez ekstrapolację, z wykresu zależności (A
2
)
i
od c
KI
.
4. Narysować zależność
1
)
K
(
K
i
1
−
od stężenia jodku potasu c
KI
. Zgodnie z
równaniem (6) zależność ta jest prostą, przechodzącą przez początek układu
współrzędnych.
5. Obliczyć współczynnik kierunkowy, liczbowo równy stałej równowagi reakcji K
c
,
albo za pomocą arkusza kalkulacyjnego, albo metodą najmniejszych kwadratów z
następującej zależności:
2
i
w
n
1
i
i
w
i
1
n
1
i
c
)
]
I
([
)
]
I
([
]
1
)
K
(
K
[
K
−
=
−
=
Σ
⋅
−
Σ
=
Document Outline
Wyszukiwarka
Podobne podstrony:
Agrofizyka, Sprawozdania ćwiczenie 35
Ćw nr 35, Ćwiczenie 35, Laboraka
Cwiczenie 35 poprawione, AGH, GiG, AGH, fizyka, laborki
ćwiczenie 35, Semestr 1, Fizyka
ćwiczenie 35
Wyniki ćwiczenia 35
ĆWICZENIA PORANNE MAC (35), ZESTAWY ĆWICZEŃ PORANNYCH MAC
Ćwiczenie nr 35, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwicz
cwiczenie nr 1 2011 10 02 13 35 22
Ćwiczenie nr 35
Cwiczeniee Nr 35, Wydział Chemiczny
cwiczenia9, zchomikowane, 35 000 edukacyjnych plików z każdej branży
35, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr35
35. Konstruktywizm, st. Pedagogika ćwiczenia, pedagogika U P tematy do egzaminów 46 tematów
35 cwiczenia 10
Ćwiczenie nr 35, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
Działania typu 35 2 ćwiczenia, Działania w zakresie 100
ĆWICZENIA PORANNE MAC (35), ZESTAWY ĆWICZEŃ PORANNYCH MAC
więcej podobnych podstron