
Seminarium z Chemii Organicznej
Temat:
DIAZOALKANY
Izabela Czalej – Kozak Politechnika Gdańska
Numer indeksu: 118282 Wydział Chemiczny
Chemia / semestr VI

Definicja
Diazoalkany ( dwuazoalkany) są to
związki o wzorze ogólnym R = N
2
,
w których dwa atomu wodoru
zostały zastąpione przez grupę
diazo-.

Diazometan
Najprostszy związek z grupy diazoalkanów
o wzorze sumarycznym CH
2
N
2

W okresie chemii klasycznej zaproponowano 2 wzoru dla
diazometanu:
H
2
C
N
N
H
2
C
N N
Wzór Curtiusa Wzór Angeliego i Wzór Thielego
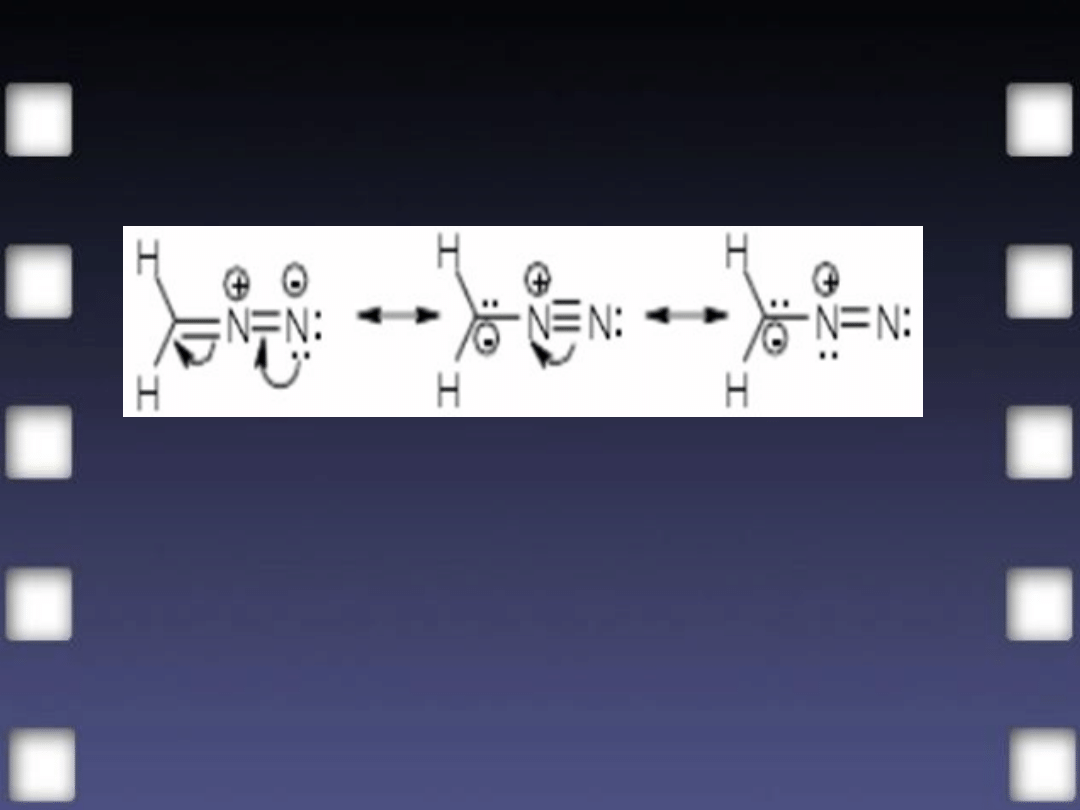
Wzór Curtiusa nie odpowiada pomiarom fizycznym, które wykazują, że
cząsteczka jest liniowa. Drugi wzór natomiast nie jest zgodny z teorią
elektronową.
Rozkład elektronów jest pośredni między strukturami granicznymi
Stosując do gazowego diazometanu metodę widm mikrofalowych ustalono,
że cząsteczka zbudowana jest liniowo, a odległość między atomami jest
następująca:
C – N – N
1,32
1,12

Otrzymywanie diazometanu
1.
Działając kwasem azotowym
Bezpośrednio można dwuazować tylko te aminy
alifatyczne, które zawierają grupę NH
2
związaną z
atomem węgla przy którym oprócz atomu wodoru
znajduje się również grupa COOC2H2 lub grupa
karbonylowa CO. Substancjami są estry α-
aminokwasów ROOC-CHR-NH2
-2H
2
O + -
C
2
H
3
OOC–CH
3
NH
2
+ ONOH C
2
H
3
OOC–CH=N=N
ester kwasu aminooctowego ester dwuazooctowy

2. Proste dwuazoalkany, których nie można
otrzymać przez bezpośrednie
dwuazowanie, otrzymuje się z N-
alkiloamidów, najczęściej z alkilouretanów
(von Wechmann, 1894) lub
alkilomoczników (p. str. 818 i 822).
Działając na te związki kwasem azotawym
otrzymuje się nitropochodne typu
nitrozoamin:
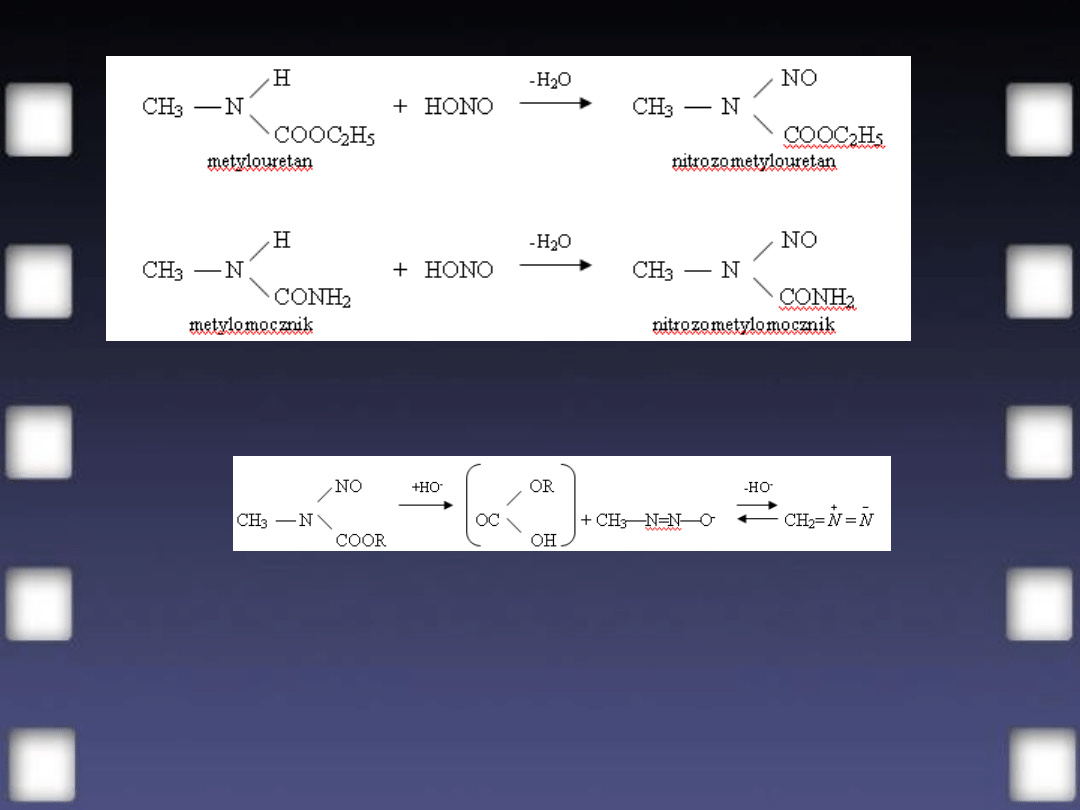
Nitrozoalkilouretan lub nitrozoalkilomocznik pod wpływem zimnego stężonego
wodorotlenku potasu przechodzi w dwuazoalkan; w podanym przykładzie będzie to
dwuazometan:
Powstający w tej reakcji jako produkt przejściowy metanodwuazan można
wyodrębnić jeżeli pracuje się uważnie na zimno, ale zazwyczaj
przechodzi on szybko w dwuzaometan. Ten ostatni wydziela się jako
gaz i rozpuszcza się w eterze ochłodzonym do temp. 0
°
C.

3. Diazopochodne zawierające grupy C6H5 i RCO
można otrzymać z hydrazonów, aldehydów i
ketonów przez odwodornienie tych związków
tlenkiem rtęciowym w roztworze eterowym:
+[O]
+ -
(C
6
H
5
)
2
C=O + H
2
N–NH
2
(C
6
H
5
)
2
C=N–NH
2
(C
6
H
5
)
2
C=N=N
benzofenon hydrazon benzofenonu -H
2
O
dwufenylodwuazometan

4. Specjalna metoda otrzymywania diazometanu
polega na działaniu stężonym wodorotlenkiem
potasu na mieszaninę chloroformu z hydrazyną
-3HCl
CHCl
3
+ H
2
N–NH
2
CH
2
=N
2

Własności fizyczne
Cząsteczki alifatycznych diazopochodnych
mają wyłącznie wiązania kowalencyjne. Z
tego powodu związki te mają niskie
temperatury wrzenia i są rozpuszczalne w
rozpuszczalnikach organicznych.
Ogrzewane do 100-150 °C wybuchają.

Diazometan jest żółtym, bardzo trującym
gazem (tw.= - 24°C). Roztwór
dwuazometanu w eterze jest bardziej
bezpieczny niż czysty gaz. W
temperaturze 0 °C rozkłada się powoli w
ciągu kilku dni wydzielając azot i
odbarwiając się. Ślady kwasów
przyspieszają rozkład.

Własności chemiczne
Reaktywność diazoalkanów można przewidzieć na
podstawie ich struktury. Jedna ze struktur granicznych
ma niezwiązaną parę elektronów przy atomie węgla.
Atom ten jest zatem ośrodkiem zasadowym lub
nukleofilowym, który reaguje z kwasami i z innymi
odczynnikami elektrofilowymi. Druga struktura graniczna
ma niezwiązane elektrony przy krańcowym atomie azotu;
jest to drugi nukleofilowy ośrodek reakcji. Tych ostatnich
reakcji jest jednak mniej i nie są tak ważne, jak reakcje
zachodzące wtedy, gdy niezwiązana para elektronów
znajduje się przy atomie węgla.

1. Reakcje z kawasami
Kwasy karboksylowe reagują szybko i
ilościowo z dwuazoalkanami, np. z
dwuazoalkanem w zimnym roztworze
eterowym, dając estry:
CH
2
=N
2
+ HCOOR → CH
3
OOC-R + N
2
Tak samo, tylko wolniej reaguje z fenolami
dając estry:
CH
2
=N
2
+ HOC
6
H
5
→ CH
3
-O-C
6
H
5
+ N
2

2. Reakcje z aldehydami i ketonami
Grupa karbonylowa jest czynnikiem
elektrofilowym (przy atomie węgla). Z
dwuazoalkanami powstaje najpierw jon
amfoteryczny, który ulega stabilizacji bądź na
skutek tworzenia się epoksytlenku, bądź też
migracji jednej z reszt R (gdzie R – alkil, aryl lub
H), np.:
C
4
H
13
CHO + CH
2
=N
2
→ C
4
H
13
–CO–CH
3
+ N
2
Cl
2
C–CHO + CH
2
=N
2
→ Cl
2
C–CH–CH
2
+ N
2
O

CH
3
–CO–CH
3
+ CH
2
=N
2
→ (CH
3
)
2
C—CH
2
+ CH
3
–CO–CH
2
–CH
3
O
40% 20%
Pod wpływem działania dwuazometanu na ketony
cykliczne następuje powiększenie się pierścienia. Z
cykloheksanonu otrzymuje się cykloheptanon:
CH
2
H
2
C CO H
2
C–H
2
C–CH
2
+
CH
2
=N
2
→ CO + N
2
H
2
C CH
2
H
2
C–CH
2
–CH
2
CH
2

3.Reakcje z chlorkami kwasowymi
Grupa karbonylowa chlorków kwasowych, chociaż jest
mniej reaktywna niż grupa karbonylowa aldehydów i
ketonów, przyłącza jednak dwuazometan (i inne
dwuazopochodne alifatyczne) dając dwuazoketon.
Chlorowodór, wydzielający się podczas reakcji, reaguje z
drugą cząsteczką dwuazoalkanu:
O O
-
O
+ + -
R–C + CH
2
=N
2
→R–C–CH
2
–N≡N→HCl + R–C–CH=N=N
Cl Cl
HCl + CH
2
=N
2
→ CH
3
Cl + N
2

4.Addycja do alkenów i
acetylenów
Proste alkeny reagują tylko z odczynnikami elektrofilowymi.
Dieny sprzężone są jednak wrażliwe także na atak
odczynników nukleofilowych. Na przykład butadien daje w
reakcji z diazometanem winylopirazolinę:
H
2
C=CH-CH=CH
2
+H
2
C=N
2
H
2
C-CH-CH=CH
2
| |
H
2
C N
N

Dwuazometan przyłącza się do acetylenu
dając pirozol:
HC ≡CH +CH
2
=N
2
→HC–CH → HC–CH
H
2
C N HC N
N NH
pirazol

5. Rozkład termiczny,
fotochemiczny i katalityczny
Rozkład termiczny dwuazometanu w fazie gazowej lub
fotochemiczny w roztworze prowadzi do metylenu CH2.
Ogrzewając roztwór dwuazometanu w obecności
halogenków boru, estrów kwasu borowego lub miedzi
metalicznej otrzymuje się polimetylen, węglowodór
wielkocząsteczkowy, podobny do polietylenu, ale o
łańcuchu zupełnie nierozgałęzionym. Reakcja przebiega
prawdopodobnie przez szereg reakcji kationowych:
– – +
BF
2
+CH
2
=N
2
→ F
2
B–CH
2
–N=N → F
2
B–CH
2
+N
2
– + – +
F
2
B–CH
2
+CH
2
=N
2
→ F
2
B–CH
2
–CH
2
+N
2
→ itd.

BIBLIOGRAFIA
1.http://www.scribd.com/doc/6621094/Mat
erialy-Do-Wykladu-z-Chemii-
Organicznej
2. C.D. Nenitescu Chemia Organiczna
tom I PWN 1967
Document Outline
- Slajd 1
- Slajd 2
- Slajd 3
- Slajd 4
- Slajd 5
- Slajd 6
- Slajd 7
- Slajd 8
- Slajd 9
- Slajd 10
- Slajd 11
- Slajd 12
- Slajd 13
- Slajd 14
- Slajd 15
- Slajd 16
- Slajd 17
- Slajd 18
- Slajd 19
- Slajd 20
- Slajd 21
Wyszukiwarka
Podobne podstrony:
3a Diazometan i diazoalkany, Wstęp
3b Diazometan i diazoalkany reakcje alkilowania
3b Diazometan i diazoalkany reakcje alkilowania
SI wstep
Zajęcie1 Wstęp
Wstęp do psychopatologii zaburzenia osobowosci materiały
układ naczyniowy wstep
ZMPST Wstep
Dekalog 0 wstęp
1 WSTEP kineza i fizykot (2)
01 AiPP Wstep
wstęp neg
Wyklad I Problemy etyczne Wstep
więcej podobnych podstron