Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
1
BADANIE WYNIKÓW NAUCZANIA Z CHEMII
POZIOM ROZSZERZONY
(CHEMIA NIEORGANICZNA)
Czas pracy 45 minut
Za rozwiązanie wszystkich zadań można otrzymać łącznie 30 punktów.
Zadanie 1. (1 pkt)
1.1
Sód i potas są bardzo aktywnymi metalami, co sprawia, że przechowuje się je w odpowiedni sposób (za-
zwyczaj w zamkniętych naczyniach pod warstwą oleju parafinowego lub nafty). Metale te pozostawione
na powietrzu bardzo szybko pokrywają się jasnym nalotem, a spalane w tlenie tworzą związki o wzorach
Na
2
O
2
i KO
2
.
Uzupełnij poniższe zdania. Wybierz i podkreśl odpowiednie oznaczenie literowe w każdym nawiasie.
A. tlenek
B. nadtlenek
C. ponadtlenek
D. – ½
E. –I
F. –II
Związek o wzorze Na
2
O
2
to ( A , B , C ) sodu, w którym tlen przyjmuje stopień utlenienia ( D , E , F ).
Związek o wzorze KO
2
to ( A , B , C ) potasu, w którym tlen przyjmuje stopień utlenienia ( D , E , F ).
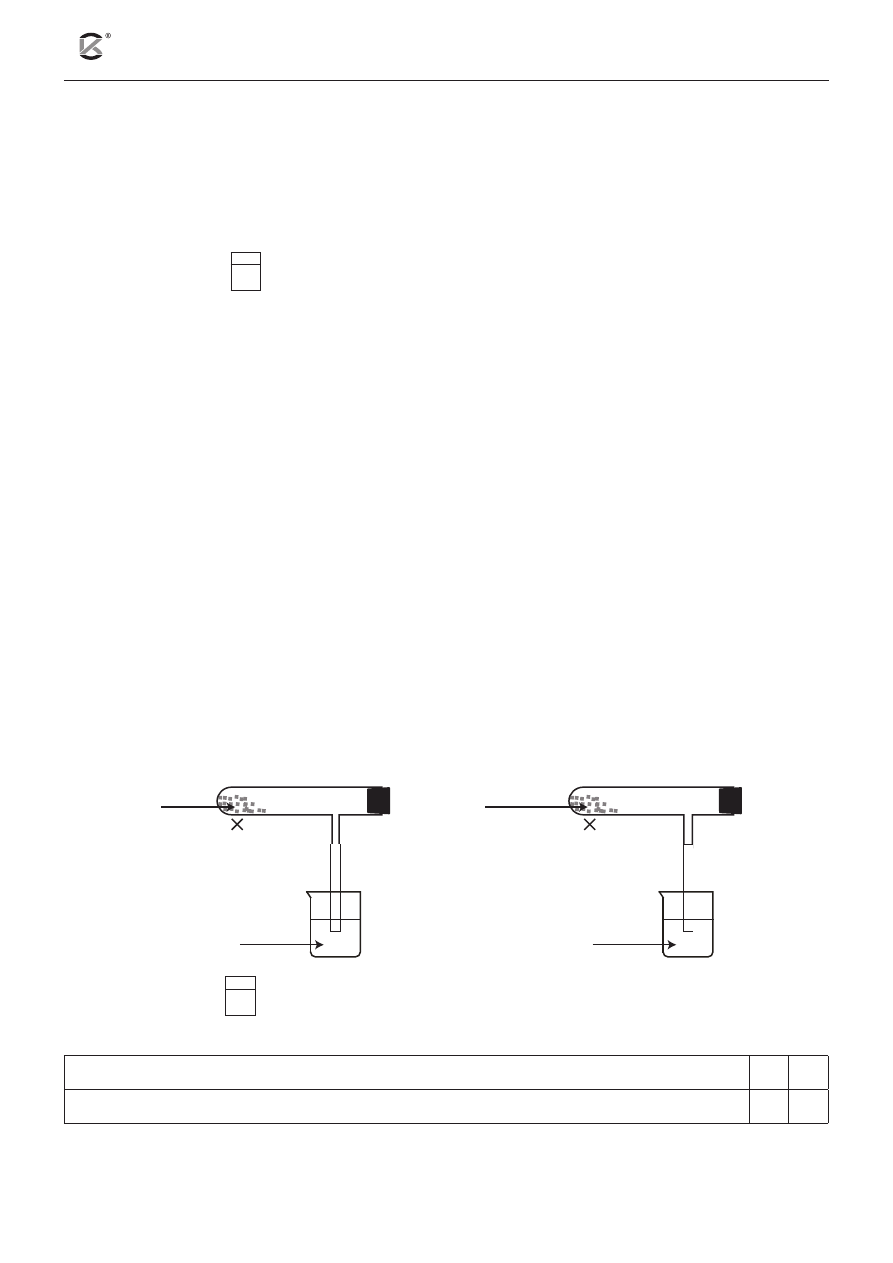
Informacja do zadań 2–3
Przygotowano dwie probówki z bocznym tubusem, do których wsypano rozkruszone kawałki wapienia
i gipsu krystalicznego. Probówki zamknięto szczelnie korkiem, a na tubus nałożono gumowy wężyk, któ-
rego wylot umieszczono w zlewce z wodą wapienną. Zawartości probówek ogrzewano za pomocą palnika.
Opisane doświadczenie ilustruje poniższy schemat.
woda
wapienna
wapień
woda
wapienna
gips
krystaliczny
Zadanie 2 (1 pkt)
2.1
Podkreśl T (tak), jeśli obserwacja jest prawdziwa, lub N (nie) – jeśli jest nieprawdziwa.
W obu probówkach wydziela się bezbarwny gaz, który powoduje mętnienie wody wapiennej. T
N
Na ściankach probówki z gipsem krystalicznym pojawiają się krople bezbarwnej cieczy.
T
N
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
2
Zadanie 3 (2 pkt)
3.1
Napisz (w formie cząsteczkowej) równania reakcji, które zachodzą w probówkach pod wpływem
ogrzewania. Przyjmij, że w sieci krystalicznej produktu reakcji termicznego rozkładu gipsu krysta-
licznego na 2 mole soli przypada 1 mol cząsteczek wody.
Probówka z wapieniem: ................................................................................................................................
Probówka z gipsem krystalicznym: ..............................................................................................................
Informacja do zadań 4–7
W temperaturze pokojowej przeprowadzono doświadczenie, w którym porównano właściwości chemiczne
glinu, tlenku glinu i wodorotlenku glinu.
W tym celu do dziewięciu probówek wprowadzono substraty zgodnie z podanym niżej wykazem:
Probówka 1: Al + H
2
SO
4(stęż.)
Probówka 4: Al
2
O
3
+ H
2
SO
4(rozc.)
Probówka 7: Al(OH)
3
+ H
2
SO
4(rozc.)
Probówka 2: Al + NaOH
(aq)
Probówka 5: Al
2
O
3
+ NaOH
(aq)
Probówka 8: Al(OH)
3
+ NaOH
(aq)
Probówka 3: Al + H
2
O
Probówka 6: Al
2
O
3
+ H
2
O
Probówka 9: Al(OH)
3
+ H
2
O
W niektórych próbach wśród produktów reakcji otrzymano związek koordynacyjny, dla którego przyjmij,
że liczba koordynacji atomu centralnego wynosi 4.
Zadanie 4 (1 pkt)
4.1
Podaj numer lub numery probówek, w których nie zaobserwowano zmian. .........................................
Zadanie 5 (1 pkt)
5.1
Podaj nazwy wszystkich związków zawierających glin, które otrzymano w powyższym doświadczeniu.
.........................................................................................................................................................................
Zadanie 6 (1 pkt)
6.1
Zapisz w formie jonowej skróconej równanie reakcji zachodzącej w probówce, w której zaobserwo-
wano wydzielanie się gazu.
.........................................................................................................................................................................
Zadanie 7 (2 pkt)
7.1
Uzupełnij poniższą tabelę.
Al
Al
2
O
3
Al(OH)
3
Stan skupienia
(temperatura pokojowa)
Barwa
Charakter chemiczny
–
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
3
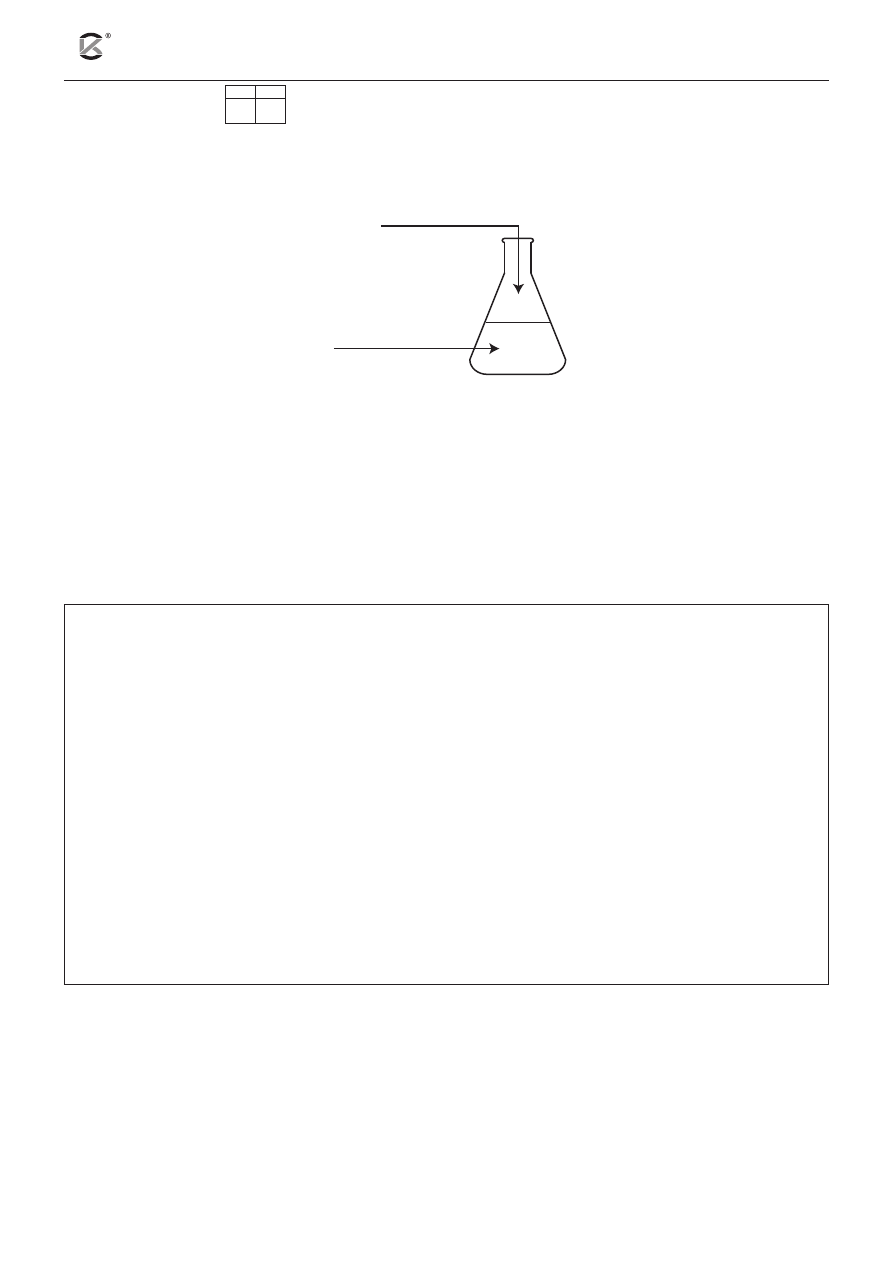
Zadanie 8 (4 pkt)
8.1 8.2
Do 20 cm
3
roztworu pewnej mocnej jednowodorotlenowej zasady YOH o pH = 12, zawierającej doda-
tek alkoholowego roztworu fenoloftaleiny, dodano 200 cm
3
roztworu pewnego słabego jednoprotonowego
kwasu HX o pH = 3. Opisane doświadczenie zilustrowano poniższym schematem:
200 cm
3
HX, pH = 3
20 cm
3
YOH, pH = 12
+ alkoholowy roztwór
fenoloftaleiny
Po dodaniu kwasu do roztworu zasady z dodatkiem fenoloftaleiny zaobserwowano, że malinowa barwa
roztworu w kolbie nie znika. Na podstawie obserwacji postawiono dwie hipotezy:
1. Kwas HX i zasada YOH zostały zmieszane w stosunku niestechiometrycznym, dlatego otrzymany roztwór
ma odczyn zasadowy.
2. Otrzymana w reakcji sól ulega w roztworze wodnym procesowi hydrolizy anionowej.
a) Zweryfikuj hipotezę 1, wykonując odpowiednie obliczenia. Uzasadnij swoją opinię przez podkreś
lenie właściwego zwrotu w nawiasie i dokończenie zdania.
Obliczenia:
Hipoteza 1 ( była / nie była ) poprawna, ponieważ .....................................................................................
.........................................................................................................................................................................
b) Zweryfikuj hipotezę 2. Używając symbolicznych wzorów, podaj zapis procesu (w formie jonowej
skróconej), jakiemu ulega otrzymana w doświadczeniu sól.
Hipoteza 2 ( była / nie była ) poprawna.
.........................................................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
4
Zadanie 9 (1 pkt)
9.1
Fragment sieci krystalicznej diamentu
Fragment sieci krystalicznej grafitu
Korzystając ze swojej wiedzy oraz z rysunków przedstawiających fragmenty sieci krystalicznej dia
mentu i grafi tu, oceń poprawność poniższych zdań. Podkreśl T (tak), jeśli zdanie jest prawdziwe, lub
N (nie) – jeśli jest nieprawdziwe.
Diament i grafi t to odmiany alotropowe węgla.
T
N
Typ hybrydyzacji orbitali atomów węgla w diamencie to sp
3
, zaś w grafi cie – sp.
T
N
Diament i grafi t tworzą kryształy kowalencyjne.
T
N
Zadanie 10 (2 pkt)
10.1 10.2
Uzupełnij poniższe zdania dotyczące budowy i właściwości amoniaku. W każdym nawiasie wybierz
i podkreśl właściwą odpowiedź.
a) Cząsteczka tego związku wykazuje wypadkowy moment dipolowy ( µ = 0 , µ ≠ 0 ).
Cząsteczka tego związku ma budowę ( polarną , niepolarną ).
Kąt między wiązaniami w cząsteczce tego związku wynosi w przybliżeniu ( 180º , 109º , 107º ).
b) Związek ten w warunkach normalnych jest ( ciałem stałym , cieczą , gazem ) i ( dobrze , słabo ) roz-
puszcza się w wodzie.
Ma charakter ( kwasowy , obojętny , zasadowy ).
Zadanie 11 (2 pkt)
11.1
Poniżej podano wzory sumaryczne pięciu substancji gazowych otrzymywanych w pracowni laboratoryjnej.
N
2
Cl
2
SO
2
CH
4
NH
3
Spośród wymienionych gazów wybierz i zapisz wzory tych, które mogą być zbierane poniższymi
sposobami.
H
2
O
Sposób 1
Sposób 2
..............................................................
.......................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
5
Informacja do zadań 12–13
Wszystkie fluorowce reagują z wodorem, tworząc fluorowcowodory. W poniższej tabeli podano masy mo-
lowe, temperatury wrzenia (pod ciśnieniem 1013 hPa) oraz długości wiązań dla odpowiednich fluorowco-
wodorów:
Wzór związku
Masa molowa, g ∙ mol
–1
Temperatura wrzenia, ºC
Długość wiązania, pm
HF
20
19,9
91,7
HCl
36,5
– 85,2
127,4
HBr
81
– 67,2
141,4
HI
128
– 35,2
160,9
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Fluorowcowodory wprowadzone do wody tworzą odpowiednie kwasy beztlenowe.
Zadanie 12 (1 pkt)
12.1
Wyjaśnij, dlaczego fluorowodór (pomimo najmniejszej masy molowej) ma najwyższą temperaturę
wrzenia w porównaniu z innymi fluorowcowodorami.
.........................................................................................................................................................................
.........................................................................................................................................................................
Zadanie 13 (1 pkt)
13.1
W podanym zdaniu wybierz i podkreśl odpowiedni wzór lub sformułowanie.
Najmocniejszym kwasem beztlenowym fluorowców jest ( HF , HCl , HBr , HI ), ponieważ wiązanie w czą-
steczce tego kwasu jest ( najdłuższe , najkrótsze ) i dlatego ( najłatwiej , najtrudniej ) ulega rozerwaniu.
Zadanie 14 (1 pkt)
14.1
W trzech nieoznakowanych probówkach umieszczono wodne roztwory soli: węglanu sodu, azotanu(V)
baru i siarczku amonu o tym samym stężeniu.
Z podanego niżej spisu odczynników wybierz i podkreśl wzór tego, który umożliwi jednoznaczną
identyfikację badanych soli. Napisz w tabeli obserwacje potwierdzające obecność tych soli w anali-
zowanych roztworach.
Roztwory wodne substancji:
KOH
HCl
MgCl
2
Obserwacje dla probówki zawierającej roztwór
Na
2
CO
3
Ba(NO
3
)
2
(NH
4
)
2
S
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
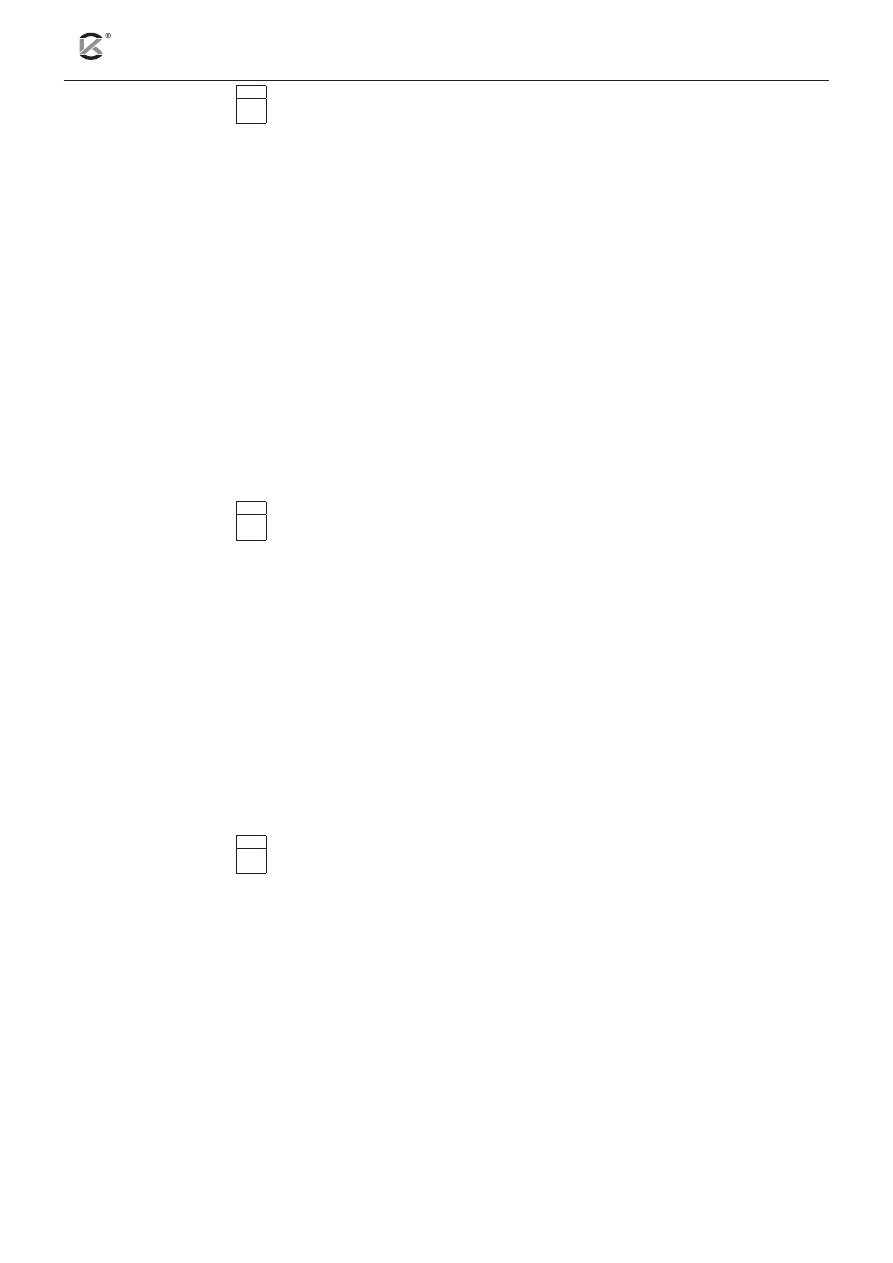
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
6
Zadanie 15 (1 pkt)
15.1
W roztworze pomiędzy jonami chromianowymi(VI) i dichromianowymi(VI) ustalił się stan równowagi
chemicznej:
2CrO
4
2–
+ H
2
O →
← Cr
2
O
7
2–
+ 2OH
–
Uczeń chciał doświadczalnie sprawdzić, w jaki sposób dodatek kwasu wpłynie na stan równowagi powyż-
szej reakcji.
Uzupełnij poniższą obserwację poprzez podkreślenie odpowiedniego słowa. Odpowiedź uzasadnij,
odnosząc się do reguły przekory.
Po dodaniu kwasu otrzymano ( żółty , zielony , pomarańczowy ) roztwór.
Uzasadnienie obserwacji: ..............................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
Zadanie 16 (2 pkt)
16.1
Poniżej przedstawiono równanie pewnej reakcji chemicznej:
3K
2
MnO
4
+ 2H
2
SO
4
→ MnO
2
+ 2KMnO
4
+ 2K
2
SO
4
+ 2H
2
O
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis
jonowoelektronowy) równanie reakcji redukcji i równanie reakcji utleniania zachodzących podczas
tej przemiany.
Równanie reakcji redukcji: ............................................................................................................................
Równanie reakcji utleniania: .........................................................................................................................
Zadanie 17 (1 pkt)
17.1
Żelazo jest znanym już od starożytności metalem o ogromnym znaczeniu gospodarczym.
W suchym powietrzu żelazo nie ulega zmianom. Jego powierzchnia jest bowiem pokryta cienką warstew-
ką, która dzięki swojej szczelności stanowi wystarczająca ochronę przed działaniem tlenu atmosferycz-
nego. Warstewka taka w razie uszkodzenia mechanicznego, np. zadrapania powierzchni, regeneruje się
samoczynnie na skutek reakcji świeżej, odsłoniętej powierzchni z zawartym w powietrzu tlenem.
W zetknięciu z roztworem elektrolitów oraz w wilgotnym powietrzu stopniowo przemienia się w miesza-
ninę uwodnionych tlenków, węglanów i innych soli.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Podaj nazwy dwóch procesów, o których mowa w powyższym opisie.
Nazwy procesów: ..........................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
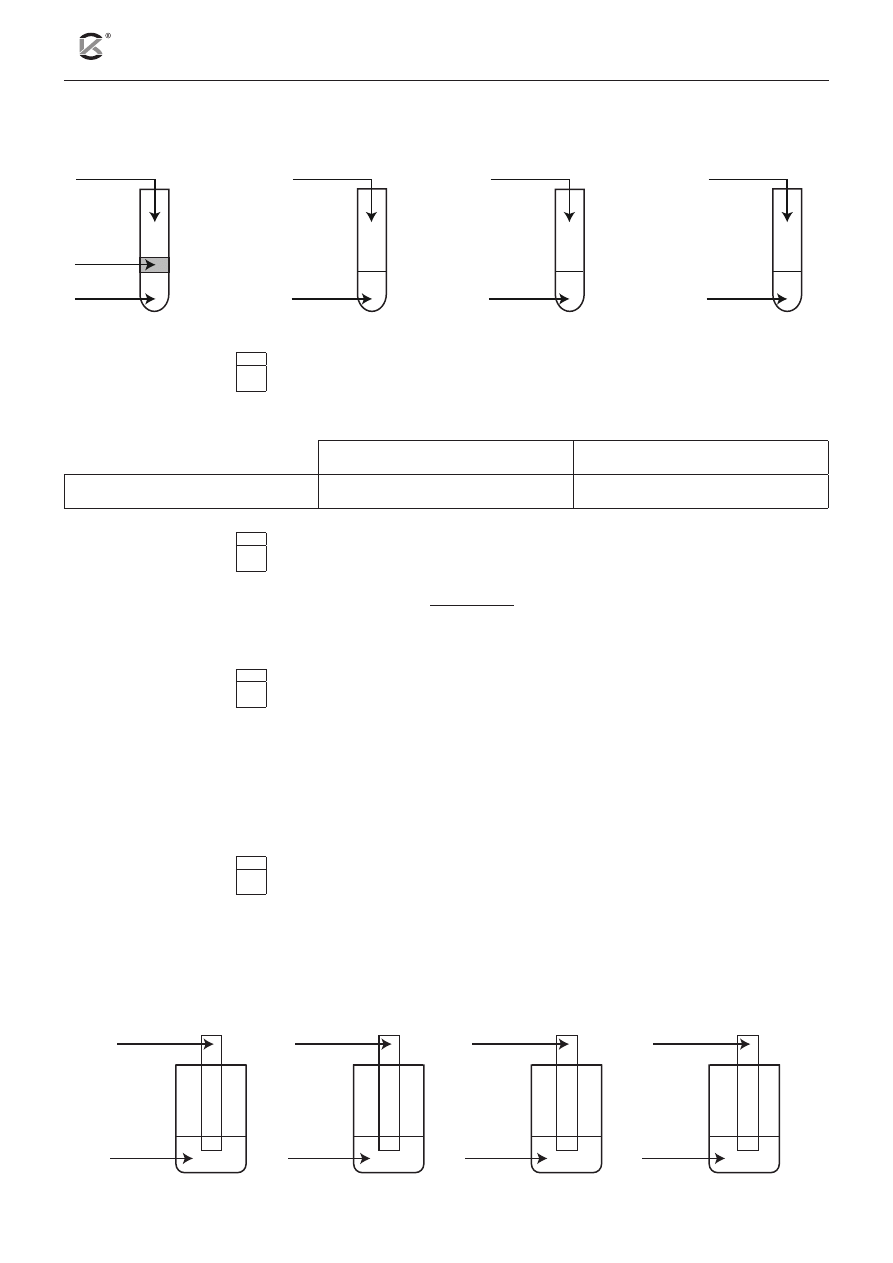
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S.K.A., Kraków 2014
Z
K
am or
7
Informacja do zadań 18–20
Przeprowadzono doświadczenie zilustrowane poniższym schematem:
NaOH
(aq)
parafina
1.
2.
FeCl
2(aq)
NaOH
(aq)
FeCl
2(aq)
2. 3% H
2
O
2
1. NaOH
(aq)
NaOH
(aq)
FeCl
2(aq)
FeCl
3(aq)
3.
4.
Zadanie 18 (1 pkt)
18.1
Uzupełnij poniższą tabelę, wpisując barwy użytych roztworów soli żelaza.
Roztwór FeCl
2
Roztwór FeCl
3
Barwa
Zadanie 19 (1 pkt)
19.1
Podaj numer lub numery probówek, w których ostatecznie otrzymano czerwonobrunatny osad.
...........................................................................
Zadanie 20 (2 pkt)
20.1
Zapisz w formie cząsteczkowej równania reakcji zachodzących w probówce oznaczonej numerem 3.
1. ....................................................................................................................................................................
2. ....................................................................................................................................................................
Zadanie 21 (1 pkt)
21.1
W roztworze soli zanurzono metalową płytkę. Po pewnym czasie płytkę wyjęto z roztworu, osuszono i za-
notowano obserwacje.
Obserwacje: Na srebrzystoszarej płytce pojawiły się ubytki i osadził się czerwonobrunatny nalot, a roztwór
się odbarwił.
Wybierz i zaznacz schemat, który przedstawia opisane wyżej doświadczenie.
A.
B.
C.
D.
Ag
CuSO
4(aq)
AgNO
3(aq)
AgNO
3(aq)
CuSO
4(aq)
Cu
Al
Fe
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Wyszukiwarka
Podobne podstrony:
chemia ogolna arkusz r 1 1391852832
chemia ogolna arkusz r 1 1391852832
I Chemia, Nieorganiczna, chemia2, Arkusze powtórzeniowe, Pobieranie1, studia 1.2, testy (Batonix91)
CHEMIA NIEORGANICZNA 2
Chemia nieorganiczna zadania 4 Nieznany
Chemia nieorganiczna zadania 7 Nieznany
KationyV, Farmacja, I rok, Chemia nieorganiczna
egz 2010-pytania spisane(1), Chemia nieorganiczna- egzmain
Tlenowce(1), Chemia, Chemia nieorganiczna
testy chemia2, Biotechnologia PŁ, chemia nieorganiczna
CHEMIA KOSMETYCZNA Chemia nieorganiczna (tlenki, kwasy, sole
Chemia nieorganiczna egzamin
Chemia nieorganiczna sciaga
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
2002, matura 2002 Chemia rozszerzona arkusz2 odpowiedzi
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
odp test 1, 1 ROK Biologia i geologia, spec.Ochrona przyrody, Chemia nieorganiczna
nieorgany-pytania2, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA labora
więcej podobnych podstron