Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
1
BADANIE WYNIKÓW NAUCZANIA Z CHEMII
POZIOM ROZSZERZONY
(CHEMIA OGÓLNA)
Czas pracy 45 minut
Za rozwiązanie wszystkich zadań można otrzymać łącznie 30 punktów.
Zadanie 1. (1 pkt)
1.1
Stanem podstawowym atomu określa się stan charakteryzujący się najmniejszą energią.
Dostarczenie energii do atomu może spowodować przeniesienie elektronu lub elektronów z niższych po-
ziomów energetycznych na wyższe – wówczas atom przechodzi w tzw. stan wzbudzony, który charaktery-
zuje wyższa energia (i mniejsza trwałość) w porównaniu ze stanem podstawowym atomu.
Poniżej przedstawiono zapisy czterech konfiguracji elektronowych:
A. 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
3d
5
B. 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
5
C. 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
3d
6
D. 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
3d
10
Uzupełnij poniższe zdanie. W tym celu wybierz i wpisz odpowiednie oznaczenie literowe (A–D).
Konfigurację elektronową atomu w stanie podstawowym przedstawia zapis: ............................................. .
Zadanie 2. (2 pkt)
2.1 2.2
Uzupełnij poniższe zdania. W tym celu wybierz i pokreśl odpowiednie sformułowania w każdym
nawiasie.
a) Gal to pierwiastek należący do bloku energetycznego ( s , p , d ). Podczas tworzenia trójdodatniego jonu
atom galu oddaje ( 1 elektron z poziomu 4p i 2 elektrony z poziomu 3d,
1 elektron z poziomu o najwyższej energii 4p i 2 elektrony z poziomu 4s,
2 elektrony z poziomu o najwyższej energii 4s i 1 elektron z poziomu 4p ).
b) Trójdodatni kation żelaza tworzy ( 2 , 3 , 4 ) powłoki elektronowe. Podczas tworzenia trójdodatniego
jonu atom żelaza oddaje ( 3 elektrony z poziomu o najwyższej energii 3d,
3 elektrony z poziomu o najniższej energii 3d,
2 elektrony z poziomu 4s i 1 elektron z poziomu 3d ).
Zadanie 3. (1 pkt)
3.1
Oceń prawdziwość poniższych zdań dotyczących budowy cząsteczki tlenku siarki(IV). Uzupełnij ta-
belę, wpisując literę P, jeżeli zdanie jest prawdziwe, lub literę F, jeżeli jest fałszywe.
P / F
W cząsteczce SO
2
pomiędzy atomami tworzą się 2 wiązania typu σ i 1 wiązanie typu �.
Orbitale atomu siarki w cząsteczce SO
2
wykazują hybrydyzację typu sp.
Cząsteczka SO
2
ma kształt liniowy.
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
2
Zadanie 4. (3 pkt)
4.1 4.2
Poniżej podano symbole wybranych pierwiastków należących do trzeciego okresu.
Na Mg Al Si P S Cl
a) Oceń, jak zmieniają się podane niżej wielkości i właściwości tych pierwiastków wraz z malejącą
liczbą atomową. Podkreśl właściwe oznaczenie literowe.
A. rośnie
B. maleje
I. Promień atomowy
A / B
II. Właściwości niemetaliczne
A / B
III. Właściwości zasadowe tlenków tych pierwiastków
A / B
IV. Maksymalna wartościowość względem tlenu
A / B
Pierwsza energia jonizacji to minimalna energia potrzebna do oderwania jednego elektronu od obojętnego
atomu.
b) Uzupełnij poniższe zdanie, podkreślając odpowiedni wyraz. Na podstawie swojej wiedzy na temat
budowy atomu, wyjaśnij przyczynę zmian wartości pierwszej energii jonizacji dla wymienionych
pierwiastków.
Dla wybranych pierwiastków należących do trzeciego okresu wraz z malejącą liczbą atomową wartość
pierwszej energii jonizacji ( rośnie , maleje ), ponieważ ...............................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
Zadanie 5. (2 pkt)
5.1
Spośród wymienionych niżej substancji wybierz wszystkie, które spełniają podane w tabeli warunki,
i wpisz ich symbole lub wzory w odpowiednie miejsca.
KCl
(s)
H
3
PO
4(s)
Ag
(s)
NaOH
(s)
C
(diament)
Charakterystyka
Symbol lub wzór substancji
Dobrze rozpuszcza się w wodzie.
W stałym stanie skupienia przewodzi prąd elektryczny.
Po rozpuszczeniu w wodzie przewodzi prąd elektryczny.
Tworzy kryształy metaliczne.
Tworzy kryształy jonowe.
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
3
Zadanie 6. (3 pkt)
6.1 6.2
Aby ośrodek materialny mógł przewodzić prąd elektryczny, musi zawierać nośniki ładunku w postaci elek-
tronów lub jonów, które muszą mieć zdolność poruszania się w ośrodku.
Wartość przewodnictwa roztworu (η) zależy od stężenia i temperatury, lecz przede wszystkim – od charak-
teru chemicznego substancji rozpuszczonej (jej zdolności do dysocjacji na jony) i od rodzaju rozpuszczal-
nika. Z reguły elektrolity mocne lepiej przewodzą prąd elektryczny niż elektrolity słabe.
Na podstawie: K. Pigoń, Z. Ruziewicz, Chemia fizyczna, PWN, Warszawa 2007.
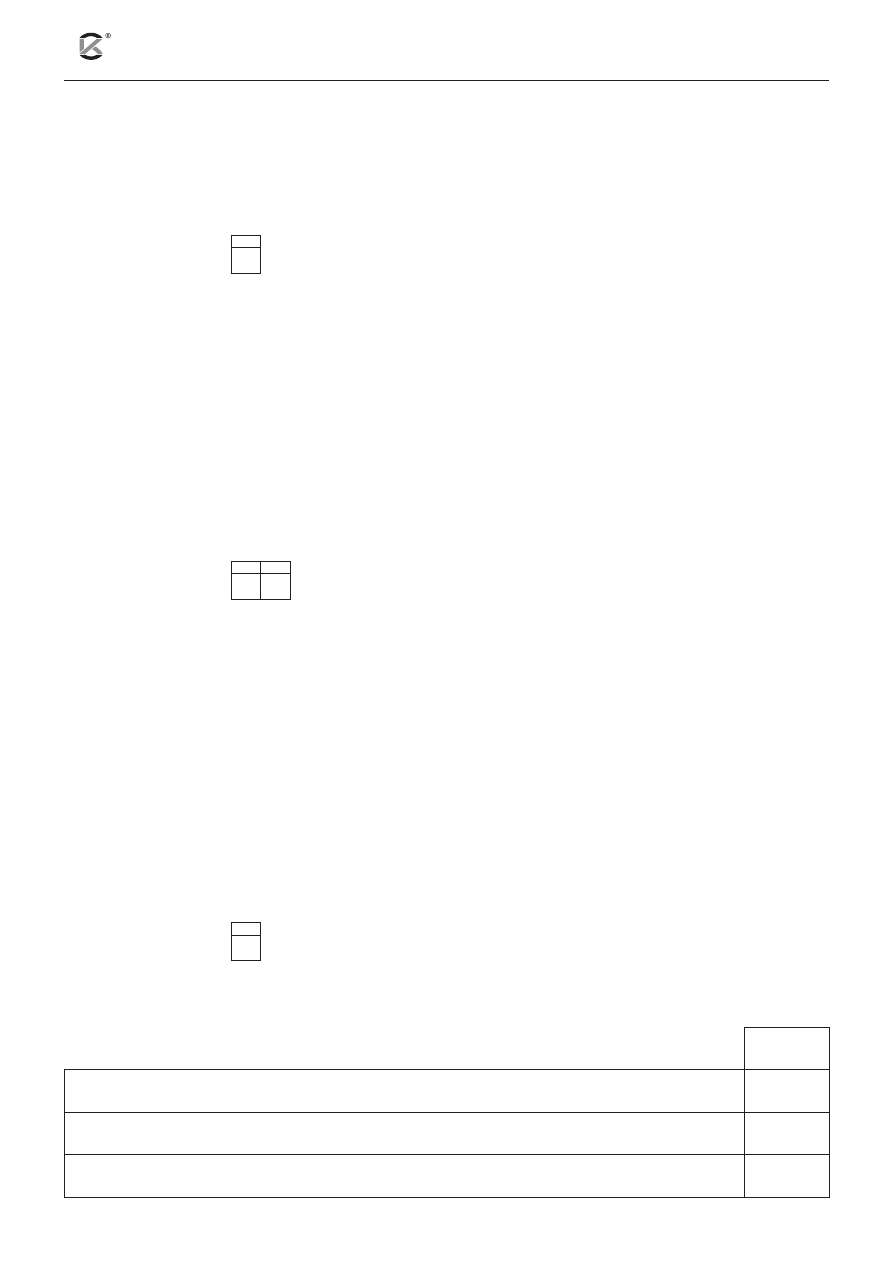
Przeprowadzono dwa doświadczenia w temperaturze T. Podczas pierwszego doświadczenia do kwasu sol-
nego dodawano kroplami wodny roztwór wodorotlenku sodu, a podczas drugiego doświadczenia do roztwo-
ru kwasu siarkowego(VI) dodawano kroplami wodny roztwór wodorotlenku baru. W obu przypadkach mie-
rzono przewodnictwo mieszaniny reakcyjnej. Przebieg doświadczeń zilustrowano poniższym schematem.
V
zasady
, cm
3
NaOH
(aq)
c = 0,1 mol/dm
3
HCl
(aq)
c = 0,1 mol/dm
3
wykres A
przewodnictwo
V
zasady
, cm
3
wykres B
przewodnictwo
Ba(OH)
2(aq)
c = 0,1 mol/dm
3
H
2
SO
4(aq)
c = 0,1 mol/dm
3
Zapisz równania reakcji (w formie cząsteczkowej), jakie zachodzą w obu zlewkach. Na tej podstawie
wskaż wykres (A lub B), który przedstawia wyniki doświadczenia z użyciem kwasu siarkowego(VI).
Uzasadnij wybór.
Zlewka z kwasem solnym: .............................................................................................................................
Zlewka z kwasem siarkowym(VI): ................................................................................................................
Wykres przedstawiający wyniki doświadczenia z użyciem kwasu siarkowego(VI) jest oznaczony literą ...... .
Uzasadnienie wyboru: ....................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
4
Zadanie 7. (1 pkt)
7.1
Odważkę hydratu chlorku baru o wzorze BaCl
2
∙ 4H
2
O i masie 1,4 g wsypano do kolby miarowej o pojem-
ności 100 cm
3
i wlano niewielką ilość wody destylowanej. Zawartość kolby wymieszano w celu rozpusz-
czenia hydratu, po czym dodano wodę destylowaną (do kreski) i otrzymano roztwór o gęstości 1,2 g/cm
3
.
Zadaniem uczniów było obliczenie stężenia procentowego otrzymanego roztworu chlorku baru. Mieli oni
podać wynik z dokładnością do drugiego miejsca po przecinku.
Poniżej przedstawiono rozwiązania sześciu uczniów, które następnie poddano analizie i ocenie.
Uczeń
Sposób rozwiązania
I
m = 1,2 g/cm
3
∙ 100 cm
3
= 120 g
m
r
= 120 g + 1,4 g = 121,4 g
m
s
= 1,4 g
1,4 g — 121,4 g
x — 100 g
x = 1,15 g
C
p
= 1,15%
II
m
r
= 1,2 g/cm
3
∙ 100 cm
3
= 120 g
m
s
= 1,4 g
1,4 g — 120 g
x — 100 g
x = 1,17 g
C
p
= 1,17%
III
m
r
= 1,2 g/cm
3
∙ 100 cm
3
= 120 g
280 g hydratu – 208 g BaCl
2
1,4 g
– m
s
m
s
= 1,04 g
1,04 g — 120 g
x — 100 g
x = 0,87 g
C
p
= 0,87%
IV
m = 1,2 g/cm
3
∙ 100 cm
3
= 120 g
280 g hydratu – 208 g BaCl
2
m
r
= 120 g + 1,4 g = 121,4 g
1,4 g
– m
s
m
s
= 1,04 g
1,04 g — 121,4 g
x — 100 g
x = 0,86 g
C
p
= 0,86%
V
m = 1,2 g/cm
3
∙ 100 cm
3
= 120 g
m
r
= 120 g + 1,4 g = 121,4 g
m
s
= 1,4 g
C
p
g
g
=
⋅
=
1 4
121 4
100
1 2
,
,
% , %
VI
m
r
= 1,2 g/cm
3
∙ 100 cm
3
= 120 g
280 g hydratu – 208 g BaCl
2
1,4 g
– m
s
m
s
= 1,04 g
C
p
g
g
=
⋅
=
1 04
120
100
0 9
,
%
, %
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
5
Przeczytaj poniższy tekst. Uzupełnij luki, wpisując numery uczniów (I–VI), do których odnoszą się
poszczególne stwierdzenia.
Tylko rozwiązanie ucznia oznaczonego numerem ___ nie zawiera błędów. Uczeń ten prawidłowo powiązał
dane z szukaną, poprawnie obliczył masę substancji i masę roztworu, nie popełnił błędów rachunkowych
i podał wynik ze wskazaną dokładnością.
Uczeń oznaczony numerem ___ zastosował poprawną metodę rozwiązania zadania, poprawnie wykonał
obliczenia, jednak wynik końcowy podał z inną niż wymagana dokładnością.
Poprawnie obliczoną masę substancji, lecz błędnie wyznaczoną masę roztworu uzyskał uczeń oznaczony
numerem ___. Z kolei uczeń oznaczony numerem ___ poprawnie obliczył masę roztworu, ale błędnie zin-
terpretował masę substancji.
Najwięcej błędów popełniło dwóch uczniów. W niewłaściwy sposób obliczyli oni masę roztworu oraz
błędnie zinterpretowali masę substancji, przy czym jeden z nich, oznaczony numerem ___, podał wynik
końcowy ze wskazaną dokładnością, podczas gdy uczeń oznaczony numerem ___ również i w tym miejscu
popełnił błąd.
Zadanie 8. (2 pkt)
8.1
Przeprowadzono reakcję termicznego rozkładu węglanu wapnia, opisaną poniższym równaniem:
CaCO
3(s)
ogrzewanie
CaO
(s)
+ CO
2(g)
W otwartym naczyniu ogrzewano 60 g węglanu wapnia. Po pewnym czasie przerwano ogrzewanie i zwa-
żono mieszaninę. Okazało się, że masa stałej pozostałości wynosiła 52 g.
Oblicz, ile procent węglanu wapnia uległo rozkładowi. Wynik podaj z dokładnością do pierwszego
miejsca po przecinku.
Obliczenia:
Odpowiedź: ................................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
6
Zadanie 9. (1 pkt)
9.1
Podczas przepuszczania tlenku siarki(IV) przez wodę zachodzą procesy, które ilustrują poniższe zapisy:
SO
2
+ 2H
2
O →
← HSO
3
–
+ H
3
O
+
HSO
3
–
+ H
2
O →
← SO
3
2–
+ H
3
O
+
Na podstawie podanych równań oceń poprawność poniższych zdań. Podkreśl T (tak), jeśli zdanie jest
prawdziwe, lub N (nie), jeśli jest nieprawdziwe.
SO
2
jest zasadą w teorii Brönsteda.
T
N
HSO
3
–
jest kwasem w teorii Brönsteda.
T
N
Zadanie 10. (2 pkt)
10.1 10.2
W tabeli podano wartości pK dla wybranych kwasów jednoprotonowych.
Wzór kwasu
pK
Na podstawie: A. Bielański,
Podstawy chemii nieorganicznej, PWN, Warszawa 2004.
I
HClO
7,3
II
HClO
3
–1
III
HNO
2
3,7
Przygotowano roztwory powyższych kwasów o jednakowym stężeniu.
Uzupełnij zdania, wpisując w wolne miejsca odpowiednie numery.
a) W roztworach o jednakowym stężeniu najwyższą wartość stopnia dysocjacji wykazuje kwas oznaczony
numerem ...................
b) Najwyższą wartość pH wykazuje roztwór kwasu oznaczonego numerem .......................
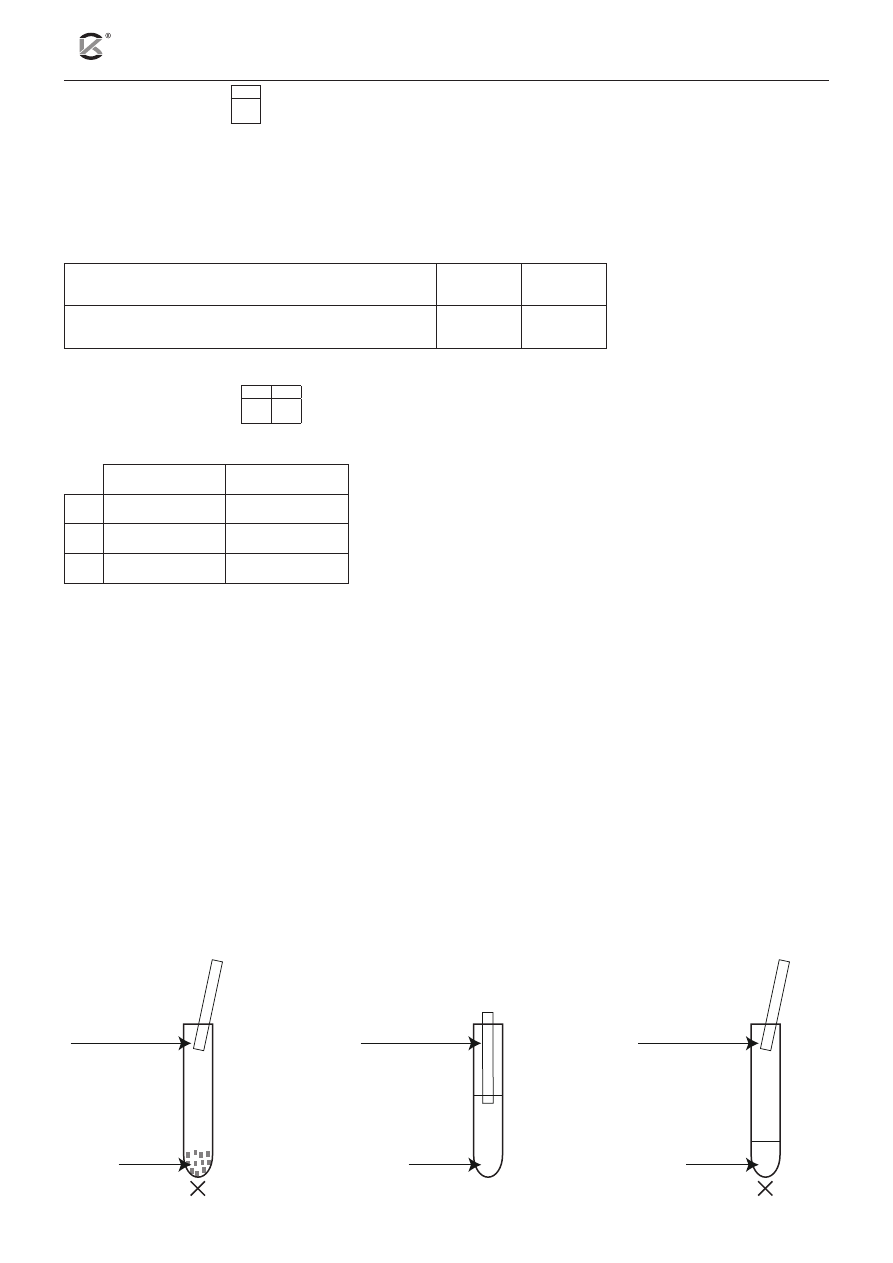
Informacja do zadań 11–13
Przeprowadzono trzy doświadczenia, w których jako substrat użyto chlorku amonu. Poniżej przedstawiono
schematy tych doświadczeń.
NH
4
Cl
(s)
zwilżony wodą
uniwersalny
papierek
wskaźnikowy
doświadczenie 1
doświadczenie 2
doświadczenie 3
NH
4
Cl
(aq)
uniwersalny
papierek
wskaźnikowy
NH
4
Cl
(aq)
+
NaOH
(aq)
zwilżony wodą
uniwersalny
papierek
wskaźnikowy
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
7
Zadanie 11. (1 pkt)
11.1
Na podstawie doświadczenia numer 1 uczeń sformułował obserwacje i wnioski.
Podkreśl T (tak), jeśli obserwacja lub wniosek są prawdziwe, lub N (nie), jeśli są nieprawdziwe.
Obserwacja: Papierek uniwersalny barwi się na zielononiebiesko.
T
N
Wniosek: Tylko amoniak (otrzymany w wyniku termicznego rozkładu soli)
– jako gaz o gęstości mniejszej od gęstości powietrza – unosi się do wylotu
probówki, a powstałe w procesie dysocjacji elektrolitycznej amoniaku jony
wodorotlenkowe powodują zmianę barwy wskaźnika.
T
N
Zadanie 12. (1 pkt)
12.1
Dla doświadczenia numer 2 wybierz odpowiednią obserwację oraz poprawny wniosek.
Uniwersalny
papierek
wskaźnikowy
A barwi się na zielononiebiesko
ponieważ
I w procesie dysocjacji elektrolitycznej
soli powstają jony Cl
–
.
B barwi się na czerwono
II w procesie hydrolizy soli powstają
jony OH
–
.
C nie zmienia zabarwienia
III w procesie hydrolizy soli powstają
jony H
+
.
Zadanie 13. (2 pkt)
13.1
Napisz w formie jonowej skróconej równania reakcji zachodzących podczas doświadczenia numer 3.
a) Równanie reakcji zachodzącej po zmieszaniu substratów i ogrzaniu: .......................................................
b) Równanie procesu odpowiadającego za zmianę barwy papierka: .............................................................
Zadanie 14. (2 pkt)
14.1
Wyznaczony w warunkach standardowych efekt cieplny reakcji syntezy jodowodoru z pierwiastków:
H
2(g)
+ I
2(s)
→ 2HI
(g)
wynosi: ∆H
o
= 52 kJ
Uzupełnij poniższe zdania, podkreślając w każdym nawiasie odpowiednie sformułowanie.
a) Reakcja syntezy jodowodoru z pierwiastków jest procesem ( endoenergetycznym , egzoenergetycznym ).
Na podstawie podanej wartości entalpii reakcji można stwierdzić, że energia ( substratów , produktów )
jest niższa od energii ( substratów , produktów ).
b) Podczas syntezy jednego mola cząsteczek jodowodoru ( wydzieli się , należy dostarczyć )
( 26 kJ , 104 kJ ) energii.
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b

Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
8
Informacja do zadań 15–16
Dla hipotetycznej reakcji przebiegającej w fazie gazowej zgodnie z równaniem: A
2
+ 3B
2
→
← 2AB
3
zbadano wpływ temperatury na wartość stężeniowej stałej równowagi reakcji K
c
. Wyniki zanotowano w tabeli:
Temperatura, K
300
400
500
Wartość stałej równowagi (K
c
)
10
5
10
3
10
Zadanie 15. (1 pkt)
15.1
Napisz, czy reakcja syntezy AB
3
jest reakcją egzoenergetyczną czy endoenergetyczną. Odpowiedź
uzasadnij, odwołując się do reguły przekory.
Reakcja syntezy AB
3
jest reakcją ....................................................
Uzasadnienie ...................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
Zadanie 16. (2 pkt)
16.1 16.2
W temperaturze 127ºC do naczynia o pojemności 10 dm
3
wprowadzono po 0,2 mola reagentów A
2
, B
2
i AB
3
.
Pewien uczeń sformułował następującą hipotezę: „Przy podanych parametrach pomiaru układ znajduje się
w stanie równowagi”.
Zweryfikuj podaną hipotezę, wykonując odpowiednie obliczenia. Następnie uzupełnij poniższe zda-
nie przez podkreślenie właściwego sformułowania w każdym nawiasie.
Obliczenia:
Hipoteza ( była , nie była ) poprawna.
Przy podanych parametrach ( stan równowagi reakcji przesunie się w prawo,
stan równowagi reakcji przesunie się w lewo,
układ znajduje się w stanie równowagi ).
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor spółka z ograniczoną odpowiedzialnością S. K. A., Kraków 2013
Z
K
am or
9
Zadanie 17. (2 pkt)
17.1 17.2
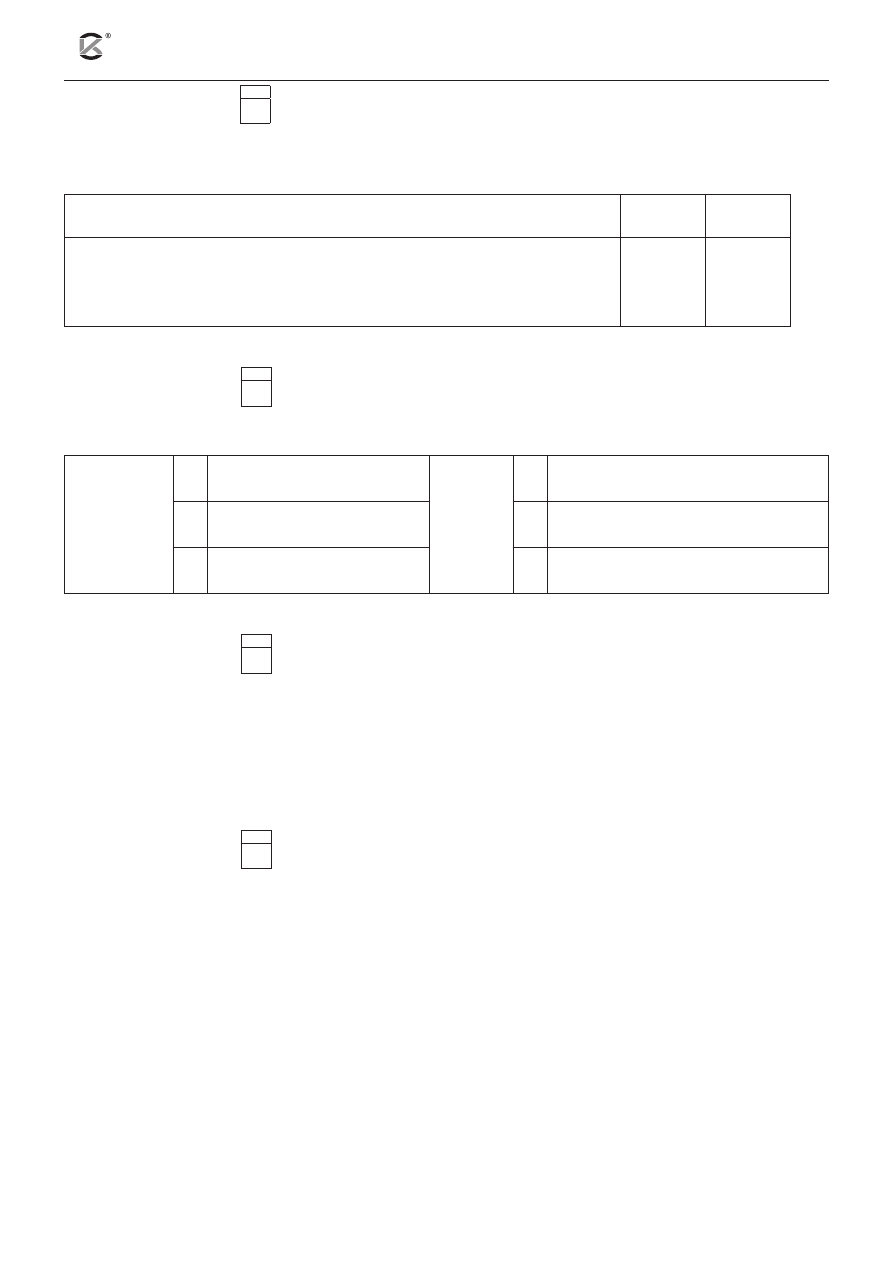
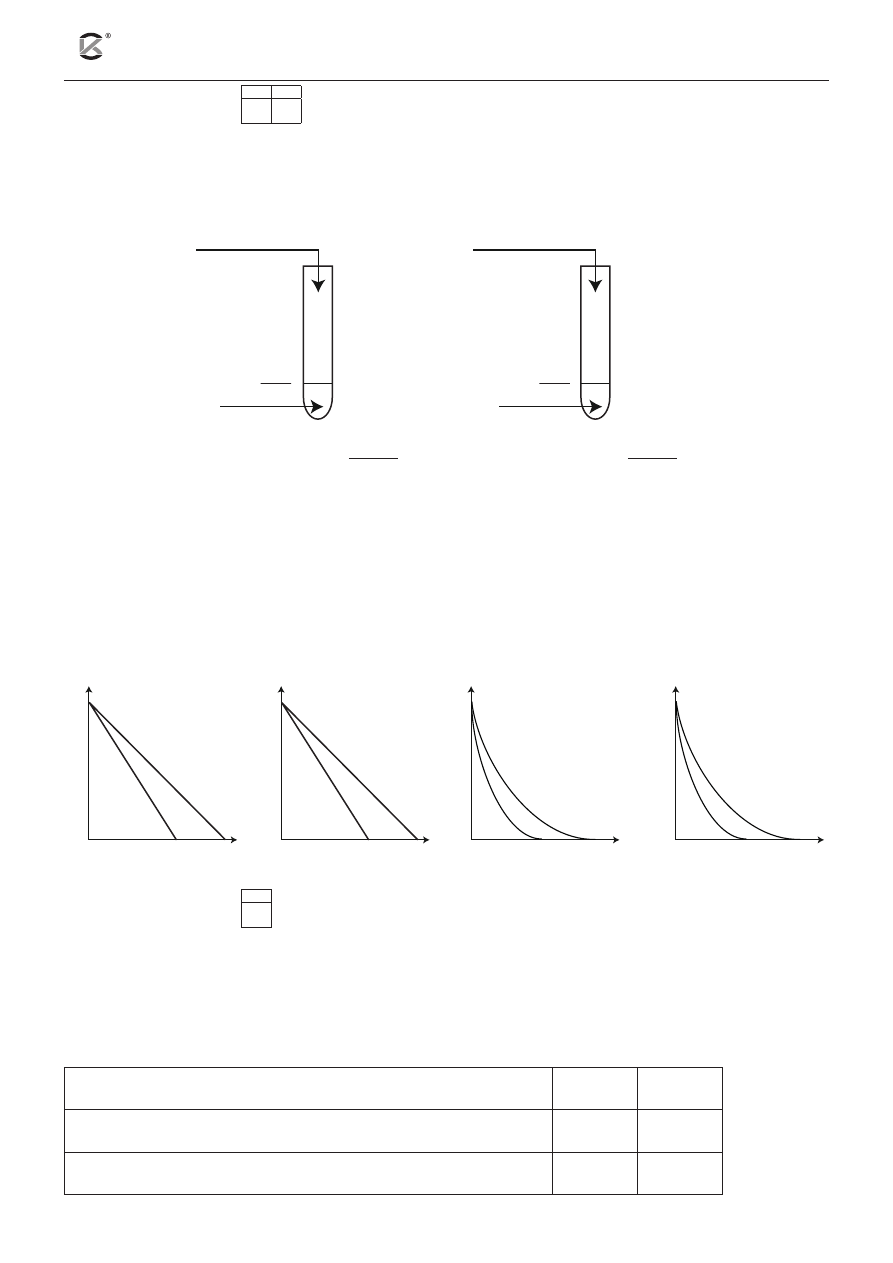
Przeprowadzono doświadczenie zilustrowane na poniższym schemacie. Substratom przypisano symbolicz-
ne oznaczenia X i HY. Pomiaru szybkości obydwu reakcji dokonano w tym samym czasie.
probówka 1
probówka 2
1 g X (wiórki)
t = 40ºC
1 g X (wiórki)
υ =
⋅
20
3
mol
dm s
t = ?
υ =
⋅
10
3
mol
dm s
HY
(aq)
c = 1
3
mol
dm
HY
(aq)
c = 1
3
mol
dm
a) Uzupełnij poniższe zdanie. W tym celu wybierz i podkreśl odpowiednią wartość temperatury.
W probówce oznaczonej numerem 2 pomiar szybkości reakcji przeprowadzono w temperaturze
( 20ºC , 30ºC , 50ºC , 80ºC ).
b) Wskaż, który wykres przedstawia zależność zmiany stężeń substratów od czasu dla reakcji w pro-
bówkach 1 i 2.
czas, s
A
stężenie, mol
∙ dm
–3
czas, s
C
stężenie, mol
∙ dm
–3
czas, s
1
2
2
1
2
1
B
stężenie, mol
∙ dm
–3
czas, s
D
stężenie, mol
∙ dm
–3
2
1
Zadanie 18. (1 pkt)
18.1
Na podstawie podanego niżej równania reakcji utleniania i redukcji:
4Zn + 10HNO
3
→ 4Zn(NO
3
)
2
+ NH
4
NO
3
+ 3H
2
O
oceń prawdziwość poniższych zdań. Podkreśl T (tak), jeśli podane zdanie jest prawdziwe, lub N (nie),
jeśli jest nieprawdziwe.
Azot z V stopnia utlenienia przechodzi na –III stopień utlenienia.
T
N
Kwas azotowy(V) wykazuje właściwości redukujące.
T
N
Kation cynku pełni funkcję reduktora.
T
N
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Wyszukiwarka
Podobne podstrony:
chemia ogolna arkusz r 1 1391852832
chemia nieorganiczna arkusz r 2 1391852744
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
instrukcja - HYDROLIZA SOLI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
pHmetr-instrukcja obsługi, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Cząsteczka (VB), CHEMIA, semestr 1, chemia ogólna, wykłady
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
Chemia ogolna wyklady 5 6 2012 Nieznany
CHEMIA OGÓLNA
Chemia ogolna zagadnienia na zaliczenie wykla
Jasiorski, chemia ogólna, Opracowane zagadninia na kolowium
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
instrukcja - CHEMIA ORGANICZNA II, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratori
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
przemiany jadrowe, Nauka, CHEMIA, Szkoła, Chemia ogólna
download, chemia ogólna
więcej podobnych podstron