
geny kumulatywne, poligeny
Cechy o zmienności ciągłej są warunkowane wieloma genami,
z których każdy segreguje zgodnie z prawami Mendla,
a ich efekty fenotypowe sumują się.
Genetyka cech ilościowych
fenotypy P F
2

krzywa
normalna
rozkład
Gaussa
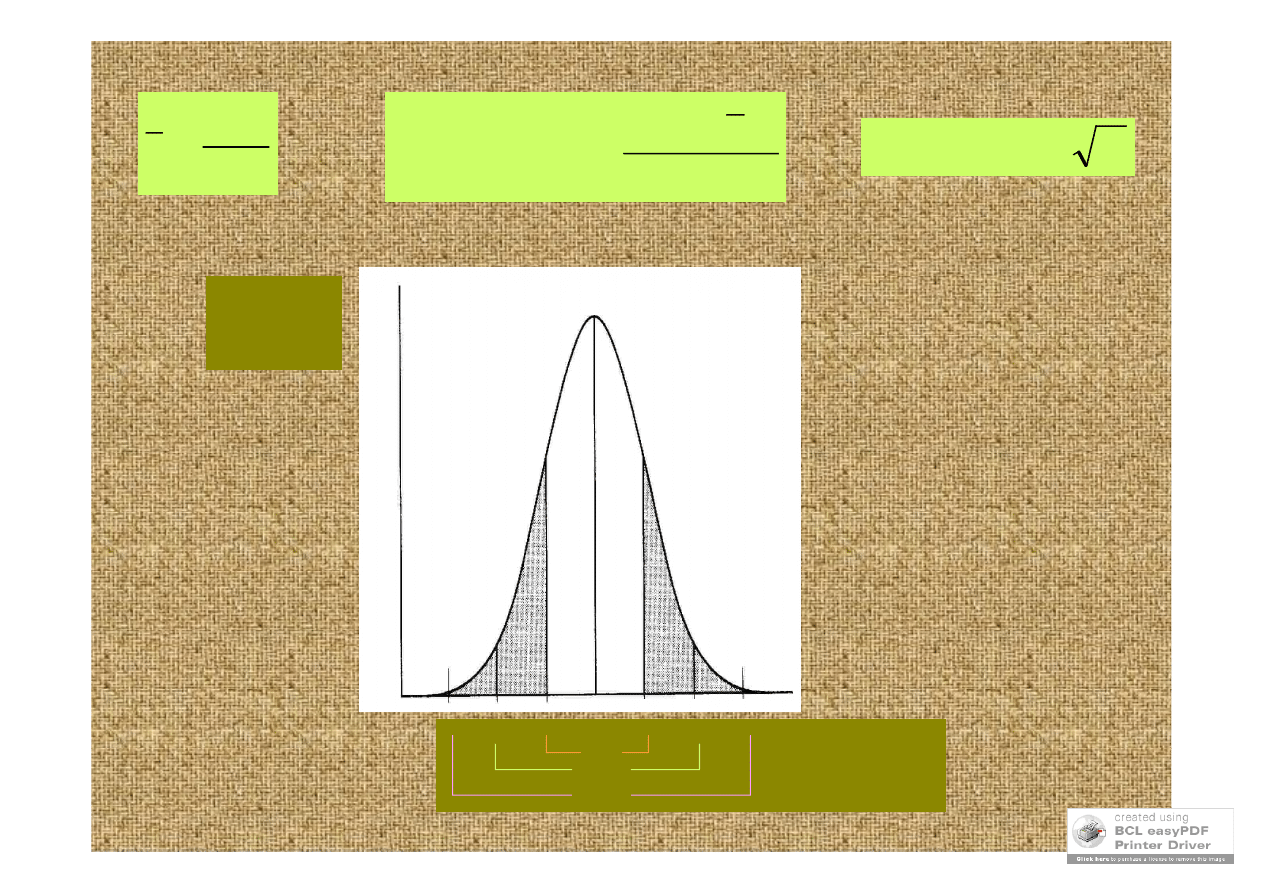
częstość
(liczba osobni-
ków o danej
wartości cechy)
-3σ -2σ -1σ średnia +1σ +2σ +3σ
wartość cechy
68%
95,5%
99,7%
n
x
x
i
1
2
2
2
n
x
x
s
V
V
sd
s
średnia arytmetyczna wariancja
odchylenie standardowe
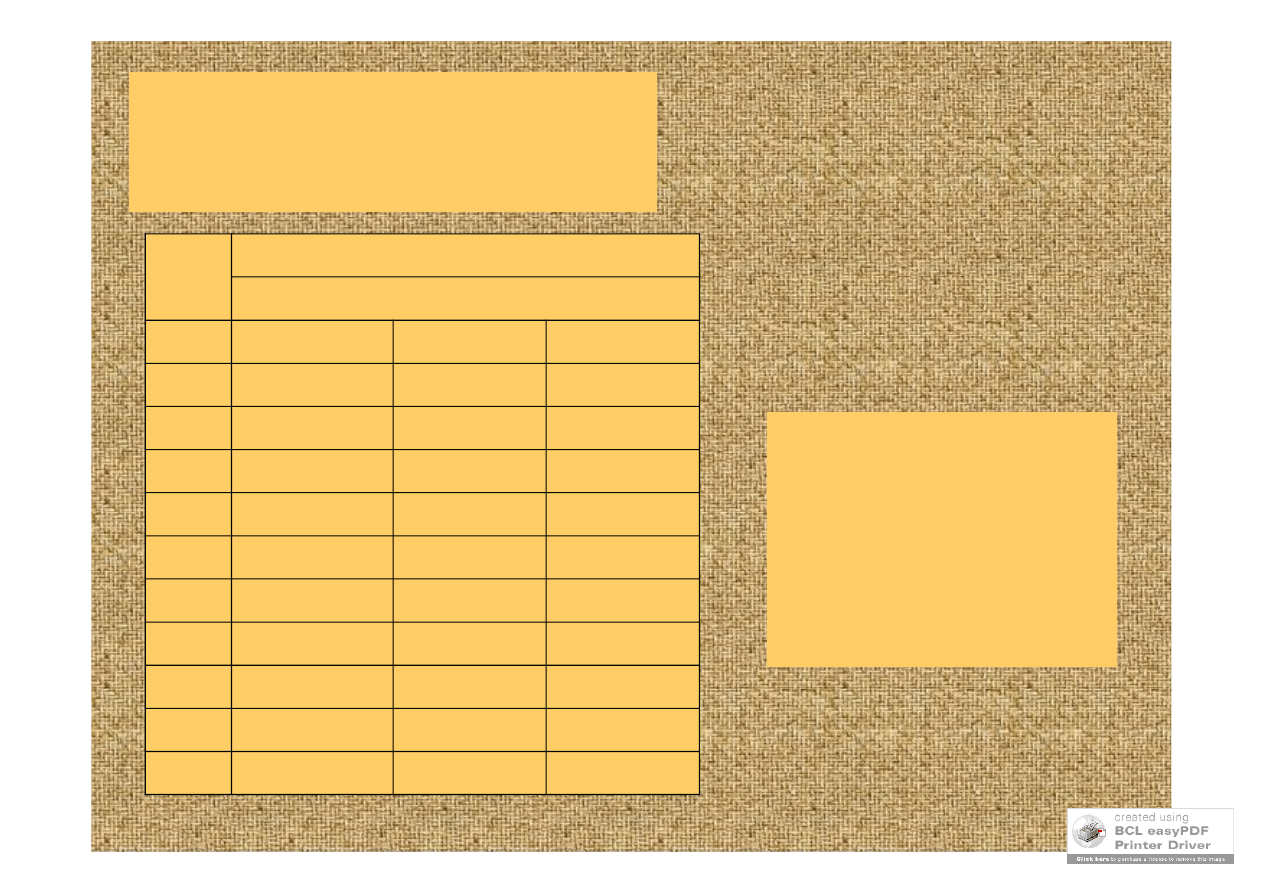
zmienność plonu z
roku na rok jest
warunkowana
zmianami
środowiskowymi
53.5
65.1
53.1
1995
39.8
53.2
41.7
1994
48.8
62.9
58.2
1993
41.5
49.0
46.6
1992
55.4
71.0
60.3
1991
0.0
0.0
0.0
1990
60.5
66.5
61.6
1989
28.4
25.7
23.1
1988
59.5
72.5
63.8
1987
47.5
55.9
47.9
1986
Agassiz
Seward
Roughrider
rok
odmiana
plon [buszli/akra= 1121 kg/ha]
plony pszenicy zimowej w
Casselton w Północnej Dakocie
na przestrzeni 10 lat
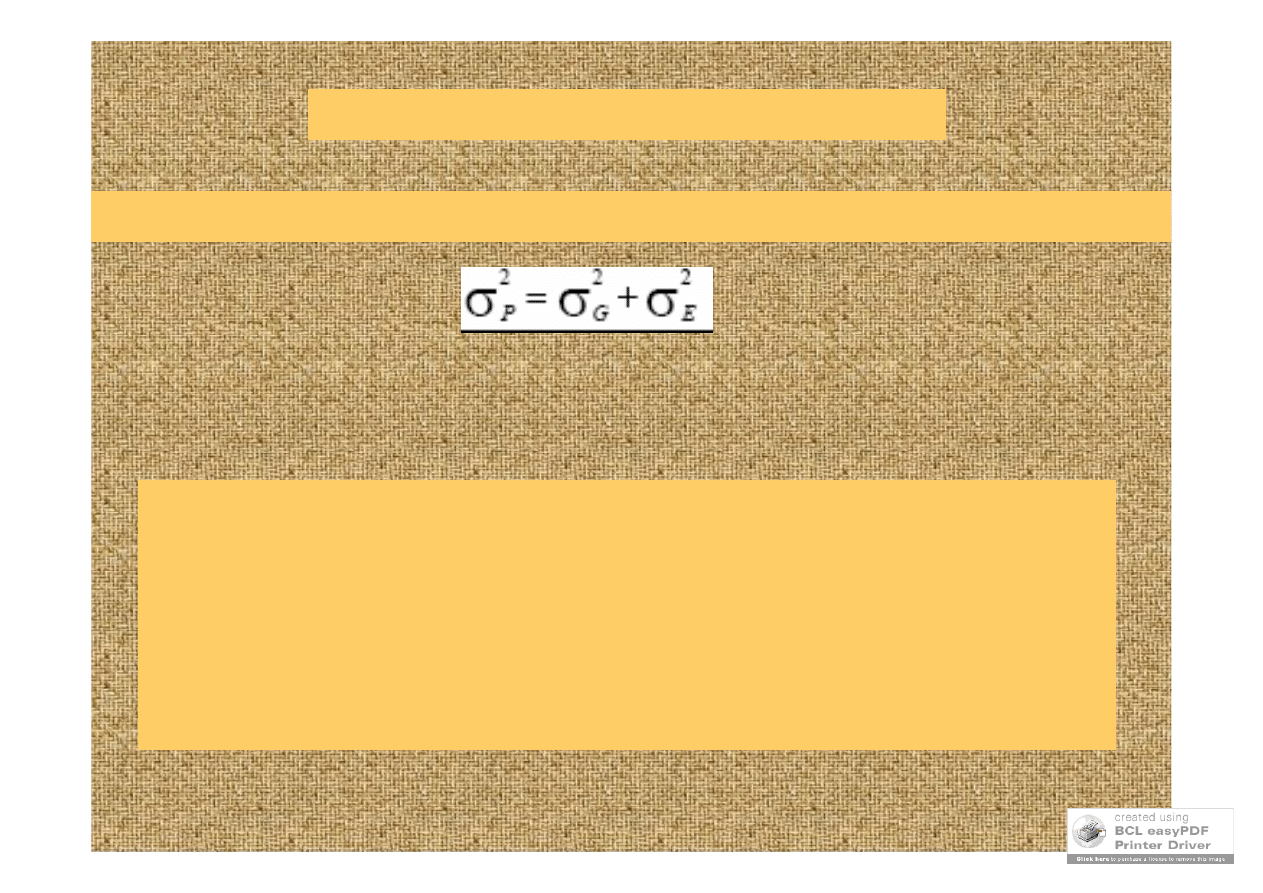
fenotyp = genotyp + środowisko
zmienność fenotypowa = zm. genetyczna + zm. środowiskowa
Podstawowe źródła zmienności genetycznej:
• losowy rozdział chromosomów
• zróżnicowana częstość alleli
• rekombinacja
• mutacje
• współdziałanie genów allelicznych i nieallelicznych

skuteczność selekcji zależy od
odziedziczalności
udział zmienności genetycznej w całkowitej zmienności
fenotypowej –
odziedziczalność (h
2
)

ocena udziału genów
– porównanie zgodności fenotypowej
u bliźniąt jednojajowych (MZ) i dwujajowych (DZ)
wysoka zgodność fenotypowa u MZ i niska u DZ - duże
znaczenie zmienności genetycznej
wysoka zgodność fenotypowa zarówno u MZ jak i DZ
wychowywanych w tym samym środowisku – duże
znaczenie zmienności środowiskowej
badanie odziedziczalności u ludzi:
ocena udziału środowiska
- porównanie zgodności feno-
typowej u bliźniąt wychowywanych w tym samym
środowisku lub oddzielnie

zgodność
cecha
MZ DZ
determinacja
choroba Huntingtona
100% 50%
autosomalna dominująca
anemia sierpowata
100% 25%
autosomalna recesywna
mukowiscydoza
100% 25%
autosomalna recesywna
odra
97% 94%
środowiskowa (zakaźna)
rozszczep wargi
40%
4%
środowiskowa + liczne geny
cukrzyca insulinozal.
30%
6%
środowiskowa + ≥ 1 gen
choroba wieńcowa
46% 12%
środowiskowa + ≥ 1 gen
schizofrenia
46% 14%
środowiskowa + ≥ 1 gen

TESTY ALLELICZNOŚCI
ustalają czy dwie niezależne mutacje
wpływające na tę samą cechę są
* alleliczne (w tym samym genie)
czy też
* niealleliczne (w różnych genach współdziałają-
cych w determinacji tej cechy)

P: mutant
1
mutant
2
fenotyp
dziki
zmutowany
F
1
:
geny
komplementują
nie komplementują
(uzupełniają się)
są
niealleliczne
alleliczne
należą do
różnych
tej samej
grupy komplementacyjnej

cis
a b
a
+
b
+
cis
a
1
a
2
a
+
trans
trans
a
1
a
2
trans
a
b
+
a
+
b
cis
dwie mutacje
niealleliczne
zawsze komplementują
dając dziki fenotyp
dwie mutacje
alleliczne
komplementują tylko w
cis
w heterozygocie
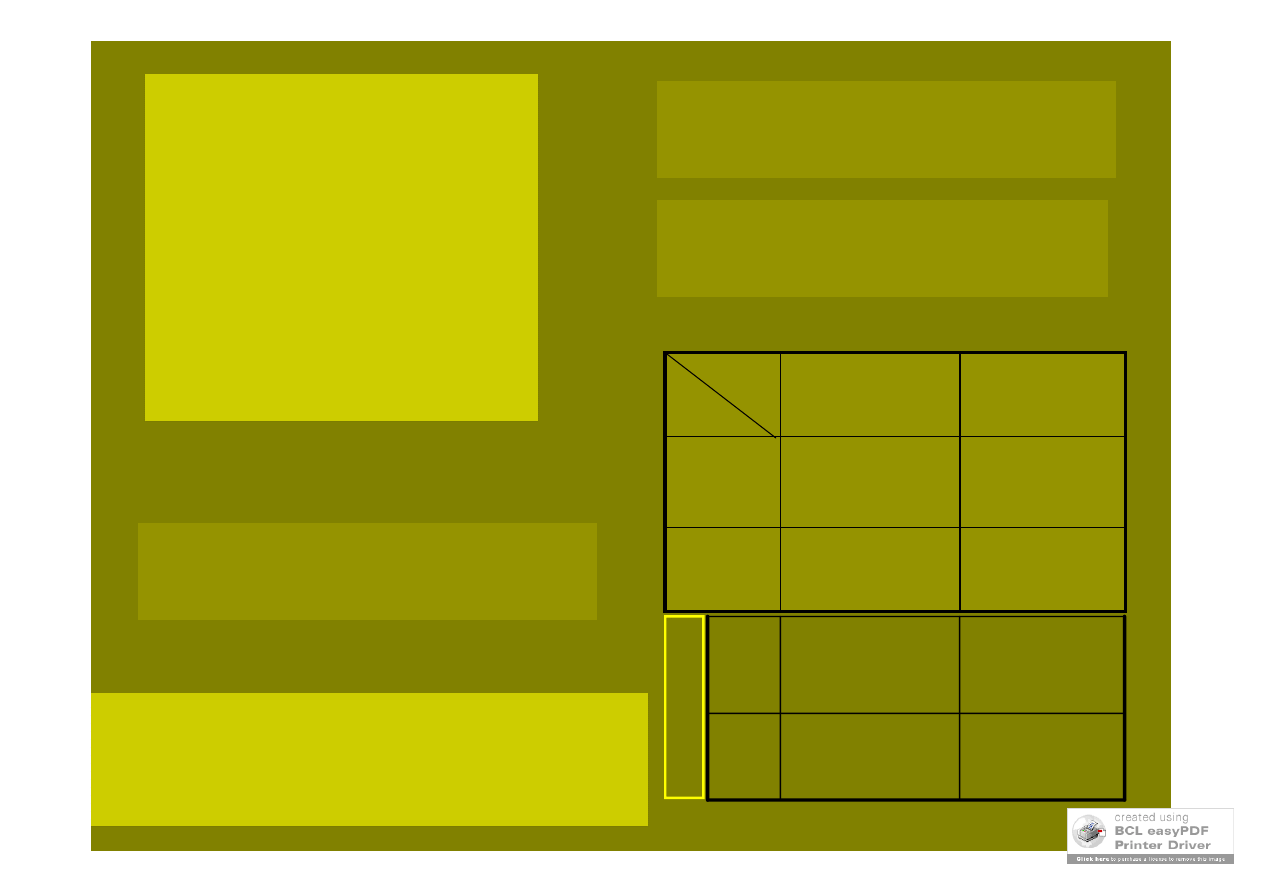
Po przeprowadzeniu
testu cis-trans, jeśli
mutacje okazały się
alleliczne (stanowią
allele funkcjonalne),
można ustalić czy są
to również allele
strukturalne
♂
w
-
białe
♀
ww
białe
w
♂
w
a
–
morelowe
♀
w
a
w
jasnomorelowe
w
a
-
w
♂
♀
P ♀
w
a
w
a
♂
w
–
o. morelowe
o. białe
F
1
♀
w
a
w
♂
w
a
–
o. jasnomorelowe
o. morelowe
P ♀
w
a
w
♂
w
–
o. jasnomorelowe
o. białe
w i w
a
nie są allelami strukturalnymi
,
pomiędzy ich loci zachodzi rekom-
binacja
r
z
a
d
k
o
♂
+
w
–
dzikie
♀
+
w
w
dzikie
+
w
♂
ww
a
-
jasnomorelowe
♀
ww
a
w
jasnomorelowe
ww
a
F
1
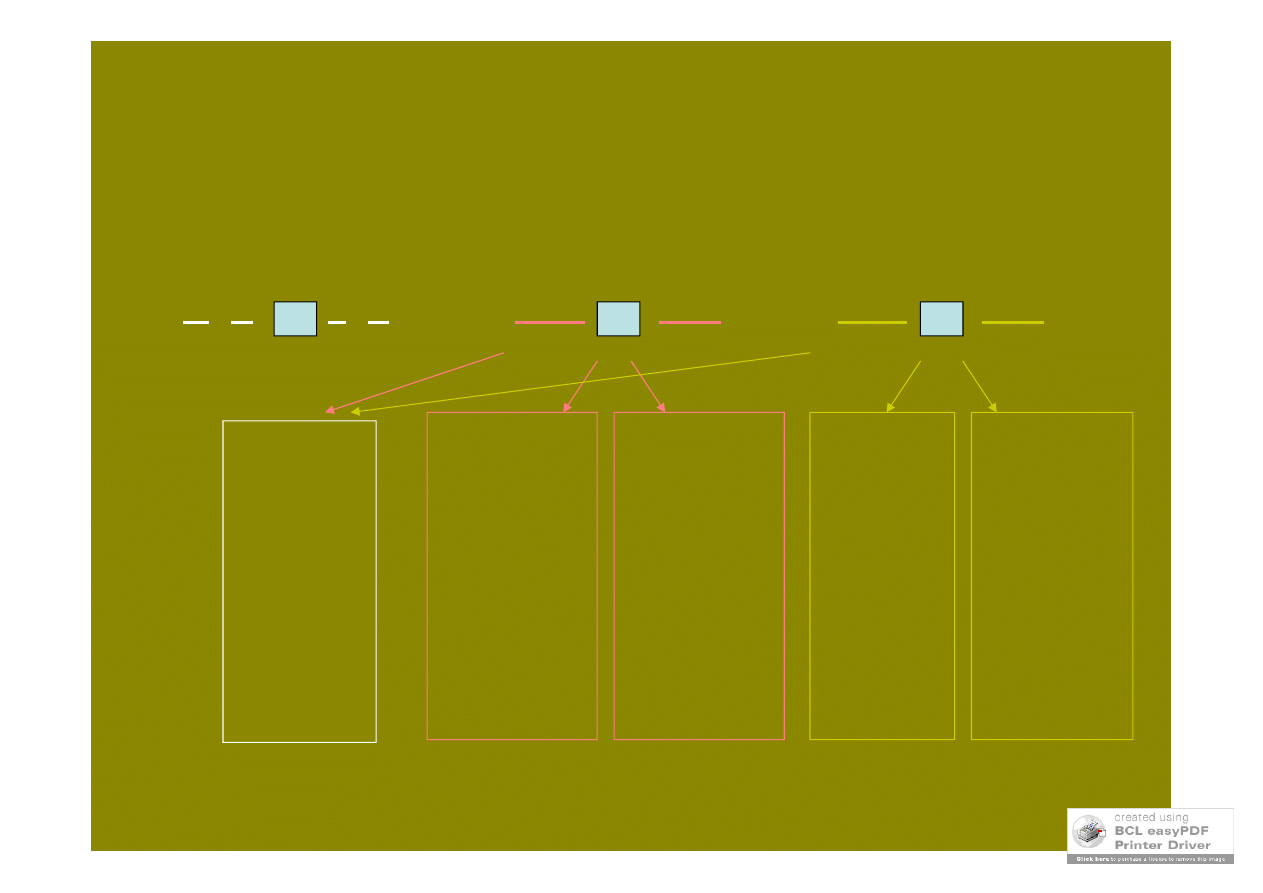
krzyżówka testowa podwójnej heterozygoty
A B
a b
a b
a b
A B
a b
a b
a b
A b
a B
a b
a b
25%
25%
25%
25%
niezależna
segregacja
np.
37%
35%
13%
15%
sprzężenie
częściowe
50%
50%
całkowite
sprzężenie
np.
7%
9%
41%
43%
sprzężenie
częściowe
50%
50%
całkowite
sprzężenie
AB
ab
Ab
aB
(genotyp potomstwa odpowiada allelom wniesionym przez gametę heterozygoty)

crossing over
• zachodzi losowo (?) między chromosomami homologicznymi
• częstość jest proporcjonalna do odległości między
genami tzn. im większa odległość tym większe
prawdopodobieństwo zajścia crossing over
• między parami genów sprzężonych zachodzi z
określoną i stałą częstością
Przyjęto, że częstość crossing over jest miarą
odległości między genami.
• pomiędzy dwoma chromosomami homologicznymi może
zajść w wielu miejscach, ale w każdym pojedynczym
c-o zawsze tylko pomiędzy dwoma niesiostrzanymi
chromatydami biwalentu
częstość crossing over nie wykazuje bezpośredniego
związku z fizycznymi odległościami genów na mapie:
• jest wysoka w pobliżu telomerów, a niska w okolicach
centromerów
1 jednostka mapowa (j.m.) = 1% crossing over =
1% rekombinacji = 1 centimorgan (cM)
• u człowieka jest znacznie wyższa u kobiet niż u mężczyzn
U
Drosophila
c-o zachodzi tylko u samic, a jego częstość
zależy od temperatury, wieku samicy oraz innych czynników
środowiska.
• istnieją gorące i zimne miejsca rekombinacji, w których c-o
zachodzi z częstością odpowiednio wyższą lub niższą od
średniej
(średnia częstość c-o u człowieka ~1 cM/Mb)

* zachodzi pomiędzy miejscami/sekwencjami homologicznymi
właściwości mejotycznej rekombinacji (r. homologicznej,
crossing-over):
* zwykle bezbłędna
* zwykle wzajemna
* mechanizm jednaki u fagów, bakterii, w mejozie – ewolucja
zachowuje geny białek biorących udział w rekombinacji
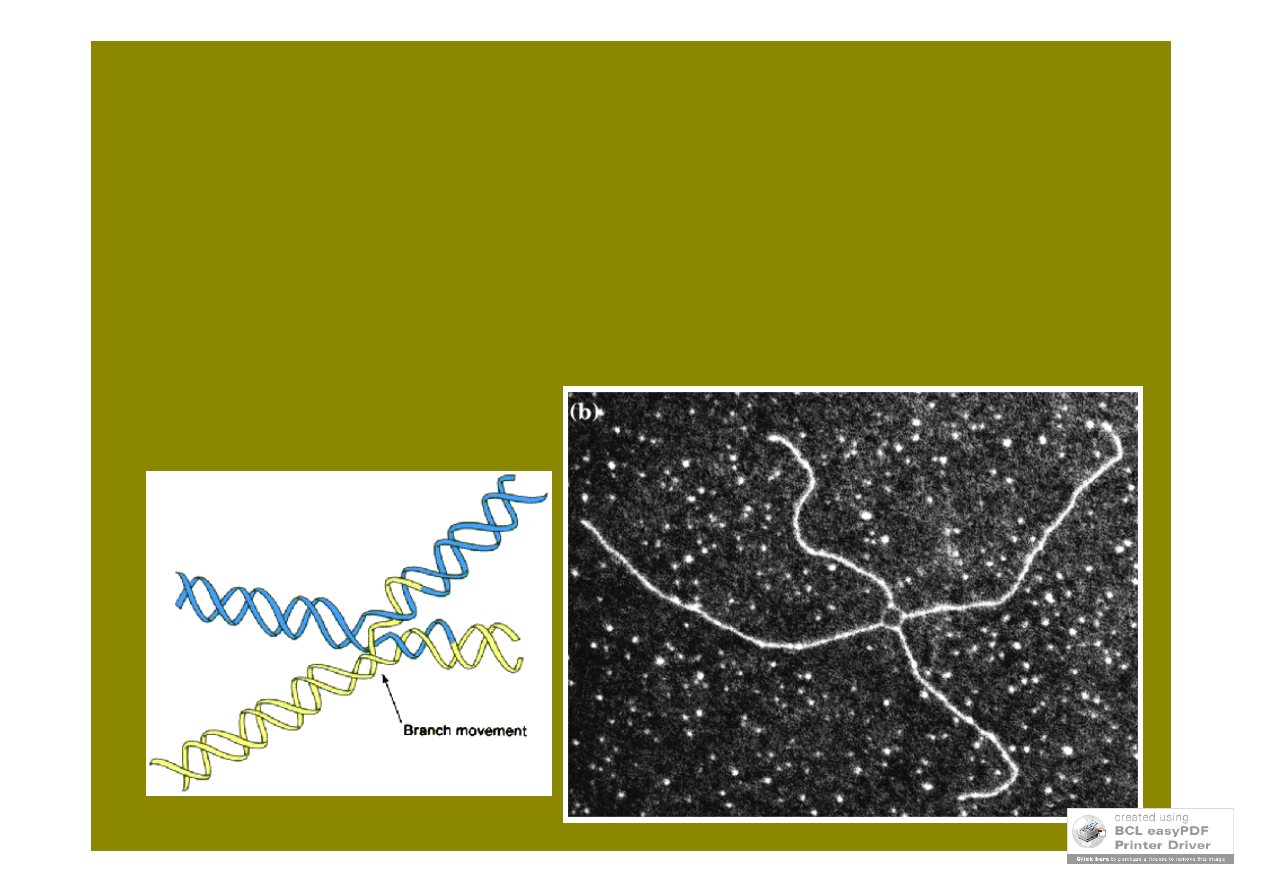
struktura Hollidaya
modele mejotycznej rekombinacji różnią się wydarzeniami
inicjacyjnymi i liczbą powstających struktur Hollidaya

2
jedno 2-niciowe nacięcie w
chromosomie „biorcy”
Szostaka i in.
(2-niciowych
pęknięć DSBR)
1
pojedyncze 1-niciowe nacięcie
jednego z chromosomów
(„dawcy”)
Meselsona-
Raddinga
1
dwa 1-niciowe nacięcia w
niciach o tej samej polarności
obu chr. homologicznych
Hollidaya
l. struktur
Hollidaya
inicjacja poprzez
model
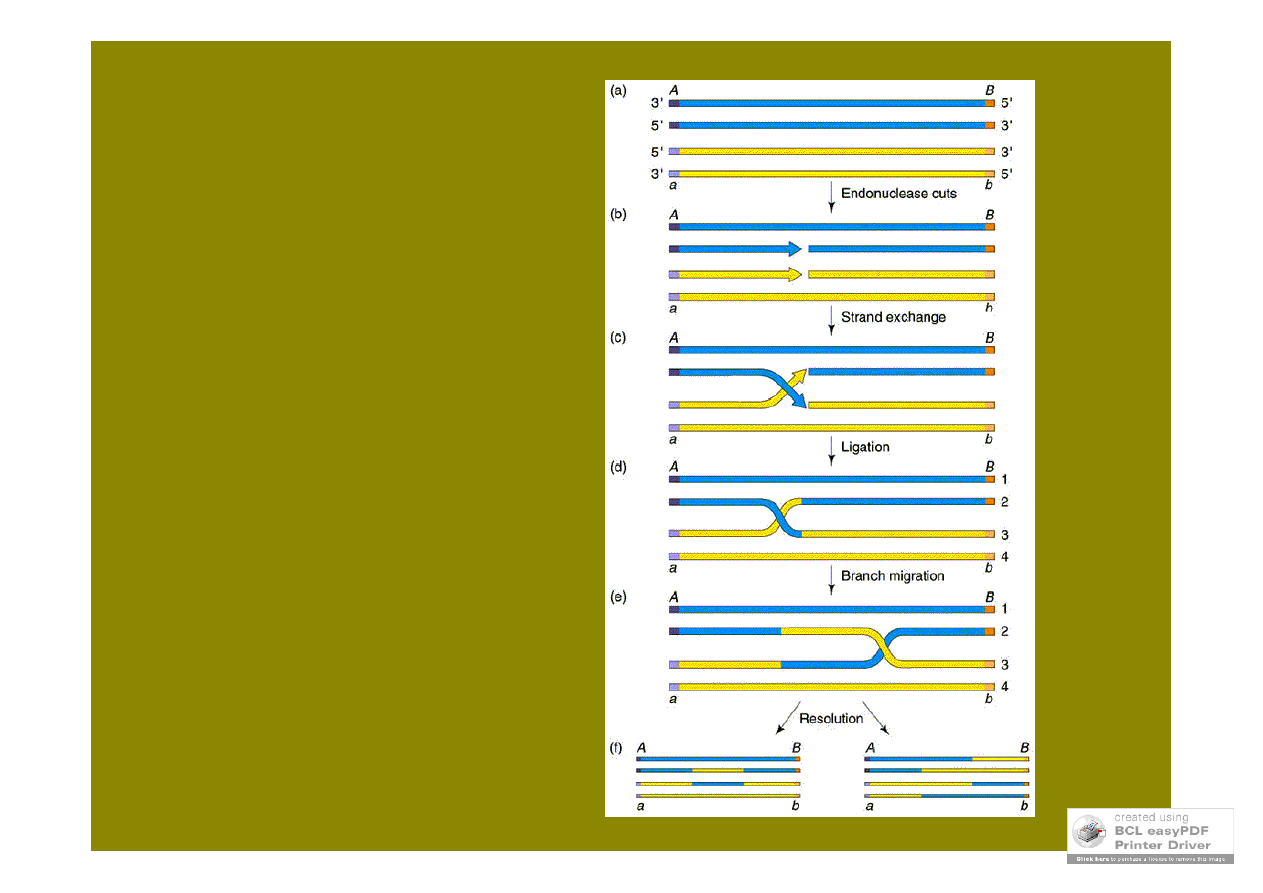
model Hollidaya
dwa 1-niciowe nacięcia w niciach
o tej samej polarności obu chr.
homologicznych
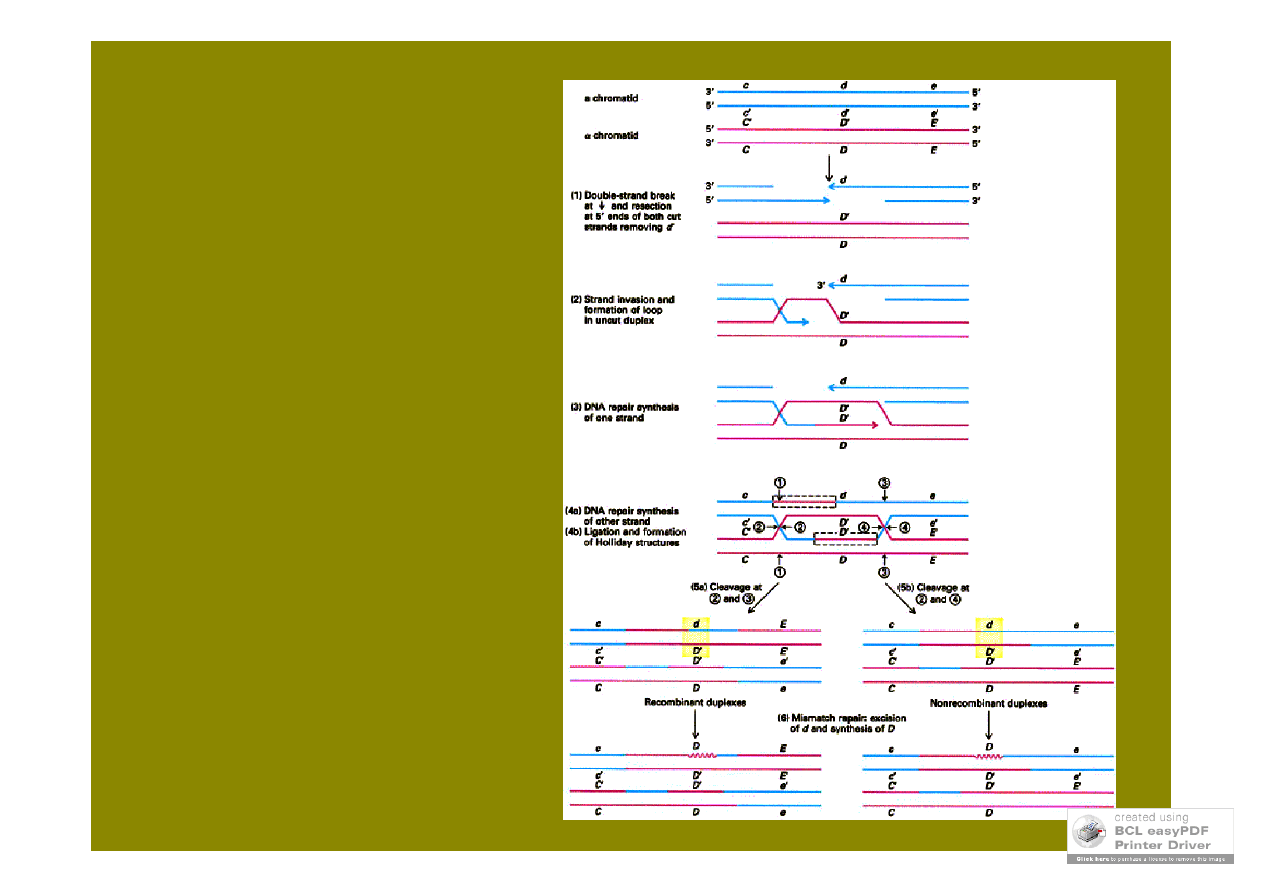
model naprawy
2-niciowych pęknięć
jedno 2-niciowe nacięcie w
chromosomie „biorcy”
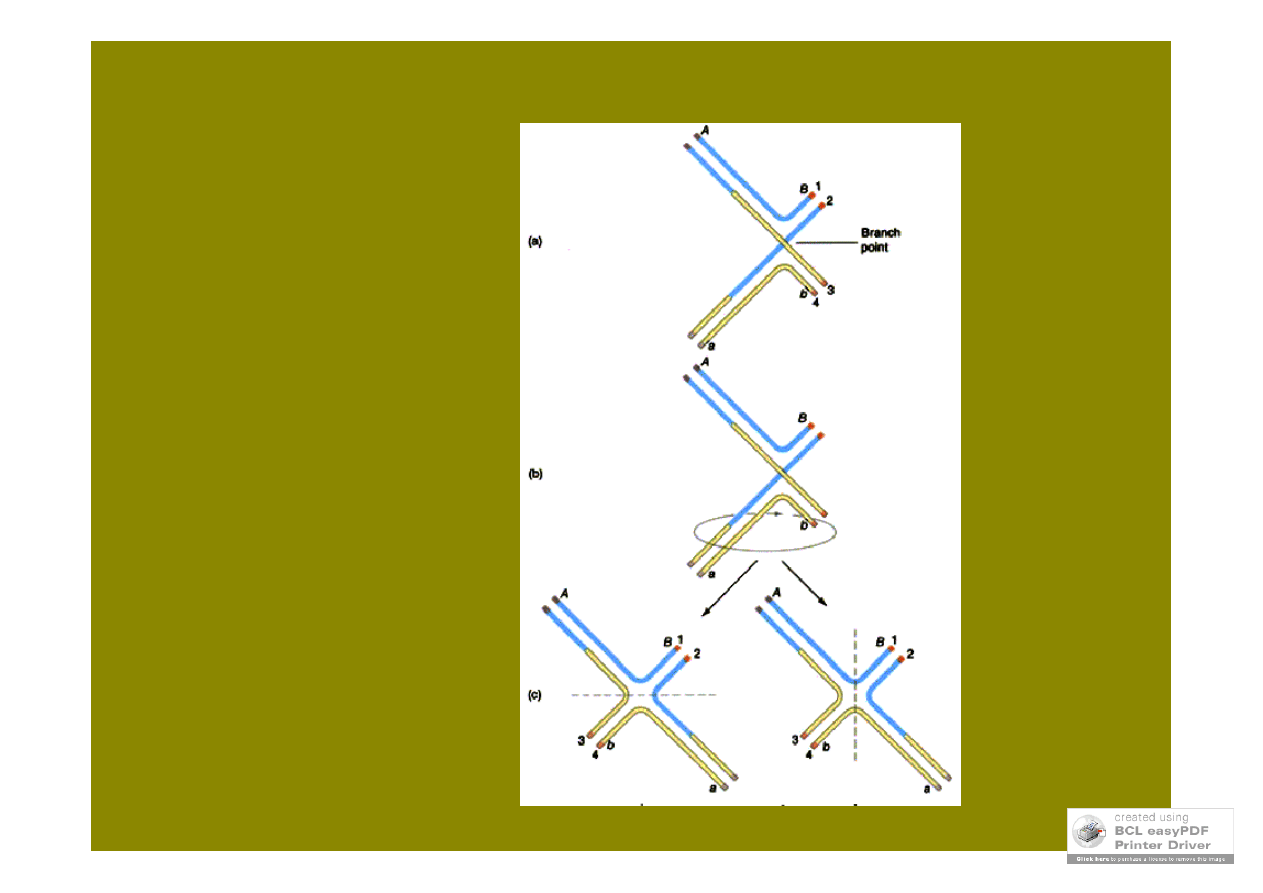
rozdzielenie
struktury
Hollidaya
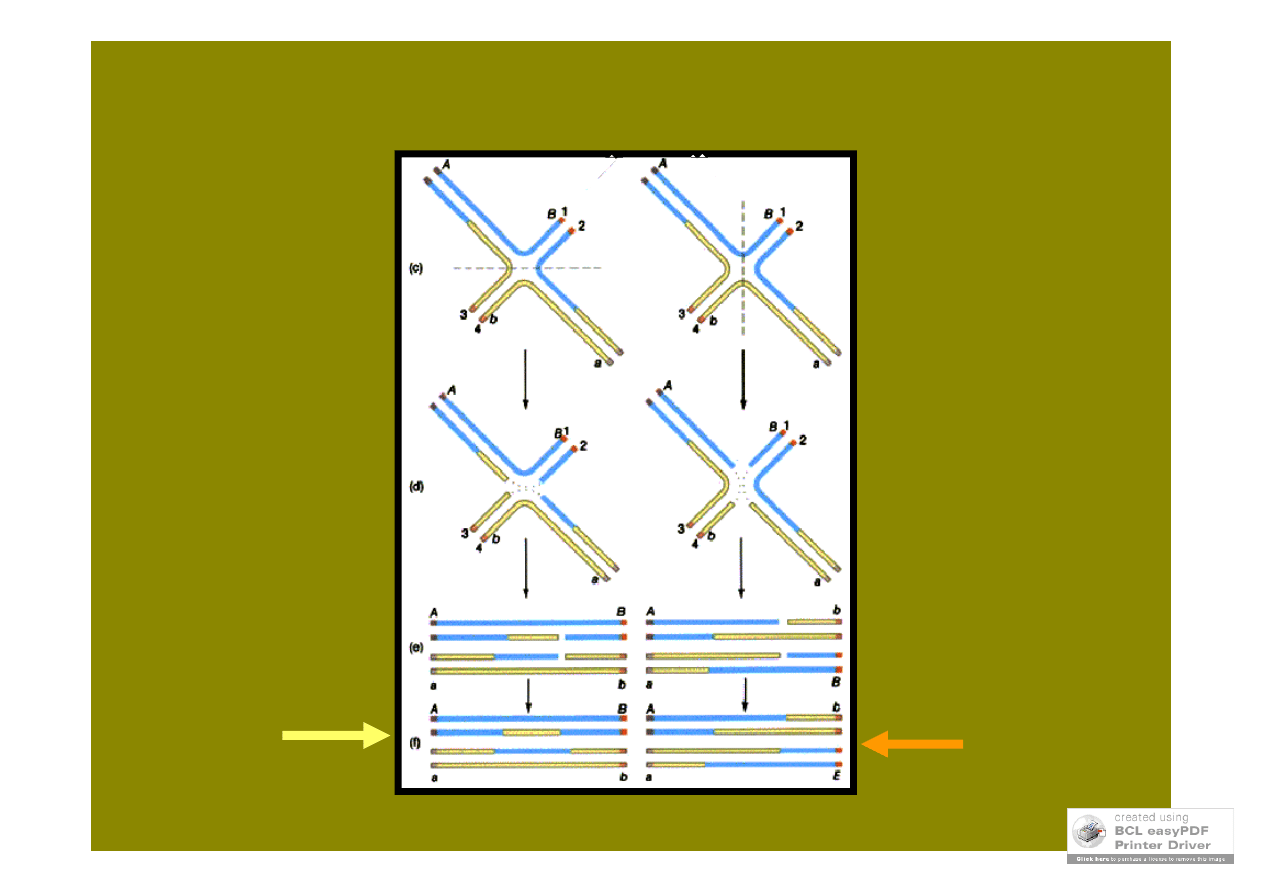
heterodupleksów,
które muszą
zostać
naprawione,
efektem może
być konwersja
lub brak
rekombinantów
wzajemnych
rekombinantów
prowadzi do powstania:
Wyszukiwarka
Podobne podstrony:
Genetyka cech ilościowych
Dziedziczenie i rozkład cech ilościowych 8 4 10
Genetyka mendlowska, I prawo Mendla to podstawa korpuskularnej, czyli cząsteczkowej teorii dziedzicz
Analiza zależności dwóch cech statystycznych ilościowych
Dziedziczenie mendlowskie prawidlowych i patologicznych cech czlowieka, Fizjoterapia, Genetyka
genetyka klasyczna, W6R05, Genetyka ilościowa
ściąga-g. molekularna, Genetyka ilościowa, Genetyka ilościowa
dziedziczenie dwóch cech, Makrokierunek, genetyka zwierząt i metody hodowlane
BIOLOGIA genetyka ujawnianie się cech, rodowody, biotechnologia i bioinżynieria, mutacje
DZIEDZICZENIE CECH, Genetyka
Seminarium3 Inne zaburzenia genetyczne
Genetyka regulacja funkcji genow
Analiza genetyczna w medycynie sądowej
03 PODSTAWY GENETYKI
więcej podobnych podstron