

Alergen
Alergen główny
Ekstrakt alergenowy
Szczepionka alergenowa
Desensytyzacja

Celem standaryzacji jest jednoczesne utrzymanie
składu i mocy wyciągów na stałym poziomie

Standaryzacja wyciągów alergenowych obejmuje:
pomiar mocy wyciągu
przyporządkowanie wyciągowi jednostek
standaryzacyjnych
identyfikację i charakteryzację materiału źródłowego

Obejmuje metody in vivo i in vitro.
Do metod in vivo
należą: punktowe testy skórne oraz
testy śródskórne
Zaś do metod in vitro należą: blokowanie RAST, test
uwalniania histaminy, test ELISA, ocena aktywności
enzymatycznej

Test RAST (radioalergosorpcji)
służy do pomiaru stężenia przeciwciał
klasy IgE reagujących z określonym alergenem.
Blokowanie tego testu opiera się na współzawodnictwie o przeciwciało
zawarte w surowicy między antygenem w ekstrakcie i alergenem
związanym z fazą stałą np. krążkiem celulozowym.
Im mniej przeciwciał zwiąże się z fazą stałą, tym wyciąg alergenowy
jest mocniejszy.

W celu określenia mocy ekstraktu, używa się średnich
wartości z rozcieńczeń jednostkowych dotyczących
poszczególnych grup.
Średnie te wyliczane są dla całej badanej grupy.
Im dany wyciąg jest słabszy, tym niższe jego rozcieńczenie
daje
ten
sam
efekt
biologiczny
co
najwyższe
rozcieńczenie w przypadku najmocniejszego wyciągu.

1.
Metoda Noona –
przyporządkowanie 1 gramowi pyłku traw 1 milion
jednostek Noona
2.
Metoda wagowo/objętościowa –
określenie stosunku wagi materiału wyjściowego do
objętości płynu służącego do sporządzenia wyciągu
3.
Metoda oceny azotu białkowego –
ocenienie
wyciągu
alergenowego
na
podstawie
ilościowego pomiaru zawartości wszystkich białek
występujących w roztworze

Standaryzacja alergenów
System Nordycki
System Amerykański
BU/ml
BAU/ml
biological unit
bioequivalent allergy unit

elektroforeza nośnikowa (SDS-PAGE)
ogniskowanie izoelektryczne (IEF)
immunoelektroforeza (CIE)
Western Blotting

Potraktowanie
cząsteczki
białka
przez
SDS
skutkuje
powstaniem kompleksów białko - SDS
o ustalonym stosunku
ładunku elektrycznego do masy
1 g białka wiąże 1,4 g SDS
W takim kompleksie SDS skutecznie maskuje oryginalny
ładunek białka –
białko uzyskuje ładunek ujemny
SDS-PAGE pozwala na łatwe i dokładne oznaczenie Mcz
rozdzielonych białek
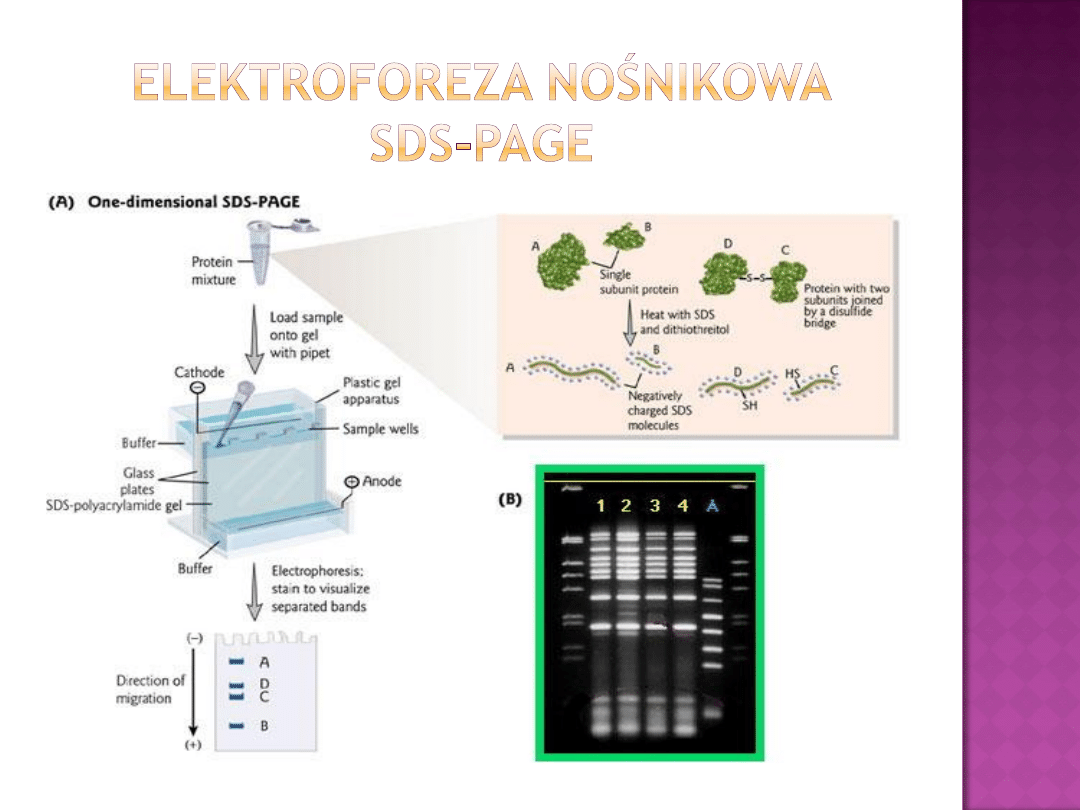

Obecność SDS przynosi szereg korzyści:
zdecydowana większość białek jest rozpuszczalna w
elektrolitach zawierających SDS
separacja białek odbywa się zgodnie z ich M
cz
barwienie kompleksów białko- SDS jest znacznie
wydajniejsze niż samego białka
Obecność SDS skutecznie eliminuje enzymatyczną
degradację białek w trakcie separacji

umożliwia rozdział białek w gradiencie pH
utworzonym w porowatym
nośniku
podczas ogniskowania, polipeptydy
wędrują pod
wpływem przyłożonego napięcia do miejsca w żelu
gdzie pH = ich pI
odbywa
się w nośniku, w którym wartość pH buforu
zmienia
się w sposób ciągły od wartości najwyższej
przy katodzie do
najniższej przy anodzie
gradient
pH
tworzy
mieszanina
syntetycznych
niskocząsteczkowych
związków
alifatycznych
zwanych
amfolitami
Wykazują przewodnictwo elektryczne
wykazują bardzo dużą pojemność buforową
nie są toksyczne dla białek
nie wykazują absorpcji przy λ=280 nm
można je łatwo oddzielić od preparatu białka

Opiera się na zjawisku precypitacji kompleksów
antygen
– przeciwciało i pozwala na detekcję
obecności antygenu oraz określenie ilości
antygenu w próbce
Jedną z jej odmian jest
elektroforeza rakietkowa

Prowadzona
jest
w
nośniku
wysyconym
przeciwciałem w warunkach pH= pI przeciwciała
W kierunku od katody do anody elektroforetycznie
migruje
próbka zawierająca antygen
W miejscu kontaktu antygen
– przeciwciało dochodzi
do precypitacji
kompleksów – widocznych jako
charakterystyczne linie o
kształcie startującej
rakiety
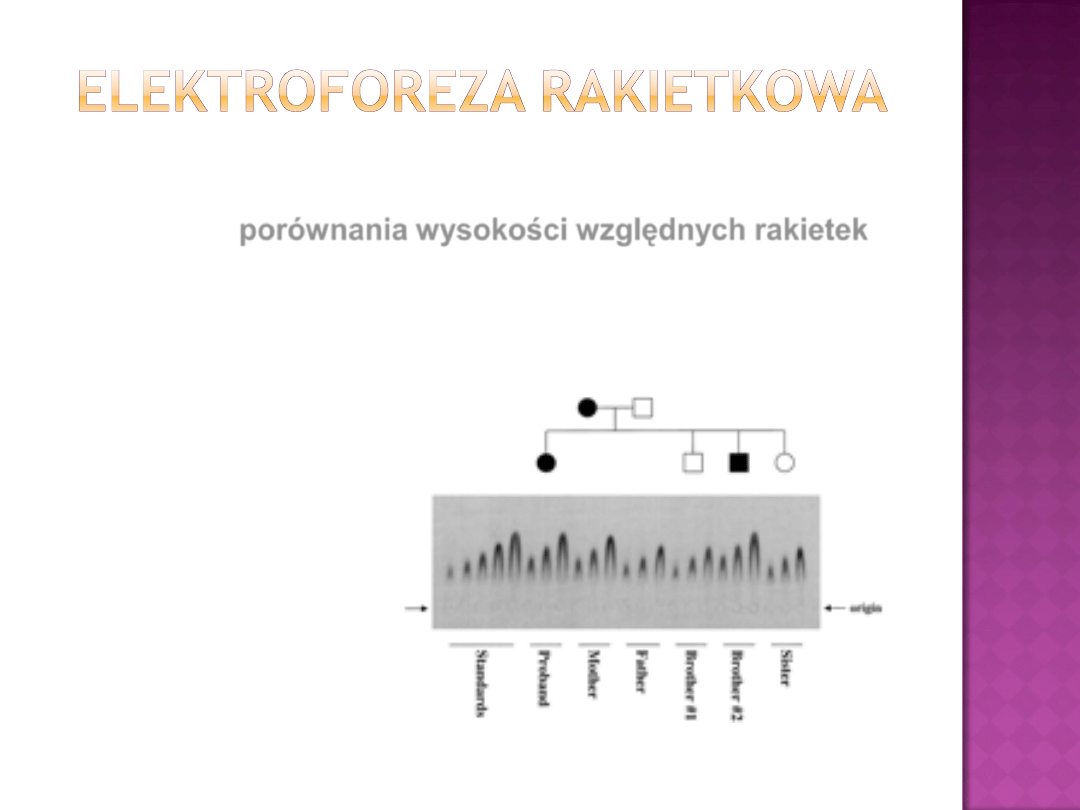
Jeśli całkowita ilość alergenów głównych jest znana wówczas
na drodze
porównania wysokości względnych rakietek
możliwe jest półilościowe zmierzenie zawartości jednego lub
większej ilości alergenów głównych

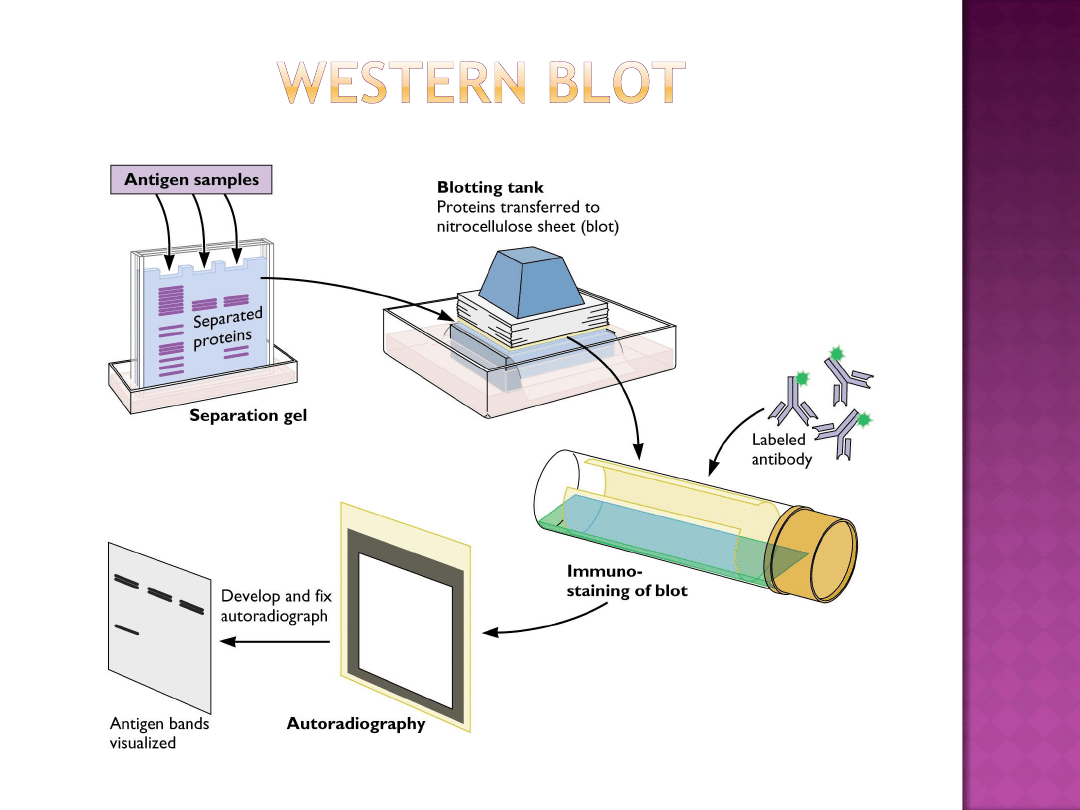
Metoda
służąca
do wykrywania
określonych białek
Rozdziela zdenaturowane
białka według ich mas
oraz natywne
według ich struktury 3D
Następnie białka są przenoszone na membranę
nitrocelulozową (lub PVDF)
Obecność określonych białek jest sprawdzana za
pomocą barwników lub przeciwciał przyłączających
się do ich epitopów.

Powstają
w wyniku modyfikacji chemicznej alergenu
, w
której znaczna część epitopów wiążących przeciwciała nie jest
już rozpoznawana
Uzyskuje się je w wyniku np. polimeryzowania alergenu pod
wpływem formaldehydu, aldehydu glutarowego, formaliny lub
ciepła jako czynnika fizycznego
ALERGOIDY
Alergoidy wysokomolekularne
M
cz
> 100 kDa
Alergoidy niskocząsteczkowe
M
cz
~ 30 kDa

Alergoidy
słabo reagują z przeciwciałami IgE i nie indukują
reakcji IgE
zależnych
Jest natomiast zachowana
immunogenność preparatu
Wykazano korzystne zmiany w wytwarzaniu cytokin (IL-10 i
IFN-
γ) przez limfocyty Th w trakcie immunoterapii alergoidem

Zmniejszona reaktywność alergenowa tych szczepionek
wpływa na:
skuteczność i bezpieczeństwo jej stosowania
szybkość osiągania maksymalnej dawki
komfort i dobrą współpracę lekarza z pacjentem

Wadą natomiast jest to, iż:
alergoidy nie mogą być prezentowane przez większość
komórek prezentujących antygen,
proces ich produkcji może doprowadzić do usunięcia
epitopów dla limfocytów T, co skutkuje zmniejszoną
aktywnością immunologiczną
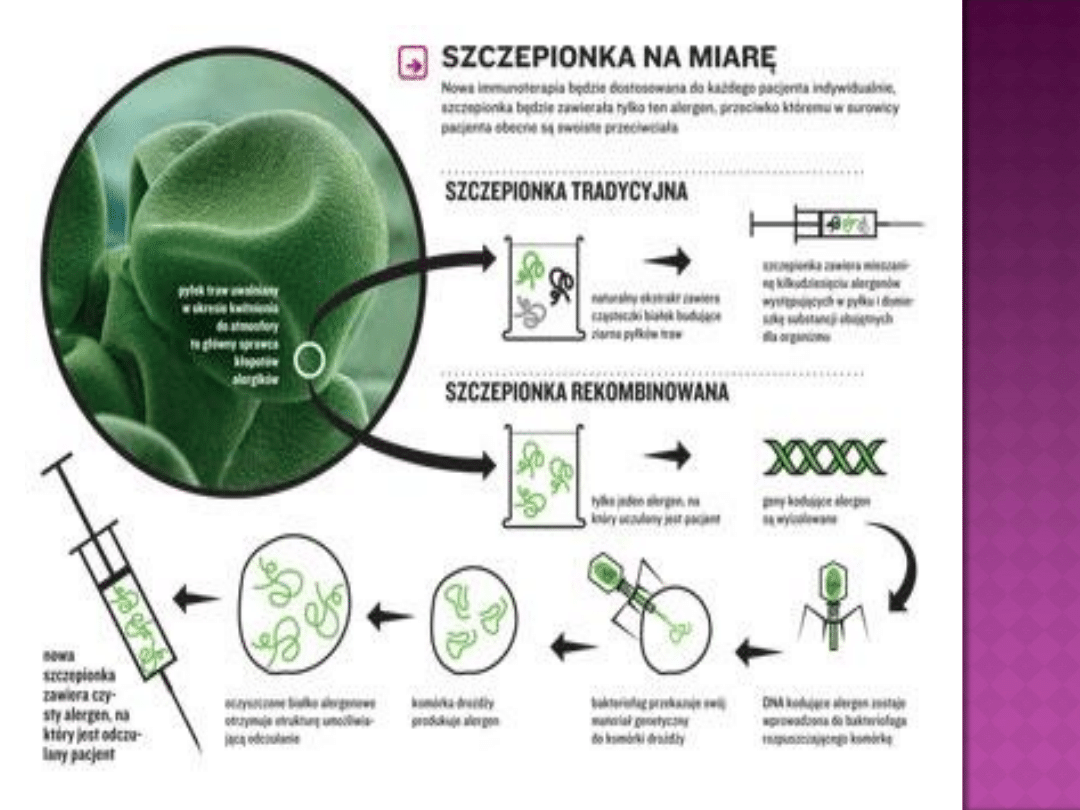

Są syntetyzowane przez obcy organizm,
wykorzystujący wprowadzoną zewnątrz
informacją genetyczną

1.
Z
materiału macierzystego alergenu izoluje się
kodujące go fragmenty DNA lub RNA
2.
Tak przygotowany gen wprowadza
się do komórki
np. bakterii,
drożdży, owadów, ssaków za pomocą
plazmidów, bakteriofagów
Metoda ta pozwala na uzyskiwanie
nieograniczonej
ilości czystej substancji.
Można
w
ten
sposób
uzyskiwać
potrzebne
przeciwciała, alergeny, cytokiny, hormony

Zastosowanie
alergenów rekombinowanych i ich
pochodnych pozwala:
Wyeliminować białka niealergenowe
Zmniejszyć ryzyko wprowadzenia alergenów z innych źródeł
Zmniejszyć ryzyko wprowadzenia materiału infekcyjnego z
materiału wyjściowego do ekstrakcji
Zapewnić wiarygodną standaryzację szczepionek
Zwiększyć bezpieczeństwo leczenia odczulającego

Metodami służącymi w tworzeniu zrekombinowanych
mogą być:
metoda
służąca do oddzielenia dzikich alergenów od
innych
fragmentów wyciągu
a
następnie użycie tych
fragmentów
jako
indywidualnych
cząstek
modyfikujących odpowiedź immunologiczną albo
wykorzystywanie ich do fuzji w celu generowania
nowej
molekuły
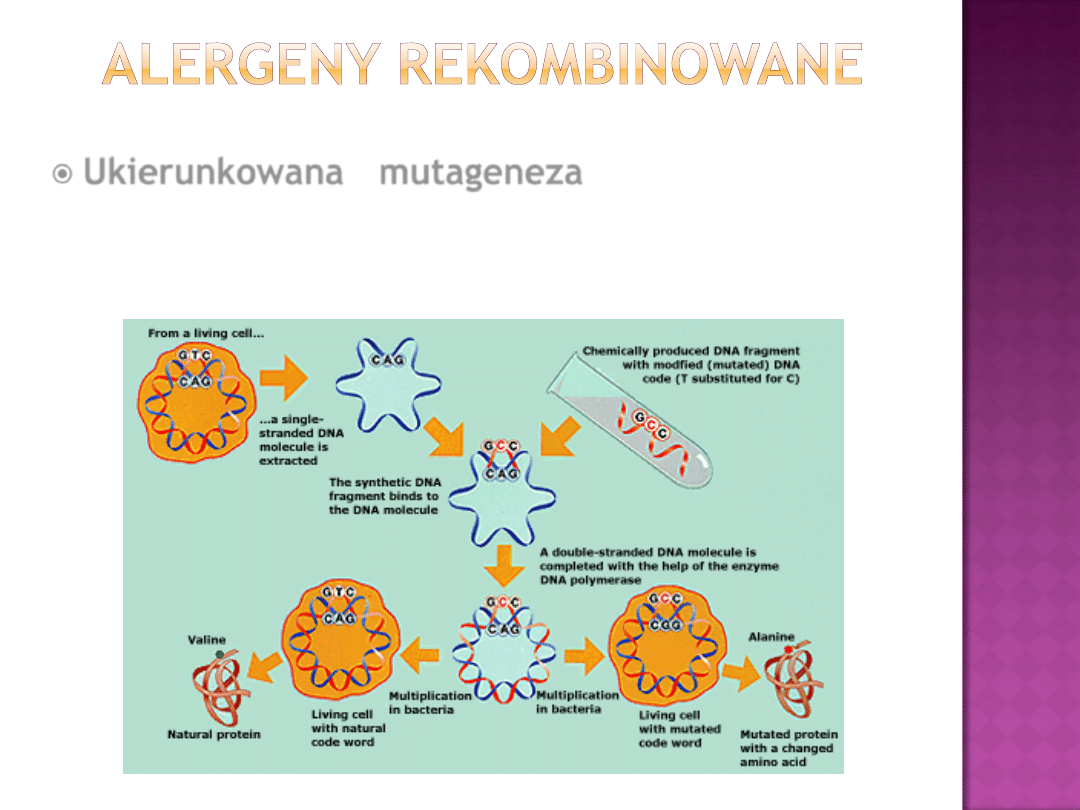
Ukierunkowana mutageneza
prowadząca do
sztucznego
wywołania
mutacji
w
ściśle
określonym miejscu genomu

Adiuwant ma za zadanie
wzmacniać proces
immunizacji a
jednocześnie być
bezpieczny.

Jego zadanie polega na:
Prezentacji antygenu, co prowadzi do wzrostu
ilości
przeciwciał blokujących, wzrostu syntezy IL-1, IL-4, IL-
10,
IL-12,
INF-
γ,
TNF-
α,
GM-CSF,
hamowanie
aktywności limfocytów Th2 i eozynofilów
Przyczynić się stworzenia antygenu o przedłużonym
działaniu w miejscu szczepienia i powolnym jego
uwalnianiu
Działaniu nośnikowemu
Działaniu immunostymulującemu
Działaniu modulującemu przez stymulację subpopulacji
Th1

Obecnie w charakterze adiuwantów wykorzystywane są:
Monofosforylowany lipid A (MPL-A)
IL-12
IL-18
Immunostymulujące oligosacharydy z niemetylowanymi CpG
zabite poprzez ogrzewanie bakterie Listeria monocytogenes
Zabite poprzez ogrzewanie bakterie Lactobacillus platnarum
Jednak najczęściej stosowane są:
Sole glinu
L-tyrozyna
Sole wapnia
Wyszukiwarka
Podobne podstrony:
pediatria gielda, pediatria1-3 od Pawła, 1) Co nie jest p/wsk do immunoterpaii swoistej :
propedeutyka immunologii swoistej 333, biologia, wykłady
Pierwotne niedobory z defektem Limfocytów T i produkcja przeciwciał, studia, immunologia
pamiec i szczepionki - ok, Immunologia
Rodzaj szczepionki a odpowiedź immunologiczna
Obornik – produkcja, przechowywanie, stosowanie i
Immunoterapia swoista 2
Założenia immunoterapii swoistej
ZASADY STOSOWANIA IMMUNOGLOBULINY anty RhD
Wykł 10 Kult 2010 Hodowle kom w produkcji szczepionek
Prewencja wet immunoprofilaktyka swoista
Mechanizmy swoistej immunoterapii alergii 3
UE szczepienia i racjonalne stosowanie antybiotyków, Zdrowie publiczne, W. Leśnikowska - Ścigalska -
Surowce stosowane do produkcji papieru
03 Stosowanie norm w produkcji Nieznany (2)
Eksploatowanie Maszyn i Urządzeń Stosowanych w Produkcji Zwierzęcej
Tabela[2], Zarządzanie i inżynieria produkcji, Semestr 4, Mechanika Stosowana
więcej podobnych podstron