
Rodzaj szczepionki a
odpowiedź immunologiczna.
Infekcje HPV.
Immunoprofilaktyka.
Bartłomiej
Kisiel
II rok farmacji

Szczepionka to preparat zawierający
antygen (antygeny) drobnoustroju,
który
po
podaniu
powoduje
wytworzenie
swoistej
odpowiedzi
immunologicznej chroniącej przed
zakażeniem danym organizmem.
Typ
odpowiedzi
immunologicznej
powstałej po podaniu szczepionki
zależy od jej rodzaju.
Szczepionki atenuowane
zawierają
żywe
drobnoustroje
pozbawione zjadliwości; są bardziej
immunogenne
niż
szczepionki
zawierające zabite drobnoustroje lub
oczyszczone konkretne antygeny.

Związanie antygenu przez cząsteczki MHC klasy 1
na powierzchni komórek
w cytoplazmie antygen
degradowany do prostego polipeptydu przez
kompleks enzymów proteolitycznych (proteosom)
powstałe polipeptydy transportowane do siateczki
śródplazmatycznej
przez
białka
opiekuńcze
(chaperones)
powstały
kompleks
antygen-
cząsteczka klasy I prezentowany jest na powierzchni
komórki stymulacja limfocytów cytotoksycznych
CD8
W ten sposób działają m.in. szczepionki BCG,
przeciwko Salmonella typhi, Vibrio cholerae,
śwince (MuV).

Szczepionki zawierające
inaktywowane organizmy
zawierają
zabite
bakterie
lub
inaktywowane wirusy.
cząsteczki dostają się do wnętrza komórki
drogą endocytozy, endocytozy receptorowej
lub
fagocytozy
degradacja
do
polipeptydów wewnątrz endosomów, gdzie
łączą się z cząsteczkami MHC klasy II
kompleks antygen-cząsteczka MHC klasy II na
powierzchni komórki aktywuje CD4+ limfocyty
pomocnicze

Antygeny w niewielkim stopniu wiążą się
cząsteczkami klasy I stymulując odpowiedź
cytotoksyczną - z reguły nie powodują
odporności przeciwzakaźnej związanej z
limfocytami cytotoksycznymi, nie stymulują
również
odpowiedzi
immunologicznej
związanej z błonami śluzowymi; mogą
indukować
jednak
wysokie
miano
specyficznych IgG i IgM w surowicy –
skuteczne w przypadku chorób, w których
wirus przemieszcza się z krwią będąc
dostępnym dla przeciwciał (WZW B, odra);
również szczepionka przeciwko krztuścowi.

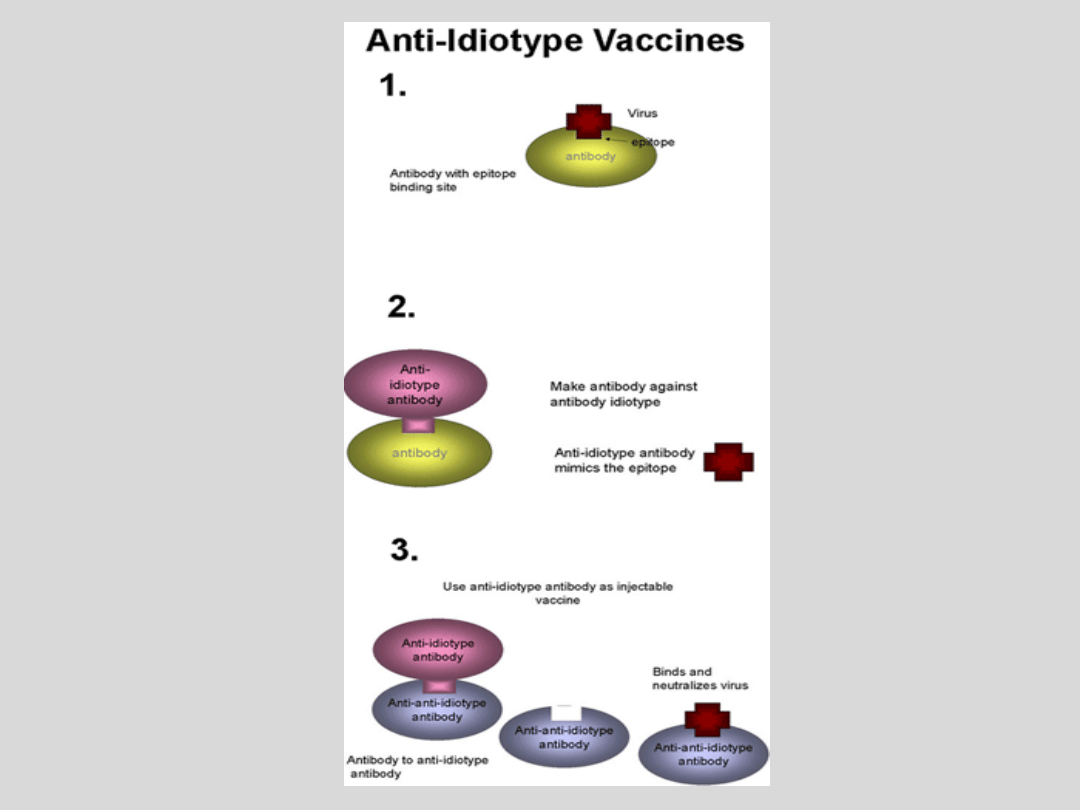
Szczepionki
antyidiotypowe
Fragment przeciwciała wiążący antygen
może
powodować
indukcję
produkcji
przeciwciał antyidiotypowych – wśród nich
powinny się znaleźć przeciwciała, których
część zmienna naśladuje budową antygen
(„obraz wewnętrzny antygenu”); cząsteczki
te powinny wywołać odpowiedź identyczną
do indukowanej antygenem. Przeciwciała
antyidiotypowe mogą indukować odpowiedź
przeciwzakaźną typu komórkowego zależną
od limfocytów T.

Infekcje HPV.
Immunoprofilaktyka
HPV (Human Papilloma Virus) – wirus
brodawczaka ludzkiego należący do rodziny
Papillomaviridae.
Jest
wirusem
bardzo
szeroko rozpowszechnionym – szacuje się, że
na całym świecie zarażonym jest nim około
630 milionów ludzi. Występuje w ponad stu
typach
wykazujących
zróżnicowane
powinowactwo narządowe w większości
stosunkowo
nieszkodliwych
(ustępujące
samoistnie zakażenia bezobjawowe), jednak
około trzydzieści typów odpowiada za
infekcje
narządów
płciowych
u obydwu płci.

W genomie HPV wyróżnia się region
niekodujący
białek
wirusowych,
region kodujący białka wczesne (E),
które są odpowiedzialne za procesy
transkrypcyjne
i regulacyjne oraz region kodujący
białka strukturalne kapsydu wirusa
(L).
W transformacji nowotworowej biorą
udział białka E6 i E7, które są
protoonkogenami.

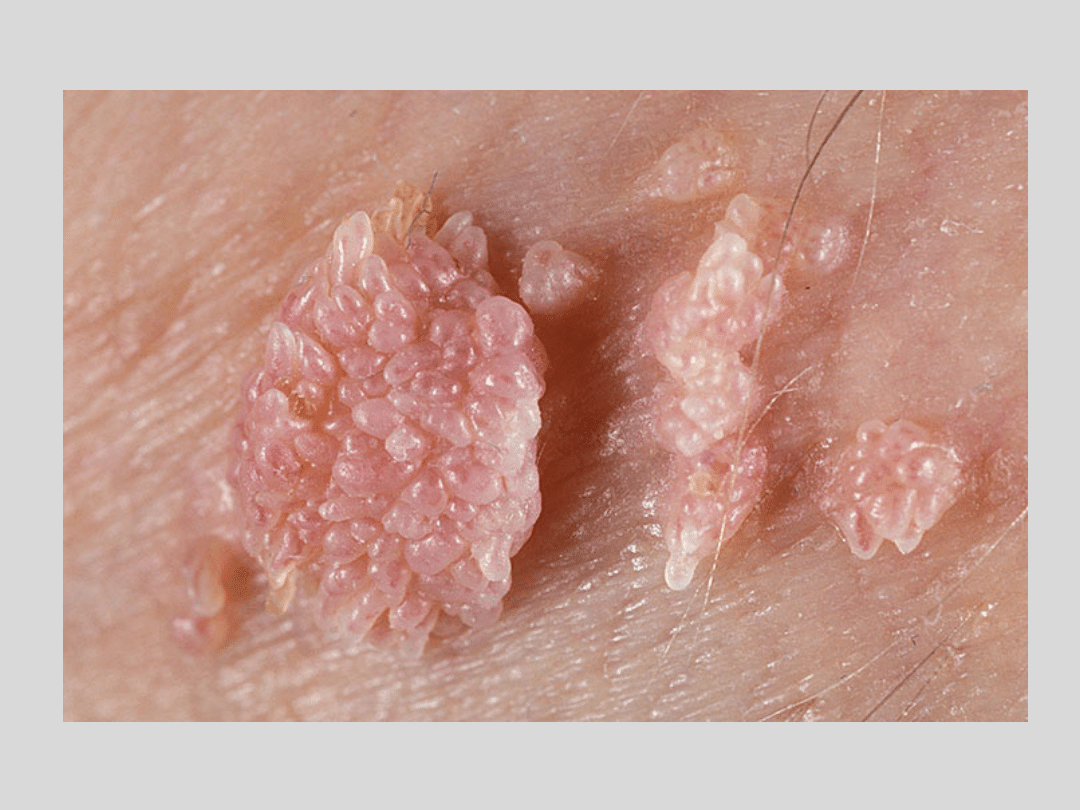
Skutki zakażenia
• Zakażenie bezobjawowe – większość zakażeń, ustępują samoistnie
dzięki naturalnej odpowiedzi immunologicznej
• Zakażenie wirusami HPV tzw. niskiego ryzyka (niskoonkogennymi)
powoduje powstanie brodawek w okolicy narządów płciowych –
brodawki nie wykazują cech nowotworów. Typy HPV 6 i 11
odpowiadają za 90% przypadków powstania brodawek
• Zakażenie
wirusami
HPV
tzw.
wysokiego
ryzyka
(wysokoonkogennymi) mogą prowadzić do powstania raka szyjki
macicy lub innych nowotworów narządów moczowo płciowych.
Najgroźniejsze
typy
to
16,
18,
31
i
45,
z czego dwa pierwsze odpowiedzialne są za ok. 70% przypadków
raka szyjki macicy
• Zakażenie noworodków przez matki wirusami typu 6 i 11 może
prowadzić do zespołu PRP – nawracającej brodawczakowatości
układu oddechowego. Objawem jest chrypka spowodowana przez
łagodne zmiany obrębie układu oddechowego oraz, rzadko,
utrudnione oddychanie

Rozwój nowotworu
• Zakażenia typami 6 i 11 powoduje minimalne ryzyko
progresji zmian
• W przypadku zakażeniem typami wysokoonkogennymi
może dojść do zmian w komórkach opisywanych jako
wewnątrznabłonkowa neoplazja szyjki macicy (CIN) -
zaburzenie
różnicowania
komórek
nabłonka
wielowarstwowego
płaskiego,
zmiana
morfologii
pojedynczych
komórek
i
zaburzenie
budowy
architektonicznej całego nabłonka:
• CIN 1 – dysplazja pierwszego stopnia jak również brodawki
narządów moczowo-płciowych
• CIN 2 – zmiany bardziej zaawansowane powiązane z
obecnością HPV typu 16 lub 18
• CIN 3 – uszkodzenie szyjki macicy znacznego stopnia lub
stan przedrakowy
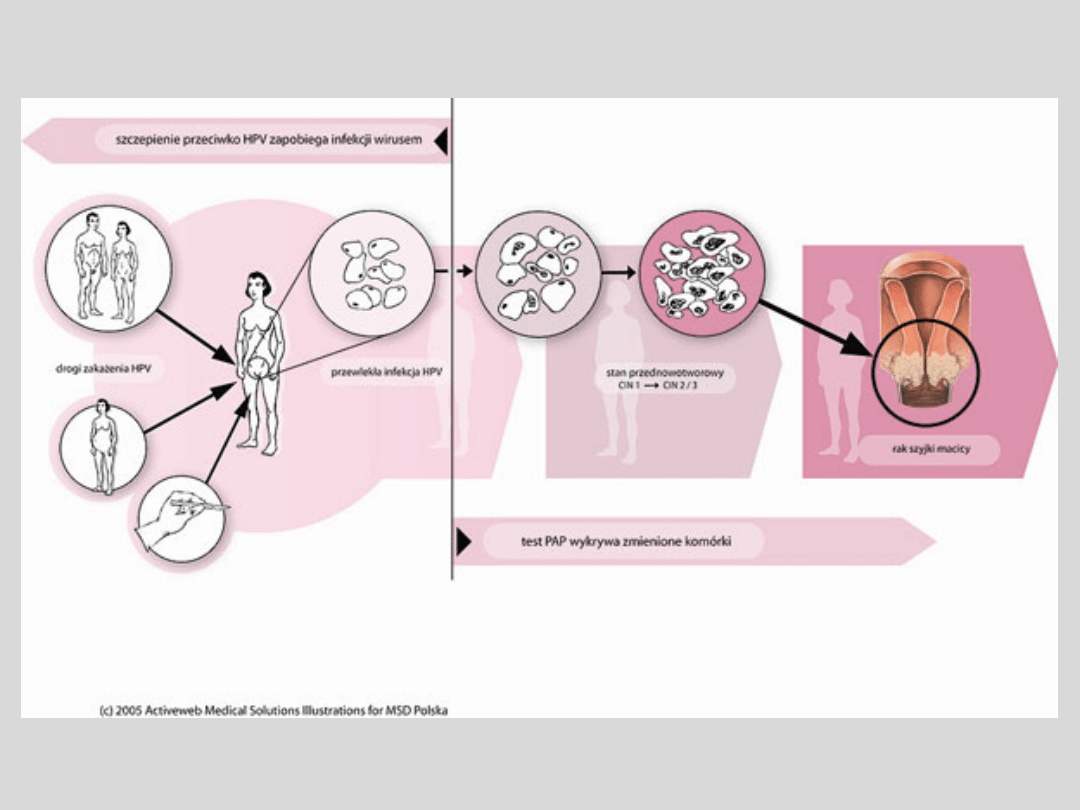
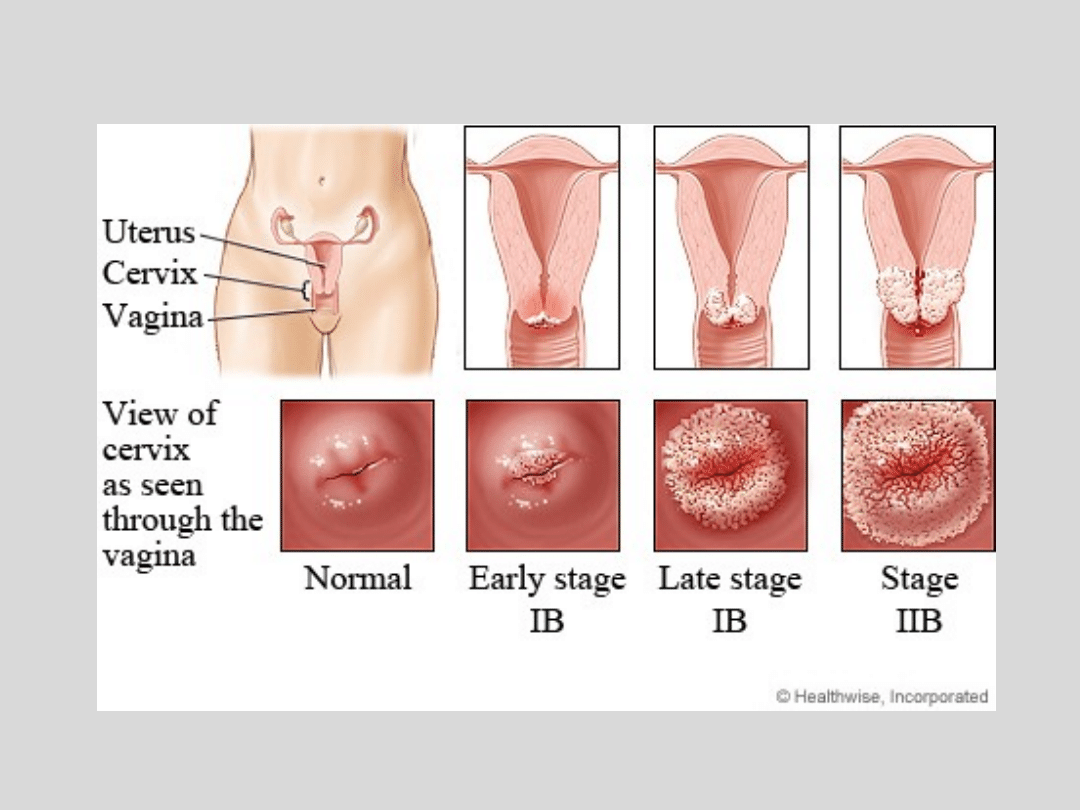
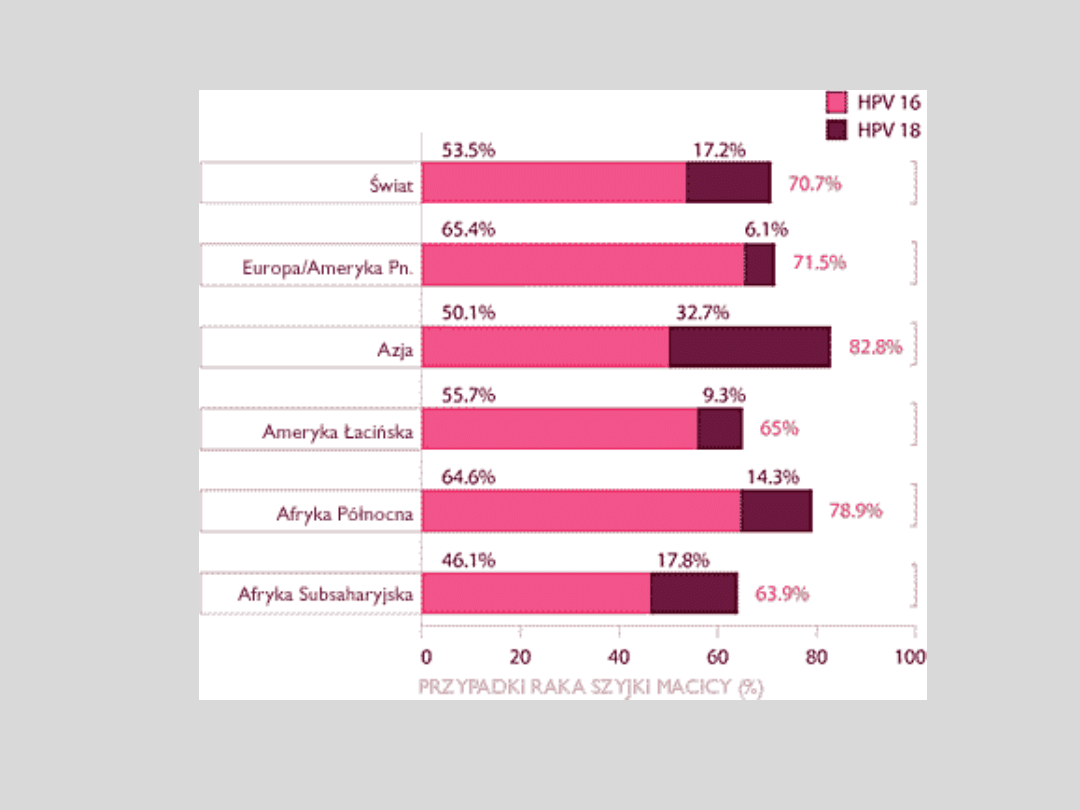

Zakażenie
Do zakażenia dochodzi podczas kontaktów
seksualnych z zarażoną osobą. Ryzyko zakażenia
można zmniejszyć przez ograniczenie liczby
partnerów seksualnych. Należy pamiętać, że
użycie
prezerwatywy
podczas
stosunku
zmniejsza, lecz nie eliminuje całkowicie ryzyka
zakażenia; stopień ochrony nie został jeszcze
dokładnie
określony,
dlatego
jedynym
stuprocentowo skutecznym sposobem uniknięcia
zakażenia jest unikanie kontaktów seksualnych z
osobami zarażonymi. Trzeba przy tym zwrócić
uwagę, że zakażenie u partnera może
przebiegać bezobjawowo.

Wykrywanie zakażenia
• Badanie cytologiczne (test Pap) - stosowane jako
badanie przesiewowe zmian w obrębie szyjki macicy;
nie jest ono specyficzne dla wirusów HPV, wynik
jednoznacznie nie potwierdza i nie wyklucza zakażenia
• Test DNA HPV – jest najpewniejszym sposobem
wykrycia infekcji, odbywa się metodą Real Time PCR.
Są to testy genetyczne, które pozwalają na dokładne
określenie, jakim typem wirusa HPV pacjent lub
pacjentka został/a zakażony/a. Technika oparta na
badaniu DNA bardzo precyzyjnie określa obecność
oraz ilość DNA wirusa w organizmie. Dzięki temu
wynik testu DNA posiada dużo większą dokładność niż
inne testy do diagnostyki HPV. Test DNA HPV pozwala
również wyjaśnić niejasny wynik cytologiczny oraz
umożliwia monitorowanie leczenia
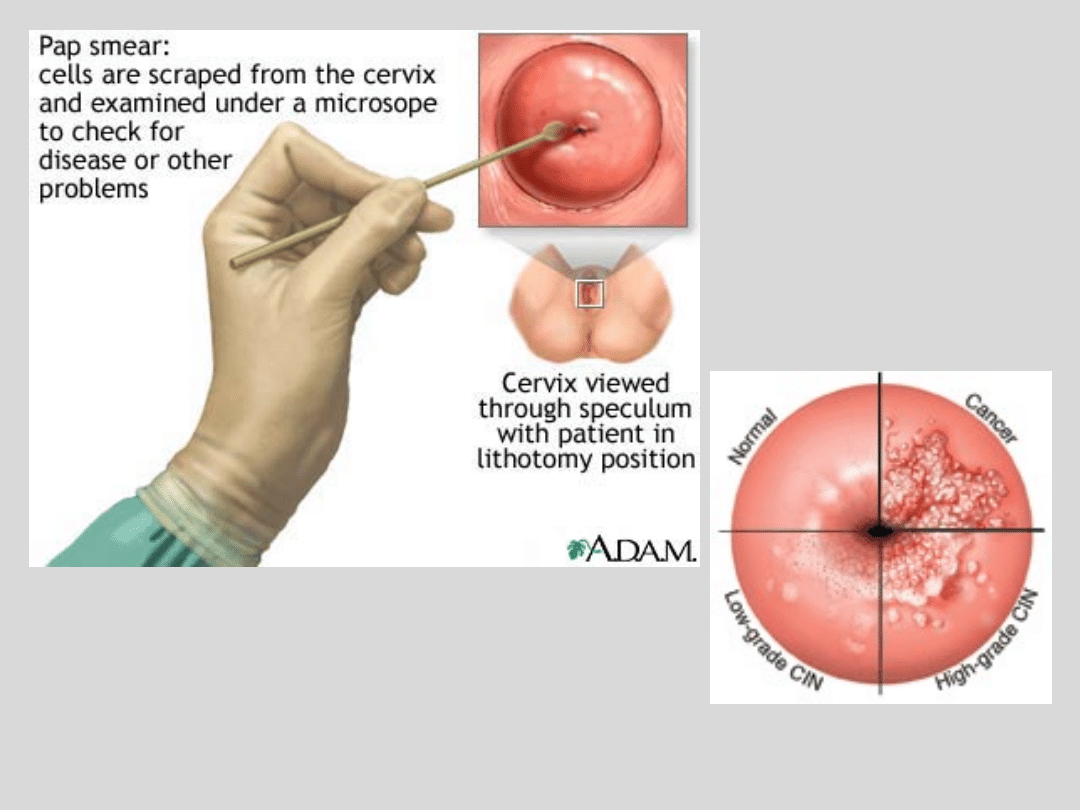

Leczenie zakażenia HPV
Na chwilą obecną nie istnieje skuteczna
metoda leczenia zakażeń wirusem – brak leków
antywirusowych. Jest jednak wiele sposobów
leczenia objawowego zmian powodowanych
przez działalność HPV – brodawek narządów
moczowo-płciowych, zmian przedrakowych, raka
szyjki macicy:
• krioterapia (zamrażanie)
• chirurgiczne wycięcie zmiany
• wycięcie zmiany pętlą elektryczną o dużej
częstotliwości (LEEP)
• zniszczenie tkanki laserem

Profilaktyka
Przy
tworzeniu
szczepionki
anty-HPV
została
wykorzystana naturalna zdolność białek otoczki
wirusowej
do
wywoływania
odpowiedzi
immunologicznej.
Drożdże
lub
systemy
bakulowirusowe zdolne są do rekombinacji proteiny L1,
która tworzy konformację trójwymiarową co powoduje
powstanie podobnej strukturalnie do wirusa cząsteczki
VLP (virus-like particle). Nie zawiera ona materiału
genetycznego i nie jest żywym ani atenuowanym
wirusem. Cząsteczki wirusopodobne (VLP) maja
zachowane
wszystkie
epitopy
konformacyjne
charakterystyczne dla prawdziwego wirusa, nie
posiadają jednak wirusowego DNA, co powoduje, że nie
mogą
wywołać
żadnych
zmian
patologicznych
zależnych od ekspresji onkogenów HPV (E6
i E7).
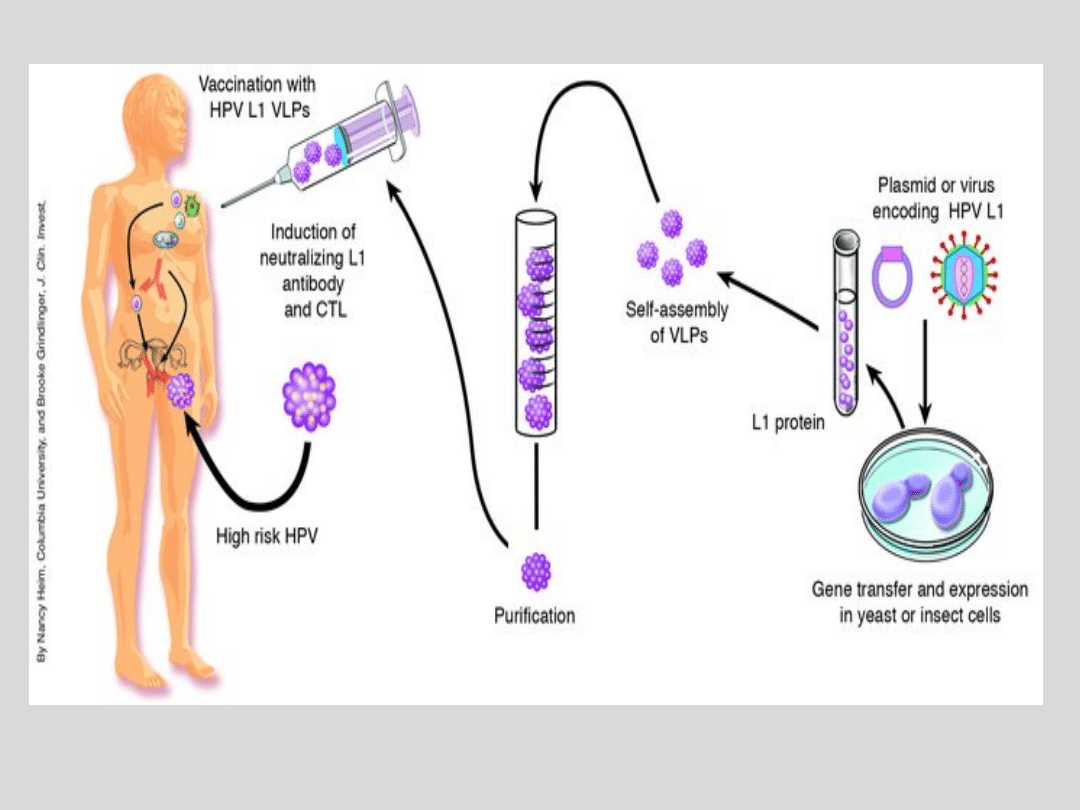

Obecnie dostępne są dwie szczepionki
profilaktyczne zawierające białko L1
kapsydu wirusowego:
• szczepionka czterowalentna Silgard/Gardasil – zawiera
zmodyfikowane przez drożdże białko kapsydu wirusa typu 6,
11, 16 i 18. Skierowana jest przeciw najczęściej
występującym typom HPV powodujących szereg zmian
rozrostowych, niezłośliwych, przednowotworowych oraz
nowotworowych,
szczególnie
na
błonach
narządów
płciowych. Adiuwantem w szczepionce jest amorficzny
siarczan wodorofosforanu glinu. Badania szczepionki
czterowalentnej
wykazały
100%
skuteczność
w
zapobieganiu powstania gruczołowego raka szyjki macicy
zależnego od HPV 16 i 18 oraz ponad 98% skuteczność w
zapobieganiu zmianom CIN 2 oraz CIN 3 spowodowanych
przez ww. typy; ponadto skutecznie chroni przed
powstaniem zmian o charakterze brodawek wywołanych
przez typy nisko- i wysokoonkogenne. Grupą docelową dla
tej szczepionki są dziewczęta i kobiety od 9 do 26 lat oraz
chłopcy od 9 do 15 lat, jednakże badania dowodzą wysokiej
skuteczności także u kobiet powyżej 45 r.ż.

• szczepionka dwuwalentna Cervarix - zawiera
zmodyfikowane białko dwóch typów wirusa – 16 i
18,
Cervarix
został
zarejestrowany
ze
wskazaniami
do
profilaktyki
zmian
przednowotworowych oraz raka szyjki macicy
związanych przyczynowo z infekcją wirusem
brodawczaka ludzkiego typu 16 i 18. Adiuwantem
w tej szczepionce jest związek oznaczony jako
AS04, który składa się ze związku glinu oraz
ufosforylowanego
lipidu
A
(liposacharydu
pozbawionego właściwości toksycznych). Badania
wskazują na 100% skuteczność w zapobieganiu
CIN2+ zależnego od typu 16 i 18 oraz 96,1% w
zapobieganiu CIN1+ zależnych od HPV 16 i 18.
Grupą docelową dla szczepionki są dziewczęta i
kobiety w wieku od 10 do 25 lat.

Kiedy?
Rutynowe stosowanie szczepionki przeciwko HPV
jest rekomendowane dla dziewczynek w
wieku 11-12 lat. Szczepionka ta jest także
rekomendowana dla dziewcząt w wieku 13-18
lat, które nie zostały zaszczepione wcześniej lub
te, u których należy dokończyć rozpoczętą później
serię szczepień. Nie ma wystarczających danych
klinicznych i ekonomicznych, które jednoznacznie
wskazywałyby, czy należy szczepić młode kobiety
w wieku 19-26 lat oraz kobiety starsze do 55 roku
życia w ogólnej populacji, które miały już kontakt
z HPV. Decyzja o szczepieniu powinna zostać
podjęta na podstawie rozmowy pomiędzy
zainteresowaną kobietą a jej lekarzem.

Bibliografia
• M.
Jakóbisiak
„Immunologia”
Wydawnictwo
Naukowe
PWN,
Warszawa 1996
• http://www.hpv.pl
• http://www.test-hpv.pl
• http://www.profilaktykarsm.pl
• www.ginekolpol.com/fulltxt.php?
ICID=882403

Dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
Wyszukiwarka
Podobne podstrony:
Charakterystyka odpowiedzi immunologicznej typu GALT faza indukcji
Ćw 06a Odpowiedź immunologiczna typu komórkowego Transformacja blastyczna
Odpowiedź immunologiczna na zakażenia wirusowe
Odpowiedź immunologiczna, Immunologia
Odpowiedź immunologiczna na zakażenia wirusowe
pochodzenie odpowiedzi immunologicznej
II Regulacja odpowiedzi immunologicznej
ODPOWIEDďz˝ IMMUNOLOGICZNA
Etapy odpowiedzi immunologicznej ustroju, Medycyna, Interna
pamiec i szczepionki - ok, Immunologia
Produkcja szczepionek stosowanych w immunoterapii swoistej
05 Odpowiedź immunologiczna w zakażeniu HIV i przebiegu AIDS
odpowiedzi immunologia, Stomatologia UMED Łódź, immunologia
13. Pierwotna i wtórna odpowiedź immunologiczna, Studia, biologia
Rodzaje i zasady odpowiedzialności lekarza w świetle aktualnego prawa polskiego, Medycyna sądowa
Charakterystyka odpowiedzi immunologicznej typu GALT faza indukcji
Regulacja odpowiedzi immunologicznej, cytokiny, immunoterapia
więcej podobnych podstron