
FARMACJA – Chemia organiczna
1
A N A L I Z A J A K O Ś C I O W A – C Z Ę Ś Ć T R Z E C I A
ANALIZA GRUP FUNKCYJNYCH: WĘGLOWODANY, AMINOKWASY, BIAŁKA, LIPIDY,
STEROIDY, ZWIĄZKI HETEROCYKLICZNE
WĘGLOWODANY
Węglowodany (cukry, sacharydy) są związkami pochodzenia naturalnego, w
większości przypadków ich struktura daje wyrazić się wzorem ogólnym C
n
(H
2
O)
m
. Aby
zaliczyć dany związek do węglowodanów należy brać pod uwagę jego właściwości
chemiczne i biologiczne.
Najbardziej ogólny podział cukrów przewiduje wyodrębnienie dwóch klas
związków:
1. cukry właściwe – węglowodany,
2. związki cukropodobne – substancje pektynowe, hemicelulozy, gumy roślinne itp.
Można
powiedzieć,
że
węglowodany
są
polihydroksyaldehydami
i
polihydroksyketonami, lub substancjami dającymi tego typu związki w wyniku hydrolizy.
Węglowodany obejmują bardzo liczną grupę związków o różnych właściwościach. Należą
tu związki drobno- i wielkocząsteczkowe, dobrze rozpuszczalne jak i praktycznie nie
rozpuszczalne w wodzie, o smaku słodkim i bez smaku, hydrolizujące i niehydrolizujące.
Węglowodany dzielimy zasadniczo na trzy typy:
1. monosacharydy
(jednocukry, cukry proste), które nie ulegają hydrolizie
do prostszych cząsteczek; struktura odpowiada, z reguły, wzorowi C
n
H
2n
O
n
, gdzie n =
2,3,4,......10;
2. oligosacharydy
(wielocukry
proste),
czyli
pochodne
monosacharydów,
zawierające wiązanie glikozydowe (acetalowe); w skład jednej cząsteczki
oligosacharydu może wchodzić od 2 do 9 cząsteczek monosacharydów;
3. polisacharydy
(wielocukry złożone), makrocząsteczki o budowie podobnej do
oligosacharydów; w wyniku hydrolizy dają wielką liczbę cząsteczek monosacharydów.
Monosacharydy
Monosacharydy (jednocukry) są to polihydroksyaldehydy lub polihydroksyketony.
Dzielimy je w zależności od:
a. liczby atomów węgla w cząsteczce na: triozy, tetrozy, pentozy, heksozy, itd.,
b. obecności grupy funkcyjnej na: aldozy – posiadające grupę aldehydową, ketozy –
zawierające grupę ketonową.
Poniżej przedstawione są wzory i nazwy monosacharydów należących do szeregu D
(konfiguracja podstawników na ostatnim asymetrycznym atomie węgla w cząsteczce jest
FARMACJA – Chemia organiczna
2
taka jak w aldehydzie D-glicerynowym). Pentozy i heksozy mają największe znaczenie
wśród monosacharydów.
ALDOZY
KETOZY
O
OH
H
OH
H
OH
D-erytroza
OH
O
O
H
H
H
OH
D-treoza
OH
OH
O
H
OH
D-erytruloza
PENTOZY
OH
O
H
OH
H
OH
H
OH
OH
O
O
H
H
H
OH
H
OH
OH
O
H
OH
O
H
H
H
OH
OH
O
O
H
H
O
H
H
H
OH
D-arabinoza
D-ryboza
D-ksyloza
D-liksoza
OH
H
OH
H
OH
O
OH
OH
O
H
H
H
OH
O
OH
D-rybuloza
D-ksyluloza
HEKSOZY
OH
O
H
OH
H
OH
H
OH
H
OH
OH
O
O
H
H
H
OH
H
OH
H
OH
OH
O
H
OH
O
H
H
H
OH
H
OH
OH
O
O
H
H
O
H
H
H
OH
H
OH
D-alloza
D-altroza
D-glukoza
D-mannoza
OH
O
H
OH
H
OH
H
OH
OH
OH
O
H
H
H
OH
H
OH
O
OH
OH
H
OH
O
H
H
H
OH
O
OH
OH
O
H
H
O
H
H
H
OH
O
OH
D-psikoza
D-fruktoza
D-sorboza
D-tagatoza
OH
O
H
OH
H
OH
O
H
H
H
OH
OH
O
O
H
H
H
OH
O
H
H
H
OH
OH
O
H
OH
O
H
H
O
H
H
H
OH
OH
O
O
H
H
O
H
H
O
H
H
H
OH
D-guloza
D-idoza
D-galaktoza
D-taloza
Monosacharydy występują głównie w formie pierścieniowej dzięki tworzeniu się
wewnątrzcząsteczkowego wiązania hemiacetalowego pomiędzy grupą karbonylową i jedną
z grup hydroksylowych.
-D-glukopiranoza
-D-fruktofuranoza
-D-galaktopiranoza
-D-fruktopiranoza
CH
2
OH
OH
HOH
2
C
O
H
H
H
OH
H
O
H
O
H
H
H
OH
H
OH
H
OH
HOH
2
C
O
CH
2
OH
H
OH
O
H
H
O
H
H
H
OH
H
O
O
OH
H
H
H
O
H
OH
H
OH
H
OH
O
OH
OH
H
H
O
H
H
OH
H
H
OH
O
OH
H
H
O
H
H
OH
H
OH
H
OH
O
OH
H
O
H
OH
H
H
O
H
OH
Projekcje Hawortha
Projekcje Fischera
CH
2
OH
H
OH
O
H
H
H
OH
H
OH
H
O
FARMACJA – Chemia organiczna
3
Pięcio- i sześcioczłonowe cykliczne hemiacetale są szczególnie trwałe, stąd węglowodany
istnieją jako mieszanina form cyklicznych i łańcuchowych pozostających ze sobą w
równowadze. Dla pięcioczłonowej formy pierścieniowej cząsteczki cukru przyjęto
określenie furanoza, natomiast dla formy sześcioczłonowej – piranoza. Oba określenia
pochodzą od cyklicznych eterów: furanu i piranu.
Utworzenie ugrupowania hemiacetalowego skutkuje także utworzeniem
dodatkowego centrum stereogenicznego w cząsteczce cukru. Karbonylowy atom węgla,
pierwotnie o hybrydyzacji sp
2
, staje się atomem tetraedrycznym o hybrydyzacji sp
3
,
połączonym z czterema różnymi atomami. W zależności od konfiguracji podstawników
przy tym właśnie atomie węgla, możemy mieć do czynienia z anomerem α lub β
pierścieniowej formy cukru. Obie formy różnią się skręcalnością właściwą [α]
D
oraz,
nieznacznie, temperaturą topnienia. Anomery w roztworze wodnym ulegają mutarotacji,
następuje odwracalne otwarcie pierścienia i odtworzenie grupy karbonylowej, po czym
zachodzi ponowne zamknięcie pierścienia, często z odwróceniem konfiguracji na
hemiacetalowym (anomerycznym) atomie węgla. Prowadzi to powstania mieszaniny
anomerów, pozostających wobec siebie w równowadze, a przez to do zmiany skręcalności
roztworu cukru. Proces ten zachodzi powoli w obojętnym pH, ale jest katalizowany
zarówno przez kwasy jak i zasady.
Właściwości chemiczne cukrów wynikają z faktu, że związki te są jednocześnie
aldehydami lub ketonami oraz alkoholami. Z obecnością grup hydroksylowych wiąże się
zdolność cukrów do tworzenia estrów, z których duże znaczenie mają estry fosforanowe.
Estry te biorą udział w katabolicznych i anabolicznych przemianach cukrów.
Z obecnością grup karbonylowych wiąże się zdolność cukrów do enolizacji. Pod
wpływem rozcieńczonych zasad ketozy i aldozy ulegają wzajemnej izomeryzacji z
wytworzeniem pośrednich form endiolowych. Proces ten nazywany jest epimeryzacją, a
cukry w nim uczestniczące – epimerami. W środowisku zasadowym epimery pozostają ze
sobą w równowadze.
Przemiany tego typu zachodzą również w komórkach roślinnych i zwierzęcych,
katalizowane są przez enzymy – epimerazy.
-D-glukopiranoza
36%
[
]
D
= +112,2
0
O
OH
H
H
H
O
H
OH
H
OH
H
OH
OH
H
H
H
O
H
OH
H
OH
OH
H
O
O
H
H
H
H
O
H
OH
H
OH
OH
OH
-D-glukopiranoza
64%
[
]
D
= +18,7
0
D-glukoza
[
]
D
roztworu w rownowadze
= 36% x (+112,2
0
) + 64% x (+18,7
0
) = +52,36
0
anomeryczny at. C
anomeryczny at. C
FARMACJA – Chemia organiczna
4
1.
Reakcje z pochodnymi amoniaku
Grupa karbonylowa w cukrach, poza tendencją do enolizacji, wykazuje właściwości
typowe dla aldehydów i ketonów. Przede wszystkim ulega reakcjom addycji nukleofilowej;
w reakcjach z fenylohydrazyną, hydroksyloaminą itp. otrzymuje się odpowiednie
pochodne azotowe (patrz, reakcje wspólne aldehydów i ketonów).
Dość istotną reakcją w analizie cukrów jest otrzymywanie osazonów. Cukry
redukujące w reakcji z fenylohydrazyną dają krystaliczne pochodne, różniące się
kształtem kryształów oraz temperaturami topnienia.
Ponieważ reakcja z fenylohydrazyną zachodzi na dwóch pierwszych atomach węgla, cukry
różniące się konfiguracją przestrzenną na tylko tych właśnie atomach węglach, a więc
będące w stosunku do siebie epimerami, tworzą identyczne osazony. Glukoza, fruktoza,
mannoza dają ten sam osazon, który krystalizuje w postaci żółtych, cienkich igiełek,
rozrzuconych pojedynczo lub zebranych w wiązki. Cukry różniące się konfiguracją na
dalszych atomach węgla tworzą różne osazony, na tej podstawie mogą być identyfikowane
oraz odróżniane jedne od drugich.
OH
O
H
OH
O
H
H
H
OH
H
OH
NH
2
-NH-C
6
H
5
OH
N
H
OH
O
H
H
H
OH
H
OH
NH
C
6
H
5
-H
2
O
NH
2
-NH-C
6
H
5
-NH
3
, C
6
H
5
NH
2
OH
N
O
H
H
H
OH
H
OH
NH
C
6
H
5
O
NH
2
-NH-C
6
H
5
-H
2
O
osazon glukozy
glukoza
fenylohydrazon glukozy
OH
O
H
H
H
OH
H
OH
N
NH C
6
H
5
N
NH C
6
H
5
OH
O
H
OH
O
H
H
H
OH
H
OH
OH
O
H
H
H
OH
H
OH
OH
OH
OH
O
H
H
H
OH
H
OH
O
OH
D-glukoza
endiol
D-fruktoza
O
H
-
O
H
-
Epimeryzacja
OH
O
O
H
H
O
H
H
H
OH
H
OH
D-mannoza
O
H
-
FARMACJA – Chemia organiczna
5
2.
Próby grupowe cukrów
Cząsteczki cukrów pod wpływem stężonych kwasów, takich jak kwas solny,
siarkowy czy octowy, ulegają odwodnieniu i przekształcają się w pochodne furanu, z
pentoz powstaje furfural, z heksoz – 5-hydroksymetylofurfural.
Związki te kondensując z fenolami dają barwne pochodne triarylometanowe.
Do barwnych prób cukrów (monosacharydów, ale również oligo- i polisacharydów, które
pod wpływem kwasów ulegają hydrolizie do cukrów prostych) należą następujące reakcje:
a.
tymolowa – uzyskuje się pochodne barwy czerwonej,
b.
Molischa z α-naftolem – barwa czerwonofioletowa),
c.
Biala z orcyną na pentozy – roztwór zabarwia się na zielono,
d.
Seliwanowa z rezorcyną na ketozy – roztwór zabarwia się na różowo.
Próby Molischa i tymolowa są reakcjami grupowymi. Znaczy to, że wynik ujemny
reakcji wyklucza obecność węglowodanów, natomiast dodatni nie jest wystarczającym
dowodem ich obecności, gdyż pozytywny wynik próby dają także aldehydy, aceton, kwasy
mlekowy, kwas cytrynowy i mrówkowy.
W próbie Biala pentozy, po odwodnieniu do furfuralu, w reakcji z orcyną i w obecności
jonów żelaza(III) tworzą kompleksy o barwie zielononiebieskiej. Heksozy natomiast
przekształcając się w hydroksymetylofurfural w tych samych warunkach reagują
znacznie słabiej dając kompleks o barwie zielonobrązowej.
Reakcja Seliwanowa jest wykorzystywana do odróżnienia ketoz od aldoz na zasadzie
różnicy w szybkości odwadniania tych cukrów. Ketozy ogrzewane w 12% wodnym
OH
+
2
OH
O
C
R
OH
H
OH
O
C
R
O
Próba Molischa
H
+
- H
2
O
CHO
O
R
R = CH
2
OH,
R = H, furfural
5- hydroksymetylofurfural
czerw onofioletow y barw nik
C
5
H
10
O
5
HCl
- 3H
2
O
O
O
H
C
6
H
12
O
6
HCl
- 3H
2
O
O
O
H
HOH
2
C
furfural
5-hydroks ymetyl ofurfural
pentoza
heksoza
FARMACJA – Chemia organiczna
6
roztworze HCl w temperaturze 100°C w ciągu 30 sekund ulegają odwodnieniu
do 5-hydroksymetylofurfuralu, który z rezorcyną tworzy kompleks o barwie czerwono-
wiśniowej. W tych warunkach aldozy nie ulegają odwodnieniu, co pozwala na ich
odróżnienie od ketoz. Użycie kwasu bardziej stężonego jak również wydłużenie czasu
ogrzewania lub podwyższenie temperatury może sprawić, iż reakcji tej ulegną również
aldozy. Próba ta daje również wynik pozytywny w przypadku wielocukrów zawierających
ketozy.
3.
Próby redukcyjne cukrów
W przypadku aldoz można mówić o własnościach redukujących. Liczne próby na
cukry oparte są na redukcji dwuwartościowego jonu miedzi(II) do jednowartościowego
jonu miedzi(I), podczas których aldozy utleniają się do kwasów aldonowych (glukoza
utlenia się do kwasu glukonowego). Najczęściej stosowane próby redukcyjne cukrów to
próby: Trommera, Fehlinga, Benedicta i Barfoeda.
Ponadto aldozy, podobnie jak aldehydy, dają pozytywny wynik reakcji Tollensa (patrz:
reakcje aldehydów).
W próbie Fehlinga po zmieszaniu odczynników „Fehling I” (CuSO
4
×5H
2
O w
rozcieńczonym H
2
SO
4
) i „Fehling II” (roztwór winianu sodowo-potasowego i NaOH)
powstaje zasadowy roztwór kompleksu wodorotlenku miedzi z winianem, co zapobiega
wytrącaniu się Cu(OH)
2
i maskowaniu końcowego produktu reakcji, czerwonego Cu
2
O.
Kompleks posiada strukturę trójwodnego winianu miedziowego, z sześciokrotnie
skoordynowanym kationem miedzi(II). Dodany cukier redukujący ulega utlenieniu
oddając elektrony, które przyjmowane są przez Cu
2+
. W wyniku tego kompleks
O
OH
H
H
H
O
H
OH
H
OH
H
OH
OH
H
H
H
O
H
OH
H
OH
OH
O
H
OH
H
H
H
O
H
OH
H
OH
OH
O
OH
O
H
-
Cu
2+
Cu
+
+
-
O
O
H
R
1
O
H
OH
R
Reakcja Biala: orcyna (R = CH
3
), produkt barwy zielonej
Reakcja Seliwanowa: rezorcyna (R = H), produkt barwy czerwonej
R
1
= H; CH
2
OH
2
+
H
+
-H
2
O
O
O
OH
O
R
R
R
1
Próba Biala / Seliwanowa
FARMACJA – Chemia organiczna
7
wodorotlenku miedzi z winianem rozpada się, Cu
2+
redukuje się do Cu
+
i po ogrzaniu
wytrąca się w postaci czerwonego lub pomarańczowego osadu tlenku miedzi(I) (Cu
2
O).
Próba Benedicta (CuSO
4
×5H
2
O, cytrynian sodu, węglan sodu) należy do
najbardziej specyficznych i czułych prób redukcyjnych na cukry. Powstający w tej reakcji
Cu
2
O w zależności od ilości cukru redukującego ma różne zabarwienie (od zielonożółtego
przez pomarańczowe do czerwonego).
W próbie Trommera rolę solubilizatora wodorotlenku miedzi(II) spełnia sam
cukier. Z tego powodu dodawanie zbyt dużej ilości siarczanu miedzi(II) może doprowadzić
do nadmiaru Cu(OH)
2
, który po ogrzaniu przechodzi w czarny CuO i maskuje prawidłowy
wynik reakcji. W przypadku dodania zbyt dużej ilości roztworu CuSO
4
i wytrącenia
wodorotlenku miedzi, należy osad odsączyć, po czym dopiero ogrzać próbę.
Próba Barfoeda (roztwór octanu miedzi i kwasu mlekowego) w modyfikacji Tauber-
Kleinera pozwala odróżnić cukry proste od dwucukrów redukujących. W przypadku
monocukrów czerwony osadu Cu
2
O pojawia się już po ok. 15 minutach ogrzewania we
wrzącej łaźni wodnej. Natomiast w przypadku disacharydów redukujących dodatni wynik
próby obserwuje się po ok. 2-3-krotnie dłuższym czasie.
Fakt, że cukry mogą zostać utlenione do kwasów aldonowych został wykorzystany
w celu odróżnienia aldoz od ketoz. Tylko w obecności aldoz następuje odbarwienie wody
bromowej z dodatkiem kwaśnego węglanu sodu.
Oligosacharydy
Oligosacharydami nazywamy wielocukry proste, zbudowane z niewielkiej liczby
cząsteczek cukrów prostych (monosacharydów) połączonych wiązaniami glikozydowymi.
Najprostszymi, a jednocześnie najważniejszymi i najbardziej rozpowszechnionymi
oligosacharydami są dwucukry, które w wyniku hydrolizy (kwasowej lub enzymatycznej),
dają monosacharydy i to najczęściej heksozy. W skład dwucukrów mogą wchodzić dwie
identyczne lub różne reszty cukrów prostych.
OH
O
H
OH
O
H
H
O
H
H
H
OH
H
D-galaktoza
Br
2
, H
2
O
OH
O
H
OH
O
H
H
O
H
H
H
OH
O
-
NaHCO
3
sól kw asu D-galaktonow ego
FARMACJA – Chemia organiczna
8
Monosacharydy wchodzące w skład dwucukrów łączą się między sobą za pomocą
wiązania O-glikozydowego α lub β. Atom wodoru hemiacetalowej grupy wodorotlenowej w
anomerze α lub β jest podstawiany resztą drugiej cząsteczki cukru, a tworzące się
wiązanie określane jest jako glikozydowe.
W przypadku, gdy w jednej z reszt monocukrowych, składających się na
cząsteczkę disacharydu, znajduje się wolna grupa hydroksylowa przy hemiacetalowym
atomie węgla, to taki disacharyd zachowuje się jak cukier prosty i jest określany
dwucukrem redukującym.
Disacharydy redukujące, między innymi, ulegają:
a. mutarotacji,
b. próbom redukcyjnym (reakcjom z odczynnikami Tollensa, Fehlinga i Benedicta itp.),
c. reakcjom addycji nukleofilowej, dając cyjanohydryny, oksymy, hydrazony, osazony
itp.
Najbardziej znanymi dwucukrami redukującymi są maltoza i laktoza. Maltoza
zbudowana jest z dwóch cząsteczek α-D-glukopiranozy połączonych wiązaniem α-1,4-
glikozydowym, natomiast laktoza składa się z α-D-glukopiranozy oraz β-D-
galaktopiranozy połączonych wiązaniem β-1,4-glikozydowym.
Jeżeli w powstawaniu wiązania glikozydowego pomiędzy dwiema cząsteczkami
monocukru biorą udział oba układy hemiacetalowe, to otrzymujemy disacharydy
nieredukujące, które nie dają reakcji typowych dla disacharydów redukujących czy
monosacharydów. Przeprowadzenie takich reakcji jest możliwe dopiero po hydrolizie
wiązania glikozydowego i uwolnieniu cząsteczek monocukrów.
w iązanie O-glikozydow e
anomeryczny atom w ęgla
O
OH
OH
H
O
H
H
H
OH
H
H
OH
-
D-Idopiranoza
C
5
H
10
O
5
O
O
OH
H
O
H
H
H
OH
H
H
OH
C
5
H
9
O
4
-pentozylo-D-idopiranozyd
anomeryczny atom w ęgla
(acetalow y)
(hemiacetalow y)
- H
2
O
maltoza
O
H
H
H
O
H
H
OH
H
OH
O
OH
O
OH
H
H
H
OH
H
OH
H
OH
O
O
H
H
H
O
H
OH
H
OH
H
OH
O
OH
H
H
H
OH
H
OH
H
OH
laktoza
reszta nieredukująca
reszta redukująca
reszta nieredukująca
reszta redukująca
1
1
4
1
1
4
O-
-D-galaktopiranozylo-(1 4)-
-D-glukopiranoza
O-
-D-glukopiranozylo-(1 4)-
-D-glukopiranoza
FARMACJA – Chemia organiczna
9
Przedstawicielem dwucukrów nieredukujących jest sacharoza, zbudowana z α-D-
glukopiranozy i β-D-fruktofuranozy połączonych ze sobą wiązaniem α-1,2-glikozydowym.
Polisacharydy
Polisacharydy są glikozydami, których cząsteczki utworzone są z setek lub tysięcy
reszt węglowodanowych, połączonych ze sobą poprzez atomy tlenu grup
hemiacetalowych.
Najważniejszymi polisacharydami są:
1. skrobia – pochodzenia wyłącznie roślinnego,
2. glikogen – pochodzenia wyłącznie zwierzęcego,
3. celuloza.
Skrobia – jest podstawowym składnikiem świata roślinnego. Ziarna skrobi,
charakterystyczne dla roślin, z których pochodzą, różnią się rozmiarami i zbudowane są z
dwóch warstw:
a. zewnętrznej – amylopektyny nierozpuszczalnej w wodzie,
b. wewnętrznej – amylozy rozpuszczalnej w wodzie.
Produktami kwasowej hydrolizy skrobi w początkowym etapie są różne dekstryny o
coraz niższym ciężarze cząsteczkowym. W dalszej kolejności uzyskuje się maltozę, a w
końcu glukozę.
Charakterystyczną reakcją dla polisacharydów zbudowanych z cząsteczek glukozy
jest próba z jodem. Amyloza daje zabarwienie niebieskie, amylopektyna – fioletowe,
glikogen – brunatnoczerwone, a celuloza – żółte. Niebieska barwa jest charakterystyczna
dla długich spiralnie skręconych nici, bez bocznych odgałęzień. W miarę skracania się
łańcucha wzmaga się zabarwienie czerwone. Produkty degradacji skrobi (dekstryny) o
długich łańcuchach barwią się na niebiesko-fioletowo (amylodekstryny), o średniej
O
H
O
H
OH
H
H
O
H
OH
O
O
H
H
H
O
H
OH
H
OH
H
OH
O
O
H
H
H
O
H
OH
H
OH
H
OH
O
H
H
O
H
OH
H
O
H
OH
reszta nieredukująca
reszta nieredukująca
sacharoza
2-O-(
-D-glukopiranozylo)-
-D-fruktofuranozyd
1
2
1
2
skrobia
H
2
O
H
+
amylodekstryny
erytrodekstryny
H
2
O
H
+
H
2
O
H
+
achrodekstryny
H
2
O
H
+
maltoza
H
2
O
H
+
glukoza
FARMACJA – Chemia organiczna
10
długości barwią się na czerwono (erytrodekstryny), a krótkie łańcuchy nie zmieniają
barwy jodu (achrodekstryny). W miarę postępu hydrolizy ilość wolnych grup
aldehydowych w dekstrynach wzrasta.
Cząsteczki skrobi w kleiku skrobiowym są otoczone płaszczem wodnym. Dodanie
substancji wiążących wodę (np. sole takie jak siarczan amonu) powoduje strącanie się
skrobi z roztworu. Skrobia jest źle rozpuszczalna w rozpuszczalnikach organicznych.
Amyloza z niektórymi rozpuszczalnikami (1-butanol) tworzy trudno rozpuszczalne związki
inkluzyjne.
AMINOKWASY
Aminokwasy są to związki, które w łańcuchu węglowym zawierają zarówno grupę
aminową jak i grupę karboksylową. Grupa aminowa w stosunku do grupy karboksylowej
może zajmować dowolną pozycję:
,
,
itd. W aminokwasach naturalnych, otrzymanych
przez hydrolizę białek, grupa aminowa występuje zawsze w pozycji
.
Aminokwasy zaliczane są do amfolitów, gdyż zachowują się jak kwasy i zasady. W
stanie stałym występują one w formie jonów obojnaczych mających charakter soli
wewnętrznych.
Ze względu na budowę chemiczną
-aminokwasy można podzielić na:
1.
Aminokwasy z ugrupowaniem niepolarnym lub hydrofobowym (alkilowym lub
arylowym): glicyna, alanina, walina, leucyna, izoleucyna, fenyloalanina, prolina.
2.
Aminokwasy z ugrupowaniem polarnym, ale niezjonizowanym zawierającym grupy
funkcyjne: OH, SH, SCH
3
, S-S oraz heterocykliczne. Są to seryna, cysteina,
treonina, tyrozyna, metionina, cystyna, tryptofan.
3.
Aminokwasy kwaśne, zawierające dodatkową grupę karboksylową: kwas
asparaginowy, kwas glutaminowy oraz ich amidy (asparagina, glutamina).
4.
Aminokwasy zasadowe, zawierające dodatkową grupę zasadową: aminową – lizyna,
ornityna; guanidynową – arginina; pierścień imidazolowy – histydyna.
Obecność dwóch grup reaktywnych wpływa na właściwości chemiczne
aminokwasów. Reakcje, którym ulegają aminokwasy można więc podzielić na niżej
wymienione grupy.
O
NH
3
+
R
O
-
O
NH
2
R
OH
COO
+
NH
3
Wzory ogól ne natural nych aminokwasów występujących w białkach
-
1
2
FARMACJA – Chemia organiczna
11
1.
Wzajemne oddziaływanie grupy aminowej i karboksylowej
Grupa karboksylowa ma zdolność do odszczepiania protonu, natomiast grupa
aminowa, jako zasadowa, może przyłączać proton. Obie grupy sprawiają, że aminokwasy
są związkami amfoterycznymi, gdyż mogą reagować zarówno z zasadami jak i z kwasami.
Ponadto grupy oddziaływują na siebie wzajemnie powodując powstawanie soli
wewnętrznej aminokwasu. Jest to powodem wysokich temperatur topnienia
poszczególnych aminokwasów oraz ich dobrej rozpuszczalności w wodzie i słabej w
rozpuszczalnikach organicznych (w przeciwieństwie do kwasów i amin, które z reguły
trudno rozpuszczają się w wodzie, a bardzo dobrze w rozpuszczalnikach organicznych).
Całkowity ładunek cząsteczki aminokwasu zależy od pH środowiska. Wartość pH, przy
której aminokwas istnieje w postaci jonu obojnaczego określany jest punktem
izoelektrycznym (pI).
Wartość pI większości aminokwasów wynosi ok. 6, obecność w cząsteczce dodatkowych
grup funkcyjnych aminowych albo karboksylowych powoduje przesunięcie punktu
izoelektrycznego w kierunku, odpowiednio, większych albo mniejszych wartości.
2.
Reakcje grupy karboksylowej
Aminokwasy są mocniejszymi kwasami od kwasu węglowego, rozpuszczają się
więc, podobnie jak kwasy karboksylowe, w 5% NaHCO
3
. Reakcji towarzyszy wydzielanie
się CO
2
, czyli zjawisko perlenia, które daje się zauważyć zazwyczaj dopiero po około 3
minutach.
Typową reakcją grupy karboksylowej aminokwasów jest kondensacja z grupą
aminową innego aminokwasu z utworzeniem wiązania peptydowego. Obie grupy nie łatwo
reagują ze sobą i w praktyce wymagane jest uaktywnienie grupy karboksylowej w jednym
z reagentów, np. poprzez utworzenie tzw. aktywnego estru. Jednocześnie, aby uniknąć
niepożądanych połączeń aminokwasów, drugi z reagentów, tzw. komponent aminowy,
O
NH
3
+
R
OH
O
NH
3
+
R
O
-
O
NH
2
R
O
-
- H
+
H
+
+
- H
+
H
+
+
kation
pH < pI
jon obojnaczy
pH = pI
anion
pH > pI
Równowaga kwasowo - zasadowa w roztworze aminokwasu
O
NH
3
+
R
O
-
+
NaHCO
3
O
NH
2
R
O
-
+
CO
2
+
H
2
O
+
Na
+
FARMACJA – Chemia organiczna
12
musi mieć „zablokowaną” grupę karboksylową. Niejednokrotnie dokonuje się tego
poprzez utworzenie estrów etylowych lub metylowych.
3.
Reakcje grupy aminowej
Grupa aminowa w aminokwasach ulega typowym reakcjom alifatycznych amin I-
rzędowych z wyjątkiem proliny i hydroksyproliny, które w pozycji α zawierają II-rzędową
grupę aminową. Najważniejszą reakcją grupy aminowej jest acylowanie prowadzące do
powstania amidu. Reakcja tego typu z udziałem innego aminokwasu, tzw. komponentu
kwasowego, jest wykorzystywana do tworzenia peptydów. Z oczywistych względów
komponent kwasowy musi mieć zabezpieczoną grupę aminową. W tym celu często
przeprowadza się reakcje acylowania lub alkilowania grupy aminowej odpowiednimi
pochodnymi chlorowcowymi (chlorki kwasowe, chlorki alkilowe).
Reakcjami charakterystycznymi grupy aminowej w aminokwasach jest działanie
kwasu azotowego(III) oraz ninhydryny:
a. Reakcja van Slyke’a z kwasem azotowym(III)
Wolne aminokwasy w wyniku działania HNO
2
ulegają deaminacji z wydzieleniem azotu i
utworzeniem
-hydroksykwasu (patrz: reakcje amin alifatycznych z HNO
2
).
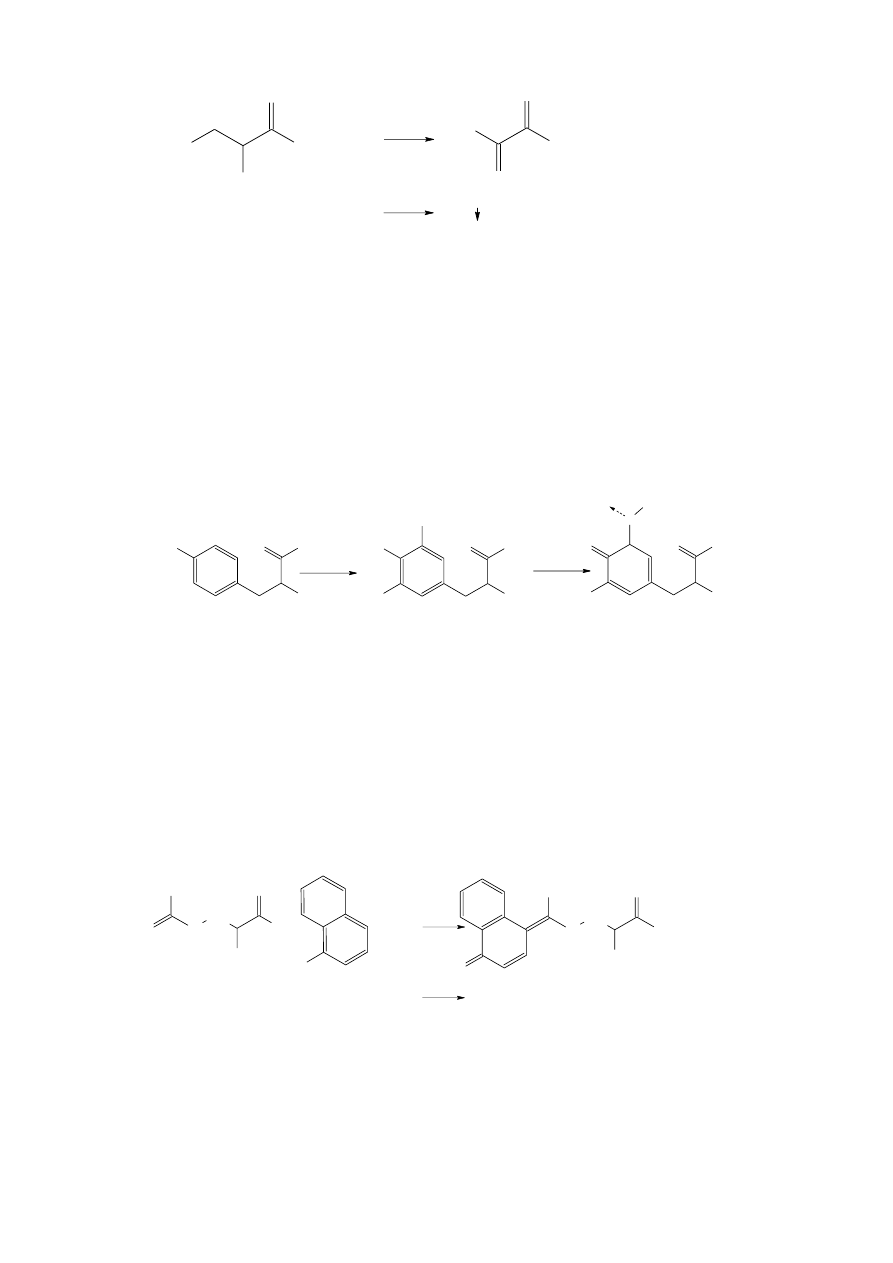
b. Reakcja ninhydrynowa
Aminokwasy, peptydy oraz białka dają charakterystyczną reakcję z roztworem
ninhydryny, podobnie jak amoniak i alifatyczne aminy I-rzędowe. Aminokwasy z wolną
grupą aminową pod wpływem ninhydryny (wodzianu triketohydrindenu) ulegają
dekarboksylacji i oksydatywnej deaminacji. Początkowo powstaje iminokwas oraz
zredukowana forma ninhydryny, tzw. hydrindantyna. Następnie iminokwas przechodzi w
aldehyd krótszy o jeden atom węgla niż wyjściowy aminokwas, uwalnia się dwutlenek
węgla oraz amoniak, który bierze udział w kondensacji z cząsteczką ninhydryny oraz
hydrindantyny. W efekcie powstaje purpura Ruhemanna o barwie niebieskofioletowej.
Reakcja ninhydrynowa jest reakcją grupową aminokwasów, a jej dokładność i czułość
sprawiła, że jest ona wykorzystywana nie tylko do wykrywania aminokwasów, ale także
do ilościowego oznaczania wolnych α-aminokwasów metodą kolorymetryczną.
Intensywność i odcień powstającego zabarwienia jest różna w zależności od rodzaju
aminokwasu, jednakże natężenie zabarwienia jest proporcjonalne do stężenia
aminokwasu w roztworze.
O
NH
3
+
R
O
-
+
HNO
2
O
OH
R
OH
+
N
2
+
H
2
O
FARMACJA – Chemia organiczna
13
Prolina i hydroksyprolina, aminokwasy z grupą aminową II-rzędową, w reakcji z
ninhydryną dają produkt o barwie żółtej.
4.
Reakcje
specyficzne
związane
z
obecnością
grup
funkcyjnych
(np. SH,. S-S, SCH
3
, OH, układy aromatyczne)
Grupa funkcyjna inna niż aminowa czy kwasowa w cząsteczce aminokwasu w
oczywisty sposób wpływa na właściwości i reaktywność tego aminokwasu, gdyż ulega
typowym reakcjom charakterystycznym dla danej klasy związków. Układy aromatyczne
mogą ulegać reakcjom substytucji elektrofilowej, grupy hydroksylowe mogą zostać
poddane reakcjom utleniania lub acylowania (z utworzeniem odpowiednich estrów).
Dodatkowe grupy aminowe, będą odpowiadały za zwiększoną zasadowość aminokwasu
oraz charakterystyczne reakcje amin.
Dość ważną właściwość wykazuje cysteina zawierająca grupę tiolową. Dzięki niej w
cząsteczkach białek powstają mostki disulfidowe (-S-S-).
Charakterystyczne próby dla poszczególnych aminokwasów polegają na
specyficznych reakcjach konkretnych grup funkcyjnych:
a. Próba cystynowa – wykrywanie aminokwasów siarkowych
Aminokwasy siarkowe z grupami –SH (cysteina) lub disulfidowymi –S-S- (cystyna),
zarówno w białkach jak i niezwiązane, ogrzewane w silnie zasadowym środowisku
przekształcają się w kwas pirogronowy z jednoczesnym odłączeniem atomów siarki w
postaci jonów siarczkowych. Jony te w reakcji z jonami ołowiu(II) dają czarny osad
siarczku ołowiu. Metionina, zawierająca grupę tioeterową, nie daje dodatniego wyniku tej
reakcji.
O
O
OH
OH
O
O
OH
+ 2NH
3
+
O
O
OH
OH
O
O
HO
O
O
N
O
O
-
NH
4
+
+ 3H
2
O
purpura Ruhemanna
+
R
COOH
NH
2
+
R
COOH
NH
R
O
H
- NH
3
, CO
2
hydrindantyna
iminokwas
O
O
OH
OH
N
H
COOH
+
- CO
2
O
O
N
+
prolina
ninhydryna
FARMACJA – Chemia organiczna
14
b. Próba
ksantoproteinowa
–
wykrywanie
aminokwasów
z
układem
aromatycznym
Reakcja ksantoproteinowa jest uwarunkowana obecnością w cząsteczce białka
aminokwasów zawierających pierścień aromatyczny (tryptofan, tyrozyna, fenyloalanina).
Pod wpływem stężonego kwasu azotowego(V) zachodzi nitrowanie pierścienia
benzenowego, a powstający produkt ma barwę żółtą. Po zalkalizowaniu żółty kolor
powstałego związku nitrowego pogłębia się do żółtopomarańczowego, gdyż powstają
intensywniej zabarwione sole.
c. Reakcja Sakaguchi’ego – wykrywanie układu guanidynowego
Arginina zawierająca grupę guanidynową reaguje z α-naftolem w środowisku
zasadowym i w obecności utleniającego bromianu(I) sodu tworzy produkt o barwie
pomarańczowoczerwonej. W reakcji wydziela się amoniak. Nadmiar bromianu(I) sodu i
dłuższy czas reakcji powoduje dalsze utlenianie produktu, co prowadzi do jego
odbarwienia. Dodatek mocznika stabilizuje utworzony barwnik. Pozytywny wynik próby
daje także metyloguanidyna i kwas guanidynowy, ale nie sama guanidyna.
d. Reakcja Pauly’ego – wykrywanie układu imidazolowego
Pochodne imidazolu, w tym histydyna, w zasadowym środowisku ulegają sprzęganiu z
solami diazoniowymi tworząc barwniki azowe (patrz: reakcje aromatycznych amin I-
rzędowych). W reakcji Pauly’ego jest stosowany kwas diazobenzenosulfonowy,
przygotowywany przez diazowanie kwasu sulfanilowego bezpośrednio przed użyciem.
O
NH
2
S
H
O
-
O
O
C
H
3
O
-
+
NH
3
H
2
O
Pb
2+
S
2-
+
+
2
+
O
H
-
S
2-
+
PbS
cysteina
+
O
H
+ NaBrO
O
NH
2
O
-
N
H
NH
NH
2
(CH
2
)
3
O
NH
2
O
-
O
NH
NH
2
(CH
2
)
3
O
H
-
+ NH
3
NaBr
2 NH
3
3 NaBrO
N
2
H
2
O
NaBr
3
3
+
+
+
+
O
NH
3
+
O
H
OH
O
NH
3
+
O
H
OH
O
2
N
NO
2
HNO
3
O
H
-
O
NH
2
O
O
-
O
2
N
N
O
-
O
- H
2
O
tyrozyna
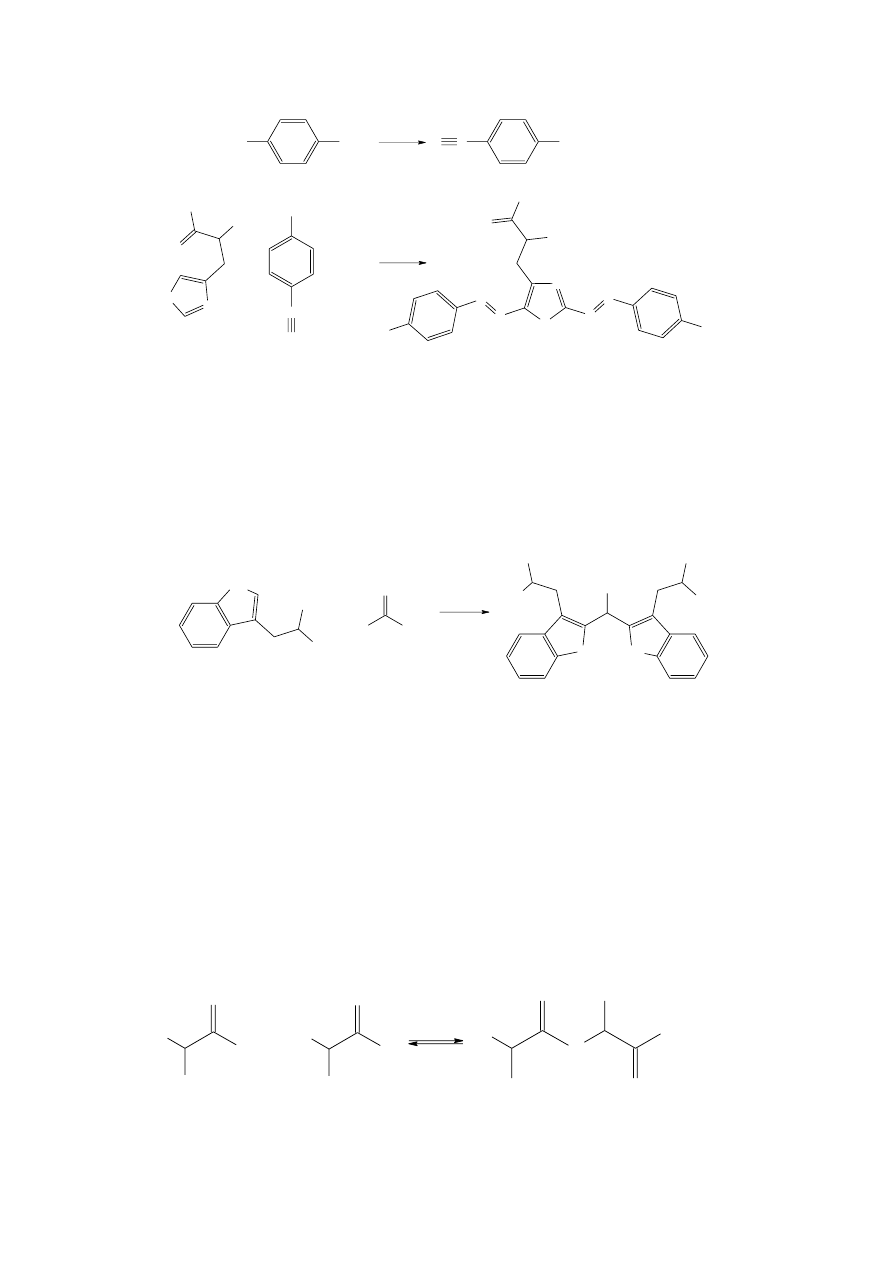
FARMACJA – Chemia organiczna
15
Pozytywny wynik próby dają fenole, w tym tyrozyna, oraz aminy aromatyczne.
e. Reakcja Adamkiewicza-Hopkinsa – wykrywanie układu indolowego
Indol, który wchodzi w skład cząsteczki tryptofanu, w środowisku stężonych
kwasów nieorganicznych ulega kondensacji z aldehydami (kwas glioksalowy, aldehyd
mrówkowy) dając barwniki arylometanowe o zabarwieniu czerwonofioletowym (patrz:
reakcje związków heterocyklicznych).
W kwaśnych hydrolizatach białek lub peptydów wynik tej próby jest ujemny, gdyż
tryptofan podczas kwasowej hydrolizy ulega rozkładowi.
BIAŁKA
Białka są to związki zbudowane z więcej niż 100 reszt
-aminokwasów o masie
cząsteczkowej powyżej 10 tys. Związki o niższej masie to polipeptydy. W białkach
wiązanie peptydowe (zwane również wiązaniem amidowym) łączy grupę karboksylową
jednego aminokwasu z grupą aminową drugiego aminokwasu. Powstanie dipeptydu z
dwu wolnych aminokwasów wiąże się z uwolnieniem jednej cząsteczki wody.
O
NH
2
N
N
H
O
H
SO
2
O
-
N
H
3
+
HONO
SO
2
O
-
N
+
N
+
2
SO
2
O
-
N
+
N
+ Na
2
CO
3
histydyna
N
N
N
N
N
N
H
NaO
3
S
SO
3
Na
O
OH
NH
2
+
CO
2
+ H
2
O
- N
2
, H
2
O
jon p-sulfobenzenodiazoniowy
pomarańczowy barwnik azowy
kwas sulfanilowy
COOH
NH
3
+
NH
H
O
COOH
+
NH
NH
COOH
COOH
NH
3
+
HOOC
N
H
3
+
H
+
-H
2
O
tryptofan
kwas glioksalowy
O
NH
2
R
1
OH
O
NH
2
R
2
OH
+
O
NH
2
R
1
NH
O
OH
R
2
+
O
H
2
aminokw as acylujący
aminokw as acylow any
dipeptyd

FARMACJA – Chemia organiczna
16
Przemyślana synteza peptydów wymaga odpowiedniego przygotowania aminokwasów do
reakcji kondensacji. Przede wszystkim należy zabezpieczyć wszystkie grupy funkcyjne,
które w warunkach reakcji mogłyby dawać produkty uboczne. Najważniejsze jest jednak
zabezpieczenie grupy aminowej w aminokwasie acylującym (komponent kwasowy) oraz
grupy kwasowej w aminokwasie acylowanym (komponencie aminowym).
Białka ze względy na swoją strukturę dzielą się na białka proste i białka złożone.
Spośród wszystkich polimerów syntetycznych i naturalnych białka są substancjami
najbardziej skomplikowanymi i posiadającymi najbardziej różnorodne właściwości.
Właściwości białek zależą od budowy i kolejności ułożenia wielu reszt aminokwasowych
(R) rozmieszczonych wzdłuż łańcucha polipeptydowego. Substancje białkowe pełnią w
przyrodzie funkcje strukturalne (np. skóra, włosy, ścięgna, włókna mięśniowe),
katalityczne (enzymy), transportowe (hemoglobina). Białkami są również substancje
odpornościowe, które z jednej strony chronią organizm przed zakażeniem, a z drugiej
uniemożliwiają przeszczepianie narządów. Wszystkie indywidualne cechy wszystkich
organizmów sprowadzają się do białek, z których te organizmy są zbudowane według
instrukcji zawartych w cząsteczkach DNA.
Substancje białkowe niezależnie od pochodzenia dają wspólne reakcje
charakterystyczne.
1.
Wysalanie białek
Białka, jako związki wielkocząsteczkowe posiadające zjonizowane grupy aminowe i
karboksylowe, wykazują zdolność wiązania dipolarnych cząsteczek wody. Dzięki temu
białka w środowisku wodnym ulegają hydratacji, pęcznieją, a następnie rozpuszczają się.
Podobnie jak inne jony, otaczają się płaszczem wodnym i w tej postaci, jako osobne
cząsteczki, tworzą roztwory koloidalne. Na rozpuszczalność białek w wodzie wpływa
obecność soli nieorganicznych oraz pH roztworu (wartość nieco inna niż punktu
izoelektrycznego sprzyja rozpuszczaniu). Wzrost stężenia soli w roztworze może jednakże
doprowadzić do strącenia białka z roztworu. Jony soli tworzą własną powłokę
solwatacyjną, przy wysokim stężeniu soli w roztworze woda hydratacyjna cząsteczek
białka zostaje od nich odciągnięta. „Obnażone” w ten sposób cząsteczki białka ulegają
koagulacji na skutek wysolenia. Proces ten jest odwracalny, wystarczy odbudować
płaszcz wodny białka poprzez dodanie wody. Podczas wysalania białko nie traci w sposób
trwały swojej przestrzennej struktury oraz funkcji biologicznych. Wysalanie białek
przeprowadza się za pomocą nasyconych roztworów (NH
4
)
2
SO
4
, NH
4
Cl, MgSO
4
.
2.
Denaturacja
Pod wpływem soli metali ciężkich, mocnych kwasów lub mocnych zasad,
podwyższonej temperatury oraz niektórych czynników chemicznych (96% etanol, aceton,
fenol) dochodzi do denaturacji i trwałego wytrącenia białek z roztworów. Denaturacja jest

FARMACJA – Chemia organiczna
17
zjawiskiem polegającym na nieodwracalnej zmianie przestrzennej struktury białek (II- i
III- i IV-rzędowej).
3.
Reakcja biuretowa Piotrowskiego
Peptydy zawierające co najmniej dwa wiązania peptydowe (a więc tripeptydy i
dłuższe) oraz białka tworzą z jonami miedzi(II) w środowisku zasadowym połączenia
kompleksowe o barwie fioletowej. Nazwa reakcji pochodzi od biuretu, który powstaje przy
ogrzewaniu mocznika i jest najprostszym związkiem dającym pozytywny wynik w tej
próbie.
Próba biuretowa jest reakcją grupową na białka, ujemny wynik tej próby eliminuje
obecność białka, chociaż pozytywny – nie w pełni ją potwierdza. Oprócz biuretu, podobny
wynik reakcji dają związki nie posiadające wiązań peptydowych, a zawierające
ugrupowania –CS-NH- oraz =CH-NH-.
Aminokwasy, w odróżnieniu od białek, tworzą z jonami miedzi(II) połączenia
kompleksowe o barwie niebieskiej (poza histydyną, która ze względu na budowę łańcucha
bocznego, tworzy kompleks o barwie fioletowoniebieskiej).
LIPIDY (TŁUSZCZE)
Lipidy obejmują szereg różnie zbudowanych biocząsteczek, spełniających ważną
rolę w świecie mikroorganizmów, roślin i zwierząt. Jako elementy żywych organizmów
spełniają rolę materiału energetycznego, zapasowego i ochronnego, oraz biorą udział w
przemianie materii jako substraty lub składniki biokatalizatorów.
Pod względem chemicznym lipidy stanowią grupę związków o budowie
glicerydowej, jak również grupę związków o właściwościach podobnych do glicerydów,
lecz o bardziej złożonej strukturze. Lipidy są substancjami nierozpuszczalnymi w wodzie.
N
H
2
NH
2
O
2
T
N
H
2
NH
NH
2
O
O
mocznik
biuret
- NH
3
NH
NH
Cu
NH
NH
O
O
NH
O
HN
O
Cu
2+
,
2-
O
H
-
- H
2
O
fioletowy kompleks biuretu
z jonami miedzi(II)
R
NH
2
O
O
R
H
2
N
O
O
Cu
R
NH
O
N
R
HN
O
N
Cu
niebieski kompleks miedzi(II)
z dwiema cząsteczkami aminokwasu
fioletowy kompleks miedzi(II)
z białkiem

FARMACJA – Chemia organiczna
18
Można je wyekstrahować z komórek słabo polarnymi rozpuszczalnikami takimi jak: eter,
chloroform, benzen, aceton. Różną rozpuszczalność lipidów w rozpuszczalnikach
organicznych można wykorzystać do ich rozdziału i wyodrębniania.
Ze względu na różnice budowy i właściwości lipidy można podzielić następująco:
1.
lipidy proste
1.1.
tłuszcze właściwe
1.2.
woski
2.
lipidy złożone
2.1.
fosfolipidy (zawierają fosfor, nie zawierają cukru)
2.1.1. glicerydy
2.1.1.1.
glicerydy estrowe (kefaliny, fosfatydylocholina)
2.1.1.2.
glicerydy enoloeterowe (plazmalogeny)
2.1.2. sfingomieliny
2.2.
glikolipidy (nie zawierają fosforu, zawierają cukier)
2.2.1. glikoglicerolipidy
2.2.2. glikosfingolipidy
3. prostaglandyny
Tłuszcze właściwe są to znane z życia codziennego oleje roślinne (olej rzepakowy,
słonecznikowy, sojowy i inne) oraz tłuszcze zwierzęce (smalec, masło, łój). W organizmie
człowieka najczęściej gromadzą się w tkance podskórnej, w tkance tłuszczowej jamy
brzusznej, w tkance łącznej oraz w stanach patologicznych otłuszczają serce, wątrobę,
nerki. Tłuszcze proste pełnią w przyrodzie funkcje materiałów zapasowych, w postaci
których organizmy magazynują energię. Tłuszcze mają ciepło spalania prawie dwa razy
większe niż węglowodany i białka. W porównaniu z innymi składnikami żywności tłuszcze
są najbardziej kaloryczne.
Tłuszcze właściwe zbudowane są z glicerolu (gliceryny) i wyższych kwasów tłuszczowych.
R
1
, R
2
, R
3
= reszty węglowodorowe kwasów tłuszczowych, np. (CH
2
)
n
CH
3
n = 2 - kwas masłowy
n = 3 – kwas walerianowy
n = 4 - kwas kapronowy
n = 6 - kwas kaprylowy
n = 7 - kwas pelargonowy
n = 10 - kwas laurynowy
n = 12 - kwas mirystynowy
n = 14 - kwas palmitynowy
n = 16 - kwas stearynowy
R
1
= R
2
= R
3
w tłuszczach syntetycznych
R
1
R
2
R
3
w tłuszczach naturalnych
H
2
C
HC
H
2
C
O
O
O
C
C
O
R
3
O
C
O
R
2
R
1
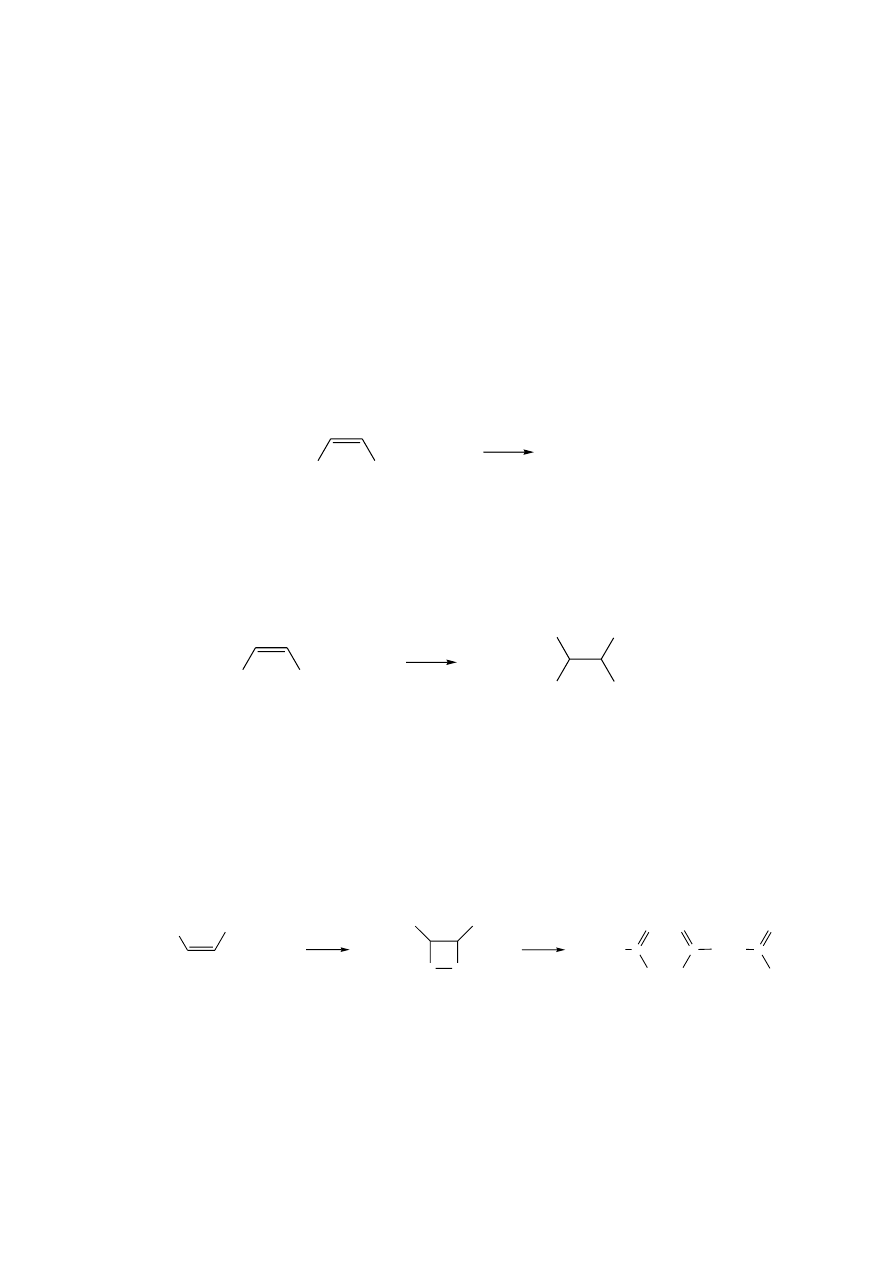
FARMACJA – Chemia organiczna
19
1.
Reakcje addycji do wiązania podwójnego
a. utwardzanie tłuszczów
Proporcje poszczególnych kwasów zmieniają się w zależności od rodzaju tłuszczu.
Tłuszcze stałe o wyższej temperaturze topnienia mają przewagę kwasów tłuszczowych
nasyconych np. tristearynian gliceryny – ciało stałe o temp. topnienia 71°C. Obecność
natomiast kwasów nienasyconych świadczy o tym, iż mamy do czynienia z tłuszczami
płynnymi, np. trioleinian gliceryny – temperatura krzepnięcia równa jest –17°C. Zmianie
charakteru tłuszczu z nienasyconego na nasycony towarzyszy zmiana stanu skupienia z
ciekłego na stały. Z tego względu proces uwodornienia przeprowadzany na skalę
przemysłową nosi nazwę utwardzania tłuszczów. Reakcję prowadzi się w podwyższonej
temperaturze i pod zwiększonym ciśnieniem, w obecności katalizatora niklowego.
b. przyłączanie jodu lub bromu
Nnienasycone tłuszcze oraz kwasy tłuszczowe przyłączają fluorowce do wiązania
wielokrotnego; odbarwiają wodę bromową oraz roztwory jodu.
c. jełczenie tłuszczów
Tłuszcze zawierające reszty nienasyconych kwasów tłuszczowych ulegają
utlenieniu pod wpływem tlenu z utleniaczy, a także, choć znacznie wolniej, pod wpływem
tlenu atmosferycznego. Wiązanie podwójne ulega rozerwaniu, a reszta kwasu
tłuszczowego zostaje rozbita na dwie cząsteczki z terminalnymi grupami aldehydowymi.
Reakcja ta zachodzi podczas jełczenia tłuszczów, a gromadzące się aldehydy nadają im
przykry smak i zapach.
2.
Zmydlanie tłuszczów
Tłuszcze właściwe łatwo ulegają hydrolizie w środowisku alkalicznym. Proces ten
nazywa się zmydlaniem tłuszczów. Hydroliza tłuszczów zachodzi także w przewodzie
CH
3
(CH
2
)
6
CH
2
CH
2
(CH
2
)
6
COOH
kwas olejowy
H
2,
kat.
CH
3
(CH
2
)
16
COOH
kwas stearynowy
CH
3
(CH
2
)
6
CH
2
CH
2
(CH
2
)
6
COOH
[O]
CH
3
(CH
2
)
6
CH
2
CH
2
(CH
2
)
6
COOH
O
O
CH
3
(CH
2
)
7
+
C
O
H
C
(CH
2
)
7
C
O
OH
O
H
CH
3
(CH
2
)
6
CH
2
CH
2
(CH
2
)
6
COOH
I
2
CH
3
(CH
2
)
6
CH
2
CH
2
(CH
2
)
6
COOH
I
I
kwas olejowy

FARMACJA – Chemia organiczna
20
pokarmowym zwierząt i człowieka. Tłuszcze wprowadzone z pokarmem ulegają hydrolizie
pod wpływem katalizatorów biochemicznych – lipaz.
W wyniku zmydlania tłuszczów powstaje glicerol oraz rozpuszczalne mydła sodowe lub
potasowe.
Mydła nierozpuszczalne (wapniowe, magnezowe, barowe, ołowiawe), otrzymuje się
działając solami tych jonów na roztwory wodne mydeł rozpuszczalnych.
Właściwości tłuszczów określają reakcje, które ustalają zawartość oraz rodzaj
kwasów tłuszczowych w tłuszczach. Najważniejsze reakcje wyrażone są za pomocą liczb:
a. liczba kwasowości to liczba mg KOH potrzebna do zobojętnienia wolnych kwasów
tłuszczowych, zawartych w 1 g tłuszczu. Liczba ta jest tym mniejsza, im świeższy
jest tłuszcz,
b. liczba zmydlenia przedstawia liczbę mg KOH potrzebną do zobojętnienia
wszystkich kwasów tłuszczowych zawartych w 1 g tłuszczu, zarówno wolnych jak i
otrzymanych po zmydleniu,
c. liczba estrowa to liczba mg KOH potrzebna do zobojętnienia kwasów
tłuszczowych związanych estrowo, a powstałych przy zmydleniu 1 g tłuszczu.
Liczbę estrową otrzymujemy odejmując od liczby zmydlenia liczbę kwasowości. W
tłuszczach obojętnych, tj. nie zawierających wolnych kwasów tłuszczowych, liczba
estrowa równa się liczbie zmydlenia,
d. liczba Reicherta-Meissla oznacza liczbę cm
3
0.1 M KOH i NaOH potrzebną do
zobojętnienia lotnych kwasów tłuszczowych po jego zmydleniu. Liczba ta ma
szczególne znaczenie w badaniu masła,
e. liczba jodowa określa ilość jodu w gramach, jaka wiąże 100 g tłuszczu. Liczba ta
wykazuje ilościowo zawartość nienasyconych kwasów tłuszczowych.
Woski są to nierozpuszczalne w wodzie tłuszczopodobne substancje stałe, służące
często w świecie roślinnym i zwierzęcym jako powłoki ochronne. Substancje te zamiast
glicerolu zawierają wyższe alifatyczne jednowodorotlenowe alkohole np. alkohol cetylowy,
alkohol mirycylowy.
H
2
C
HC
H
2
C
O
O
O
C
C
O
R
O
C
O
R
R
+
3 NaOH
H
2
C
HC
H
2
C
OH
OH
OH
R
O
ONa
+
3
T
roztw. alkoholowy
mydło sodowe
gliceryna
2 R-COONa
+
CaCl
2
(R-COO)
2
Ca
+
2 NaCl

FARMACJA – Chemia organiczna
21
Często kwas i alkohol mają tą samą ilość atomów węgla. Fakt ten może wskazywać, że
oba te składniki powstały z dwóch cząsteczek tego samego aldehydu w wyniku reakcji
Cannizzaro. Jedna cząsteczka aldehydu utlenia się do kwasu, druga redukuje się do
alkoholu, po czym następuje estryfikacja.
Niektóre woski są zbudowane z kwasów tłuszczowych i steroli (cholesterolu, lanosterolu).
Lipidy złożone są to substancje o właściwościach fizycznych podobnych do
tłuszczów właściwych. Różnią się od lipidów prostych tym, iż poza kwasem tłuszczowym i
alkoholem zawierają składniki azotowe, fosforowe, a niekiedy węglowodanowe.
Przy rozdzielaniu lipidów złożonych wykorzystuje się nieznaczne różnice w ich
rozpuszczalności.
Fosfolipidy ulegając hydrolizie dają: kwasy tłuszczowe, alkohol, kwas
ortofosforowy oraz związek zawierający azot. Fosfolipidy obok białek złożonych wchodzą
w skład struktur membranowych oddzielających poszczególne elementy w komórce
(błony komórkowe, mitochondrialne i mikrosomowe). Nadają pewne właściwości fizyczne
tym strukturom np. wysoką przepuszczalność dla niepolarnych cząsteczek, a także lizę
powodowaną przez czynniki powierzchniowo aktywne. Przedstawicielami fosfolipidów są
lecytyny, związki zawierające resztę fosforanową zestryfikowaną choliną, o wzorze:
Fosfatydylocholina (lecytyna) tworzy się w organizmie z tłuszczów. Jest ona dobrym
czynnikiem emulgującym i prawdopodobnie ułatwia wprowadzenie tłuszczów do tkanek.
Lecytyny występują w żółtku jaja kurzego i w tkance nerwowej.
STEROIDY
Ekstrakty lipidowe z roślin i tkanek zwierzęcych, oprócz tłuszczów, fosfolipidów
oraz terpenów, zawierają także steroidy – cząsteczki, których cechą charakterystyczną
jest węglowy szkielet gonanu, czyli układ czteropierścieniowy wywodzący się od 1,2-
cyklopentanoperhydrofenantrenu.
CH
3
(CH
2
)
n
CH
2
O
O
CH
2
(CH
2
)
m
CH
3
wosk pszczeli
n = 13 do 33; m = 22 do 34
H
2
C
HC
H
2
C
O
O
O
C
P
O
O
O
C
O
R
2
R
1
O
-
CH
2
CH
2
N
+
CH
3
CH
3
CH
3

FARMACJA – Chemia organiczna
22
Poszczególne grupy steroidów odróżnia wzajemny układ skondensowanych
pierścieni, stopień nienasycenia tych pierścieni oraz rodzaj i długość łańcuchów
bocznych (R
1
, R
2
, R
3
). Wszystkie steroidy przy C
10
i C
13
(R
1
i R
2
) posiadają grupę
metylową, natomiast podstawniki przy C
17
(R
3
) są bardzo zróżnicowane. Wyjątek stanowią
estrogeny, u których pierścień A jest aromatyczny, a zatem przy C
10
nie posiada grupy
CH
3
.
Ze względu na budowę steroidów można więc wyróżnić pochodne:
a. estranu; żeńskie hormony płciowe, np. estradiol,
b. androstanu; męskie hormony płciowe, np. testosteron, androsteron,
c. pregnanu; progesteron oraz hormony kory nadnerczy np. kortykosteron,
aldosteron,
d. cholanu; składniki żółci, np. kwas cholowy,
e. cholestanu; cholesterol, ergosterol.
W zależności od rodzaju grupy funkcyjnej steroidy dzielimy na: alkohole (sterole), kwasy i
hydroksykwasy (kwasy żółciowe), fenole i ketony (hormony sterydowe).
Najważniejszym i najpopularniejszym przedstawicielem steroli pochodzenia
zwierzęcego jest cholesterol. Występuje we wszystkich komórkach ssaków, jest istotnym
składnikiem błon komórkowych, służy jako substrat kwasów żółciowych oraz hormonów
płciowych, w tkankach nerwowych wchodzi w skład otoczki mielinowej.
Podobnie jak lipidy, cholesterol nie rozpuszcza się w wodzie, lecz rozpuszcza się w eterze,
benzenie i innych rozpuszczalnikach organicznych.
Cholesterol ulega takim reakcjom chemicznym, jakie grupy funkcyjne posiada. Ze
względu na grupę hydroksylową przy trzecim atomie węgla będzie reagował jak alkohole,
13
14
9
8
10
17
12
11
15
16
7
5
6
1
4
2
3
R
1
R
2
R
3
B
C
D
A
13
14
9
8
10
17
12
11
15
16
7
5
6
20
CH
3
18
CH
3
19
1
23
22
4
C
H
3
21
24
2
3
H
H
H
H
25
CH
3
27
CH
3
26
O
H
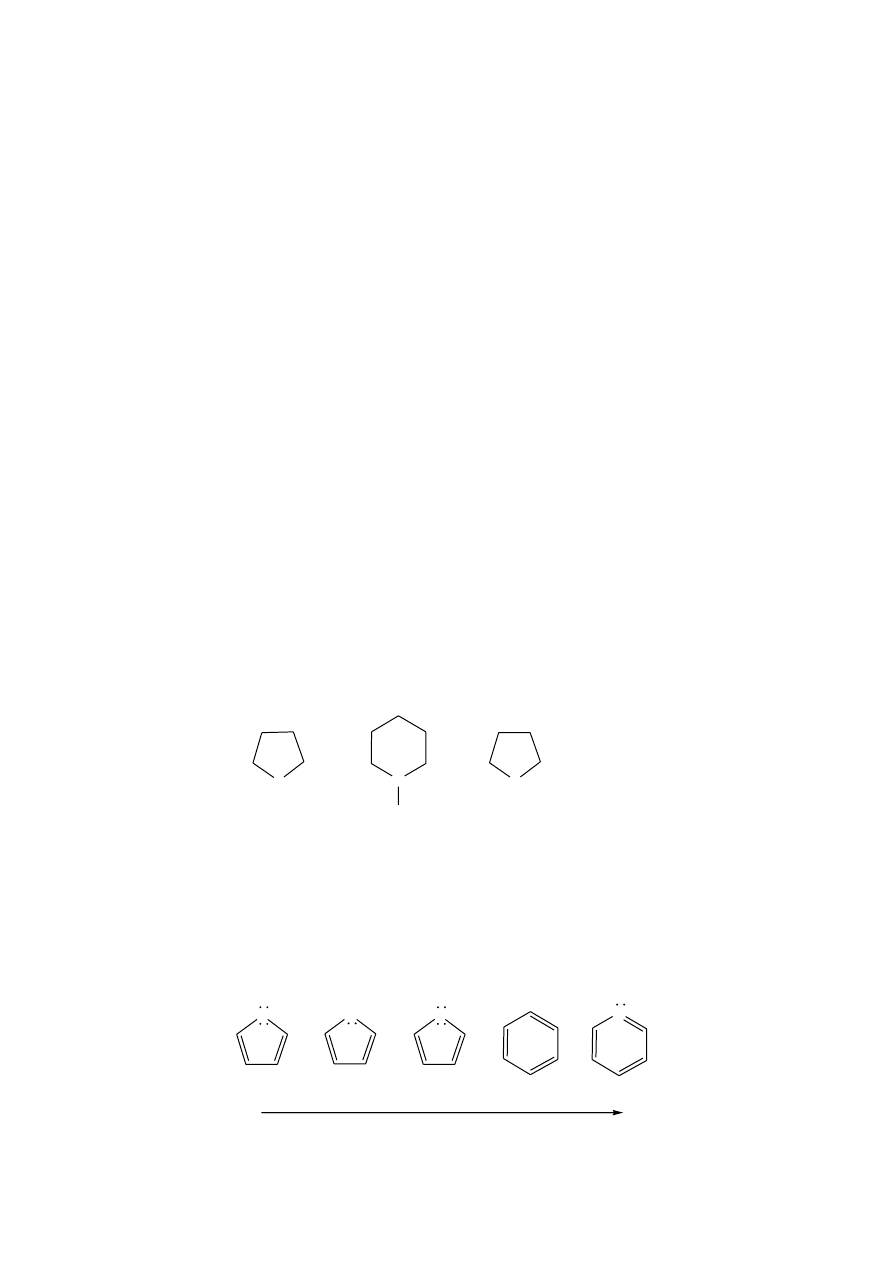
FARMACJA – Chemia organiczna
23
ulegając reakcjom estryfikacji oraz utlenienia (do ketonów). Estry cholesterolu z
alifatycznymi i aromatycznymi kwasami znalazły zastosowanie jako ciekłe kryształy.
Obecność wiązania podwójnego pomiędzy piątym a szóstym atomem węgla (pierścień B)
sprawia, że cholesterol zachowuje się jak alken i ulega reakcjom addycji (uwodornienie,
addycja bromu).
Sterole, takie jak cholesterol, zawierające podwójne wiązanie w bezwodnym
środowisku w reakcji z mocnymi kwasami dają barwne produkty. Pod wpływem
stężonych kwasów (np. H
2
SO
4
) dochodzi do odłączenia dwóch cząsteczek wody z dwóch
cząsteczek sterolu i powstania bisterolu, którego pochodne sulfonowe są barwne: zielone
w reakcji Liebermana-Burcharda i czerwone w reakcji Salkowskiego.
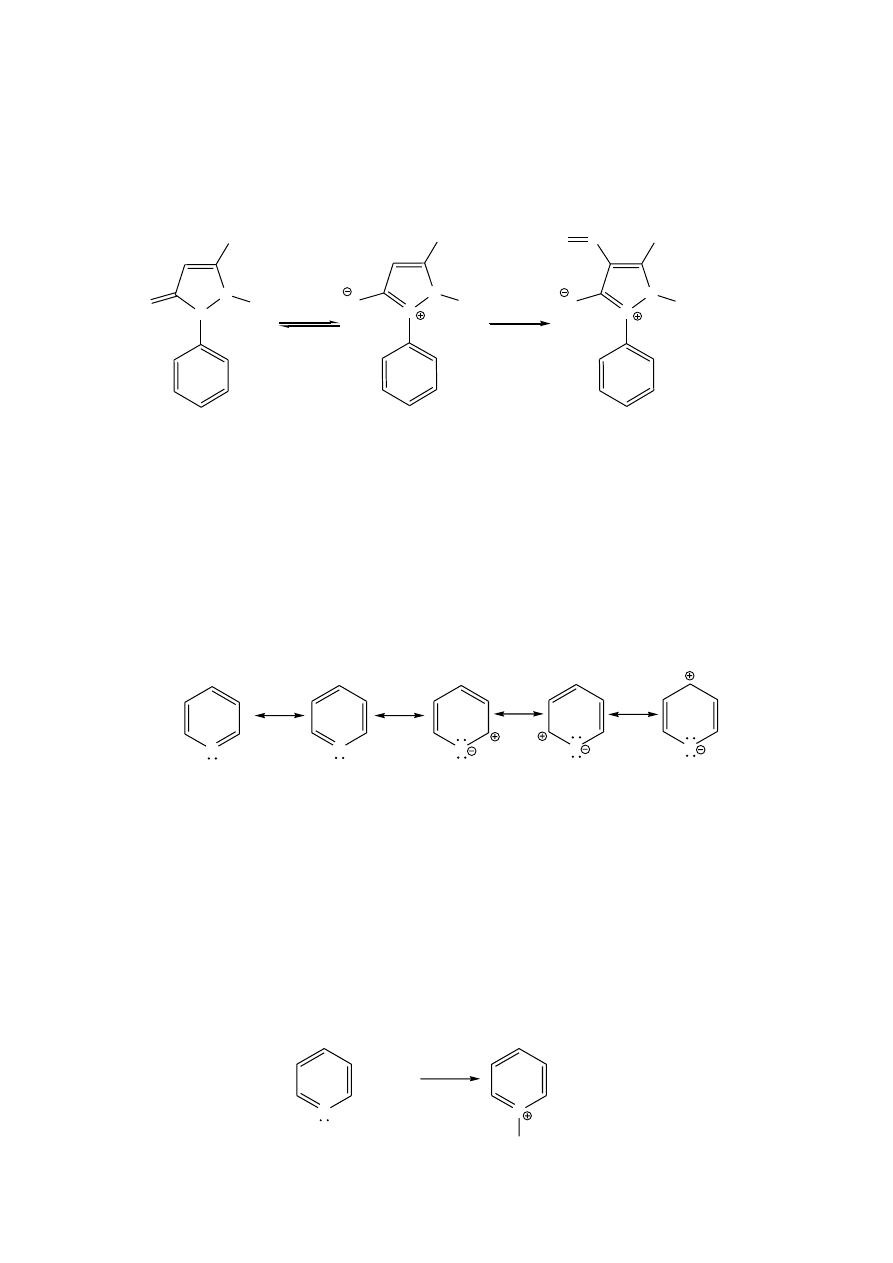
ZWIĄZKI HETEROCYKLICZNE
Heterocykliczne związki organiczne są związkami o budowie pierścieniowej, w
których jeden lub więcej atomów pierścienia stanowią pierwiastki inne niż węgiel, tzw.
heteroatomy, np. azot, tlen, siarka, fosfor, bor, cyna, krzem.
Nasycone związki heterocykliczne lub zawierające jedno wiązanie podwójne
pomiędzy atomami w pierścieniu posiadają właściwości analogiczne do właściwości
związków acyklicznych. Tetrahydrofuran jest typowym eterem, piperydyna – aminą
drugorzędową, zaś tetrahydrotiofen – sulfidem.
Aromatyczne związki heterocykliczne wykazują właściwości typowe dla benzenu.
Są odporne na utlenianie, chętnie wchodzą w reakcje substytucji, a nie przyłączenia.
Charakter aromatyczny zależy od rodzaju związku. Podane poniżej przykłady
podstawowych związków heterocyklicznych uszeregowano zgodnie ze zwiększającymi się
właściwościami aromatycznymi w porównaniu z benzenem:
S
N
O
H
tetrahydrotiofen
tetrahydrofuran
piperydyna
O
H
N
S
N
furan
pirol
tiofen
benzen
pirydyna
wzrost charakteru aromatycznego

FARMACJA – Chemia organiczna
24
O znaczeniu związków heterocyklicznych świadczy ilość i różnorodność substancji
tego typu występujących w przyrodzie, a także otrzymywanych na skalę przemysłową
leków i barwników. Liczne związki spełniają ważne funkcje w organizmach roślinnych i
zwierzęcych. Węglowodany można uznać za pochodne piranu lub furanu. Najbardziej
rozpowszechnione są jednak związki heterocykliczne zawierające atomy azotu (kwasy
nukleinowe, aminokwasy, białka, antybiotyki).
Związki pięcioczłonowe.
Do pięcioczłonowych związków heterocyklicznych z jednym heteroatomem
zaliczamy furan, pirol, tiofen. Każdy z nich wykazuje wyraźny charakter aromatyczny,
wynikający z delokalizacji czterech elektronów
atomów węgla i pary elektronowej
dostarczanej przez heteroatom – tworzy się sekstet elektronowy. Łatwo reagują z
odczynnikami elektrofilowymi w reakcjach substytucji, co wyjaśniają następujące
struktury rezonansowe pirolu:
Pirol ma charakter amfoteryczny; jest zarówno słabym kwasem, jak i bardzo słabą
zasadą. Rozpuszcza się w roztworach zasad, tworząc sole sodowe i potasowe oraz w
rozcieńczonych kwasach. Prócz reakcji nitrowania, sulfonowania, acylowania,
chlorowcowania, ulega również sprzęganiu ze związkami diazoniowymi. Podstawienie
przebiega w pozycji 2 (
) pierścienia, jeżeli oba położenia
są zajęte – w położeniu
.
Pirol ulega kondensacji z aldehydami, tworząc pochodne dipirylometanu:
Dalsze kondensowanie tego typu prowadzi do utworzenia układu cyklicznego, tzw.
porfiny, która jest elementem strukturalnym hemoglobiny i chlorofilu. Pierścienie
pirolowe w porfinie połączone są ze sobą mostkami metinowymi.
N
H
N
H
N
H
N
H
N
H
H
N
2
+ HCHO
H
N
H
N
+ H
2
O
NH
N
HN
N
porfina
czerwone kryształy

FARMACJA – Chemia organiczna
25
Furan, pirol i tiofen tworzą z benzenem układy skondensowane.
W przyrodzie najbardziej rozpowszechniony jest indol (2,3-benzopirol), stanowiący
szkielet tryptofanu i jego pochodnych, tryptaminy, serotoniny oraz wielu alkaloidów.
Ważnym biologicznie układem heterocyklicznym jest pirazol (1,2-diazol), który
wprawdzie nie występuje w produktach naturalnych, ale jest podstawą wielu związków
otrzymywanych syntetycznie takich jak barwniki oraz substancje biologicznie czynne, np.
pestycydy oraz leki. Przykładem pochodnej pirazolu jest antypiryna (fenazon) – związek o
właściwościach przeciwgorączkowych, przeciwbólowych oraz przeciwzapalnych.
Do ważnych prób pozwalających wykryć wyżej opisane układy heterocykliczne są
następujące próby:
1.
Próba Ehrlicha
Pirol i jego pochodne w reakcji z aldehydem p-dimetyloaminobenzoesowym w
obecności kwasu solnego dają barwne produkty:
Pozytywny wynik próby Ehrlicha dają także I-rzędowe aminy aromatyczne (anilina)
tworząc intensywnie pomarańczowe połączenia.
2.
Wykrywanie indolu
Działając na indol formaliną w środowisku kwasu siarkowego(VI) można
zaobserwować pojawienie się białego osadu oraz fioletowego pierścienia na granicy wolno
mieszających się składników mieszaniny reakcyjnej (patrz reakcja pirolu z aldehydami).
N
H
N
H
H
N
H
H
C
N
O
H
+
C
N
N
H
- H
2
O
H
+
C
N
NH
H
O
H
N
S
benzofuran
indol
benzotiofen
FARMACJA – Chemia organiczna
26
3.
Wykrywanie antypiryny
Antypiryna w postaci jonu obojnaczego o strukturze analogicznej do anionu
fenolanowego reaguje z kwasem azotowym(III), dając nitrozoantypirynę o barwie zielonej,
przechodzącej w oliwkową. Niekiedy nitrozoantypiryna wytrąca się w postaci oliwkowego
osadu.
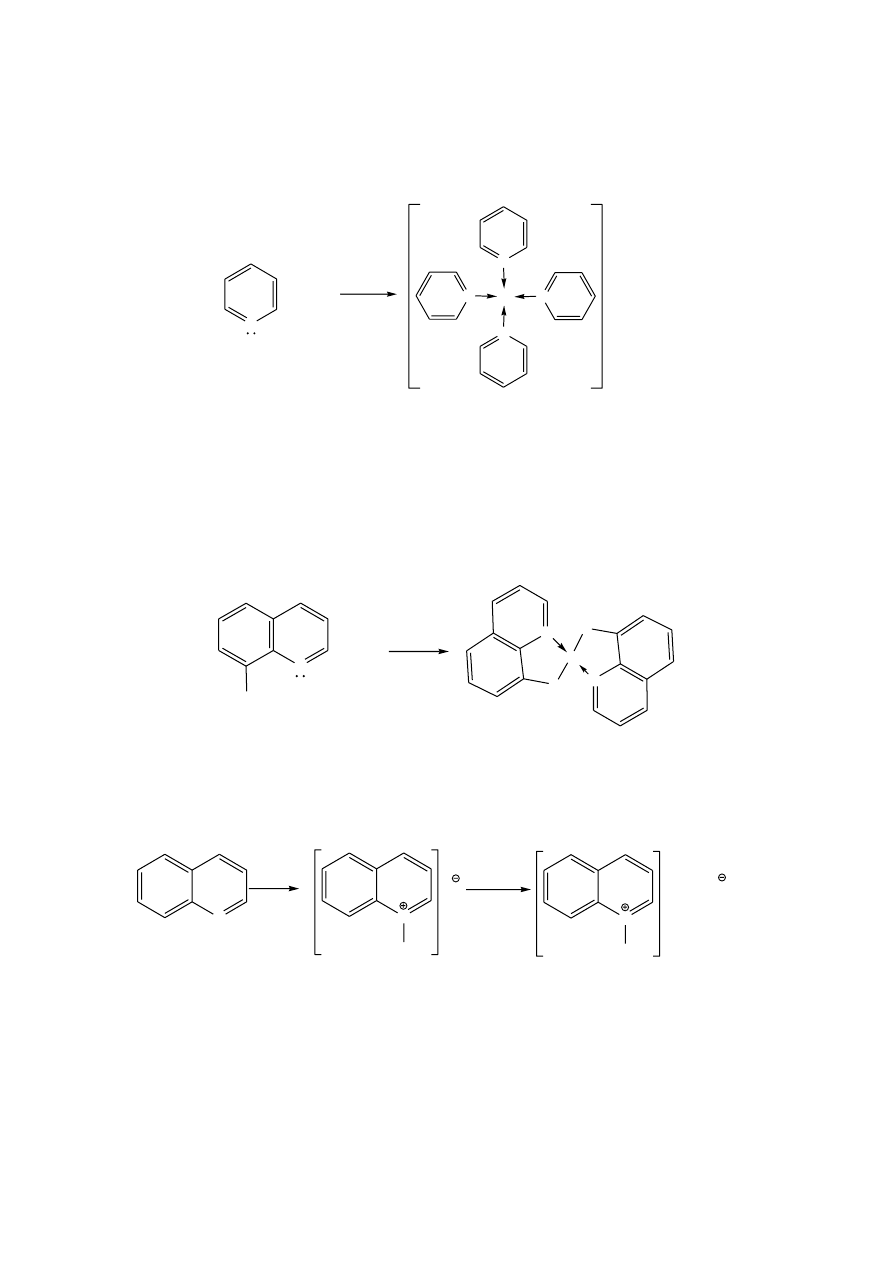
Związki sześcioczłonowe
Do sześcioczłonowych związków heterocyklicznych należą między innymi pirydyna
i pirymidyna, które mogą tworzyć układy skondensowane z innymi pierścieniami.
Charakter aromatyczny pirydyny wynika z delokalizacji sześciu elektronów
, po
jednym od każdego z pięciu atomów węgla i jednego atomu azotu. Strukturę pirydyny
przedstawia się jako hybrydę rezonansową następujących struktur:
Taki rozkład ładunków w pierścieniu pirydyny sprawia, że jest ona bardziej podatna na
substytucję nukleofilową niż elektrofilową, szczególnie w pozycjach 2 i 4 (α i γ).
4.
Reakcje i pirydyny i jej pochodnych
a.
Właściwości zasadowe
Ze względu na wolną parę elektronową azotu, pirydyna i jej pochodne wykazują
słabe właściwości zasadowe (posiadają ugrupowanie charakterystyczne dla amin
trzeciorzędowych). Wodne roztwory pirydyny i chinoliny (rozpuszcza się łatwiej w gorącej
wodzie) wykazują odczyn zasadowy.
N
N
O
CH
3
CH
3
N
N
O
CH
3
CH
3
HNO
2
- H
2
O
N
N
O
CH
3
CH
3
N
O
antypiryna
jon obojnaczy
nitrozoantypiryna
barwa zielona
N
+ HOH
N
H
+ OH
-
N
N
N
N
N
FARMACJA – Chemia organiczna
27
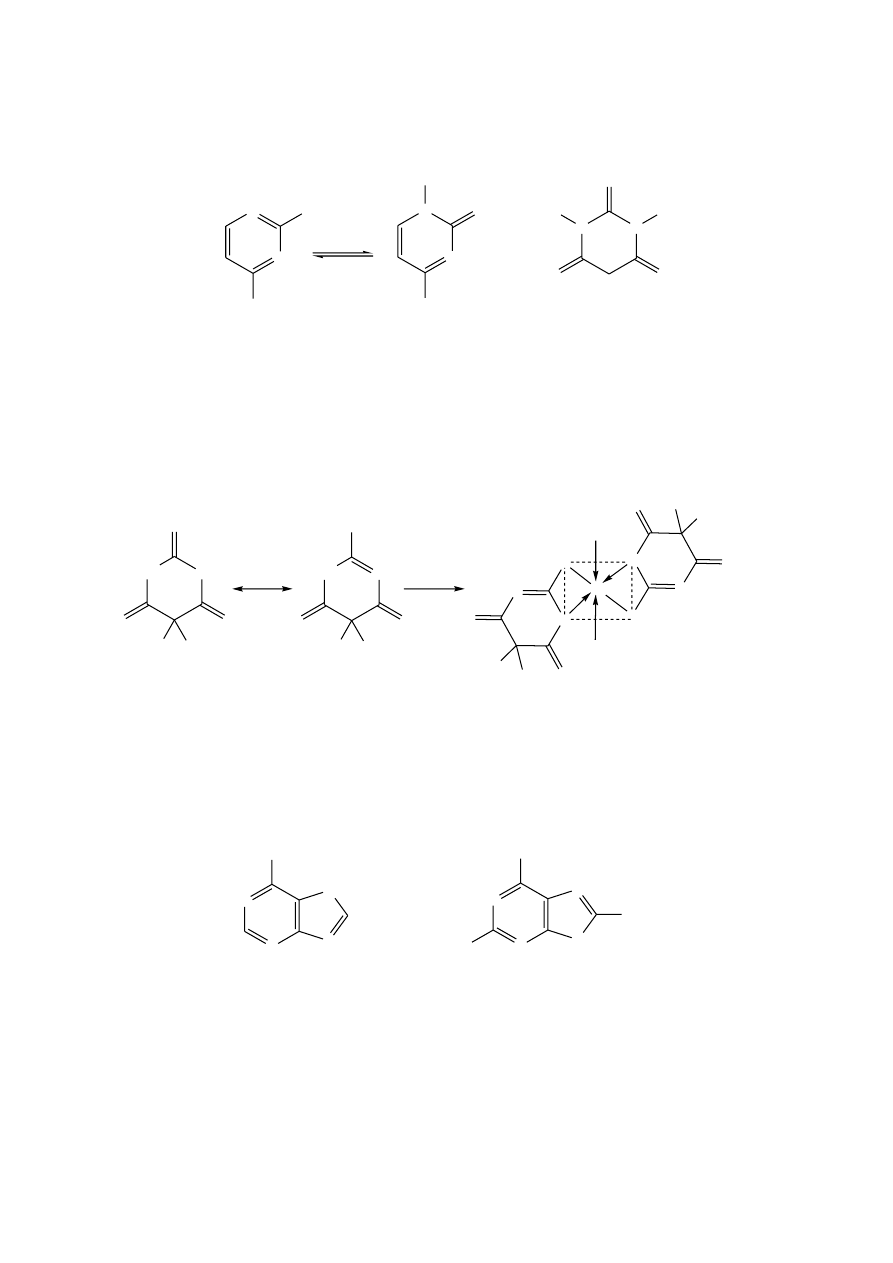
b.
Tworzenie związków kompleksowych
Pirydyna, jak również jej analogi skondensowane z pierścieniem benzenowym
chętnie tworzą barwne połączenia koordynacyjne z jonami metali.
Pirydyna i chinolina w reakcji z CuSO
4
pogłębiają niebieską barwę roztworu.
8-Hydroksychinolina (oksyna) z większością metali (poza metalami alkalicznymi) tworzy
barwne połączenia chelatowe (kleszczowe). Związki te wytrącają się w określonym pH.
Zmieniając pH środowiska reakcyjnego można rozdzielić mieszaninę kationów metali
poprzez stopniowe wytrącanie ich w postaci soli z 8-hydroksychinoliną. Z tego właśnie
względu związek ten jest często używany do oznaczania jonów metali w roztworach
wodnych.
Zasady azotowe (np. chinolina) z heksacyjanożelazianem(II) potasu tworzą
dobrze krystalizujące, trudno rozpuszczalne sole. Kształt kryształów otrzymanych
połączeń jest bardzo charakterystyczny, co pozwala na identyfikację wielu alkaloidów.
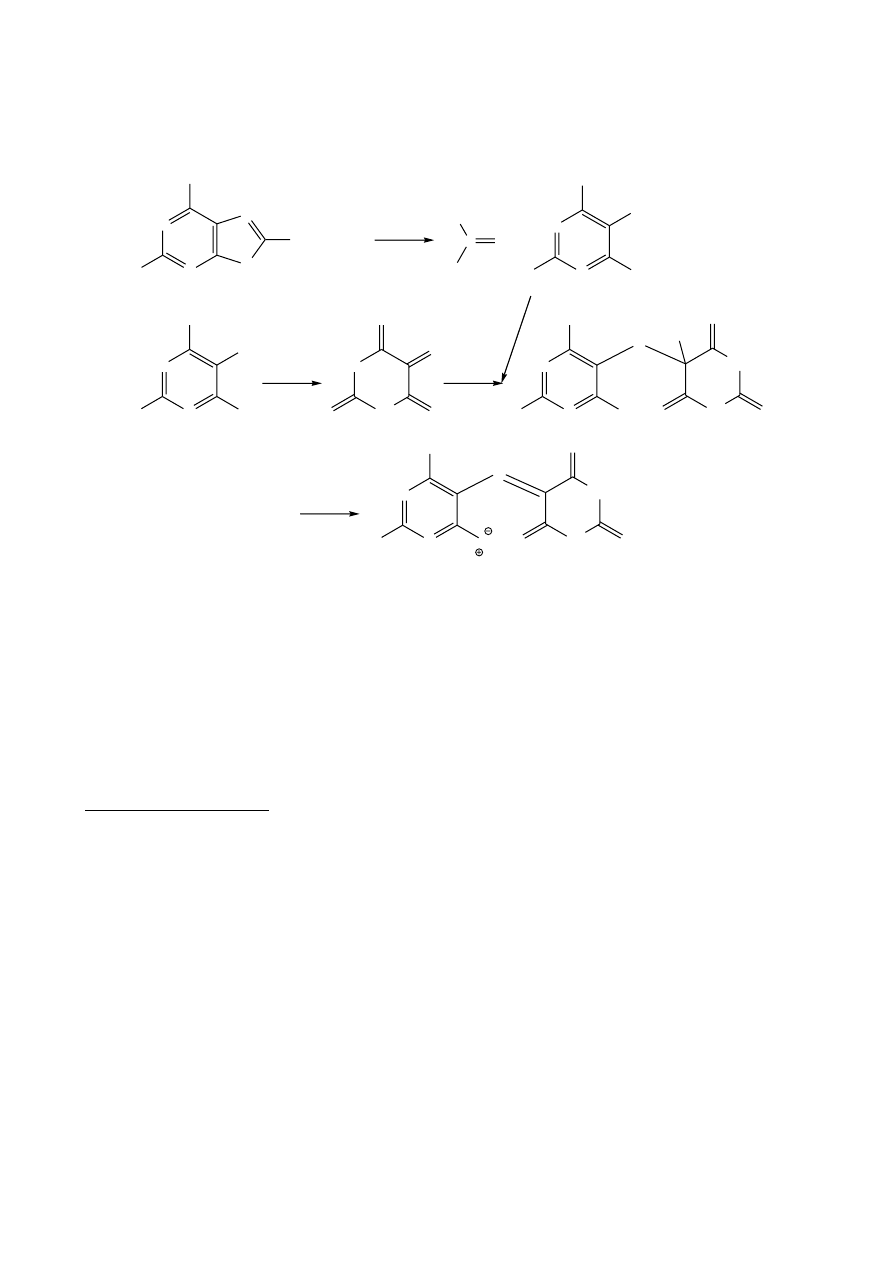
5.
Próby na pochodne pirymidyny
Pirymidyna jest związkiem najważniejszym z diazyn, ze względu na
rozpowszechnienie jej pochodnych. Struktura pirymidyny jest bardzo zbliżona do
struktury pirydyny. Stanowi ją sześcioczłonowy pierścień aromatyczny z dwoma
heteroatomami azotu w położeniach 1 i 3. Obecność drugiego atomu azotu potęguje
właściwości chemiczne w porównaniu z pirydyną. Pirymidyna stanowi podstawowy układ
N
+ Cu
2+
4
N
N
N
N
Cu
2+
N
OH
+ Co
2+
N
O
Co
N
O
N
4
+ 4HCl
N
4
H
Cl
K
4
[Fe(CN)
6
]
N
H
[Fe(CN)
6
]
4
4
+ 4KCl
FARMACJA – Chemia organiczna
28
dla zasad pirymidynowych, budujących kwasy nukleinowe (cytozyna, tymina, uracyl), a
jako pierścień nasycony występuje w szeroko stosowanych barbituranach, pochodnych
kwasu barbiturowego (Allobarbital, Luminal).
a. Reakcja Parriego na pochodne kwasu barbiturowego
Na obecność barbituranów w próbce wskazuje dodatnia próba Parriego,
polegająca na tworzeniu z jonami kobaltowymi(II) w bezwodnym środowisku, w obecności
zasad, fluoryzujących kompleksów o zabarwieniu czerwonofioletowym.
Dodatni wynik tej próby dają także pochodne puryny.
b. Próba mureksydowa na pochodne puryny
Pirymidyna skondensowana z pierścieniem imidazolu (1,3-diazolu) stanowi kolejny
bardzo ważny układ heterocykliczny, zwany puryną. Struktura ta występuje w adeninie i
guaninie, kwasie moczowym a także w takich alkaloidach jak kofeina, teobromina i
teofilina.
Charakterystyczną reakcją na układy purynowe jest próba mureksydowa,
polegająca na ich utlenieniu do pochodnych kwasu purpurowego o zabarwieniu
czerwonożółtym. Kwas moczowy pod wpływem kwasu azotowego(V) ulega hydrolizie do
mocznika i kwasu dialurowego, który częściowo ulega utlenieniu do alloksanu. Obydwa
produkty reakcji łączą się ze sobą tworząc trudno rozpuszczalną alloksantynę.
N
N
OH
NH
2
N
N
O
NH
2
H
cytozyna
formy tautomeryczne
N
N
O
O
O
H
H
kwas barbiturowy
N
N
N
NH
NH
2
N
N
NH
N
OH
OH
OH
adenina
(6-aminopuryna)
kwas moczowy
N
N
O
O
O
R
1
R
2
N
N
O
O
O
R
1
R
2
Co
NH
3
NH
3
barwna
pochodna barbituranu
(związek koordynacyjny)
NH
NH
R
1
R
2
O
O
O
N
NH
R
1
R
2
O
O
OH
Co
2+
, NH
3
FARMACJA – Chemia organiczna
29
Alloksantyna w obecności amoniaku tworzy mureksyd – sól amonową kwasu
purpurowego.
Ponadto kwas moczowy, tak jak inne heterocykliczne pochodne fenoli oraz proste
fenole, posiada zdolność redukowania soli kwasów fosforomolibdenowego i
fosforowolframowego (reakcja Folina) do połączeń o niższym stopniu utlenienia metalu –
Mo
5+
do Mo
3+
oraz W
5+
do W
3+
. Dokładna struktura tych barwnych połączeń nie jest
znana.
Pytania sprawdzające
1. Jak odróżnić od siebie laktozę i galaktozę, co zaobserwujesz?
2. Na czym polega próba Molischa i o czym świadczy jej negatywny wynik?
3. W trzech probówkach znajdują się wodne roztwory glukozy, sacharozy i fruktozy. Jak
stwierdzić w której z nich jest fruktoza?
4. Wymień dwa naturalne cukrowce, które dają pozytywny wynik z odczynnikiem
Seliwanowa.
5. Które z wymienionych związków dają pozytywny wynik próby Fehlinga: aldehyd
glicerynowy, D-ryboza, glikogen, laktoza, fruktoza, maltoza, celuloza, sacharoza, D-
glukoza?
6. Jak sprawdzić, czy dany roztwór zwiera skrobię?
N
N
NH
N
OH
OH
OH
kwas moczowy
H
+
+ 2H
2
O
C
O
NH
2
NH
2
N
N
OH
OH
OH
OH
+
kwas dialurowy
N
N
OH
OH
OH
OH
[O]
-H
2
O
NH
NH
O
O
O
O
N
N
OH
OH
OH
NH
NH
O
O
O
O
OH
alloksan
alloksantyna
N
N
OH
O
OH
NH
NH
O
O
O
N
NH
4
2NH
3
mureksyd
-2H
2
O

FARMACJA – Chemia organiczna
30
7. Jakie reakcje należy przeprowadzić, aby wykryć obecność aminokwasu w roztworze?
Podaj odpowiednie równania reakcji i spostrzeżenia.
8. Omów reakcje charakterystyczne pozwalające na wykrycie szczególnych
aminokwasów zawierających dodatkowe grupy funkcyjne lub układy aromatyczne.
9. Na czym polega próba biuretowa? Jakie związki pozwala wykryć?
10. Jakie reakcje należy przeprowadzić aby odróżnić od siebie cysteinę, alaninę i prolinę?
Co zaobserwujesz?
11. Jaka jest przyczyna żółknięcia skóry po zetknięciu się ze stężonym roztworem kwasu
azotowego(V)?
12. Jakie zmiany zaobserwujesz po działaniu na roztwór białka: etanolem, chlorkiem
sodu, azotanem(V) srebra, chlorkiem amonowym? Które zmiany można cofnąć po
silnym rozcieńczeniu wodą?
13. Przedstaw podział tłuszczowców.
14. Omów liczby charakteryzujące jakość tłuszczów.
15. Na czym polega proces zmydlania tłuszczów?
16. W jaki sposób można otrzymać mydła rozpuszczalne i nierozpuszczalne w wodzie?
17. Na czym polega proces utwardzania tłuszczów?
18. Jak zachowują się kwasy tłuszczowe nienasycone pod wpływem tlenu z utleniaczy?
19. Przedstaw wzór cholesterolu.
20. Omów właściwości chemiczne cholesterolu. Napisz odpowiednie równania reakcji.
21. Narysuj wzory strukturalne: tiofenu, furanu, pirolu, pirydyny, pirymidyny,
piperydyny, indolu, chinoliny, kwasu moczowego.
22. W jaki sposób wykryjesz pochodne pirolu?
23. Na czym polega reakcja antypiryny z kwasem azotowym(III)?
24. W jaki sposób udowodnisz zasadowość pirydyny, chinoliny, chininy?
25. Napisz równanie reakcji 8-hydroksychinoliny z jonami bizmutu(III).
26. Napisz równanie reakcji chinoliny z siarczanem(VI) miedzi(II).
27. Jak wykrywamy indol?
28. Podaj reakcje charakterystyczne dla kwasu moczowego. Na czym polega ich przebieg?
29. Podaj przebieg reakcji Parriego dla cytozyny.
30. Na czym polega próba mureksydowa?
Wyszukiwarka
Podobne podstrony:
f [t] analiza jakosciowa teoria cz 1 [2014]
Sprawozdanie 2 Badanie właściwości i analiza jakościowa anionów, Politechika Białostocka, budownictw
Sprawozdanie 2 Badanie właściwości i analiza jakościowa kationów, Politechika Białostocka, budownict
ANALIZA EKONOMICZNA teoria3
analiza ekonomiczna przedsiębiorstwa - cz. 5, analiza finansowa
Analiza jakościowa kationów i anionów, Analiza jakościowa
analiza wody sprawozdanie chemia analityczna analiza wody teoria
1 ćwiczenie (Analiza jakościowa wody) OZNACZANIE CHLORKÓW I SIARCZANÓW
Analiza ekonomiczna teoria (26 strony) id 60090 (2)
Wybrane metody analizy jakościowej. Reakcje analityczne wybranych anionów, sprawka z chemi utp rok I
27 Kardas Prusak Gajek Analiza jakosci wyrobow
ANALIZA FINANSOWA WYKŁAD 3 CZ 1
Analiza Częstotliwościowa teoria
Analiza sygnalow i predykcja cz 1
1 ćwiczenie (Analiza jakościowa wody) OZNACZANIE ZWIĄZKÓW AZOTU
analiza jakościowa kationów
Analiza matematyczna Teoria sciaga
więcej podobnych podstron