
FARMACJA – Chemia organiczna
1
A N A L I Z A J A K O Ś C I O W A – C Z Ę Ś Ć P I E R W S Z A
ANALIZA PIERWIASTKOWA ZWIĄZKÓW ORGANICZNYCH
Gwałtowny rozwój wielu dziedzin naukowych w ostatnich kilkudziesięciu latach
spowodował, że chemik organik dysponuje obecnie aparaturą badawczą, dzięki której
może identyfikować nieznane substancje w czasie bardzo krótkim wykorzystując techniki
takie jak spektroskopia w podczerwieni, nadfiolecie, spektrometria masowa czy
magnetycznego rezonansu jądrowego.
Organiczna analiza jakościowa należy do najtrudniejszych zadań analitycznych.
Znajomość podstawowych metod analizy jakościowej jest dla chemika nieodzowna;
prowadzenie badań chemicznych wymaga identyfikowania produktów otrzymywanych w
nowych reakcjach, co zwykle jest zadaniem znacznie bardziej skomplikowanym i
czasochłonnym niż prowadzenie samej syntezy. Poza tym, student w trakcie ćwiczeń
dotyczących analizy jakościowej poznaje praktycznie charakterystyczne reakcje związków
o różnych grupach funkcyjnych, uczy się prawidłowo wykonywać próby oraz logicznie
wyciągać wnioski z wyników własnych doświadczeń.
Schemat postępowania analitycznego w jakościowej analizie związków
organicznych obejmuje następujące etapy:
1. Obserwacje ogólne:
-
stan fizyczny substancji (np. ciecz o dużej lepkości, kryształy w postaci igieł, itd.);
-
barwa substancji (wskazuje na obecność chromoforów). Należy pamiętać, że
zabarwienie może pochodzić też od zanieczyszczeń;
-
zapach substancji;
-
próby prażenia i spalania (barwa płomienia, kopcenie, pozostałość po prażeniu).
2. Oznaczanie stałych fizycznych (temperatura topnienia i temperatura wrzenia).
3. Jakościowe oznaczanie pierwiastków.
4. Badanie rozpuszczalności związku.
5. Interpretacja widm – wykrycie grup funkcyjnych.
6. Zastosowanie reakcji charakterystycznych na grupy funkcyjne.
7. Zaszeregowanie związku do odpowiedniej klasy (lub szeregu homologicznego).
Wyciągnięcie logicznych wniosków ze wszystkich wykonanych prób i porównanie z
danymi literaturowymi.
8. Otrzymanie pochodnych – potwierdzenie wyciągniętych wniosków.
Wykrywanie substancji organicznych przeprowadza się wykonując próbę
spalania. Polega ona na obserwacji zachowania się badanego związku podczas prażenia w

FARMACJA – Chemia organiczna
2
związek organiczny
CuO
prażenie
CO
2
+ Ba(OH)
2
BaCO
3
+ H
2
O
CO
2
+ H
2
O
płomieniu palnika. Związki organiczne zwęglają się, związki nieorganiczne, poza
nielicznymi wyjątkami, nie ulegają zmianom organoleptycznym. Próba spalania pozwala
ponadto stwierdzić obecność metalu w analizowanym związku. Świadczy o niej popiół
uzyskany po skończonym procesie prażenia.
Jakościowa analiza pierwiastków obejmuje próby wykrywania poszczególnych
pierwiastków, obecnych w związkach organicznych, tj. węgla, wodoru, azotu, siarki,
fluorowców i tlenu. Znacznie rzadziej występujące w związkach organicznych metale
identyfikuje się bezpośrednio po wykonaniu próby spalania.
Wymienione wyżej pierwiastki występują w związkach organicznych najczęściej w
postaci niejonowo związanej. Bezpośrednie wykrycie ich w tej formie nie jest w większości
przypadków możliwe. Z tego też względu wykonywanie odpowiednich prób na
poszczególne pierwiastki (poza tlenem) musi być poprzedzone przekształceniem tych
ostatnich w proste związki nieorganiczne, a mianowicie:
węgla
– w dwutlenek węgla,
wodoru
– w wodę,
azotu
– w cyjanki nieorganiczne lub amoniak,
siarki
– w siarczki nieorganiczne,
fluorowców – w halogenki nieorganiczne.
Powyższe procesy zachodzą podczas rozkładu związku organicznego. W dwóch
pierwszych przypadkach przeprowadza się rozkład na drodze prażenia substancji
organicznej z tlenkiem miedziowym. W pozostałych przypadkach poddaje się związki
organiczne mineralizacji za pomocą stapiania z metalicznym sodem.
1.
Wykrywanie węgla i wodoru
Pozytywna próba spalania jest wystarczającym dowodem na obecność węgla
w analizowanym związku. Dla związków organicznych łatwo lotnych, sublimujących oraz
rozkładających się pod wpływem temperatury do produktów gazowych, uzyskuje się w
próbie spalania wynik negatywny. W takich przypadkach obecność węgla stwierdza się za
pomocą próby, polegającej na prażeniu substancji z tlenkiem miedzi(II). Podczas tego
procesu następuje utlenienie węgla do dwutlenku węgla oraz wodoru do wody.
Dwutlenek węgla wykrywa się w postaci nierozpuszczalnego w wodzie węglanu baru lub
wapnia, a woda pojawia się w postaci kropelek (lub rosy) na górnych, chłodnych
ściankach probówki, zgodnie z reakcją:
FARMACJA – Chemia organiczna
3
N
organicznie związany
Na
stapianie
NaCN
S
organicznie związana
Na
stapianie
Na
2
S
X
organicznie związany
Na
stapianie
NaX
RCOONH
4
+ NaOH
RCOONa + NH
3
+ H
2
O
RCONH
2
+ NaOH
RCOONa + NH
3
T
T
RCN + NaOH + H
2
O
RCOONa + NH
3
T
2NaCN + FeSO
4
Fe(CN)
2
+ Na
2
SO
4
Fe(CN)
2
+ 4NaCN
Na
4
[Fe(CN)
6
]
3Na
4
[Fe(CN)
6
] + 2Fe
2
(SO
4
)
3
Fe
4
[Fe(CN)
6
]
3
+ 6Na
2
SO
4
2.
Mineralizacja substancji organicznej i próby Lassaigne’a
Podczas procesu mineralizacji, który polega między innymi na stapianiu
substancji organicznej z sodem, azot, siarka i chlorowce organicznie związane,
przekształcają się w proste związki nieorganiczne o strukturze jonowej, to jest w cyjanek,
siarczek i halogenek sodu:
Po przeprowadzeniu procesu mineralizacji związku organicznego przeprowadza się
próby Lassaigne’a pozwalające wykryć azot, siarkę i fluorowce za pomocą reakcji
jakościowych, stosowanych w analizie nieorganicznej, wykonując próby na cyjanki,
siarczki i halogenki.
3.
Wykrywanie azotu
a.
Azot luźno związany, na przykład w postaci soli amonowej, amidu lub
nitrylu, wykrywa się bezpośrednio, to znaczy z pominięciem procesu mineralizacji,
poddając analizowany związek hydrolizie alkalicznej, podczas której azot wydziela się w
postaci amoniaku:
b.
Wykrywanie azotu organicznie związanego polega na mineralizacji
substancji organicznej, a następnie przeprowadzeniu uzyskanego cyjanku sodu w błękit
pruski, czyli heksacyjanożelazian(II) żelaza(III):
Uwaga: Próba Lassaigne’a jest niepewna dla związków lotnych, związków nitrowych, azowych,
diazowych i pochodnych pirolu. Także w przypadku związków zawierających azot luźno związany,
wynik tej próby może być negatywny na skutek ulotnienia się azotu w postaci amoniaku podczas
procesu mineralizacji.

FARMACJA – Chemia organiczna
4
2Na
+
+ S
2-
+ Na
2
[Fe(CN)
5
NO]
Na
4
[Fe(CN)
5
NOS]
Na
2
S + 2CH
3
COOH
H
2
S + 2CH
3
COONa
H
2
S + (CH
3
COO)
2
Pb
PbS + 2CH
3
COOH
4.
Wykrywanie siarki
Podczas prażenia substancji zawierającej siarkę powstaje siarczek sodowy, którego
obecność można stwierdzić w dwojaki sposób:
a.
w reakcji z nitroprusydkiem sodowym - jony siarczkowe w środowisku
zasadowym wchodzą w reakcję z nitroprusydkiem sodowym dając intensywne,
purpurowe zabarwienie:
b.
w reakcji z octanem ołowiu(II) - jony siarczkowe z octanem ołowiu(II)
w obecności kwasu octowego tworzą czarny osad siarczku ołowiu(II), nierozpuszczalny w
kwasach, a rozpuszczalny w stęż. gorącym kwasie azotowym:
5.
Wykrywanie fluorowców
a.
Próba Beilsteina
Jest to reakcja miedzi z fluorowcami w płomieniu palnika gazowego. Podczas
ogrzewania tworzą się halogenki miedzi(II), które barwią płomień palnika na zielono.
Chociaż próba w sposób najczulszy pozwala wykryć te pierwiastki, posiada znaczenie
jedynie orientacyjne. Pozytywny wynik próby dają bowiem również związki organiczne
pozbawione atomu fluorowca, a zawierające azot, a mianowicie cyjanki, rodanki,
mocznik, tiomocznik, niektóre pochodne pirydyny i chinoliny.
b.
Reakcja z AgNO
3
Atom fluorowca w związku organicznym najczęściej jest silnie związany. W tym
przypadku wykrywa się go za pomocą reakcji z azotanem srebra, po uprzednim
przeprowadzeniu mineralizacji substancji analizowanej. W reakcji tej uzyskuje się trudno
rozpuszczalne halogenki srebra, różniące się miedzy sobą barwą oraz rozpuszczalnością
w wodnym roztworze amoniaku.
W przypadku wykrywania fluorowca luźno związanego, np. w solach amoniowych
i oksoniowych, należy przeprowadzić alkaliczną hydrolizę badanego związku do
halogenku sodowego lub potasowego, a następnie wykonać reakcję z azotanem(V) srebra.
AgCl + 2NH
3(aq)
Ag(NH
3
)
2
+
+ Cl
-
NaCl + AgNO
3
AgCl + NaNO
3

FARMACJA – Chemia organiczna
5
6.
Ustalanie rodzaju fluorowca
a.
Rozpuszczalność halogenku srebrowego w wodnym roztworze
amoniaku
Rodzaj atomu fluorowca można określić za pomocą metod stosowanych w analizie
nieorganicznej, badając rozpuszczalność halogenku srebrowego uzyskanego zarówno w
analizie fluorowca luźno związanego, jak też po mineralizacji związku zawierającego
fluorowiec związany silnie. Osad biały, serowaty, fiołkowiejący w świetle i rozpuszczalny
w 10%-owym wodnym roztworze amoniaku wskazuje na obecność chloru. Osad
jasnożółty, serowaty, zieleniejący na świetle i rozpuszczalny w stężonym wodnym
roztworze amoniaku dowodzi obecności bromu, zaś osad o podobnym wyglądzie, ale
nierozpuszczalny w stężonym NH
3aq
świadczy o obecności jodu w analizowanym związku.
b.
Próba z wodą chlorową
Woda chlorowa utlenia jodki i bromki sukcesywnie do wolnego jodu i bromu.
Nadmiar wody chlorowej utlenia jod do bezbarwnego jodanu. Próba z wodą chlorową
pozwala wykryć jod i brom obok siebie, zgodnie z następującym schematem reakcji:
Jod i brom rozpuszczają się w tetrachlorku węgla lub chloroformie. Warstwa
rozpuszczalnika organicznego przyjmuje najpierw zabarwienie różowo-fioletowe od
wydzielającego się jodu. Po jego utlenieniu do jodanu pojawia się zabarwienie brunatno-
czerwone bromu. Brak zabarwienia wskazuje na obecność chloru w przypadku
pozytywnej próby z azotanem srebrowym.
W praktyce, ze względu na toksyczność chloru nie stosuje się wody chlorowej a jedynie
10% roztwór chloraminy T lub wodę bromową. Użycie wody bromowej nie pozwala na
pełną identyfikację fluorowców w związku organicznym, jedynie można potwierdzić
obecność jodu.
I
2
+ 5Cl
2
+ 6H
2
O
2 IO
3
-
+ 10Cl
-
+ 12H
+
2I
-
+ Cl
2
I
2
+ 2Cl
-
2Br
-
+ Cl
2
Br
2
+ 2Cl
-

FARMACJA – Chemia organiczna
6
ANALIZA GRUP FUNKCYJNYCH: WĘGLOWODORY, ALKOHOLE, FENOLE
WĘGLOWODORY
Węglowodory są to połączenia organiczne zbudowane z atomów węgla i wodoru. Ze
względu na różne sposoby łączenia się atomów węgla w tych związkach dzielimy je na:
1. Łańcuchowe (acykliczne):
a. nasycone czyli alkany (parafiny) – między atomami węgla występują jedynie wiązania
pojedyncze, szereg homologiczny C
n
H
2n+2
, atomy węgla występują w stanie
hybrydyzacji sp
3
(np. metan, etan); reakcją charakterystyczną jest reakcja substytucji
wolnorodnikowej;
b. nienasycone, które między atomami węgla posiadają wiązania wielokrotne:
alkeny – o jednym lub kilku wiązaniach podwójnych między atomami węgla,
szereg homologiczny odpowiadający związkom z jednym wiązaniem podwójnym -
C
2
H
2n
, atomy węgla przy wiązaniu podwójnym w stanie hybrydyzacji sp
2
(np.
eten, propen, but-2-en);
alkiny – o jednym lub kilku wiązaniach potrójnych między atomami węgla, szereg
homologiczny odpowiadający związkom z jednym wiązaniem potrójnym - C
n
H
2n-2
;
atomy węgla przy wiązaniu potrójnym w stanie hybrydyzacji sp (np. etyn czyli
acetylen, propyn, but-2-yn);
Reakcją charakterystyczną węglowodorów nienasyconych jest reakcja addycji do wiązania
wielokrotnego.
2. Pierścieniowe albo cykliczne:
a. alicykliczne – zbudowane z pierścieni karbocyklicznych, których wszystkie wiązania
są pojedyncze (np. cyklopropan), tworzą szereg homologiczny o wzorze C
n
H
2n
,
b. aromatyczne – zbudowane z pierścieni karbocyklicznych, w których atomy węgla
występują w stanie hybrydyzacji sp
2
(np. benzen), reakcją charakterystyczną jest
reakcja substytucji elektrofilowej.
Nie znaleziono dotychczas, z nielicznymi wyjątkami, odpowiednich pochodnych do
charakterystyki węglowodorów alifatycznych i alicyklicznych. Ich identyfikacja opiera się
na oznaczeniu temperatury wrzenia, temperatury topnienia, gęstości, współczynnika
załamania światła oraz pomiarach widmowych (IR,
1
H NMR i
13
C NMR). Można jedynie
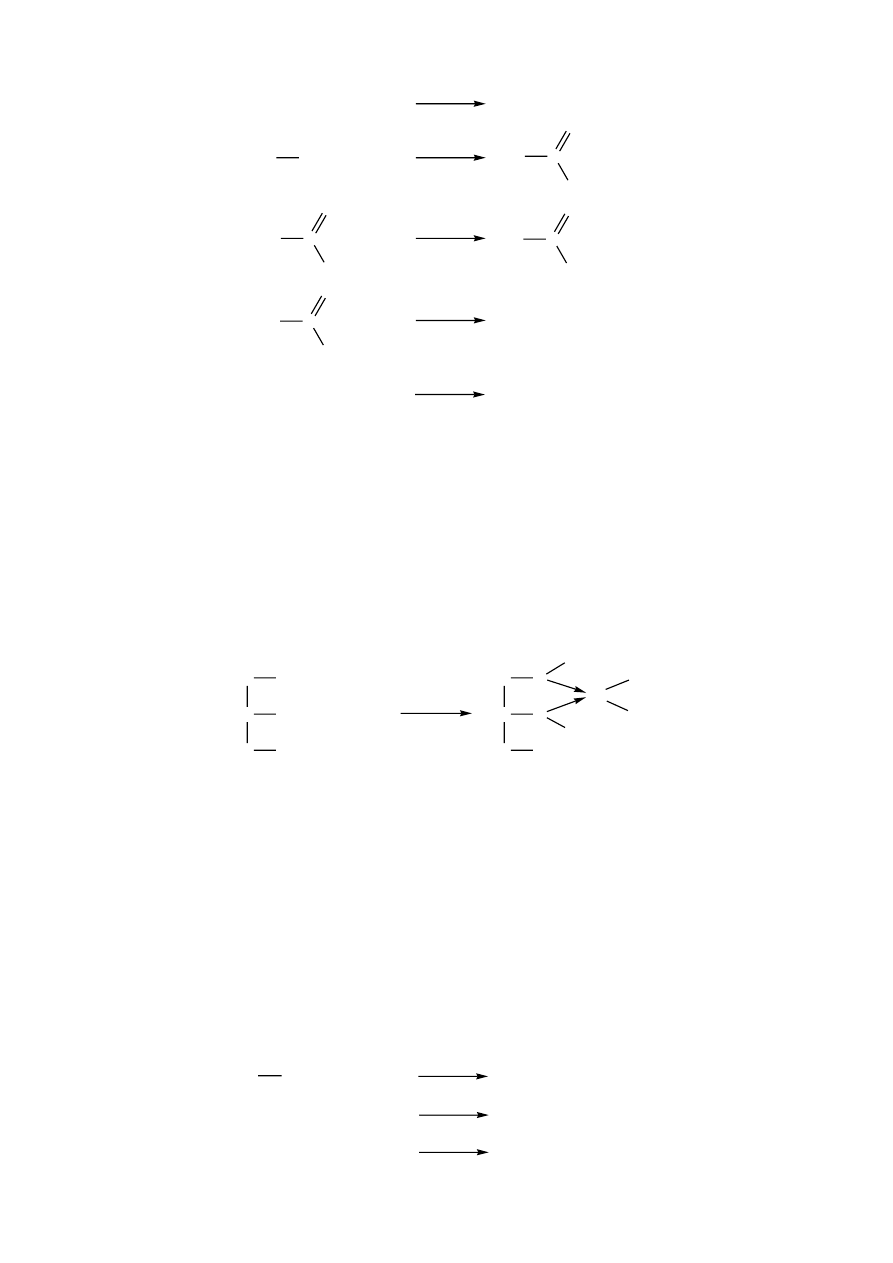
określić rodzaj węglowodoru w reakcjach z nadmanganianem potasu albo bromem:
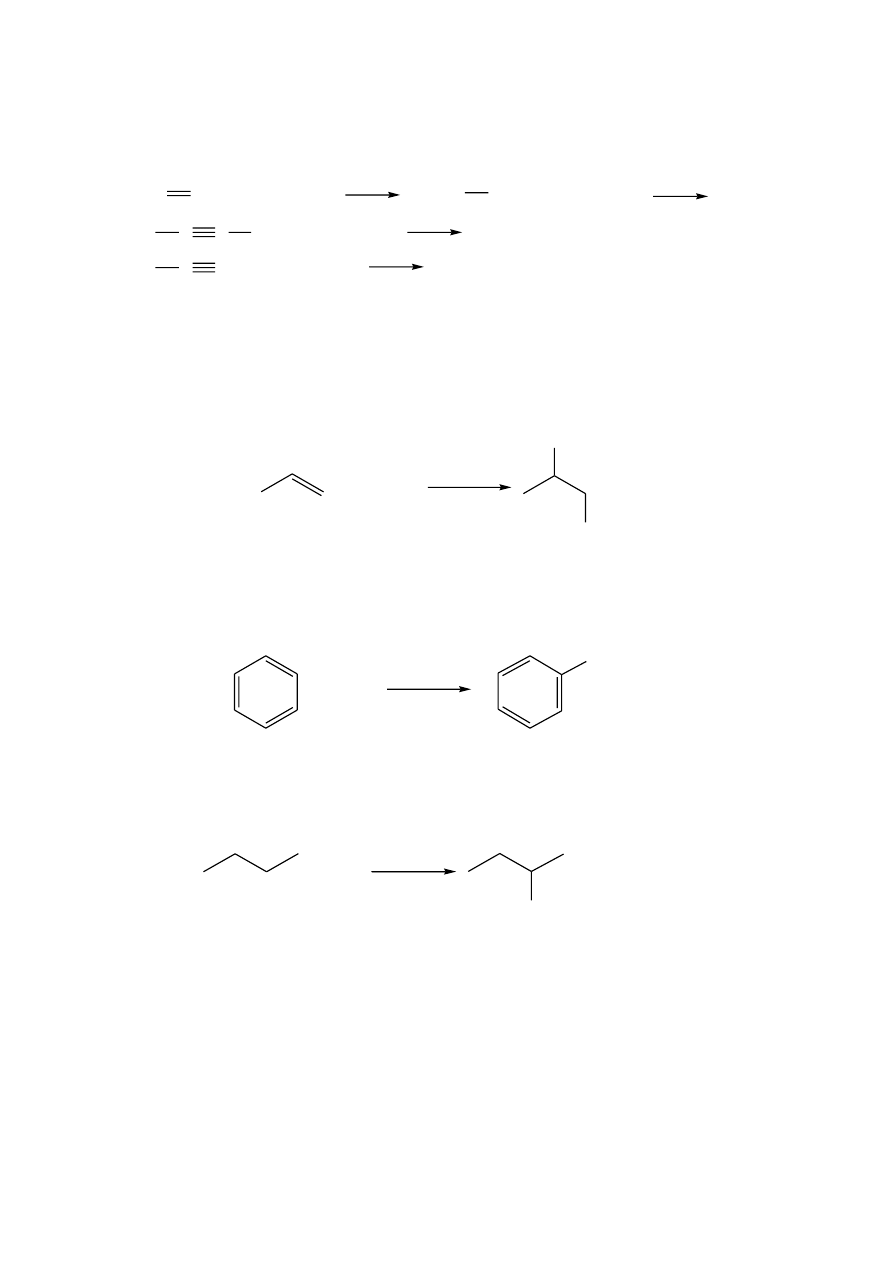
1.
Reakcja Lehmana (z nadmanganianem potasu)
W reakcji Lehmana węglowodory nienasycone odbarwiają roztwór KMnO
4
z
wydzieleniem brunatnego osadu dwutlenku manganu. Reakcja prowadzi do rozerwania
wiązania wielokrotnego, alkeny utleniają się do aldehydów lub ketonów, natomiast alkiny
do kwasów karboksylowych. Alkiny terminalne, zawierające wiązanie potrójne przy
FARMACJA – Chemia organiczna
7
pierwszym atomie węgla, utleniają się do odpowiedniego kwasu karboksylowego i
dwutlenku węgla). Węglowodory nasycone i aromatyczne reagują bardzo powoli i dopiero
po podgrzaniu.
2.
Reakcja z bromem
W obecności węglowodorów nienasyconych następuje natychmiastowe odbarwienie
roztworu bromu. Zachodzi reakcja addycji bromu do atomów węgla połączonych
wiązaniem podwójnym lub potrójnym.
Węglowodory aromatyczne ulegają reakcji substytucji elektrofilowej z wydzieleniem
bromowodoru, jednakże wymagany jest udział katalizatora (wiórki żelaza, kwasy Lewisa,
np. FeCl
3
).
Węglowodory nasycone pod wpływem naświetlania promieniowaniem UV lub po ogrzaniu
ulegają reakcji substytucji wolnorodnikowej, także z wydzieleniem bromowodoru.
ALKOHOLE
Alkohole są to związki alifatyczne lub alicykliczne zawierające jedną lub większą
ilość grup wodorotlenowych, stąd mamy do czynienia z alkoholami jedno- lub
wielowodorotlenowymi.
W zależności od struktury fragmentu węglowodorowego wyróżniamy:
+ Br
2
Br
+ HBr
kat
benzen
bromobenzen
+ Br
2
Br
Br
propen
1,2-dibromopropan
+ Br
2
+ HBr
Br
hv
butan
2-bromobutan
CH
2
CH
2
+ 2MnO
4
-
+ 4H
2
O
HOCH
2
CH
2
OH + 2MnO
2
+ 2OH
-
6HCHO
C
C
CH
3
CH
3
+ 2MnO
4
-
+ 2H
2
O
3
3
2CH
3
COOH + 2MnO
2
+ 2OH
-
C
CH
CH
3
+ 2MnO
4
-
+ 2H
2
O
CH
3
COOH + CO
2
+ 2MnO
2
+ 2OH
-
FARMACJA – Chemia organiczna
8
a. alkohole I-rzędowe – alkohole, w których grupa –OH związana jest z atomem węgla
połączonym z dwoma atomami wodoru;
b. alkohole II-rzędowe – alkohole, w których grupa –OH związana jest z atomem węgla
połączonym z jednym atomem wodoru;
c. alkohole III-rzędowe – alkohole, w których grupa –OH związana jest z atomem węgla
pozbawionym atomów wodoru.
Rzędowość alkoholi można rozróżnić za pomocą metody Lucasa lub w reakcji
z odczynnikiem chromowym.
3.
Reakcja z odczynnikiem Lucasa
Próba ta polega na różnorodnym zachowaniu się I-, II- i III-rzędowych alkoholi w
obecności odczynnika Lucasa, którym jest roztwór bezwodnego ZnCl
2
w stężonym kwasie
solnym (68 g ZnCl
2
w 52.5 g stężonego HCl). W wyniku tej próby możemy zaobserwować:
a. w przypadku alkoholi I-rzędowych - brak zmian prócz lekkiego ściemnienia, roztwór
pozostaje klarowny;
b. roztwór klarowny, po 1-1.5 godzinie następuje rozdzielenie warstw – w przypadku
alkoholi drugorzędowych;
c. wyraźne,
natychmiastowe
rozdzielenie
warstw
w
przypadku
alkoholi
trzeciorzędowych.
Uwaga: Alkohole trzeciorzędowe reagują ze stężonym kwasem solnym nawet bez dodania
ZnCl
2
. Alkohol allilowy, benzylowy i cynamonowy (alkohole pierwszorzędowe), reagują
podobnie jak alkohole II- i III-rzędowe.
4.
Identyfikacja alkoholi trzeciorzędowych metodą Bordwella i Wellmana
Alkohole I- i II-rzędowe reagują z odczynnikiem chromowym (roztwór CrO
3
w
stężonym H
2
SO
4
) dając błękitnozielone zabarwienie pochodzące od związków chromu na
+3 stopniu utlenienia. Alkohole pierwszorzędowe utleniają się do aldehydów, a alkohole
+ HCl
ZnCl
2
CH
OH
H
3
C
H
3
C
+
CH
Cl
H
3
C
H
3
C
H
2
O
izopropanol
2-chloropropan
C
CH
3
CH
3
+ HCl
ZnCl
2
H
2
O
H
3
C
OH
C
CH
3
CH
3
+
H
3
C
Cl
t-butanol
2-chloro-2-metylopropan
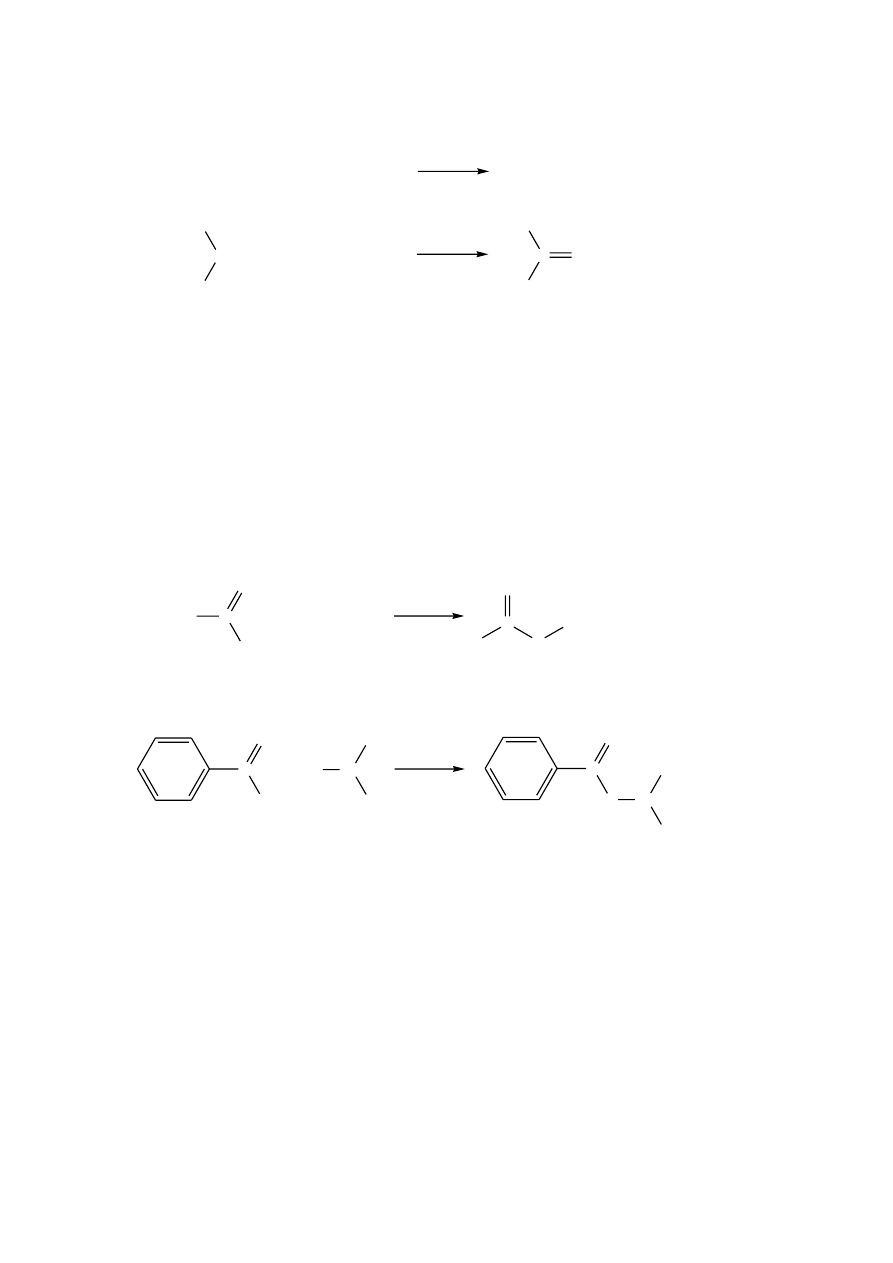
FARMACJA – Chemia organiczna
9
drugorzędowe do odpowiednich ketonów. Alkohole trzeciorzędowe nie reagują z
odczynnikiem chromowym.
5.
Tworzenie estrów
Bez względu na rzędowość oraz ilość grup hydroksylowych, alkohole energicznie
reagują z chlorkami kwasowymi tworząc odpowiednie estry, które można zidentyfikować
w oparciu o charakterystyczny zapach. Reakcja acylowania alkoholi, np. chlorkiem
acetylu czy chlorkiem benzoilu, jest reakcją nieodwracalną i zachodzi z bardzo dużą
wydajnością.
Estry można uzyskać także poprzez działanie na alkohole kwasami karboksylowymi,
jednakże reakcja zachodzi w sposób odwracalny i wymaga zastosowania katalizatora (np.
kwasu mineralnego).
6.
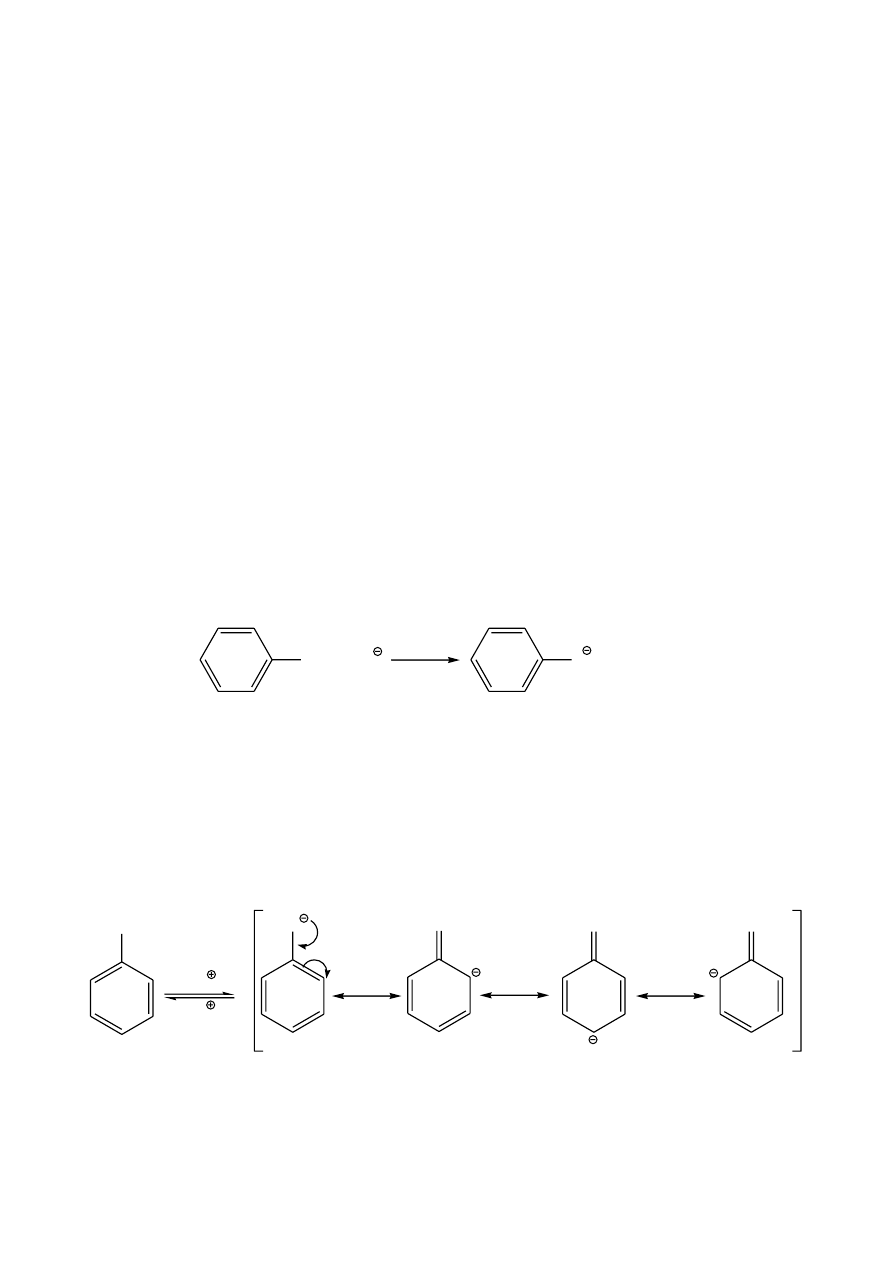
Próba jodoformowa
Reakcją charakterystyczną dla etanolu i metylokarbinoli (R-CH(OH)-CH
3
, R= CH
3
-,
C
2
H
5
- lub inny podstawnik) jest próba jodoformowa – reakcja Liebena. Próba ta polega
na utlenieniu alkoholu do odpowiedniego związku karbonylowego (w przypadku etanolu
do aldehydu octowego), a następnie utworzeniu jodoformu.
H
3
C
C
O
Cl
H
3
C
C
O
O
CH
2
CH
3
+ CH
3
CH
2
OH
+ HCl
chlorek acetylu
octan etylu
Reakcja acetylowania
C
O
Cl
+
chlorek benzoilu
benzoesan izopropylu
C
O
O
CH
CH
3
CH
3
+ HCl
CH
CH
3
CH
3
HO
Reakcja benzoilowania
3CH
3
CH
2
OH + 2CrO
4
2-
+ 6H
+
3CH
3
CHO + 2Cr
3+
+ 6H
2
O
etanol
aldehyd octowy
+ 2CrO
4
2-
+ 6H
+
+ 2Cr
3+
+ 6H
2
O
CHOH
H
3
C
H
3
C
3
C
H
3
C
H
3
C
3
O
propan-2-ol
aceton
FARMACJA – Chemia organiczna
10
Uwaga: Pozytywny wynik próby jodoformowej dają także aldehyd octowy i metyloketony,
np. aceton lub butanon (napisz odpowiednie równania reakcji).
7.
Rozróżnianie alkoholi jednowodorotlenowych od wielowodorotlenowych:
a.
reakcja z jonami miedzi(II)
Alkohole wielowodorotlenowe, takie jak glikol lub gliceryna roztwarzają
galaretowaty niebieski osad wodorotlenku miedzi(II) tworząc rozpuszczalne w wodzie
kompleksy miedzi o barwie szafirowej.
b.
metoda Malaprade’a – reakcja na α-glikole
Reakcji tej ulegają związki 1,2-dihydroksylowe, jak również α-hydroksyaldehydy i
α-hydroksyketony. Związki ulegające tej reakcji redukują kwas nadjodowy do jodanów,
jednocześnie wiązanie między atomami węgla, połączonymi z grupami hydroksylowymi
ulega rozerwaniu z utworzeniem związków karbonylowych. Te następnie są utleniane do
kwasów karboksylowych za pomocą powstającego jodanu. Wydzielający się w wyniku tej
reakcji jodek potasu po dodaniu azotanu srebra przekształca się w nierozpuszczalny w
wodzie żółty jodek srebra.
I
2
+ 2NaOH
NaOI + NaI + H
2
O
H
3
C
C
O
H
H
3
C
CH
2
OH + NaOI
+ NaI + H
2
O
I
3
C
C
O
H
+ 3NaOI
+ 3NaOH
H
3
C
C
O
H
I
3
C
C
O
H
+ NaOH
CHI
3
+ HCOONa
jodoform
CH
3
CH
2
OH + 4I
2
+ 6NaOH
CHI
3
+ HCOONa + 5NaI + 5H
2
O
Sumarycznie:
HOCH
2
CH
2
OH + NaIO
4
2HCHO + NaIO
3
+ H
2
O
3HCHO + NaIO
3
3HCOOH + NaI
NaI + AgNO
3
AgI + KNO
3
H
2
C
HC
OH
OH
H
2
C
OH
+ Cu(OH)
2
H
2
C
HC
O
O
H
2
C
OH
Cu
OH
OH
H
H
niebieski
osad
szafirowy zw. koordynacyjny
rozpuszczalny w wodzie
FARMACJA – Chemia organiczna
11
OH
O
H
+
O
O
O
-
H
struktury rezonansowe jonu fenolanowego
Reakcja ta może również służyć do utlenienia węglowodanów, szczególnie
polisacharydów, jednakże wymagane jest wówczas użycie wyższej temperatury.
FENOLE
Cechą charakterystyczną budowy chemicznej fenoli jest obecność grupy
OH
związanej bezpośrednio z węglem wchodzącym w skład pierścienia aromatycznego. Fenole
są trudno rozpuszczalne w wodzie. Rozpuszczalność fenoli w wodzie wzrasta wraz ze
wzrostem liczby grup OH w cząsteczce. Fenole łatwo rozpuszczają się w alkoholach,
eterze, chloroformie, roztworach wodorotlenków metali. Najprostsze fenole są cieczami
lub ciałami stałymi o niskich temperaturach topnienia. Mają wysokie temperatury
wrzenia, co jest spowodowane występowaniem międzycząsteczkowych wiązań
wodorowych. Jednowodorotlenowe fenole mają charakterystyczny zapach, natomiast u
fenoli wielowodorotlenowych zapach jest mniej intensywny.
Atom wodoru grupy
OH w fenolach ulega odszczepieniu znacznie łatwiej niż w
alkoholach. Fenole są na tyle silnymi kwasami, że ich sole można otrzymywać w
reakcjach z wodorotlenkami metali. Charakter kwasowy prostych fenoli nie jest wyraźny,
gdyż nie reagują one z wodorowęglanem sodu, co pozwala odróżnić fenole od kwasów
karboksylowych.
Wzrost kwasowości fenolu w porównaniu z alkoholami jest spowodowany rezonansową
stabilizacją anionu fenolanowego. Efekt ten tłumaczy także aktywację pierścienia
aromatycznego w reakcjach substytucji elektrofilowej. Powstająca wskutek jonizacji
grupa -O
, dzięki ładunkowi ujemnemu jest grupą bardziej elektronodonorową niż grupa
-OH.
OH + OH
O
+ H
2
O
fenol
jon fenolanowy
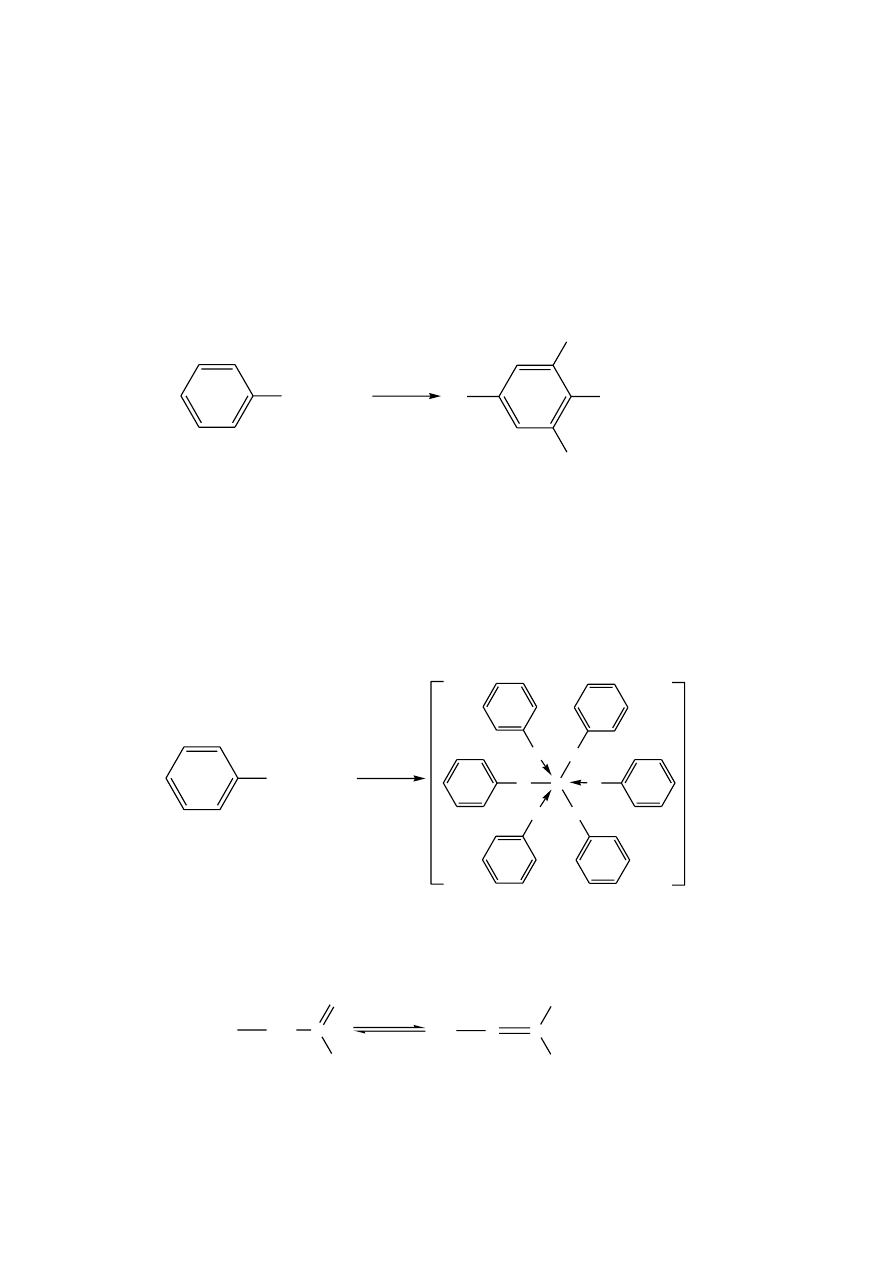
FARMACJA – Chemia organiczna
12
8.
Bromowanie fenolu
Wpływ aktywujący grupy -OH jest tak silny, że podstawienie zachodzi szybko
nawet w bardzo łagodnych warunkach. Często dochodzi do powstania produktów
wielopodstawionych, gdyż nie ma możliwości zatrzymania reakcji po wprowadzeniu
jednego podstawnika. Przykładowo bromefenol jest silniejszym kwasem niż fenol,
wytwarza większe stężenie anionów i szybciej ulega bromowaniu. Grupa -OH jest
podstawnikiem pierwszego rodzaju i kieruje następne podstawniki w pozycje orto
i para. W związku z tym podczas bromowania fenolu powstaje tribromofenol.
9.
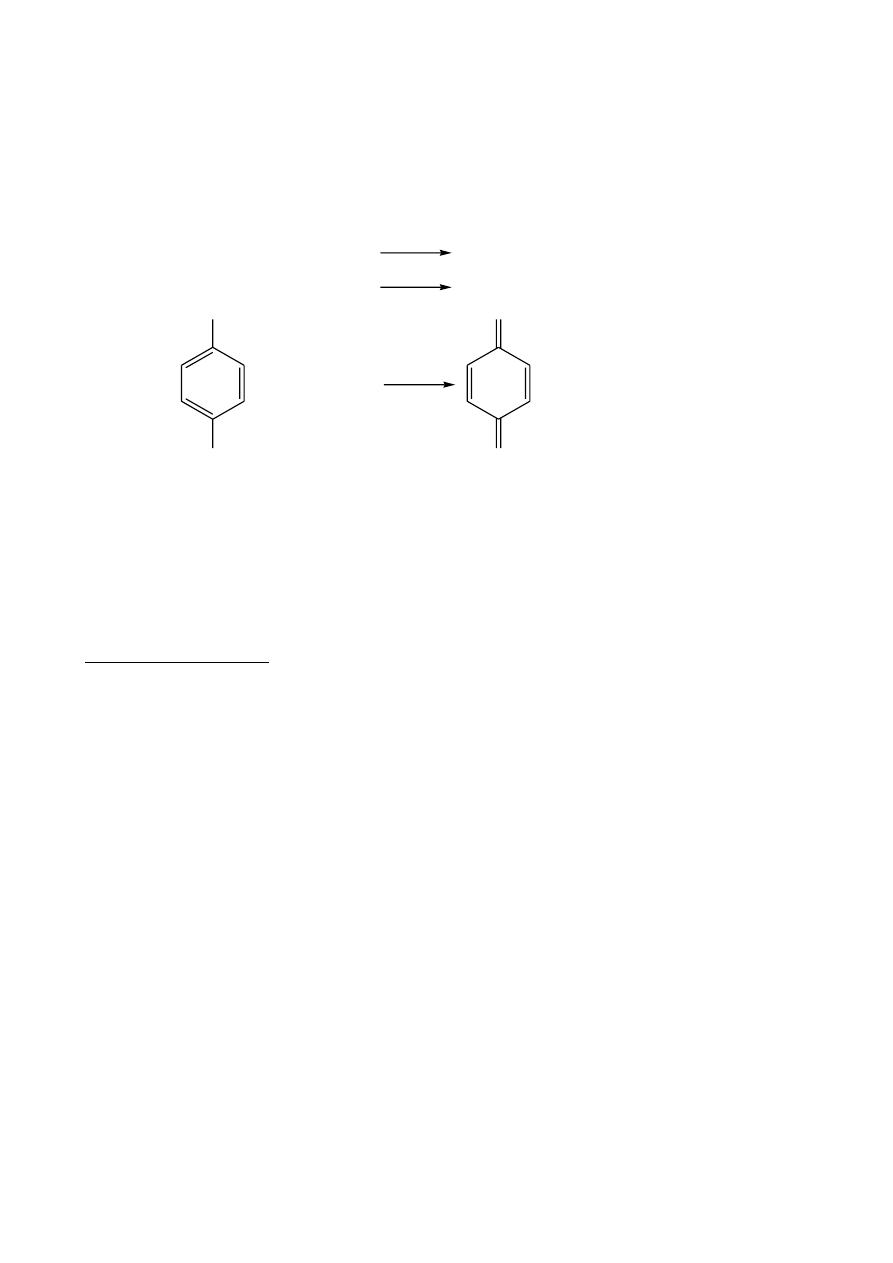
Kompleksy fenoli z jonami żelaza
Fenole z jonami żelaza(III) tworzą barwne kompleksy. Barwa tych połączeń zależy
od rodzaju fenolu, użytego rozpuszczalnika i stężenia reagentów. Zabarwienie to może
być nietrwałe i należy je obserwować w chwili dodawania odczynnika. Fenole zawierające
co najmniej dwie grupy
OH w położeniu „orto” dają silnie zabarwione roztwory, np. kwas
galusowy daje tzw. „atrament żelazowy”. Podobnie reaguje kwas salicylowy.
Dodatnią próbę z jonami Fe
3+
(FeCl
3
) dają również związki zdolne do enolizacji (aldehydy,
ketony) oraz kwas salicylowy.
OH +
H
2
O
20
o
C
OH +
Br
Br
Br
3Br
2
3HBr
OH + Fe
3+
6
Fe
3-
+ 6H
+
O
O
O
O
O
O
CH
2
C
O
R
C
H
C
OH
R
aldehyd: R = H:
keton: R = CH
3,
CH
2
CH
3,
enol
FARMACJA – Chemia organiczna
13
10.
Właściwości redukcyjne fenoli
Fenole, szczególnie wielowodorotlenowe, są reduktorami, silniejszymi niż
alkohole. Podobnie jak aldehydy redukują amoniakalny roztwór soli srebra z
wytworzeniem lustra srebrowego. Utlenianie fenoli prowadzi do zaniku aromatycznego
charakteru związku i powstania nienasyconych ketonów.
Fenole ulegają także reakcji z odczynnikiem Fehlinga (CuSO
4
, winian sodowo-potasowy,
NaOH) w silnie zasadowym środowisku redukując jonu Cu
2+
do tlenku miedzi(I) (Cu
2
O).
Pytania sprawdzające
1.
Podaj i krótko scharakteryzuj sposób postępowania analitycznego w jakościowej
analizie związku organicznego.
2.
Omów sposób wykrywania azotu luźno związanego w związkach organicznych.
Podaj odpowiednie równania reakcji.
3.
Na czym polega próba Lassaigne’a?
4.
Napisz równania wszystkich reakcji, które pozwolą stwierdzić obecność jodu w
związku organicznym.
5.
Napisz równania wszystkich reakcji, które pozwolą stwierdzić obecność azotu w
związku organicznym.
6.
Napisz równania wszystkich reakcji, które pozwolą potwierdzić obecność siarki w
związku organicznym.
7.
Podaj sposoby rozróżniania rzędowości alkoholi.
8.
Przy pomocy jakich prób potwierdzisz, że badanym związkiem jest alkohol
trzeciorzędowy?
9.
Na czym polega próba jodoformowa? Jakie związki możemy wykryć przy jej użyciu?
10.
Podaj cykl reakcji zachodzących podczas próby jodoformowej dla izopropanolu,
OH
OH
+ 2[Ag(NH
3
)
2
]OH
+ 2Ag + 4NH
3
+ 2H
2
O
O
O
hydrochinon
chinon
2AgNO
3
+ 2NaOH
Ag
2
O + 2NaNO
3
+ H
2
O
Ag
2
O + 4NH
3
+ H
2
O
2[Ag(NH
3
)
2
]OH

FARMACJA – Chemia organiczna
14
butan-2-olu, etanalu.
11.
Co to są α-glikole? Przy pomocy jakich prób możemy je wykryć?
12.
Jak odróżnisz wodne roztwory gliceryny i etanolu?
13.
Jak wykrywamy węglowodory nienasycone? Jedną z prób dokładnie omów.
14.
W jaki sposób możemy wykazać kwasowe właściwości fenolu?
15.
Podaj reakcje jakim ulega fenol. Napisz odpowiednie równania.
16.
Podaj produkty utleniania nadmanganianem potasu: propenu, pent-2-enu, but-1-
ynu, heksy-3-ynu. Napisz odpowiednie równania reakcji (pamiętaj, że są to reakcje
red-ox).
17.
Na przykładzie hydrochinonu lub rezorcyny omów i przedstaw za pomocą
odpowiednich równań reakcji właściwości redukcyjne fenoli.
Wyszukiwarka
Podobne podstrony:
f [t] analiza jakosciowa teoria cz 3 [2014]
Sprawozdanie 2 Badanie właściwości i analiza jakościowa anionów, Politechika Białostocka, budownictw
Sprawozdanie 2 Badanie właściwości i analiza jakościowa kationów, Politechika Białostocka, budownict
ANALIZA EKONOMICZNA teoria3
analiza ekonomiczna przedsiębiorstwa - cz. 5, analiza finansowa
Analiza jakościowa kationów i anionów, Analiza jakościowa
analiza wody sprawozdanie chemia analityczna analiza wody teoria
1 ćwiczenie (Analiza jakościowa wody) OZNACZANIE CHLORKÓW I SIARCZANÓW
Analiza ekonomiczna teoria (26 strony) id 60090 (2)
Wybrane metody analizy jakościowej. Reakcje analityczne wybranych anionów, sprawka z chemi utp rok I
27 Kardas Prusak Gajek Analiza jakosci wyrobow
ANALIZA FINANSOWA WYKŁAD 3 CZ 1
Analiza Częstotliwościowa teoria
Analiza sygnalow i predykcja cz 1
1 ćwiczenie (Analiza jakościowa wody) OZNACZANIE ZWIĄZKÓW AZOTU
analiza jakościowa kationów
Analiza matematyczna Teoria sciaga
więcej podobnych podstron