
N
a wiele osób spad∏ ogromny ci´˝ar opiekowania
si´ ca∏kowicie niesprawnym intelektualnie star-
szym cz∏onkiem rodziny, który jeszcze kilka lat
temu by∏ pe∏en energii – zajmowa∏ si´ wnukami, uprawia∏
hobby i cieszy∏ si´ ˝yciem. Problem zaczyna si´ zwykle od
pozornie niewinnego roztargnienia: kilkakrotnego powta-
rzania pytaƒ. Choremu trudno zrozumieç skomplikowa-
nà dyskusj´ lub uczestniczyç w bardziej z∏o˝onych formach
rozrywki. Rodzina poczàtkowo k∏adzie to na karb zm´cze-
nia lub podesz∏ego wieku. Ale dziadek lub babcia sà coraz
bardziej zapominalscy. Niektórzy nie potrafià wróciç do
domu z niedalekiego sklepu, a nawet rozpoznaç twarzy
swych bliskich. W koƒcu dotàd samodzielna osoba potrze-
buje pomocy w codziennym ˝yciu: podczas mycia, ubiera-
nia si´, jedzenia i wychodzenia na spacer.
W ten sposób objawia si´ kilka schorzeƒ zwanych ot´-
pieniami – pewne cz´Êci mózgu przestajà wówczas praco-
waç. Prowadzi to do zaburzeƒ pami´ci, oceny, rozumowa-
nia i emocjonalnych. Objawy te nie sà niczym nowym: ich
opisy mo˝na znaleêç w literaturze starogreckiej i Êrednio-
wiecznej. Wi´kszoÊç ot´pieƒ najcz´Êciej dotyka ludzi star-
szych, dlatego choroby te stanowià powa˝ny problem
w krajach, w których znacznie wyd∏u˝y∏a si´ Êrednia d∏u-
goÊç ˝ycia. Oko∏o 15% osób powy˝ej 65 roku ˝ycia zapada
na jakiÊ rodzaj choroby ot´piennej, zaÊ wÊród tych, którzy
do˝ywajà 85 lat – co najmniej 35%.
SpoÊród wszystkich typów ot´pieƒ najpowszechniejsza
jest choroba Alzheimera. Obecnie cierpi na nià 4 mln Ame-
rykanów, a wed∏ug ocen ekspertów do roku 2025 na ca∏ym
Êwiecie b´dzie 22 mln chorych. Jeszcze do niedawna nie
rozumiano przyczyn tej choroby; nadal te˝ nie wiadomo, jak
jà leczyç oraz jej zapobiegaç. Odkrycia w epidemiologii,
genetyce, biologii molekularnej i komórkowej oraz innych
56 Â
WIAT
N
AUKI
Luty 2001
CHOROBA ALZHEIMERA
to problem milionów ludzi
oraz ich rodzin. Jest to jedno
z wielu wywo∏anych zwyro-
dnieniem mózgu ot´pieƒ, któ-
rego cz´stoÊç wyst´powania
gwa∏townie roÊnie w miar´
starzenia si´ ludnoÊci Êwiata.
Nie∏atwo rozwiàzaç biochemicznà ∏amig∏ówk´
obrazujàcà chorob´ Alzheimera,
ale fragmenty, które jeszcze 10 lat
temu przypisywano innej uk∏adance,
teraz zaczynajà pasowaç
uk∏adanka
Ot´pienna
Peter H. St George-Hyslop

Â
WIAT
N
AUKI
Luty 2001 57
ED KASHI

dyscyplinach wiedzy uk∏adajà si´ teraz
w pewnà ca∏oÊç, pozwalajàc badaczom
na zidentyfikowanie chocia˝ cz´Êci me-
chanizmów le˝àcych u jej pod∏o˝a.
Wydaje si´, ˝e choroba Alzheimera
powstaje w wyniku niezwykle silnych
zaburzeƒ w procesie przetwarzania nie-
których bia∏ek, co prowadzi do zaÊmie-
cenia komórek mózgowych i przestrzeni
mi´dzy nimi toksycznymi fragmentami
bia∏kowymi. Co ciekawe, wiadomo ju˝,
˝e wiele innych spowodowanych zwy-
rodnieniem mózgu zaburzeƒ, wÊród
nich ot´pienie czo∏owo-skroniowe, cho-
roba Parkinsona i Creutzfeldta–Jakoba,
równie˝ charakteryzuje si´ zaburzenia-
mi metabolizmu bia∏kowego. Dzi´ki tym
spostrze˝eniom byç mo˝e uda si´ opra-
cowaç nowe sposoby leczenia choroby
Alzheimera i innych ot´pieƒ – na przy-
k∏ad szczepionkami, które pobudzi∏yby
organizm do pozbycia si´ przynajmniej
cz´Êci owych toksycznych fragmentów
bia∏kowych.
Odczytywanie mózgu
Obecna wiedza o chorobie Alzheime-
ra to efekt badania mózgów zmar∏ych
pacjentów. Wykryto ubytki komórek
nerwowych w pewnych rejonach mó-
zgu, takich jak odpowiedzialny za pro-
cesy pami´ciowe hipokamp i kora mó-
zgowa, która uczestniczy w mechani-
zmach rozumowania, zapami´tywania,
mowy i innych wa˝nych procesach
myÊlowych.
Od roku 1970 naukowcy wiedzà, ˝e
cz´Êç z obumierajàcych neuronów to
neurony cholinergiczne, przesy∏ajàce in-
formacje za poÊrednictwem acetylocho-
liny, neuroprzekaênika rozk∏adanego
nast´pnie przez enzym acetylocholine-
steraz´. Leki wprowadzone na rynek
w ostatnim dziesi´cioleciu, takie jak ta-
kryna czy donepezil, uniemo˝liwiajà je-
go funkcjonowanie. Chroniàc acetylo-
cholin´, opóêniajà rozwój choroby
Alzheimera w jej wczesnych stadiach.
Niestety, stajà si´ bezu˝yteczne w mo-
mencie ca∏kowitego zwyrodnienia neu-
ronów cholinergicznych.
Innym objawem tej choroby sà z∏ogi
bia∏ek odk∏adajàce si´ zarówno w sa-
mych komórkach mózgowych, jak i po-
mi´dzy nimi. Wyst´pujàce wewnàtrz
komórek zwane sà zwyrodnieniami neu-
rofibrylarnymi (albo nerwowo-w∏ókien-
kowymi) i przypominajà dwie splecio-
ne ze sobà i tworzàce spiral´ nici. W la-
tach osiemdziesiàtych stwierdzono, ˝e
sploty te sk∏adajà si´ z bia∏ka tau. Ma
ono istotne znaczenie, poniewa˝ wià-
˝e si´ z bia∏kiem tubulinà, które z kolei
tworzy bardzo wa˝ne struktury zwane
mikrotubulami. Jak filary i legary pod-
JOHN W. KARAPELOU
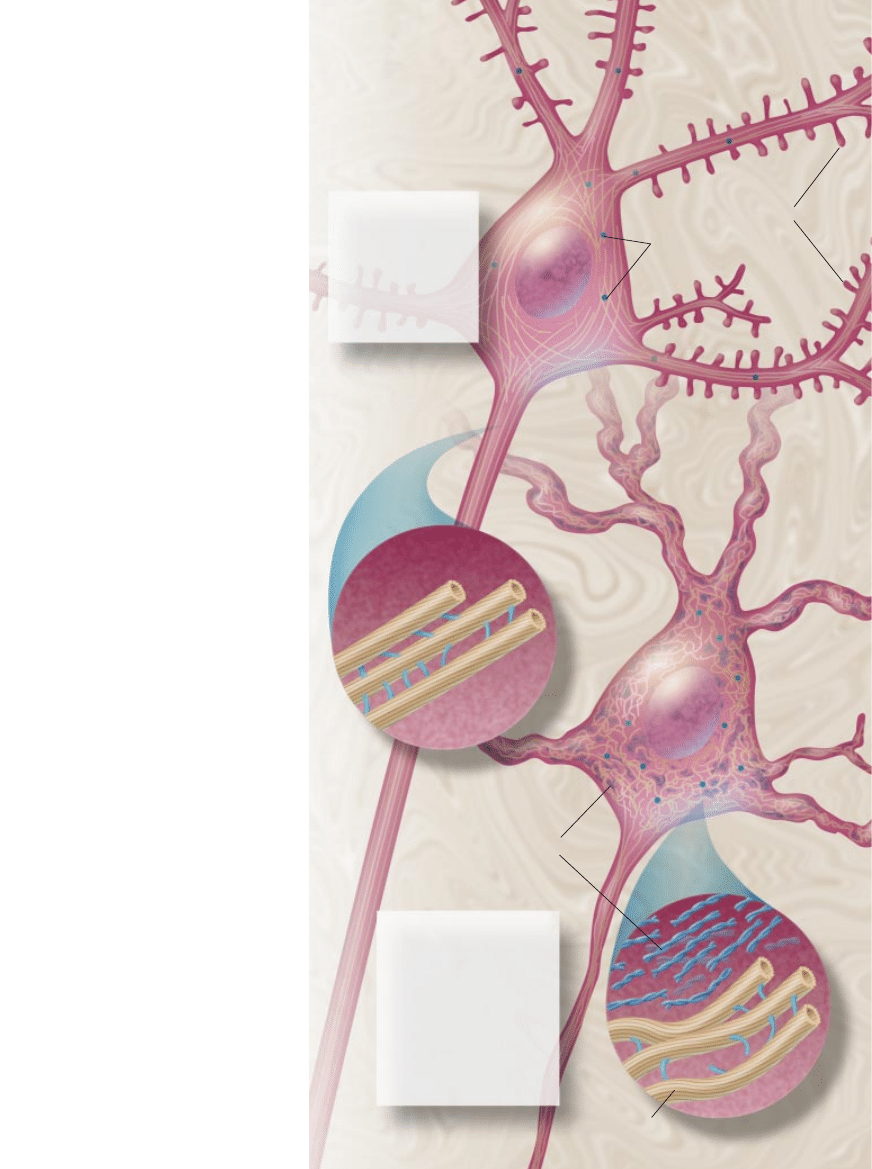
Bia∏ko prekursora
β-amyloidu (βAPP)
mo˝e ulegaç rozk∏adowi w ró˝ny spo-
sób. Jest ci´te przez enzymy alfa-
i gamma-sekretaz´ (wówczas po-
wstaje nieszkodliwy fragment p3)
bàdê przez beta- i gamma-sekreta-
z´. Jednym z produktów koƒcowych
tych procesów jest nieszkodliwy pep-
tyd
β-amyloidu z∏o˝ony z 40 amino-
kwasów lub jego toksyczna wersja
z 42 aminokwasami.
Czàsteczki toksycznego
β-amyloidu
gromadzà si´ wokó∏ komórki. Przy-
czynà tego bywa niekiedy to, ˝e for-
ma
ε4 apolipoproteiny E (APOE) jest
wybiórczo usuwana z przestrzeni
mi´dzykomórkowej kosztem trans-
portu
β-amyloidu, którego nadmiar
wyrzàdza szkody.
Z
β-amyloidu tworzà si´ blaszki, któ-
re mogà zaburzaç gospodark´ wap-
niowà, co powoduje powstawanie
szkodliwych wolnych rodników, lub
wywo∏aç agregacj´ komórek od-
pornoÊciowych, takich jak mikroglej
– prowadzi to do odczynu zapal-
nego i nasilenia wczeÊniejszych
uszkodzeƒ.
Powstawanie blaszki amyloidowej
DENDRYTY
HIPOKAMP
NEURON
β
APP
α
γ
β
γ
β
γ
APOE
ε
4
β-
AMYLOID 42
40
p3
42
AKSON
MIKROGLEJ
Z¸OGI
β
-AMYLOIDU
BLASZKA
AMYLOIDOWA
USZKODZONE
DENDRYTY

trzymujà budynek, tak one przenika-
jàc komórk´, utrzymujà jej kszta∏t. Sà
równie˝ kana∏ami, którymi krà˝à w ko-
mórce jej sk∏adniki, takie jak mitochon-
dria, oraz substancje od˝ywcze i inne
czàsteczki.
Sploty bia∏ka tau nie sà jednak cha-
rakterystyczne wy∏àcznie dla choroby
Alzheimera. Pomimo ˝e u dotkni´tych
nià osób typowe jest du˝e zag´szczenie
zwyrodnieƒ neurofibrylarnych silnie
korelujàce ze stopniem ot´pienia, wielu
badaczy nie uwa˝a∏o, ˝e zaburzenia
spowodowane przez bia∏ko tau sà tak
istotne, jak wywo∏ane przez drugi ro-
dzaj depozytów bia∏kowych stwierdza-
nych w chorobie Alzheimera, czyli bla-
szek amyloidowych, zwanych tak˝e
blaszkami starczymi. (Niedawno bia∏-
ko tau wzbudzi∏o nieco wi´ksze zainte-
resowanie, ale o tym póêniej.)
Gromadzà si´ one w przestrzeniach
mi´dzykomórkowych, a towarzyszà im
zazwyczaj (b´dàce cz´Êcià uk∏adu odpor-
noÊciowego mózgu) komórki reakcji
zapalnej zwane mikroglejem, które pró-
bujà zapewne roz∏o˝yç i usunàç uszko-
dzone neurony, a byç mo˝e same blaszki.
Nie jest jasne, czy otoczone nimi lub znaj-
dujàce si´ obok nich komórki nerwowe
– cz´sto sprawiajàce wra˝enie nabrzmia-
∏ych i zdeformowanych – funkcjonujà
normalnie, poniewa˝ nasilenie ot´pienia
s∏abo wià˝e si´ z zag´szczeniem blaszek
amyloidowych. Wyst´pujà one wpraw-
dzie u wi´kszoÊci starszych osób, nie-
mniej ich obfitoÊç w hipokampie i korze
mózgowej jest zjawiskiem swoistym u pa-
cjentów z chorobà Alzheimera, a poja-
wiajà si´ one na d∏ugo przed powsta-
niem zwyrodnieƒ neurofibrylarnych.
Naukowcy, bioràc pod uwag´ du˝e
zag´szczenie i wczesne pojawianie si´
tych blaszek, od dawna byli przekona-
ni, ˝e poznanie procesu ich powstawa-
nia mo˝e dostarczyç wskazówek co do
przyczyn choroby. W 1984 roku George
G. Glenner z University of California
w San Diego odkry∏, ˝e g∏ównym sk∏ad-
nikiem blaszek jest peptyd sk∏adajàcy
si´ z 40 albo z 42 aminokwasów. Wkrót-
ce potem zsekwencjonowano gen ko-
dujàcy bia∏ko prekursora
β-amyloidu,
czyli
βAPP (β-Amyloid Precursor Prote-
in). Te biochemiczne odkrycia doskona-
le pasowa∏y do informacji dostarcza-
nych jednoczeÊnie przez genetyków.
Czynniki dziedziczne
Od czasu gdy w roku 1907 niemiecki
neurolog Alois Alzheimer zidentyfi-
kowa∏ chorob´ nazwanà póêniej jego
imieniem, epidemiolodzy starali si´
okreÊliç i zrozumieç sposób jej rozprze-
strzeniania. Próbowali na przyk∏ad
stwierdziç, czy jest przekazywana w ro-
dzinie, a zatem zdeterminowana gene-
tycznie, czy te˝ wyzwalajà jà jakieÊ czyn-
niki Êrodowiskowe. Z wyników badaƒ
prowadzonych w latach osiemdziesià-
tych wyciàgni´to wniosek, ˝e cz∏on-
kowie pewnych rodzin zapadajà na nià
cz´Êciej. Znaleziono takie, w których
choroba przekazywana jest z pokolenia
na pokolenie po∏owie potomstwa oboj-
ga p∏ci. Wskazywa∏o to, ˝e podatnoÊç
na chorob´ zwiàzana jest z dziedzicze-
niem wadliwego genu na chromosomie
autosomalnym (niep∏ciowym) oraz ˝e
zmutowany gen chorego rodzica jest
dominujàcy.
Epidemiolodzy natrafili równie˝ na
osoby z chorobà Alzheimera w rodzi-
nach nie obcià˝onych dziedzicznie, co
Êwiadczy, ˝e to schorzenie ma pod∏o˝e
nie tylko genetyczne. Czynniki wywo-
∏ujàce chorob´ sà wi´c najwyraêniej z∏o-
˝one i zró˝nicowane – dziedziczenie od-
grywa zapewne rol´ w znacznej cz´Êci
przypadków (szacunkowo od 1 do 40%).
Próby zidentyfikowania czynników
Êrodowiskowych, które mog∏yby dzia-
∏aç ∏àcznie lub niezale˝nie od czynni-
ków dziedzicznych, nie przynios∏y jed-
noznacznych rezultatów. Nieliczne
dotàd zidentyfikowane intrygujà, ale
wcià˝ nie wyjaÊniajà przyczyn choroby.
Wydaje si´, ˝e wi´ksze zagro˝enie jest
zwiàzane z niskim poziomem edukacji
we wczesnym dzieciƒstwie, powa˝nym
urazem g∏owy oraz – chocia˝ w sposób
mniej znaczàcy – kontaktem z alumi-
nium w wodzie pitnej.
Korelacje te nie oznaczajà jednak
zwiàzków przyczynowych i mo˝e si´
okazaç, ˝e powy˝sze czynniki wskazu-
jà w gruncie rzeczy na dzia∏anie innych
czynników lub bodêców. Na przyk∏ad
uraz g∏owy mo˝e po prostu spowodo-
waç zmniejszenie liczby neuronów,
wskutek czego objawy choroby Alz-
heimera pojawià si´ wczeÊniej.
Wykazanie istnienia pod∏o˝a gene-
tycznego da∏o jednak poczàtek inte-
resujàcym badaniom, poniewa˝ ka˝de
takie odkrycie ma znaczenie dla wszyst-
kich przypadków choroby. Zaburzenia
kliniczne, neuropatologiczne i bioche-
miczne sà przecie˝ takie same, niezale˝-
nie od tego, czy choroba jest uwarun-
kowana genetycznie, czy te˝ spora-
dyczna (jak nazywa si´ innà postaç tego
schorzenia).
Szybko ustalono, ˝e gen kodujàcy
βAPP znajduje si´ na chromosomie 21.
Mniej wi´cej w tym samym czasie oka-
za∏o si´, i˝ w niektórych rodzinach
Â
WIAT
N
AUKI
Luty 2001 59
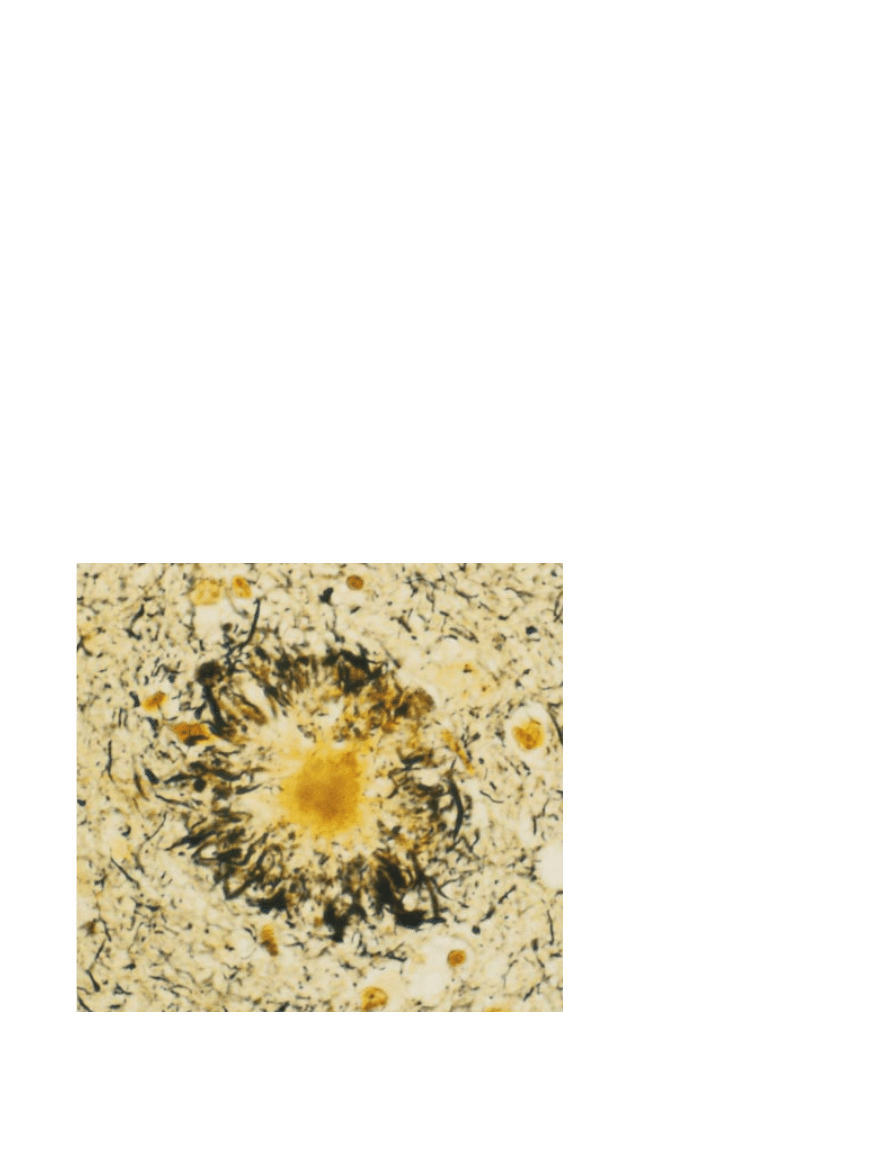
BLASZKI BETA-AMYLOIDOWE to jeden z najwczeÊniejszych objawów choroby Alz-
heimera, aczkolwiek ich zag´szczenie nie ma Êcis∏ego zwiàzku z nasileniem ot´pienia.
Na obrazie uzyskanym za pomocà mikroskopu optycznego, przedstawiajàcym kor´ mó-
zgowà osoby chorej, blaszki widaç jako ciemne plamy. Powstawanie szkodliwego
β-amy-
loidu wchodzàcego w sk∏ad tych blaszek rozpoczyna si´ od nieprawid∏owego przetwa-
rzania czàsteczki bia∏ka prekursora
β-amyloidu i prowadzi do uszkodzenia komórki
nerwowej
(ilustracja na sàsiedniej stronie), a w efekcie do choroby ot´piennej.
Zidentyfikowane czynniki ryzyka intrygujà,
ale wcià˝ nie wyjaÊniajà przyczyn choroby.
PETER H. ST GEORGE-HYSLOP

obcià˝onych chorobà Alzheimera chro-
mosom ten mo˝e byç uszkodzony.
Skàdinàd wiedziano, ˝e u osób z zespo-
∏em Downa (majàcych trzy zamiast
dwóch kopii chromosomu 21) prawie
zawsze wyst´pujà pewne objawy cho-
roby Alzheimera oko∏o 40 roku ˝ycia.
Fakty te Êwiadczy∏y, ˝e gen prekursora
β-amyloidu mo˝e byç miejscem muta-
cji odpowiedzialnej za niektóre przy-
padki choroby Alzheimera.
Przewidywania te potwierdzono na
poczàtku lat dziewi´çdziesiàtych, kie-
dy grupa badaczy – wÊród nich Blas
Frangione i Efrat Levy z New York Me-
dical Center, Alison M. Goate z Wa-
shington University School of Medi-
cine, Michael Mullan z University of
Southern Florida, Lydia Hendriks i Chri-
stine Van Broeckhoven z Uniwersytetu
w Antwerpii oraz Harry Karlinsky i moi
wspó∏pracownicy z University of To-
ronto – zidentyfikowa∏a tego typu mu-
tacje u osób dotkni´tych dziedzicznà
postacià choroby Alzheimera. (Ponie-
wa˝ geny zawierajà instrukcje o synte-
zie bia∏ek, mutacja w obr´bie genu mo-
˝e oznaczaç, ˝e kodowane przez niego
bia∏ko b´dzie nieprawid∏owo zbudowa-
ne, a zatem b´dzie wadliwie funkcjono-
waç w organizmie.) Podj´to wi´c wy-
si∏ki, aby ustaliç, w jaki sposób peptyd
β-amyloidu powstaje z bia∏ka βAPP.
Wprawdzie jego rola biologiczna
pozostaje niejasna, wiadomo jednak, ˝e
produkowane jest w wielu tkankach
i komórkach, a mo˝e sk∏adaç si´ z
695–770 aminokwasów. Bia∏ko to tkwi w
b∏onie komórkowej w taki sposób, ˝e je-
go krótki koniec znajduje si´ wewnàtrz
komórki, a d∏u˝szy w przestrzeni mi´-
dzykomórkowej. Peptyd
β-amyloidu
wycinany jest z fragmentu bia∏ka znaj-
dujàcego si´ w b∏onie. Stwierdzono, ˝e
βAPP jest rozcinany dwoma sposoba-
mi; w jednym z procesów nast´puje to
wskutek dzia∏ania enzymu zwanego al-
fa-sekretazà. (Badacze zajmujàcy si´ cho-
robà Alzheimera zazwyczaj okreÊlajà
ten enzym przymiotnikiem „domnie-
many”, poniewa˝ zak∏adamy, ˝e istnie-
je i mamy na to dowody, ale nie uda∏o
si´ jeszcze go wyizolowaç.) Kolejnego
ci´cia dokonuje inny domniemany en-
zym – gamma-sekretaza. W wyniku
tych ci´ç powstaje nieszkodliwy frag-
ment peptydowy zwany p3.
Niefortunne ci´cie
βAPP ulega rozk∏adowi tak˝e pod-
czas innego dwustopniowego procesu,
nie zawsze jednak nieszkodliwego. Naj-
pierw enzym zwany beta-sekretazà,
który wyizolowa∏ Martin Citron i jego
wspó∏pracownicy z Amgen, rozcina
bia∏ko. Jeden z powsta∏ych kawa∏ków,
zwany fragmentem C99-
βAPP (ponie-
wa˝ sk∏ada si´ z 99 aminokwasów), jest
nast´pnie ci´ty przez gamma-sekreta-
z´, co prowadzi do powstania peptydu
β-amyloidu.
W normalnych warunkach wi´kszoÊç
∏aƒcuchów
β-amyloidu liczy 40 amino-
kwasów. Natomiast poni˝ej 10% za-
wiera dwa dodatkowe aminokwasy. Pe-
ter T. Lansbury i Bruce Yankner z
Harvard University, a tak˝e Paul E. Fra-
ser i Joanne McLaurin z University of
Toronto oraz inni naukowcy wykazali,
˝e w∏aÊnie ta nieco d∏u˝sza forma jest
odpowiedzialna za powstawanie bla-
szek i dzia∏a toksycznie na komórki
nerwowe.
Prowadzone sà obecnie badania ma-
jàce wyjaÊniç, w jaki sposób wersja z 42
aminokwasami uszkadza neurony.
Ze wst´pnych prac wynika, ˝e docho-
dzi do tego w ró˝ny sposób. Peptyd
prawdopodobnie zaburza mechanizm
regulacji poziomu wapnia, co niekiedy
prowadzi do Êmierci komórki, oraz
uszkadza mitochondria, powodujàc
uwalnianie wolnych rodników tleno-
wych; te zaÊ uszkadzajà bia∏ka, lipidy
oraz DNA. Mo˝e tak˝e powodowaç –
o czym ju˝ wspominaliÊmy – uwalnia-
nie sk∏adników komórki na zewnàtrz.
To z kolei zwabia komórki odpornoÊcio-
we i powstaje reakcja zapalna, wskutek
której nasilajà si´ zapewne inne uszko-
dzenia spowodowane przez peptyd. Su-
gerowane mechanizmy wprawdzie in-
trygujà, ale ich znaczenie w rozwoju
ot´pienia pozostaje, przynajmniej na ra-
zie, przedmiotem sporów.
Genetycy wykryli tymczasem kilka
mutacji odpowiedzialnych za podsta-
wianie innych aminokwasów dok∏ad-
nie w tych miejscach ∏aƒcucha
βAPP,
w których dokonujà ci´ç alfa-, beta-
i gamma-sekretaza. W wyniku tych mu-
tacji dochodzi do zwi´kszenia iloÊci obu
form
β-amyloidu lub nasilenia produk-
cji jego d∏u˝szej, toksycznej wersji.
Koncepcja, ˝e podstawowe znaczenie
w powstawaniu choroby Alzheimera
majà zmiany w metabolizmie
βAPP, zy-
ska∏a dodatkowe wsparcie, gdy naukow-
cy odkryli mutacje w zespole genów
zaburzajàce proces rozcinania
βAPP.
W 1995 roku wraz z moimi wspó∏pra-
cownikami sklonowaliÊmy dwa geny
zwane presenilin 1 i presenilin 2 – zloka-
lizowane odpowiednio na chromosomie
14 i 1 – których mutacje sà odpowiedzial-
ne za bardzo agresywnà postaç choro-
by Alzheimera o wczesnym poczàtku.
(Obserwuje si´ jà u 10–60% pacjentów
60 Â
WIAT
N
AUKI
Luty 2001
SPLOTY BIA¸KA TAU pojawiajà si´ w póênych stadiach choroby, a ich zag´szczenie ma wyraêny zwiàzek z nasileniem ot´pienia. Wy-
glàdajà jak ciemne trójkàty
(zdj´cie spod mikroskopu optycznego z lewej) i jak po∏àczone parami spiralne w∏ókna (zdj´cie spod mikrosko-
pu elektronowego z prawej). Zaburzajà mikrotubularnà struktur´ neuronu, spychajàc mikrotubule na jednà stron´ komórki, co utrudnia
zarówno transport substancji od˝ywczych, jak i przekazywanie sygna∏ów nerwowych
(ilustracja na sàsiedniej stronie).
CATHERINE BERGERON
University of Toronto
I
ROBERT D. TERRY
University of California w
San Diego
z rodzinnà formà tego schorzenia.) Oba
geny kodujà bia∏ka preseniliny, które kil-
kakrotnie przewijajà si´ przez b∏on´ ko-
mórkowà jak szew w materiale. Bia∏ka
owe przechodzà skomplikowany proces
dojrzewania, podczas którego rozcina-
ne sà na dwa kawa∏ki, a nast´pnie w∏à-
czane w kompleks bia∏kowy rozcinajà-
cy inne bia∏ka b∏onowe, takie jak
βAPP
czy bia∏ko notch, uczestniczàce w roz-
woju embrionalnym.
W niew∏aÊciwym miejscu
Z kilku badaƒ, które przeprowadzili
Bart De Strooper z Flandryjskiego Mi´-
dzyuniwersyteckiego Instytutu Bio-
technologii w Leuven w Belgii, Christian
Haass z Ludwig-Maximillians Univer-
sität w Monachium, Gopal Thinakaran
z University of Chicago oraz mój zespó∏
z Toronto, wynika, ˝e pewne zmiany
wywo∏ane w presenilinach zaburzajà ak-
tywnoÊç tych kompleksów, a co za tym
idzie sposób przekszta∏cania przez nie
bia∏ek. Wiemy, ˝e dzia∏ajà one m.in.
na
βAPP, poniewa˝ u myszy nie wy-
twarzajàcej wskutek sztucznie wywo-
∏anej mutacji preseniliny 1 nie powsta-
je
β-amyloid, gdy˝ gamma-sekretaza nie
dokonuje ostatniego ci´cia. Kilka innych
bia∏ek b∏onowych, ∏àcznie z bia∏kiem
notch, równie˝ nie ulega prawid∏owe-
mu rozk∏adowi.
Mutacje genów presenilin 1 i preseni-
lin 2 zachodzàce u osób z rodzinnà for-
mà choroby Alzheimera majà jednak od-
wrotny skutek. Zwi´kszajà liczb´ ci´ç
dokonywanych przez gamma-sekreta-
z´ i w rezultacie powodujà nadproduk-
cj´
β-amyloidu, zw∏aszcza jego d∏u˝szej,
toksycznej wersji. Za wczeÊnie jeszcze
na wnioski, ale niewykluczone, ˝e pre-
seniliny i gamma-sekretaza to jedno i to
samo. A mo˝e jednak preseniliny sà po-
Êrednio powiàzane z gamma-sekretazà,
na przyk∏ad aktywujà jà lub poÊredni-
czà w jej dzia∏aniu, umo˝liwiajàc kon-
takt tego enzymu z
βAPP?
Wprawdzie mutacje genów kodujà-
cych preseniliny i
βAPP majà zgubne
skutki, ale sà przyczynà jedynie 50%
przypadków rodzinnej formy choroby
Alzheimera o wczesnym poczàtku, a
wi´c zaledwie 5% wszystkich zachoro-
waƒ. Okazuje si´, ˝e z wi´kszoÊcià
zwiàzany jest inny gen.
Badania przeprowadzone w roku
1993 przez Allena D. Rosesa (obecnie za-
trudnionego w Glaxo Wellcome) oraz
jego wspó∏pracowników, Margaret Peri-
cak-Vance z Duke University i Jonatha-
na Hainesa z Vanderbilt University,
wskazywa∏y na obecnoÊç na chromoso-
mie 19 genu zwiàzanego z typowà po-
stacià choroby Alzheimera, pojawiajàcà
Mikrotubule stanowià
szkielet komórki, a jed-
noczeÊnie szlaki trans-
portu innych jej sk∏ad-
ników i substancji od-
˝ywczych. Zbudowane
sà z tubuliny – bia∏ka,
z którym wià˝e si´ bia∏-
ko tau.
W chorobie Alzheimera iloÊç
i rodzaj produkowanego bia∏-
ka tau ulegajà zmianom lub
zmienia si´ charakter wiàza-
nia tego bia∏ka z tubulinà.
W rezultacie dochodzi do na-
gromadzenia splotów tau,
które rozpychajà mikrotubule,
zmieniajàc ich kszta∏t i zabu-
rzajàc funkcjonowanie. Mo-
gà tak˝e zablokowaç neuron.
JOHN W. KARAPELOU
Uszkodzenie
mikrotubul
DENDRYTY
SUBSTANCJE
OD˚YWCZE
JÑDRO
NEURON
MIKROTUBULE
AKSON
SPLOTY BIA¸KA TAU
USZKODZONE
MIKROTUBULE
si´ w póêniejszym okresie ˝ycia. Roses,
wówczas pracujàcy w Duke Universi-
ty, i Warren J. Stritmatter, równie˝ z tej
uczelni, wyizolowali apolipoprotein´ E
(APOE), która transportuje cholesterol
we krwi i uczestniczy w naprawie i re-
generacji komórek. Gen kodujàcy APOE
spotykany jest w trzech formach, czyli
allelach, których cz´stoÊç wyst´powa-
nia waha si´ nieco w ró˝nych popula-
cjach: wariant
ε3 – uwa˝any za normal-
ny – pojawia si´ u 40–90% ludzi;
ε2 i ε4
sà mniej powszechne i wykryto je od-
powiednio u 2 oraz 6–37% ogó∏u osób.
Roses i jego wspó∏pracownicy stwier-
dzili jednak, ˝e wÊród pacjentów z cho-
robà Alzheimera cz´stoÊç wyst´powa-
nia wariantu
ε4 jest doÊç du˝a i wynosi
oko∏o 40%.
Posiadanie allelu
ε4 mo˝e w ró˝ny
sposób zwi´kszaç zagro˝enie choro-
bà Alzheimera. Wed∏ug jednej z hipo-
tez bia∏ko formy
ε4 rywalizuje z pepty-
dem
β-amyloidu, jeÊli chodzi o usuni´-
cie z przestrzeni mi´dzykomórkowej.
Stwierdzono, ˝e jedna z czàsteczek od-
powiedzialnych za to znacznie lepiej ra-
dzi sobie z bia∏kiem
ε4 ni˝ z β-amylo-
idem. W rezultacie dochodzi do nagro-
madzenia tego peptydu, co mo˝e spo-
wodowaç zaburzenia biochemiczne.
Scenariusz ten znajduje poparcie w fak-
tach. Pacjenci z wariantem
ε4 APOE ma-
jà bowiem wi´ksze z∏ogi
β-amyloidu ni˝
chorzy z wariantami
ε2 i ε3. Ponadto
choroba rozwija si´ znacznie wczeÊniej
u osób z mutacjami zarówno w obr´bie
genu kodujàcego
βAPP, jak i APOE ni˝
u tych, u których wyst´puje tylko muta-
cja pierwszego z nich, zaÊ sà obecne al-
lele
ε2 lub ε3 genu odpowiedzialnego
za kodowanie APOE.
Zgromadzone w latach dziewi´çdzie-
siàtych dane wskazujà, ˝e jednym
z czynników wyzwalajàcych chorob´
Alzheimera jest zaburzenie procesów
przetwarzania
βAPP i peptydu β-amy-
loidu. Wcià˝ jednak brakuje kilku wa˝-
nych informacji. K∏opoty z rozcinaniem
βAPP i akumulacjà β-amyloidu zaczy-
najà si´ we wczesnych stadiach choroby.
Co jednak dzieje si´ póêniej? Dlaczego
zag´szczenie blaszek
β-amyloidowych
nie jest skorelowane z nasileniem zmian
chorobowych? Problem polega wi´c
w istocie na tym, czy z∏ogi
β-amyloidu
rzeczywiÊcie wywo∏ujà ot´pienie. To za-
sadnicze i wcià˝ pozostajàce bez odpo-
wiedzi pytanie od lat nurtuje specjali-
stów. Moim zdaniem, nieprawid∏owe
postacie
βAPP i β-amyloidu inicjujà sze-
reg szkodliwych zdarzeƒ, których efek-
tem jest uszkodzenie i Êmierç neuronów,
a w nast´pstwie zmiany ot´pienne. Jed-
nym z nich mo˝e byç pojawienie si´
zwyrodnieƒ neurofibrylarnych.
Powrót do tau
Do niedawna sàdzono, ˝e nienormal-
nie skr´cone pary w∏ókien bia∏ka tau to
nieszkodliwe zjawisko wtórne. Po ana-
lizie choroby zwanej ot´pieniem czo∏o-
wo-skroniowym podano jednak to prze-
konanie w wàtpliwoÊç. Jest to rzadkie
schorzenie, w którym u pewnej liczby
pacjentów stwierdza si´ z∏ogi bia∏ka tau.
Podobnie jak w chorobie Alzheimera
niektóre przypadki majà charakter ro-
dzinny. Badania, przeprowadzone m.in.
przez Kirka C. Wilhelmsena z Universi-
ty of California w San Francisco, wska-
zujà, ˝e rodzinna postaç tej choroby ma
pod∏o˝e genetyczne.
Jeden z odpowiedzialnych za to ge-
nów znajduje si´ na chromosomie 17, na
którym zlokalizowany jest równie˝ gen
kodujàcy bia∏ko tau. Badajàc przypadki
ot´pienia czo∏owo-skroniowego, którym
towarzyszy∏o nagromadzenie tego bia∏-
ka, Gerard D. Schellenberg z University
of Washington zidentyfikowa∏ mutacj´
kodujàcego je genu. To dokonane w 1998
roku wa˝ne odkrycie wskazywa∏o na
mo˝liwoÊç wyst´powania zmian ot´pien-
nych wskutek zaburzeƒ przetwarzania
i gromadzenia bia∏ka tau.
Zwyrodnienia neurofibrylarne stano-
wià zapewne integralnà cz´Êç równie˝
choroby Alzheimera. Pozwoli∏oby to le-
piej zrozumieç fakt, na który 10 lat te-
mu zwracali uwag´ Robert D. Terry
i Robert Katzman z UCSD – zag´szcze-
nie zwyrodnieƒ neurofibrylarnych jest
w chorobie Alzheimera ÊciÊle skorelo-
wane ze stopniem ot´pienia. Nie wie-
my jeszcze, w jaki sposób mutacja genu
kodujàcego bia∏ko tau wywo∏uje ot´-
pienie czo∏owo-skroniowe, ale wyniki
badaƒ wskazujà na wspomnianà ju˝
62 Â
WIAT
N
AUKI
Luty 2001
Niezale˝nie, jak w przysz∏oÊci b´dzie
leczona choroba Alzheimera, cieszy fakt,
˝e powsta∏o tyle nowych mo˝liwoÊci.
BLASZKI AMYLOIDOWE I ZWYRODNIENIA NEUROFIBRYLARNE wyst´pujàce w póê-
niejszych stadiach choroby Alzheimera. Sk∏adajàcy si´ z
β-amyloidu rdzeƒ blaszki (poma-
raƒczowy) otoczony jest aureolà zakoƒczeƒ nerwowych zawierajàcych czarne w∏ókna bia∏ka
tau. Komórki reakcji zapalnej mózgu – mikroglej i astrocyty – sà widoczne jako ma∏e, brà-
zowe struktury kàtowe mi´dzy zakoƒczeniami nerwów.
PETER H. ST GEORGE-HYSLOP
uprzednio mo˝liwoÊç, a mianowicie po-
wa˝ne uszkodzenie mikrotubul. Mo˝e
wówczas ulec zaburzeniom wiàzanie
bia∏ek tau do stanowiàcej ich szkielet tu-
buliny lub zostaç zak∏ócona równowa-
ga mi´dzy ró˝nymi typami tych bia∏ek.
Skutkiem obu tych nieprawid∏owo-
Êci by∏oby wi´c nagromadzanie si´ nad-
miernych iloÊci wolnego bia∏ka tau
w postaci po∏àczonych parami i skr´co-
nych wokó∏ siebie spiralnie w∏ókien.
Struktury mikrotubularne nie funkcjo-
nowa∏yby wówczas prawid∏owo, a z∏o-
gi tau uniemo˝liwia∏y transport komór-
kowy. W rezultacie neurony nie by∏yby
w stanie przekazywaç sygna∏ów elek-
trycznych ani transportowaç substancji
od˝ywczych i innych wa˝nych sk∏ad-
ników w obr´bie komórki. Wydaje si´,
˝e nieprawid∏owy metabolizm
βAPP i
β-amyloidu uruchamia kaskad´ zda-
rzeƒ, z których cz´Êç prowadzi do
zmian w bia∏ku tau, co z kolei powodu-
je dalsze uszkodzenie neuronów pro-
wadzàce do ot´pienia.
Odkrycia dokonane w ciàgu ostatnich
10 lat w biochemii, genetyce molekular-
nej, epidemiologii, a tak˝e badaniach
klinicznych znacznie poszerzy∏y naszà
wiedz´ o mechanizmach powstawania
choroby Alzheimera. Zwi´ksza to szan-
s´ na opracowanie w najbli˝szym czasie
skutecznych metod leczenia. W niektó-
rych zapewne skorzysta si´ z niedaw-
nych odkryç, dotyczàcych bia∏ka tau,
a dane o
βAPP i β-amyloidzie wp∏ynà
na intensyfikacj´ badaƒ nad nowymi
sposobami walki z chorobà.
Nowe metody leczenia
Naukowcy próbujà na przyk∏ad
otrzymaç zwiàzki, które b´dà blokowaç
zdolnoÊç beta- lub gamma-sekretazy do
ci´cia czàsteczki
βAPP, co zapobiegnie
powstawaniu
β-amyloidu. Inni poszu-
kujà metod ∏agodzenia spowodowanych
przez niego szkód. Prowadzone sà obec-
nie badania kliniczne w celu spraw-
dzenia, czy przeciwutleniacze, takie jak
witamina E lub niesteroidowe leki prze-
ciwzapalne, na przyk∏ad ibuprofen, mo-
gà os∏abiç niektóre toksyczne skutki
dzia∏ania
β-amyloidu.
Wielu badaczy pracuje równie˝ nad
sposobami zmniejszania akumulacji te-
go peptydu za pomocà zwiàzków naÊla-
dujàcych barwniki typu czerwieƒ kon-
go, które wbudowujà si´ w blaszki amy-
loidowe lub w czàsteczki zwane gliko-
aminoglikanami – uczestniczàce praw-
dopodobnie w procesie powstawania
z∏ogów
β-amyloidu. Zwiàzki takie roz-
bijajà agregacje tego peptydu od Êrodka.
Idàc tym tropem, Dale Schenk i jego
wspó∏pracownicy z Elan Pharmaceuti-
cals w San Francisco opracowali nie-
dawno na bazie
β-amyloidu szczepion-
k´. Stwierdzili, ˝e u myszy z odmianà
choroby Alzheimera charakteryzujàcà
si´ obecnoÊcià z∏ogów szkodliwego pep-
tydu i brakiem w∏ókienek tau szczepion-
ka
β-amyloidowa zmniejsza liczb´ po-
wstajàcych blaszek. Czy b´dzie ona
skuteczna równie˝ w przypadku ludzi,
wyka˝à próby kliniczne.
Niezale˝nie, jak b´dzie si´ leczyç
w przysz∏oÊci chorob´ Alzheimera, cie-
szy fakt, ˝e pojawi∏o si´ w tej dziedzinie
tyle nowych mo˝liwoÊci. Informacje
o ró˝nych stadiach choroby oraz wielu
czynnikach biochemicznych odgrywajà-
cych w nich istotnà rol´ pozwoli∏y na-
ukowcom lepiej poznaç mechanizmy jej
powstawania i rozwoju.
T∏umaczy∏
Andrzej Bidziƒski
Â
WIAT
N
AUKI
Luty 2001 63
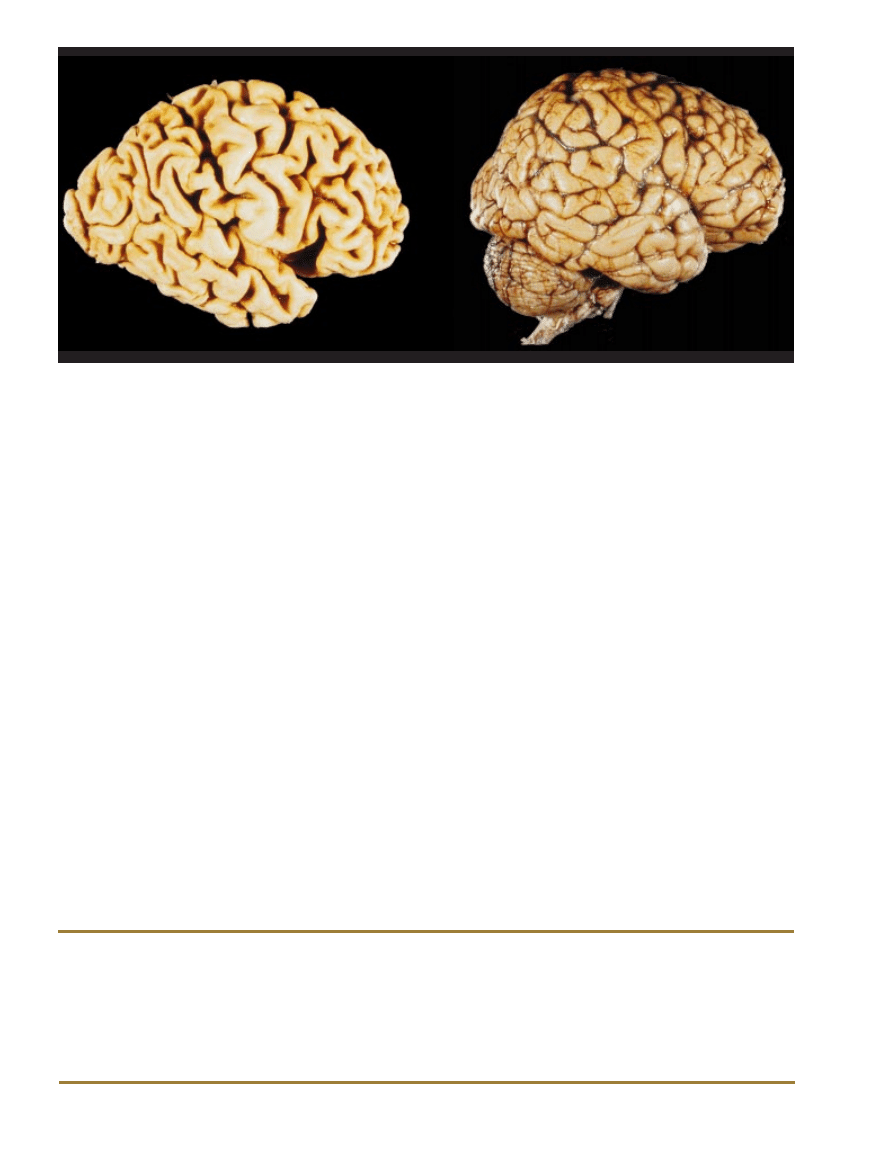
ZANIK MÓZGU stanowi jednoznaczny dowód szkód, jakie wyrzàdza choroba Alzheimera. W niektórych regionach tego narzàdu docho-
dzi do utraty neuronów, wskutek czego pofa∏dowana powierzchnia mózgowa ulega wyg∏adzeniu. Rozmiar zniszczeƒ widaç wyraênie, gdy
porównamy mózg pacjenta z chorobà Alzheimera
(z lewej) z mózgiem osoby zdrowej w tym samym wieku (z prawej).
PETER H. ST GEORGE-HYSLOP
Informacje o autorze
PETER H. ST GEORGE-HYSLOP jest neurologiem i genetykiem molekularnym.
Po uzyskaniu stopnia doktora nauk medycznych w University of Ottawa kontynu-
owa∏ studia podyplomowe z medycyny wewn´trznej i neurologii w University of
Toronto, a studia podoktoranckie z genetyki molekularnej w Harvard Medical
School. Obecnie jest dyrektorem Center for Research in Neurodegenerative Diseases
w University of Toronto oraz Memory Disorders Clinic w Toronto Western Hospital.
Interesuje si´ zarówno badaniami podstawowymi nad molekularnymi mechanizma-
mi choroby Alzheimera, jak te˝ przek∏adaniem wyników tych badaƒ na skuteczne
metody jej leczenia.
Literatura uzupe∏niajàca
NEUROPATHOLOGY OF DEMENTING DISORDERS.
Red. W.
R. Markesbury; Arnold, 1998.
ALZHEIMER DISEASE.
Red. R. D. Terry, R. Katzman, K.
L. Bick i S. S. Sisodia. Wyd. II. Lippincott; Williams
& Wilkins, 1999.
NICASTRIN MODULATES PRESENILIN-MEDIATED Notch/glp-1
SIGNAL TRANSDUCTION AND
βAPP PROCESSING.
Peter St
George-Hyslop, Gang Yu i in.; Nature, tom 407, s.
48-54, 7 IX 2000.
Wyszukiwarka
Podobne podstrony:
zespoly otepienne
Ukladanie dawki bytowej psy
Pielęgnowanie chorego z otępieniem
ukladanie zdan kl I III
12a Równowaga ciecz para w układach dwuskładnikowych (a)id 14224 ppt
6Straty napięcia i mocy w układach WN2
Szumy w układach fizycznych
Metody układania algorytmów rekurencja, metoda dziel i zwyciężaj, programowanie dynamiczne, metoda
3 14 ukladanie i rozwiazywanie Nieznany
Linie wplywowe w ukladach statycznie wyznaczalnych belka3
test 1 - 2010, Elektrotechnika-materiały do szkoły, Zakłócenia w układach elektroenergetycznych
Pomiar natężenia przepływu cieczy roboczej w układach hydrauliki siłowej - sprawko, Uczelnia, Hydrau
Pomiar mocy czynnej w układach trójfazowych
otępienie
Jak układać ocieplenie w ścianie trójwarstwowej
więcej podobnych podstron