
1
Warto ciowo
Warto ciowo
jest miar
zdolno ci pierwiastka do tworzenia
wi za
chemicznych. Poj cie warto ciowo ci kszta towa o si
w
latach 1850 – 1870. Najwi ksze zas ugi na tym polu ma Kekulé,
który w 1857 roku stwierdzi czterowarto ciowo
atomu w gla a w
1866 roku zaproponowa
pier cieniow
struktur
benzenu.
Kreseczkami zacz li oznacza wi zania chemiczne Couper (1858)
i Brown (1864).
Friedrich August Kekulé von Stradonitz

2
Termin warto ciowo
kojarzy si z nast puj cymi poj ciami:
1. Warto ciowo
formalna (stechiometryczna).
2. Stopie utlenienia.
3.
adunek formalny.
4. Liczba koordynacyjna.
Warto ciowo
formalna (stechiometryczna)
Klasyczna definicja: liczba atomów H, z którymi reaguje atom danego
pierwiastka. Dla pierwiastka, który nie reaguje z wodorem, warto ciowo
ustala si
na podstawie jego reakcji z tlenem. Definicja ta nadal jest
stosowana w chemii organicznej, gdzie C jest czterowarto ciowy, H
jednowarto ciowy, O dwuwarto ciowy, N trój- i pi ciowarto ciowy i P
pi ciowarto ciowy. To wystarcza do budowania prawid owych wzorów
strukturalnych w chemii organicznej pod warunkiem, e uwzgl dnia si
sprawy stereochemii.
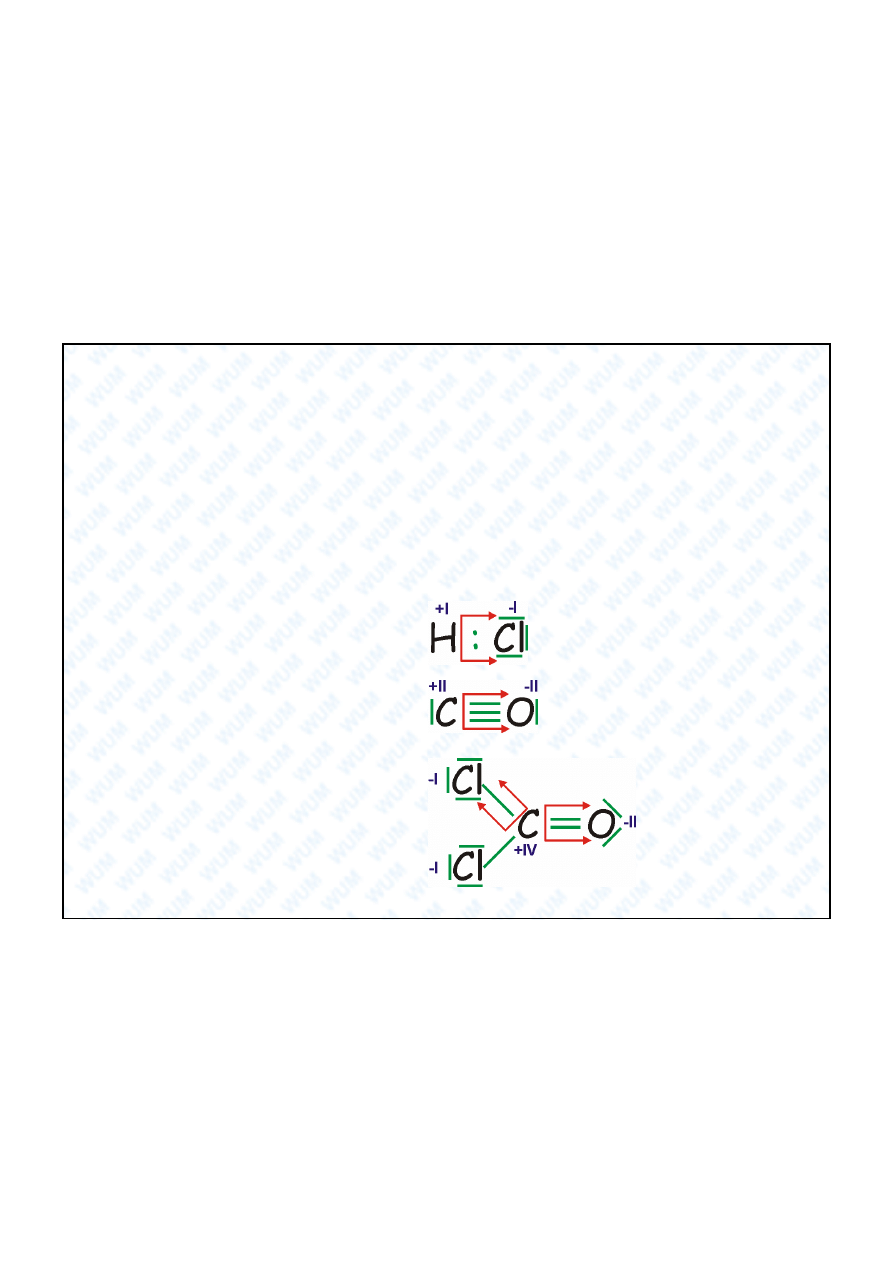
3
Poj cie stopnnia utlenienia jest bardzo wa ne w chemii nieorganicznej.
Okre laj c stopie
utlenienia
elektrony wi za
przypisujemy
formalnie bardziej elektroujemnym atomom a nast pnie obliczamy
nadmiarowe adunki atomowe w takiej hipotetycznej strukturze:
Stopie utlenienia
chlorowodór
tlenek w gla
fosgen
4
1. Wszystkie wi
ce elektrony przydziela si atomom po po owie.
2. Wszystkie niewi
ce elektrony przydziela si w ca
ci atomom, przy
których si znajduj .
3. adunek formalny atomu stanowi ró nic pomi dzy liczb elektronów
walencyjnych w izolowanym atomie a liczb elektronów przypisanych temu
atomowi w cz steczce na podstawie powy szych regu 1 i 2.
tlenek w gla
Uwaga ! Nie myli
adunków formalnych z adunkami cz stkowymi
s
cymi do
oznaczania polarno ci wi za kowalencyjnych spolaryzowanych.
Zgadza si z polarno ci
okre lon metodami
spektroskopowymi !
adunek formalny
Struktury o najmniejszych adunkach formalnych maj zwykle najmniejsz
energi , tzn. s najbardziej prawdopodobne !

5
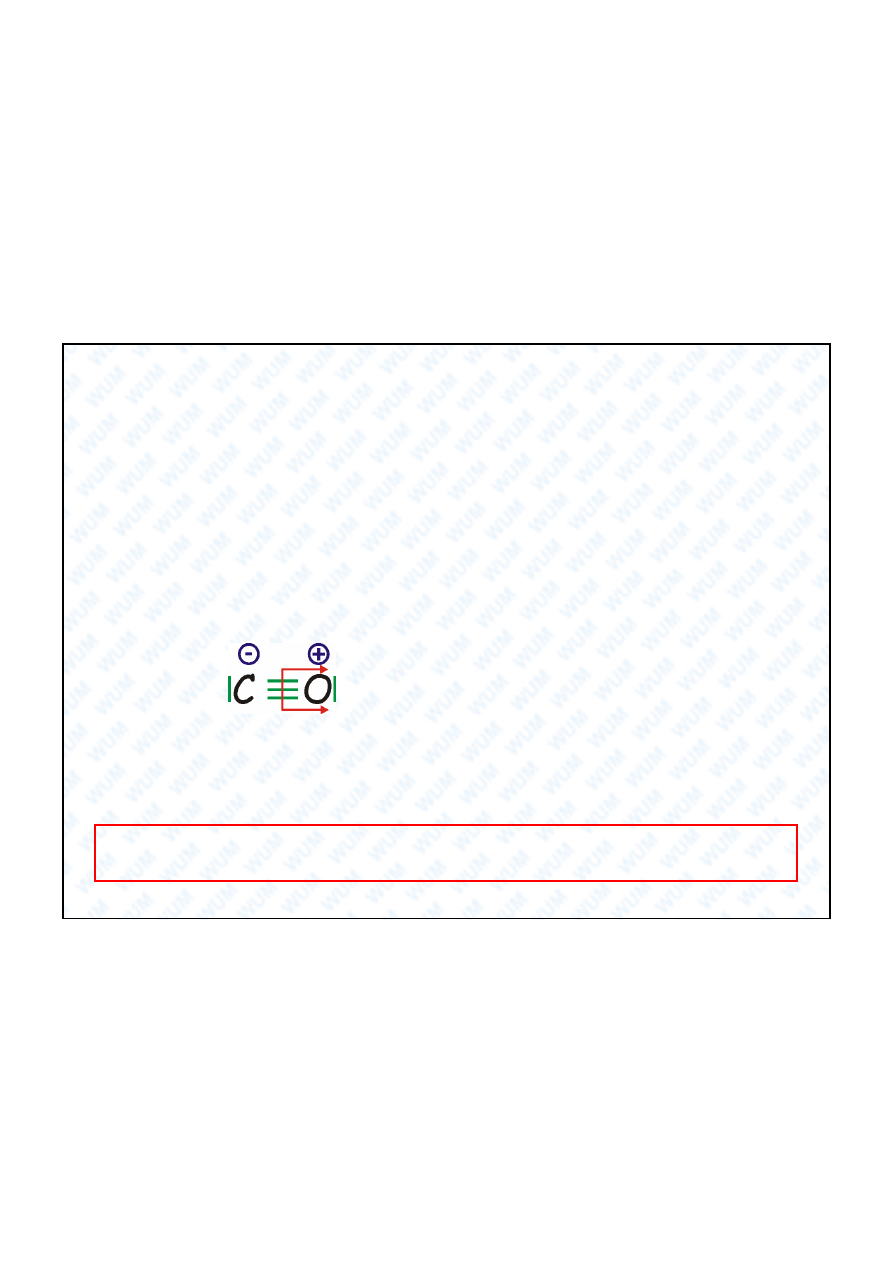
Jeszcze o tlenku w gla…
1. Wzór Lewisa nie zgadza si
z warto ciowo ci
formaln
! Jest 10
elektronów, czyli 5 par elektronowych. Mo liwy jest tylko wzór
| O|
.
Struktura elektronowa z podwójnym wi zaniem
C=O
nie jest
prawid owa (nadmiar 2 elektronów).
2. Prawid owy jest wzór Lewisa a nie wzór napisany na podstawie
warto ciowo ci formalnych. Wskazuj
na to ekperymentalnie
wyznaczone parametry fizykochemiczne cz steczki, np. d ugo
wi zania:
C-O
1,50 Å
C=O
1,29 Å
O
w tlenku w gla 1,15 Å !
3. Na gruncie teorii MO struktura elektronowa CO przypomina acetylen:
| O|
HC CH

6
Liczba koordynacyjna (
LK
) równa jest liczbie wi za koordynacyjnych utworzonych
przez dany atom.
Najpopularniejsze liczby koordynacyjne:
8
(struktura dodekaedru),
6
(struktura oktaedryczna),
4
(struktura tetraedryczna).
Przyk ady ró nych LK:
8
struktura dodekaedru, czyli dwunasto cianu foremnego
Mo(CN)
8
4-
6
struktura oktaedryczna
Ni(NH
3
)
6
2+
4
struktura tetraedryczna
SiO
4
4-
struktura p askokwadratowa
Cu(NH
3
)
4
2+
2
struktura liniowa
Ag(CN)
2
-
Liczba koordynacyjna
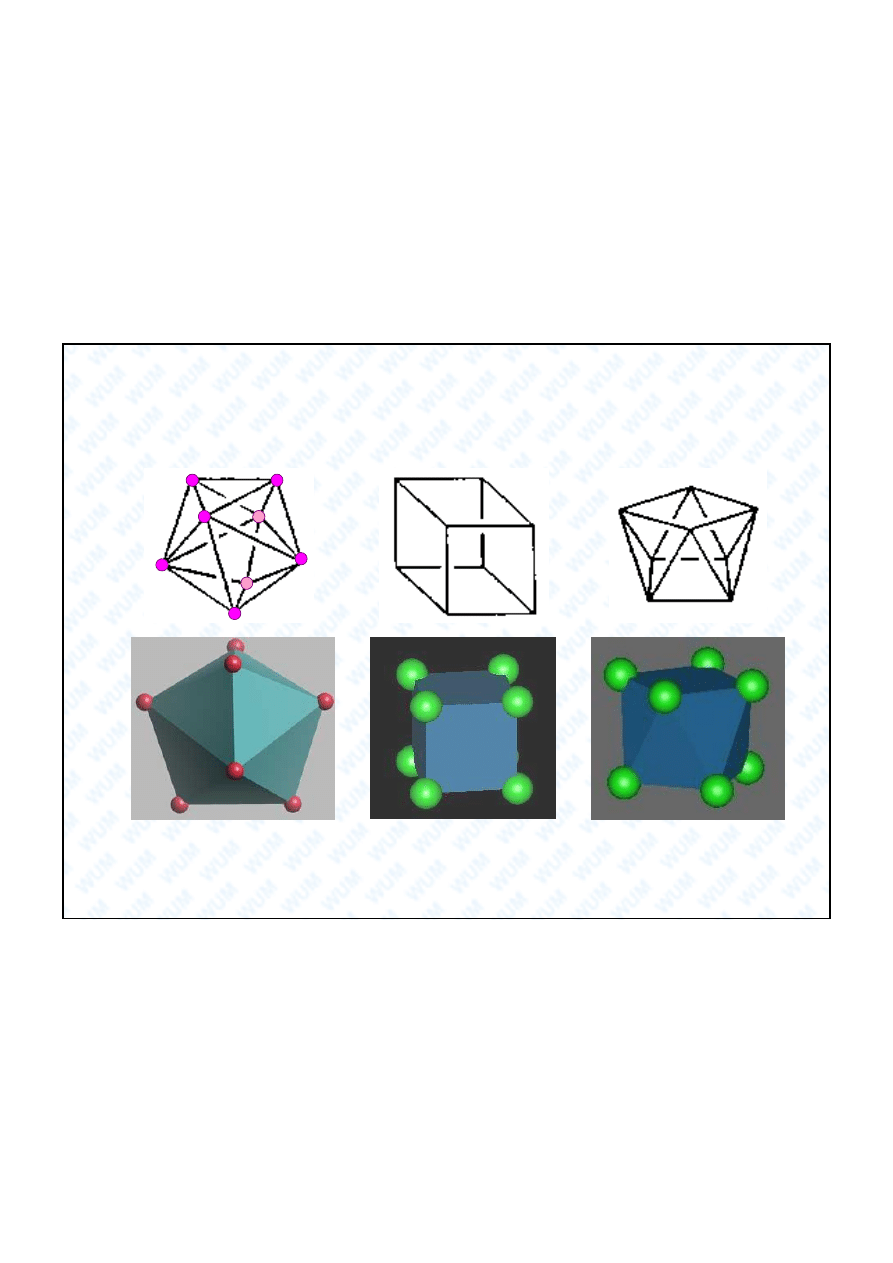
7
Wielo ciany koordynacyjne dla LK = 8
Dodekaedr
Sze cian
Antypryzma kwadratowa
Uwaga ! Istnieje wiele typów dodekaedrów.
8
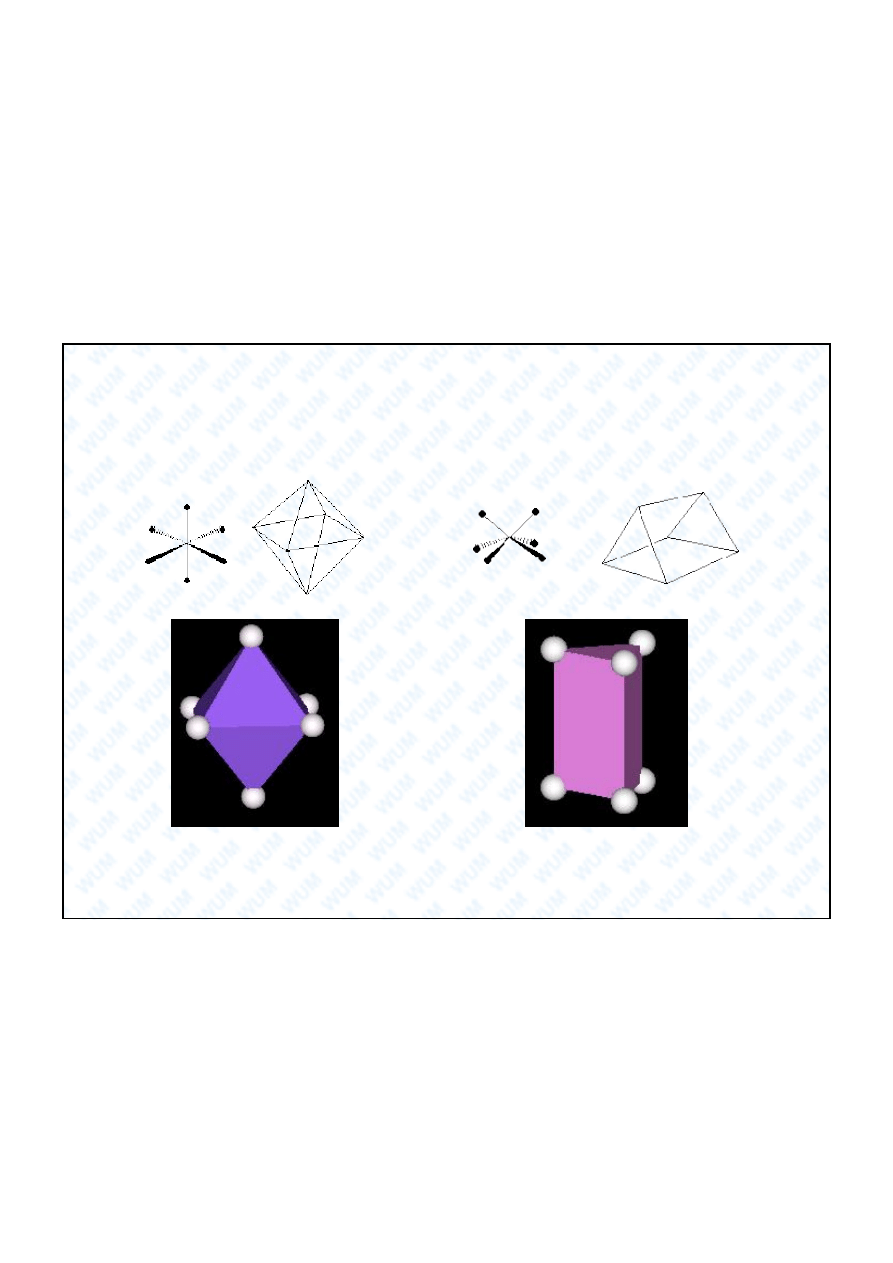
Wielo ciany koordynacyjne dla LK = 6
mio cian foremny
Pryzmat trygonalny

9
Regu a oktetu (Abegg 1904)
Gazy szlachetne charakteryzuj
si
wysokimi potencja ami jonizacji, zerowymi
powinowactwami elektronowymi oraz bierno ci
chemiczn . Maj
wi c bardzo
stabilny uk ad elektronowy pow oki walencyjnej - oktet elektronowy (wyj tek
stanowi He z dubletem walencyjnym). Atomy innych pierwiastków (poza
wodorem) d
do uzyskania oktetu walencyjnego drog
reakcji chemicznych.
Wodór d
y do uzyskania dubletu helowego. Podsumowuj c:
Ka dy pierwiastek tworz c zwi zek chemiczny przyjmuje konfiguracj
elektronow najbli szego gazu szlachetnego.
Fizykochemik niemiecki Richard Abegg (1869-1910) urodzi si w Gda sku
Od 1899 r. profesor uniwersytetu we Wroc awiu. Zgin
w katastrofie balonu.

10
Symbolika kropkowa Lewisa (1902)
Gilbert Newton Lewis w swoim
laboratorium w MIT (Berkeley)
Lewis rozwin
teori oktetu Abegga i zastosowa
do wyja nienia natury wi za
kowalencyjnych.
11
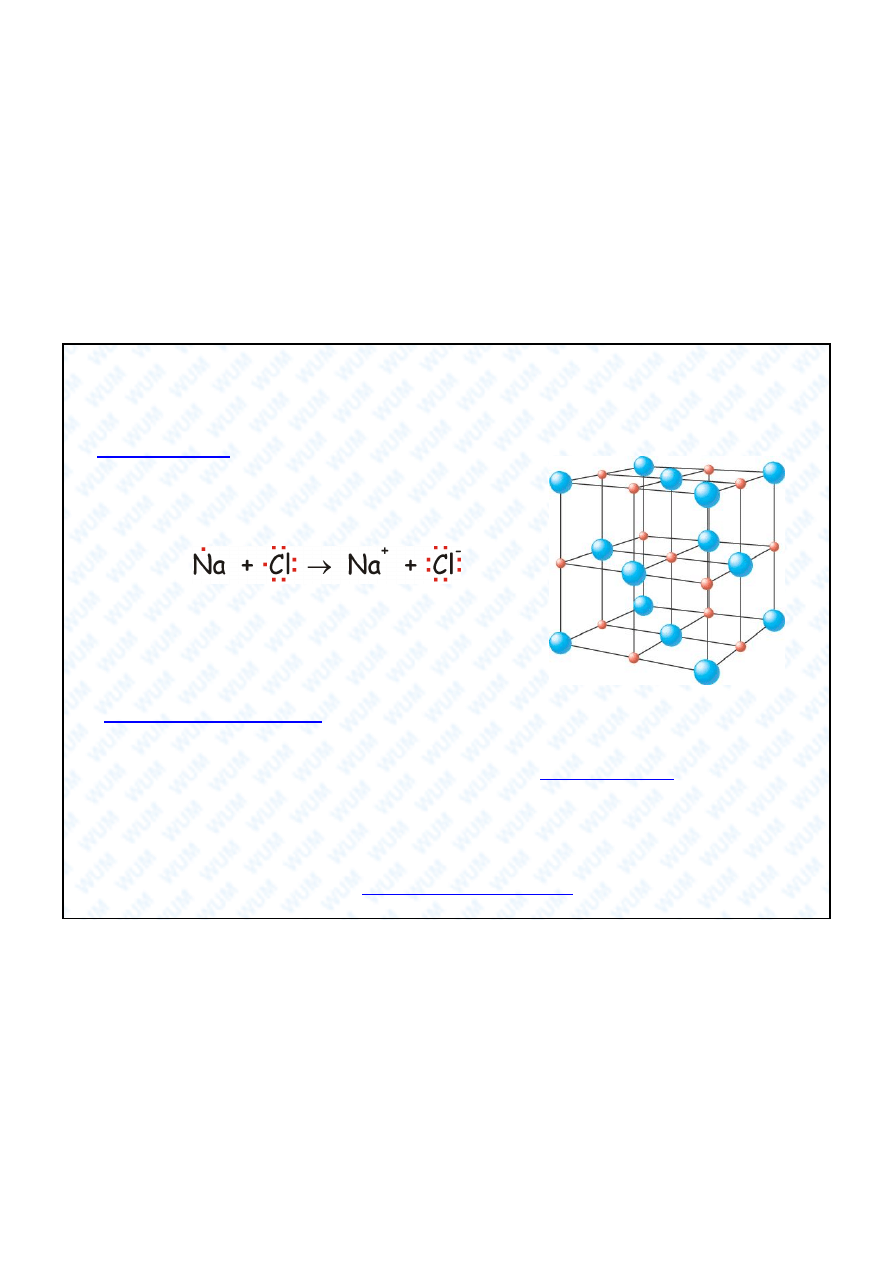
Wi zanie jonowe i jonowa sie krystaliczna
Teoria Kossela (1917): przekazanie elektronu
przez atom elektrododatni atomowi
elektroujemnemu, utworzenie kationu i anionu,
przci ganie elektrostatyczne.
Przyk ad:
(w ten sposób Na uzyskuje oktet 2s
2
2p
6
z
przedostatniej pow oki a Cl uzupe nia ostatni
pow ok do o miu elektronów)
Na
+
Cl
-
Jonowa sie
krystaliczna - minimalizacja si odpychania elektrostatycznego
jonów o tym samych znakach adunku i maksymalizacja si przyci gania
elektrostatycznego jonów o znakach przeciwnych. Kryszta jonowy jest jedn
wielk moleku
zawieraj
w w
ach sieci optymalnie upakowane jony, na
przemian dodatnie i ujemne. To optymalne upakowanie jonów prowadzi do
stabilizacji energetycznej kryszta u, energia wydzielaj ca si
przy jego
tworzeniu z jonów nosi nazw energii sieci krystalicznej.

12
Energi sieci krystalicznej mo na oceni na podstawie prawa Coulomba:
d
Q
Q
k
E
2
1
E ro nie, gdy rosn
adunki Q1 i Q2 a odleg
d mi dzy nimi maleje. Wobec tego
E ro nie, gdy malej promienie jonowe, czyli gdy jony znajduj si bli ej siebie.
Efekt energetyczny reakcji, w której powstaje kryszta jonowy z atomów, to suma
energii jonizacji, powinowactwa elektronowego i energii sieci krystalicznej.
Kryszta y jonowe maj wysokie temperatury topnienia i po stopieniu przewodz
pr d elektryczny.
Jonowe po czenia metali przej ciowych nie mo na wyt umaczy regu
oktetu.
Np. Ag o konfiguracji elektronowej 4d
10
5s
1
tworzy jon Ag+ przez oddanie
elektronu 1s i w ten sposób ostatni pow ok staje si pow oka czwarta, która
jest ca kowicie zape niona 18 elektronami. Budow krystalicznych kompleksów
metali przej ciowych opisuje teoria pola krystalicznego.
Energia jonowej sieci krystalicznej
13
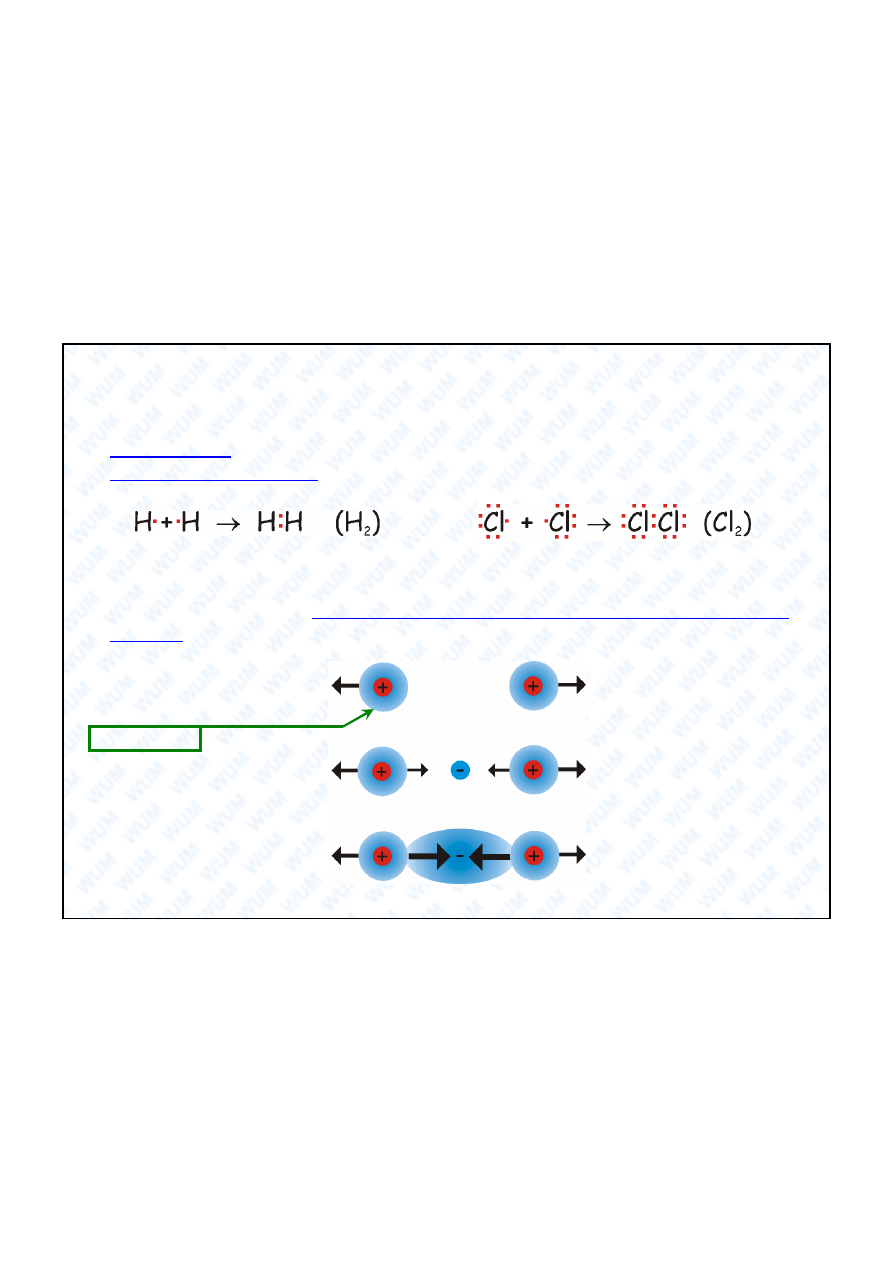
Wi zanie kowalencyjne
Teoria Lewisa (1916) zak ada, e wi zanie kowalencyjne tworzy si
w wyniku
uwspólnienia elektronów, np.:
W wyniku uwspólnienia elektronów oba reaguj ce atomy zapewniaj
sobie
oktet elektronowy (wodór
dublet helowy) na ostatniej pow oce. Uwspólnieniu
elektronów towarzyszy koncentracja ujemnego adunku pomi dzy reaguj cymi
atomami, co pozwala wyja ni
wi zanie kowalencyjne na gruncie teorii
elektrostatycznej:
Definicja:
zr b atomowy = atom –
elektrony walencyjne
Zr b atomowy ma
sumaryczny adunek
dodatni.
odpychanie
absze odpychanie
przyci ganie
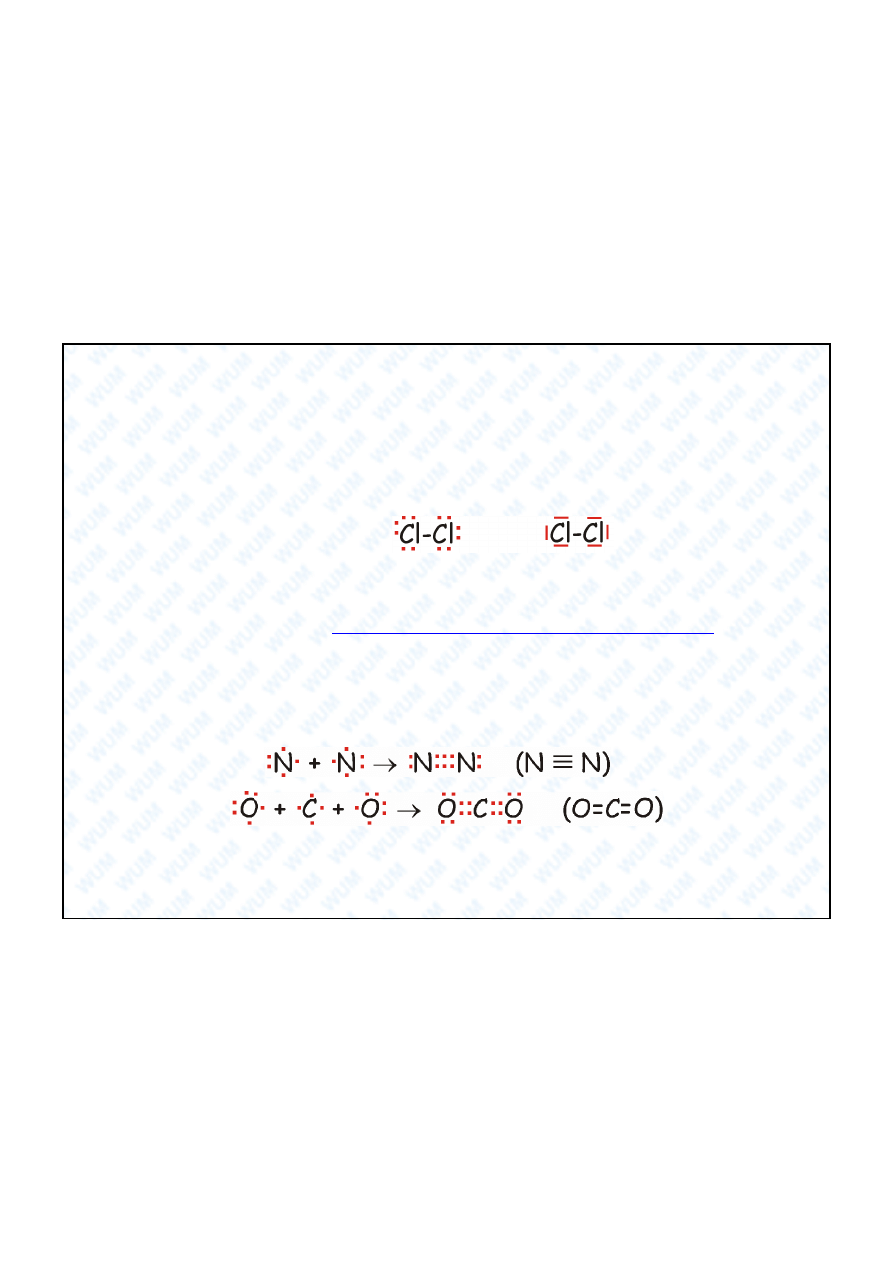
14
Wi zanie kowalencyjne c.d.
Par elektronów wi
cych oznacza si kresk (symbol wi zania) a pozosta e
elektrony oznacza si
kropkami lub wszystkie pary elektronowe (wi
ce i
wolne) oznacza si kreskami:
Je eli pierwiatki tworz ce wi zanie kowalencyjne ró ni si elektroujemno ci ,
to mamy do czynienia z wi zaniem kowalencyjnym spolaryzowanym. Takie
wi zanie ma elektryczny moment dipolowy.
lub
Wi zania kowalencyjne wielokrotne
W pierwszym przyk adzie rz d wi zania N N wynosi 3, w drugim przypadku
rz d wi zania C=O wynosi 2.
15
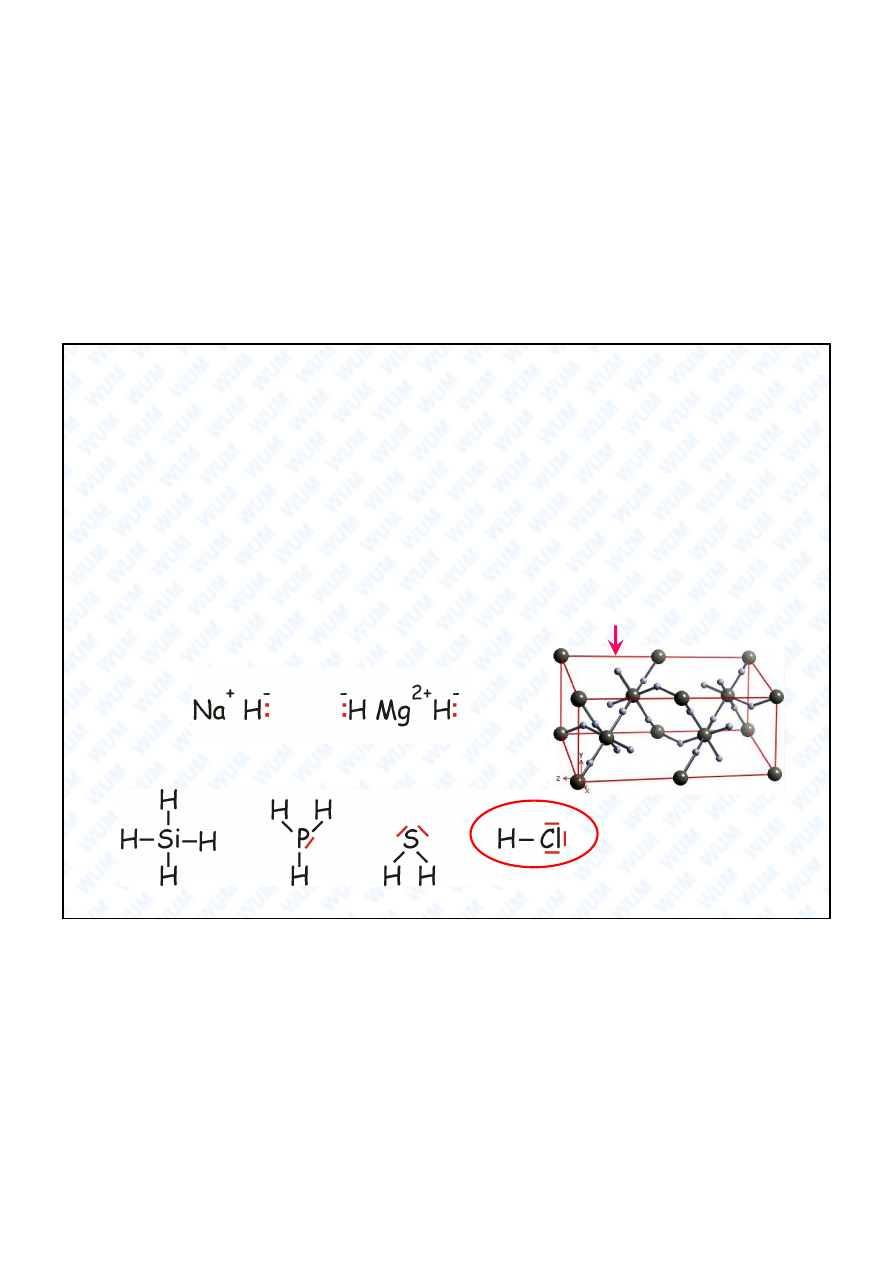
Przyk ad
Stosuj c teori
Lewisa i Kossela mo na wyja ni
np. wi zania w
wodorkach 3-ego okresu:
NaH, MgH
2
, AlH
3
, SiH
4
, PH
3
, H
2
S i HCl
. Trzeba
rozwa
ró nice elektroujemno ci mi dzy atomami tych wodorków. W
skali Paulinga mamy:
H 2,2; Na 0,9; Mg 1,3; Al 1,6; Si 1,9; P 2,2; S 2,6; Cl
3,2
. Dwa pierwsze zwi zki maj
charakter jonowy, przy czym bardziej
elektroujemne atomy wodoru maj
adunek ujemny.
AlH
3
ma charakter
przej ciowy (
= 0,6
)
– struktura polimeryczna.
Pozosta e wodorki maj charakter kowalencyjny:
kowalencyjny
spolaryzowany
Al
H

16
Porównanie typowych zwi zków jonowych i kowalencyjnych
Zwi zki jonowe
(zwykle nieorganiczne)
Krystaliczne cia a sta e
- kryszta y o budowie jonowej.
Wysokie temperatury topnienia i wrzenia.
Przewodz pr d elektryczny w stanie
stopionym.
Wiele zwi zków jonowych rozpuszcza
si w wodzie i dysocjuje (elektrolity), ale
nie rozpuszcza si w rozpuszczalnikach
niepolarnych.
Zwi zki kowalencyjne
(zwykle organiczne)
Gazy, ciecze lub cia a sta e zbudowane z
cz steczek - kryszta y o budowie
molekularnej.
Niskie temperatury topnienia i wrzenia.
abe przewodniki pr du we wszystkich
stanach skupienia.
Wiele zwi zków kowalencyjnych
rozpuszcza si w rozpuszczalnikach
niepolarnych, ale nie rozpuszcza si w
wodzie.
… ale np. SiC
du o wyj tków !

17
Regu y tworzenia wzorów Lewisa
1. Obliczy sumaryczn liczb elektronów walencyjnych w cz steczce lub jonie,
uwzgl dniaj c wypadkowy adunek, np.:
N
2
O 2 × 5 + 6 = 16
w sumie 8 par elektronowych
CO
3
2-
4 + 3 × 6 + 2 = 24
w sumie 12 par elektronowych
2. Zaproponowa struktur cz steczki, cz c atomy pojedynczymi wi zaniami,
czyli wi
cymi parami elektronowymi (trzeba z góry wiedzie , które atomy s
ze sob po czone lub przyj
jakie za
enie w sprawie struktury, a eby je
pó niej zweryfikowa ).
3. Rozmie ci pozosta e elektrony wokó atomów (niewi
ce pary elektronowe) i
w wi zaniach (wi
ce pary elektronowe), tworz c ewentualnie wi zania
wielokrotne, tak a eby spe ni regu oktetu dla ka dego z tych atomów
(dubletu dla wodoru !).
18
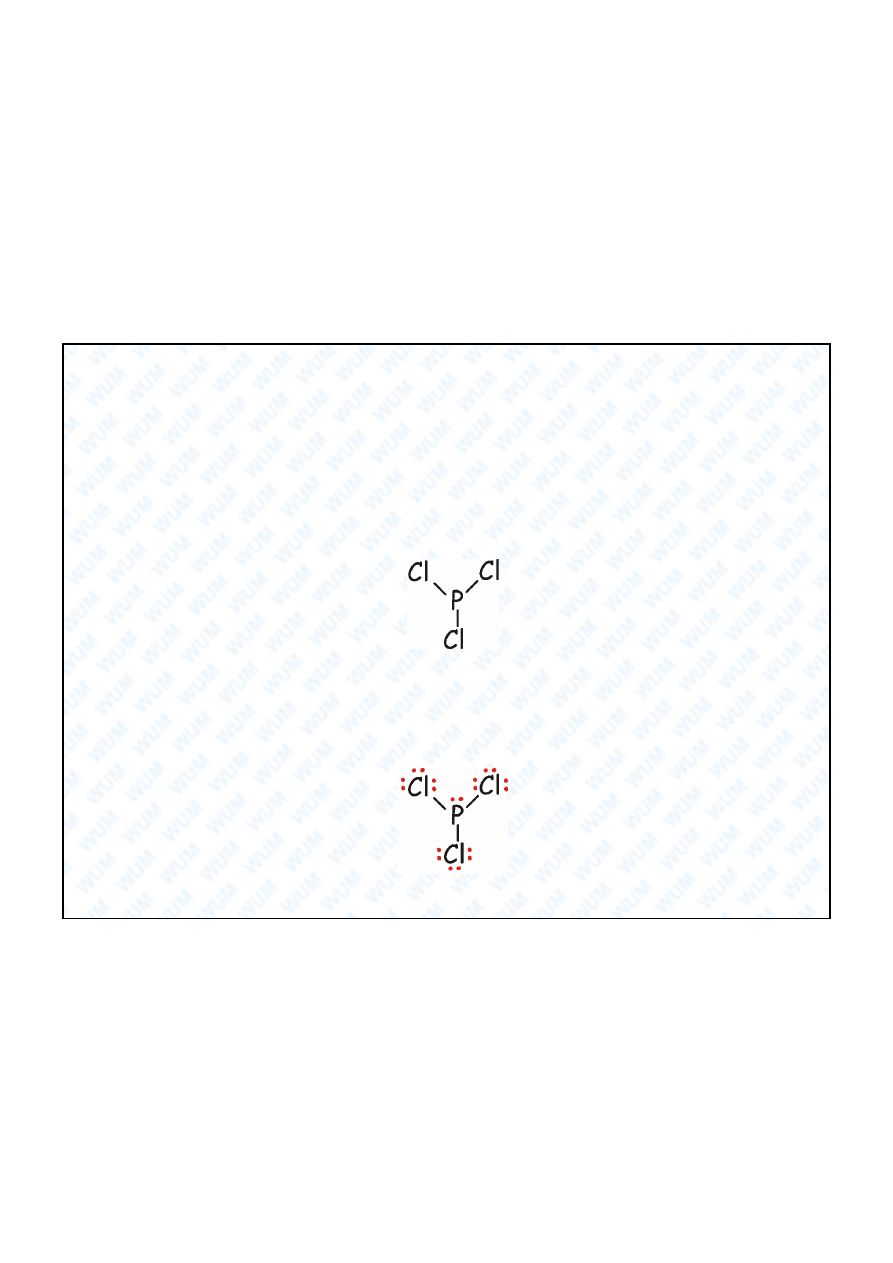
Przyk ad PCl
3
1. Ca kowita liczba elektronów walencyjnych: 5 + 3 × 7 = 26, czyli w sumie
13 par elektronowych.
2. Intuicja chemiczna „podpowiada” nam struktur :
3. Wykorzystali my 3 pary elektronowe, jako pary wi
ce. Pozostaje do
wykorzystania jeszcze 10 par elektronowych. Po 3 pary dajemy
ka demu atomowi Cl a dla P zostaje jedna para elektronowa. Ka dy z
atomów uzyskuje w ten sposób oktet elektronów:
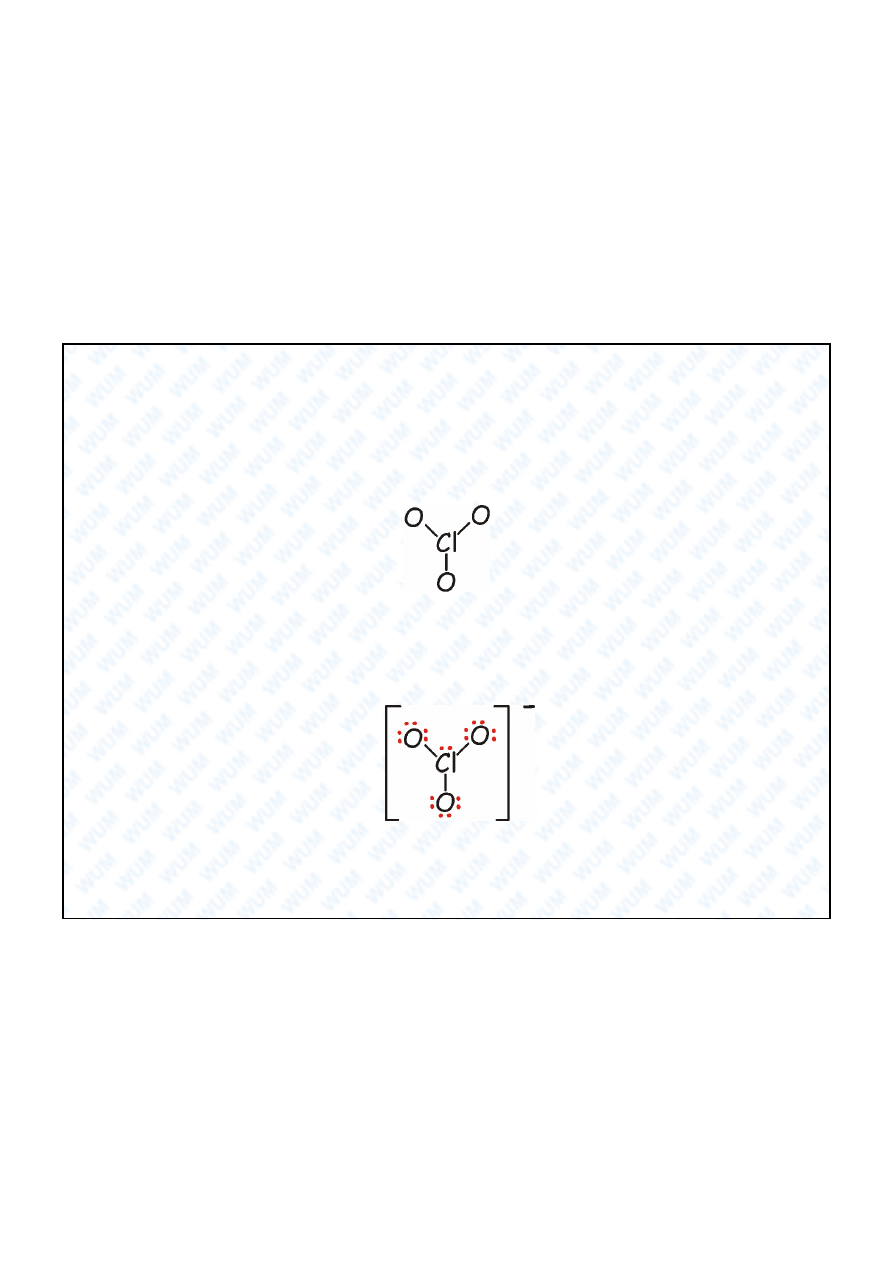
19
Przyk ad ClO
3
-
1. Ca kowita liczba elektronów walencyjnych: 7 + 3 × 6 + 1 = 26, czyli w
sumie 13 par elektronowych.
2. Intuicja chemiczna „podpowiada” nam struktur :
3. Wykorzystali my 3 pary elektronowe, jako pary wi
ce. Pozostaje do
wykorzystania jeszcze 10 par elektronowych. Po 3 pary dajemy
ka demu atomowi O a dla Cl zostaje jedna para elektronowa. Ka dy z
atomów uzyskuje w ten sposób oktet elektronów:
Uwaga ! Identyczna struktura elektronowa jak dla PCl
3
, gdy
te dwa
przypadki s izoelektronowe.

20
Przyk ad HCN
1. Ca kowita liczba elektronów walencyjnych: 1 + 4 + 5 = 10, czyli w sumie
5 par elektronowych.
2. Wiemy z góry, e struktura jest liniowa:
H-C-N
Wykorzystali my ju 2
pary elektronowe, jako pary wi
ce. Pozostaj
do wykorzystania
jeszcze 3 pary elektronowe, które nale y przydzieli atomom C i N jako
wolne pary elektronowe.
3. Propozycja wzorów Lewisa z pojedynczymi wi zaniami:
4. Propozycja wzorów Lewisa z podwójnym wi zaniem
(do wkorzystania 2 wolne pary elektronowe):
5. Propozycja wzoru Lewisa z potrójnym wi zaniem
(do wkorzystania 1 wolna para elektronowa):
H-C-N
H-C-N
:
:
:
:
:
:
6 6 8 4
:
H-C-N
: :
-
H-C-N
:
-
8 6 6 8
:
H-C-N
--
2 8 8
21
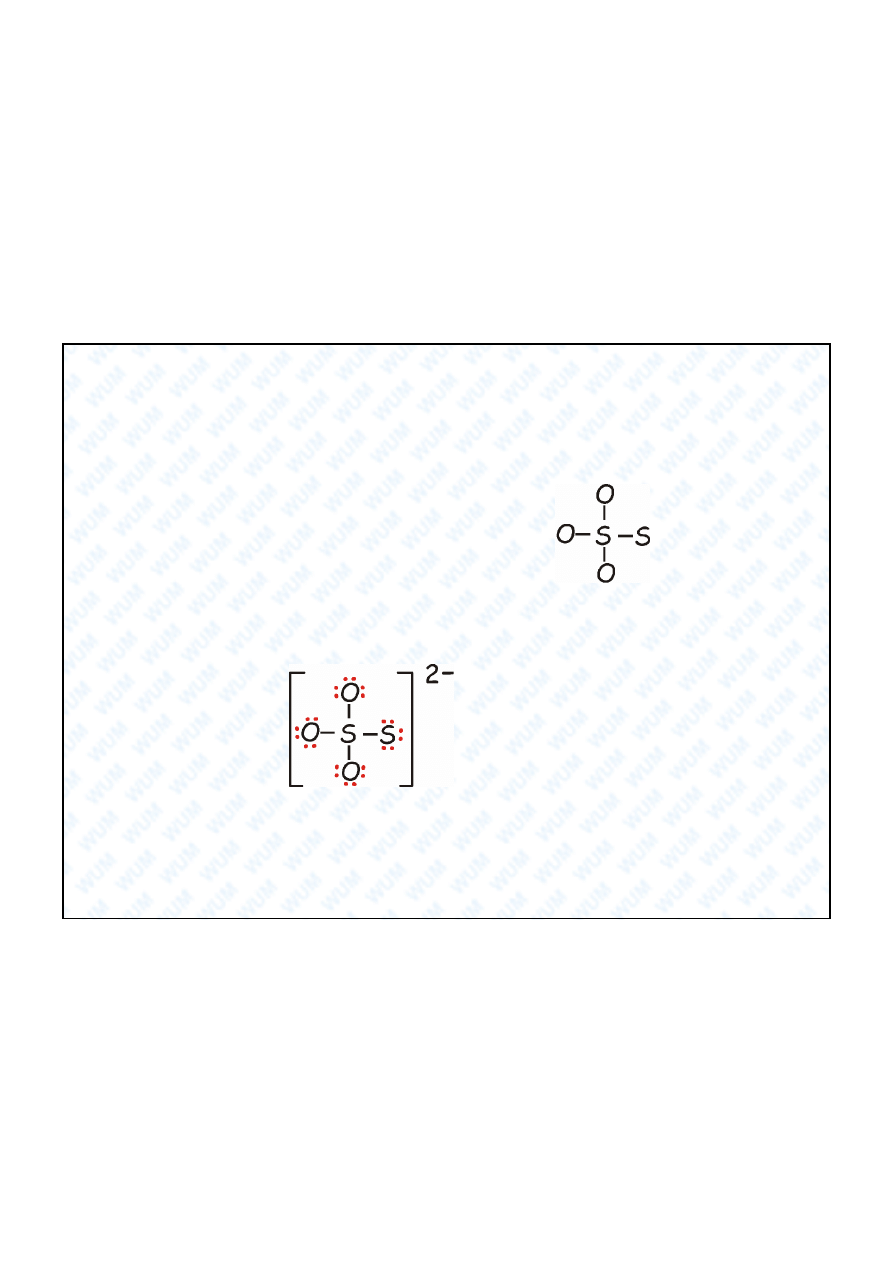
Przyk ad S
2
O
3
2-
1. Ca kowita liczba elektronów walencyjnych: 5 × 6 + 2 = 32, czyli w sumie 16 par
elektronowych.
2. Intuicja chemiczna „podpowiada” nam struktur :
3. Wykorzystali my 4 pary elektronowe, jako pary wi
ce. Pozostaje do
wykorzystania jeszcze 12 par elektronowych. Po 3 pary dajemy ka demu atomowi
O oraz peryferyjnemu S(-II). Ka dy z atomów uzyskuje w ten sposób oktet
elektronów:
Uwaga ! Podobn budow elektronow ma izoelektronowy z S
2
O
3
2-
jon SO
4
2-
.
Pokazanie w tej strukturze dwóch
wi za
podwójnych wymaga dla
centralnego atomu S zastosowania
koncepcji rozszerzonej walencyjnej
pow oki elektronowej.
22
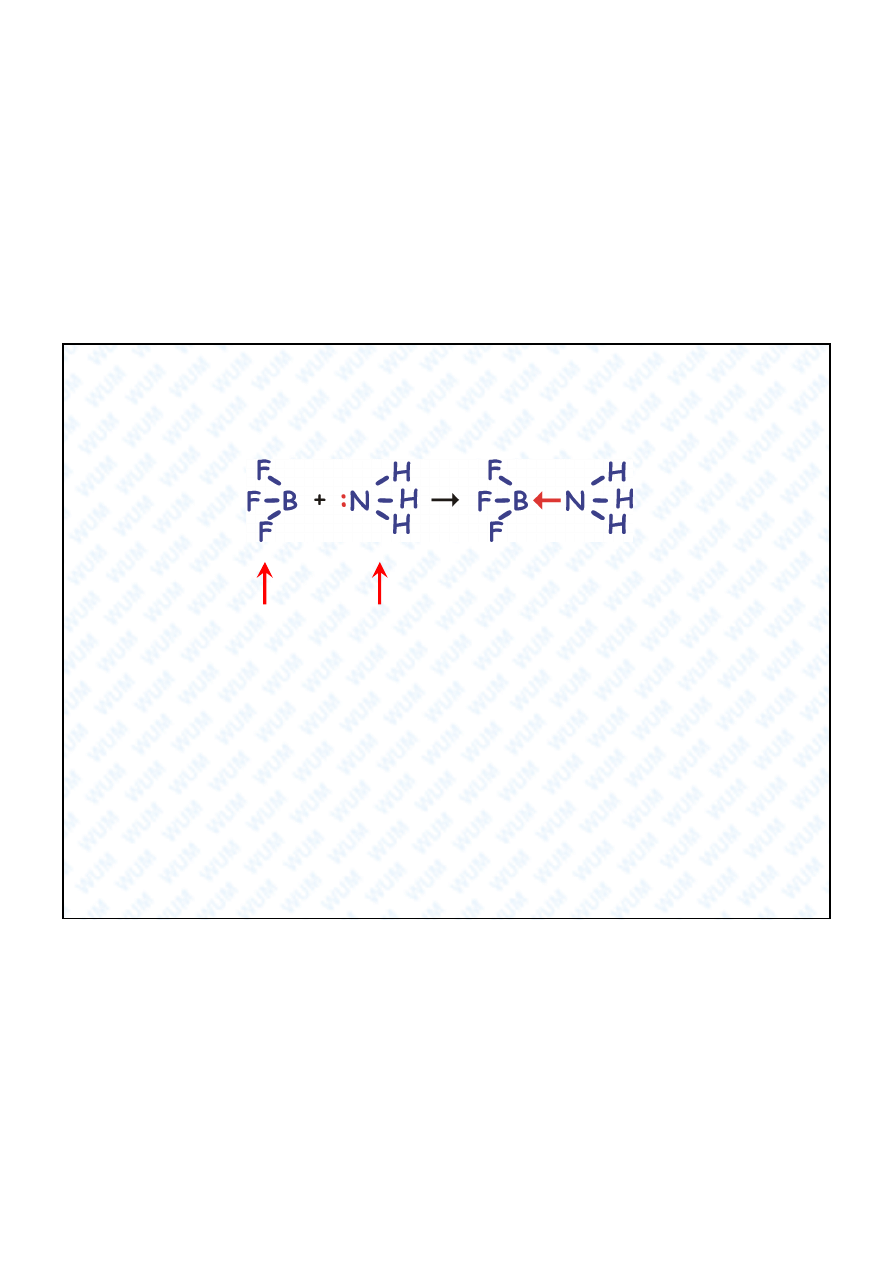
Wi zanie koordynacyjne
Wi zanie koordynacyjne stanowi szczególny przypadek wi zania
kowalencyjnego. Wi
ca para elektronów pochodzi w tym
przypadku tylko od jednego z atomów tworz cych wi zanie.
Uwaga ! W tej symbolice k adzie si nacisk na po czenia atomów
w ramach cz steczki (tzn. który atom z którym jest zwi zany -
topologia), a nie na jej geometri . Geometri cz steczek b dziemy
rozwa a pó niej.
zasada Lewisa
kwas Lewisa
23
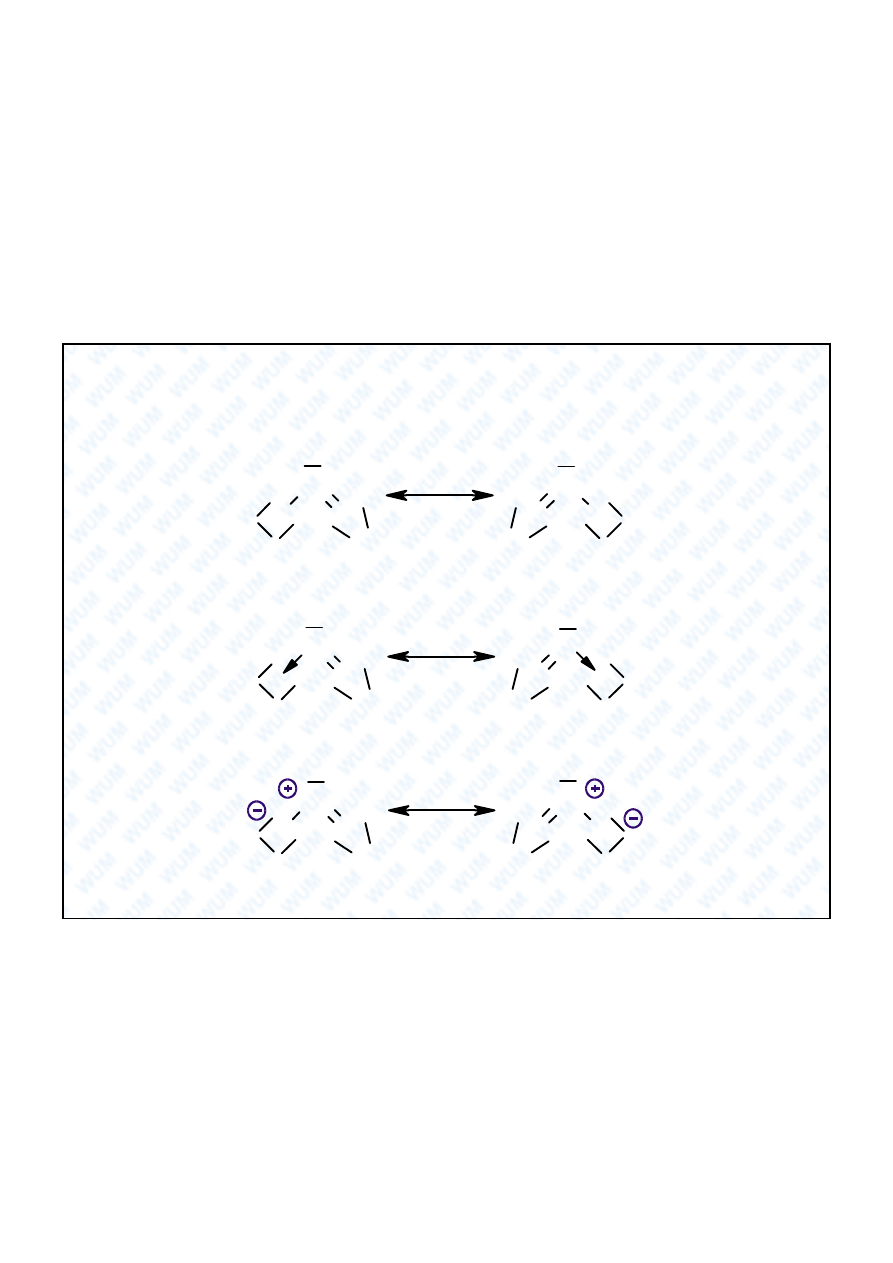
Rezonans (mezomeria)
Cz sto spotykamy si z sytuacj , w której pojedyncze diagramy Lewisa nie
opisuj dobrze rozk adu elektronowego. Rozwa my ozon O3:
Z do wiadczenia:
Oba wi zania O-O maj t sam d ugo
, chocia jest to sprzeczne ze struktur
Lewisa, która spe nia regu oktetu (wi zanie podwójne jest krótsze ni
pojedyncze):
Jednak e podwójne wi zanie mo emy równie umie ci pomi dzy drug par
atomów tlenu:
O
O
O
O
O
O
117
O
1,278 Å
1,278 Å
O
O
O

24
Rezonans (mezomeria) c.d.
Takie równocenne struktury nazywamy strukturami rezonansowymi (Pauling 1928).
Rozk ad elektronowy jest opisany jednocze nie obiema strukturami, co pozwala
wyt umaczy równe d ugo ci wi za . Stosujemy nast puj cy zapis:
Uwaga ! Dwukierunkowa strza ka nie oznacza równowagi chemicznej, ani oscylacji
rozk adów elektronowych cz steczki. Naprawd cz steczka istnieje w jednej formie - tej
znalezionej do wiadczalnie.
Rysuj c struktury rezonansowe nale y pami ta , e atomy musz w nich by tak samo
po czone (ta sama topologia) - ró ne b
tylko rozk ady elektronowe.
Im wi cej struktur rezonansowych opisuje dan cz steczk , tym jest ona trwalsza.
Mówimy, e rezonans stabilizuje cz steczk .
O
O
O
O
O
O
25
Ró ne sposoby przedstawiania struktur rezonansowych: ozon
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
0
0
0
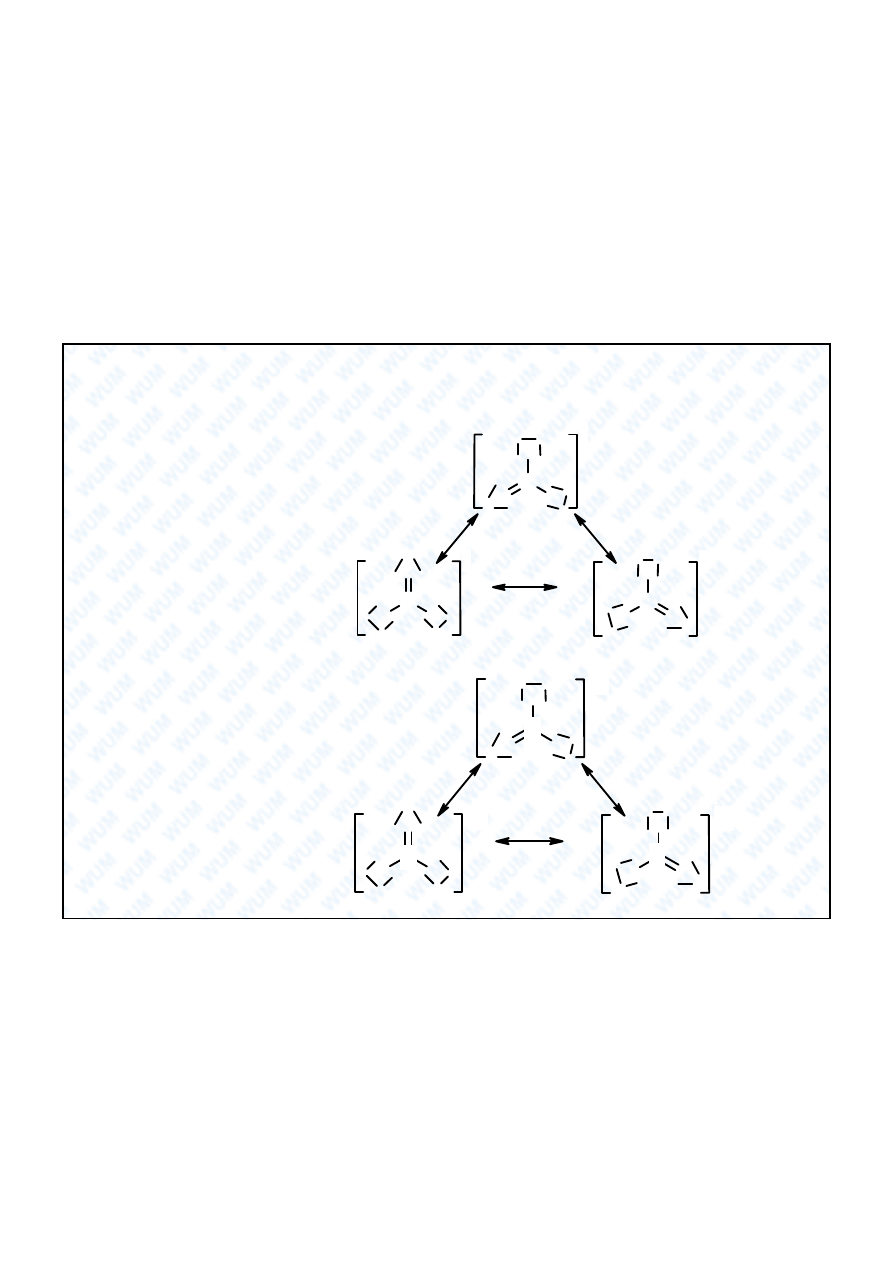
26
Struktury rezonansowe anionów kwasów tlenowych
O
N
O
O
O
N
O
O
O
N
O
O
-
-
-
O
O
O
O
O
O
O
O
O
C
C
C
2-
2-
2-
NO
3
-
5 + (3
6) + 1 = 24
czyli 12 par elektronowych
CO
3
2-
4 + (3
6) +2 = 24
czyli 12 par elektronowych

27
Wyj tki od regu y oktetu
3.
Nadmiar elektronów
–
wykorzystanie walencyjnych orbitali d atomu centralnego
(od 3
-ego okresu):
Grupa IVA
CF
6
NIE
SiF
6
TAK
Grupa VA
NCl
5
NIE
PCl
5
TAK
Tendencja do rozszerzenia walencyjnych pow ok elektronowych ro nie wraz z dost pno ci
walencyjnych orbitali d atomu centralnego i zmniejszaniem si rozmiarów atomów zewn trznych:
a) NF
3
jest trwa y. NF
5
nie istnieje.
Azot nie ma walencyjnych orbitali d.
b) PF
3
i PF
5
- oba istniej .
Fosfor ma nieobsadzone walencyjne orbitale d.
c) PF
5
jest bardziej trwa y ni PCl
5
.
Promienie atomowe: F < Cl .
4.
Kompleksy metali przej ciowych
(w dalszej cz
ci kursu).
1.
Rodniki
(cz steczki zawieraj ce niesparowane elektrony), np.
NO
, gdzie mamy 5 + 6 = 11
elektronów walencyjnych, czyli jeden musi by
niesparowany. W tym przypadku ca kowite
sparowanie elektronów nie jest mo liwe i jeden z atomów nie mo e mie oktetu walencyjnego.
2.
Deficyt elektronowy
- wi zanie koordynacyjne. Bor w
BF
3
ma za
ma o o dwa elektrony, czyli jest kwasem Lewisa i akceptorem
elektronów w wi zaniach koordynacyjnych. W kompleksie z
amoniakiem donorem pary elektronowej jest azot.
28
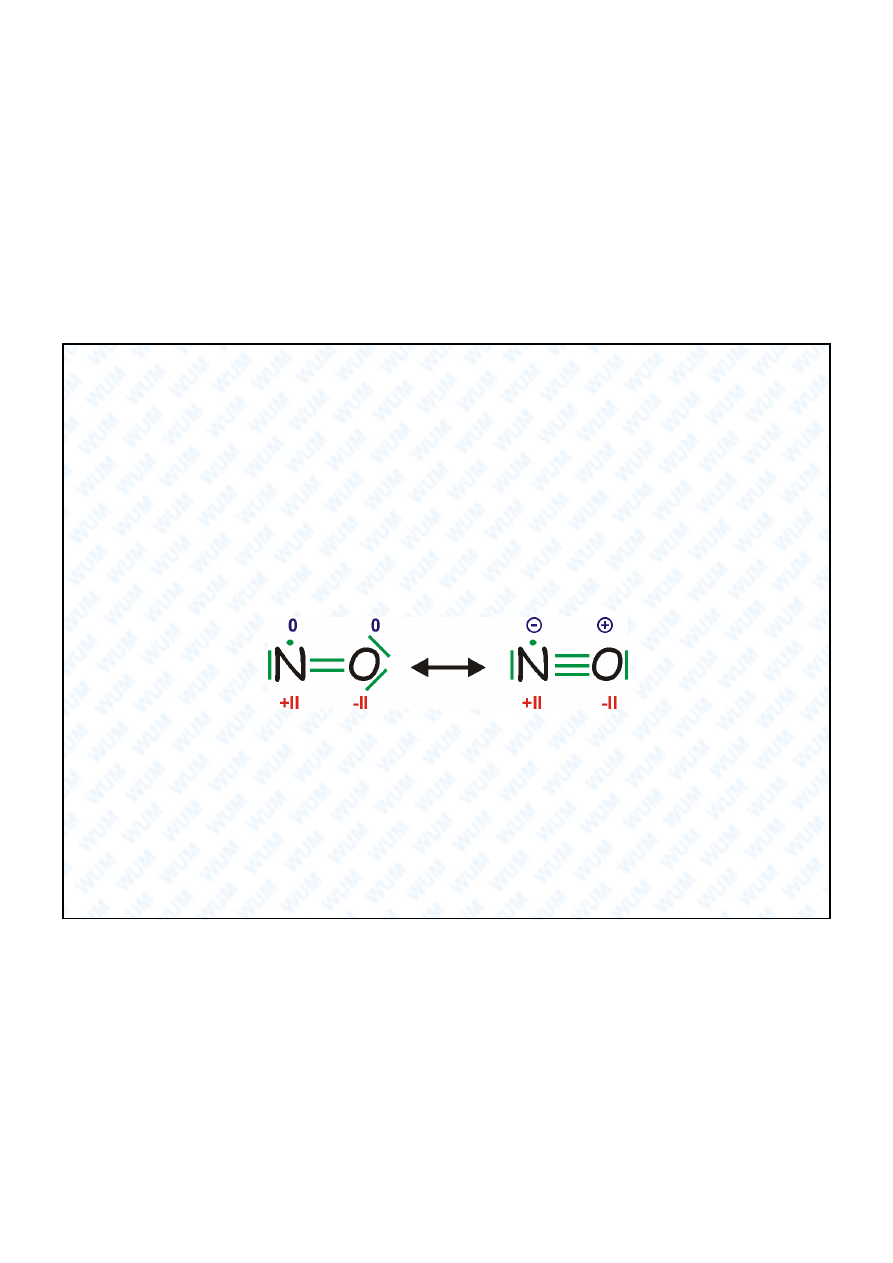
Tlenek azotu
NO
11 elektronów
5 par elektronowych + 1
elektron niesparowany
Rodnik – w
ciwo ci paramagnetyczne !
Rezonans tych struktur daje rz d wi zania równy 2,5
zgodny z wynikami eksperymentalnymi.

29
Do wiadczenia, które prof.
Louis J. Ignarro
przeprowadzi w 1990 r. dowiod y, e NO jest
neuroprzeka nikiem
odpowiedzialnym za
zjawisko erekcji. Praktycznym zastosowaniem
tego odkrycia sta o si
opracowanie sildenafilu,
czyli pierwszego doustnego leku skutecznego w
terapii impotencji, a prof. L. J. Ignarro zyska
miano "ojca Viagry". Obecnie wiadomo, e NO
reguluje motoryk
przewodu pokarmowego,
uczestniczy w funkcjach uk adu oddechowego,
odgrywa rol
neuromodulatora
w OUN
(wp ywaj c m.in. na pami
, czym zainteresowali
si
naukowcy poszukuj cy skutecznego leku na
choroby ot pienne) oraz bierze udzia
w
procesach przeciwzapalnych i odporno ciowych,
co z kolei mo e mie
du e znaczenie przy
tworzeniu nowych leków przeciwnowotworowych.
Prze omowe odkrycie roli tlenku azotu jako czynnika sygna owego,
rozlu niaj cego ciany naczy
krwiono nych by o wynikiem prac
trójki naukowców:
Roberta F. Furchgotta, Feride'a Murada i Louisa
J. Ignarro
. Wszyscy trzej uczeni zostali w 1998 r. wspólnie
uhonorowani Nagrod Nobla.
AM 28 maja 2006 r.
Wr czenie medalu im. Doktora
Tytusa Cha ubi skiego
30
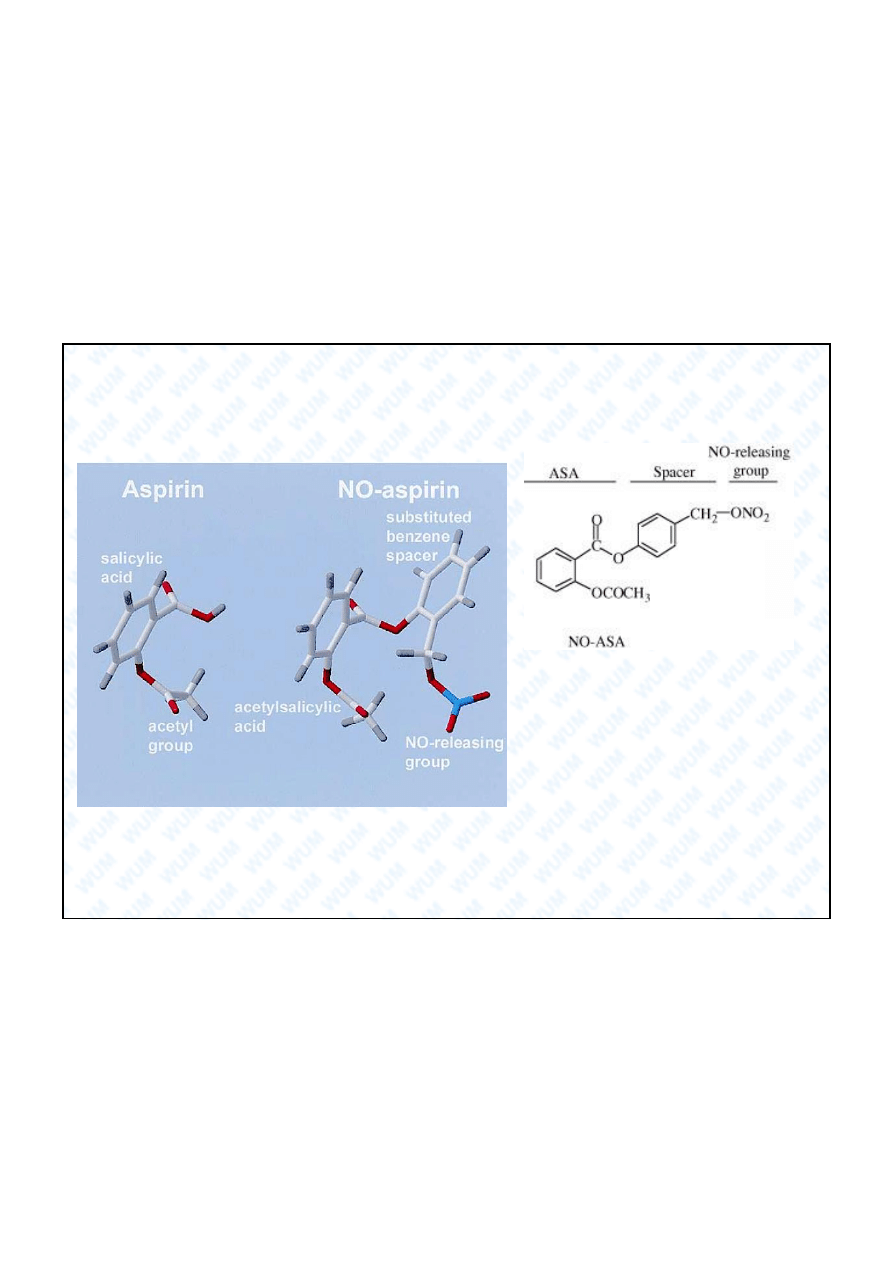
Niesteroidowe leki przeciwzapalne (NLPZ) uwalniaj ce tlenek azotu
NO-NSAIDs (NO-donating nonsteroidal anti-inflammatory drugs)
Pochodna NO-ASA poza
kwasem acetylosalicylowym,
czyli substancj
aktywn
aspiryny, wydziela tak e tlenek
azotu, który chroni b on
luzow
dka przed
uszkodzeniem.
NO-ASA ma dzia anie antynowotworowe !

31
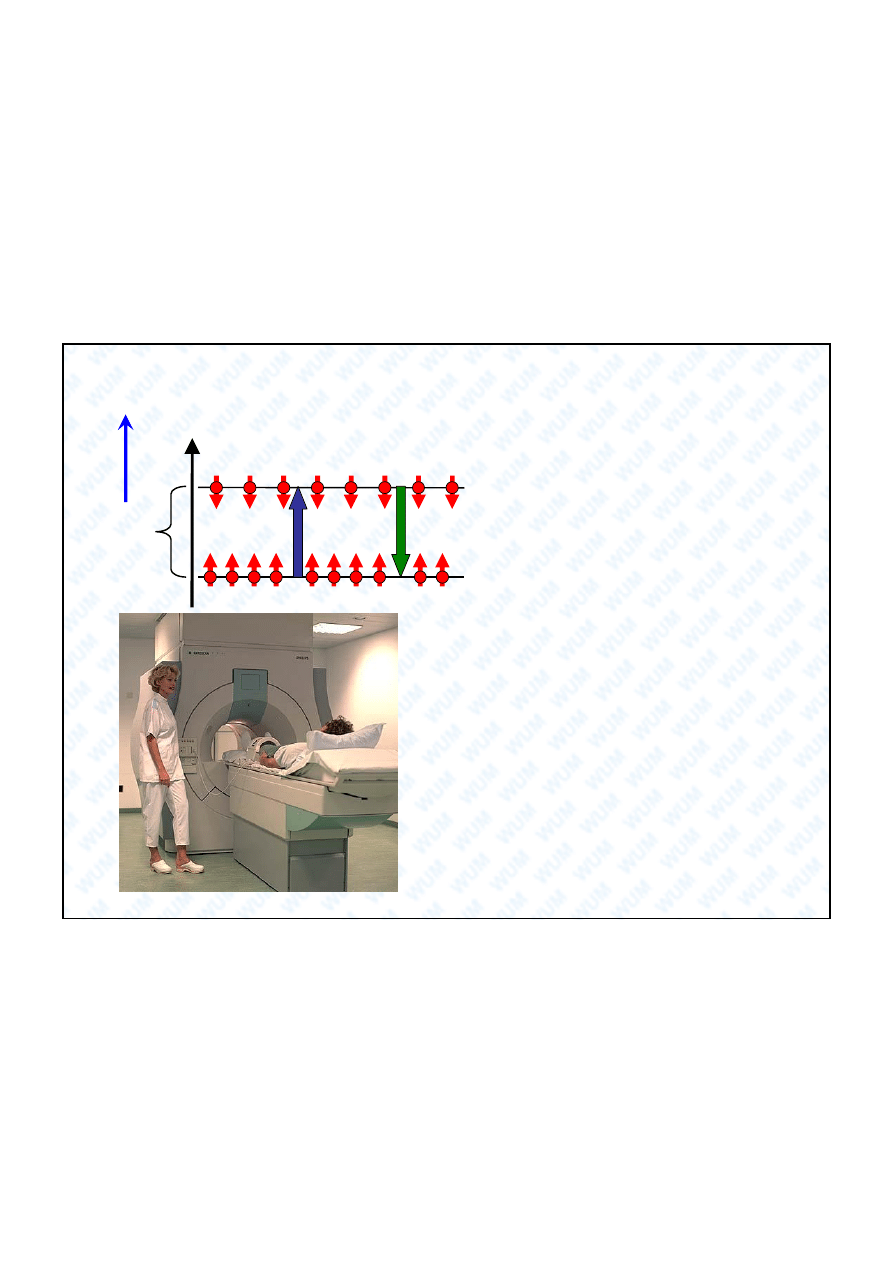
Paramagnetyzm
Paramagnetyzm
ciek ego tlenu.
B
B
B
B
32
Spektroskopia rezonansów magnetycznych
E
B
0
Energia
Absorpcja
fotonu
Relaksacja
spinowo-sieciowa
Magnetyczne momenty spinowe
niesparowanych
elektronów w
rodnikach lub tzw. j der magne-
tycznych (np.
1
H,
13
C,
15
N lub
31
P)
w cz steczkach diamagnetycz-
nych maj skwantowane poziomy
energetyczne w zewn trznym
polu magnetycznym B
0
. Odst p
E mi dzy poziomami jest
proporcjonalny do B
0
. Je eli do-
pasowa do niego fotony, czyli ich cz sto
do B
0
(rezonans), to zachodz
przej cia
spektroskopowe. W przypadku niesparowanych
elektronów jest to zjawisko elektronowego
rezonansu paramagnetycznego (EPR) a dla j der
jest to zjawisko j drowego rezonansu
magnetycznego (NMR). Spektroskopia EPR
wymaga fotonów o cz sto ci rz du kilku GHz a
NMR realizuje si
przy cz sto ciach rz du setek
MHz. EPR s
y do wykrywania, identyfikacji i
okre lania st
rodników. NMR jest niezb dny
w analizie zwi zków organicznych oraz jest
stosowany do obrazowania medycznego tkanek
mi kkich (MRI).
33
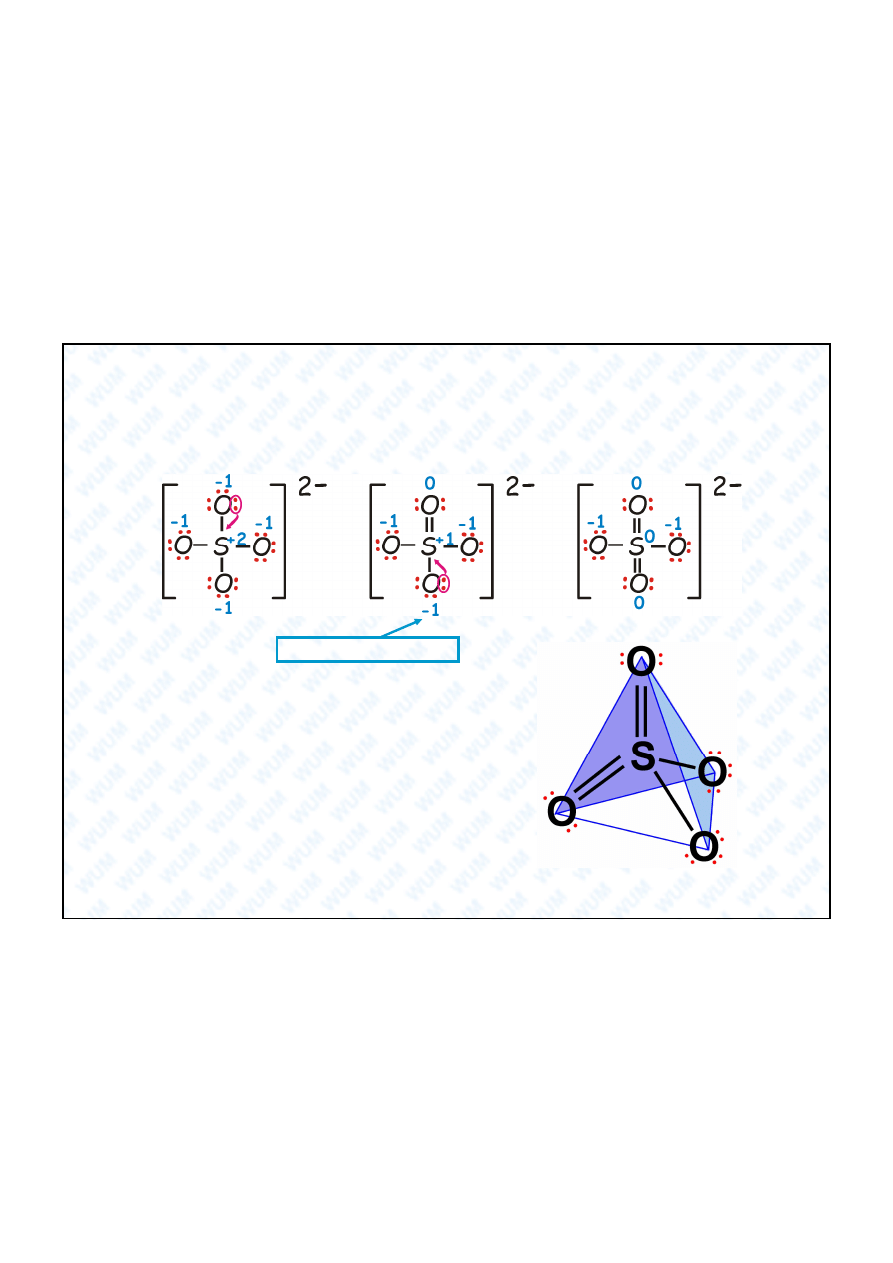
I
II
III
Rozszerzona pow oka walencyjna siarki w jonie siarczanowym(VI) ?
Poszczególne adunki formalne s
najbardziej zbli one do 0 w strukturze
rezonansowej
III
i ta ze wzgl du na adunki
formalne jest najbardziej uprzywilejowana,
chocia pow oka walencyjna atomu S jest tu
rozszerzona do 12 elektronów.
Uwaga !
Struktura rezonansowa III jest
jedn
z 6-ciu mo liwych ze wzgl du na
rozmieszczenie wi za
podwójnych.
adunek na centralnym atomie S
wynosi +1,77 !

34
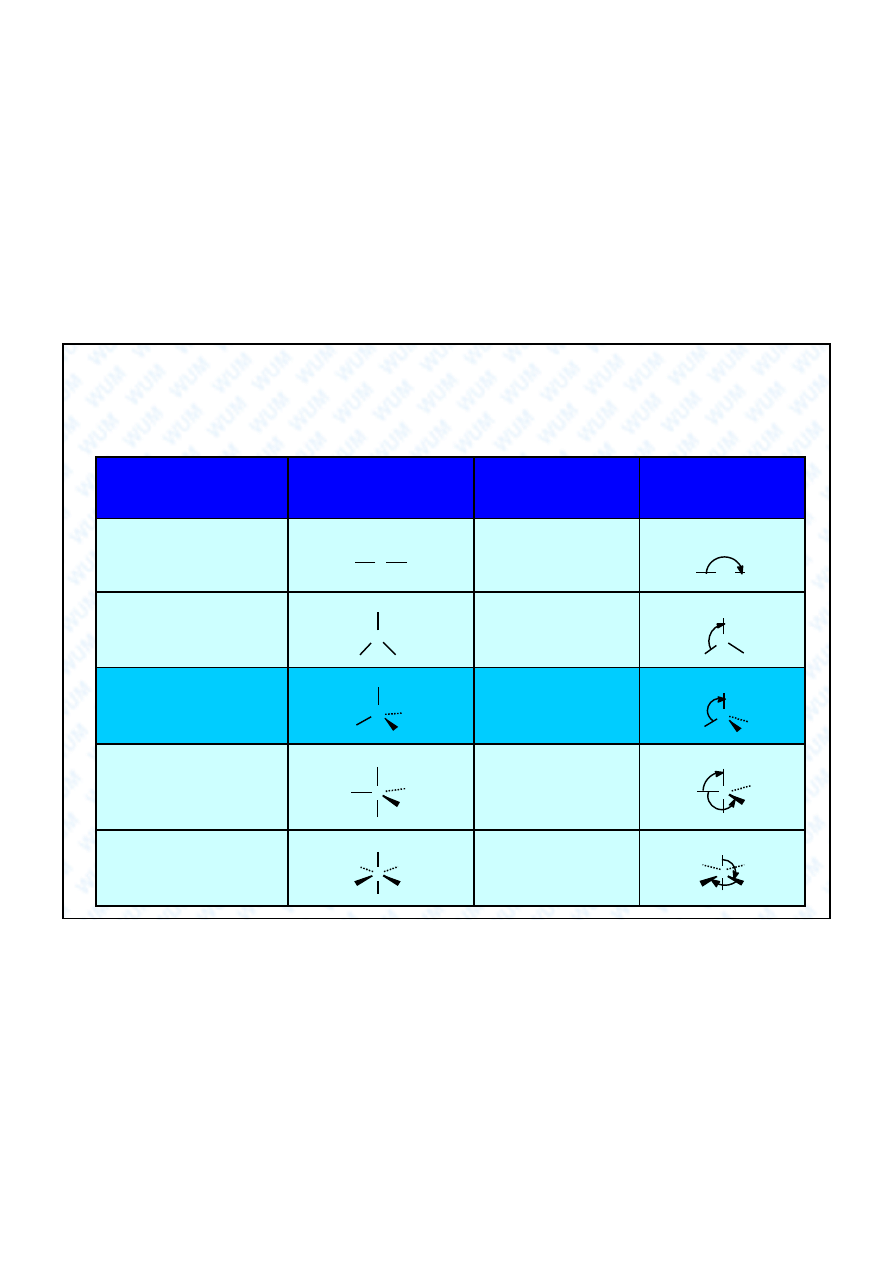
Model odpychania si walencyjnych par elektronowych
(VSEPR: Valence Shell Electron Pair Repulsion)
1. Cz steczka przybiera taki kszta t, który pozwala zminimalizowa
odpychanie
elektrostatyczne walencyjnych par elektronowych.
2. Walencyjne pary elektronowe dzieli si na wi
ce i niewi
ce (wolne).
3. Wi zanie wielokrotne traktowane jest jako obszar o du ej g sto ci
elektronowej, analogicznie do pojedynczej pary elektronowej.
4. Niesparowany elektron traktuje si
jako obszar o mniejszej g sto ci
elektronowej.
5. Si a odpychania maleje w kolejno ci: para wolna – para wolna > para wolna –
para wi
ca > para wi
ca – para wi
ca.
35
Zale no
mi dzy geometri cz steczki
a liczb par elektronowych
Liczba par
elektronowych
Rozmieszczenie par
elektronowych
Przewidywany
kszta t cz steczki
Przyk ad
2
deficyt elektronowy
:
A
:
liniowy
Cl
Be
Cl
180
o
3
deficyt elektronowy
..
A
..
..
trójk tny
F
B
F
F
120
o
4
oktet
:
..
A
:
:
tetraedryczny
H
H
C
H
H
109,5
o
5
nadmiar elektronów
:
A
:
:
..
..
bipiramidy
trygonalnej
Cl
P
Cl
Cl
Cl
Cl
90
o
120
o
6
nadmiar elektronów
:
A
:
:
:
..
..
oktaedryczny
F
S
F
F
F
F
F
90
o
90
o
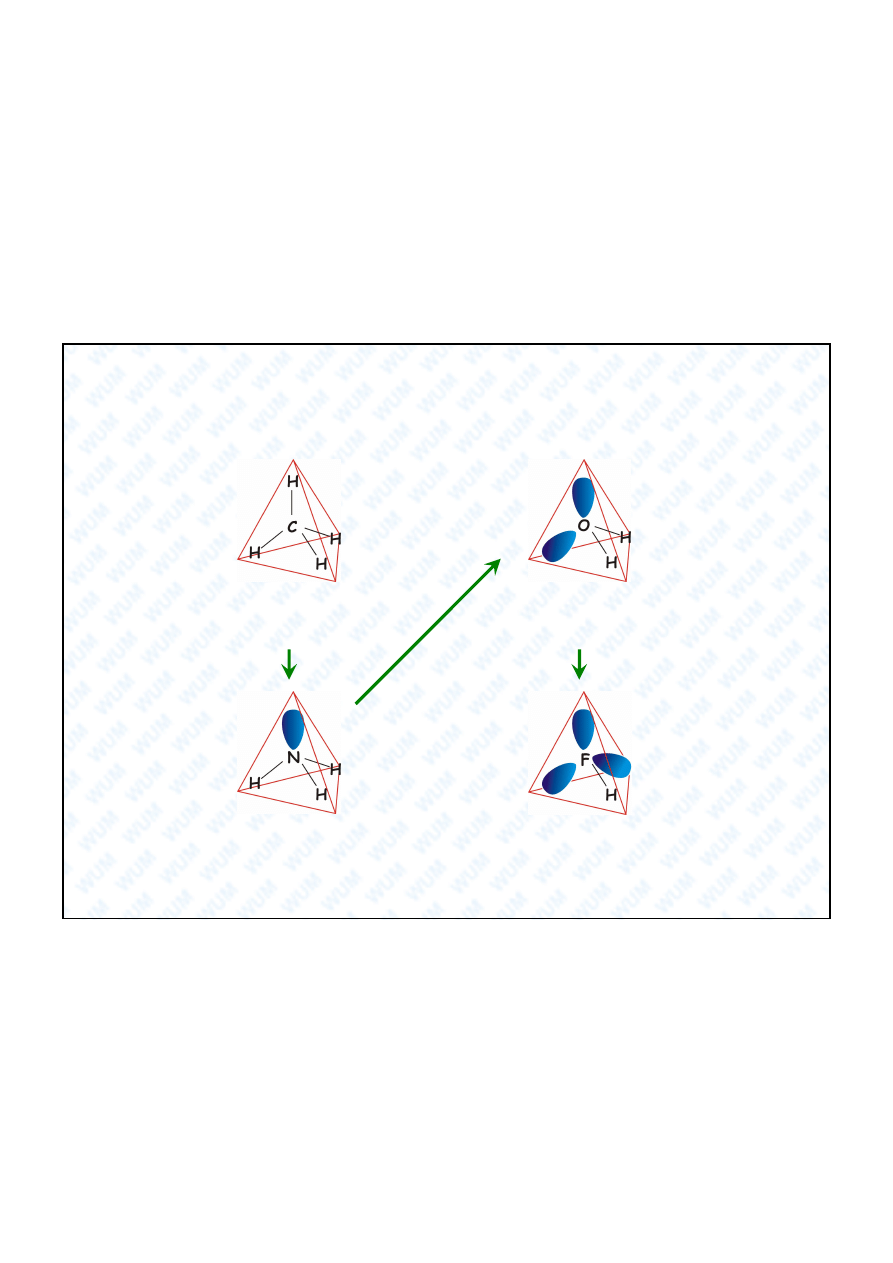
36
Spe niona regu a oktetu:
geometria cz steczek wodorków niemetali drugiego okresu
Pary elektronowe:
4 wi
ce, 0 wolnych.
Pary elektronowe:
3 wi
ce, 1 wolna.
Pary elektronowe:
2 wi
ce, 2 wolne.
Pary elektronowe:
1 wi
ca, 3 wolne.
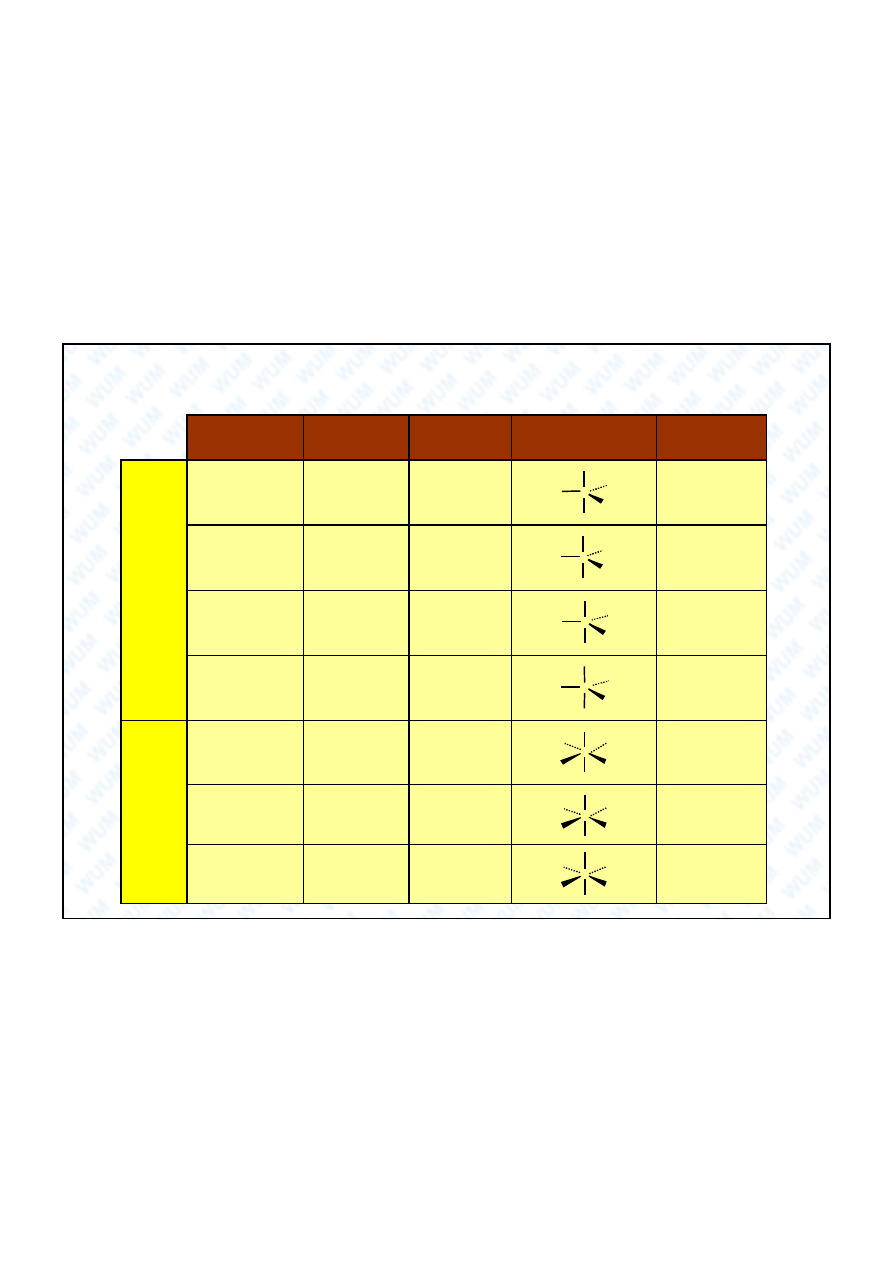
37
Liczba par
wi
cych
Liczba par
wolnych
Wzór
Struktura
Przyk ad
5
0
AB
5
B
A
B
B
B
B
PCl
5
4
1
AB
4
A
B
B
B
B
:
SF
4
3
2
AB
3
B
A
:
:
B
B
ClF
3
bipi
ram
ida t
rygon
alna
2
3
AB
2
:
A
:
:
B
B
XeF
2
6
0
AB
6
A
B
B
B
B
B
B
SF
6
5
1
AB
5
A
B
B
B
B
B
..
BrF
5
oktae
dr
4
2
AB
4
A
B
B
B
B
..
..
XeF
4
Struktura cz steczek z atomem centralnym maj cym
rozszerzon pow ok walencyjn
38
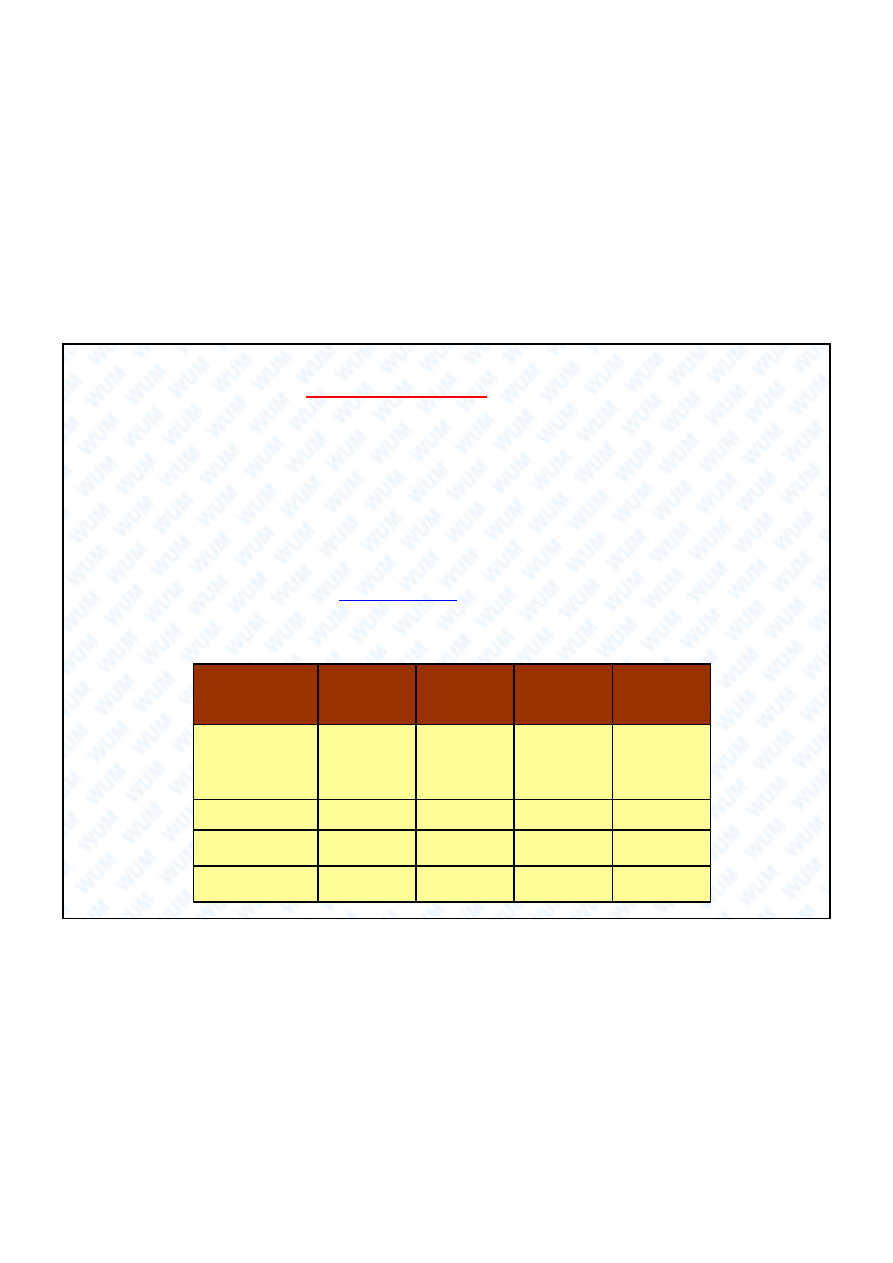
Liczba
elektronów
walencyjnych
16
17
18
19
Wzór
sumaryczny
+IV
CO
2
+V
NO
2
+
+IV
NO
2
0
O
3
+III
NO
2
-
+IV
ClO
2
Rz d wi zania
2
1,5
1,5
1,5
Kszta t
cz steczki
liniowy
trójk tny
trójk tny
trójk tny
ciwo ci
magnetyczne
dia-
para-
dia-
para-
Wzór strukturalny powinien:
1. Pokazywa , które atomy s w cz steczce po czone ze sob wi zaniami
chemicznymi.
2. Charakteryzowa liczb i rz d tych wi za .
3. Charakteryzowa struktur elektronow atomowych pow ok walencyjnych i wi za .
4. By zgodny ze stopniami utlenienia pierwiastków.
5. Charakteryzowa kszta t cz steczki.
Powy sze warunki spe niaj
wzory Lewisa z uwzgl dnieniem mezomerii oraz teorii
odpychania si
walencyjnych par elektronowych. Rozpatrzymy przyk ady
nast puj cych cz steczek:

39
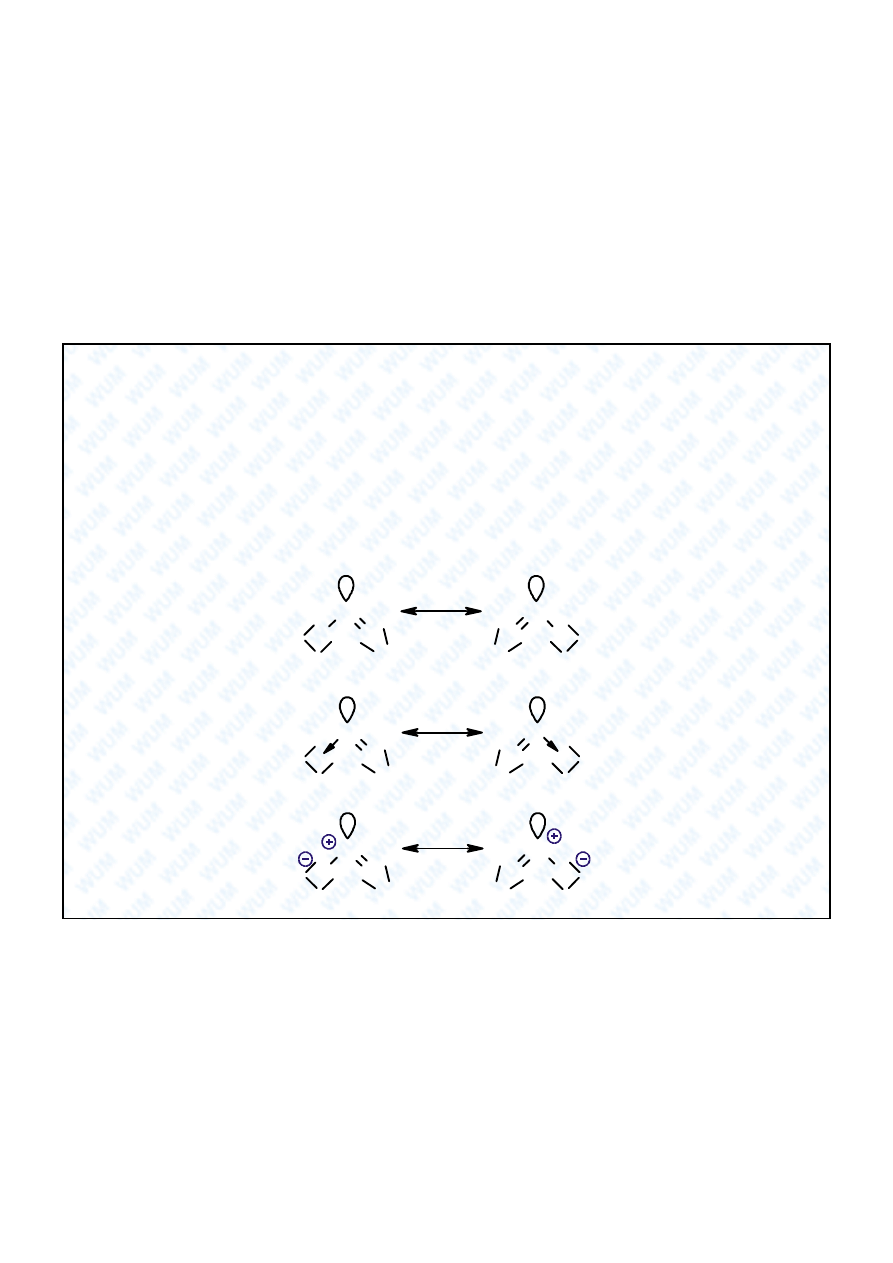
Ditlenek w gla: CO
2
Wzór formalny: O=C=O
Wzory Lewisa:
Jon nitroniowy: NO
2
+
Wzór formalny: [O=N=O]
+
Wzory Lewisa:
O=C=O
-II +IV -II
O=C=O
0
0
0
-II +V -II
O=N=O
[
]
O=N=O
+
40
Ditlenek azotu: NO
2
Wzór formalny: O=N=O
Wzór formalny
nie pokazuje, e NO
2
jest
paramagnetyczny,
przewiduje z y rz d wi zania,
nie przewiduje trójk tnego kszta tu cz steczki.
Wzory Lewisa
N
O
O
.
N
O
O
.
N
O
O
.
N
O
O
.
N
O
.
O
N
O
.
O
+IV
-II
-II
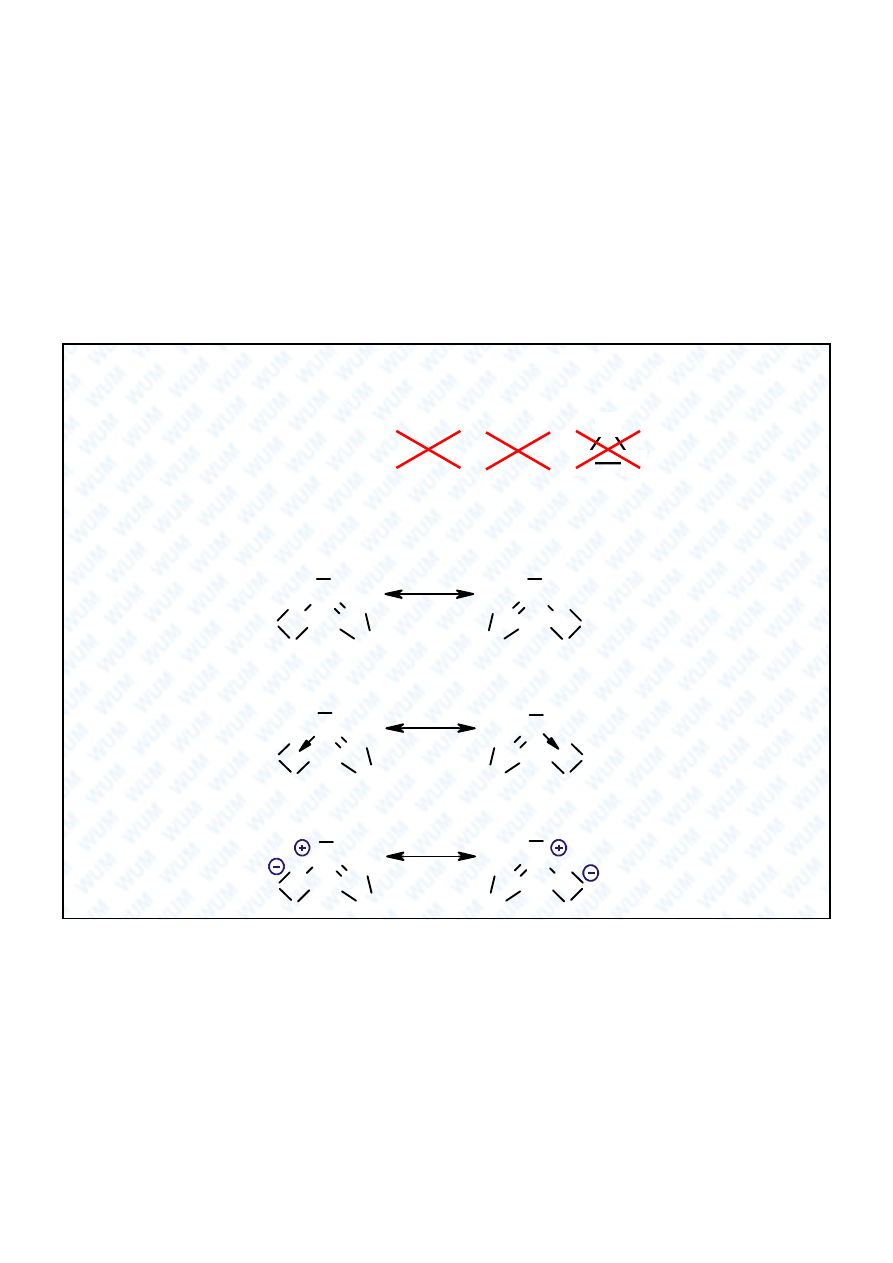
41
Ozon: O
3
Wzór formalny: O=O=O , O=O-O ,
Wzór formalny zawodzi ca kowicie.
Wzory Lewisa
0
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
0
0
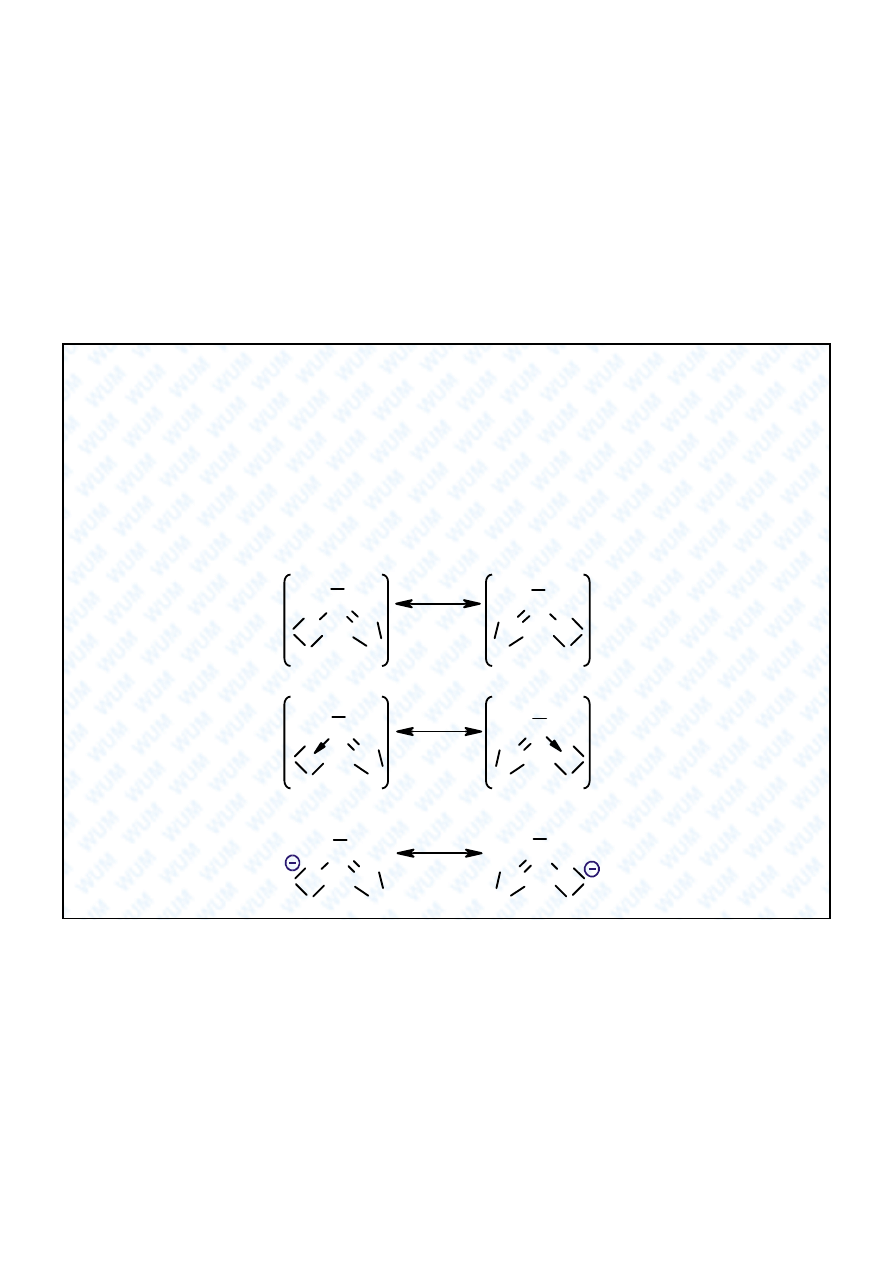
42
Anion azotanowy (III) : NO
2
-
Wzór formalny: [O=N-O]
-
Wzór formalny nie pokazuje, e
oba wi zania s
równocenne,
rz d wi zania wynosi 1,5 i e
cz steczka ma kszta t trójk tny (bierzemy pod uwag
uk ad j der atomowych).
Wzory Lewisa
N
O
O
N
O
O
N
O
O
N
O
O
N
O
O
N
O
O
+III
-II
-II
-
-
-
-
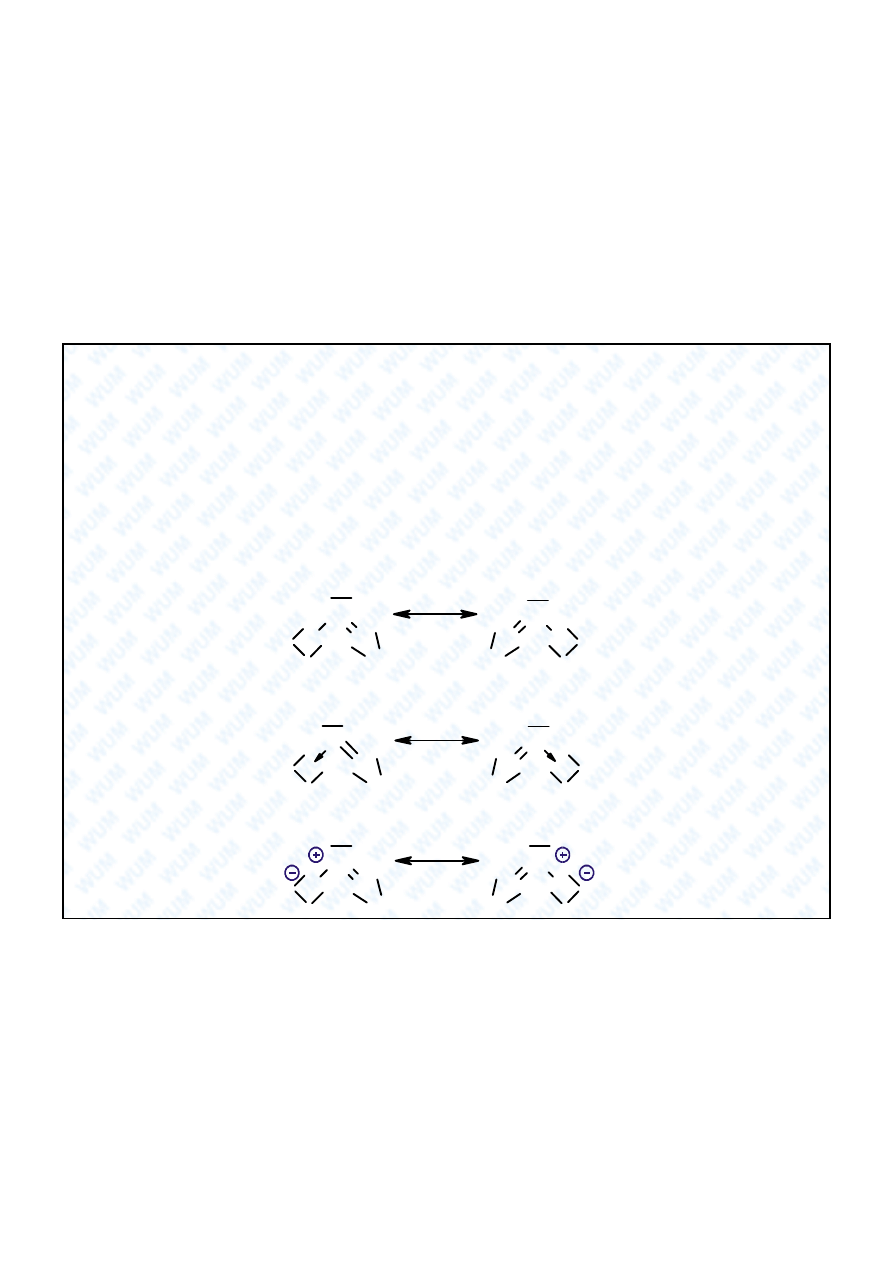
43
Ditlenek chloru: ClO
2
Wzór formalny: O=Cl=O
Wzór formalny nie pokazuje, e
ClO
2
jest
paramagnetyczny,
przewiduje z y rz d wi zania,
nie przewiduje trójk tnego kszta tu cz steczki (bierzemy
pod uwag uk ad j der).
Wzory Lewisa
Cl
O
O
.
Cl
O
O
.
Cl
O
O
.
Cl
O
.
O
Cl
O
.
O
Cl
O
O
.
+IV
-II
-II
Wyszukiwarka
Podobne podstrony:
Chemia ogolna i nieorg 13 2010
Chemia ogolna i nieorg 12 2010
Chemia ogolna i nieorg 15 2010
Chemia ogolna i nieorg 14 2010
Chemia ogolna i nieorg 13 2010
Chemia ogolna i nieorg 15 2010
Chemia ogolna i nieorg 14 2010
Egzamin 2010 - 2011 - wymagania, Science ^^, Farmacja, 1 rok, Chemia, Ogólna i nieorgan, egzamin, ch
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
Teoria do I i II gr. anionów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kati
28, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
Opracowanie - chemia ogólna i nieorganiczna, Nanotechnologia, sem I, chemia
Litowce, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
więcej podobnych podstron